このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
酵母の菌タイプIIIエフェクターの発現により誘導される増殖阻害表現型の同定
要約
このビデオでは、我々は酵母における細菌のタイプIIIエフェクターの発現とエフェクター誘導性成長抑制の表現型を同定するための手順を説明します。そのような表現型は、その後、エフェクター機能と目標を明らかにするために悪用される可能性があります。
要約
多くのグラム陰性病原性細菌は、宿主細胞のサイトゾルへエフェクタータンパク質のスイートを転位するタイプIII分泌系を使用してください。セル内で、タイプIIIエフェクターの免疫応答を抑制し、病原体の成長を促進するため、ホスト細胞プロセスを破壊する。植物と動物の細菌性病原体の多数のタイプIIIエフェクターは、これまでに同定されており、まだそのうちのほんの数は十分に特徴付けされています。これらのエフェクターの機能を理解するために、彼らは病原性、特定の感染症の段階におそらく固有の役割、および遺伝的に困難を増加させる及ぼす可能性があることを微妙な効果は、特定の細菌株のエフェクターレパートリーの中で機能的な冗長性の組み合わせによって損なわれている特定の病原体を操作する。出芽酵母におけるタイプIIIエフェクターの発現
プロトコル
I.は、タイプIIIエフェクターのために酵母発現系を設計する
興味のエフェクタータイプIII(S)の発現に適した酵母のシステムのキャリブレーションは重要な課題であり、いくつかの試行錯誤が必要になる場合があります。このようなシステムを設計する際に考慮し、最適化すべき主要な関連性の要因である:1)プロモーターは、2エフェクターの発現(s)を駆動)エフェクター遺伝子のコピー数は、3)エピトープタグタンパク質の発現を検証するために使用する、および4)酵母株。
1)プロモーター
細菌のタイプIIIエフェクターの酵母細胞への毒性がある可能性があるため、誘導性プロモーターは、それらの発現を制御するために使用する必要があります。 GAL1プロモーターは、一般的にこの目的のために使用され、その活性は増殖培地中に存在する炭素源によって規制されています:それは、グルコースによって抑制とガラクトースによって誘導される。しかし、このプロモーターは望ましくない毒性をもたらす抑制条件下でわずかに漏れやすいと報告された。同様の問題が発生した場合、それは以下のようにエフェクター遺伝子のコピー数を最小限に抑えるために、またはそのようなMET3またはCUP1プロモーター1などの代替誘導性プロモーターを、使用することをお勧めします。ここでは、ガラクトース誘導性プロモーターからのエフェクタータンパク質を発現させるための手順について説明します。
2)遺伝子のコピー数
タンパク質の発現レベルに影響を及ぼす追加のパラメータは、セル内に存在するエフェクター遺伝子のコピー数です。高い発現レベルは、エフェクター遺伝子(セル当たり40〜60枚)2ミクロンプラスミドによって運ばれるときに達成されています。中間式は、エフェクター遺伝子が相同組換えによって、酵母ゲノムに統合されている場合、低発現が達成されるのに対し、動原体を含むプラスミド(細胞あたり1から3のコピー)を使用して取得されます。セントロメアを含むベクターおよびGAL1プロモーターを組み合わせることで我々は成功し、植物病原体グラム陰性細菌のPV。vesicatoriaとシュードモナスシリン PVの約50エフェクターを表明している。イムノブロット分析によって検出可能なレベルでと抑制条件下での無視できる漏れ(サロモンとSessaとトマト 、未発表)。
3)エピトープタグ
興味のエフェクターに対する抗体が使用できない場合は、エピトープタグは、免疫ブロットによってその発現をモニターするためのエフェクタータンパク質に融合している。一般的に使用されるタグは、Mycの、ヘマグルチニン(HA)またはフラグです信頼性の高い商業抗体が用意されていますになる。我々はエフェクタータンパク質の構造と活性に不要な有害な影響を最小限にするためにタグのコピーを1つだけ使用することをお勧めします。
4)酵母株
発現に使用する酵母菌株の基本要件は、発現ベクターの選択マーカーの栄養要求性である。異なる酵母株は、特定のエフェクターの発現に異なる感度を表示するかもしれないことに注意することが重要です。例えば、我々はBY4741とW303株はいくつかのグラム陰性細菌のPV。vesicatoriaエフェクター(サロモンとSessa、未発表)に異なる感度を持っていることを観察した。したがって、異なる酵母株への関心の(の)エフェクターをテストするのが好ましい。
II。酵母のメディアの準備
任意のベクターが含まれていない酵母株の成長のために、増殖培地としてYPD(10 g / Lの酵母エキス、20g / lのペプトン、2%[W / V]グルコース)を使用します。固体培地の場合は、溶液(固形培地は非常に柔らかいの場合は、[V / V] 5 NのNaOHストック溶液からの高圧蒸気滅菌前に培地に0.05%を追加)に2%[w / vの]寒天追加。私たちは、最終容量の90%で、グルコースを含まない培地を調製し、これをオートクレーブをお勧めします。使用直前に、フィルター滅菌した20%[W / V]グルコース溶液(° Cの汚染を防止するため、4で20%グルコース溶液を保つ)で100%にボリュームを埋める。
選択可能なマーカー(ロイシン、ウラシル、ヒスチジンまたはトリプトファン)に原を提供するベクターを含む酵母株の生育のために、アミノ酸なくロイシン、ウラシル、ヒスチジンおよびトリプトファン(6.7 g / Lの酵母窒素塩基なく合成ドロップアウト培地を使用、1.4 g / Lの酵母合成培地のサプリメント - ドロップアウト)および2%[W / V]グルコース、または2%[W / V]ガラクトースと1%[w / vの]ラフィノースを含む。固体培地の場合は、[W / V]寒天液に2%を追加。私たちは、最終容量の90%で培地を調製し、これをオートクレーブをお勧めします。使用直前に、必要な炭素源(20%グルコース、20%を保つに応じて、ろ過滅菌した20%グルコース溶液、またはフィルター滅菌した20%のガラクトース+ 10%のラフィノース溶液で100%にボリュームを埋めるガラクトース+ 4で10%ラフィノースソリューション℃の汚染を防ぐため)。表現VECの選択マーカーに応じてTorは、使用前に(10 1 g/100ミリリットルロイシン在庫からML / L、200 mg/100 mlのウラシルの株式から10ミリリットル/ L、2ミリリットル/ L 1 g/100から他のアミノ酸またはウラシルを追加mlのヒスチジンの株式、あるいは2 ml / 1 g/100ミリリットルトリプトファンの株式からL)。ロイシンとウラシル株を調製する際に、オートクレーブでそれらを滅菌し、室温でおいてください。フィルタリングすることにより、それらを殺菌、ヒスチジンおよびトリプトファン株を調製する際に、光から保護するためにアルミホイルで瓶をラップし、4℃で保管℃、手順では、以下のロイシンを添加した合成ドロップアウト培地を説明し、ウラシル、ヒスチジンおよびトリプトファンを合成完全培地として指定されています。
ソリッドメディアプレートを4℃で2ヶ月間まで保存することができます使用前に、室温で無菌層流フードで20分間プレートを乾燥させる。
III。酵母の変換
- 酵母の形質転換の手順を開始する前に、以下の3つのソリューションを準備:50%[w / vの]ポリエチレングリコール(PEG)3350のソリューション、1 M LiAc溶液のpH = 8.0、およびTE溶液(100mMのトリスpH = 6.85とし10mMのEDTAでpH = 8.0)。溶液をろ過滅菌し、4℃に保つ℃、
- 長い木製のシャフトまたは無菌接種ループを使用して、新鮮なプレートから酵母のコロニー(1-2 mmの直径)を選択し、15 mlのポリプロピレンチューブにYPD 3 mlを接種する。軽くボルテックスして。ローラーで培養管を配置し、℃で一定の回転で30℃で一晩インキュベートする。
- 午前中は、室温で5分間、800gでローラーや遠心分離機から文化を取り外します。遠心後、上清を完全に取り除く。
- 1 mlの再懸濁バッファー(10%[V / V] TE溶液、10%[V / V] 1 M LiAcのソリューション)とボルテックスで細胞を再懸濁します。
- 変換される各プラスミドおよび追加の制御形質転換のために、マイクロチューブに細胞懸濁液100μlを移す。
- 各チューブに、一本鎖サケ精子DNA(10 mg / mlの)と、形質転換するプラスミドDNAの250から500 ngの(コントロールのチューブを除く)の5μlを加える。
- 慎重に変換ソリューションの各チューブに650μL(10%[V / V] TE溶液、10%[V / V] 1 M LiAc溶液を、80%[V / V] 50%[w / vの] PEG溶液に追加する)と渦。
- ℃で30分間ローラー上で30でインキュベートする。
- 、シェーカーからチューブを外しDMSO 70μlを追加し、反転管による混合10から15回(細胞を壊さないようにボルテックスしないでください)。
- 15分間42℃で予め温めておいた水浴とインキュベートにチューブを置きます。
- 水浴からチューブを外し、すぐに2分間氷上に置きます。
- チューブが冷却した後、室温で5分間、800gで、それらを遠心する。
- マイクロ遠心機からチューブを取り出し、慎重にピペットを用いて粘性上清を取り除く。
- 滅菌再蒸留水(DDW)150μlの各チューブの細胞ペレットを再懸濁し、そして炭素源として2%グルコースを含む合成完全培地のプレート上となしの細胞懸濁液を広げプラスミドが提供するアミノ酸またはヌクレオチド原栄養。
- プレートは2分間、オープンのままにし、それらを層流フード内で乾燥させます。二から三日間30℃インキュベーターでプレートを置きます。
- コロニー(1-2 mmの直径)がプレート上に出現したら、各形質転換から約10の単一コロニーを選択し、新しいプレートに移す。コロニーを転送する場合、酵母細胞の大量の成長を可能にするには、2センチ× 2 cmのパッチを作る。二日間30℃インキュベーターで培養する。
- 酵母のパッチが成長しているときは、インキュベータからプレートを取り外し、パラフィルムで、それらを封印。プレートを4℃で保存することができますすべての10-14日間新鮮なプレートにコロニーを移す。
IV。イムノブロットでエフェクターの発現を確認する酵母のタンパク質抽出物を準備
- 炭素源として2%グルコースを補充した適切な合成完全培地3mlを含む15 mlのポリプロピレンチューブに新鮮なプレートから、アミノ酸またはそのプラスミドのヌクレオチドなし酵母のコロニー(1-2 mmの直径)を選ぶ選択肢の原栄養を提供します。ローラーで培養チューブを置き、30℃で一晩インキュベート
- 次の日に、ローラーから文化を削除し、室温で5分間、800 gで遠心。遠心機からチューブを外し、上清を捨てる。
- 滅菌DDWとボルテックスの3mlに細胞ペレットを再懸濁します。
- 滅菌DDW 3mlに上清を、再懸濁します細胞を廃棄、再び遠心する。
- 炭素源として2%ガラクトースと1%ラフィノースを添加した合成完全培地3 mlを含む新しい15mlチューブに細胞懸濁液200μlを移し、そしてアミノ酸なしまたはヌクレオチドの選択のプラスミドが原を提供するため。ボルテックス、ローラーの場所、および30℃一晩インキュベート℃にして混合
- 次の朝に、マイクロチューブに培養液1 mlを(またはそれ以上の低密度培養のための)転送。室温で5分間、800 gで遠心分離して細胞を収集する。
- ここからは、β-メルカプトエタノール有毒な蒸気の吸入を避けるために、ドラフト内で動作します。慎重にピペットを用いて上清を除去し、氷冷した溶解液100μl(4%[V / V] 5 N水酸化ナトリウム、0.5%[V / V]β-メルカプトエタノール)で細胞ペレットを再懸濁します。ボルテックスで精力的に混合し、30分間氷上でインキュベートする。
- インキュベーションの間、pHを9〜10に溶解バッファー100μlを力価測定に必要な塩酸の体積(6 N)を決定する。ラック内の場所10マイクロチューブを、この目的に、それらの各々に溶解バッファー100μlを移す。各チューブとボルテックスに塩酸(6 N)の様々なボリューム(1〜10μl)を追加します。サンプルを取り、pH指示薬のストリップを使用して溶液のpHを確認してください。
- インキュベーションの終わりには、ボルテックスで溶解液と混合する前のステップ(よりよい精度のため、ライセートに先端を挿入せずに、チューブの側面にHCl溶液を置く)で決定した塩酸の体積を加える。
- 3倍のサンプル緩衝液50μl(30%[V / V]グリセロール、15%[V / V]β-メルカプトエタノール、37.5%を追加[V / V] 500mMのトリス- HClでpH = 6.8、0.15%[w / vの]ドデシル硫酸ナトリウム[SDS]とボルテックス(溶液が黄色に変わる場合、それはpHが低すぎることを意味し、溶解液の数マイクロリットルが解決するまで追加する必要があることによりライセートやミックスにブロモフェノールブルーの数粒)青)が点灯します。
- 針とマイクロチューブの蓋に穴を穿刺した後、ヒートブロックで5分間ライセートソリューションを煮る。
- 加熱ブロックからチューブを外し、溶液を室温で2分間冷却することができます。
- ボルテックス後、ライセート液と10秒のためにそれをスピンダウンする。イムノブロット分析用SDS - PAGEゲルに30μlのロード。
V.はエフェクター誘導性成長抑制表現型を検出するアッセイをスポッティング
- 新鮮なプレートから15 mlのポリプロピレンチューブに、関心と接種の発現プラスミドを持つ酵母のコロニー(1-2 mmの直径)、炭素源としてやアミノ酸なしで2%グルコースを添加した合成完全培地3 mlを選ぶ酸またはこれのヌクレオチドは、発現プラスミドは、原栄養を提供します。空のプラスミドを有する制御酵母株に対して同じ手順を繰り返します。ローラーで培養管を配置し、℃で一定の回転で30℃で一晩インキュベートする。
- 次の日に、ローラーからの文化を削除し、室温で5分間、800 gで遠心。遠心機からチューブを外し、上清を捨てる。
- 滅菌DDWとボルテックスの3mlに細胞ペレットを再懸濁します。
- 滅菌DDWの3mlの遠心分離工程および再懸細胞を繰り返します。
- それらの光学密度(OD)を決定するために、900μlのDDWと渦を含むマイクロチューブに各培養液100μlを移す。プラスチックキュベットにチューブの内容を注ぎ、(参照としてDDW 1mlで満たされたキュベットを使用)波長600nmにおける吸光度を測定する。 10の希釈率をキュベット内の文化のOD 600を乗じて、初期の文化のOD 600を計算する。
- 次に、最初の文化のOD 600に基づいて、滅菌マイクロチューブにOD 600 = 1.0に細胞懸濁液(1ml)を準備する。
- 900μlの滅菌DDWで満たされた3滅菌マイクロチューブを使用して、前の手順で調製した各細胞懸濁液から、3つの10倍段階希釈液(OD 600 = 0.1、0.01、0.001)(OD 600 = 1.0)を準備する。
- 選択肢のプラスミドが原を提供するには、2つのアミノ酸なしで合成完全培地を含むプレートまたはヌクレオチドを準備する。つのプレートの培地は、2%グルコース、2%ガラクトースと1%のラフィノースと、他の板のようで補足されるべきである。 20分間室温で無菌層流フードのプレートを乾燥させるとグリッドの上に置きます。
- それぞれの文化のため、両方の抑制と誘導するメディア上の行の4つの希釈からスポットを10μl。
- スポッティング後、数分間フード内でプレートを開いたまま。斑点が乾燥しているときに、プレートをカバーし、2〜3日、30℃のインキュベーターに置いてください。
- インキュベーション後、プレートを取り出し、酵母の成長を分析する。最初に、細胞密度が抑制培地を含むプレート上で類似していることを確認してください。その後、誘導培地を含むプレート上で空のベクターを保持する文化に関心のエフェクタータンパク質を発現する培養物の増殖を比較する。
注:エフェクターは、標準的な実験の成長条件下での酵母の生育にレート制限されていない細胞プロセスを標的とすることがあります。このようなエフェクターのための成長の阻害の表現型の同定を可能にするために、誘導メディアはエフェクターに対する感受性を増加させるので、酵母の細胞機能を変化させる化合物を補給することができます。おそらくこの手順に統合することができます化学物質のリストについては、パーソンズらを参照してください。 (2004年)2。
VI。代表的な結果
タイプIIIエフェクターの発現により誘導される増殖阻害表現型の分析と検知をスポッティング代表的な酵母は、図に示す。 1。この実験では、タイプIIIエフェクターAvrPto、HopAA1 - 1およびグラム陰性植物病原細菌シュードモナスシリン PV。 トマト(PST)のAvrE1は酵母株BY4741のセントロメアを含むプラスミドpGML10から発現され、そしてその能力について試験酵母の成長を阻害する。ガラクトース誘導性GAL1プロモーターの制御下にあるpstファイルタイプIIIエフェクターの発現または空のベクターを含む個々の酵母培養物を連続希釈し、抑制(グルコース)や誘導(ガラクトース)メディア(図1)上に播いた。培地を抑制する上で、AvrPtoとHopAA1 - 1の発現のためのプラスミドを持つ酵母菌株は、空のベクターを含む対照株と同様の成長を示した。しかし、同じ媒体で、AvrE1を持つ酵母は、おそらくGAL1プロモーターの漏れのある程度とAvrE1の高い細胞毒性効果に関連して、わずかに減少した成長を示した。誘導条件では、AvrE1エフェクターの式には、任意の希釈でコロニーの欠如によって反射された大幅な成長の抑制表現型を引き起こした。前述Munkvoldらによって観察された。3、HopAA1 - 1の発現をAvrPtoは何の効果も認められなかったしながらも、成長の深刻な阻害をもたらした。
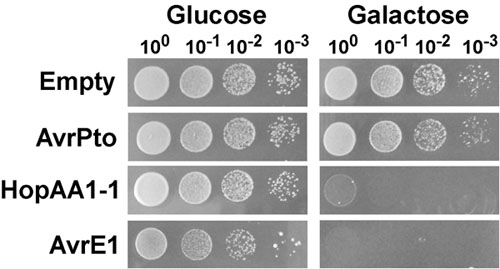
図1。 シュードモナスシリン PV。 トマトの発現に起因する酵母の増殖阻害(PST)III型エフェクターAvrE1とHopAA1 - 1。プラスミドpGML10を含む酵母株(BY4741)、AvrPtoのガラクトース誘導性発現のための空やキャリングGAL1駆動型カセットのどちらかが、HopAA1 - 1またはAvrE1は、炭素源としてグルコース(2%)、そして欠けてロイシンを添加した合成完全培地で一晩増殖させた。文化、洗浄OD 600 = 1.0とシリアル10倍希釈するために正規化されたがロイシンとを含有するグルコースを欠く合成完全な固体培地上にスポット(2%)、またはガラクトース(2%)とラフィノース(1%)いた。写真は、酵母のための° Cはそれぞれ、グルコースとガラクトースのメディアに成長している2の後に採取し、30℃で成長中の3日間した。
ディスカッション
本発表では、我々は、III型細菌のエフェクタータンパク質とどのようにエフェクター誘導性成長抑制の表現型を識別するための発現のための異種システムとして、出芽酵母の出芽酵母を使用する方法を示します。重要なことは、これらの表現型は、酵母の増殖に対するエフェクターの負の影響の抑制を識別するための遺伝子スクリーニングに利用することができます。サプレッサは、?...
謝辞
この作品は、イスラエル科学財団によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Yeast extract | Difco Laboratories | 212750 | |
| Peptone | Difco Laboratories | 211677 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| Agar | Difco Laboratories | 214010 | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S8045 | |
| Yeast nitrogen base w/o amino acids | Difco Laboratories | 291940 | |
| Yeast synthetic drop-out medium supplement | Sigma-Aldrich | Y2001 | |
| D-galactose | Sigma-Aldrich | G0750 | >99%; <0.1% glucose |
| D-raffinose | Sigma-Aldrich | R0250 | >98% |
| L-leucine | Sigma-Aldrich | L8000 | |
| Uracil | Sigma-Aldrich | U0750 | |
| L-tryptophan | Sigma-Aldrich | T0254 | |
| L-histidine | Sigma-Aldrich | H6034 | |
| DNA, single stranded, from salmon testes | Sigma-Aldrich | D7656 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D5879 | Desiccate |
| Hydrochloric acid (HCl) | Sigma-Aldrich | H1758 | |
| Polyethylene glycol (PEG) 3350 | Sigma-Aldrich | P4338 | |
| Lithium acetate (LiAc) | Sigma-Aldrich | L4958 | |
| Tris (base) | JT Baker | 4109-02 | |
| Ethylenediamine-tetraacetic acid (EDTA) | Sigma-Aldrich | E5134 | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| Bromophenol blue | Sigma-Aldrich | B6131 | |
| Dodecyl sulfate sodium salt (SDS) | Merck & Co., Inc. | 8.22050.1000 | |
| Centrifuge tubes (15 ml) | Corning | 430052 | Sterile |
| Spectrophotometer cuvette (10x4x45 mm) | Sarstedt Ltd | 67.742 | |
| Inoculation loop | Sigma-Aldrich | Z643009 | Sterile |
| Parafilm | Sigma-Aldrich | P7543 | |
| pH indicator strip, pH 6.5-10.0 | Merck & Co., Inc. | 1.09543.0001 |
参考文献
- Siggers, K. A., Lesser, C. F. The yeast Saccharomyces cerevisiae: a versatile model system for the identification and characterization of bacterial virulence proteins. Cell Host Microbe. 4, 8-15 (2008).
- Parsons, A. B. Integration of chemical-genetic and genetic interaction data links bioactive compounds to cellular target pathways. Nat. Biotechnol. 22, 62-69 (2004).
- Munkvold, K. R., Martin, M. E., Bronstein, P. A., Collmer, A. A survey of the Pseudomonas syringae pv. tomato DC3000 type III secretion system effector repertoire reveals several effectors that are deleterious when expressed in Saccharomyces cerevisiae. Mol. Plant-Microbe Interact. 21, 490-502 (2008).
- Curak, J., Rohde, J., Stagljar, I. Yeast as a tool to study bacterial effectors. Curr. Opin. Microbiol. 12, 18-23 (2009).
- Slagowski, N. L., Kramer, R. W., Morrison, M. F., LaBaer, J., Lesser, C. F. A functional genomic yeast screen to identify pathogenic bacterial proteins. PLoS Pathog. 4, e9-e9 (2008).
- Huang, J., Lesser, C. F., Lory, S. The essential role of the CopN protein in Chlamydia pneumoniae intracellular growth. Nature. 456, 112-115 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved