È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Identificazione dei fenotipi inibizione della crescita indotta da Espressione di effettori batterica di tipo III nel lievito
In questo articolo
Riepilogo
In questo video, si descrive una procedura per l'espressione di effettori batterica di tipo III nel lievito e l'individuazione di fenotipi crescita effettrici indotte inibizione. Fenotipi quali può essere successivamente sfruttato per chiarire le funzioni effettrici e gli obiettivi.
Abstract
Molti batteri Gram-negativi patogeni utilizzano un sistema di secrezione tipo III a traslocare una serie di proteine effettrici nel citosol delle cellule ospiti. All'interno della cellula, tipo di effettori III sovvertire processi host cellulari per sopprimere le risposte immunitarie e favorire la crescita dei patogeni. Numerosi effettori tipo III di patogeni animali e vegetali batteriche sono stati identificati fino ad oggi, ma solo pochi di loro sono ben caratterizzati. Comprendere le funzioni di questi effettori è stata compromessa da una combinazione di ridondanza funzionale nel repertorio effettore di un ceppo batterico dato, gli effetti sottili che possono esercitare per aumentare la virulenza, i ruoli che sono forse specifici per alcune fasi dell'infezione, e le difficoltà di geneticamente la manipolazione di determinati agenti patogeni. Espressione di tipo III effettori nel lievito
Protocollo
I. La progettazione di un sistema di espressione per il tipo di lievito per DJ III
Calibrazione di un sistema appropriato di lievito per l'espressione del III tipo effettore (s) di interesse è un compito importante e può richiedere alcuni tentativi ed errori. Fattori che rivestono un'importanza fondamentale da prendere in considerazione quando si progetta e ottimizzato un tale sistema sono: 1) il promotore di guida espressione del effettrici (s), 2) il numero di copie del gene effettore, 3) il tag epitopo utilizzati per verificare l'espressione della proteina , e 4) il ceppo di lievito.
1) Promotore
A causa batterica di tipo III effettori possono essere tossici per le cellule di lievito, un promotore inducibile deve essere utilizzato per controllare la loro espressione. Il promotore GAL1 è comunemente usato per questo scopo e la sua attività è regolata dalla fonte di carbonio presente nel terreno di coltura: è repressa da glucosio e galattosio indotta da. Tuttavia, questo promotore è stato segnalato come un po 'che perde in condizioni di reprimere con conseguente tossicità indesiderati. Se un problema analogo si riscontra, è consigliabile ridurre al minimo il numero di copie del gene effettore come descritto di seguito, o per usare promotori inducibili alternative, come il MET3 o CUP1 promotori 1. Qui si descrivono le modalità per l'espressione delle proteine effettrici da un galattosio-promotore inducibile.
2) Gene copia-numero
Un ulteriore parametro che incidono sul livello di espressione della proteina è il numero di copie del gene effettore presenti nella cellula. Elevati livelli di espressione si ottengono quando il gene effettore è approvata a 2-micron plasmide (40-60 copie per cellula). Espressione intermedio è ottenuta utilizzando un centromero contenenti plasmide (1-3 copie per cellula), mentre la bassa espressione si ottiene quando il gene effettore è integrato nel genoma del lievito per ricombinazione omologa. Grazie alla combinazione di un centromero contenenti vettore e promotore GAL1 che abbiamo espresso con successo circa 50 effettori della patogeni delle piante Xanthomonas campestris pv. Vesicatoria e Pseudomonas syringae pv. Pomodoro a livelli rilevabili mediante analisi immunoblot e con perdite trascurabili in condizioni di repressione (Salomon e Sessa , inedito).
3) epitopi tag
Se gli anticorpi contro l'effettore di interesse non sono disponibili, un tag epitopo è fusa alla proteina effettore di monitorare la sua espressione da immunoblot. Tag più utilizzati sono Myc, emoagglutinina (HA) o Bandiera, al quale affidabile anticorpi commerciali sono disponibili. Ti consigliamo di utilizzare una sola copia del tag per minimizzare indesiderati effetti deleteri sulla struttura e sull'attività delle proteine effettrici.
4) ceppo di lievito
Un requisito fondamentale per il ceppo di lievito da utilizzare per l'espressione è auxotrophy al marcatore del vettore di espressione. E 'importante notare che diversi ceppi di lievito possono visualizzare diverse sensibilità di espressione di alcuni effettori. Per esempio, abbiamo osservato che i ceppi BY4741 e W303 hanno sensibilità diverse a diverse Xanthomonas campestris pv. Vesicatoria effettori (Salomon e Sessa, inedito). Pertanto, è preferibile testare la effettrici (s) di interesse in diversi ceppi di lievito.
II. Preparazione dei supporti di lievito
Per la crescita di ceppi di lievito che non contengono vettoriale, utilizzare YPD (10 g / l estratto di lievito, 20 g / L peptone e 2% [w / v] glucosio) come mezzo di crescita. Per i mezzi solidi, aggiungere 2% [w / v] agar alla soluzione (se il terreno solido è molto morbido, aggiungere 0,05% [v / v] da uno stock soluzione al 5 N NaOH al mezzo prima di autoclave). Si consiglia di preparare il mezzo senza glucosio nel 90% del volume finale e la sterilizzazione in autoclave. Poco prima dell'uso, riempire il volume al 100% con un filtro-sterilizzata il 20% [w / v] una soluzione di glucosio (conservare la soluzione di glucosio al 20% a 4 ° C per prevenire la contaminazione).
Per la crescita di ceppi di lievito contenente un vettore che fornisce prototrophy ad un marcatore (leucina, uracile, istidina o triptofano), l'uso sintetico drop-out medio senza leucina, uracile, istidina e triptofano (6,7 g / L di azoto base di lievito senza aminoacidi , 1,4 g / L di lievito sintetico drop-out supplemento media) e contenente il 2% [w / v] glucosio, o al 2% [w / v] galattosio e 1% [w / v] raffinosio. Per i mezzi solidi, aggiungere 2% [w / v] agar alla soluzione. Si consiglia di preparare il medio nel 90% del volume finale e la sterilizzazione in autoclave. Poco prima dell'uso, riempire il volume al 100% con un filtro-sterilizzato soluzione di glucosio al 20%, o di galattosio, sterilizzata per filtrazione raffinosio soluzione al 20% + 10%, a seconda della fonte di carbonio desiderata (mantenere il glucosio al 20% e il 20% galattosio + soluzioni raffinosio 10% a 4 ° C per prevenire la contaminazione). A seconda del marcatore del vec espressionetor, aggiungere gli altri amminoacidi o uracile prima dell'uso (10 ml / l da un 1 g/100 ml di leucina stock, 10 ml / l da un magazzino 200 mg/100 ml uracile, 2 ml / l da un 1 g/100 ml di brodo istidina, o 2 ml / l da un magazzino 1 g/100 ml triptofano). Nel preparare scorte di leucina e uracile, li sterilizzare in autoclave e tenere a temperatura ambiente. Nel preparare le scorte istidina e triptofano, li sterilizzare filtrando, avvolgere la bottiglia con un foglio di alluminio per proteggere dalla luce, e mantenere a 4 ° C. Nelle procedure descritte di seguito, sintetico drop-out medio integrato con leucina, uracile, istidina e triptofano è designato come sintesi terreno completo.
Solido-media piastre possono essere conservate per un massimo di due mesi a 4 ° C. Prima dell'uso, a secco le piastre per 20 minuti in una cappa a flusso laminare sterile a temperatura ambiente.
III. Trasformazione di lievito
- Prima di iniziare la procedura di trasformazione lievito, preparare le seguenti tre soluzioni: il 50% [w / v] polietilene glicole (PEG) 3350 soluzione, un M 1 LIAC pH = 8.0, e una soluzione TE (100 mM Tris pH = 6.85 e 10 mM EDTA pH = 8,0). Filtro-sterilizzare le soluzioni e tenere a 4 ° C.
- Utilizzando una lunga asta di legno o un ansa da inoculo sterile, scegliere una colonia di lievito (1-2 mm di diametro) da un piatto fresco e inoculare 3 ml di YPD in un tubo di polipropilene da 15 ml. Vortex brevemente. Posizionare il tubo di cultura in un rullo e incubare una notte a 30 ° C con rotazione costante.
- Al mattino, rimuovere la cultura dal rullo e centrifugare a 800 g per 5 minuti a temperatura ambiente. Dopo la centrifugazione, rimuovere completamente il surnatante.
- Risospendere le cellule in 1 ml di tampone risospensione (10% [v / v] TE soluzione, il 10% [v / v] 1 M soluzione LIAC) e mescolare con il vortex.
- Per ogni plasmide ad essere trasformata e una trasformazione ulteriore controllo, il trasferimento di 100 l di sospensione cellulare ad un microprovette.
- Per ogni tubo, aggiungere 5 ml di DNA a singolo filamento di sperma di salmone (10 mg / ml) e 250-500 ng di DNA plasmidico da trasformare (ad eccezione della provetta di controllo).
- Aggiungere con cautela ad ogni tubo di 650 microlitri di soluzione di trasformazione (10% [v / v] TE soluzione, il 10% [v / v] 1 M soluzione LIAC, 80% [v / v] del 50% [w / v] soluzione di PEG ) e vortice.
- Incubare a 30 ° C per 30 minuti su un rullo.
- Rimuovere i tubi dal shaker, aggiungere 70 ml di DMSO, e mescolare invertendo i tubi di 10-15 volte (non vortice per evitare di rompere le cellule).
- Porre i tubi in un 42 ° C preriscaldata bagnomaria e incubare per 15 min.
- Rimuovere i tubi dal bagnomaria e subito metterli in ghiaccio per 2 minuti.
- Una volta che i tubi si sono raffreddati, li centrifugare a 800 g per 5 minuti a temperatura ambiente.
- Prendete i tubi della microcentrifuga e rimuovere con attenzione il sopranatante viscoso con una pipetta.
- Risospendere il pellet di cellule di ogni tubo in 150 ml di acqua sterile bidistillata (DDW), e diffondere la sospensione cellulare su un piatto sintetico terreno completo contenente il 2% di glucosio come fonte di carbonio e senza l'aminoacido o nucleotidi a cui il plasmide fornisce prototrophy.
- Lasciare le piastre aperto per 2 minuti e permettere loro di asciugare in una cappa a flusso laminare. Posizionare le piastre in un incubatore a 30 ° C per 2-3 giorni.
- Una volta che le colonie (1-2 mm di diametro) sono apparsi sui piatti, raccogliere circa 10 singole colonie da ogni trasformazione e di trasferirli in un piatto fresco. Quando si trasferiscono le colonie, fare 2 cm x 2 cm patch per permettere la crescita di una grande quantità di cellule di lievito. Incubare le piastre in un incubatore a 30 ° C per due giorni.
- Quando le patch lievito sono cresciuti, rimuovere le piastre dal termostato e sigillare con parafilm. Piastre possono essere conservati a 4 ° C. Trasferimento colonie su una piastra fresco ogni 10-14 giorni.
IV. Preparazione di una proteina Estratto di lievito per verificare Espressione Effettistica da Immunoblot
- Scegli una colonia di lievito (1-2 mm di diametro) da un piatto fresco ad un tubo in polipropilene da 15 ml contenente 3 ml di appropriati terreno sintetico completo integrato con il 2% di glucosio come fonte di carbonio e senza l'aminoacido o nucleotidi a cui il plasmide di scelta fornisce prototrophy. Posizionare il tubo di cultura in un rullo e incubare una notte a 30 ° C.
- Nel giorno seguente, togliere la cultura dal rullo e centrifugare a 800 g per 5 minuti a temperatura ambiente. Rimuovere i tubi dalla centrifuga e scartare il surnatante.
- Risospendere il pellet in 3 ml di DDW sterile e mescolare nel vortex.
- Centrifuga di nuovo, scartare le cellule surnatante e risospendere in 3 ml di DDW sterile.
- Trasferire 200 microlitri della sospensione cellulare in un nuovo tubo 15 ml contenente 3 ml di terreno completo sintetico integrato con il 2% e 1% galattosio raffinosio come fonte di carbonio, e senza l'aminoacido o nucleotidi a cui il plasmide di scelta fornisce prototrophy.Mescolare nel vortex, posto in un rullo, e incubare una notte a 30 ° C.
- Al mattino seguente, trasferire 1 ml della cultura (o più per le culture a bassa densità) ad un microprovette. Raccogliere le cellule per centrifugazione a 800 g per 5 minuti a temperatura ambiente.
- Da qui in poi, il lavoro in una cappa aspirante per evitare di inalare β-mercaptoetanolo vapori tossici. Rimuovere con attenzione il sopranatante con una pipetta e risospendere il pellet cellulare in 100 ml di soluzione ghiacciata lisi (4% [v / v] 5 N NaOH, 0,5% [v / v] β-mercaptoetanolo). Mescolare vigorosamente nel vortex e incubare in ghiaccio per 30 min.
- Durante l'incubazione, determinare il volume di HCl (6 N) richiesto per la titolazione 100 l di tampone di lisi a pH 9-10. A questo scopo, versare 10 microprovette in un microlitri 100 rack e trasferimento del tampone di lisi in ciascuno di essi. Aggiungi vari volumi (1-10 microlitri) di HCl (6 N) per ciascuna provetta e mescolare nel vortex. Prelevare un campione e controllare il pH della soluzione con una striscia indicatore di pH.
- Al termine della incubazione, aggiungere il volume di HCl determinata nel passaggio precedente al lisato e mescolare nel vortex (per una migliore accuratezza, la soluzione di HCl posto sul lato del tubo senza inserire la punta nel lisato).
- Aggiungere 50 ml di tampone campione 3x (30% [v / v] glicerolo, il 15% [v / v] β-mercaptoetanolo, il 37,5% [v / v] 500 mM Tris-HCl pH = 6,8, 0,15% [w / v ] di sodio dodecil solfato [SDS] e qualche grano di blu di bromofenolo) al lisato e mescolare nel vortex (se la soluzione diventa gialla, significa che il pH è troppo basso, e un paio di microlitri di soluzione lisi dovrebbero essere aggiunti fino a quando la soluzione diventa blu).
- Far bollire la soluzione lisato per 5 minuti su un blocco di riscaldamento dopo fora un buco nella copertura del microtubo con un ago.
- Rimuovere il microtubo dal blocco di riscaldamento e consentire la soluzione di raffreddamento per 2 minuti a temperatura ambiente.
- Vortex la soluzione lisato e poi spin down per 10 sec. 30 microlitri di carico su un gel SDS-PAGE per l'analisi immunoblot.
V. Spotting analisi per rilevare Effettistica indotta Fenotipi inibizione della crescita
- Da un piatto fresco prendere una colonia di lievito (1-2 mm di diametro) che trasportano l'espressione plasmide di interesse e inoculare in un tubo da 15 ml in polipropilene, 3 ml di terreno completo sintetico integrato con il 2% di glucosio come fonte di carbonio e senza l'aminoacido acido o nucleotidi a cui il plasmide di espressione fornisce prototrophy. Ripetete la stessa procedura per un ceppo di lievito di controllo che trasporta un plasmide vuoto. Posizionare i tubi di cultura in un rullo e incubare una notte a 30 ° C con rotazione costante.
- Nel giorno seguente, togliere le culture dal rullo e centrifugare a 800 g per 5 minuti a temperatura ambiente. Rimuovere i tubi dalla centrifuga e scartare il surnatante.
- Risospendere il pellet in 3 ml di DDW sterile e mescolare nel vortex.
- Ripetere la fase di centrifugazione e risospendere le cellule in 3 ml di DDW sterile.
- Per determinare la loro densità ottica (OD), trasferire 100 ul di ogni cultura ad un microprovette contenente 900 microlitri DDW e vortice. Versare il contenuto dei tubi in una cuvetta di plastica e misurare l'assorbanza alla lunghezza d'onda di 600 nm (utilizzare come riferimento una cuvetta riempita con 1 ml di DDW). Calcolare il diametro esterno 600 delle culture iniziale moltiplicando l'OD 600 delle culture nella cella di un fattore di diluizione di 10.
- Successivamente, in base al diametro esterno 600 del culture iniziale, preparare sospensioni cellulari (1 ml) con un diametro esterno 600 = 1.0 in microprovette sterili.
- Utilizzando 3 microprovette sterili riempiti con 900 microlitri DDW sterili, preparare tre diluizioni seriali di 10 volte (OD 600 = 0,1, 0,01 e 0,001) da ogni sospensione cellulare (OD 600 = 1,0) preparato nel passaggio precedente.
- Preparare due piastre contenenti sintetico terreno completo senza la aminoacidi o nucleotidi a cui il plasmide di scelta fornisce prototrophy. Il mezzo di una piastra dovrebbe essere completato con 2% di glucosio e quella degli altri piastra con il 2% e 1% galattosio raffinosio. Essiccare le piastre in una cappa a flusso laminare sterile a temperatura ambiente per 20 minuti e metterli su una griglia.
- Per ogni cultura, punto 10 microlitri dai quattro diluizioni in fila su entrambi i reprimendo e indurre i media.
- Dopo spotting, lasciare i piatti aperto il cofano per alcuni minuti. Quando le macchie sono secche, coprire i piatti e metterli in un incubatore a 30 ° C per 2-3 giorni.
- Dopo l'incubazione, togliere i piatti e analizzare la crescita del lievito. In primo luogo, verificare che le densità di cellule sono simili sulla piastra contenente medio repressione. Poi, confrontare la crescita della cultura che esprime la proteina effettore di interesse con la cultura che trasporta un vettore vuoto sul piatto contenente medio indurre.
Nota: effettori possono essere indirizzati processi cellulari che non si limita la velocità di crescita del lievito in condizioni standard di crescita di laboratorio.Per consentire l'identificazione di fenotipi inibizione della crescita per effettori tale, inducendo i media può essere integrato con sostanze che alterano le funzioni cellulari del lievito, aumentando così la loro sensibilità ai effettori. Per un elenco di sostanze chimiche che possono eventualmente essere integrato in questa procedura, fare riferimento a Parsons et al. (2004) 2.
VI. Rappresentante Risultati
Un lievito rappresentante spotting analisi e l'individuazione di fenotipi inibizione della crescita indotta da effettori espressione di tipo III sono mostrati in fig. 1. In questo esperimento, il tipo III effettori AvrPto, HopAA1-1 e AvrE1 dei Gram-negativi fitopatogeni batterio Pseudomonas syringae pv. Pomodoro (Pst) sono stati espressi dal centromero contenenti pGML10 plasmide nel ceppo di lievito BY4741, e testati per la loro capacità per inibire la crescita del lievito. Lieviti individuo esprime Pst tipo effettori III sotto il controllo del promotore inducibile GAL1 galattosio o con un vettore vuoto sono stati diluiti in serie e placcato sulla repressione (glucosio) o indurre (galattosio) media (Fig. 1). Sulla repressione media, i ceppi di lievito portando plasmidi per l'espressione di AvrPto e HopAA1-1 mostra una crescita simile a quella del ceppo di controllo che contiene un vettore vuoto. Ma sullo stesso supporto, il lievito portando AvrE1 mostrato una crescita leggermente ridotta, probabilmente correlati ad un certo grado di perdita del promotore GAL1 e per l'effetto citotossico di alta AvrE1. In condizioni di induzione, espressione della AvrE1 effettrici ha causato una drastica fenotipo inibizione della crescita riflette la mancanza di colonie in ogni diluizione. Come già osservato da Munkvold et al. 3, espressione di HopAA1-1 ha comportato una grave inibizione della crescita, mentre AvrPto non ha mostrato alcun effetto.
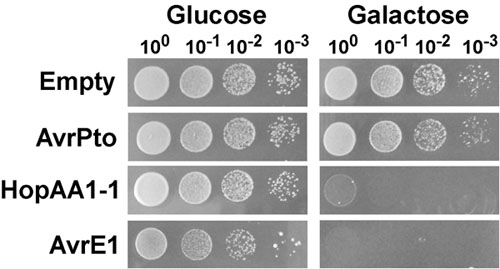
Figura 1. Lievito di inibizione della crescita causato dalla espressione della Pseudomonas syringae pv. Pomodoro (Pst) di tipo III effettori AvrE1 e HopAA1-1. Ceppi di lievito (BY4741) contenente il plasmide pGML10, sia vuoto o che trasportano GAL1-driven cassette per galattosio-inducibile espressione di AvrPto , HopAA1-1 o AvrE1, durante la notte sono stati coltivati in terreno completo sintetico integrato con glucosio (2%) come fonte di carbonio, e privo di leucina. Le culture sono stati lavati, normalizzato a OD 600 = 1.0 e seriale 10-diluizioni sono stati avvistati su supporti sintetici completa solido manca leucina e glucosio contenente (2%), o galattosio (2%) e raffinosio (1%). Le fotografie sono state prese dopo 2 e 3 giorni di crescita a 30 ° C per il lievito crescita in glucosio e galattosio dei media, rispettivamente.
Discussione
In questa presentazione, abbiamo illustrato come utilizzare il lievito Saccharomyces cerevisiae in erba come un sistema eterologo per l'espressione di tipo III proteine batteriche effettrici e come identificare effettore indotta fenotipi inibizione della crescita. È importante sottolineare che questi fenotipi possono essere utilizzati in schermi genetici per identificare soppressori dell'impatto negativo di effettori sulla crescita del lievito. Soppressori possono rappresentare bersagli diretti d...
Riconoscimenti
Questo lavoro è stato sostenuto dalla Israel Science Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| Yeast extract | Difco Laboratories | 212750 | |
| Peptone | Difco Laboratories | 211677 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| Agar | Difco Laboratories | 214010 | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S8045 | |
| Yeast nitrogen base w/o amino acids | Difco Laboratories | 291940 | |
| Yeast synthetic drop-out medium supplement | Sigma-Aldrich | Y2001 | |
| D-galactose | Sigma-Aldrich | G0750 | >99%; <0.1% glucose |
| D-raffinose | Sigma-Aldrich | R0250 | >98% |
| L-leucine | Sigma-Aldrich | L8000 | |
| Uracil | Sigma-Aldrich | U0750 | |
| L-tryptophan | Sigma-Aldrich | T0254 | |
| L-histidine | Sigma-Aldrich | H6034 | |
| DNA, single stranded, from salmon testes | Sigma-Aldrich | D7656 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D5879 | Desiccate |
| Hydrochloric acid (HCl) | Sigma-Aldrich | H1758 | |
| Polyethylene glycol (PEG) 3350 | Sigma-Aldrich | P4338 | |
| Lithium acetate (LiAc) | Sigma-Aldrich | L4958 | |
| Tris (base) | JT Baker | 4109-02 | |
| Ethylenediamine-tetraacetic acid (EDTA) | Sigma-Aldrich | E5134 | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| Bromophenol blue | Sigma-Aldrich | B6131 | |
| Dodecyl sulfate sodium salt (SDS) | Merck & Co., Inc. | 8.22050.1000 | |
| Centrifuge tubes (15 ml) | Corning | 430052 | Sterile |
| Spectrophotometer cuvette (10x4x45 mm) | Sarstedt Ltd | 67.742 | |
| Inoculation loop | Sigma-Aldrich | Z643009 | Sterile |
| Parafilm | Sigma-Aldrich | P7543 | |
| pH indicator strip, pH 6.5-10.0 | Merck & Co., Inc. | 1.09543.0001 |
Riferimenti
- Siggers, K. A., Lesser, C. F. The yeast Saccharomyces cerevisiae: a versatile model system for the identification and characterization of bacterial virulence proteins. Cell Host Microbe. 4, 8-15 (2008).
- Parsons, A. B. Integration of chemical-genetic and genetic interaction data links bioactive compounds to cellular target pathways. Nat. Biotechnol. 22, 62-69 (2004).
- Munkvold, K. R., Martin, M. E., Bronstein, P. A., Collmer, A. A survey of the Pseudomonas syringae pv. tomato DC3000 type III secretion system effector repertoire reveals several effectors that are deleterious when expressed in Saccharomyces cerevisiae. Mol. Plant-Microbe Interact. 21, 490-502 (2008).
- Curak, J., Rohde, J., Stagljar, I. Yeast as a tool to study bacterial effectors. Curr. Opin. Microbiol. 12, 18-23 (2009).
- Slagowski, N. L., Kramer, R. W., Morrison, M. F., LaBaer, J., Lesser, C. F. A functional genomic yeast screen to identify pathogenic bacterial proteins. PLoS Pathog. 4, e9-e9 (2008).
- Huang, J., Lesser, C. F., Lory, S. The essential role of the CopN protein in Chlamydia pneumoniae intracellular growth. Nature. 456, 112-115 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon