Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Идентификация фенотипов ингибирование роста индуцированной экспрессии бактериального типа создания эффектов III в Дрожжи
Резюме
В этом видео мы опишем процедуру выражения типа бактериальных эффекторов III в дрожжах и идентификации эффекторных вызванных фенотипы ингибирование роста. Такие фенотипов может быть впоследствии использована для выяснения эффекторных функций и задач.
Аннотация
Многие грамотрицательные патогенные бактерии используют тип секреции III системы к транслокации набор эффекторных белков в цитоплазме клеток хозяина. В ячейке, типа III эффекторов подорвать хост клеточных процессов для подавления иммунных реакций и способствовать росту возбудителя. Многочисленные типа III эффекторы растений и животных, бактериальных патогенов были определены на сегодняшний день, но лишь немногие из них хорошо подходит. Понимание функций этих эффекторов была подорвана сочетание функциональной избыточностью в эффекторных репертуара данного бактериального штамма, тонкие эффекты, которые они могут оказывать увеличение вирулентности, роли, которые, возможно, характерных для определенных стадиях инфекции, и трудности с генетически манипулирования определенные патогенные микроорганизмы. Выражение типа эффекторов III в почкующихся дрожжей
протокол
I. Разработка системы Дрожжи Выражение для создания эффектов типа III
Калибровка дрожжей система подходит для выражения типа III эффекторные (ы), представляющих интерес, является важной задачей и может потребовать некоторых проб и ошибок. Факторы крупных актуальность, которые должны быть рассмотрены и оптимизированы при проектировании такой системы являются: 1) промоутер вождения выражение эффекторные (ы), 2) число копий гена эффекторные, 3) эпитопа теги используются для проверки экспрессии белка и 4) штамм дрожжей.
1) Промоутер
Поскольку бактериальные типа III эффекторы могут быть токсичными для дрожжевых клеток, индуцируемых промоторов должны быть использованы для контроля их выражения. Промоутер GAL1 обычно используется для этой цели и ее деятельность регулируется настоящим источником углерода в питательной среде: оно подавляется глюкозы и индуцированной галактозы. Тем не менее, этот промотор было сообщено как немного вытекающей при подавлении условиях приводит к нежелательной токсичности. Если аналогичная проблема встречается, желательно свести к минимуму число копий гена эффекторные, как описано ниже, или для использования альтернативных промоторов индуцибельной, таких как MET3 или CUP1 промоутеров 1. Здесь мы описываем процедуры для выражения эффекторных белков из галактозы-индуцируемых промоутера.
2) копию гена-номер
Дополнительного параметра, влияющих на уровень экспрессии белка является количество копий гена эффекторных присутствует в клетке. Высокие уровни экспрессии достигаются тогда, когда эффекторных генов осуществляется с помощью 2-микронной плазмиды (40-60 копий в клетки). Промежуточные выражение получается с помощью центромеры содержащие плазмиды (1-3 копий на клетку), тогда как низкая экспрессия достигается, когда эффекторные ген встраивается в геном дрожжей путем гомологичной рекомбинации. Объединив центромеры содержащих векторные и GAL1 промоутер мы успешно выразили около 50 эффекторы патогенов растений Xanthomonas сатрезЫз ру. Vesicatoria и Pseudomonas syringae ру. Помидор на уровнях обнаруживается иммуноблот анализ и при незначительной утечке в условиях подавления (Salomon и Sessa , неопубликованные).
3) Эпитоп теги
Если антитела против эффекторных интереса нет, теги эпитопа сливается с эффекторных белков, чтобы следить за его выражению иммуноблота. Часто используемые теги Myc, гемагглютинина (HA), либо флаг, к которому надежные коммерческие антитела имеются. Мы рекомендуем использовать только одну копию тега, чтобы минимизировать нежелательное негативное влияние на структуру и деятельность эффекторных белков.
4) штамм дрожжей
Одно из основных условий для штамм дрожжей, которые будут использоваться для выражения auxotrophy к выбору маркера вектор экспрессии. Важно отметить, что различные штаммы дрожжей могут отображать различную чувствительность к выражению некоторых эффекторов. Например, мы обнаружили, что BY4741 и W303 штаммы имеют различную чувствительность к нескольким Xanthomonas сатрезЫз ру. Vesicatoria эффекторов (Salomon и Сесса, не опубликовано). Поэтому, желательно, чтобы проверить эффекторные (ы), представляющих интерес в разных штаммов дрожжей.
II. Подготовка дрожжей СМИ
Для роста штаммов дрожжей, которые не содержат какой-либо вектор, используйте YPD (10 г / л дрожжевого экстракта, 20 г / л пептона и 2% [/ об] глюкозы) в качестве питательной среды. Для твердых сред, добавить 2% [/ об] агар, чтобы решение (если твердой среде является очень мягким, добавить 0,05% [об. /] из 5 N маточного раствора NaOH в среду перед автоклавированием). Мы рекомендуем подготовке среде без глюкозы в 90% от конечного объема и автоклавирования его. Незадолго перед использованием, заполнить объем до 100% с фильтром стерилизовать 20% [/ об] раствор глюкозы (держать 20% раствора глюкозы при 4 ° С для предотвращения загрязнения).
Для роста дрожжей штаммов, содержащих вектор, который обеспечивает прототрофности для селективного маркера (лейцин, урацил, гистидина или триптофан), использование синтетических отсева среде без лейцина, урацил, гистидин и триптофан (6,7 г / л дрожжевого азотистого основания без аминокислот , 1,4 г / л дрожжевого синтетических отсева среди дополнение) и содержащий 2% [/ об] глюкозы, или 2% [/ об] галактозы и 1% [/ об] раффинозы. Для твердых сред, добавить 2% [/ об] агар к решению. Мы рекомендуем подготовке среды в 90% от конечного объема и автоклавирования его. Незадолго перед использованием, заполнить объем до 100% с фильтром стерилизовать 20% раствора глюкозы или фильтр-стерилизовать 20% галактозы + 10% раффиноза решение, в зависимости от желаемого источника углерода (держать 20% глюкозы и 20% галактоза + 10% растворы раффиноза при 4 ° С для предотвращения загрязнения). В зависимости от выбора маркера выражение векторатор, добавить другие аминокислоты или урацил перед использованием (10 мл / л от 1 г/100 мл лейцин акции, 10 мл / л от 200 мг/100 фондовом урацил мл, 2 мл / л от 1 г/100 мл гистидина акций, или 2 мл / л от 1 г/100 мл фондовом триптофан). При подготовке лейцина и урацил акции, стерилизовать их в автоклаве и держать при комнатной температуре. При подготовке гистидин и триптофан акции, стерилизовать их с помощью фильтрации, оберните бутылку с алюминиевой фольгой для защиты от света, и держать при температуре 4 ° C. В процедуре, описанной ниже, синтетические, бросающих среде, дополненной лейцин, урацил, гистидин и триптофан обозначается как синтетические полной среде.
Твердые СМИ пластины могут быть сохранены на срок до двух месяцев при температуре 4 ° C. Перед употреблением сухих пластин в течение 20 мин в стерильной ламинарном боксе при комнатной температуре.
III. Дрожжи преобразования
- Перед началом процедуры дрожжей трансформации, подготовить следующие три решения: 50% [/ об] полиэтиленгликоля (ПЭГ) 3350 раствор, 1 М раствор LiAc рН = 8,0, и решение TE (100 мМ Трис рН = 6,85 и 10 мМ ЭДТА рН = 8,0). Фильтр-стерилизовать решения и держать при температуре 4 ° C.
- Использование длинный деревянный вал или стерильной петлей прививки, забрать дрожжевых колоний (1-2 мм в диаметре) из свежей пластинки и привить 3 мл YPD в 15 мл полипропиленовые трубы. Vortex ненадолго. Место культуры трубки в роликах и инкубировать в течение ночи при 30 ° С при постоянном вращении.
- Утром, удалить культуры от ролика и центрифуге при 800 г в течение 5 мин при комнатной температуре. После центрифугирования полностью удалить супернатант.
- Ресуспендируют клеток в 1 мл ресуспендирования буфера (10% [/ о] TE раствор, 10% [/ о] 1 M LiAc раствор) и микс вортексе.
- Для каждой плазмиды к преображению и дополнительное преобразование регулирования передать 100 мкл клеточной суспензии для микропробирок.
- Для каждой трубки, добавляют 5 мкл одной нити ДНК спермы лосося (10 мг / мл) и 250-500 нг плазмидной ДНК должна быть преобразована (за исключением контроля трубки).
- Аккуратно добавить в каждую пробирку 650 мкл трансформации решение (10% [/ о] TE раствор, 10% [/ о] 1 M LiAc решение, 80% [/ о] 50% [/ об] PEG решение ) и вихрь.
- Инкубировать при температуре 30 ° С в течение 30 минут на ролик.
- Удалить труб из шейкера, добавить 70 мкл ДМСО и смеси путем обращения труб 10-15 раз (не вихрь, чтобы избежать нарушения клеток).
- Место труб в 42 ° С подогретого водяную баню и выдержать в течение 15 мин.
- Удалить труб из водяной бане и сразу же поместить их на льду в течение 2 мин.
- Как только трубы остыли, центрифуги их в 800 г в течение 5 мин при комнатной температуре.
- Возьмите трубы из микроцентрифужных и осторожно удалите супернатант вязкой использованием дозаторов.
- Ресуспендируют осадок клеток каждой трубы в 150 мкл стерильной дистиллированной водой (DDW), а также распространение клеточной суспензии на синтетической полной пластине среде, содержащей 2% глюкозы в качестве источника углерода и без аминокислоты или нуклеотидной которых плазмида обеспечивает прототрофности.
- Оставьте пластин открытой в течение 2 минут и дайте им высохнуть в ламинарном боксе. Место плит в 30 ° C инкубаторе в течение двух-трех дней.
- После колонии (1-2 мм в диаметре) появились на пластинках, выбрать около 10 отдельных колоний друг от преобразования и передачи их на свежие пластины. При передаче колониях, сделать 2 см х 2 см, патчи, чтобы рост большого количества дрожжевых клеток. Инкубируйте пластин в инкубаторе при температуре 30 ° С в течение двух дней.
- Когда дрожжи патчи выросли, удаления пластины из инкубатора и запечатать их с парафильмом. Плиты можно хранить при 4 ° C. Передача колоний на свежем пластины каждые 10-14 дней.
IV. Подготовка белкового экстракта дрожжей для проверки создания эффектов выражения Вестернблот
- Выберите колонии дрожжей (1-2 мм в диаметре) из свежих пластину 15 мл полипропиленовые трубки, содержащей 3 мл соответствующего синтетического полной среде с добавлением 2% глюкозы в качестве источника углерода и без аминокислоты или нуклеотидной которой плазмиды выбора обеспечивает прототрофности. Место культуры трубки в роликах и инкубировать в течение ночи при 30 ° C.
- В следующий день, удалить культуры от ролика и центрифуге при 800 г в течение 5 мин при комнатной температуре. Удалить труб из центрифуги и отбросить супернатант.
- Ресуспендируют клеточный осадок в 3 мл стерильной DDW и смешать по вортексе.
- Центрифуга снова отбросить супернатант и ресуспендирования клеток в 3 мл стерильной DDW.
- Передача 200 мкл суспензии клеток в новый 15 мл пробирку 3 мл синтетического полной среде с добавлением 2% галактозы и 1% раффиноза в качестве источника углерода, и без аминокислоты или нуклеотидной которой плазмиды выбора обеспечивает прототрофности.Смешайте по вортексе, поместить в ролик, и инкубировать в течение ночи при 30 ° C.
- В следующее утро, передачу 1 мл культуры (или более низкой культуры плотности) для микропробирок. Урожай клетки центрифугированием при 800 г в течение 5 мин при комнатной температуре.
- Здесь и далее работать в вытяжном шкафу, чтобы избежать дыхание β-меркаптоэтанол токсичных паров. Осторожно удалите супернатант использованием дозаторов и ресуспендируют осадок клеток в 100 мкл ледяной решение лизис (4% [об. /] 5 N NaOH, 0,5% [об. /] β-меркаптоэтанол). Mix энергично вортексе и инкубировать на льду в течение 30 мин.
- Во время инкубации, определения объема соляной кислоты (6 N), необходимых для titering 100 мкл лизирующего буфера до рН 9-10. С этой целью разместить 10 пробирок в стойку и передачи 100 мкл лизирующего буфера в каждую из них. Добавить различных объемов (1-10 мкл) HCl (6 N) в каждую пробирку и перемешайте на вортексе. Возьмите образец и проверять рН раствора с использованием полосы рН показатель.
- В конце инкубации, добавить объема соляной кислоты определяется в предыдущем шаге, чтобы лизат и смешать по вортексе (для большей точности, место решение HCl на стороне трубки, не вставляя наконечник в лизат).
- Добавить 50 мкл буфера 3x образца (30% [об. /] глицерина, 15% [об. /] β-меркаптоэтанол, 37,5% [об. /] 500 мМ Трис-HCl, рН = 6,8, 0,15% [м / о ] додецилсульфата натрия [SDS] и несколько зерен бромфенола синий), чтобы лизат и смешать по вортексе (если раствор становится желтым, это означает, что рН слишком низкий, и несколько микролитров лизис решение должно быть добавлено до решения синим цветом).
- Отварите лизат решение в течение 5 минут на обогрев блок после прокола отверстие в крышке микропробирок с помощью иглы.
- Удалить микропробирок из нагревательного блока и позволяют решение для охлаждения в течение 2 мин при комнатной температуре.
- Vortex лизат раствором, а затем вращать его в течение 10 сек. Нагрузка 30 мкл на SDS-PAGE гель для анализа иммуноблота.
В. Зрительные метода обнаруживать создания эффектов вызванных фенотипы ингибирование роста
- Из свежих пластины забрать дрожжевых колоний (1-2 мм в диаметре) проведение выражение плазмиды интерес и привить в 15 трубке полипропилена мл, 3 мл синтетического полной среде с добавлением 2% глюкозы в качестве источника углерода и без аминокислот кислоты или нуклеотидной которой выражение плазмида обеспечивает прототрофности. Повторите ту же процедуру для штамма дрожжей контроль проведение пустой плазмиды. Место культуры труб в роликах и инкубировать в течение ночи при 30 ° С при постоянном вращении.
- В следующий день, удалить культур от валика и центрифуги на 800 г в течение 5 мин при комнатной температуре. Удалить труб из центрифуги и отбросить супернатант.
- Ресуспендируют клеточный осадок в 3 мл стерильной DDW и смешать по вортексе.
- Повторите шаг центрифугирования и ресуспендирования клеток в 3 мл стерильной DDW.
- Для определения их оптической плотности (ОП), передачи 100 мкл каждой культуры по отношению микропробирку содержащие 900 мкл DDW и вихря. Вылейте содержимое трубки в пластиковых кювет и измерять оптическую плотность при длине волны 600 нм (использования в качестве справочного кювета заполнена 1 мл DDW). Рассчитать OD 600 начальных культур путем умножения OD 600 из культур в кювете на разведении в 10 раз.
- Далее, на основе OD 600 начальных культур, подготовка клеточные суспензии (1 мл) с OD 600 = 1,0 в стерильных пробирок.
- С помощью 3 стерильные микропробирки заполнены 900 мкл стерильной DDW, подготовить три 10-кратный серийные разведения (OD 600 = 0,1, 0,01 и 0,001) от каждой клеточной суспензии (OD 600 = 1,0), подготовленный на предыдущем шаге.
- Подготовка двух пластин, содержащих синтетические полной среде без аминокислоты или нуклеотидной которой плазмиды выбора обеспечивает прототрофности. Способами по своему пластина должна быть с добавлением 2% глюкозы и у других пластина с 2% галактозы и 1% раффинозы. Сухие пластины в стерильном ламинарном боксе при комнатной температуре в течение 20 минут и разместить их на сетке.
- Для каждой культуры, место 10 мкл из четырех разведения в ряд по обе подавлять и вызывать СМИ.
- После кровянистые выделения, оставляют открытыми пластин в капюшоне в течение нескольких минут. Если пятна сухие, покрывают тарелки и размещают их в 30 ° C инкубатора в течение 2-3 дней.
- После инкубации, выньте из пластин и анализа роста дрожжей. Во-первых, подтвердить, что клетка плотности похожих на пластину, содержащую подавление среды. Затем сравните рост культуры выражения эффекторных белков интереса к культуре проведения пустой вектор на пластину, содержащую вызывающие среды.
Примечание: эффекторы могут быть ориентированы на клеточные процессы, которые не являются лимитирующим для роста дрожжей при стандартных условиях роста лаборатории.Чтобы разрешить определение фенотипов ингибирование роста для таких эффекторов, вызывая средств массовой информации может быть дополнен с соединениями, которые изменяют дрожжей клеточных функций, повышая тем самым их чувствительность к эффекторов. Для перечень химических веществ, которые возможно могут быть интегрированы в эту процедуру, обратитесь к Парсонс и др.. (2004) 2.
VI. Представитель Результаты
Представитель дрожжей кровянистые выделения анализа и выявления ингибирование роста фенотипы индуцированных выражение типа эффекторов III, показаны на рис. 1. В этом эксперименте, тип III эффекторов AvrPto, HopAA1-1 и AvrE1 из грам-отрицательные бактерии Pseudomonas фитопатогенных syringae ру. Помидор (PST) были высказаны от центромеры содержащие плазмиды pGML10 в штамм дрожжей BY4741, и проверены на их способность ингибировать рост дрожжей. Индивидуальные культур дрожжей выражения Pst типа III эффекторы под контролем индуцируемого галактозы GAL1 промоутером или содержащие пустые вектора были последовательно разбавляли и высевали на подавление (глюкозы) или побуждение (галактозы) СМИ (рис. 1). На подавление среды, штаммов дрожжей проведения плазмид для экспрессии AvrPto и HopAA1-1 выставлены аналогичного роста контрольного штамма содержащих пустой вектор. Однако на той же среде, дрожжи проведения AvrE1 отображается слегка замедленный рост, вероятно, связано с какой-то степени утечки GAL1 промоутер и высокой цитотоксический эффект AvrE1. В вызывающие условия, выражение AvrE1 эффекторных вызвало резкое торможение роста фенотип отражает отсутствие колоний в любом разбавлении. Как ранее наблюдали Munkvold и соавт. 3, выражение HopAA1-1 также привело к серьезному торможению роста, в то время как AvrPto не показали никакого эффекта.
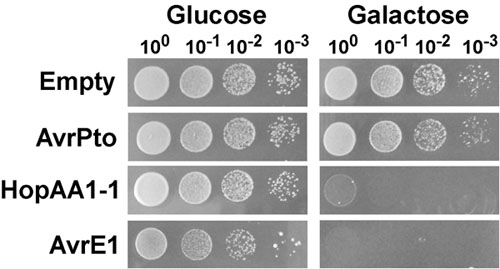
Рисунок 1. Дрожжи ингибирование роста вызвано выражение Pseudomonas syringae ру. Помидор (PST) тип III эффекторов AvrE1 и HopAA1-1. Штаммов дрожжей (BY4741), содержащие плазмиды pGML10, либо пустыми, либо проведение GAL1 управляемые кассеты для галактозы-индуцибельной экспрессии AvrPto , HopAA1-1 или AvrE1, выращивали в течение ночи в синтетических полной среде с глюкозой (2%) в качестве источника углерода, а также отсутствие лейцина. Культуры промывали, нормированная на OD 600 = 1,0 и серийный 10-кратные разведения были замечены на синтетической полной твердых средах без лейцина и содержащих глюкозу (2%), или галактозы (2%) и раффинозу (1%). Фотографии были приняты после 2 и 3 дней роста при 30 ° С для дрожжей, растущих в глюкозу и галактозу средства массовой информации, соответственно.
Обсуждение
В этой презентации мы показали, как использовать почкующихся дрожжей Saccharomyces CEREVISIAE как гетерологичных системы для выражения типа III бактериальных эффекторных белков и как определить эффекторных вызванных фенотипы ингибирование роста. Важно, что эти фенотипы могут быть использов...
Благодарности
Эта работа была поддержана Израиль научного фонда.
Материалы
| Name | Company | Catalog Number | Comments |
| Yeast extract | Difco Laboratories | 212750 | |
| Peptone | Difco Laboratories | 211677 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| Agar | Difco Laboratories | 214010 | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S8045 | |
| Yeast nitrogen base w/o amino acids | Difco Laboratories | 291940 | |
| Yeast synthetic drop-out medium supplement | Sigma-Aldrich | Y2001 | |
| D-galactose | Sigma-Aldrich | G0750 | >99%; <0.1% glucose |
| D-raffinose | Sigma-Aldrich | R0250 | >98% |
| L-leucine | Sigma-Aldrich | L8000 | |
| Uracil | Sigma-Aldrich | U0750 | |
| L-tryptophan | Sigma-Aldrich | T0254 | |
| L-histidine | Sigma-Aldrich | H6034 | |
| DNA, single stranded, from salmon testes | Sigma-Aldrich | D7656 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D5879 | Desiccate |
| Hydrochloric acid (HCl) | Sigma-Aldrich | H1758 | |
| Polyethylene glycol (PEG) 3350 | Sigma-Aldrich | P4338 | |
| Lithium acetate (LiAc) | Sigma-Aldrich | L4958 | |
| Tris (base) | JT Baker | 4109-02 | |
| Ethylenediamine-tetraacetic acid (EDTA) | Sigma-Aldrich | E5134 | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| Bromophenol blue | Sigma-Aldrich | B6131 | |
| Dodecyl sulfate sodium salt (SDS) | Merck & Co., Inc. | 8.22050.1000 | |
| Centrifuge tubes (15 ml) | Corning | 430052 | Sterile |
| Spectrophotometer cuvette (10x4x45 mm) | Sarstedt Ltd | 67.742 | |
| Inoculation loop | Sigma-Aldrich | Z643009 | Sterile |
| Parafilm | Sigma-Aldrich | P7543 | |
| pH indicator strip, pH 6.5-10.0 | Merck & Co., Inc. | 1.09543.0001 |
Ссылки
- Siggers, K. A., Lesser, C. F. The yeast Saccharomyces cerevisiae: a versatile model system for the identification and characterization of bacterial virulence proteins. Cell Host Microbe. 4, 8-15 (2008).
- Parsons, A. B. Integration of chemical-genetic and genetic interaction data links bioactive compounds to cellular target pathways. Nat. Biotechnol. 22, 62-69 (2004).
- Munkvold, K. R., Martin, M. E., Bronstein, P. A., Collmer, A. A survey of the Pseudomonas syringae pv. tomato DC3000 type III secretion system effector repertoire reveals several effectors that are deleterious when expressed in Saccharomyces cerevisiae. Mol. Plant-Microbe Interact. 21, 490-502 (2008).
- Curak, J., Rohde, J., Stagljar, I. Yeast as a tool to study bacterial effectors. Curr. Opin. Microbiol. 12, 18-23 (2009).
- Slagowski, N. L., Kramer, R. W., Morrison, M. F., LaBaer, J., Lesser, C. F. A functional genomic yeast screen to identify pathogenic bacterial proteins. PLoS Pathog. 4, e9-e9 (2008).
- Huang, J., Lesser, C. F., Lory, S. The essential role of the CopN protein in Chlamydia pneumoniae intracellular growth. Nature. 456, 112-115 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены