Method Article
פלואורני
In This Article
Summary
בין השלושה סוגי היתושים, כלומר אנופלס, Aedes, ו Culex, טכניקות מיפוי הגנום פיסיות הוקמו רק עבור אנופלס, שחבריהם בעלי כרומוזומים polytene קריאים. לסוגים של Aedes ו Culex עם זאת, מיפוי ציטוגנטית נותר מאתגר בגלל האיכות הירודה של הכרומוזומים polytene. כאן אנו מציגים פרוטוקול אוניברסלי להשגת הכנות באיכות גבוהה של כרומוזומים mitotic ופרוטוקול דגי אופטימיזציה עבור כל השלושה הסוגים של יתושים.
Abstract
פלורסנט כלאה באתר (FISH) הוא טכניקה המשמשת באופן שגרתי במעבדות רבות כדי לקבוע את המיקום הכרומוזומלי של בדיקות DNA ו-RNA. יישום החשוב של שיטה זו הוא הפיתוח של מפות באיכות גבוהה פיסיות שימושיות לשיפור המכלולים הגנום לאורגניזמים שונים. דפוס banding הטבעי של כרומוזומים polytene והמיטוטי מספק הנחיות לסידור והכיוון המדויק של supercontigs הגנומי. בין שלושה סוגי יתושי אנופלס, כלומר, Aedes, וCulex, טכניקת מיפוי כרומוזום מבוססת מבוססת היטב פותחה רק עבור אנופלס, שחבריה מחזיקים הכרומוזומים polytene קריאים 1. כתוצאה ממאמצי מיפוי הגנום, 88% מ. gambiae הגנום הושם לתפקידי כרומוזום מדויקים 2,3. שני סוגים אחרים, יתושי Aedes וCulex, שpolytenized ב הכרומוזומים גרועיםecause של ייצוג יתר משמעותי של אלמנטי transposable בגנום שלהם 4, 5, 6. רק 31 ו 9% מsupercontings הגנומי הוקצו ללא סדר או נטייה לכרומוזומים של AE. aegypti 7 וCx. quinquefasciatus 8, בהתאמה. הכנת כרומוזום mitotic לשני מינים אלה הוגבל בעבר לגרעיני מוח ושורות תאים. עם זאת, שקופיות כרומוזום שהוכנו מגרעיני המוח של יתושים בדרך כלל להכיל מספרים נמוכים של צלחות metaphase 9. כמו כן, למרות טכניקת FISH פותחה עבור כרומוזומים mitotic משורת תאים של AE. aegypti 10, ההצטברות של שחלופי כרומוזומליות מרובים בכרומוזומים 11 שורת תאים הופך אותם חסרי תועלת למיפוי הגנום. כאן אנו מתארים טכניקה פשוטה וחזקה לקבלת הכנות כרומוזום mitotic איכותיות מדיסקים דמיוניים (IDS) של 4 זחלי instar ה שגלשמש עבור כל השלושה הסוגים של יתושים. פרוטוקול סטנדרטי דגים 12 הוא מותאם לשימוש בשיבוטי BAC של הדנ"א הגנומי כמו בדיקה על כרומוזומים mitotic של AE. aegypti וCx. quinquefasciatus, ולניצול spacer intergenic (IGS) אזור של דנ"א ריבוזומלי (rDNA) כמו בדיקה ב. הכרומוזומים gambiae. בנוסף למיפוי פיזי, הטכניקה שפותחה ניתן ליישם ציטוגנטיקה אוכלוסייה וטקסונומיה כרומוזום / סיסטמטיקה של יתושים וקבוצות חרקים אחרות.
Protocol
1. הכנת כרומוזום
זחלי יתושים גודלו באמצעות פרוטוקול סטנדרטי המתוארים בשיטות מחקר באנופלס זמין באתר האינטרנט של מחקר המלריה ומרכז משאבים מגיבים עיון (MR4) 13. הטמפרטורות של גידול יתושים שונו כדי לספק את המספר הגבוה ביותר של הכרומוזומים בדיסקים דמיוניים ותמותה הנמוכה ביותר של הזחלים. שלבי התפתחות זחלי יתושים נקבעו על בסיס את הגדלים של 13 כמוסות ראשם.
- ביצי יתושי האץ' ב28 מעלות, ולאחר 2-3 ימים, 2 nd או העברת זחלי 3 rd instar עד 16 מעלות צלזיוס במשך Ae. aegypti וCx. quinquefasciatus ועד 22 מעלות צלזיוס במשך. gambiae.
- 4 בזחלי מקום instar על קרח לכמה דקות לקיבוע.
- העברת זחל לשקופית עם ירידה של פתרון hypotonic קר (0.5% כךציטראט dium או כלוריד 0.075 M אשלגן), והנח אותו מתחת למיקרוסקופ סטריאו.
- בחר זחל עם תעודות סגלגלות (האיור 1B) לנתיחה נוספת.
- לערוף זחל, וחתך את הציפורן מצד הגחון של בית החזה באמצעות מספרי הזחל מבתרים (איור 2 א). הפוך קיצוץ נוסף במגזר שני או שלישי בטן לנתח את המעיים מהזחל. את הכיוונים של הקיצוצים מוצגים באמצעות חיצים.
- פתח את הציפורן, ולהסיר את המעיים ושומן בגוף מהזחל. הסר את פתרון hypotonic מהשקופית באמצעות נייר סינון, ולהוסיף טיפה טריה של פתרון hypotonic ישירות למזהים (איור 2 ב '). שמור זחל בפתרון hypotonic עבור 10 דקות ב RT.
- הסר פתרון hypotonic באמצעות נייר סינון, וליישם הפתרון של Carnoy (אתנול / חומצה אצטית ביחס 3:1). לאחר הוספת פתרון מקבע, IDS פונה מייד לבן ולהיות גלויים בקלות מתחת למיקרוסקופ (האיור 2C ).
- השימוש במחטים מבתרות, להסיר מזהים מהזחל (האיור 2D), ולהעביר אותם לירידה של חומצת propionic 50%. הסר את כל רקמות אחרות, כגון מעיים ושומן בגוף, מהשקופית. כיסוי מזהים עם תלוש כיסוי 22x22 unsiliconized, ולשמור על 10 דקות ב RT.
- כסה את השקופית עם נייר סינון, וקישואי רקמות על ידי קשה על המחק של עיפרון על ההיקף של תלוש הכיסוי.
- בקצרה לנתח את האיכות של השקופית באמצעות מיקרוסקופ שלב הניגוד ב100x או 200x גדלה (איור 3). תכשירים ה> 50 מרווחי כרומוזום יכולים להיחשב מתאים לדגים.
- לטבול ולהחזיק את השקופית בחנקן נוזלי עד שייעצר מבעבע. הסר את הכיסוי מתלוש השקופית באמצעות סכין גילוח, ולהעביר את השקופית מייד למכל של 70% אתנול הקר ב -20 ° C. חנות ב 4 מעלות צלזיוס למשך שעות לפחות 1 לתוצאה הטובה ביותר ההתייבשות (אם יש צורך, שקופיות ניתן לאחסן ב-tהצעד מכמה דקות עד מספר ימים).
- מייבש שקופיות בסדרה של אתנול (70%, 80%, 100%) ב 4 מעלות צלזיוס למשך 5 דקות כל אחד, ואוויר יבש בRT.
- אחסן מגלשות יבשות ב -20 ° C לפני ניצולם לדגים.
2. חילוץ של שברי DNA חוזרים
ביצוע דגים של בדיקת DNA שיבוט BAC על כרומוזומים מAe. aegypti וCx. quinquefasciatus דורש באמצעות שברי DNA חוזרים ללא תווית לחסום הכלאה נוקבת של DNA חוזר לכרומוזומים. האיחוד מחדש של ה-DNA הגדיל DNA הבודד מתפצל לחתיכות של כמה מאה נ"ב עוקב עקום 0 C t כאשר C 0 הוא הריכוז הראשוני של גדילי דנ"א יחיד ולא פעם reannealing. שברי DNA עם ערכי שוויון עד 10 -10 -1 -4 או 10 ° -10 C0t 2 נחשבים מאוד מתון וחוזר על עצמו, בהתאמה.
- חלץ 400-500 מיקרוגרם של הדנ"א הגנומי מיתוש בוגר באמצעות דם Qiagen וMaxikit תא תרבות, ולהכין את פתרון ה-DNA בμl 1.2x SSC 100-1,000 ng /.
- דנ"א לפגל על ידי נחת צינור בטוח נעילה עם הדנ"א הגנומי לבלוק חימום prewarmed עד 120 מעלות צלזיוס למשך 2 דקות. טמפרטורה גבוהה מסייעת לנעה DNA ל200-500 ברי BP.
- בהתאם לריכוז ה-DNA, לשייך מחדש דנ"א על ידי נחת הצינור ב 60 מעלות צלזיוס במשך 15-150 דקות כדי להשיג את שברי 0 C t-DNA ל-C 0 t3 (טבלה 1).
- הנח את הצינור עם DNA על קרח 2 דקות.
- העבר את ה-DNA עד 42 מעלות צלזיוס, להוסיף S1 nuclease חיץ 10x חומם מראש וS1 nuclease לריכוז סופי של 100 U ל1 מ"ג של ה-DNA, ודגירה במשך שעה 1.
- דנ"א משקע על ידי הוספת נפח 0.1 יצטט M 3 נתרן ונפח 1 מתוך isopropanol בRT.
- צנטריפוגה בסל"ד 14000 עבור 20 דקות ב 4 ° C.
- שטוף DNA באתנול 70%, ושוב בסרכזת 14000 סל"ד למשך 10 דקותב 4 ° C.
- להתייבש באוויר ולפזר DNA גלולה בחיץ TE.
- למדוד את ריכוז ה-DNA, ולדמיין על ידי אלקטרופורזה ג'ל. בדרך כלל הכמות הסופית של שברי DNA חוזרים מייצגת 35-50% מסכום DNA המקורי.
3. דנ"א Probe תיוג
שני פרוטוקולים שונים שמשו לתיוג BAC שיבוט DNA הבדיקה ובדיקת rDNA IGS.
תיוג שיבוט 3.1 BAC להשתמש בכינוי-תרגום
- לחלץ דנ"א שיבוט BAC מספריית BAC באמצעות ערכת Construct גדולה Qiagen.
- הכן תערובת תגובה על תיוג כינוי-תרגום על קרח עם נפח סופי של 50 μl: 1 מיקרוגרם המבודד BAC השיבוט דנ"א, 0.05 מ"מ כל אחד ללא תווית dATP, dCTP, וdGTP ו0.015 מ"מ של dTTP; μl 1 מתוך Cy3-dUTP (או אחר fluorochrome); 0.05 מ"ג / מיליליטר BSA, 5 μl של חיץ 10x nick-תרגום, 20 U של ה-DNA פולימרז, ו0.0012 U של DNase.
- לדגור על 15 מעלות צלזיוס למשך 2.5 שעות.
- עצור תגובה על ידי הוספת μl 1 מתוך 0.5 מ 'EDTA.
- חללית החנות ב -20 ° C במקום חשוך.
3.2 IGS rDNA תיוג באמצעות PCR
- הכן תערובת תגובה על קרח עם נפח סופי של 50 μl: 200 ננוגרם של הדנ"א הגנומי; 0.05 מ"מ כל אחד ללא תווית dATP, dCTP, וdGTP; 0.015 מ"מ של dTTP; μl 1 מתוך Cy3-dUTP (או אחר fluorochrome); 5 μl של 10x PCR-חיץ; 50 pmol של קדימה; האו"ם (GTGTGCCCCTTCCTCGATGT) ולהיפך; פריימרים GA (CTGGTTTGGTCGGCACGTTT) להגברת IGS; ו10 U של פולימראז תקי DNA 14.
- מבצע תגובת PCR באמצעות פרמטרי PCR רגילים להגברת IGS: 95 מעלות צלזיוס / 5 דקות x 1 מחזור; (95 מעלות צלזיוס / 30 שניות, 50 מעלות צלזיוס / 30 שניות, 72 ° C / 30 שניות) x 30 מחזורים; 72 ° C / 5 דקות מחזור x 1, ו 4 ° C מחזיקים 14.
- חללית החנות ב -20 ° C במקום חשוך.
4. פלורסנט כלאה באתר
פרוטוקול דגים זה כולל שתי וריאציות: 1 לבאמצעות DNA השיבוט BAC כמו בדיקה על כרומוזומים mitotic של AE. aegypti וCx. quinquefasciatus והשני לשימוש rDNA IGS על כרומוזומים mitotic של. gambiae. אם באמצעות בדיקות DNA שיבוט BAC, טיפול RNase דלג על שלבי 4.3, 4.4, וצעד שקופית / בדיקה סימולטנית denaturation 4.19. אם אתם משתמשים בIGS rDNA חללית, להכין תערובת הכלאה בלי 0 שברי DNA t C, ולדלג על שקופית / בדיקה נפרדת denaturing צעדים 4.10, 4.11, 4.16, 4.17 ו.
- דגירת שקופיות ב2x SSC למשך 30 דקות ב 37 ° C.
- מייבש שקופיות בסדרה של 70%, 80%, ו 100% אתנול למשך 5 דקות בכל RT, ואוויר יבש. אם ביצוע דגים עם BAC השיבוט DNA, להמשיך ישירות לשלב 4.5.
- דגירת הכנת כרומוזום ב0.1 מ"ג / מיליליטר RNase פתרון תחת parafilm למשך 30 דקות ב 37 מעלות צלזיוס.
- לשטוף פעמים ב2x SSC למשך 5 דקות כל אחד ב 37 ° C.
- שים את השקופיות אנינה צנצנת עם 0.037% פתרון HCl פפסין 0.01% ו, ודגירה במשך 5 דקות בשעת 37 ° C.
- שטוף את השקופיות ב1x PBS למשך 5 דקות בRT.
- תקן הכנת כרומוזום בצנצנת עם 1% פורמלין ב1x PBS הוכן מ10% ניטראליים שנאגר פורמלין למשך 10 דקות בRT.
- שטוף את השקופיות ב1x PBS למשך 5 דקות בRT.
- מייבש שקופיות בסדרה של 70%, 80%, ו 100% אתנול למשך 5 דקות בכל RT, והכנות אוויר יבשות על 37 ° C. אם מבצע FISH עם IGS, להמשיך ישירות לשלב 4.12
- שקופיות לפגל בצנצנת עם פוראמיד 70% prewarmed עבור 2 דקות ב 72 ° C.
- מייבש שקופיות בסדרה של קר (-20 מעלות צלזיוס) 70%, 80%, ו 100% אתנול למשך 5 דקות כל אחד, ואוויר יבש ב 37 ° C.
- הכן תערובת הכלאה: 5. Μl בדיקה של DNA שכותרת מהשלב 3, 10 μl של DNA C 0 t מ שלב 2 עם ריכוז סופי של 0.5 μl ng / μl, ו 5 של מיקרוגרם 1 / DNA הזרע μl sonicated סלמון לדגים עם IGS rDNA, להכיןתערובת הכלאה בלי 0 שברי DNA t C.
- דנ"א משקע על ידי הוספת נפח 0.1 יצטט M 3 נתרן ו2 כרכים של אתנול. שמור ב -20 ° C ל1-3 שעות.
- צנטריפוגה בסל"ד 14000 ב 4 מעלות צלזיוס למשך 20 דקות, הסר את אתנול, ואוויר יבש בגלולת RT.
- יסודיות לפזר את הגלולה ב10 μl של חיץ הכלאה: 50%. פוראמיד, 20% סולפט dextran, 2x SSC אם ביצוע דגים עם IGS, להמשיך ישירות לשלב 4.18
- תערובת הכלאה לפגל ל7 דקות ב97 מעלות צלזיוס, ומייד לשים על קרח לדקה 1.
- Prehybridize תערובת על 37 מעלות צלזיוס למשך 30 דקות, כדי למנוע הכלאה נוקבת של DNA החוזר לכרומוזומים.
- הנח 10 μl של תערובת ההכלאה בשקופית, ומכסים בתלוש כיסוי 22x22. למנוע היווצרות בועות - בועות אוויר יש להסיר עם לחץ קל לביצוע coverslip אם דגים עם DNA השיבוט BAC, להמשיך ישירות לשלב 4.20 <./ Em>
- לפגל בדיקת דנ"א וכרומוזום בו זמנית באמצעות בלוק חימום ב 75 מעלות צלזיוס למשך 5 דקות.
- תלוש כיסוי דבק סביב היקף שימוש בבטון גומי.
- בצע הכלאה בין הלילה בתא לח ב 37 ° C.
- הסר מלט גומי וcoverslip מהשקופית.
- 2 דקות לשטוף שקופית בפתרון prewarmed 1 (0.4x SSC, 0.3% Nonidet-P40) בשעת 73 ° C.
- שטוף את השקופיות בפתרון 2 (2x SSC, 0.1% Nonidet-P40) למשך 5 דקות בRT.
- Counterstain שקופית באמצעות 0.001 מ"מ YOYO-1 ב1x PBS עבור 10 דקות בתא לח בRT.
- הר בכמות קטנה של מגיב להאריך antifade זהב עם פתק כיסוי.
- נתח את ההכנות תחת מיקרוסקופ פלואורסצנטי באמצעות קובע מסנן מתאים בהגדלת 1000 x (איור 4).
5. נציג תוצאות
מזהי חרקים נמצאים בכל קטע של הזחל. בהתאם למיקום, הey להפוך לרקמות שונות בשלב הבוגר של החרק. המזהים, המשמשים להכנת כרומוזום בפרוטוקול זה, להתפתח לרגליים בשלב הבוגר של היתוש. תעודות אלה ממוקמים בצד הגחוני של בית החזה והזחל הן בבירור מבעד לציפורן מתחת למיקרוסקופ (איור 1). בתחילת שלב ה 4 instar זחל, מזהים יש צורה עגולה (איור 1 א). המספרים הגדולים ביותר של מיטוזה, ~ 175 באחד 9 זהות, נצברים בשלב מאוחר יותר "סגלגל בצורה" (האיור 1B), שיש לקחת בחשבון את השלב האופטימלי להכנת שקופית. בשלב זה, מזהה ביניים מתפצל לשתיים: 1 הופך לרגל ועוד אחד הופך לכנף. אנחנו מעדיפים להשתמש במזהי הרגל הגדולים בשלב "הסגלגל" לשקופית הכנת כרומוזום. התרשים 1C מייצג מזהים בשלב האחרון של פיתוח 4 זחל instar ה. בשלב זה,מזהים כבר התפתחו לרגליים וכנפיים, ומכילים כמות משמעותית של רקמות בדיל ומספר נמוך של מיטוזה. שלב זה של התפתחות זהות יש להימנע לשקופית הכנת כרומוזום. אנו ממליצים גם זחלי יתושי גידול בטמפרטורות נמוכות: 16. מעלות צלזיוס במשך Aedes וCulex ו 22 מעלות צלזיוס במשך אנופלס זה עוזר להגדיל את כמות מיטוזה במזהים 9.
איור 2 מדגים נתיחת זיהוי מבית החזה של 4 זחל instar ה. בגלל הציפורן של חרק חי קשה לנתח, מומלץ להשתמש במספריים מבתרים במקום את המחטים נפוצות להכנת זחל. ההליך החיוני ביותר להשגת הכנת כרומוזום באיכות גבוהה הוא טיפול הפתרון hypotonic. לקבלת תוצאות הטובות ביותר, אנו מסירים את המעיים ושומן בגוף מחזה הזחל לפני טיפול זה. נפיחות של התאים הזהים במהלך הליך זה עוזר להפיץ כרומוזוםזה בשקופית (איור 3 א). האיכות המתאימה לטיפול פתרון hypotonic ניתן לזהות בקלות על ידי צורתו העגולה של תאים בהכנות (איור 3 א ', ב'). תאים עם צורת אליפסה מעידים טיפול פתרון hypotonic מספיק (האיור 3C). כדי להיבחר לדגים, הכנת כרומוזום צריכה להכיל לפחות 50 מרווחי כרומוזום באיכות גבוהה. בדרך כלל, ~ 90% מהשקופיות שהוכנו באמצעות פרוטוקול זה יש איכות מספיקה לדגים 9.
אנו מציגים שני פרוטוקולי דגים שונים במקצת: פרוטוקול מתקדם לדגים באמצעות בדיקת DNA גנומי BAC שיבוט על כרומוזומים mitotic של Aedes וCulex ופרוטוקול דגים פשוט לIGS rDNA חללית על כרומוזומים mitotic של אנופלס. הגנומים של Aedes וCulex הם חוזרים על עצמו מאוד בגלל ייצוג היתר של אלמנטי transposable 7,8. לפיכך, ביצוע דגים, ut שilizes DNA השיבוט BAC הגנומי כמו בדיקה, דורש הוספת שברי DNA חוזרים ללא תווית לחללית כדי לחסום הכלאה נוקבת של DNA חוזר לכרומוזומים. להפקה את שברי DNA החוזרים, הדנ"א הגנומי הוא מפוגל ב 120 מעלות צלזיוס למשך 2 דקות. דנ"א רותח בטמפרטורה גבוהה גם עוזר להשיג DNA בברי 200-500 נקודתי בסיס. דנ"א מותר לשייך מחדש לאחר טיפול זה. שברי DNA החוזרים מאוד נוטים למצוא את בת הזוג שלהם לאיחוד מחדש מהר יותר מאשר ה-DNA ברצפים ייחודיים עושה. כתוצאה מכך, האיחוד מחדש של ה-DNA כדלקמן C 0 x עקומת t כאשר C 0 הוא הריכוז הראשוני של גדילי דנ"א יחיד, ולא בפעם reannealing. שברי DNA עם 0 C ערכים שווים ל10-4 T - 10-1 או 100-102 נחשבים מאוד מתון וחוזרים על עצמו, בהתאמה. הזמן של האיחוד מחדש לשברי DNA 0 t C שונים ניתן לחשב באמצעות הדואר הנוסחא t = C 0 t-X × 4.98 / 0 C, שבו לא - הזמן של דגירה, C 0 t X - C 0 שבריר t (1 C0t = 1, C 0 t 2 = 2, וכו ') ו-C 0 - הריכוז ראשוני DNA במיקרוגרם / μl 15 (טבלה 1). לאחר איחוד מחדש, גדילי דנ"א יחיד מתעכל באמצעות S1 nuclease. אנחנו מעדיפים ובזבזנו את כל שברי DNA 0 t C ל-C 0 3 t יחד במקום שבריר הנפוץ C 0 t 1-DNA. C 0 שברי t אלה כוללים כמה מרצפי DNA מתון החוזרים ויחד מייצגים לרוב 35-50% מהסכום המקורי של הדנ"א הגנומי AE. aegypti. הפרופורציה הנכונה בין הבדיקה DNA שכותרת והשבריר ללא תווית C 0 t-DNA תלויה ברכיב ה-DNA בכל אחד חוזר על עצמו כפיל BAC מסוים. בממוצע, אנחנו משתמשים 1:20 לבדיקת C 0 tשיעור שבריר של DNA לצורך השיג אותות מקובלים / יחס רקע תוצאת הדגים. Prehybridization של הבדיקה DNA עם 0 שברי C t-DNA בצינור למשך 30 דקות לפני ההכלאה בפועל בשקופית גם עוזר להפחית רקע. תיוג, הכלאה עצמו, והשטיפה בפרוטוקול זה מבוצעים באמצעות תנאים סטנדרטיים 12.
תוצאות הדגים של שתי בדיקות שכותרתו שונה BAC שיבוט DNA על כרומוזום mitotic של AE. aegypti וCx. quinquefasciatus הם מוצגים באיורי 4 א 'וב', בהתאמה. בדיקות DNA שיבוט BAC לייצר אותות חזקים בעמדה אחת בכרומוזומים. הכרומוזומים שמוצגים באיור 1 הם counterstained עם יודיד YOYO-1. צבע זה מייצר את הדפוסים התקבצו מיטב על AE. הכרומוזומים aegypti 9. לחלופין, צבעי ניאון אחרים, כגון DAPI או יודיד propidium, יכולים להיות מנוצלים עבור ההדואר counterstaining כרומוזום. לphotobleaching דיכוי של השקופיות, אנו משתמשים להאריך בינוניים גוברים antifade זהב. ריאגנט הזה יש יכולות שימור אות טובות וגם ניתן להסיר בקלות מהשקופית על ידי השטיפה ב1x PBS אם יש צורך להשתמש באותה השקופית במשך כמה הכלאות.
גרסה פשוטה של פרוטוקול הדגים מיועדת להכלאה של IGS rDNA חללית על כרומוזומים mitotic של אנופלס. גני ריבוזומלי באנופלס מיוצגים כמקבץ רב צורות של גנים הממוקמים על כרומוזומי מין 16. בדיקת DNA בפרוטוקול זה מסומן באמצעות תגובת PCR סטנדרטית על ידי הוספה או Cy3 Cy5 dNTPs כותרתו fluorescently. בגלל חסימת הכלאה נוקבת של DNA החוזר בeuchromatin אינו נחוץ, כל הפעולות הקשורות לשימוש ב0 שברי DNA t C הושמטו. במקום זאת, הם הכנות כרומוזום pretreated עם RNase למניעת הכלאה של IGS rDNA החללית כדילגרעין. כרומוזומים ובדיקת DNA הם מפוגלים בו זמנית על ידי חימום השקופית יחד עם בדיקה במערכת הכלאה ב 75 מעלות צלזיוס למשך 5 דקות. הכלאה ושטיפה בפרוטוקול זה גם בוצעו באמצעות תנאים סטנדרטיים לדגים 12. התוצאה של דגים מודגמת באיור 4C: פולימורפיזם של הכלאת IGS rDNA בין שני כרומוזומי X נראה בבירור.
C 0 t 3| ריכוז ה-DNA מיקרוגרם / μl | Reannealing זמן, דקות | |
| C 0 t 2 | 0.1 | 100 |
| 0.3 | 33 | |
| 0.5 | 20 | |
| 0.7 | 14 | |
| 0.9 | 11 | |
| 1 | 10 | |
| 0.1 | 150 | |
| 0.3 | 50 | |
| 0.5 | 30 | |
| 0.7 | 21 | |
| 0.9 | 17 | |
| 1 | 15 |
טבלה 1. ריכוז ה-DNA וזמני reannealing להכנת C 0 T2 ו C 0 שברי T3.
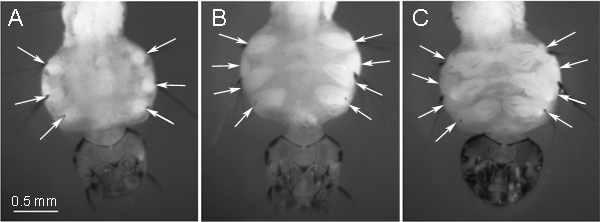
איור 1 שלבים של פיתוח הזהות ב4 זחל instar ה:) מוקדמת "דמות עגולה" במה; ב ') שלב ביניים "סגלגל צורה" - אופטימלי להכנת כרומוזום; ג) בשלב מאוחר - לא ראוי להכנות כרומוזום. . עמדות מזהים מסומנות על ידי חצים בצד הגחוני של בית החזה הזחל.
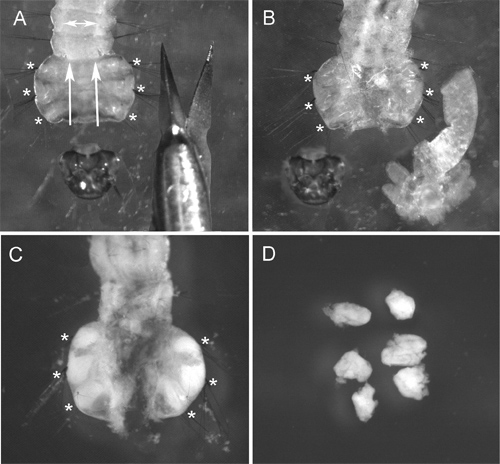
איור 2 צעדים של ביתור ID:) זחל ערוף (לכיוון קיצוצים מסומנים על ידי חיצים); B) זחלים עם בטן גזורה תחת טיפול פתרון hypotonic (מזהים להתנפח ולהפוך לכמעט בלתי נראה); C) זחל לאחר יישום הפתרון של Carnoy (. מזהים הפכו לבנים ונראה בבירור); ד) גזור מזהים בפתרון של Carnoy. עמדות של תעודות בזחל מסומנות באמצעות כוכביות.
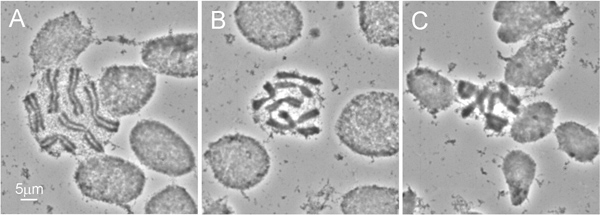
איור 3 איכויות שונות של ממרחים: כרומוזום) התפשטות כרומוזום מושלמת - צורה עגולה של התאים מדגימה טיפול מספק של תעודות הזהות בפתרון hypotonic; B) טיפול hypotonic מושלם - הכרומוזומים הם מעט undersquashed; C) התפשטות כרומוזום עניה. - התוצאה שלטיפול hypotonic מספיק מצוין באמצעות צורה סגלגלה של התאים.
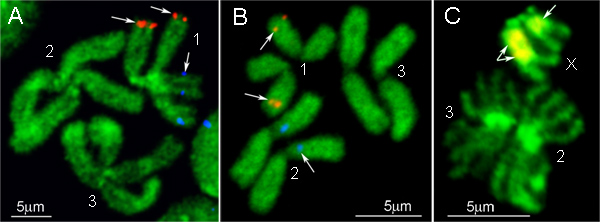
איור 4. דוגמאות לדגים עם שיבוטי BAC (A, B) וrDNA IGS (ג') בכרומוזומים של AE. aegypti (), Cx. quinquefasciatus (ב '), ו. gambiae (C). 1, 2 ו 3 - הם מספרים של כרומוזומים; X - כרומוזום מין נשי ב. gambiae.
Discussion
Nonfluorescent כלאה באתר על כרומוזומים mitotic של יתושים בוצע לראשונה בשנת 1990 על ידי א 'קומאר וק ראי 17. במחקר זה, 18S וגני DNA ריבוזומלי -28, משובט יחד באחד פלסמיד, הונחו לכרומוזומים של 20 מינים של יתושים. בדיקת DNA הייתה שכותרת רדיואקטיבית והכלאת הכרומוזומים מגרעיני המוח. בין שלושה סוגי יתושים, דגי טכניקה פותחה רק לכרומוזומים mitotic משורת התאים של AE. aegypti 10,18,19 ומעולם לא בוצע על כרומוזומים mitotic מיתושים חיים. לאחרונה, פתח טכניקה פשוטה וחזקה לקבלת הכנות כרומוזום באיכות גבוהה מתעודות זהות של 4 זחלים ה instar 9. שיטה זו מאפשרת למספר גבוה של הכרומוזומים שיתקבל בשקופית אחת ויכולה לשמש אוניברסלי עבור כל הזנים של יתושים. הנחיצות של שימוש sta זחל היחיד, לא גלמים או מבוגרGES של יתושים, לשקופית הכנה הוא כנראה המגבלה היחידה של השיטה. השיטה הסטנדרטית דגי 12 הייתה מותאמת לשימוש BAC שיבוט גנטי וrDNA IGS כמו בדיקות לכרומוזומים mitotic של Aedes, Culex, ואנופלס.
בנוסף ליישומים הספציפיים האלה, את פרוטוקולי הדגים המתוארים כאן יכולים לשמש גם למטרות אחרות. הפרוטוקול המתקדם הדגים, אשר מנצל 0 שברי DNA t C לחסימת הכלאה נוקבת, יכול להיות מיושם גם להכלאה של שיבוטי BAC או כל מקטעי דנ"א גדולים אחרים באזורי heterochromatic של אנופלס. אזורי Heterochromatic מועשרים במרכיבי transposable וחוזר אחרים, ובדיקות מהאזורים אלה בדרך כלל לייצר רקע חזק בכרומוזומים 3. שימוש 0 שברים ללא תווית C t DNA יסייע להפחית הכלאה נוקבת של החללית לכרומוזומים. הגרסה הפשוטה של דגי יחסי הציבורotocol יכול לשמש לכל rDNA או בדיקות DNA חוזרים על כרומוזומים mitotic של יתושים וחרקים אחרים. בנוסף, זה יכול להיות מיושם גם להכלאה של DNA השיבוט BAC במינים בעלי תכולת DNA חוזרת נמוכה באזורי euchromatic כגון אנופלס או דרוזופילה. הפרוטוקול המוצע כאן יעזור להשיג מכלולים הגנום כרומוזום מבוססים מאוד מוגמרים, ליתושים ויכול באופן כללי לשמש ליישומי cytogenetic שונים בקבוצות אחרות של חרקים.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
אנו מודים סרגיי Demin וטטיאנה Karamysheva על עזרו בהכנת כרומוזום ודגים על אנופלס. אנו מודים גם לדוד Severson שספקו לנו Aedes ושכפולים גנטיים DNA Culex BAC ומליסה ווייד לעריכת הטקסט. עבודה זו נתמכה על ידי שני מענקים מהמוסד הלאומי לבריאות: 1R21 AI88035-01 למריה V. Sharakhova ו1R21 AI094289-01 לאיגור V. Sharakhov.
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב / הציוד | חברה | מספר קטלוגים | תגובות |
| MZ6 stereomicroscope היקה | ליקה | VA-OM-E194-354 | Stereomicroscope שונה ניתן להשתמש |
| מיקרוסקופ השלב אולימפוס CX41 | אולימפוס | CX41 | מיקרוסקופ פאזה שונה ניתן להשתמש |
| אולימפוס BX61 מיקרוסקופ פלואורסצנטי | אולימפוס | BX61 | מיקרוסקופ פלואורסצנטי שונה ניתן להשתמש |
| Denaturation / כלת מערכת שקופיות ThermoBrite | אבוט מולקולרי | 30-144110 | משמש כבלוק חימום ותא לח |
| מחטים מבתרות | ScienceTools פיין | 10130-10 | |
| מחזיקי מחט | כלי מדע פיין | 26018-17 | |
| מספריים מבתרים | כלי מדע פיין | 15000-03 | |
| 75x25 הכפול חלבי המייקר מחליק | קורנינג | 2949-75x25 | |
| coverslips מיקרוסקופ המ"מ 22x22 | הפישר סיינטיפיק | 12-544-10 | |
| Parafilm | הפישר סיינטיפיק | 13-374-10 | |
| גומי מלט | הפישר סיינטיפיק | 50-949-105 | |
| חומצה אצטית | הפישר סיינטיפיק | A491-212 | |
| 200 הוכחת אלכוהול | מעבדות Decon | 2701 | |
| חומצת Propionic | סיגמא Aldrich | 402907 | |
| חומצת כלור | הפישר סיינטיפיק | A144-500 | |
| dihydrate ציטרט הנתרן | הפישר סיינטיפיק | S279-500 | |
| trihydrate יצטט נתרן | הפישר סיינטיפיק | BP334-500 | |
| אשלגן כלורי | הפישר סיינטיפיק | BP366-500 | |
| EDTA | הפישר סיינטיפיק | S311-500 | |
| טריס בסיס | הפישר סיינטיפיק | BP152-1 | |
| PBS 10x | Invitrogen | P5493 | |
| 10% NBF (ניטראלי שנאגר פורמלין) | סיגמה אולדריץ | HT501128 | |
| 99% פוראמיד | הפישר Scientific | BP227500 | |
| מלח נתרן סולפט dextran | סיגמה אולדריץ | D8906 | |
| 20x SSC חיץ | Invitrogen | AM9765 | |
| 1 פתרון יודיד mM YOYO-1 (491/509) | Invitrogen | Y3601 | |
| Antifade להאריך ריאגנט זהב | Invitrogen | P36930 | |
| dATP, dCTP, dGTP, dTTP | Fermentas | R0141, R0151, R0161, R0171 | |
| Cy3-dUTP, Cy5-dUTP | GE Healthcare | PA53022, PA55022 | |
| BSA | סיגמה אולדריץ | A3294 | |
| פולימראז ה-DNA אני | Fermentas | EP0041 | |
| אני DNase | Fermentas | EN0521 | |
| S1 nuclease | Fermentas | EN0321 | |
| DNA פולימראז תקי | Invitrogen | 18038-042 | |
| RNase | סיגמה אולדריץ | 9001-99-4 | |
| עכלן | USB | 9001-75-6 | |
| דנ"א זרע סלמון | סיגמה אולדריץ | D7656 | |
| Nonidet-P40 (NP40) | ביולוגי בארה"ב | NC9375914 | |
| דם Qiagen וMaxikit תא תרבות | Qiagen | 13362 | |
| ערכת Construct גדולה Qiagen | Qiagen | 12462 |
References
- Sharakhov, I. V., Sharakhova, M. V., Verrity, J. F., Abbington, L. E. . Chromosome Mapping Research Developments. , (2008).
- Holt, R. A., et al. The genome sequence of the malaria mosquito Anopheles gambiae. Science. 298, 129-149 (2002).
- Sharakhova, M. V., et al. Update of the Anopheles gambiae PEST genome assembly. Genome biology. 8, R5 (2007).
- Campos, J., Andrade, C. F., Recco-Pimentel, S. M. A technique for preparing polytene chromosomes from Aedes aegypti (Diptera, Culicinae). Memorias do Instituto Oswaldo Cruz. 98, 387-390 (2003).
- Campos, J., Andrade, C. F., Recco-Pimentel, S. M. Malpighian tubule polytene chromosomes of Culex quinquefasciatus (Diptera, Culicinae). Memorias do Instituto Oswaldo Cruz. 98, 383-386 (2003).
- McAbee, R. D., Christiansen, J. A., Cornel, A. J. A detailed larval salivary gland polytene chromosome photomap for Culex quinquefasciatus (Diptera: Culicidae) from Johannesburg, South Africa. J. Med. Entomol. 44, 229-237 (2007).
- Nene, V., et al. Genome sequence of Aedes aegypti, a major arbovirus vector. Science. 316, 1718-1723 (2007).
- Arensburger, P., et al. Sequencing of Culex quinquefasciatus establishes a platform for mosquito comparative genomics. Science. 330, 86-88 (2010).
- Sharakhova, M. V., et al. Imaginal discs--a new source of chromosomes for genome mapping of the yellow fever mosquito Aedes aegypti. PLoS neglected tropical diseases. 5, e1335 (2011).
- Brown, S. E., et al. Toward a physical map of Aedes aegypti. Insect Mol. Biol. 4, 161-167 (1995).
- Steiniger, G. E., Mukherjee, A. B. Insect chromosome banding: technique for G- and Q-banding pattern in the mosquito Aedes albopictus. Can. J. Genet. Cytol. 17, 241-244 (1975).
- Garimberti, E., Tosi, S., Bridger, J. M., Volpi, E. V. . Fluorescence in situ hybridization (FISH). , (2010).
- Scott, J. A., Brogdon, W. G., Collins, F. H. Identification of single specimens of the Anopheles gambiae complex by the polymerase chain reaction. The American journal of tropical medicine and hygiene. 49, 520-529 (1993).
- Trifonov, V. A., Vorobyeva, N. N., Rens, W., Leiehr, T. . Fluorescence in situ hybridization (FISH). , (2009).
- Collins, F. H., et al. A ribosomal RNA gene probe differentiates member species of the Anopheles gambiae complex. The American journal of tropical medicine and hygiene. 37, 37-41 (1987).
- Kumar, A., Rai, K. S. Chromosomal localization and copy number of 18S+28S ribosomal RNA genes in evolutionary diverse mosquitoes (Diptera, Culicidae). Hereditas. 113, 277-289 (1990).
- Brown, S. E., Knudson, D. L. FISH landmarks for Aedes aegypti chromosomes. Insect Mol. Biol. 6, 197-202 (1997).
- Brown, S. E., Severson, D. W., Smith, L. A., Knudson, D. L. Integration of the Aedes aegypti mosquito genetic linkage and physical maps. Genetics. 157, 1299-1305 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved