Method Article
Floresan
Bu Makalede
Özet
Yani üç sivrisinek cinsler arasında, Anofel, Aedes Ve Culex Fiziksel, genom haritalama teknikleri için sadece kuruldu Anofel, Üyeleri okunabilir politen kromozomlar taşıyan. Bir cins için Aedes Ve Culex Ancak, sitogenetik haritalama çünkü politen kromozomlar kalitesiz zorlu kalır. Burada kaliteli mitotik kromozom preparatları ve sivrisinekler her üç cins için optimize FISH protokolü elde etmek için evrensel bir protokol mevcut.
Özet
In situ hibridizasyon (FISH) Floresan rutin DNA ve RNA problarının kromozomal konumunu belirlemek için birçok laboratuvar tarafından kullanılan bir tekniktir. Bu yöntemin önemli bir uygulaması, çeşitli organizmalarda genom montajlar iyileştirilmesi için yararlı, yüksek kaliteli fiziksel harita geliştirilmesidir. Politen ve mitotik kromozom doğal bantlama modeli genomik supercontigs kesin sipariş ve yönlendirme için rehberlik sağlar. Yani üç sivrisinek cins, Anopheles, Aedes, Culex ve, arasında köklü bir kromozom tabanlı haritalama tekniği yalnızca üyeleri tarafından okunabilir politen kromozomlar 1 sahip Anofel için geliştirilmiştir. Genom haritalama çalışmaları, bir% 88 arasında bir sonucu olarak. gambiae genom hassas kromozom pozisyonları 2,3 konmuştur. Diğer iki sivrisinek cins, Aedes ve Culex, kötü kromozomlar b polytenized oylandıbunların genomlarının 4, 5, 6, transpozonlar önemli overrepresentation arasında ecause. Genomik supercontings Sadece 31 ve% 9 Ae kromozomlar için veya yönlendirme olmadan atanmıştır. aegypti sırasıyla 7 ve Cx. quinquefasciatus 8,. Bu iki tür için mitotik kromozom hazırlama önce beyin ganglia ve hücre hatları ile sınırlı olmuştu. Bununla birlikte, sivrisinek beyin gangliyon hazırlanan kromozom slaytlar genellikle metafaz levha 9 düşük sayıda içerir. Ayrıca, FISH tekniği Ae bir hücre hattından mitotik kromozomlar için geliştirilmiş olmasına rağmen. aegypti 10 hücre hattı kromozom 11'de birden fazla kromozom anomalileri birikimi genom haritalama için onları işe yaramaz hale getirir. Burada 4. evre larvalar hayalsel diskleri (kimlikleri) yüksek kaliteli mitotik kromozom preparatları elde etmek için basit, güçlü bir tekniği tarif hangi cbir sivrisineklerin tüm üç cins için kullanılabilir. Standart BALIK protokol 12 Ae mitotik kromozom üzerinde bir prob olarak genomik DNA BAC klonları kullanmak için optimize edilmiştir. aegypti ve Cx. quinquefasciatus ve An ile ilgili bir prob olarak intergenik boşluk (IGS) ribozomal DNA bölgesi (rDNA) kullanan için. gambiae kromozom. fiziksel harita ek olarak, geliştirilmiş teknik nüfus sitogenetik ve kromozom taksonomisi / sivrisinek ve diğer böcek grupları sistematik için uygulanabilir.
Protokol
1. Kromozom Hazırlık
Sivrisinek larvalarının Sıtma Araştırma ve Referans Reaktifi Kaynak Merkezi'nin web sitesinde bulunan Anofel Araştırma Yöntemleri açıklanan standart bir protokolü kullanarak yetiştirilmiştir (MR4) 13. Sivrisinek yetiştirme sıcaklıkları hayalsel diskler ve larvaların düşük mortalite kromozom sayısının en sağlamak için modifiye edilmiştir. Sivrisinek larvaları gelişim aşamaları kendi başının kapsül 13 boyutlarına göre belirlenmiştir.
- 28. Hatch sivrisinek yumurta ° C arasında ve Ae için 16 ° C'de 2-3 gün için, transfer 2. ya da 3. deri değiştirme safhasında larva sonra. aegypti ve Cx. Bir için quinquefasciatus ile 22 ° C arasındadır. gambiae.
- Immobilizasyon için birkaç dakika buz koyun 4. evre larvalar.
- Soğuk hipotonik çözüm bir damla (0.5% öylesine bir slayt larva transferisodyum sitrat ya da 0.075 M potasyum klorür), ve stereo mikroskop altında yerleştirin.
- İlave diseksiyon için oval kimlikleri (Şekil 1B) ile larva seçin.
- Larva başını kesmek ve diseksiyon makas (Şekil 2A) kullanarak larva toraks ventral tarafında manikür kesti. Larva gelen gut incelemek için ikinci veya üçüncü abdominal segmente ek kesim olun. Kesim yönleri oklarla gösterilmiştir.
- Manikür açın ve larva gelen gut ve vücut yağ çıkarmak. Filtre kağıdı kullanarak slayttan Hipotonik çözelti çıkarın ve doğrudan kimlikleri Hipotonik çözelti (Şekil 2B) taze bir damla ekleyin. Oda sıcaklığında 10 dakika için hipotonik çözelti içinde larva tutun.
- Filtre kağıdı kullanılarak hipotonik çözüm çıkarın ve Carnoy solüsyonu (3:1 oranında etanol / asetik asit) uygulanır. Sabitleştirici çözeltisi ilave edildikten sonra, hemen (Şekil 2C beyaza ve mikroskop altında kolayca görünür hale kimlikleri ).
- Diseksiyon iğne kullanarak, larva (Şekil 2B) dan kimlikleri kaldırın ve% 50 propiyonik asit bir damla aktarabilirsiniz. Slayt gibi gut ve vücut yağ gibi diğer dokuları çıkartın. Bir unsiliconized 22x22 kapak kayma ile kimlikleri örtün ve oda sıcaklığında 10 dakika tutun.
- Filtre kağıdı ile slayt, ve squash kapak kayma çevre üzerinde bir kalem silgi dokunarak doku örtün.
- Kısaca faz-kontrast 100x de mikroskop veya 200x büyütme (Şekil 3) kullanarak slayt kalitesini analiz. > 50 kromozom yayılır Hazırlıklar FISH için uygun kabul edilebilir.
- Bu köpürme durana kadar sıvı azot içinde slayt daldırın ve tutun. Bir jilet kullanarak slayt kapak kayma çıkarın ve -20 ° C'de soğutulmuş% 70 etanol içeren bir kaba hemen slayt aktarmak 4 ° C arasında depolandığında en dehidrasyon sonucu (gerekirse için en az 1 saat süre ile, slaytlar t saklanabilirbirkaç gün ile birkaç dakika arasında onun adım).
- 5 dakika her biri, ve oda sıcaklığında kuru hava için 4 etanol ve bir dizi (% 70,% 80,% 100) ° C 'de slaytlar kurutmak.
- FISH için onları kullanan önce -20 ° C'de kuru slaytlar saklayın.
2. Tekrarlayan DNA kısımlarının çıkarımı
Ae gelen kromozomlar üzerinde BAC klonu DNA prob BALIK gerçekleştirme. aegypti ve Cx. quinquefasciatus kromozomlarına DNA tekrarlarının belirsiz hibridizasyon engellemek için etiketsiz tekrarlayan DNA kesirler kullanarak gerektirir. Birkaç yüz bp'lik parçalar halinde dağıtılır tek sarmallı DNA tekrar birleşme Z 0 tek iplikli DNA'nın ilk konsantrasyon ve t reannealing zaman bir C eğrisi 0 t izler. 10 -4 -10 -1 veya 10 eşit C0t değerleri ° -10 2 DNA kesirler, sırasıyla yüksek ve orta tekrarlı olarak kabul edilir.
- 40 ayıkla0-500 Qiagen Kan ve Hücre Kültürü Maxikit kullanarak tüm erişkin sivrisinek genomik DNA mikrogram ve 100-1.000 ng / 1.2x SSC içinde ul DNA çözüm hazırlayın.
- Bir ısıtma bloğu içine genomik DNA ile güvenli kilit tüp yerleştirerek doğasını DNA ° C 2 dakika süreyle 120 ISITMASIZ. Yüksek sıcaklık 200-500 bp fragmanları DNA aralığı için yardımcı olur.
- DNA konsantrasyonuna bağlı olarak, Z 0 t3 (Tablo 1) C 0 t DNA fraksiyonlar kadar elde etmek için 15-150 dakika süreyle 60 ° C'de tüp yerleştirerek DNA reassociate.
- 2 dakika için buz üzerinde DNA ile yerleştirilir.
- 42 DNA transferi ° C, DNA 1 mg başına 100 U nihai konsantrasyonu önceden ısıtılmış 10x S1 nükleaz tampon ve S1 nükleaz ekleyin ve 1 saat boyunca inkübe edilir.
- 3 M sodyum asetat ve oda sıcaklığında 1 hacim izopropanol, 0.1 hacim ilave edilerek bir çökelti DNA.
- 4 ° C'de 20 dakika boyunca 14,000 rpm'de santrifüje
- % 70 etanol içinde DNA yıkayın ve 10 dakika süreyle 14,000 rpm'de tekrar santrifüj4 ° C'de
- Hava kuru ve TE tampon DNA pelet çözülür.
- DNA konsantrasyonu ölçün ve jel elektroforezi ile görselleştirmek. Ortalama tekrarlayan DNA fraksiyonlarının nihai miktar orijinal DNA miktarının% 35-50 temsil eder.
3. DNA Probe Etiketleme
İki farklı protokolleri etiketleme BAC klon DNA prob ve IGS rDNA prob kullanıldı.
Nick-çeviri kullanarak 3.1 BAC klonu etiketleme
- Qiagen Büyük Construct Kit kullanarak BAC kütüphaneden BAC klon DNA ayıklayın.
- , Cy3-dUTP ve 1 ul (veya başka bir 1 ug BAC klon izole edilmiş DNA, 0.05 mM, etiketlenmemiş dATP, dCTP, dGTP ve dTTP ve her bir 0.015 mM: 50 ul nihai hacim ile buz üzerinde takma çeviri etiketleme için reaksiyon karışımının hazırlanması florokrom), BSA 0.05 mg / ml, 10x nick-çeviri tampon 5 ul, DNA-polimeraz 20 U I ve DNaz ve 0.0012 U.
- 2 için 15 ° C sıcaklıkta inkübe.5 Saat.
- 0.5 M EDTA, 1 ul ilave edilerek reaksiyon durdurun.
- Karanlık bir yerde -20 ° C'de saklayın prob.
PCR kullanarak 3.2 IGS rDNA etiketleme
- ; 0.05 mM, etiketlenmemiş dATP, dCTP, dGTP ve her biri, dTTP 0.015 mM ve Cy3-dUTP (veya başka bir florokrom) ve 1 ul, 5 ul genomik DNA, 200 ng: 50 ul nihai hacim ile buz üzerinde reaksiyon karışımı hazırlayın 10x PCR tampon; ileri 50 pmol; BM (GTGTGCCCCTTCCTCGATGT) ve ters; IGS amplifikasyon için GA (CTGGTTTGGTCGGCACGTTT) primerleri ve Taq DNA polimeraz, 14, 10 U.
- (95 ° C / 30 sn, 50 ° C / 30 sn, 72 ° C / 30 sn) x 30 çevrimleri;; 72 ° C 95 ° C / 5 dk x 1 döngüsü: IGS amplifikasyonu için standart PCR parametreleri kullanılarak PCR reaksiyon gerçekleştirin / 5 dak x 1 döngü ve 4 ° C 14 tutun.
- Karanlık bir yerde -20 ° C'de saklayın prob.
4. In situ Hibridizasyon Floresan
Bu BALIK protokolü iki varyasyonları içerir: Ae mitotik kromozom üzerindeki bir prob olarak BAC klonu DNA kullanılarak ilk. aegypti ve Cx. quinquefasciatus ve An mitotik kromozom üzerinde IGS rDNA kullanmak için ikinci. gambiae. BAC klon DNA probları kullanıyorsanız, atlama RNaz tedavisi 4.3, 4.4 adım ve eşzamanlı slayt / prob denatürasyon adım 4.19. IGS rDNA prob kullanıyorsanız, C 0 t DNA fraksiyonları olmadan hibridizasyon karışımı hazırlamak ve adımlarını 4.10, 4.11, 4.16 ve 4.17 denatüre ayrı slayt / prob atlayın.
- 37 30 dakika için 2x SSC içinde slaytlar inkübe ° C.
- 5 RT dk her, ve kuru hava için% 70 serisi,% 80, ve% 100 etanol içinde slaytlar Kurut. BAC klonu DNA ile FISH yapıyorsanız, 4,5 doğrudan adım ilerleyin.
- 37 ° C 'de 30 dakika süre ile parafilm altında 0.1 mg / ml RNase çözelti içinde kromozom hazırlama inkübe edin.
- 37 5 dakika için, her 2x SSC içinde iki kere yıkayın ° C.
- Slaytlar i koy37% 0.01 pepsin ve% 0.037 HCl çözeltisi ve 5 dakika için inkübe ile na kavanoz ° C.
- RT az 5 dakika 1x PBS slaytlar yıkayınız.
- RT 10 dakika için formalin nötr tamponlu% 10 hazırlanan 1x PBS içinde% 1 formalin ile bir kavanoza kromozom hazırlama düzeltildi.
- RT az 5 dakika 1x PBS slaytlar yıkayınız.
- 37 5 RT dk her, ve hava kuru hazırlıkları için% 70 serisi,% 80, ve% 100 etanol slaytlar Kurut ° C IGS ile FISH yapıyorsanız, 4.12 doğrudan adım devam
- 72 ° C'de 2 dakika önceden ısıtılmış% 70 formamid bir kavanoza doğasını slaytlar
- Soğuk serisi (-20 ° C) 37% 70,% 80, ve 5 dk her, ve kuru hava için% 100 etanol ° C. slaytlar Kurut
- IGS ile balık Adım 3, 1 ug / ml 'sonicated somon sperm DNA 0.5 ng / ul, ve 5 ul nihai konsantrasyon adım 2'deki C 0 t DNA 10 ul dan etiketlenmiş DNA probu 5 ul:. Melezleme karışım hazırlayın rDNA hazırlamak,C 0 t DNA fraksiyonları olmadan hibridizasyon karışımı.
- 3 M sodyum asetat ve 2 hacim etanol, 0.1 hacim ilave edilerek bir çökelti DNA. 1-3 saat boyunca -20 ° C'de saklayın.
- 4 14.000 rpm'de santrifüj 20 dakika için ° C, etanol kaldırmak ve hava kuru oda sıcaklığında pelet.
- İyice hibridizasyon tamponu 10 ul içinde çözülür pelet:.% 50 formamid,% 20 dekstran sülfat, 2x SSC ile IGS FISH icra durumunda, 4.18 doğrudan ilgili adıma
- 7 97 dk ° C, ve hemen için doğasını hibridizasyon Karışım 1 dakika süreyle buz koymak.
- Kromozomlara tekrarlayan DNA spesifik hibridizasyon önlemek için 30 dakika için 37 ° C 'de karışım Prehybridize.
- 10 slaytta hibridizasyon karışımı ul ve 22x22 kapak kayma ile kapak yerleştirin. Kabarcık oluşumunu önleyin - hava kabarcıkları lamel hafif basınç ile çıkarılmalıdır BAC klonu DNA ile FISH yapıyorsanız, 4.20 doğrudan adım devam <./ Em>
- Aynı anda 5 dakika 75 bir ısıtma bloğu ° C kullanarak prob ve kromozom DNA denatüre.
- Kauçuk çimento kullanarak çevresine Tutkal kapak kayma.
- 37 nemli odasında gecede hibridizasyon gerçekleştirin ° C.
- Slayttan kauçuk çimento ve lamel çıkarın.
- 73 ° C'de önceden ısıtılmış Çözüm 1 (0.4x SSC,% 0.3 Nonidet-P40) slayt 2 dakika yıkayın
- RT az 5 dakika boyunca Çözüm 2 (2x SSC,% 0.1 Nonidet-P40) slaytlar yıkayınız.
- Oda sıcaklığında nemli odaya 10 dakika boyunca PBS içerisinde 1 x 0,001 mm YOYO-1 kullanarak slaydın Counterstain.
- Bir kapak slipi ile Altın antifade reaktif uzatmak küçük bir miktar içinde monte edin.
- 1.000 x büyütme (Şekil 4) uygun filtre setlerini kullanarak bir floresan mikroskop altında hazırlıklarını analiz edin.
5. Temsilcisi Sonuçlar
Böcek kimlikleri larva her segmentte yer almaktadır. Konumuna bağlı olarak, inciey böceğin ergin aşamada farklı dokulara dönüşmektedir. Bu protokolde kromozom hazırlama için kullanılan kimlikleri, sivrisinek yetişkin aşamada bacak dönüşebilir. Bu kimlikleri larva toraks ventral tarafında bulunan ve mikroskop altında manikür (Şekil 1) ile açıkça görülebilir vardır. Erken 4. evre larva aşamasında, kimlikleri yuvarlak bir şekil (Şekil 1A) var. Mitoz büyük sayılar, biri ~ 175 Kimliği 9, slayt hazırlanması için en uygun aşamasında dikkate alınması gereken bir sonraki "oval" aşamada (Şekil 1B), birikmiş edilir. Bu durumda, iki ara kimlik ayrılır: bir bacak dönüşür ve başka bir kanat haline dönüştürür. Biz kromozom slayt hazırlama "oval" aşamasında büyük bacak kimliklerini kullanmayı tercih ediyoruz. Şekil 1C 4. evre larva gelişme son aşamada kimlikleri temsil eder. Bu aşamada,Kimlikleri zaten bacaklarını ve kanatlarını dönüşmüş ve farklılaşmış dokuların önemli miktarda ve mitoz sayısının düşük içerirler. Kimlik gelişimi Bu aşama kromozom slayt hazırlanması için kaçınılmalıdır. Biz de düşük sıcaklıklarda yetiştirme sivrisinek larvaları tavsiye:. 16 ° C Aedes ve Culex ve 22 ° C Anofel için bu kimlikleri 9 mitoz miktarını artırmak için yardımcı olur.
Şekil 2 4. evre larva torakstan kimliği diseksiyonu göstermektedir. Canlı bir böcek manikür teşrih etmek zor olduğundan, kesme makası yerine genellikle larva hazırlanmasında kullanılan iğneler kullanmanızı öneririz. Yüksek kaliteli kromozom hazırlama elde etmek için en önemli prosedür Hipotonik çözelti tedavidir. En iyi sonuç için, bu tedaviden önce larva torakstan bağırsak ve vücut yağ çıkarmak. Bu işlem sırasında kimliği hücrelerinin şişmesi kromozom yayılmasına yardımcı olurBir slayt (Şekil 3A) ile ilgili. Hipotonik çözelti tedavinin uygun kalite kolayca hazırlıkları hücrelerin yuvarlak şekil (Şekil 3A, B) tarafından kabul edilebilir. Oval şekilli hücreler yetersiz Hipotonik çözelti tedavisi (Şekil 3C) gösterir. BALIK seçilmesi için, kromozom hazırlama en az 50, yüksek kaliteli kromozom yayılır içermelidir. Normalde, bu protokolü kullanarak hazırlanan slaytlar ~ 90% BALIK 9 için yeterli kaliteye sahip.
Aedes ve Culex mitotik kromozom üzerindeki genomik BAC klonu DNA probu kullanılarak FISH ve Anofel mitotik kromozom üzerinde IGS rDNA prob için basit FISH protokolü için gelişmiş protokol: Biz iki biraz farklı FISH protokolleri sunmak. Aedes ve Culex genomu dolayı transpozonlar 7,8 overrepresentation son derece tekrarlanır. Böylece, performans BALIK, utbir prob olarak genomik BAC klonu DNA ilizes kromozomlarına DNA tekrarlarının belirsiz hibridizasyon engellemek için prob etiketsiz tekrarlayan DNA kesirler ekleyerek gerektirir. Fraksiyonların tekrar eden DNA çıkarma için, genomik DNA, 2 dakika süre ile 120 ° C 'de denatüre edilir. Yüksek bir sıcaklıkta kaynayan DNA ayrıca 200-500 bp fragman olarak DNA elde etmek için yardımcı olur. DNA Bu tedaviden sonra reassociate izin verilir. Oldukça tekrarlayıcı DNA parçalarının hızlı benzersiz dizileri DNA yaptığından daha tekrar birleşme için onların arkadaşı bulmak eğilimindedir. Sonuç olarak, Z 0 tek iplikli DNA'nın ilk konsantrasyonunu DNA tekrar birleşme bir Z 0 x t eğri aşağıdaki, ve t reannealing zamandır. 10-4 eşit C 0 t değerleri ile DNA fraksiyonları - 10-1 veya 100-102 sırasıyla yüksek ve orta tekrarlı olarak kabul edilir. Farklı C 0 t DNA kesirler için tekrar birleşme ve zaman th kullanılarak hesaplanabilirE formülü t = C 0 t X × 4.98 / C 0, nerede t - kuluçka süresi, C 0 t X - C 0 t fraksiyonu (C0t 1 = 1, C 0 t 2 = 2, vb) ve C 0 - ug / ml 'den 15 ilk DNA konsantrasyonu (Tablo 1). Tekrar birleşme sonra, tek damarlı bir DNA S1 nükleaz ile sindirilir. Biz kadar tüm C 0 t DNA kesirler kullanmayı tercih C 0 araya t 3 yerine yaygın olarak kullanılan C 0 t 1 DNA kesir. Bunlar, Z 0 t fraksiyonlar kısmen tekrarlayan DNA dizilerinin bazılarını ve birlikte genellikle Ae var olan genomik DNA orijinal miktarın% 35-50 temsil eder. aegypti. Işaretli DNA probu ve etiketsiz C 0 t DNA fraksiyonu arasında doğru orantılı her bir BAC klonu tekrarlayan DNA bileşeni bağlıdır. Ortalama olarak, C 0 t 1:20 prob kullanınKabul edilebilir sinyaller / FISH sonucu zemin oranı elde etmek için DNA kesir oranı. Slayt üzerinde gerçek hibridizasyon önce 30 dakika boyunca bir tüp C 0 t DNA fraksiyonları ile DNA prob Prehybridization ayrıca arka plan azaltmaya yardımcı olur. Etiketleme, hibridizasyon kendisi, ve bu protokoldeki yıkama standart koşullar 12 kullanılarak yapılmaktadır.
Ae mitotik kromozom üzerinde iki farklı etiketlenebilir BAC klonu DNA probları ve FISH sonuçları. aegypti ve Cx. quinquefasciatus, sırasıyla, Şekil 4A ve B de gösterilmiştir. BAC klonu DNA probları kromozomlar üzerinde tek bir konumda güçlü sinyaller üretir. Şekil 1 'de gösterildiği kromozom YOYO-1 iyodür ile zıt edilir. Bu boya Ae en iyi bantlama kalıpları üretir. aegypti kromozom 9. Alternatif olarak, bu tür DAPI veya propidyum iyodür gibi floresan boyalar, th için kullanılabilire kromozom counterstaining. Slaytların bastırmak photobleaching için, Altın antifade montaj orta Prolong kullanın. Bu reaktif iyi bir sinyal muhafaza özelliğe sahiptir ve aynı zamanda kolayca birkaç hibritleşme için aynı slayt kullanmak için gerekli ise 1 x PBS içinde çalkalama ile kayar çıkarılabilir.
FISH protokolü basit bir versiyonu Anofel mitotik kromozom üzerinde IGS rDNA prob hibridizasyon için tasarlanmıştır. Anopheles içinde ribozomal genlerin cinsiyet kromozom 16 üzerinde yer alan bir gen polimorfik küme olarak temsil edilir. Bu protokol bir DNA prob floresan etiketli Cy3 veya Cy5 dNTP ekleyerek standart PCR reaksiyonu kullanılarak etiketlenir. Ökromatin tekrarlayan DNA spesifik hibridizasyon engelleme gerekli değildir Çünkü, C 0 t DNA fraksiyonları kullanılmasıyla ilgili tüm adımları atlanır. Bunun yerine, kromozom preparatları için IGS rDNA prob hibridizasyon önlemek için RNaz ile tedavi edilirçekirdekçik. Kromozom ve DNA probu 5 dk için 75 ° C sıcaklıkta bir melezleştirme sistem içinde bir sonda ile birlikte kayar ısıtma ile eş zamanlı olarak denatüre edilir. Bu protokolde Hibritleşme ve yıkama da FISH 12 için standart koşullar kullanılarak yapılmaktadır. FISH sonucu Şekil 4C gösterilmiştir: iki X kromozomu arasındaki IGS rDNA melezleme polimorfizmi açıkça görülebilir.
C 0 t 3| DNA konsantrasyonu mg / ul | Zaman Reannealing, dak | |
| C 0 t 2 | 0.1 | 100 |
| 0.3 | 33 | |
| 0.5 | 20 | |
| 0.7 | 14 | |
| 0.9 | 11 | |
| 1 | 10 | |
| 0.1 | 150 | |
| 0.3 | 50 | |
| 0.5 | 30 | |
| 0.7 | 21 | |
| 0.9 | 17 | |
| 1 | 15 |
Tablo 1. DNA yoğunlaşması ve Z 0, T2 ve T3 0 C fraksiyonlarının hazırlanması için reannealing kez.
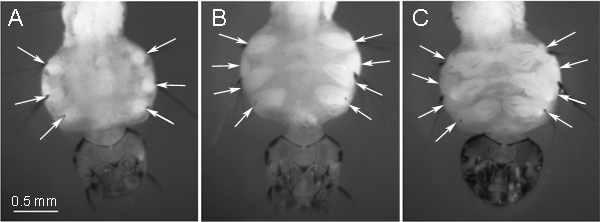
Şekil 1 4. evre larva içinde kimlik gelişimi aşamaları: A) Erken bir "yuvarlak" aşaması; B) bir ara "oval şekil" aşaması - kromozom hazırlama için optimal, C) bir geç evre - kromozom hazırlıkları için uygunsuz. . Kimlikleri pozisyonları larva toraks ventral tarafta oklarla gösterilir.
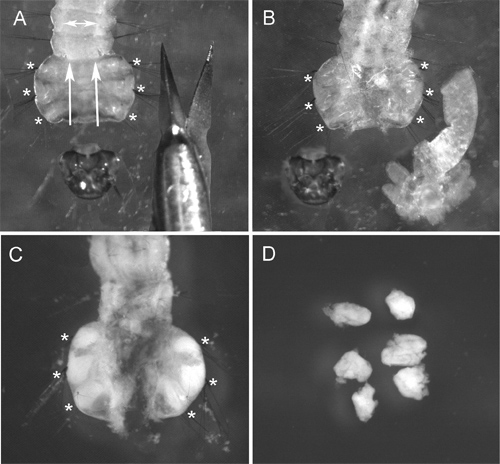
Şekil 2 ID diseksiyon Adımlar: A) Kesik larva (kesim yönü oklarla gösterilir); hipotonik çözüm tedavi altında disseke gut (kimlikleri şişer ve neredeyse görünmez hale) ile B) larvalarının; C) Larva Carnoy solüsyonu uygulamasından sonra (. Kimlikleri) beyaz ve açıkça görünür hale gelir; D) Carnoy solüsyonu içerisinde kimliklerini disseke. Larva içinde kimlikleri pozisyonlar yıldız işareti ile gösterilir.
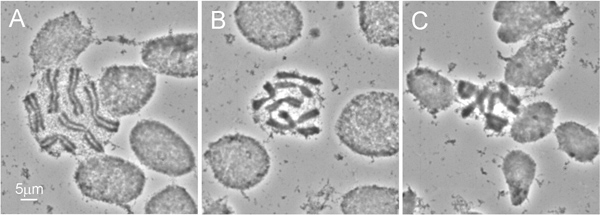
Şekil 3 Kromozom yayılır Farklı özellikleri: A) mükemmel bir kromozomun yaymak - hücrelerin yuvarlak Hipotonik çözelti içinde kimlikleri yeterli tedavi gösterirse; B) mükemmel bir hipotonik tedavi - kromozomları biraz undersquashed vardır; C) fakir bir kromozom yayıldı. - sonucundayetersiz hipotonik tedavi hücrelerin oval şekil ile gösterilir.
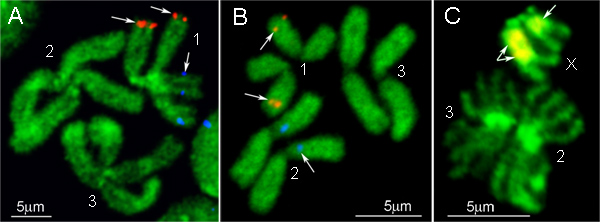
Şekil 4,. BAC klonları, (A, B) ve Ae kromozomlar içinde IGS rDNA (C) ile FISH örnekleri. aegypti (A), Cx. quinquefasciatus (B), ve bir. gambiae (C). 1, 2 ve 3 - kromozom sayıları, X - Bir kadın cinsiyet kromozomu. gambiae.
Tartışmalar
Sivrisinekler mitotik kromozom üzerinde in situ hibridizasyon nonfluorescent A. Kaya ve K. Rai 17 tarafından 1990 yılında ilk kez yapıldı. Bu çalışmada, 18S ve 28S ribozomal DNA genleri, plazmid bir araya klonlanmış sivrisinekler 20 tür kromozom yerleştirildi. DNA prob radyoaktif işaretli ve beyin gangliyonlarından kromozomlarına hibridize edildi. Üç sivrisinek cins arasında, FISH tekniği sadece Ae hücre çizgisi mitotik kromozomlar için geliştirilmiştir. aegypti 10,18,19 ve canlı sivrisinek mitotik kromozom üzerinde hiç yapılmamıştır. Son zamanlarda, biz 4. evre larvalar 9 ID'ler yüksek kaliteli kromozom preparatları elde etmek için basit, güçlü bir teknik geliştirdi. Bu yöntem, kromozom sayısının yüksek bir slayt elde edilmesini sağlar ve evrensel olarak sivrisineklerin tüm türler için de kullanılabilir. Sadece larva, pupa veya ergin olmayan sta kullanmanın gerekliliğiSivrisinekler geçitlerde slayt hazırlanması için muhtemelen yöntemi tek sınırlama. Standart FISH yöntemi 12 Aedes, Culex ve Anofel ve mitotik kromozomlar için sondalar olarak genomik BAC klonu ve IGS rDNA kullanmak için optimize edilmiştir.
Bu özel uygulamaların yanı sıra, burada açıklanan FISH protokoller da başka amaçlar için de kullanılabilir. Spesifik hibridizasyon bloke etmek için Z 0 t DNA fraksiyonlar kullanmaktadır gelişmiş FISH protokol, aynı zamanda BAC klonları veya Anopheles arasında heterokromatik bölgelerde, herhangi bir başka büyük DNA parçalarının hibridizasyon için uygulanabilir. Heterokromatik bölgelerde hareketli elementleri ve diğer tekrarları ile zenginleştirilmiş ve bu bölgelerden probları normal kromozomlar 3 güçlü bir arka plan üretmek. Etiketsiz C 0 t DNA fraksiyonları kullanma kromozomlarına probun spesifik hibridizasyon azaltmaya yardımcı olacaktır. BALIK pr basit sürümüotocol herhangi rDNA veya sivrisinek ve diğer böceklerin mitotik kromozom üzerinde tekrar eden DNA probları için de kullanılabilir. Buna ek olarak, aynı zamanda bu gibi Anopheles veya Drosophila gibi euchromatic bölgelerinde düşük tekrarlayan DNA içeriğine sahip türler BAC klon DNA hibridizasyon için uygulanabilir. Burada teklif edilen protokol sivrisinekler için son derece işlenmiş kromozom-bazlı genomu montajlar elde etmek için yardımcı olacak ve genel olarak diğer böcek gruplar halinde sitogenetik çeşitli uygulamalar için kullanılabilir.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Biz Anofel ilgili kromozom hazırlama ve FISH ile yardım Sergei demineralize ve Tatyana Karamysheva ederim. Biz de metin düzenleme için bize Aedes ve Culex genomik DNA BAC klonları ve Melissa Wade sağlamak için David Severson ederim. 1R21 AI88035-01 Maria V. Sharakhova ve 1R21 AI094289-01 Igor V. Sharakhov: Bu çalışma Ulusal Sağlık Enstitüleri iki hibe ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif / Ekipman Adı | Şirket | Katalog numarası | Yorumlar |
| MZ6 Leica stereomikroskop | Leica | VA-OM-E194-354 | Farklı bir stereomikroskop kullanılabilirler |
| Olympus CX41 fazlı mikroskop | Olimpos | CX41 | Farklı bir faz mikroskop kullanılır |
| Olympus BX61 floresan mikroskop | Olimpos | BX61 | Farklı bir floresan mikroskobu kullanılabilirler |
| ThermoBrite Slayt Denatürasyon / Hibridizasyon Sistemi | Abbott Moleküler | 30-144110 | Bir ısıtma bloğu ve nemli bir oda olarak hizmet vermektedir |
| Diseksiyon iğneleri | Güzel ScienceTools | 10130-10 | |
| İğne tutucular | Güzel Bilim Araçları | 26018-17 | |
| Diseksiyon makas | Güzel Bilim Araçları | 15000-03 | |
| 75x25 çift buzlu mikro slaytlar | Corning | 2949-75x25 | |
| 22x22 mm mikroskop lamelleri | Fisher Scientific | 12-544-10 | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Kauçuk tutkalı | Fisher Scientific | 50-949-105 | |
| Asetik asit | Fisher Scientific | A491-212 | |
| Alkol 200 Proof | Temizlenme Laboratuvarlar | 2701 | |
| Propionik asit | Sigma-Aldrbalık bilimi | 402907 | |
| Hidroklorik asit | Fisher Scientific | A144-500 | |
| Sodyum sitrat dihidrat | Fisher Scientific | S279-500 | |
| Sodyum asetat trihidrat | Fisher Scientific | BP334-500 | |
| Potasyum klorür | Fisher Scientific | BP366-500 | |
| EDTA | Fisher Scientific | S311-500 | |
| Tris baz | Fisher Scientific | BP152-1 | |
| 10x PBS | Invitrogen | P5493 | |
| 10% NBF (nötr tamponlu formalin) | Sigma-Aldrich | HT501128 | |
| % 99 formamid | Fisher Scientific | BP227500 | |
| Dekstran sülfat sodyum tuzu | Sigma-Aldrich | D8906 | |
| 20x SSC tampon | Invitrogen | AM9765 | |
| 1 mM YOYO-1 iyodür (491/509) çözeltisi | Invitrogen | Y3601 | |
| Altın reaktifi Prolong antifade | Invitrogen | P36930 | |
| dATP, dCTP, dGTP, dTTP | Fermentas | R0141, R0151, R0161, R0171 | |
| Cy3-dUTP, Cy5-dUTP | GE Healthcare | PA53022, PA55022 | |
| BSA | Sigma-Aldrich | A3294 | |
| DNA Polimeraz I | Fermentas | EP0041 | |
| DNaz I | Fermentas | EN0521 | |
| S1 Nükleazlar | Fermentas | EN0321 | |
| Taq DNA Polimeraz | Invitrogen | 18038-042 | |
| RNaz | Sigma-Aldrich | 9001-99-4 | |
| Pepsin | USB | 9001-75-6 | |
| Somon sperm DNA'sı | Sigma-Aldrich | D7656 | |
| Nonidet-P40 (NP40) | ABD, Biyolojik | NC9375914 | |
| Qiagen Kan ve Hücre Kültürü Maxikit | Qiagen | 13362 | |
| Qiagen Büyük Construct Takımı | Qiagen | 12462 |
Referanslar
- Sharakhov, I. V., Sharakhova, M. V., Verrity, J. F., Abbington, L. E. . Chromosome Mapping Research Developments. , (2008).
- Holt, R. A., et al. The genome sequence of the malaria mosquito Anopheles gambiae. Science. 298, 129-149 (2002).
- Sharakhova, M. V., et al. Update of the Anopheles gambiae PEST genome assembly. Genome biology. 8, R5 (2007).
- Campos, J., Andrade, C. F., Recco-Pimentel, S. M. A technique for preparing polytene chromosomes from Aedes aegypti (Diptera, Culicinae). Memorias do Instituto Oswaldo Cruz. 98, 387-390 (2003).
- Campos, J., Andrade, C. F., Recco-Pimentel, S. M. Malpighian tubule polytene chromosomes of Culex quinquefasciatus (Diptera, Culicinae). Memorias do Instituto Oswaldo Cruz. 98, 383-386 (2003).
- McAbee, R. D., Christiansen, J. A., Cornel, A. J. A detailed larval salivary gland polytene chromosome photomap for Culex quinquefasciatus (Diptera: Culicidae) from Johannesburg, South Africa. J. Med. Entomol. 44, 229-237 (2007).
- Nene, V., et al. Genome sequence of Aedes aegypti, a major arbovirus vector. Science. 316, 1718-1723 (2007).
- Arensburger, P., et al. Sequencing of Culex quinquefasciatus establishes a platform for mosquito comparative genomics. Science. 330, 86-88 (2010).
- Sharakhova, M. V., et al. Imaginal discs--a new source of chromosomes for genome mapping of the yellow fever mosquito Aedes aegypti. PLoS neglected tropical diseases. 5, e1335 (2011).
- Brown, S. E., et al. Toward a physical map of Aedes aegypti. Insect Mol. Biol. 4, 161-167 (1995).
- Steiniger, G. E., Mukherjee, A. B. Insect chromosome banding: technique for G- and Q-banding pattern in the mosquito Aedes albopictus. Can. J. Genet. Cytol. 17, 241-244 (1975).
- Garimberti, E., Tosi, S., Bridger, J. M., Volpi, E. V. . Fluorescence in situ hybridization (FISH). , (2010).
- Scott, J. A., Brogdon, W. G., Collins, F. H. Identification of single specimens of the Anopheles gambiae complex by the polymerase chain reaction. The American journal of tropical medicine and hygiene. 49, 520-529 (1993).
- Trifonov, V. A., Vorobyeva, N. N., Rens, W., Leiehr, T. . Fluorescence in situ hybridization (FISH). , (2009).
- Collins, F. H., et al. A ribosomal RNA gene probe differentiates member species of the Anopheles gambiae complex. The American journal of tropical medicine and hygiene. 37, 37-41 (1987).
- Kumar, A., Rai, K. S. Chromosomal localization and copy number of 18S+28S ribosomal RNA genes in evolutionary diverse mosquitoes (Diptera, Culicidae). Hereditas. 113, 277-289 (1990).
- Brown, S. E., Knudson, D. L. FISH landmarks for Aedes aegypti chromosomes. Insect Mol. Biol. 6, 197-202 (1997).
- Brown, S. E., Severson, D. W., Smith, L. A., Knudson, D. L. Integration of the Aedes aegypti mosquito genetic linkage and physical maps. Genetics. 157, 1299-1305 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır