Method Article
Флуоресцентный
В этой статье
Резюме
Среди трех комаров родов, а именно: Anopheles, Aedes И Culex, Физические методы картирования генома были созданы только для Anopheles, Члены которого обладают читается политенных хромосом. Для родов Aedes И Culex, Однако, цитогенетические отображение остается сложной из-за низкого качества политенных хромосом. Здесь мы представляем универсальный протокол для получения высококачественных препаратов митотических хромосом и оптимизированный протокол FISH для всех трех родов комаров.
Аннотация
Флуоресцентный в гибридизация (FISH) представляет собой метод обычно используется во многих лабораториях для определения хромосомного положения ДНК-и РНК-зондов. Одним из важных применения этого метода является разработка высококачественных физические карты полезны для улучшения генома сборок для различных организмов. Естественная картина диапазонов политенных и митотических хромосом предоставляет руководство для точного упорядочения и ориентации геномной supercontigs. Среди трех комаров родов, а именно Anopheles, Aedes, Culex и, устоявшихся хромосомы на основе отображения методика была разработана только для Anopheles, члены которой обладают читается политенных хромосомах 1. В результате генома отображение усилия, 88%. gambiae генома была помещена в определенные позиции хромосомы 2,3. Два других родов комаров, Aedes и Culex, были плохо polytenized хромосом бecause значительных чрезмерно мобильных элементов в геноме 4, 5, 6. Только 31 и 9% геномной supercontings были назначены без порядка и ориентации на хромосомах Ae. Aegypti 7 и СХ. quinquefasciatus 8, соответственно. Митоза хромосомы подготовки для этих двух видов ранее были ограничены ганглии мозга и клеточных линий. Тем не менее, хромосомы слайды получены из мозга ганглиев комары обычно содержат низкое количество метафазных пластинок 9. Кроме того, хотя FISH методика была разработана для митотических хромосом из клеточной линии Ae. Aegypti 10, накопление нескольких хромосомных перестроек в линии клеток хромосомы 11 делает их бесполезными для отображения генома. Здесь мы опишем простую, надежную технику для получения высококачественных препаратов митотических хромосом от имагинальных дисков (ID) из 4-го возраста личинки которых сбыть использованы для всех трех родов комаров. Стандартный протокол рыба 12 оптимизирована для использования ВАС-клонов геномной ДНК в качестве зонда на митотических хромосомах Ae. Aegypti и Cx. quinquefasciatus, а также для использования межгенные прокладку (IGS) области рибосомной ДНК (рДНК) в качестве зонда на. gambiae хромосом. Помимо физического картирования, разработанная методика может быть применена к населению цитогенетики и хромосомы таксономии / систематики комаров и других групп насекомых.
протокол
1. Хромосома подготовка
Личинки комаров было выращено с использованием стандартного протокола описаны в методах в Anopheles исследований доступна на сайте Научно-исследовательского малярией и справочники реагентов ресурсный центр (MR4) 13. Температура комаров воспитания были изменены, чтобы обеспечить высокое число хромосом в имагинальных дисков и низкая смертность личинок. Этапы развития личинок комаров были определены на основе размеров головы капсулы 13.
- Hatch комара яйца при температуре 28 ° С, а через 2-3 дня, передача 2-й или 3-го возраста личинки до 16 ° C для Ae. Aegypti и Cx. quinquefasciatus и до 22 ° С. gambiae.
- Место 4-го возраста личинок на льду в течение нескольких минут для иммобилизации.
- Передача личинки на слайд с капелькой холодного гипотонический раствор (0,5%, таксредой цитрат или 0,075 М хлористого калия), и поместить его под стерео микроскоп.
- Выберите личинки с овальной идентификаторов (рис. 1б) для дальнейшего расчленения.
- Обезглавьте личинки, и вырезать кутикулу с брюшной стороны личиночной грудной клетки использованием рассечение ножницами (рис. 2A). Сделать дополнительный разрез на второй или третий сегмент брюшка вскрыть кишечник от личинки. Направления разрезов показаны стрелками.
- Откройте кутикулу и удалите кишечника и жир от личинки. Снимите гипотонический раствор из слайд с использованием фильтровальной бумаги, а также добавить свежую каплю гипотонического раствора непосредственно к идентификаторов (рис. 2В). Хранить личинки в гипотонический раствор в течение 10 мин при комнатной температуре.
- Удалить гипотонического раствора с использованием фильтровальной бумаги, а также применять раствор Карнуа (этанол / уксусная кислота в соотношении 3:1). После добавления фиксирующие решение, IDS сразу становятся белыми и становятся хорошо видны под микроскопом (рис. 2C ).
- Использование рассекает иглы, удалить идентификаторы из личинки (рис. 2D), и передавать их в каплю 50% пропионовой кислоты. Удалите любые другие ткани, такие как кишечник и жира тела, от слайда. Крышка идентификаторы с unsiliconized 22x22 покровным, и держать в течение 10 минут при комнатной температуре.
- Накройте слайд с фильтровальной бумагой, и сквош ткани, нажав на ластик пучка по периметру крышки скольжения.
- Кратко проанализировать качество слайд, используя фазово-контрастного микроскопа 100x или 200x увеличением (рис. 3). Препараты с> 50 спреды хромосомы можно считать подходящим для рыбы.
- Опустите и удерживать слайд в жидком азоте до упора пузырьков. Снимите крышку от скольжения слайд, используя лезвие бритвы, и передать слайды сразу в контейнере из 70% этанола охлажденным до -20 ° C. Хранить при температуре 4 ° С в течение не менее 1 часа за лучший результат дегидратации (при необходимости, слайды можно хранить при тего шаге от нескольких минут до нескольких дней).
- Высушить слайды в серии этанола (70%, 80%, 100%) при 4 ° С в течение 5 мин каждая, и сухой воздух при комнатной температуре.
- Хранить сухую слайды при температуре от -20 ° C до использования их для рыбы.
2. Добыча Повторяющиеся Фракции ДНК
Выполнение FISH ДНК-зонда BAC клона на хромосомы от Ae. Aegypti и Cx. quinquefasciatus требует использования немеченого повторяющихся фракции ДНК, чтобы заблокировать неспецифической гибридизации ДНК повторяется в хромосомах. Реассоциации одной нити ДНК раскололась на куски несколько сотен пар оснований следует C 0 т кривой, где C 0 является начальной концентрации одноцепочечной ДНК и Т reannealing времени. ДНК фракций с C0t значений, равных 10 -4 -10 -1 или 10 ° -10 2 рассматриваются как высоко и умеренно повторяющиеся, соответственно.
- Извлечение 400-500 мкг геномной ДНК из всего взрослого комара использованием Qiagen крови и Maxikit культуре клеток, и подготовить 100-1000 нг / мкл раствора ДНК в 1,2 x SSC.
- Денатурации ДНК путем размещения безопасной блокировки трубки с геномной ДНК в нагревательный блок, предварительно нагретой до 120 ° C в течение 2 мин. Высокая температура позволяет варьировать ДНК в 200-500 б.п. фрагментов.
- В зависимости от концентрации ДНК, реассоциировать ДНК путем размещения трубы при 60 ° С в течение 15-150 мин для получения C 0 фракций ДНК т до C 0 t3 (табл. 1).
- Поместите пробирку с ДНК на льду в течение 2 мин.
- Передача ДНК до 42 ° С, добавить предварительно нагретую 10x S1 нуклеазы буфера и нуклеазы S1 до конечной концентрации 100 ЕД в 1 мг ДНК, и инкубировать в течение 1 часа.
- Осадок ДНК добавлением 0,1 объема 3 М ацетата натрия и 1 объема изопропанола при комнатной температуре.
- Центрифуга при 14000 оборотов в минуту в течение 20 мин при 4 ° C.
- Вымойте ДНК в 70% этаноле, и снова центрифугируют при 14000 оборотов в минуту в течение 10 минпри 4 ° C.
- Воздушно-сухой и растворить осадок ДНК в буфере TE.
- Измерение концентрации ДНК и визуализировать помощью гель-электрофореза. Обычно окончательное количество повторяющихся фракции ДНК представляет 35-50% от первоначальной суммы ДНК.
3. ДНК-зонда маркировки
Два разных протоколов, используемых для маркировки BAC клонов ДНК-зонда и IGS рДНК.
3,1 BAC клона маркировки использовании ник-трансляции
- Извлечение BAC клонов ДНК из библиотеки BAC использованием Qiagen Большой набор Construct.
- Подготовка реакционной смеси для ник-трансляции маркировки на льду с конечным объемом 50 мкл: 1 мкг изолированы BAC клонов ДНК, 0,05 мМ каждого из немеченого дАТФ, дЦТФ, и дГТФ и 0,015 мМ дТТФ; 1 мкл Cy3-дУТФ (или другого флуорохромом); 0,05 мг / мл BSA, 5 мкл 10x ник-перевода буфера, 20 U ДНК-полимеразы I, U и 0,0012 ДНКазы.
- Инкубировать при 15 ° С в течение 20,5 часа.
- Остановить реакцию добавлением 1 мкл 0,5 М ЭДТА.
- Магазин зонда при -20 ° C в темном месте.
3,2 IGS рДНК маркировки с помощью ПЦР
- Подготовка реакционной смеси на льду с окончательным объемом 50 мкл: 200 нг геномной ДНК, 0,05 мМ каждого из немеченого дАТФ, дЦТФ, и дГТФ; 0,015 мм из дТТФ; 1 мкл Cy3-дУТФ (или другой флуорохромом), 5 мкл 10-кратный ПЦР-буфер, 50 пмоль вперед; ООН (GTGTGCCCCTTCCTCGATGT) и наоборот; GA (CTGGTTTGGTCGGCACGTTT) праймеры для амплификации IGS, и 10 из U Taq ДНК-полимеразы 14.
- Выполните ПЦР с использованием стандартных параметров ПЦР для амплификации IGS: 95 ° C / 5 мин х 1 цикл; (95 ° C / 30 сек, 50 ° C / 30 сек, 72 ° C / 30 сек) х 30 циклов 72 ° C / 5 мин х 1 цикл, и 4 ° C удерживать 14.
- Магазин зонда при -20 ° C в темном месте.
4. Флуоресцентный в гибридизация
Эта рыба протокол включает в себя два варианта: первый для использования BAC клона ДНК в качестве зонда на митотических хромосомах Ae. Aegypti и Cx. quinquefasciatus, а второй для использования IGS рДНК на митотических хромосомах. gambiae. При использовании зондов BAC клонов ДНК, РНК показывать лечения шаги 4.3, 4.4, и одновременное слайд / зонд денатурации шагом 4.19. При использовании IGS рДНК, подготовить гибридизации смеси без C 0 фракций т ДНК, и пропустить отдельные слайды / зонд денатурирующих шагом 4.10, 4.11, 4.16, и 4.17.
- Инкубируйте слайды в 2х SSC в течение 30 мин при 37 ° C.
- Высушить слайды в серии из 70%, 80% и 100% этанола в течение 5 мин при комнатной температуре, и воздух сухой. При выполнении рыбы с BAC клонов ДНК, переходите к шагу 4.5.
- Инкубируйте хромосомы препарата в 0,1 мг / мл РНКазы решение при парафильмом в течение 30 мин при 37 ° C.
- Мыть два раза в 2х SSC в течение 5 мин каждый при 37 ° C.
- Положить слайды яНС банка с 0,01% пепсина и соляной кислоты 0,037% раствора и инкубировать 5 мин при 37 ° C.
- Вымойте слайды в 1x PBS в течение 5 мин при комнатной температуре.
- Исправить хромосомы подготовку в банке с 1% формалина в 1x PBS получали из 10% нейтральный буферный формалин в течение 10 мин при комнатной температуре.
- Вымойте слайды в 1x PBS в течение 5 мин при комнатной температуре.
- Высушить слайды в серии из 70%, 80% и 100% этанола в течение 5 мин при комнатной температуре, и воздух сухие препараты при температуре 37 ° C. При выполнении рыбы с IGS, перейдем непосредственно к этапу 4,12
- Денатурировать слайды в банку с предварительно нагретым 70% формамида в течение 2 мин при 72 ° С.
- Высушить слайды в серии холодно (-20 ° C) 70%, 80% и 100% этанолом в течение 5 мин каждая, и сухой воздух при 37 ° C.
- Подготовка гибридизации смеси. 5 мкл меченого зонда ДНК с шага 3, 10 мкл C 0 T ДНК из шага 2 с конечной концентрации 0,5 нг / мкл и 5 мкл 1 мкг / мкл ультразвуком ДНК спермы лосося для рыбы с IGS рДНК, готовитьгибридизации смеси без C 0 фракций т ДНК.
- Осадок ДНК добавлением 0,1 объема 3 М ацетата натрия и 2 объемов этанола. Хранить при -20 ° C в течение 1-3 часов.
- Центрифуга при 14000 оборотов в минуту при 4 ° С в течение 20 мин, удалить этанол, и воздух сухой осадок при комнатной температуре.
- Тщательно растворить осадок в 10 мкл буфера гибридизации. 50% формамида, 20% сульфата декстрана, 2x SSC При выполнении рыбы с IGS, перейдем непосредственно к этапу 4,18
- Денатурировать смеси гибридизации в течение 7 мин при 97 ° C, и сразу же положить на льду в течение 1 мин.
- Prehybridize смеси при 37 ° С в течение 30 мин для предотвращения неспецифической гибридизации повторяющихся ДНК хромосом.
- Поместите 10 мкл гибридизации смеси на слайде, и крышка с крышкой 22x22 скольжения. Предотвращение образования пузырьков - пузырьки воздуха должны быть удалены с легким нажимом на покровное При выполнении FISH с ДНК BAC клона, перейдем непосредственно к этапу 4,20 <./ EM>
- Денатурировать зонда и хромосомной ДНК одновременно, используя нагревательный блок при 75 ° С в течение 5 мин.
- Клей покровного стекла по всему периметру использованием резинового клея.
- Выполнять в течение ночи гибридизации во влажной камере при температуре 37 ° C.
- Удалите резиновый клей и покровного из слайда.
- Вымойте слайд 2 мин в предварительно нагретой раствор 1 (0.4x SSC, 0,3% Nonidet-P40) при 73 ° C.
- Вымойте слайды в решение 2 (2x SSC, 0,1% Nonidet-P40) в течение 5 минут при комнатной температуре.
- Контрастирующая слайд, используя 0,001 мм YOYO-1 в 1x PBS в течение 10 минут во влажной камере при комнатной температуре.
- Установите в небольшом количестве продлить реагента Золотой antifade с крышкой скольжения.
- Анализ препаратов под флуоресцентным микроскопом, используя соответствующие наборы фильтров при 1000-кратном увеличении (рис. 4).
5. Представитель Результаты
Насекомое идентификаторы находятся в каждом сегменте личинки. В зависимости от положения, тыс.еу превращаться в различных тканях у взрослой стадии насекомых. Идентификаторы, которые используются для подготовки хромосомы в этом протоколе, развиваются в ногах у взрослой стадии комара. Эти идентификаторы расположены на брюшной стороне личиночной грудной клетки и четко видны через кутикулу под микроскопом (рис. 1). В начале 4-й этап личиночного возраста, идентификаторы имеют округлую форму (рис. 1А). Наибольшее число митозов, ~ 175 в одном ID 9, накапливаются на более позднее "овальные" стадии (рис. 1б), которые должны быть рассмотрены оптимальные этап для подготовки слайд. В это время промежуточной ID распадается на две: одна переходит в ногу, а другая превращается в крыло. Мы предпочитаем использовать большой идентификаторы ногой в "овальные" этап для подготовки слайд хромосомы. Рис. 1С представляет идентификаторов на последнем этапе 4-го развития взрослой личинки. На данном этапе,Идентификаторы уже превратилась в ноги и крылья, и содержат значительное количество дифференцированных тканей и низкое число митозов. Этот этап ID развития следует избегать хромосомы подготовке слайдов. Мы также рекомендуем выращивания личинок комаров при низких температурах. 16 ° C для Aedes и Culex и 22 ° C для Anopheles Это помогает увеличить количество митозов в идентификаторами 9.
На рисунке 2 показан ID рассечение от грудной клетки из 4-го возраста личинки. Потому что кутикула живых насекомых трудно анализировать, мы рекомендуем использовать рассечение ножницами вместо иглы, обычно используемые для подготовки личинки. Наиболее важные процедуры получения высококачественного хромосомы подготовки является гипотонической обработки раствором. Для достижения наилучших результатов, мы удаляем кишечника и жир от личиночной грудной клетки до этого лечения. Отек ID клетки во время этой процедуры помогает распространять хромосомыа на слайде (рис. 3А). Надлежащее качество лечения гипотонического раствора можно легко узнать по круглой формы клеток в препаратах (рис. 3а, б). Клетки с овальной формой указывают на недостаточную гипотонического раствора для обработки (рис. 3). Чтобы быть выбраны для рыбы, хромосомы подготовка должна содержать по меньшей мере 50 высококачественных спредов хромосомы. Как правило, ~ 90% из слайдов подготовлены с использованием этого протокола есть достаточное качество для рыб 9.
Мы представляем два немного разных рыб протоколов: расширенный протокол для рыбы с помощью геномных BAC клонов ДНК-зонда на митотических хромосомах Aedes и Culex и простой протокол рыбы IGS рДНК на митотических хромосомах Anopheles. Генома Aedes и Culex очень повторяющиеся из-за чрезмерной мобильных элементов 7,8. Таким образом, выполнение рыбы, которая утilizes геномного клона BAC ДНК в качестве зонда, требует добавления немеченого повторяющихся фракции ДНК зонд, чтобы заблокировать неспецифической гибридизации ДНК повторов на хромосомах. Для извлечения повторяющихся фракции ДНК, геномной ДНК денатурируют при 120 ° С в течение 2 мин. Кипение ДНК при высокой температуре также помогает получить ДНК фрагментов 200-500 бп. ДНК позволил реассоциировать после этого лечения. Часто повторяющихся фрагментов ДНК, как правило, найти свою пару на реассоциации быстрее, чем ДНК с уникальной последовательности делает. В результате, реассоциации ДНК следующим C 0 х т кривой, где C 0 является начальной концентрации одноцепочечной ДНК, а Т reannealing времени. ДНК фракций с C 0 значение т равно 10-4 - 10-1 или 100-102 считаются высоко и умеренно повторяющиеся, соответственно. Время реассоциации для разных фракций C 0 T ДНК может быть рассчитана с использованием йэлектронной формуле T = C 0 T X × 4,98 / C 0, где Т - время инкубации, C 0 T X - C 0 T фракции (C0t 1 = 1, C 0 T 2 = 2 и т.д.) и C 0 - Начальная концентрация ДНК в мкг / мкл 15 (табл. 1). После реассоциации, одноцепочечной ДНК переваривается использованием S1 нуклеазы. Мы предпочитаем использовать все фракции C 0 T ДНК до C 0 T 3 вместе, а обычно используется C 0 T 1 ДНК фракции. Эти C 0 T фракции включают некоторые из умеренно повторяющихся последовательностей ДНК и вместе как правило, представляют 35-50% от первоначальной суммы геномной ДНК в Ae. Aegypti. Правильное соотношение между меченым зондом ДНК и немеченого C 0 T ДНК фракции зависит от повторяющихся компонентов ДНК в каждой конкретной клон BAC. В среднем, мы используем 1:20 зонд C 0 тДНК фракции пропорции для получения приемлемого сигналов / фон рыбы результат. Предварительной гибридизации ДНК-зонда с C 0 T ДНК фракций в трубке в течение 30 мин до фактического гибридизации на слайде также помогает уменьшить фон. Маркировка, гибридизация себя, и мытье в этом протоколе выполняются с использованием стандартных условиях 12.
FISH результаты двух по-разному помечены BAC клонов ДНК-зонды на митотических хромосомах Ae. Aegypti и Cx. quinquefasciatus показаны на рисунках 4а и B, соответственно. BAC зондов ДНК клона производят сильные сигналы в одном положении на хромосомах. Хромосомы показано на рисунке 1, контрастно с YOYO-1 йодид. Этот краситель производит лучшие полосы узоров на Ae. Aegypti хромосомы 9. Кроме того, другие флуоресцентные красители, такие как DAPI или пропидия йодид, могут быть использованы для гоcounterstaining электронной хромосомы. Для подавления фотообесцвечивания из слайдов, мы используем продлить Золотой antifade монтаж среды. Этот реагент имеет хорошую способность сохранения сигнала, а также может быть легко удалена из слайд промывкой 1x PBS, если это необходимо использовать те же слайды в течение нескольких гибридизации.
Простой вариант FISH протокол предназначен для гибридизации IGS рДНК на митотических хромосомах Anopheles. Рибосомных генов в Anopheles представлены в виде полиморфных кластера генов, расположенных на половых хромосомах 16. ДНК-зонда в этом протоколе обозначена с использованием стандартных ПЦР-реакции, добавив флуоресцентно меченые Cy3 или Cy5 дНТФ. Из-за блокирования неспецифической гибридизации ДНК, повторяющиеся в эухроматине не нужно, все шаги, связанные с использованием C 0 фракций т ДНК опущены. Вместо этого, хромосомные препараты предварительно РНКазой для предотвращения гибридизации IGS рДНК вядрышко. Хромосомы и ДНК-зонда денатурировали одновременно при нагревании слайд вместе с зондом в системе гибридизации при 75 ° С в течение 5 мин. Гибридизации и промывки в этом протоколе также выполняются с использованием стандартных условий для рыбы 12. В результате рыба показано на рисунке 4C: полиморфизм гибридизации IGS рДНК между двумя Х-хромосомами четко виден.
C 0 T 3| Концентрация ДНК мкг / мкл | Reannealing время, мин | |
| C 0 T 2 | 0,1 | 100 |
| 0,3 | 33 | |
| 0,5 | 20 | |
| 0,7 | 14 | |
| 0,9 | 11 | |
| 1 | 10 | |
| 0,1 | 150 | |
| 0,3 | 50 | |
| 0,5 | 30 | |
| 0,7 | 21 | |
| 0,9 | 17 | |
| 1 | 15 |
Таблица 1. Концентрация ДНК и reannealing время для подготовки C 0 t2 и t3 C 0 фракций.
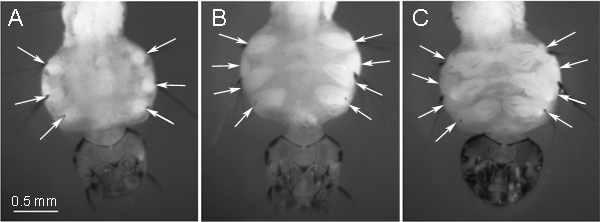
Рисунок 1 Этапы развития ID в 4-й личинки возраста: а) ранние "круглой формы" стадии, B) промежуточный "овальной формы" этап - оптимальный для подготовки хромосомы, С) поздняя стадия - подходит для хромосоме препаратов. . Позиции идентификаторов указано стрелками на брюшной стороне личиночной грудной клетки.
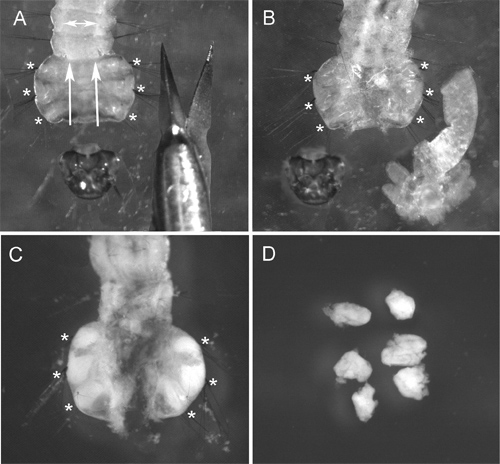
Рисунок 2 Шаги ID рассечения: A) обезглавленное личинки (в направлении сокращения указаны стрелками), б) личинки с расчлененным кишечника при гипотонической обработки раствором (идентификаторы набухают и становятся почти невидимыми); C) личинки после решения приложения Карнуа (. идентификаторы становятся белыми и хорошо видны); D) расчлененный идентификаторов в решении Карнуа. Позиции идентификаторов в личинку обозначены звездочками.
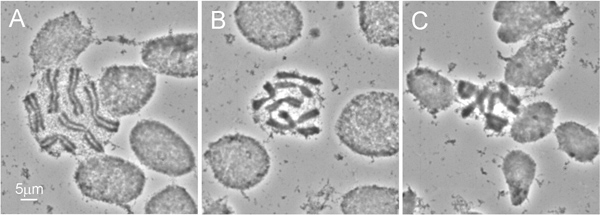
Рисунок 3 различных качеств хромосомы распространяется: а) идеально распространения хромосомы - округлой формы клеток демонстрирует достаточную обработку идентификаторов в гипотонический раствор, B) идеально гипотонической обработки - хромосомы немного undersquashed, С) бедные распространение хромосомы. - результатнедостаточное лечение гипотонических указывается овальной формы клеток.
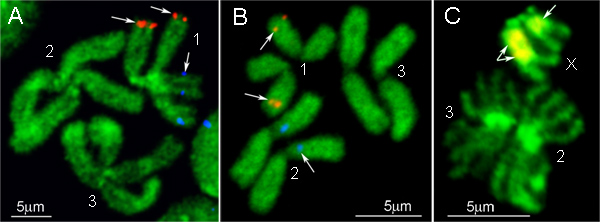
Рисунок 4. Примеры рыбы с ВАС-клонов (A, B) и IGS рДНК (C) в хромосомах Ae. Aegypti (A), Cx. quinquefasciatus (B), и. gambiae (C). 1, 2 и 3 - это число хромосом, X - женская половая хромосома в. gambiae.
Обсуждение
Nonfluorescent в гибридизация на митотических хромосом комаров была выполнена в первый раз в 1990 году А. К. Кумар и Rai 17. В этом исследовании, 18S и 28S рибосомных генов ДНК, клонированных в одной плазмиды, были помещены в хромосомы 20 видов комаров. ДНК-зонда была радиоактивно меченый и гибридизовали с хромосомами из мозга ганглиев. Среди трех родов комаров, рыбы методика была разработана только для митотических хромосом из клеток линии Ae. Aegypti 10,18,19 и никогда не выполняются на митотических хромосом у живых комаров. Недавно мы разработали простую, надежную технику для получения высококачественных препаратов хромосом из идентификаторов 4-го возраста личинки 9. Этот метод позволяет с высокой числа хромосом, которые будут получены в одном слайде и может быть универсально для всех видов комаров. Необходимость использования только в личиночной, а не куколки или взрослой станцииГЭС комаров, для подготовки слайд, пожалуй, единственное ограничение метода. Стандартный метод FISH 12 был оптимизирован для использования геномных BAC клона и IGS рДНК в качестве зондов для митотических хромосомах Aedes, Culex, Anopheles и.
В дополнение к этим конкретным приложениям, рыба протоколов, описанных здесь, могут быть также использованы для других целей. Расширенный протокол FISH, который использует C 0 T ДНК фракций для блокирования неспецифической гибридизации, также может быть применен для гибридизации ВАС-клонов или любых других больших фрагментов ДНК в гетерохроматиновых районах Anopheles. Гетерохроматиновых регионов обогащенного мобильные элементы и другие повторы, и зонды из этих регионов обычно производят сильный фон на хромосомах 3. Использование немеченого C 0 фракций т ДНК будет способствовать снижению неспецифической гибридизации зонда с хромосомами. Простой вариант FISH пр.otocol может быть использован для любого рДНК или повторяющейся ДНК-зонды на митотических хромосом комаров и других насекомых. Кроме того, она также может быть применен для гибридизации ДНК клонов BAC у видов с низким содержанием повторяющихся ДНК в эухроматиновых таких регионах, как Anopheles или дрозофилы. Протокола, предложенного здесь, поможет получить высокую готовой хромосомы на основе генома сборок для комаров и могут быть широко использованы для различных приложений цитогенетического в других группах насекомых.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим Сергей Демин и Татьяна Карамышева за помощь в подготовке хромосомы и рыбы на Anopheles. Мы также благодарим Дэвида Severson за предоставление нам Aedes и Culex геномной ДНК ВАС-клонов и Мелисса Уэйд для редактирования текста. Эта работа была поддержана двумя грантов от Национального института здоровья: 1R21 AI88035-01 Мария В. Sharakhova и 1R21 AI094289-01 Игорь В. Sharakhov.
Материалы
| Name | Company | Catalog Number | Comments |
| Название Реагенты / Оборудование | Компания | Номер в каталоге | Комментарии |
| MZ6 Leica стереомикроскопа | Leica | VA-OM-E194-354 | Различных стереомикроскопа могут быть использованы |
| Olympus CX41 фазового микроскопа | Олимп | CX41 | Различные фазы микроскоп может быть использован |
| Olympus BX61 флуоресцентного микроскопа | Олимп | BX61 | Различных флуоресцентный микроскоп может быть использован |
| ThermoBrite Презентация денатурации / гибридизации системы | Abbott молекулярной | 30-144110 | Служит в качестве блока отопления и влажной камере |
| Пройдя иглы | Изобразительное ScienceTools | 10130-10 | |
| Иглодержатели | Средства изобразительных наук | 26018-17 | |
| Анатомические ножницы | Средства изобразительных наук | 15000-03 | |
| 75x25 двойного матового микро горки | Гранулирование | 2949-75x25 | |
| 22x22 мм покровные микроскопом | Fisher Scientific | 12-544-10 | |
| Parafilm | Fisher Scientific | 13-374-10 | |
| Резиновый цемент | Fisher Scientific | 50-949-105 | |
| Уксусная кислота | Fisher Scientific | A491-212 | |
| Алкоголь 200 Proof | Decon лабораторий | 2701 | |
| Пропионовая кислота | Sigma-Aldrич | 402907 | |
| Соляная кислота | Fisher Scientific | A144-500 | |
| Дигидрат цитрат натрия | Fisher Scientific | S279-500 | |
| Тригидрата ацетата натрия | Fisher Scientific | BP334-500 | |
| Хлористый калий | Fisher Scientific | BP366-500 | |
| EDTA | Fisher Scientific | S311-500 | |
| Tris базы | Fisher Scientific | BP152-1 | |
| 10x PBS | Invitrogen | P5493 | |
| 10% NBF (нейтральный буферный формалин) | Sigma-Aldrich | HT501128 | |
| 99% формамида | Фишер Scientific | BP227500 | |
| Декстран сульфата натрия соль | Sigma-Aldrich | D8906 | |
| 20x SSC буфера | Invitrogen | AM9765 | |
| 1 мМ YOYO-1 йодид (491/509) решением | Invitrogen | Y3601 | |
| Antifade продлить Золотой реагентов | Invitrogen | P36930 | |
| дАТФ, дЦТФ, дГТФ, дТТФ | Fermentas | R0141, R0151, R0161, R0171 | |
| Cy-3-дУТФ, Cy5-дУТФ | GE Healthcare | PA53022, PA55022 | |
| BSA | Sigma-Aldrich | A3294 | |
| ДНК-полимеразы I | Fermentas | EP0041 | |
| ДНКазы I | Fermentas | EN0521 | |
| S1 нуклеазы | Fermentas | EN0321 | |
| Taq ДНК-полимеразы | Invitrogen | 18038-042 | |
| РНКазы | Sigma-Aldrich | 9001-99-4 | |
| Пепсин | USB | 9001-75-6 | |
| ДНК спермы лосося | Sigma-Aldrich | D7656 | |
| Nonidet-P40 (NP40) | США биологическому | NC9375914 | |
| Qiagen крови и Maxikit культуре клеток | Qiagen | 13362 | |
| Qiagen Большой набор Construct | Qiagen | 12462 |
Ссылки
- Sharakhov, I. V., Sharakhova, M. V., Verrity, J. F., Abbington, L. E. . Chromosome Mapping Research Developments. , (2008).
- Holt, R. A., et al. The genome sequence of the malaria mosquito Anopheles gambiae. Science. 298, 129-149 (2002).
- Sharakhova, M. V., et al. Update of the Anopheles gambiae PEST genome assembly. Genome biology. 8, R5 (2007).
- Campos, J., Andrade, C. F., Recco-Pimentel, S. M. A technique for preparing polytene chromosomes from Aedes aegypti (Diptera, Culicinae). Memorias do Instituto Oswaldo Cruz. 98, 387-390 (2003).
- Campos, J., Andrade, C. F., Recco-Pimentel, S. M. Malpighian tubule polytene chromosomes of Culex quinquefasciatus (Diptera, Culicinae). Memorias do Instituto Oswaldo Cruz. 98, 383-386 (2003).
- McAbee, R. D., Christiansen, J. A., Cornel, A. J. A detailed larval salivary gland polytene chromosome photomap for Culex quinquefasciatus (Diptera: Culicidae) from Johannesburg, South Africa. J. Med. Entomol. 44, 229-237 (2007).
- Nene, V., et al. Genome sequence of Aedes aegypti, a major arbovirus vector. Science. 316, 1718-1723 (2007).
- Arensburger, P., et al. Sequencing of Culex quinquefasciatus establishes a platform for mosquito comparative genomics. Science. 330, 86-88 (2010).
- Sharakhova, M. V., et al. Imaginal discs--a new source of chromosomes for genome mapping of the yellow fever mosquito Aedes aegypti. PLoS neglected tropical diseases. 5, e1335 (2011).
- Brown, S. E., et al. Toward a physical map of Aedes aegypti. Insect Mol. Biol. 4, 161-167 (1995).
- Steiniger, G. E., Mukherjee, A. B. Insect chromosome banding: technique for G- and Q-banding pattern in the mosquito Aedes albopictus. Can. J. Genet. Cytol. 17, 241-244 (1975).
- Garimberti, E., Tosi, S., Bridger, J. M., Volpi, E. V. . Fluorescence in situ hybridization (FISH). , (2010).
- Scott, J. A., Brogdon, W. G., Collins, F. H. Identification of single specimens of the Anopheles gambiae complex by the polymerase chain reaction. The American journal of tropical medicine and hygiene. 49, 520-529 (1993).
- Trifonov, V. A., Vorobyeva, N. N., Rens, W., Leiehr, T. . Fluorescence in situ hybridization (FISH). , (2009).
- Collins, F. H., et al. A ribosomal RNA gene probe differentiates member species of the Anopheles gambiae complex. The American journal of tropical medicine and hygiene. 37, 37-41 (1987).
- Kumar, A., Rai, K. S. Chromosomal localization and copy number of 18S+28S ribosomal RNA genes in evolutionary diverse mosquitoes (Diptera, Culicidae). Hereditas. 113, 277-289 (1990).
- Brown, S. E., Knudson, D. L. FISH landmarks for Aedes aegypti chromosomes. Insect Mol. Biol. 6, 197-202 (1997).
- Brown, S. E., Severson, D. W., Smith, L. A., Knudson, D. L. Integration of the Aedes aegypti mosquito genetic linkage and physical maps. Genetics. 157, 1299-1305 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены