Method Article
גרימת פלסטיות של astrocytic רצפטורים על ידי מניפולציה של מחירים ירי עצביים
In This Article
Summary
כאן אנו מתארים עיבוד של פרוטוקולים המשמשים כדי לגרום פלסטיות homeostatic בנוירונים לחקר הפלסטיות של קולטני G-חלבון בשילוב astrocytic. לאחרונה משמש כדי לבחון שינויים בקבוצת astrocytic אני mGluRs בעכברים לנוער, ניתן ליישם השיטה למדידת קנה מידה של GPCRs astrocytic השונות, ברקמות של עכברים בוגרים באתרו וin vivo, ולקבל הערכה טובה יותר של הרגישות של קולטני astrocytic לשינויים בפעילות עצבית.
Abstract
קרוב לשני עשורים של מחקר קבע כי האסטרוציטים באתר וin vivo לבטא קולטנים רבים G-חלבון בשילוב (GPCRs) שיכול להיות מגורה על ידי משדר neuronally שפורסם. עם זאת, היכולת של קולטני astrocytic להפגין גמישות בתגובה לשינויים בפעילות עצבית זכתה לתשומת לב מועטת. כאן אנו מתארים מערכת מודל שיכול לשמש לגלובלי בהיקף של למעלה או למטה קבוצת astrocytic אני metabotropic קולטני גלוטמט (mGluRs) בפרוסות מוח חריפות. הם כללו שיטות על איך להכין פרוסות בהיפוקמפוס parasagittal, לבנות תאים מתאימים לדגירת פרוסה לטווח ארוך, bidirectionally לתפעל תדירות פוטנציאלית, האסטרוציטים עומס פעולה עצבית ותהליכי astrocyte עם Ca 2 + חיווי ניאון, ולמדוד שינויים בפעילות GQ GPCR astrocytic ידי הקלטה astrocyte הספונטני ועורר Ca 2 אירועים + באמצעות מיקרוסקופיה confocal. בעיקרו של דבר, "r סידןoadmap "הוא הניתן לאיך למדוד את הפלסטיות של GPCRs GQ astrocytic. יישומים של הטכניקה ללימוד של האסטרוציטים הם דנו. יש שיש הבנה של אופן שאיתות קולט astrocytic מושפע משינויים בפעילות עצבית השלכות חשובות עבור שניהם הפונקציה הסינפטי הנורמלית, כמו גם הפרעות תהליכים בסיסי נוירולוגיות ומחלות ניווניות.
Introduction
האסטרוציטים להגיב בתוך שניות לגירוי של תאי עצב או אקסונים עצביים עם עליות Ca cytoplasmic 2 + וכתוצאה מכך כמעט אך ורק מהפעלה של GPCRs GQ astrocytic. לדוגמא, קולטני אצטילכולין מוסקריניים 1, 2 קולטנים קנבינואידים, קולטנים 1A α adrenergic 3, 4, והקבוצה שאני mGluRs (ראה להלן) הם כל תת GQ GPCR astrocytic שחריפות להגיב על פעילות עצבית. הפעלה של קבוצת astrocytic אני mGluRs הודגמה נרחבת ביותר, בעקבות הגירוי של afferents glutamatergic העצבית באתרו (כמו פרוסות בהיפוקמפוס חריפות) 5-7, כמו גם בקליפת מוח עכבר המבוגר in vivo בעקבות גירוי חושי 8. התוצאה של הפעלה של astrocytic GQ GPCR איתות על הביולוגיה והפיסיולוגיה של האסטרוציטים, תאי עצב, או אינטראקציות astrocyte נוירון כבר עניין של ויכוח 9-12. זה יהיה שלשת זמן עד שהפונקציה של איתות קולטן תא העצב לastrocyte מוערך באופן מלא.
למרות שזה ברור שנוירונים יכולים להפעיל קולטני astrocytic תוך שימוש בפרוטוקולים ניסיוניים, יש היבטים של תקשורת קולט נוירון לastrocyte שנותר הבינו היטב. ראשית, הסכום בפועל של פעילות עצבית הנדרשת להפעלת astrocytic GQ GPCRs אינו מוגדר היטב, ושנית, היכולת של קולטני astrocytic להפגין גמישות שימוש תלוי זכתה לתשומת לב מועטת. כדי להתחיל לענות על שאלות אלה, לאחרונה פיתחו פרוטוקול כדי לגרום לשינוי קנה מידה דו כיוונית של קבוצת astrocytic אני mGluRs בפרוסות בהיפוקמפוס לנוער חריפה בתגובה לשינויים ארוך טווח בפוטנציאל פעולה עצבי (AP) תלויים פעילות הסינפטית. בדומה למה שכבר גילה לפלסטיות homeostatic דו כיוונית של קולטנים עצביים גלוטמט ionotropic 13, 14, קבוצת astrocytic אני mGluRs בהיקף של עד עבורמצור llowing של פוטנציאל פעולה עצבי ולקצץ כאשר תדירות פוטנציאל פעולה עצבית מוגברת 15. שינויים מפצים אלה בקולטנים astrocytic ניתן למדוד על ידי הקלטה ספונטנית ועוררו astrocyte Ca 2 + ארעיים ולהשוות את המאפיינים של אירועים אלה לאלה מהאסטרוציטים בתנאי בקרה. בכתב היד הזה, אנו מתארים את המתודולוגיה המלאה לשימוש בפרוטוקול זה, ובכלל זה הכנת פרוסות בהיפוקמפוס, תנאי דגירה חריפים כדי לגרום לשינוי קנה מידה של הקולטן astrocyte, טעינת astrocyte Ca 2 + מחוון צבע, Ca 2 + טכניקות הדמיה באמצעות מיקרוסקופיה confocal, והשפעות צפויות על astrocyte פעילות GQ GPCR. השפעות צפויות על astrocyte Ca 2 + מאפייני איתות - שיתאימו לאלו שנרשמו בעבר בתאים בתרבית transfected עם רמות ביטוי שונות של GPCRs GQ - מספקים "מפת דרכים" שיכול לשמש במחקרים עתידיים לassay לשינויים כבביטוי GPCR trocytic. ההשלכות ויישומים אפשריים לשימוש בטכניקה זו יתרמו להבנה של אינטראקציות astrocyte עצבי במוח בריא וחולה שלנו.
Protocol
ההליכים שלהלן אושרו על ידי הוועדה המוסדית טיפול בבעלי חיים ושימוש באוניברסיטת קליפורניה, ריברסייד.
1. בנייה של דגירה קאמרית ומחזיק Slice
- בניית תא הדגירה: לבנות תא הדגירה מחומר כי הוא רעיל. ודא שהתא שולט זרימת אוויר, מחזיק כמות מספקת של ACSF לבעל פרוסה לצוף, והוא גדול מספיק כדי שבעל פרוסה יכול לצוף בקצה אחד של החדר ואילו פיזור הגז מהקווים חמצן מתרחש ב קצה שני. חלק המגירה של מיכל אחסון פיפטה עם מכסה האוויר חזק (איור 1 א) מתאים לקריטריונים אלה יפה.
- לקדוח חור קטן בצד של המכל כ ¼ 1 מלמעלה ו¼ מהצד. להתאים חתיכת הצינור גמיש דרך החור (איור 1). היזהר לקדוח נמוך מספיק כך שהצינורות לא יהיו דחוסים כאשר המכסה סגור, עדיין גבוהים מספיק כך שהוא מעל לפתרון.
- החל סיליקון איטום תפר ("אוטם תפר אקווריום") כדי ליצור חותם אטום למים שבין קו החמצן והקאמרי.
- חבר את הקצה "בחוץ" של הצינור למכל דלק (חמצן 95%, 5% פחמן דו חמצני) באמצעות התאמת Luer גברית. להתאמה אישית, לחתוך ל-להתאים טיפ טבעי משופע 200 μl פיפטה (תרשים 1C).
- חבר את הקצה "בתוך" של צינורות לסעפת פלסטיק שורה אחת עד שש. חותכים להתאמה שישה טיפים פיפטה microloader 20 μl Eppendorf לכל מפרצון סעפת (1D איור). הפתיחה הנאה של microloaders היא אידיאלית להפקת זרם יציב של בועות קטנות.
- כדי לאפשר אוורור, לקדוח שני חורים זעירים על המכסה של המכל (איור 1E).
- בניית h פרוסהישן יותר: בעל פרוסה עשוי מRack צף בועה (איור 1F).
- הסר את "הרגליים" התחתונה של המתלה הבועה, ולחתוך את החלק העליון של כ 1 ¾ פנימה
- להדביק פיסת חומר רשת ניילון לתחתית של המדף העגול באמצעות דבק cyanoacrylate (כגון סטנדרטי בדבק מגע דבק) כדי ליצור בעל שמונה היטב פרוס (איור 1G). כל אחד גם יכול להתאים פרוס בהיפוקמפוס עכבר אחת.
- התאם את בעל פרוסה בקצה אחד של תא הדגירה ומנגנון microloader-סעפת בקצה השני. הרשה הטיפים microloader לנוח על רצפת החדר (איור 1H). הגדרה זו נועדה להבטיח חמצון מספיק לשניהם את החלק העליון והתחתון של פרוסות בהיפוקמפוס חריפות, וכדי למנוע בועות שיוצאות ישירות מתחת לבעל פרוסה כדי למזער תסיסה פרוסה ולמנוע מגע ישיר של בועות עם פרוסות בהיפוקמפוס.
- יש לשטוף את תאי הדגירהמחזיקי פרוסת ד ביסודיות עם DDH 2 O לאחר כל ניסוי, ולטהר עם EtOH 70% שבועיים. במקרה של דוגרים פרוסות בפתרונות שונים, בעלי תאים מרובים / הפרוסה יהיה צורך.
2. פתרונות וסמים
- נוזל המוח ושדרה מלאכותי (ACSF): הכן 4 L של ACSF הסטנדרטי בDDH 2 O באמצעות הפעולות הבאות (במ"מ): 125 NaCl, KCl 2.5, 2.5 CaCl 2, 1.3 MgCl 2, 1.25 אא 2 PO 4, 26.0 NaHCO 3, 15 גלוקוז, ו0.1 Trolox. מדוד את osmolarity של הפתרון באמצעות osmometer; זה צריך לבוא ל~ 310 mOsm. קומפוזיציות ACSF לתנאי ניסוי מתוארות להלן (ראה פרוטוקול 3). לסנן את כל הפתרונות באמצעות מסנן בקבוק העליון 0.22 מיקרומטר לתוך בקבוקי זכוכית autoclaved. פתרונות יציבים ב 4 מעלות צלזיוס עד לחודש.
- חיתוך חיץ: הכן את הפרוסות באמצעות ACSF שונה המכיל (במ"מ): 125 NaCl, KCl 2.5, 3.8 MGCl 2, 1.25 אא 2 PO 4, 26.0 NaHCO 3, 15 גלוקוז, ו1.3 חומצה אסקורבית. מדוד את osmolarity של הפתרון באמצעות osmometer; זה צריך לבוא ל~ 310 mOsm. החלפה של CaCl 2 עם MgCl 2 בחיץ החיתוך משפרת את בריאות פרוסה.
- Sulforhodamine 101 (SR-101, 1 מיקרומטר) משמש לזיהוי האסטרוציטים בפרוסות בהיפוקמפוס חריפה. הפוך מניית 1 מ"מ של SR-101 ידי דילול 60.67 מ"ג SR-101 בשל ACSF סידן נמוך הותאם מוכן כדלקמן (מ"מ) 100 מיליליטר: 125 NaCl, KCl 2.5, 0.5 CaCl 2, 6 MgCl 2, 1.25 אא 2 PO 4, 26.0 NaHCO 3, 15 גלוקוז, ו1.3 חומצה אסקורבית. ודא שosmolarity של ACSF סידן הנמוך הוא ~ 310 mOsm. לדלל את מניות SR-101 1 מ"מ 1,000 פעמים בCa 2 + ACSF הנמוך הותאם לטעינה. אחסן את פתרון SR-101 הסופי ב 4 ° C ומוגנים מפני אור עד צורך לניסוי.
3. מניפולציה של Lאונג טווח ירי עצבי במחירים חריפים בהיפוקמפוס Slices
השתמש באחד משני פרוטוקולי דגירה בניסויים נפרדים לתמרן שיעורי ירי עצביים לטווח ארוך:
- לעכב ירי עצבי: דגירה בtetrodotoxin (TTX, 1 מיקרומטר): זהירות: ידית TTX בזהירות כפי שהוא יכול להיות קטלני אם הם נלקחים בכמויות מספיקות. כפפות ומשקפי מומלצים. TTX מבטל לחלוטין ירי עצבי מונע-AP בפרוסות חריפות. דגירה פרוסות ב3.5 מ"מ K + ACSF, בתוספת TTX 1 מיקרומטר בתנאי הניסוי. במצב השליטה, דגירה פרוסות ב3.5 מ"מ K + ACSF ללא TTX. ההשוואה בין שני התנאים חושפת את ההשפעה של דבר האבני בפעילות GQ GPCR astrocytic. 3.5 מ"מ K + ACSF משמש כתנאי שליטה (בניגוד לומר, 2.5 מ"מ K +) על מנת למקסם את ההשפעה של טיפול TTX.
- או -
- הגדל את הירי עצבי מעלשיעורים בסיסיים: דגירה באשלגן גבוה: ריכוז K + הגדלת תאית depolarizes נוירונים ומגביר את קצב הירי הבסיסי שלהם. דגירה ב5.0 מ"מ K + ACSF מעלה באופן משמעותי את תדירות פוטנציאל פעולה עצבית לעומת 2.5 מ"מ K + 15 ACSF. דגירה פרוס ב5.0 מ"מ K + ACSF לתנאי הניסוי, ולמצב השליטה, דגירה פרוסות בתקן 2.5 מ"מ K + ACSF. ההשוואה בין שני התנאים חושפת את ההשפעה למטה קנה המידה בפעילות GQ GPCR astrocytic.
4. חריף בהיפוקמפוס Slice הכנה
- הקמת חדר ההתאוששות החמה:
- לחמם את אמבט המים עד 35 ° C, ואז למקם את תאי דגירה מוכנות בפנים. מלא את האמבטיה במים במים עד לגובה של ACSF בתוך תאי הדגירה (איור 1G).
- חמצן ACSF הניסיוני ושליטה עם 95% O 2, 5% גO 2. הבועות הנפלטות ממכשירי microloader-סעפת צריכה להיות קטנות ושפע, אלא גם עדינים; לא צריכה להיות כל תנועה נראית של ACSF בתוך התא.
- הגדרת התא לנתיחה קרה כקרח:
- קח שני דליים של קרח. הנח בקבוק של כ 300 מיליליטר חיתוך חיץ לתוך דלי אחד של קרח ולשמור אותו מחומצן עם 95% O 2, 5% CO 2 עבור 20 דקות. לצלול 100 מ"מ צלחת פטרי לתוך דלי קרח האחר, ממש מתחת לפני השטח של קרח. להבטיח את הצד השני של צלחת פטרי הוא במגע ישיר עם הקרח. יוצקים מעט חיץ חיתוך לתוך צלחת פטרי ולשמור אותו מחומצן גם כן.
- צ'יל חוד החנית של סכין הגילוח חד קצה על ידי השריית למאגר החיתוך הקר כקרח בצלחת פטרי לדקות יותר מ 1.
- Vibratome התקנה:
- הפעל את vibratome ולוודא הניקוז סגור.
- אבטח את תא החיתוך ברטטספר עב וקרח חבילה סביב חדר החיתוך. Precool ל0-4 ° C.
- הסר מפעל גריז מסכין גילוח הקצה הכפול על ידי השריית אותו לEtOH 70% למשך 5 דקות ולאחר מכן לשטוף עם DDH 2 O. לחתוך אותו לשני חצאים בזהירות (לא לכופף את הלהב) והר מחצית להב אחד על לחסום את החיתוך.
- הסרת מוח העכבר:
- הרדימי עכבר C57BL/6J שנה עד שנה ויום בת בתא קטן מראש עם 0.5 מיליליטר isoflurane נספג Kimwipe או כדור צמר גפן. בעדינות קמצוץ הבהונות של בעלי החיים על מנת לוודא שאין רפלקס כאב.
- לערוף את העכבר באמצעות מספריים חדים, ולאחר מכן להסיר את הקרקפת בעזרת מלקחיים קטנים. השתמש במספרי עצם קטנים כדי לחתוך את הגולגולת מהמוח הקטן לנורות חוש הריח לאורך סדק אורכי. הסר את דשי גולגולתי באמצעות המלקחיים הקטנים. להסיר בעדינות את המוח עם מרית, ולהטביע אותו לחיץ חיתוך מחומצן קר כקרח בצלחת פטרי.
- Bisect מוח העכבר עם סכין הגילוח הצונן בצלחת פטרי כדי לאפשר יותר שטח פנים לקירור וחמצון. בואו ההמיספרות נחצו לשבת בחיץ החיתוך הקר כקרח ל2-3 דקות. המוח צריך להיות לגמרי מגניב ומוצק יותר.
- למרוח שכבה דקה של דבק cyanoacrylate על הפלטפורמה של vibratome. מדביקים את שני ההמיספרות לקיצוץ פלטפורמת הצד למטה ובצדדים עד לרוחב, עם הנורה חוש הריח פונה קדימה. אבטח את הפלטפורמה בחדר החיתוך, ולאחר מכן למלא את תא החיתוך עם קרח קר, חיץ חיתוך מחומצן היטב.
- המשך חמצון תא החיתוך בעת הכנת 300 מיקרומטר פרוסות עבות parasagittal באמצעות vibratome. חותכים את הפרוסות בתדר של 85 הרץ, מהירות התקדמותה של 0.20 מ"מ / שנייה, והמשרעת של 1.40 מ"מ. הערה: יש לנו מצאתי כי המשתנה החשוב ביותר בהכנת פרוסות בהיפוקמפוס חריפה בריאה הוא איכות vibratome. המעבדה שלנו משתמשת במגנט S היקה VT 1200ic לנהוג vibratome עם vibrocheck להפחתת רעידות "Z".
- לאחר חיתוך, לנתח את ההיפוקמפוס וקליפת מוח entorhinal הסמוכה מכל פרוסה parasagittal באמצעות מלקחיים חדים. לבצע הליך זה ב, חיץ החיתוך מחומצן גם קר כקרח בתא החנית של vibratome. חדות המלקחיים היא חשובות מאוד לבריאות הפרוסה כפי שהוא ממזער את הטיפול בפרוסות.
- הפוך טפטפת העברה על ידי ניתוק קצה פיפטה פסטר זכוכית הארוכה ותוספת החלק השבור עם נורת פיפטה. זה מאפשר שימוש בסוף הגדול של פיפטה להעביר פרוסות. הקפד להזמין טפטפות ללא התוספת הכותנה בסופו של הדבר הגדול (ראה טבלת חומרים). כפרוסות מוכנות בתנאים לא סטרילי, זה לא הכרחי לחיטוי פיפטה לפני השימוש, אם כי טפטפת חדש צריך להיות מוכן ושימש לכל ניסוי.
- העבר כל פרוס בהיפוקמפוס לתאי הדגירה במי C ° 35אמבטיה, על ידי טבילת טפטפת העברה לACSF בתוך כל טוב של בעל פרוסה וaspirating פרוסה. למזער את התנועה של הפרוסה במהלך תהליך זה. העברה ישירה של פרוסות לתוצאות האמבטיה דגירה חמות בפרוסות באיכות טובות יותר מאשר "ramping" הטמפרטורה בהדרגה.
- לאפשר לפרוסות בהיפוקמפוס להתאושש באמבט המים החם עבור סכום כולל של 45 דקות, בחלוקה כדלקמן: דגירה פרוס עבור 20 דקות ב1 מיקרומטר SR-101 מדוללים בACSF סידן נמוך, ולאחר מכן להעבירם לACSF סידן הנמוך (ללא SR-101) עבור 10 דקות. בהמשך לכך, להעביר את הפרוסות לשליטה או ACSF ניסיוני ל15 דקות הנותרות של הדגירה החמה.
- לאחר ההתאוששות החמה 45 דקות, להעביר בזהירות את תאי דגירה מאמבט המים 35 מעלות צלזיוס לספסל העליון, ולאחר מכן לאפשר לפרוסות להמשיך דגירה בטמפרטורת חדר למשך זמן דגירה כולל של 3 שעות לפני תחילת בולוס הטעינה פרוטוקול (ראה להלן).
5. טוען בולוס של האסטרוציטים עם Ca 2 + מחוון
- צבע הכנת Ca 2 + מחוון בולוס טעינה:
- לכל בקבוקון של צבע (50 מיקרוגרם), להוסיף 3.87 μl של sulfoxide הטרי דימתיל (DMSO) ו מערבולת ביסודיות. הרעננות של DMSO היא חשובה לטעינה טובה, ולכן, לפצח האמפולה טרי בכל פעם.
- מערבבים ב9 μl של 20% חומצת pluronic ומערבולת ביסודיות. מערבבים את הצבע עם של ACSF הניסוי או בקרה הנאותה ומערבולת גם 100 μl, לריכוז צבע סופי של 10 מיקרומטר.
- סנן את הפתרון באמצעות צינור מסנן צנטריפוגות. פעולה זו מונעת את פיפטה הטעינה מהסתימה במהלך הפליטה של הצבע.
- הכן את פיפטה מזכוכית נימים ורוסיליקט משכו להתנגדות של כ 1.3 MΩ כאשר התמלאו פתרון צבע.
- מניחים פרוסה בהיפוקמפוס לתוך תא הקלטה מיועד לשימוש עם מיקרוסקופורציפות ינקב עם ACSF מחומצן מאותו הרכב שהודגר ב( 1.5 מיליליטר / דקה). חלופי בין שליטה ותנאי ניסוי בעת בחירה פרוסה בהיפוקמפוס.
- בטל פרוסות בהיפוקמפוס מחפשת לא בריאה. האיכות של פרוסות משתנות אפילו בתוך ניסוי נתון. אין קריטריונים שנקבעו לכימות בריאות פרוסה, ולכן קביעת בריאות פרוסה היא סובייקטיבי ומבוסס בעיקר על ניסיון.
- באופן כללי, לשמור על פרוסות שיש משטח המופיע חלק ואחוז גבוה של תאים פירמידליים CA1 בריאים (איור 2 א). תאים פירמידליים CA1 רגישים במיוחד ופגיעים לעלבונות במערכת העצבים המרכזית, כך שיש אחוז גדול (≥ 75%) של נוירונים פירמידליים CA1 בריאים עשויים להיות קריטריונים שימושיים לקבלה או דחייה של הפרוסה.
- בטל פרוסות שיש נוירונים מתים כ> 25%. יש נוירונים המלח מראה דמוי ביצה מטוגנת (איור 2 ב). הערה: אנו חהיש ציין כי הזווית של לחתוך משחקת תפקיד משמעותי בהחלטה האם נוירונים נראים בריאים או לא. אם דנדריטים עצביים מקרינים כלפי מעלה (מתוך פרוסה), ואז הנוירונים יהיו בעיקר מתים. זה כנראה משום שחלק גדול כל כך של נוירון הנפח כלול בתוך העץ הדנדריטי, שניתוק דנדריטים הוא קטלני לתאים. מצד השני, אם דנדריטים מקרינים במקביל לאו בזווית כלפי מטה מפני השטח פרוס, יהיה אחוז גבוה של תאי עצב בריאים. לפעמים, אם כן, הנוירונים יהיו בעיקר מתים בצד אחד של הפרוסה ובריאה למראה בצד השני.
- אתר שדה מתאים של האסטרוציטים SR 40-70 מיקרומטר מתחת לפני השטח פרוס המבוססים על גודל, מורפולוגיה, ומיקום באמצעות התערבות ההפרש לעומת זאת (DIC) אופטיקה.
- טען את פיפטה הזכוכית עם פתרון צבע ומוריד אותה אל פני השטח של הפרוסה מעל תחום זה באמצעות holde microelectrode תיקון מהדק סטנדרטיr. עם פיפטה על פני השטח של הפרוסה, להחיל בחזרה לחץ פיפטה להתחיל לצבוע ולהוציא. פליטה של צבע תהיה גלויה תחת שתי אופטיקה DIC וליזר מתאים כגון קו 488 לצבע ירוק.
- לאט לאט להוריד את פיפטה כ 40 מיקרומטר מתחת לפני השטח פרוס באמצעות micromanipulator ולאפשר לצבע כדי להוציא לכ 45-60 שניות. לאחר מכן, להוריד את פיפטה 35 מיקרומטר נוסף (75 מיקרומטר מתחת לפני השטח פרוס) ולהוציא את הצבע לכ 45-60 שניות. לאט לאט לחזור קצה פיפטה מהפרוסה. זמן הזרקה קצר יותר עשוי לגרום לטעינת צבע מספיקה, ואילו הזרקה ארוכה יותר נוטה להגדיל טעינת רקע, אשר מקטינה יחס אות לרעש של ההקלטה.
- כדי להבטיח שמספר רב של האסטרוציטים לקחת את צבען, זה בדרך כלל מועיל להזריק בולוס צבע שני במרחק קצר משם. הרם את פיפטה בחזרה אל פני השטח של הפרוסה, לוודא כי פיפטה לא סתומה, ולאחר מכן מויש פיפטה כ 80-100 מיקרומטר הרחק מאתר ההזרקה הראשון, יחד radiatum השכבה. חזור על הפעולה הזרקת בולוס באתר זה.
- לאפשר 30-45 דקות לפני ההדמיה להאסטרוציטים לקחת את צבען ולאות הרקע לאזול. השאר את הפרוסה בתא זלוף בתקופה זו. ודא זמן הדגירה הזה בנוי לטיפול 4 שעות הכוללת של הניסוי. קבל את הפרוסה וחזור על השלבים הבאים 5.2-5.8.
6. Ca ספונטני וGQ GPCR astrocytic עוררו אגוניסט הקלטת 2 + פעילות בהיפוקמפוס Slices
- הגדרת מיקרוסקופ confocal הדמיה:
- הגבלת חשיפת הפרוסה לאור הלייזר היא בעל חשיבות עליונה, כפי שחשיפה גבוהה יכולה להוביל להלבנה לצבוע ו / או phototoxicity. שימוש גבוה יותר הגדלה אופטית או הגדרת זום מוגברת מגדיל את החשיפה לאור לשדה הדמיה. לכן, להגדיר את ערכי ברירת המחדל עבור כל לייזר לsettin מכפיל גבוהגרם, רווח 1x ו0.5% תפוקת לייזר כוח.
- החל זום 1.5x להדמיה טובה יותר של תהליכי astrocyte.
- הגדר את רזולוציית שדה 512 x 512 פיקסלים.
- קבע את מהירות סריקה למהירה ביותר האפשרי, שהוא ~ 1.2 שניות לסריקה באמצעות מצב סריקת דרך אחת.
- איסוף ספקטרום פליטה באמצעות מסנני bandpass של 503-548 ננומטר לליזר 488 ננומטר, ו624-724 ננומטר לליזר 559 ננומטר. הגדרות אלה מאפשרות הדמיה של שדה של ~ 5-8 האסטרוציטים במהירות מהירה יחסית ברזולוציה מספיקה כדי לבחון גופי תא astrocyte ותהליכים עיקריים. באופן אידיאלי, האסטרוציטים בתחום יהיו בהירים מספיק כדי לראות בבירור, אך ללא כל הרוויה פיקסל.
- לאשר את זהותם של תאים נטענים עם Ca 2 + לצבוע כהאסטרוציטים ידי הדמיה colabeling SR-101 באמצעות לייזר 559 ננומטר.
- פעילות הקלטת astrocyte Ca 2 +:
- לצייר תיבות באמצעות תוכנת תמונת רכישה על אזורים של עניין (ROהאם) בתוך התא, במקרה זה על פני גופי תא astrocyte. התיבות לא צריכים לכלול פיקסלים ברקע, כדי להשיג את יחס אות לרעש הטוב ביותר האפשרי. לצייר תיבה אחת על רקע כנקודת התייחסות.
- לעבור זלוף לACSF ניסיוני בתוספת TTX 1 מיקרומטר (Abcam) דרך השארית של הניסוי. זה מבטל כל תגובות עצביות אפשריות מונעות-AP סידן astrocyte. לאחר מכן עליות שנותר בריכוז + astrocytic Ca 2 תהיה בשל לשחרור quantal ועי, פעילות GPCR מכוננת (הבסיסית), או שילוב כלשהו של שני המנגנונים.
- שיא הקרינה לאורך זמן מכל ROIs. כל עלייה בקרינה לאורך קו בסיס מצביעה על עלייה בריכוז + Ca 2 cytoplasmic 16, ולכן פעילות GPCR בהאסטרוציטים 10, 17, 18. כדי להימנע מכל תופעות קנה מידה המוקדמת אפשריות על קולטני astrocytic ידי TTX, ניסויים מלאים בתוך 40 fr דקותאום הזמן שבו זלוף TTX 1 מיקרומטר החל.
- לאחר קבלת 10 דקות של הקלטה הבסיסית של Ca 2 + פעילות ספונטנית, להחיל אגוניסט של עניין (כגון DHPG) בריכוזים ברצף הולך וגדל. השאירו מינימום של 5 דקות בין יישומים כדי להפחית הפחתת רגישות הקולטן אפשרית.
- בסוף ההקלטה, להחיל קוקטייל של אגוניסטים לGPCRs GQ astrocytic אחרים כביקורת חיובית לastrocytic שלם GQ GPCR איתות מסלולים. מרכיבי קוקטייל אגוניסט יהיו תלויים בקולטן של עניין. 10 מיקרומטר של כל אחד מGPCR GQ אגוניסטים היסטמין, carbachol, ו2nA-ATP כדי לעורר קולטני H1 היסטמין [H1R], קולטני אצטילכולין מוסקריניים [mAchR], וקולטנים purinergic, בהתאמה, הוא [P2YR] קוקטייל אגוניסט נפוץ.
- רכישת תמונה לאחר ניסוי:
- בסיומו של Ca 2 + ההקלטה, לקחת עדיין תמונות עם ננומטר 488 ו559 לייזרי ננומטר, ואו אישור מאוחר יותר של זהות astrocyte ומיקום החזר על השקעה. הגדרות צריכת חשמל בלייזר וHV עשויים להשתנות באופן חופשי בשלב זה כדי לקבל תמונה אופטימלית עבור colocalization, כפי שכבר לא קיים חשש לגבי עוצמת אור לייזר המשפיעה על הנתונים (איור 2 א).
- חזור על שלבים 6.1-6.3 עבור סכום כולל של כ -8 פרוסות ו40 האסטרוציטים / קבוצה. פרוסות צריכה לבוא מתוך מינימום של 3 עכברים שונים.
7. ניתוח של פעילות 2 + astrocyte Ca
- הגדרת Ca 2 + גובה: תקינה בהגדרת Ca 2 + ארעיים לא מבוסס היטב בקרב הקהילה המדעית. להלן פרוטוקול טיפוסי שמגדיל את רגישות תוך הגבלת זיהוי של אירועים חיוביים כוזבים מתוך רעש תחילת המחקר.
- האם חבר מעבדה אחר להקצות כל פרוסה קוד מספרי כדי לנתח אותם באופן עיוור. בסיומו של ניתוח, לפענח כל פרוסה.
- לנתח astrocyte הספונטני ועורר Ca 2 + גבהים לא מקוון באמצעות תוכנת ניתוח הדמיה. לצייר מחדש ו / או לשנות את הגודל, הצורה והמיקום של ROIs בהתאם לצורך.
- עליות ציון בעוצמת הקרינה על בסיס כCa 2 + העלאה אם משרעת השיא היא גדולה יותר משתי סטיות תקן (SD) מעל לממוצע של 30 שניות של הקרינה בסיס ממוצעת של לפחות שתי נקודות דגימה ברציפות. בהקלטות רועשות במיוחד (נמוך אות לרעש), קריטריונים זה ייתכן שיצטרכו להיות מותאם ל3 SD מעל הקרינה הממוצעת בנקודת ההתחלה. הגדר את תחילתה של כל אחת 2 + גובה Ca כנקודת נתונים האחרון שלפני את עוצמת הקרינה עולה על סטיית תקן אחת מעל לממוצע.
- להבדיל בין multipeak לעומת אירועים בודד שיא רצופים. ציון אירוע "multipeak" כאשר עוצמת הקרינה אינה חוזרת לנקודת התחלה (להלן SD ערך בסיס הממוצע +2) ל&# 8804; 9 נקודות רצופות נתונים (10.8 שניות) בין פסגות. לפיכך, יהיו לי אירועי שיא יחיד 10 נקודות או יותר נתוני בסיס ברציפות שביניהם.
- לסווג את האירועים כתגובות מסוג "רמה", כאשר עוצמת הקרינה שומרת המשרעת שיא (± 10% משווי שיא) לפחות 3.6 שניות.
- נתח את משרעת, תדירות, וקינטיקה של ארעיים סידן ספונטני ועורר אגוניסט.
- הגדר המשרעת שיא של Ca 2 + הגובה כנקודת נתונים עם ערך העצמה הגבוה ביותר (במקרים של תגובות "multipeak" להשתמש בשיא הראשון, ראה איור 2).
- לחשב את זמן עלייה כהפרש בין תחילת התגובה והזמן המתאים למשרעת השיא. הערה: 0-100% זמן עלייה ייתכן שיהיה צורך בשימוש על מנת שיהיה מספר מספיק של נקודות נתונים כדי לקבל ערך זמן; לסרוק במהירות היא משתנה חשוב כאן.
- חישוב השהיה כזמןבין תחילתו של זלוף אגוניסט לתחילת התגובה. זמן עלייה עשוי להיות אמצעי יעיל יותר בפרוסות מוח, כל עוד לשטוף-בפעמים ליצור לבלבל בחישוב שיהוי בתגובה.
- לקבוע אם יש הבדלים משמעותיים סטטיסטי בין שתי הקבוצות עבור כל פרמטר באמצעות מבחן t העצמאי של הסטודנט. השתמש במספר האסטרוציטים כ'n '. השתמש במבחן החי בריבוע של פירסון להשוות את דפוסי Ca 2 + פעילות בין קבוצות בקרה וטיפול. השתמש במבחן 2 הזנב המדויק של פישר כדי להשוות אחוזי דפוסי Ca 2 + פעילות ספציפיות בין קבוצות בקרה וטיפול. להביע את ההבדלים כ* p <0.05, ** p <0.01, ו*** p <0.001.
תוצאות
נציג תוצאות באיור 3 מראות את ההשפעה של דגירה של פרוסות בהיפוקמפוס העכבר חריפות בTTX ל4-6 שעות על astrocyte SR Ca 2 + פעילות. הנתונים כוללים גם Ca 2 + ארעיים ספונטניות וקבוצה עוררו DHPG אני mGluR Ca 2 + תגובות, מפרוסות מודגרות בACSF שליטה לעומת ACSF תוספת TTX. מלבד תכונות בסיסיות אופייניות מורפולוגיים, הרכבה תהליך stellate וגודל סומה קטנה (~ 10 מיקרומטר), האסטרוציטים מזוהים בSR על ידי כיסוי של AM Ca 2 + המחוון OGB-1 עם סמן astrocyte סלקטיבית SR-101 19, 20 ( איור 3 א). קופסות ממוספרות על גופי תא astrocyte מתאימות לקרינה הממוספרת על עקבות זמן שמוצגים באיור 3. אגוניסט קבוצת 1 mGluR (RS)-3.5 DHPG מוחל כדי לקבוע את השפעות קנה מידה הספציפיות על mGluRs קבוצת 1 בהאסטרוציטים. להפלות בין Physiology בספציפי של השפעת קנה המידה לmGluRs קבוצת 1 לעומת GPCRs GQ אחרת, קוקטייל של אגוניסטים מיושם בסופו של כל ניסוי. כאן אנו משמשים 10 מיקרומטר כל אחת מGPCR GQ אגוניסטים היסטמין, כלוריד carbamylcholine (carbachol) וdisodium אדנוזין 5'-ATP (Na-ATP). קוקטייל אגוניסט משמש גם כביקורת חיובית לזהות האסטרוציטים קיימא, מגיבים במקרים בהם תאים אינם מגיבים לDHPG, כנראה משום האסטרוציטים בפרט אלה אינם מבטאים כמויות מספיקות של הקולטן כדי לעורר תגובה לDHPG.
אנחנו השתמשנו בריכוזים שונים של DHPG, כוללים 5 מיקרומטר ו15 מיקרומטר (איור 3), כמו גם 30 מיקרומטר ו50 מיקרומטר (איור 4 א) כדי לסייע בחשיפה לשינויים בקבוצה astrocytic אני mGluRs. מערכת היחסים בין 2 תגובות הסלולר Ca + ורמות ביטוי GQ GPCR כבר נבדקו בעבר במבחנה 21-24. ראשית,סף להגיב לריכוז אגוניסט מסוים תלוי בצפיפות של קולטנים מתבטאים בכל תא. באוכלוסייה של תאים, תאים יותר להגיב בCa 2 + גובה לריכוז מסוים של אגוניסט כאשר התאים transfected עם צפיפות גבוהה יותר של הקולטנים. לאחר דוגרים פרוסות בTTX, אחוז האסטרוציטים באוכלוסייה מגיב לריכוז קבוע של עליות אגוניסט (3B דמויות ו3 ג). מצאנו כי מיקרומטר 5 ו15 מיקרומטר DHPG מגלים הבדלים ברורים בשיעור של האסטרוציטים מגיבים בין השליטה ותאים שטופלו TTX, בעוד 30 ו50 מיקרומטר DHPG נדרש כדי להשוות את תגובות אני mGluR קבוצה ב5.0 מ"מ K + טופל לעומת שליטה תאים (איור 4 א).
הקשר בין דפוסי Ca 2 + תגובת astrocytic וריכוז אגוניסט גם נבדק באתרם. הגדלת אגוניסטריכוז מסיט את הדפוס של Ca 2 + בתגובת האסטרוציטים מהשיא יחיד Ca 2 + גבהים לmultipeak ורמה Ca 2 + גבהים 25-27. בהתבסס על ממצאים קודמים אלו, אנו צופים כי דפוס התגובה לריכוז אחד של אגוניסט יעבור אם יש שינויים ברמת ביטוי הקולטן. לכן, תלוי באיזה משתי השיטות דרוג הוא מנוצל (עיכוב ירי עצבי או בהגדלתו), הריכוז של אגוניסט הדרוש כדי לייצר דפוס תגובה מסוים יהיה להגדיל או להקטין. לדוגמא, האסטרוציטים מודגרות בTTX משמרת Ca 2 + דפוס התגובה עוררו DHPG ליותר רמה מסוג Ca 2 + גבהים ולהגיב כדי להוריד את ריכוזי אגוניסט לעומת השליטה האסטרוציטים (איור 3 ג). אם ניקח בחשבון את המחקרים הקודמים, תצפיות אלה מראים כי קבוצת רמות ביטוי הקולטן אני mGluR בהאסטרוציטים גדלה.
זמן עלייה והתפרצות (חביון) של Ca 2 + הגבהים גם הוכחו לתאם ישירות לשינויים ברמות ביטוי GQ GPCR בתאים בתרבית 22-24. רמות ביטוי קולט גבוהות יותר לגרום לשיהוי תגובה קצר יותר וזמני עלייה מהירים יותר בעת ירידה בצפיפות הקולטן מייצרת את האפקט ההפוך. להאסטרוציטים מודגרות בTTX, Ca יש 2 + ארעיים עורר על ידי יישום של DHPG באופן משמעותי מהר יותר יעלה פעמים לעומת האסטרוציטים מודגרות בACSF שליטה (איור 3D). כפי שהוזכר קודם לכן, אמפליטודות של Ca 2 + תגובות עוררות אגוניסט תישאר ללא שינוי ללא קשר לריכוז אגוניסט או מודל קנה המידה 15 (איור 3D).
בנוסף לשינויים שנצפו ישירות על ידי הפעלת קבוצה אני mGluRs עם DHPG, astrocyte הספונטני Ca 2 + פעילות מושפעת גם באופן משמעותי על ידי מניפולציה זו. אנו צופיםעליית 2.26 פי דה בשיעור של האסטרוציטים פעילים באופן ספונטני מודגרות בTTX לעומת שליטה. זוהי עלייה מרק 12.9% מהאסטרוציטים שליטה מציגים פעילות ספונטנית בסומה ל42.1% בTTX מודגרות האסטרוציטים (איור 3E). כי זה ידוע שפעילות תערוכת GPCRs "מהותית" או מכוננת בהיעדר אגוניסט 21, 26, 28, ושעולה רמת פעילות מהותית זו עם עלייה ברמות ביטוי הקולטן, נתונים אלה מצביעים על כך שהצפיפות של עליות GQ GPCRs astrocytic בעקבות הפחתה ארוך טווח בירי פוטנציאל פעולה עצבית. בדומה לתגובות עוררות אגוניסט, זמני עלייה של Ca 2 + הגבהים ספונטניים גם מוגברים (איור 3E).
נציגי נתונים באמצעות הפרוטוקול השני, הדגירה באשלגן החוץ תאי גבוה (5.0 מ"מ), מתואר בFigure 4. עלייה בK תאי + 2.5-5.0 תוצאות מ"מ לעלייה משמעותית בתדירות פעולת נוירון CA3 בסיס פוטנציאל 15. ריכוזים גבוהים יותר של DHPG (30 מיקרומטר ו50 מיקרומטר) הם הכרחיים על מנת לעורר קבוצה אני mGluR Ca 2 + תגובות מהאסטרוציטים מודגרות באשלגן גבוה (איורים 4 א ו -4 ב). זה עולה בקנה אחד עם רמה מופחתת של קבוצת היענות אני mGluR בהאסטרוציטים לאחר עלייה ארוך טווח בפוטנציאל פעולה עצבי. בנוסף, דפוס התגובה עורר לריכוז קבוע של DHPG משמרות מתגובות כמו רמה לתגובות חלשות בודד שיא (איור 4). בוחן את אחוז האסטרוציטים הפעילים באופן ספונטני בשני תנאי אשלגן מגלה כי פחות האסטרוציטים מודגרות גבוה K + הם פעילים באופן ספונטני בהשוואה למצב השליטה (איור 4C). השפעה זו היא בoppositכיוון אלקטרוני של מצב TTX שבה אחוז של האסטרוציטים מציגים 2 + גבהים Ca ספונטניים הוא גדל. אחרון, שניהם עוררו ויש לי Ca 2 + גבהים ספונטניים זמני עלייה איטיים יותר בהאסטרוציטים מודגרות גבוהה K + לעומת מצב השליטה (4C דמויות ו4D). בסך הכל נתונים אלה מראים כי רמות ביטוי GQ GPCR astrocytic סולם bidirectionally בהתאם לרמת פעילות עצבית פוטנציאל פעולה לאורך תקופת זמן ממושכת.

איור 1. ייצור תא דגירה פרוס ולהגדיר. () חלק המגירה של מיכל אחסון פיפטה Brinkmann יחד עם מכסה האוויר חזק שלה משמש לבניית תא הדגירה הפרוסה. (ב) דר.י.ל. חור בצד השני של המכל כ ¼ 1 מלמעלה ו¼ מהצד. תתאים בחתיכת צינור גמיש. (ג) חבר את מנגנון microloader-סעפת עד הסוף הפנימי של צינורות גמישים. שים לב לחתוך להתאמת קצה טבעי 200 μl פיפטה (חץ לבן). שש microloaders אפנדורף 20 μl (ד ') הם חתכו להתאמה לסעפת שורה אחת עד שש ליצור מנגנון microloader-סעפת. (ה) מקדחה שני חורים קטנים על המכסה. Rack בועה צף להכנת מחזיק פרוסה (F). (ז) "הרגליים" התחתונה של המתלה הבועה צף יוסרו כך שפיסת חומר רשת ניילון יכולה להיות דבוקה לתחתית. (H) מלא את תא הדגירה עם כמות מספקת של ACSF כך שצף בעל פרוסה. התאם את אורך הצינור ולכן הטיפים של microloaders יכולים לנוח באחת מפינות רצפת החדר. כאשר מניח את תא הדגירה באמבט המים, מפלס המים באמבטיה צריך להיות באותה הרמה כמו ACSF בחדר. לחץ כאן לצפייה בתמונה גדולה יותר.
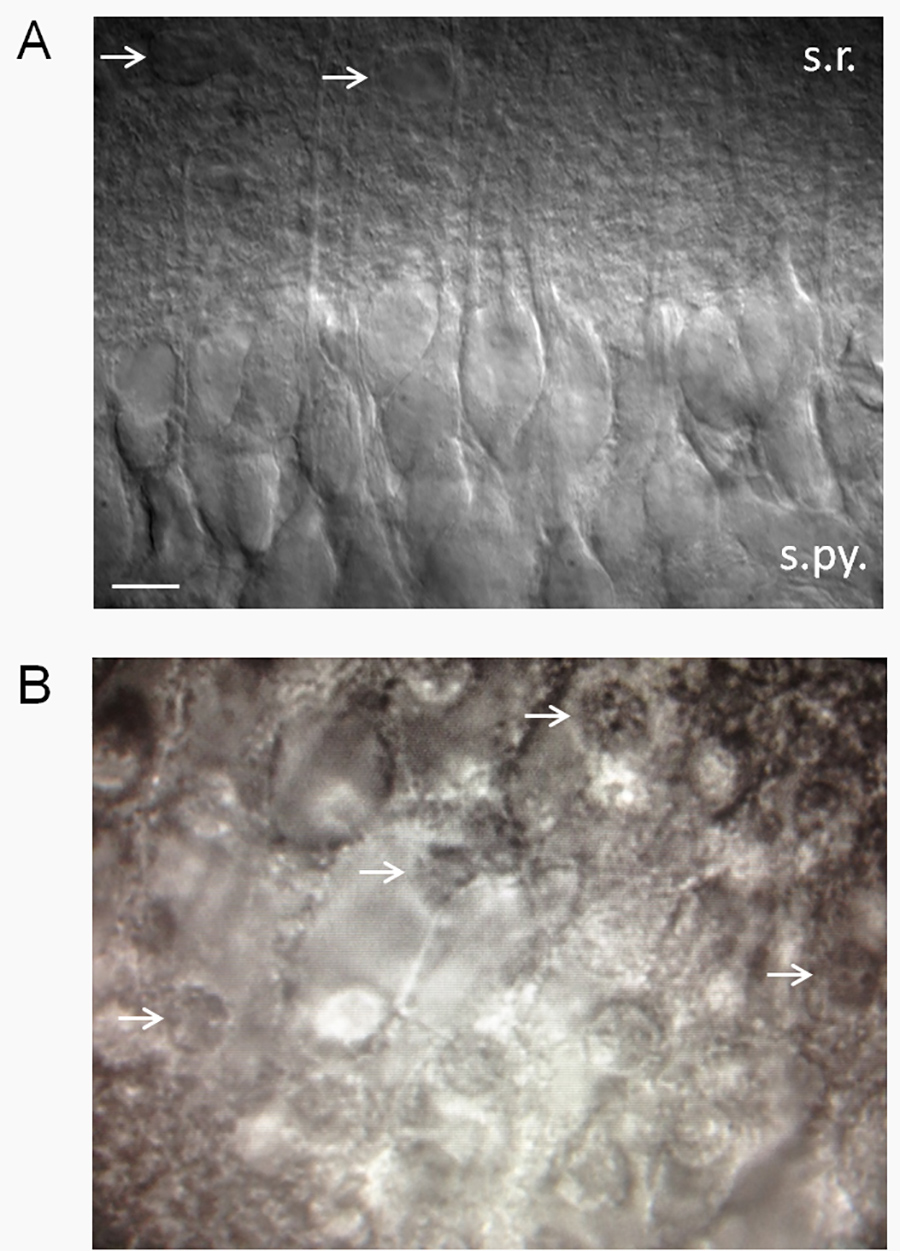
איור 2. הערכה של בריאות פרוסה. () פרוס בהיפוקמפוס למראה בריאה באמצעות התערבות ההפרש לעומת זאת (DIC) אופטיקה. יש פרוסות בריאים, מראה קטיפתי חלק ואחוז גבוה של נוירונים פירמידליים CA1 בריאים. הערה דנדריטים הפסגה מקרינים לתוך radiatum שכבה. תיקון מהדק של נוירונים שנראים כמו אלה המוצגים כאן חושף פוטנציאל נמוך מנוחת קרום (-61 ל-62 mV) בתקן 2.5 מ"מ K + ACSF עם פוטנציאל פעולה ספונטנית כמה. שיעורי פוטנציאל הממברנה וירי ישתנו כפונקציה של האקסtracellular K + (שיה ואח'. 15). חיצים מצביעים על האסטרוציטים משוערים. קיצורים: SR, radiatum שכבה; s.py., pyramidale שכבה. סרגל קנה מידה, 10 מיקרומטר. (ב) פרוסות לא בריאים תהיה אחוז גבוה של נוירונים פירמידליים CA1 מתים, שבו יש את המראה של ביצים מטוגנות (חיצים לבנים מצביעים על גרעינים של תאי עצב מתים - "החלמון" של הביצה מטוגנת). לחץ כאן לצפייה בתמונה גדולה יותר.
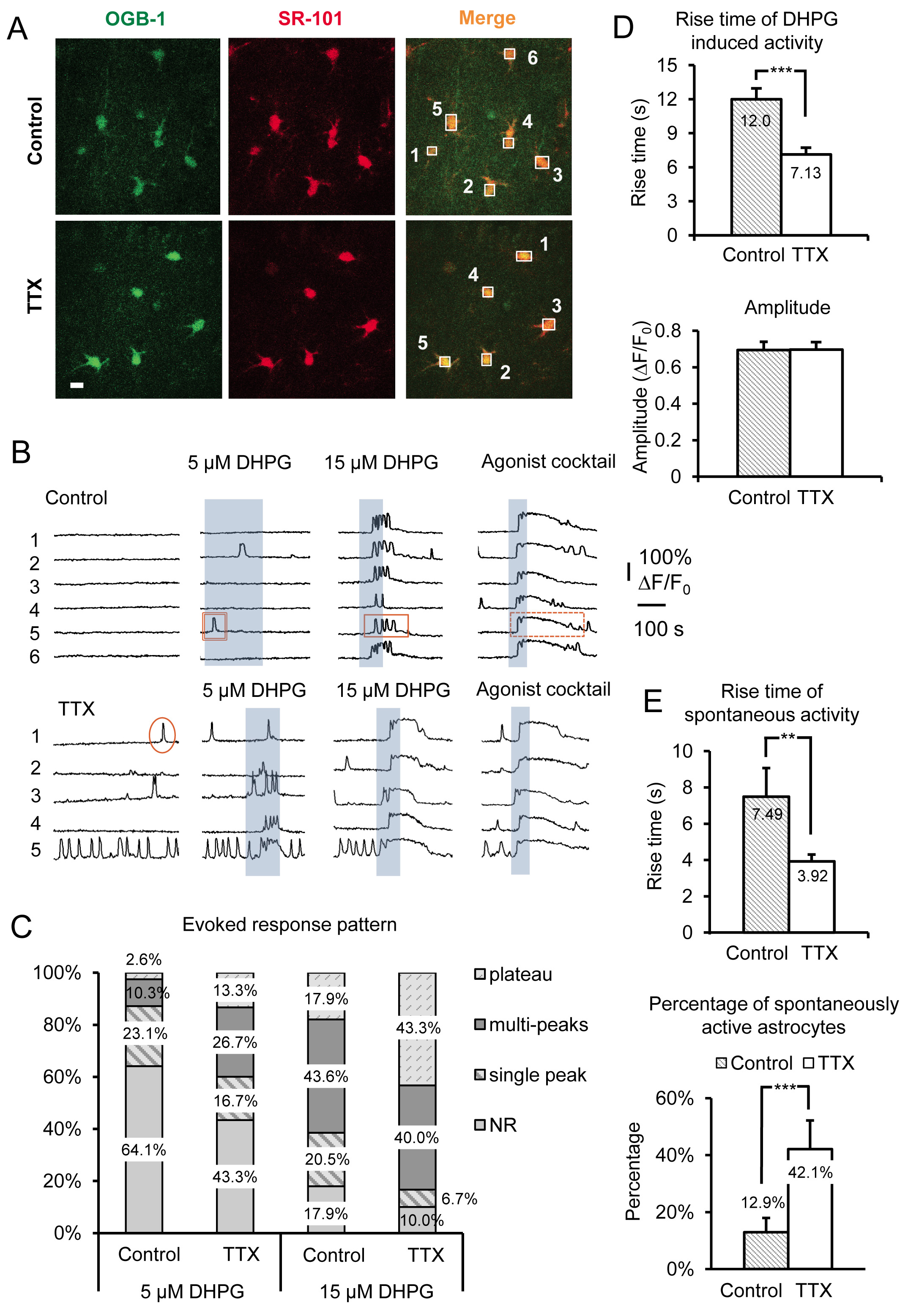
איור 3. הקלטה מוגברת פעילות GQ GPCR והקבוצה עוררה אני mGluR Ca 2 + תגובות לאחר עיכוב ארוך טווח של נקודתי גישה עצביות על ידי דגירה בTTX. (א) נציג תמונות של תאים בתחום ההקלטה מודגרות בגontrol תנאים (פנלים העליונים) או בTTX (לוחות נמוכים) שלקחו את אורגון גרין BAPTA-1:00 Ca 2 + צבע מחוון (פנלים משמאל) ו-SR-101 (פנלים באמצע). בר סולם הוא 10 מיקרומטר. כיסוי של שני האותות ("מיזוג") מצביע על כך שעומס האסטרוציטים עם Ca 2 + מדד. תיבות נמשכות מעל סומה astrocyte בודדת להקליט עוצמת הקרינה לאורך הזמן בערוץ הירוק כדי לפקח על Ca 2 + פעילות בהאסטרוציטים. (ב) עקבות לדוגמא מתיבות ההקלטה ב) של Ca 2 + פעילות בהאסטרוציטים. האסטרוציטים מודגרות במופע TTX מוגבר פעילות ספונטנית וקבוצה עוררה חזקה יותר אני mGluR Ca 2 + תגובות כפי שמעידים שינויים בדפוס התגובה. דוגמאות לשיא יחיד (מעגל), multipeak (מלבן), ומישור (מלבן מקווקו) Ca 2 + הארעיים מוצגות. שינויים (ג) בדפוסי תגובה ניכרים במיוחד באמצעות concent שונהמנות של הקבוצה אני mGluR אגוניסט DHPG. תגובות multipeak ורמה יותר ניכרות לאחר הדגירה בTTX בהשוואה לשליטה בריכוז אגוניסט נתון. (ד) עלייה פעמים של 2 + תגובות Ca עוררו DHPG הם מהירים יותר בהאסטרוציטים מודגרות בTTX בהשוואה לבקרה (פנל עליון), בעוד אמפליטודות לא משתנה (פנל תחתון), מעיד על אמפליטודות תגובה "הכל או לא כלום" פעם אחת כבר הגיע לסף להגיב. (ה) Rise זמנים של astrocyte הספונטני Ca 2 + ארעיים הם גם מהיר יותר בTTX מודגרות לעומת שליטה מודגרות האסטרוציטים (פנל עליון), בעוד שהאחוז של האסטרוציטים באוכלוסייה מציג 2 עליות ספונטניות GQ GPCR Ca + פעילות (פנל תחתון). לחץ כאן לצפייה בתמונה גדולה יותר.

איור 4. astrocytic פחת הקלטת פעילות GQ GPCR וקבוצה עוררה אני mGluR Ca 2 תגובות + בהמשך לעלייה ארוך טווח בנקודתי גישה עצבית על ידי דגירה באשלגן החוץ תאי גבוה. () עקבות נציג astrocyte Ca 2 + הקלטות מפרוסות מודגרות ב5.0 מ"מ K + ACSF לdepolarize נוירונים ולהגדיל את קצב הירי שלהם הבסיסי לעומת השליטה ACSF (2.5 מ"מ K + ACSF). האסטרוציטים הודגרו עם 5.0 תערוכת מ"מ K + ACSF Ca 2 + ארעיים גופני פחות ספונטנית וDHPG החלש עוררו תגובות בהשוואה להאסטרוציטים מודגרות בACSF שליטה. (ב) השוואה של דפוסים עוררו תגובות לריכוזים שונים של DHPG מגלה סוגים חלשים תגובה לאחר עלייה ארוך טווח בנקודתי גישה עצבית. (ג) ירידה בשיעור של האסטרוציטים בפוpulation מציג 2 + Ca פעילות ספונטנית הוא ציין לאחר דגירה ארוך טווח בK גבוה + לעומת השליטה ACSF (פנל עליון), בעוד שזמני עלייה של הפעילות הספונטנית הפכו איטיים יותר (פנל תחתון). (ד) עלייה זמנים של astrocyte עורר Ca 2 + תגובות לריכוזים שונים של DHPG להיות איטי הבא 5.0 טיפול מ"מ K + בהשוואה להאסטרוציטים מודגרות בACSF שליטה. לחץ כאן לצפייה בתמונה גדולה יותר.
Discussion
המודלים דרוג תיארו מייצגים שיטות מעשיות לחקר פלסטיות לטווח הארוך של קבוצת astrocytic אני mGluRs. 2 + אירועי Ca הדמיה ספונטניים ועוררו מספק assay רגיש למדידת שינויים בפעילות GQ GPCR astrocytic, כראיות מוצקות כבר נקבעו שastrocyte Ca 2 + גבהים להתרחש בעקבות שחרורו מIP 3 חנויות R-רגיש במורד הזרם של GQ GPCR הפעלה 10, 12, 17, 18. האחוז של האסטרוציטים באוכלוסייה מגיב לקבוצת אגוניסט אני mGluR והדפוס כגון Ca 2 + תגובות לדווח על שינויים בי mGluRs קבוצה על ידי האסטרוציטים.
הטכניקה הספציפית משמשת לטעינת האסטרוציטים עם Ca 2 + מחוון היא שיקול חשוב בעיצוב של ניסויים כדי לחפש שינויים בפעילות GQ GPCR astrocytic. בולוס טעינה או האסטרוציטים מרובים טעינה בתפזורת, או pטעינת atch מהדק של האסטרוציטים אדם יכולה לשמש לתמונת Ca 2 + ארעיים בהאסטרוציטים. כל אחת מהגישות מציעים יתרונות וחסרונות מסוימים. ישירות מילוי האסטרוציטים עם Ca 2 + מחוון באמצעות מהדק תיקון מאפשר זיהוי חד משמעי של התא כastrocyte ללא צורך בסמן המשני כגון SR-101. משלוח תיקון מהדק של מחוון גם מאפשר הקלטה של Ca 2 + פעילות מתאי astrocytic קטנים כוללים תהליכים סבוכים בסדר, שעלול להיות עמוקים יותר בפרוסה שבו תאים בריאים ועם יותר אינטראקציות שלמות עם סינפסות (תלוי בכוח הלייזר זמין). עם זאת, טעינת תיקון מהדק סובלת מתפוקה נמוכה כמו הנתונים נאספים תא אחד בכל פעם. לטעינה בתפזורת, לעומת זאת, מאפשרת למספר גדול של האסטרוציטים להיות טעון עם Ca 2 + מדד וצלם בו זמנית. עם זאת, רק האסטרוציטים סמוכים לפני השטח (<20 מיקרומטר) של הפרוסה נטענים, בדאגה קשורהים על בריאות תא וסינפסות בשלמותה.
פרוטוקול בולוס טעינת backpressure שהוצג כאן מציע את דרך ביניים, עם קצב העברת נתונים גבוה יחסית והיכולת לפקח על Ca 2 + פעילות עמוקה יותר בתוך פרוסה (40-75 מיקרומטר). גידול משמעותי בשיעור של האסטרוציטים פעילים באופן ספונטני תוך שימוש בטכניקת בולוס הטעינה הוא ציין בהשוואה לטעינה בתפזורת, טוען כי הקשרים בין הסינפסות עצביות ותהליכי astrocytic יותר מלאים 15. עם טעינה טובה, אפשר לעתים קרובות לעקוב אחר Ca 2 + פעילות בתהליכים עיקריים של האסטרוציטים (מידע לא מוצג) או שעלול להיות אפילו קטנים יותר תאים באמצעות מיקרוסקופ 2 פוטונים. עם זאת, טיפול היה צריך להיות מבוצע בהקצאת התהליכים הקטנים לastrocyte מסוים, ככל שהגבולות להשתלב מכתים הרקע ספציפי. חשש נוסף בשימוש בנהלים לטעינה בתפזורת או בולוס טעינה הוא את הצורך במרץ המשנימשתכשך לזיהוי astrocyte. למרות שזה כבר ידוע במשך שנים רבות כי האסטרוציטים מעדיפים לקחת את אסתר AM Ca 2 + מחוונים, סמן המשני SR-101 משמשים לעתים קרובות כדי לוודא את התאים הטעונים כמו האסטרוציטים. SR-101 עשויים בעצמו לשנות את הרגישות הפנימית של נוירונים 29. שימוש בSR-101 מאשש את הצורך לבצע את כל astrocyte Ca 2 + המדידות בTTX להגביל SR-101 השפעות אפשריות על רגישות עצבית. בהנחה ששניהם שליטה וקבוצות ניסוי כוללים SR-101, הסמן בעצמו לא צריך להסביר את תופעות שנצפו בastrocyte Ca 2 + האיתות הבאה מניפולציה ארוך טווח של פוטנציאל פעולה עצבי. SR-101 עשויים להיות יותר של דאגה גבוהה K + ניסויים, עם זאת, כפי שהוא עשוי להפחית את ההבדל בין 2.5 מ"מ K + לעומת 5.0 מ"מ K + אם קצב הירי הבסיסי לא משתנה באופן יחסי.
גישה מאוד מבטיחה לספק Ca 2 + מחוון להאסטרוציטים התפתחה לאחרונה אשר מציע חלופה אטרקטיבית לגישות מסורתיות יותר באמצעות Ca 2 + צבעים. התקדמות משמעותית נעשה בשנים האחרונות עם אינדיקטורים סידן מקודד גנטי (GECIs) הממוקדים להאסטרוציטים 30-32. GECIs יכול להיות מועבר להאסטרוציטים ידי microinjection vivo של וקטורים ויראליים adeno הקשורים לאזור במוח של עניין, כגון ההיפוקמפוס. ביטוי של GECIs מושגת לאחר כשבועיים בעקבות זיהום ויראלי 32. ישנם יתרונות רבים שהוצגו על ידי השימוש בGECIs בהאסטרוציטים. ראשית, הווקטורים ממוקדות האסטרוציטים באמצעות אמרגן astrocyte הספציפי, כך שהתאים שכותרתו הם האסטרוציטים 32. שנית, רעש אות לעכשיו נראה דומה למה שניתן להשיג באמצעות משלוח תיקון מהדק של צבע, אך ללא הפולשנות של שיש לו פיפטה את תיקון בתא 32. שלישית, המחוונים יכולים להיות דלivered ובא לידי ביטוי ברקמה בוגרת, שהוא בעייתי בשיטות משלוח לטעינה בתפזורת. יתרה, הביטוי פסיפס מציע היכולת להבדיל בקרב האסטרוציטים מרובים. לכן, יכולים להיות צילמו כמה האסטרוציטים פוטנציאליים בו זמנית, גם בעת ההקלטה בסומה וbranchlets בסדר באותו הזמן. לכן, באופן פוטנציאלי טכניקה אחת בודדת יכולה לשמש במקום של שלוש טכניקות נפרדות (לטעינה בתפזורת, בולוס טעינה, וטעינת התיקון-clamp) להקליט פעילות דרוג של GPCRs GQ astrocytic, מאוד להגדיל את היעילות.
חסרון פוטנציאלי אחד של שימוש במשלוח בתיווך נגיפי של Ca 2 + אינדיקטורים להאסטרוציטים הוא ההשפעה האפשרית על בריאות פרוסת 32. הווקטורים ויראליים adeno הקשורים בשימוש, כדי לספק את GECIs הוכחו בעבר לגרום דבק תגובתי של האסטרוציטים 33. הכנת פרוסות המוח באופן כללי סביר להניח יוזמת בשלבים מוקדמים של פתולוגיה כוללים שחרורו של inflammatory מולקולות 10. לכן, בשילוב עם הזמנים ארוכי הדגירה נדרשו כדי לגרום קנה מידה של קולטנים astrocytic, שימוש בGECIs מועבר באמצעות וקטורים ויראליים היית צריך לקבל תמורה נוספת בהקשר של בריאות פרוסה בסוגים אלה של ניסויים.
כאשר העסקת פרוטוקול זה, חשוב לזכור שבזמן היישום לאגוניסט כדי לייצר תגובה ישתנה כפונקציה של זמינות הקולטן. לריכוז מסוים של אגוניסט, זמן היישום יצטרך להיות ארוך יותר אם הקולטנים טפסו למטה, וקצרים יותר אם הקולטנים טפסו למעלה, לסמים כדי להגיע לריכוז מתאים ברקמה להפעלת קולטנים מספיק כדי לייצר Ca 2 + תגובה. לכן, פעמים יישום תרופה, ואפשרות הריכוזים שלהם, ייתכן שתהיינה צורך להיות מותאמות בהתאם לכיוון המיועד של קנה המידה. לדוגמא, ריכוז אגוניסט ייתכן שיהיה הצורך הוריד בגASE של TTX להימנע להרוות תגובות, ועלה לאחר דוגרים פרוסות ב+ K הגבוה אפילו לראות תגובה. באופן ספציפי, ריכוז DHPG הועבר 5-15 מיקרומטר לאחר טיפול TTX ל30-50 מיקרומטר לאחר טיפול 5.0 מ"מ K + על מנת ללמוד 2 + דפוסי תגובת Ca, כ5-15 מיקרומטר היה לעתים קרובות נמוך מדי כדי לייצר תשובות אמינות ב האסטרוציטים לאחר קנה המידה במורד של הקבוצה אני mGluRs.
הקלטה של astrocyte Ca 2 + פעילות לא מספקת עדות ישירה של הכנסת קולט או הפנמה או מקרום הפלזמה. עם זאת, המבוסס על הדמיון המדהים של נתונים עם נתונים ממחקרים קודמים במבחנה שבדקו את הקשר הישיר בין רמות ביטוי GQ GPCR וספונטאניות ועוררו Ca 2 + ארעיים 21-24, הפרשנות ההגיונית ביותר של השינויים בCa 2 + איתות היא שיש לי רמות ביטוי astrocyte משטח קולטהשתנה. גישה משלימה עשויה להיות שיקול חשוב, אם רוצה לספק ראיות נוספות על המקום של ההשפעה על Ca 2 + פעילות. אסטרטגיה שבה השתמש הייתה לבחון את ההשפעה של הדגירה TTX על פרוסות בהיפוקמפוס מעכברי MrgA1R astrocytic. עכברים מהונדסים אלה מבטאים GQ GPCR זר (MrgA1R) רק בהאסטרוציטים. משום שקולטן זה הוא לא האם למוח, אין הנוירוטרנסמיטר אנדוגני הנוכחי כדי לשנות את רמות הפעילות שלה. העבודות קודמות הראו כי קולטן זה עוסק באותו מולקולות איתות תאית כפי שאני mGluRs קבוצת אנדוגני באותו האסטרוציטים 34. דגירה לאחר לטווח הארוך של פרוסות מעכברי MrgA1R בTTX, לא נמצאו הבדלים בתגובות MrgA1R עורר אגוניסט לעומת שליטת littermate מודגרות פרוסות תספק ראיות לכך ההשפעה על astrocyte Ca 2 + הפעילות היא כתוצאה משינויים המקומיים לקולט פני השטח, במיוחד אם תגובות של הקבוצה אני mGluR עדיין signifמשופר icantly באותו האסטרוציטים. אלטרנטיבה, אם כי אסטרטגיה אולי מעורבת יותר תהיה לבודד האסטרוציטים מהפרוסות לניתוח כתם מערבי, כל עוד שבריר קרום יכול להיות מנותח לשינויים ברמות ביטוי הקולטן לפני השטח. מיון תא הקרינה הופעל (FACS) או cytometry זרימה עשוי להיות מועיל כאן.
היישומים האפשריים של שיטה זו למחקר של נוירונים, האסטרוציטים ואינטראקציות astrocyte העצבי הם רבים. בניסויים שלנו, רק קבוצה עוררו DHPG אני mGluR 2 + תגובות Ca astrocytic נחקרו, בפרוסות בהיפוקמפוס חריפות מבודדות מעכברים לנוער. הכנה זו יש לא רק afferents השלמה (בטחונות שפר), אלא גם את תאי עצב שיוצרים אותם (תאים פירמידליים CA3), כך שניתן לתפעל את שיעורי הירי של נוירונים glutamatergic הללו על תאי postsynaptic (תאים פירמידליים CA1) ו האסטרוציטים בradiatum שכבת התהליכים שassociatE עם סינפסות אלה. הפרוסה בהיפוקמפוס חריפה לא יכולה להיות ההכנה הטובה ביותר לטיפול בשיעורי ירי של סוגים אחרים של תאי עצב, לעומת זאת, afferents רבות נותקו מהנוירונים שיוצרים אותם. עם זאת, זה עשוי להיות אפשרי בהכנות פרוסה מסוימות להתבונן פלסטיות של תת GQ GPCR אחר astrocytic. לדוגמא, פרוסות יכולים להיות מוכנות עם נוירונים בסיס מוח קדמי כולינרגית והתחזיות שלהם להיפוקמפוס בשלמותה. דגירה של הפרוסות האלה בTTX או גבוה K + תשפיע על שיעורי ירי בסיס של נוירונים הכולינרגית, מה שמוביל לקנה מידה של mAchRs בהאסטרוציטים של Oriens שכבה, שמקבלים חלק ניכר מהזנת כולינרגית 1. חלופה שלא נבדק עדיין גישה ללמוד דרוג astrocytic קולטן בתוך אזור מסוים של המוח, עם כל החיבורים ללא פגע בעוד קנה מידה מתרחשת, יכול להיות לשימוש מודל in vivo שבו שחרור מתמשך של TTX מושגת על ידי השתלה של פלסטפולימר ic Elvax 40W מעל האזור של עניין 35. גישה זו כבר השתמשה בעבר במחקר של קנה מידה עצבית, אלא גם צריכה להיות רלוונטי לכיול astrocytic. לבסוף, עם את ההודעה הנכונה, מחקרים עתידיים יכולים לבחון משפחות GPCR אחרות, לרבות שינויים בi GPCRs של G או G. אפשר לחזות GABA-B G astrocytic אני GPCRs להיות מושפע בעקבות העיכוב של ירי באופן מקומי מקרין interneurons GABA בתוך כל הכנת פרוסה. פיתוח המדדים חדשים מיקוד מולקולות איתות אחרות, כגון מחוון של מחנה השליח השני בזמן אמת, הייתי לפתוח את האזור חדש של מחקר על תקשורת קולטן תא העצב לastrocyte.
קנה מידה דו כיוונית של mGluRs astrocytic ידי מניפולציה של שיעורי ירי נוירון בסיסיים מספקת מידה מסוימת של הרגישות של האסטרוציטים לשחרורו בתיווך-AP של הנוירוטרנסמיטר. האסטרוציטים, ככל הנראה, יכולים לחוש APS וglutama ספונטנייםשחרור te בסינפסות של תאי הפירמידה שפר טחונות-CA1 גם כאשר תאי K + הוא בטווח פיסיולוגי. בעוד יישום חריף של TTX אינו מפחית את התדירות של astrocyte הספונטני Ca 2 + פעילות 18, 36, 37, Ca 2 + הפעילות בין האסטרוציטים באוכלוסייה הופך להיות חסרת קורלציה 36, מתן עדות לכך שקולטני astrocytic גלאי סוכנות הידיעות AP. הדבר מצביע על כך האסטרוציטים לחוש בנקודות עצביות ספונטניות ללא השפעה על Ca 2 + הפעילות הכוללת שלהם. מקובל כי ריכוזים תאיים של ה-IP 3 צריכים להגיע לרמת סף כדי לעורר IP 3 רופי מספיק כדי להוביל לCa 2 + גובה לזיהוי. אפשר בנקודות עצביות ספונטניות להפעיל GPCRs astrocytic מבלי לייצר 2 + גבהים Ca מדידים? מחקרים עתידיים יכולים לנצל פלואורסצנטי התהודה העברת אנרגיה (סריג) או techn דומה ique (כמו ברט) כדי לבחון את מערכת היחסים בין צימוד חלבון G לקולטן (מדד של הפעלת קולטן) וCa 2 + שחרור מחנויות פנימיות. ברט כבר נעשה שימוש נרחב במבחנה כדי לזהות צימוד החלבון לGPCR G 38, למרות שזה עשוי להיות קצת זמן לפני שטכנולוגיה זו תהיה זמינה לשימוש בהכנות רקמות שלמות. יתכן כי GPCRs GQ astrocytic נמצאים מופעלת לעתים תכופות יותר מאשר ניתן להקליט באמצעות הכלים Ca 2 + הדמיה הזמינות כרגע. בנוסף לחישת פוטנציאל פעולה, GPCRs GQ astrocytic יכולה להיות גם מסוגלת לזהות שחרור quantal מיניאטורי של הנוירוטרנסמיטר כפי שדווח במחקר שנערך לאחרונה 39. השיטה דרוג כיוונית המתוארת כאן עשויה לשמש במחקרים עתידיים על מנת לספק מדד למידה שבה GPCRs astrocytic GQ לזהות שחרור quantal ועי של הנוירוטרנסמיטר, על ידי הכללת bafilomycin A1 בפרוטוקול הדגירה המידה.
ntent "> עד כה, פרוטוקולי קנה המידה היה בשימוש רק בפרוסות בהיפוקמפוס מעכברים לנוער (p12-p18). לכן, אינה ידוע כרגע אם דרוג קולט astrocytic יכול גם להיגרם ברקמה שהתקבלה בעכברים בוגרים. מחקר שנערך לאחרונה משכנע עולה כי קבוצת ביטוי אני mGluR בהאסטרוציטים פוחת במידה ניכרת לאחר השבוע של גיל הראשון וממשיך לרדת עד לבגרות, עם רמות נמוכות מאוד של ביטוי הקולטן בהאסטרוציטים מבוגרים 40. לפיכך יהיה מעניין לקבוע אם mGluRs astrocytic בהיקף של עד הבא ארוך עיכוב ארוך של ירי עצבי בפרוסות בהיפוקמפוס העכבר בוגרות לרמות מתקרבות לאלה ראו בהאסטרוציטים מעכברים לנוער. ממצא זה מציע כי ביטוי הקולטן astrocytic אינו סטטי בגיל מסוים, אך יכול להשתנות במהירות בהתאם לרמות של פעילות עצבית. בניגוד ל ביטוי מופחת של הקבוצה אני mGluRs בעכברים בוגרים, ראיות מתגלה כי רצפטורים adrenergic, כוללים & #945; 1A, 2A α, וβ 1 תת, באים לידי ביטוי בעיקר על ידי האסטרוציטים במוח הבוגר 3, 4. Adrenergic 1A α GQ GPCR עשוי להיות יעד אטרקטיבי למחקרים עתידיים של תקשורת נוירון לastrocyte, לרבות אם קולטנים אלה רגישים לשינויים בשיעורי ירי נוירון adrenergic.Disclosures
המחברים מבקשים לחשוף כי tetrodotoxin משמש במחקרים אלה נרכש מAbcam. היה לי Abcam שום מעורבות בהשערות, עיצוב, או אוסף של נתונים. כל התקשורת בעניין מתן החסות של העבודה על ידי Abcam התרחשה לאחר תהליך ביקורת העמיתים היה שלם.
Acknowledgements
המחברים רוצים להכיר המרכז של UC Riverside לגלייה-עצבי אינטראקציות לדיון חשוב של פרוטוקולי קנה המידה ונתונים. המחברים רוצים גם לתת תודה כנה לך Abcam למתן חסות לפרסום של עבודתם.
Materials
| Name | Company | Catalog Number | Comments |
| Chamber Supplies | |||
| Brinkmann pipette storage container | Fisher Scientific | 03-491 | Use the drawer portion as the incubation chamber |
| Electrical drill | |||
| Flexible tubing | Tygon | R-3603 | |
| Silicone seam sealant | Also called aquarium seam sealer | ||
| Gas tank | 95% oxygen, 5% carbon dioxide | ||
| Natural beveled pipette tip | USA Scientific | 1111-1000 | Cut-to-fit to connect oxygenate lines |
| One-to-six lines manifold | Warner Instruments | 64-0210 (MP-6) | For the microloader-manifold apparatus |
| Microloader | Eppendorf | 5242 956.003 | For the microloader-manifold apparatus, cut-to-fit |
| Floating Bubble Rack | Bel Art Scienceware | F18875-0400 | For slice holder |
| 600 µm Sefar Nitex Nylon mesh | ELKO Filtering Co. | 06-600/51 | For slice holder |
| Krazy Glue | For slice holder | ||
| Reagents | |||
| Isoflurane | Baxter | 1001936060 | |
| NaCl | Fisher | S271-3 | |
| KCl | Fisher | P333-500 | |
| CaCl2 | Fisher | C79-500 | |
| MgCl2 | Fisher | M33-500 | |
| NaH2PO4 | Fisher | S369-500 | |
| NaHCO3 | Fisher | S233-500 | |
| Glucose | Fisher | Fisher | |
| (±)-6-Hydroxy-2,5,7,8- tetramethylchromane-2-carboxylic acid (Trolox) | Acros Organics | 53188-07-1 | |
| Ascorbic acid | Acros Organics | 401471000 | |
| Tetrodotoxin citrate (TTX) | Abcam | ab120055 | |
| Sulforhodamine 101 (SR-101) | Sigma-Aldrich | 284912 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Pluronic Acid F-127 | Invitrogen, Molecular Probes | P6867 | |
| Oregon Green 488 BAPTA-1 AM *cell permeant (special packaging) | Invitrogen, Molecular Probes | O6807 | |
| (RS)-3,5-DHPG | Abcam | ab120020 | |
| Histamine | Sigma-Aldrich | H7125 | |
| Carbamoylcholine chloride (Carbachol) | Sigma-Aldrich | C4382 | |
| Adenosine 5’-ATP disodium (Na-ATP) | Sigma-Aldrich | A7699 | |
| Dissection Tools | |||
| Single-edge razor blade | GEM | 62-0161 | For bisection |
| Double edge razor blade | TED PELLA, INC. | 121-6 | For cutting slices |
| Mayo Scissors, supercut | WPI | 14010-15 | For decapitation |
| Fine iris scissors, straight | Fine Science Tools | 14094-11 | For cutting the skull |
| Iris forceps, curved | WPI | 15915 | To remove the skin and skull |
| Small spatula | To remove/transfer the brain | ||
| Dumostar Dumont #5 Biologie Tip forceps | Fine Science Tools | 11295-10 | For hippocampus dissection |
| Glass Pasteur pipette | Fisher | 13-678-20B | For transferring brain slices |
| Pasteur pipette rubber bulb | Fisher | 03-448-22 | For transferring brain slices |
| Polystyrene 100 mm tissue culture dishes | Corning | 25020 | |
| Vibratome | Leica | VT 1200S | |
| Water bath | Fisher | ISOTEMP 210 | For warm incubation |
| Micropipette puller | Narishige | PC-10 | For bolus-loading pipette |
| Confocal microscope | Olympus | Olympus Fluoview 1000 | |
| Low Profile Open Diamond Bath Imaging Chamber with PM-1 platform | Warner Instruments | RC-26GLP | diamond bath with low profile |
| Borosilicate glass pipette | World Precision Instruments | TW150F-4 | For bolus-loading pipette |
| Micromanipulator | Sutter Instrument | ROE-200 | For bolus-loading pipette |
| Spin-X centrifuge tube filter with 0.22 µm cellulose acetate | Costar | 8161 |
References
- Araque, A., Martin, E. D., Perea, G., Arellano, J. I., Buno, W. Synaptically released acetylcholine evokes Ca2+ elevations in astrocytes in hippocampal slices. J. Neurosci. 22, 2443-2450 (2002).
- Navarrete, M., Araque, A. Endocannabinoids mediate neuron-astrocyte communication. Neuron. 57, 883-893 (2008).
- Bekar, L. K., He, W., Nedergaard, M. Locus coeruleus alpha-adrenergic-mediated activation of cortical astrocytes in vivo. Cereb. Cortex. 18, 2789-2795 (2008).
- Hertz, L., Lovatt, D., Goldman, S. A., Nedergaard, M. Adrenoceptors in brain: cellular gene expression and effects on astrocytic metabolism and Ca2. Neurochem. Int. 57, 411-420 (2010).
- Porter, J. T., McCarthy, K. D. Hippocampal astrocytes in situ respond to glutamate released from synaptic terminals. J. Neurosci. 16, 5073-5081 (1996).
- Bernardinelli, Y., et al. Astrocytes display complex and localized calcium responses to single-neuron stimulation in the hippocampus. J. Neurosci. 31, 8905-8919 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Wang, X., et al. Astrocytic Ca2+ signaling evoked by sensory stimulation in vivo. Nat. Neurosci. 9, 816-823 (2006).
- Fiacco, T. A., Agulhon, C., McCarthy, K. D. Sorting out astrocyte physiology from pharmacology. Annu. Rev. Pharmacol. Toxicol. 49, 151-174 (2009).
- Agulhon, C., et al. Calcium Signaling and Gliotransmission in Normal vs Reactive Astrocytes. Front. Pharmacol. 3, 139 (2012).
- Nedergaard, M., Verkhratsky, A. Artifact versus reality--how astrocytes contribute to synaptic events. Glia. 60, 1013-1023 (2012).
- Nizar, K., et al. In vivo stimulus-induced vasodilation occurs without IP3 receptor activation and may precede astrocytic calcium increase. J. Neurosci. 33, 8411-8422 (2013).
- Sutton, M. A., et al. Miniature neurotransmission stabilizes synaptic function via tonic suppression of local dendritic protein synthesis. Cell. 125, 785-799 (2006).
- Ibata, K., Sun, Q., Turrigiano, G. G. Rapid synaptic scaling induced by changes in postsynaptic firing. Neuron. 57, 819-826 (2008).
- Xie, A. X., et al. Bidirectional scaling of astrocytic metabotropic glutamate receptor signaling following long-term changes in neuronal firing rates. PLoS ONE. 7, (2012).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol. Rev. 79, 1089-1125 (1999).
- Petravicz, J., Fiacco, T. A., McCarthy, K. D. Loss of IP3 receptor-dependent Ca2+ increases in hippocampal astrocytes does not affect baseline CA1 pyramidal neuron synaptic activity. J. Neurosci. 28, 4967-4973 (2008).
- Nett, W. J., Oloff, S. H., McCarthy, K. D. Hippocampal astrocytes in situ exhibit calcium oscillations that occur independent of neuronal activity. J. Neurophysiol. 87, 528-537 (2002).
- Garaschuk, O., Milos, R. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1, 380-386 (2006).
- Nimmerjahn, A., Kirchhoff, F., Kerr, J. N., Helmchen, F. Sulforhodamine 101 as a specific marker of astroglia in the neocortex in vivo. Nat. Methods. 1, 31-37 (2004).
- Prezeau, L., et al. Changes in the carboxyl-terminal domain of metabotropic glutamate receptor 1 by alternative splicing generate receptors with differing agonist-independent activity. Mol. Pharmacol. 49, 422-429 (1996).
- Shao, Y., McCarthy, K. D. Quantitative relationship between alpha 1-adrenergic receptor density and the receptor-mediated calcium response in individual astroglial cells. Mol. Pharmacol. 44, 247-254 (1993).
- Wang, S. S., Thompson, S. H. Measurement of changes in functional muscarinic acetylcholine receptor density in single neuroblastoma cells using calcium release kinetics. Cell Calcium. 15, 483-496 (1994).
- Ostasov, P., Krusek, J., Durchankova, D., Svoboda, P., Novotny, J. Ca2+ responses to thyrotropin-releasing hormone and angiotensin II: the role of plasma membrane integrity and effect of G11alpha protein overexpression on homologous and heterologous desensitization. Cell Biochem. Funct. 26, 264-274 (2008).
- Shelton, M. K., McCarthy, K. D. Hippocampal astrocytes exhibit Ca2+-elevating muscarinic cholinergic and histaminergic receptors in situ. J. Neurochem. 74, 555-563 (2000).
- Hermans, E., Challiss, R. A. Structural signalling and regulatory properties of the group I metabotropic glutamate receptors: prototypic family C G-protein-coupled receptors. Biochem. J. 359, 465-484 (2001).
- Zur Nieden, R., Deitmer, J. W. The Role of Metabotropic Glutamate Receptors for the Generation of Calcium Oscillations in Rat Hippocampal Astrocytes In Situ. Cortex. 16 (5), 676-687 (2005).
- de Ligt, R. A., Kourounakis, A. P., AP, I. J. Inverse agonism at G protein-coupled receptors: (patho)physiological relevance and implications for drug discovery. Br. J. Pharmacol. 130, 1-12 (2000).
- Kang, J., et al. Sulforhodamine 101 induces long-term potentiation of intrinsic excitability and synaptic efficacy in hippocampal CA1 pyramidal neurons. Neuroscience. 169, 1601-1609 (2010).
- Tong, X., Shigetomi, E., Looger, L. L., Khakh, B. S. Genetically encoded calcium indicators and astrocyte calcium microdomains. Neuroscientist. 19, 274-291 (2013).
- Akerboom, J., et al. Optimization of a GCaMP Calcium Indicator for Neural Activity Imaging. J. Neurosci. 32, 13819-13840 (2012).
- Shigetomi, E., et al. Imaging calcium microdomains within entire astrocyte territories and endfeet with GCaMPs expressed using adeno-associated viruses. J. Gen. Physiol. 141, 633-647 (2013).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nat. Neurosci. 13, 584-591 (2010).
- Fiacco, T. A., et al. Selective stimulation of astrocyte calcium in situ does not affect neuronal excitatory synaptic activity. Neuron. 54, 611-626 (2007).
- Echegoyen, J., Neu, A., Graber, K. D., Soltesz, I. Homeostatic plasticity studied using in vivo hippocampal activity-blockade: synaptic scaling, intrinsic plasticity and age-dependence. PLoS One. 2, (2007).
- Aguado, F., Espinosa-Parrilla, J. F., Carmona, M. A., Soriano, E. Neuronal activity regulates correlated network properties of spontaneous calcium transients in astrocytes in situ. J. Neurosci. 22, 9430-9444 (2002).
- Takata, N., Hirase, H. Cortical layer 1 and layer 2/3 astrocytes exhibit distinct calcium dynamics in vivo. PLoS ONE. 3, e2525 (2008).
- Salahpour, A., et al. BRET biosensors to study GPCR biology, pharmacology, and signal transduction. Front. Endocrinol. 3 (105), (2012).
- Di Castro, M. A., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat. Neurosci. 14, 1276-1284 (2011).
- Sun, W., et al. Glutamate-dependent neuroglial calcium signaling differs between young and adult. Science. 339, 197-200 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved