Method Article
Induktion von Plastizität Astrozytäre Rezeptoren durch Manipulation der neuronalen Feuerraten
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Anpassung der Protokolle verwendet, um homöostatische Plastizität in Neuronen für die Untersuchung der Plastizität von Astrozyten G-Protein-gekoppelten Rezeptoren zu induzieren. Kürzlich verwendet werden, um Veränderungen in Astrozyten Gruppe I mGluRs mit jungen Mäusen zu untersuchen, kann das Verfahren auf die Skalierung der verschiedenen Astrozyten GPCRs zu messen, in Gewebe von erwachsenen Mäusen in situ und in vivo, und ein besseres Verständnis für die Empfindlichkeit der Rezeptoren Astrozyten gewinnen angewendet werden Veränderungen in der neuronalen Aktivität.
Zusammenfassung
Nähe von zwei Dekaden der Forschung hat festgestellt, dass Astrozyten in situ und in vivo exprimieren viele G-Protein-gekoppelten Rezeptoren (GPCRs), die von neuronal-Freigabe Sende angeregt werden können. Jedoch wurde die Fähigkeit von Astrozyten Rezeptoren Plastizität in Reaktion auf Veränderungen in der neuronalen Aktivität aufweisen, wenig Aufmerksamkeit geschenkt. Hier beschreiben wir ein Modellsystem, die global nach oben oder unten skalieren Astrozyten Gruppe I metabotropen Glutamat-Rezeptoren (mGluRs) in akuten Hirnschnitten verwendet werden kann. Enthalten sind Methoden, wie man parasagittale Hippocampus vorbereiten, bauen Kammern geeignet für langfristige Scheibe Inkubation bidirektional manipulieren neuronalen Aktionspotential, Belastung Astrozyten und Astrozyten Prozesse mit fluoreszierenden Ca 2 +-Indikator, und messen Veränderungen in Astrozyten Gq GPCR-Aktivität durch die Aufnahme spontane und evozierte Astrozyten Ca 2 +-Ereignisse mit Hilfe der konfokalen Mikroskopie. Im wesentlichen ein "Calcium roadmap "ist, wie man Plastizität der Astrozyten Gq GPCRs zu messen. Anwendungen der Technik zur Untersuchung von Astrozyten diskutiert. Nachdem ein Verständnis dafür, wie Astrozyten-Rezeptor-Signal wird durch Veränderungen der neuronalen Aktivität beeinflusst hat wichtige Implikationen sowohl für die normale synaptische Funktion sowie Prozesse zugrunde liegenden neurologischen Störungen und neurodegenerative Erkrankungen.
Einleitung
Astrozyten reagieren innerhalb von Sekunden bis Stimulation von Neuronen oder neuronalen Axonen mit einem Anstieg der cytoplasmatischen Ca 2 + resultierenden fast ausschließlich aus der Aktivierung von Astrozyten Gq GPCRs. Zum Beispiel muskarinischen Acetylcholin-Rezeptoren 1, 2 Cannabinoid-Rezeptoren, α 1A adrenergen Rezeptoren 3, 4, und ich mGluRs Gruppe (siehe unten) sind alle Astrozyten Gq GPCR-Subtypen, die akut die neuronale Aktivität zu reagieren. Aktivierung von Astrozyten Gruppe I-mGluRs wurde sehr ausgiebig demonstriert, nach Stimulation des glutamatergen Nerven Afferenzen in situ (z. B. akute Hippocampus) 5-7 sowie in adulten Maus Kortex in vivo nach sensorischer Stimulation 8. Das Ergebnis der Aktivierung von Astrozyten Gq GPCR-Signal über die Biologie und Physiologie der Astrozyten, Neuronen oder Astrozyten-Neuron-Interaktionen ist eine Angelegenheit der Debatte 12.09. Es wird s seinome Zeit vor der Funktion von Neuronen zu Astrozyten-Rezeptor-Signal ist voll gewürdigt.
Zwar ist klar, dass Neuronen Astrozyten Rezeptoren mit Versuchsprotokolle zu aktivieren, gibt es Aspekte der Neuron-zu-Astrozyten-Rezeptor-Kommunikation, die kaum verstanden zu bleiben. Zuerst wird die tatsächliche Menge der neuronalen Aktivität erforderlich Astrozyten Gq GPCRs aktivieren ist nicht gut definiert, und die zweite ist die Fähigkeit der Astrozyten Rezeptoren nutzungsabhängige Plastizität aufweisen wenig Aufmerksamkeit geschenkt. Um zu beginnen, um diese Fragen zu beantworten, haben wir vor kurzem ein Protokoll zur bidirektionalen Skalierung der Astrozyten Gruppe I mGluRs in akuten Jugend Hippocampus in Reaktion auf langfristige Veränderungen in der neuronalen Aktionspotential (AP)-abhängige synaptische Aktivität zu induzieren. Ähnlich wie für bidirektionale homöostatische Plastizität neuronaler ionotropen Glutamat-Rezeptoren 13, 14, Astrozyten Gruppe I mGluRs Scale-up fo entdecktllowing Blockade neuronaler Aktionspotentiale und verkleinern, wenn neuronale Aktionspotentialfrequenz erhöht 15. Diese kompensatorischen Veränderungen in Astrozyten Rezeptoren können durch spontane Aufnahme gemessen werden und evozierte Astrozyten Ca 2 +-Transienten-und den Vergleich der Eigenschaften von diesen Ereignissen um die aus Astrozyten in Kontrollbedingungen. In diesem Manuskript, beschreiben wir die vollständige Methodik für den Einsatz dieses Protokolls, einschließlich der Vorbereitung der akuten Hippocampus, Inkubationsbedingungen zu Astrozyten-Rezeptor-Skalierung zu induzieren, Astrozyten Ca 2 +-Indikator-Farbstoff Laden, Ca 2 +-Imaging-Techniken mit Hilfe der konfokalen Mikroskopie und erwarteten Auswirkungen auf Astrozyten Gq GPCR-Aktivität. Vorhersehbare Auswirkungen auf Astrozyten Ca 2 + Signaleigenschaften - was die zuvor in kultivierten Zellen mit unterschiedlichen Expressionsniveaus von Gq GPCRs transfiziert aufgezeichnet wurde - eine "Roadmap", die in zukünftigen Studien genutzt werden kann, um Änderungen in wie Assaytrocytic GPCR Ausdruck. Die Auswirkungen und Anwendungsmöglichkeiten für den Einsatz dieser Technik wird zu unserem Verständnis der Astrozyten-neuronalen Interaktionen im gesunden und erkrankten Gehirn beitragen.
Protokoll
Die Verfahren, die folgen, sind von der Institutional Animal Care und Verwenden Committee der University of California, Riverside genehmigt worden.
1. Der Bau der Inkubation Kammer-und Slice-Halter
- Bau der Brutraum: Konstruieren Sie die Inkubation Kammer von Material, das nicht toxisch ist. Stellen Sie sicher, dass die Kammer hat Luftzirkulation kontrolliert, hält eine ausreichende Menge von ACSF für eine Scheibe Halter zu schweben, und ist groß genug, so dass die Scheibe Halter kann an einem Ende der Kammer schweben, während das Gas-Dispersion aus Sauerstofflinien bei der auftritt anderen Ende. Der Schubladenteil einer Pipettenspeicherbehälter mit seiner luftdichten Deckel (1A) erfüllt diese Kriterien gut.
- Bohrer ein kleines Loch auf der Seite des Behälters etwa 1 ¼ von oben und ¼ von der Seite. Setzen Sie ein Stück Schlauch durch das Loch (Abbildung 1B). Sei vorsichtig zu bohren niedrig genug, so daß der Schlauch nicht groß genug, damit es über der Lösung komprimiert werden, wenn der Deckel geschlossen ist, vor.
- Bewerben Silikonnahtdichter ("Aquarium Nahtdichter"), um eine wasserdichte Abdichtung zwischen der Sauerstoffleitung und der Kammer zu schaffen.
- Verbinden der "Außenseite" Ende des Schlauchs an einen Gasbehälter (95% Sauerstoff, 5% Kohlendioxid) mit einem männlichen Luer-Fitting. Für eine individuelle Passform, cut-to-fit eine natürliche abgeschrägte 200 ul Pipettenspitze (Abbildung 1C).
- Schließen Sie das "Innere" Ende der Rohrleitung zu einer Eins-zu-sechs Line Kunststoff vielfältig. Cut-to-fit sechs 20 ul Eppendorf Microloader Pipettenspitzen mit jedem Verteiler Einlass (1D). Die feine Öffnung der Microloader ist ideal für die Herstellung einen stetigen Strom von kleinen Blasen.
- Um für die Belüftung, bohren Sie zwei kleine Löcher auf dem Deckel des Behälters (1E).
- Die Konstruktion der Scheibe hälter: Die Scheibenhalter ist aus einer Schwimmblase Rack (1F) gefertigt.
- Entfernen Sie die unteren "Beine" der Blase-Rack, und schneiden Sie die Spitze auf etwa 1 ¾ Zoll
- Kleben Sie ein Stück Nylon-Mesh-Material an der Unterseite des runden Gestell mit Sekundenkleber (zB Standard Krazy Glue), um ein acht-und Slice-Halter (1G) erstellen. Jedes der gut kann eine einzelne Maus Hippocampus-Scheibe passen.
- Setzen Sie die Scheibe Halter an einem Ende der Inkubation Kammer und der Microloader-Verteilergeräte am anderen Ende. Lassen Sie die Microloader Tipps, um auf dem Boden der Kammer (Abbildung 1H) ruhen. Dieser Aufbau ist so ausgelegt, um eine ausreichende Sauerstoffversorgung zu der Ober-und der Unterseite der akuten Hippocampus zu gewährleisten und zu vermeiden, Blasen kommen direkt unterhalb der Scheibe Halter, um Schnitt Bewegung zu minimieren und den direkten Kontakt der Blasen mit den Hippocampus zu verhindern.
- Der Inkubationskammern Spülen eined Scheibe Halter gründlich mit ddH2O nach jedem Experiment und zu dekontaminieren, mit 70% EtOH wöchentlich. Im Fall von Scheiben Inkubieren in verschiedenen Lösungen werden mehrere Kammern / Scheibe Halter benötigt werden.
2. Solutions und Drogen
- Künstliche Liquor (ACSF): Bereiten 4 l Standard ACSF in ddH2O mit dem folgenden (in mm): 125 NaCl, 2,5 KCl, 2,5 CaCl 2, 1,3 MgCl 2, 1,25 NaH 2 PO 4, 26,0 NaHCO 3, 15 Glukose und 0,1 Trolox. Messung der Osmolarität der Lösung unter Verwendung eines Osmometers, es sollte ~ 310 mOsm kommen. ACSF Zusammensetzungen für die experimentellen Bedingungen sind im Folgenden beschrieben (siehe Protokoll Nr. 3). Alle Lösungen mit einem 0,22 um Flaschenaufsatz-Filter in autoklavierten Glasflaschen. Lösungen sind stabil in 4 ° C für bis zu einem Monat.
- Slicing Puffer: 125 NaCl, 2,5 KCl, 3,8 MgC: mit einer modifizierten ACSF (in mM) Bereiten Scheibenl 2, 1,25 NaH 2 PO 4, 26,0 NaHCO 3, 15 Glucose, Ascorbinsäure und 1,3. Messung der Osmolarität der Lösung unter Verwendung eines Osmometers, es sollte ~ 310 mOsm kommen. Ersatz von CaCl 2 mit MgCl 2 in der Schneidescheibe Puffer verbessert die Gesundheit.
- Sulforhodamin 101 (SR-101, 1 uM) wird verwendet, um Astrozyten in akuten Hippocampus zu identifizieren. Machen Sie eine 1 mM Stamm der SR-101 durch Verdünnen 60.67 mg SR-101 in 100 ml eines modifizierten niedrigen Calcium ACSF als (in mm) folgt hergestellt: 125 NaCl, 2,5 KCl, 0,5 CaCl 2, 6 MgCl 2, 1,25 NaH 2 PO 4, 26,0 NaHCO 3, 15 Glucose, Ascorbinsäure und 1,3. Überprüfen Sie, dass die Osmolarität der niedrigen Calcium ACSF ist ~ 310 mOsm. Verdünnen Sie die 1 mM SR-101 Lager in 1.000-mal geändert niedrigen Ca 2 +-ACSF zum Laden. Bewahren Sie die letzten SR-101-Lösung in 4 ° C und vor Licht geschützt werden, bis für das Experiment benötigt werden.
3. Manipulation von Long Zeit Neuronale Firing Preise in Akute Hippocampus
Verwenden Sie eine der beiden Protokolle Inkubation in getrennten Experimenten zur langfristigen neuronalen Feuerraten zu manipulieren:
- Sperren neuronale Aktivität: Inkubation in Tetrodotoxin (TTX, 1 uM): ACHTUNG: Griff TTX mit Vorsicht, da kann es tödlich sein, wenn in ausreichender Menge aufgenommen werden. Handschuhe und Schutzbrille empfohlen. TTX vollständig abschafft AP-getrieben neuronale Aktivität in der akuten Scheiben schneiden. Scheiben Inkubation in 3,5 mM K + ACSF, plus 1 uM TTX in der experimentellen Zustand. In der Kontrollbedingung, Inkubation Scheiben in 3,5 mM K + ACSF ohne TTX. Der Vergleich zwischen den beiden Bedingungen zeigt das Up-Scaling-Effekt in Astrozyten Gq GPCR-Aktivität. 3,5 mM K + ACSF dient als der Steuerzustand (im Gegensatz zu sagen, 2,5 mM K +), um die Wirkung von TTX Behandlung zu maximieren.
- ODER -
- Steigern neuronale Aktivität überBasalraten: Inkubation in hohen Kalium: Erhöhung der extrazellulären K +-Konzentration depolarisiert Neuronen und erhöht ihre basalen Feuerrate. Inkubation in 5,0 mM K + ACSF Vergleich zu 2,5 mM K + ACSF 15 deutlich erhöht neuronale Aktionspotentialfrequenz. Scheiben Inkubation in 5,0 mM K + ACSF für die Versuchsanlage, und der Kontrollbedingung, Inkubation Scheiben in Standard 2,5 mM K + ACSF. Der Vergleich zwischen den beiden Bedingungen zeigt die Down-Scaling-Effekt in Astrozyten Gq GPCR-Aktivität.
4. Akute hippokampalen Slice-Vorbereitung
- Einrichten der Wärmerückgewinnung Kammer:
- Wärmen Sie das Wasserbad auf 35 ° C, dann legen Sie die vorbereitet Inkubationskammern innen. Füllen Sie den Wasser Badewanne mit Wasser bis zur Höhe des ACSF innerhalb der Inkubation Kammern (1G).
- Oxydieren die Versuchs-und Kontroll ACSF mit 95% O 2, 5% CO 2. Die von der Microloader-Verteilergeräte emittiert Blasen sollte klein und groß, aber auch sanft sein, es sollte jede sichtbare Bewegung von ACSF in der Kammer nicht sein.
- Einrichten des eiskalten Dissektion Kammer:
- Nehmen Sie zwei Eimer Eis. Legen Sie eine Flasche ca. 300 ml Schneiden Puffer in einem Eimer mit Eis und halten Sie es mit Sauerstoff angereichert mit 95% O 2, 5% CO 2 für 20 min. Tauchen Sie ein 100 mm Petrischale in die andere Eiskübel, knapp unter der Oberfläche des Eises. Sicherstellen, dass die Seite der Petrischale befindet sich in direktem Kontakt mit dem Eis. Gießen Sie etwas Slicing-Puffer in die Petrischale und halten Sie es mit Sauerstoff angereichert als gut.
- Kühlen Sie die Schnittkante des Einzel Rasierklinge durch Eintauchen in die eiskalten Slicing Puffer in der Petrischale für mehr als 1 min.
- Vibratom Setup:
- Schalten Sie den Vibratoms und sicherzustellen, dass die Drainage wird geschlossen.
- Sichern Sie die Schneidkammer in der Schwingungstome und Packeis rund um die Schneidkammer. Vorzukühlen es auf 0-4 ° C.
- Entfernen Fabrik Fette aus der Doppel Rasierklinge durch Einweichen in 70% EtOH für 5 min und dann Spülen mit ddH2O. Schneiden Sie es in Hälften vorsichtig (nicht die Klinge verbiegen) und montieren eine Hälfte Klinge auf den Schneideblock.
- Entfernen Sie die Maus Gehirn:
- Anesthetize einen zwölf bis achtzehn Tage alten C57BL/6J Maus in einer kleinen Kammer mit 0,5 ml Isofluran in eine Kimwipe oder Wattebausch getränkt vorinstalliert. Sanft Prise des Tieres Zehen um sicherzustellen, dass es keine Schmerzen Reflex.
- Enthaupten Sie die Maus mit einer scharfen Schere, dann entfernen Sie die Kopfhaut mit kleinen Pinzette. Verwenden Sie kleine Knochen Schere, um den Schädel aus dem Kleinhirn zu den Riechkolben entlang der Längsspalte geschnitten. Entfernen Sie die Hirnlappen mit den kleinen Pinzette. Entfernen Sie vorsichtig das Gehirn mit einem Spachtel, und tauchen sie in den eiskalten sauerstoffhaltigen Slicing-Puffer in der Petrischale.
- Bisect die Mausgehirn mit der gekühlten Rasierklinge in die Petrischale, um mehr Fläche für die Kühlung und die Sauerstoffversorgung zu ermöglichen. Lassen Sie die halbiert Halbkugeln sitzen in der eiskalten Slicing Puffer für 2-3 min. Das Gehirn muss vollständig abgekühlt und fester geworden.
- Tragen Sie eine dünne Schicht der Sekundenkleber auf der Plattform des Vibratom. Kleben Sie beide Hemisphären zur Plattform Schnittseite nach unten und den Seiten bis mit dem Riechkolben nach vorne. Sichern Sie die Plattform in der Schneidkammer, dann füllen Sie den Schneidkammer mit eiskaltem, gut mit Sauerstoff Slicing-Puffer.
- Weiter Sauerstoffanreicherung des Schneidkammer während der Vorbereitung 300 um dicke Scheiben parasagittale mit der Vibratom. Schneiden die Scheiben bei einer Frequenz von 85 Hz, einer Vorwärtsgeschwindigkeit von 0,20 mm / s und einer Amplitude von 1,40 mm. HINWEIS: Wir haben festgestellt, dass die wichtigste Variable in Vorbereitung gesunde akuten Hippocampus ist die Qualität der Vibratom. Unser Labor verwendet die Leica VT 1200 S Magnetic fahren Vibratom mit Vibrocheck bis "z" Vibrationen zu reduzieren.
- Nach dem Schneiden, sezieren den Hippocampus und der angrenzenden entorhinalen Kortex aus jedem parasagittale Scheibe mit scharfen Pinzette. Führen Sie dieses Verfahren in der eiskalten, gut mit Sauerstoff Slicing-Puffer in der Schneidkammer des Vibratom. Die Schärfe der Zange ist, die Scheibe Gesundheit sehr wichtig, da sie die Handhabung der Scheiben minimiert.
- Machen Sie eine Transferpipette durch Abbrechen der langen Spitze einer Glaspasteurpipette und übertraf den defekten Teil mit einer Pipette Glühbirne. Dies ermöglicht die Verwendung des großen Endes der Pipette, um Scheiben zu übertragen. Achten Sie darauf, Pipetten, ohne die Watte in das große Ende zu bestellen (siehe Materialien Tabelle). Als Scheiben in unsterilen Bedingungen hergestellt wird, ist es nicht notwendig, die Pipette vor der Verwendung autoklaviert, obwohl eine neue Pipette hergestellt und für jedes Experiment verwendet werden.
- Übertragen Sie jede Hippocampus-Scheibe an die Inkubation Kammern in der 35 ° C WasserBad, durch Eintauchen des Transferpipette in das ACSF innerhalb jeder Vertiefung der Scheibe Halter und Ansaugen der Scheibe. Minimieren Bewegung der Scheibe während dieses Prozesses. Direkter Transfer der Scheiben zu den warmen Inkubationsbad Ergebnisse in besserer Qualität als Scheiben "Ramping" die Temperatur allmählich auf.
- Lassen Sie die Hippocampus-Schnitten in der warmen Wasserbad für insgesamt 45 min, die sich wie folgt wieder her: Scheiben Inkubation für 20 min in 1 uM SR-101 in niedrigen Calcium ACSF verdünnt, dann übertragen Sie sie auf dem niedrigen Calcium ACSF (ohne SR-101) für 10 min. Anschließend übertragen Sie die Scheiben zu kontrollieren oder zu experimentellen ACSF für die restlichen 15 Minuten des warmen Inkubation.
- Nach 45 min Wärmerückgewinnung sorgfältig bewegen die Inkubationskammern vom 35 ° C Wasserbad der Tisch und dann erlauben die Scheiben weiterhin bei Raumtemperatur insgesamt Inkubationszeit 3 hr bevor Bolus Lade inkubieren Protokoll (siehe unten).
5. Bolus Laden von Astrozyten mit Ca 2 +-Indikator
- Vorbereitung Ca 2 +-Indikator-Farbstoff-Bolus-loading:
- Für jedes Fläschchen Farbstoff (50 ug), fügen 3.87 ml frisches Dimethylsulfoxid (DMSO) und Vortex gründlich. Die Frische der DMSO ist für eine gute Be-und daher jedes Mal knacken einer frischen Ampulle.
- Mix in 9 ul 20% Pluronsäure und gründlich vortexen. Mischen Sie den Farbstoff mit 100 ul der entsprechenden experimentellen oder Kontroll ACSF und Wirbel gut, für eine endgültige Farbstoffkonzentration von 10 uM.
- Die Lösung wird mit einer Zentrifuge Filterrohr. Dieser Schritt verhindert, daß der Lade Pipette Verstopfen beim Ausstoßen des Farbstoffs.
- Vorbereitung einer Pipette aus einem Borosilikatglas Kapillare gezogen, um einen Widerstand von etwa 1,3 M &OHgr;, wenn sie mit Farbstofflösung gefüllt.
- Legen Sie eine Hippocampus-Scheibe in einem Aufnahmeraum für die Verwendung mit dem Mikroskop entwickeltund kontinuierlich mit Sauerstoff angereichert ACSF mit der gleichen Zusammensetzung, die es in (1,5 ml / min) perfundiert inkubiert. Wechseln Sie zwischen Kontroll-und Versuchsbedingungen bei der Auswahl einer Hippocampus-Scheibe.
- Entsorgen ungesund aussehende Hippocampus. Die Qualität der Scheiben wird auch innerhalb einer gegebenen Experiment variieren. Es gibt keine festen Kriterien zur Quantifizierung der Scheibe Gesundheit, daher ist die Bestimmung von Schicht Gesundheit subjektive und meist auf Erfahrung.
- Generell halten Scheiben, die eine glatte Oberfläche erscheinen und einen hohen Anteil an gesunden CA1-Pyramidenzellen (2A) haben. CA1-Pyramidenzellen sind besonders empfindlich und anfällig für CNS Beleidigungen, so dass ein großer Prozentsatz (≥ 75%) der gesunden CA1 Pyramidenzellen kann eine sinnvolle Kriterien für die Annahme oder Ablehnung eine Scheibe sein.
- Entsorgen Sie Scheiben, die etwa> 25% tot Neuronen. Tote Neuronen eine Spiegelei-Aussehen (Abbildung 2B). HINWEIS: Wir hahabe beobachtet, dass der Winkel der Schnitt eine große Rolle, ob in Nervenzellen gesund oder nicht erscheinen spielt. Wenn neuronalen Dendriten nach oben ragenden (von der Scheibe), dann werden die Neuronen meist tot sein. Dies liegt vermutlich daran, wie ein Großteil der Neuronen Volumen innerhalb der dendritischen Struktur enthalten, dass Abtrennen der Dendriten ist tödlich für die Zellen. Auf der anderen Seite, wenn die Dendriten sind parallel oder in einem Winkel nach unten von der Scheibenoberfläche hervorsteht, wird es einen hohen Prozentsatz von gesunden Neuronen. Manchmal daher Neuronen meist tot auf der einen Seite der Scheibe und gesund aussehende auf der anderen Seite zu sein.
- Suchen Sie einen geeigneten Bereich der Astrozyten sr 40-70 um unter der Scheibenoberfläche basierend auf Größe, Morphologie und Lage mit Differentialinterferenzkontrast (DIC)-Optik.
- Legen Sie die Glaspipette mit Farbstofflösung und senken Sie es an die Oberfläche der Scheibe über diesem Bereich mit einem Standard-Patch-Clamp-Mikroelektrode holder. Mit der Pipette an der Oberfläche der Scheibe, gelten wieder Druck auf die Pipette, um Farbausstoß beginnen. Auswurf der Farbstoff wird unter beiden DIC-Optik und einem geeigneten Laser, wie ein 488-Linie für einen grünen Farbstoff sichtbar sein.
- Langsam absenken Pipette etwa 40 um unten Slice Oberfläche mit einem Mikromanipulator und erlauben der Farbstoff ca. 45-60 sec auszuwerfen. Dann senken Sie die Pipette eine zusätzliche 35 um (75 um unter Scheibenoberfläche) und Auswerfen Farbstoff für ca. 45-60 Sekunden. Langsam einfahren Pipettenspitze von der Scheibe. Kürzere Einspritzzeit wird wahrscheinlich in unzureichender Farbstoffbeladung führen, während längere Einspritz neigt dazu, im Hintergrund zu laden, das Signal-zu-Rausch-Verhältnis der Aufnahme verringert erhöhen.
- Um sicherzustellen, dass eine große Anzahl von Astrozyten nehmen den Farbstoff, ist es meist hilfreich, um einen zweiten Farbstoff-Bolus weit entfernt injizieren. Heben Sie die Pipette wieder an die Oberfläche der Scheibe, stellen Sie sicher, dass die Pipette nicht verstopft ist, dann move Pipette ca. 80-100 &mgr; m entfernt von der ersten Injektionsstelle entlang des Stratum radiatum. Wiederholen Bolus-Injektion auf dieser Website.
- Lassen Sie ca. 30-45 min vor Bildgebung für die Astrozyten, sich der Farbstoff und für die Hintergrundsignal zu verringern. Lassen Sie die Scheibe in der Perfusionskammer während dieser Zeit. Stellen Sie sicher, dass dieser Inkubationszeit wird in den insgesamt 4 h Behandlung des Experiments gebaut. Erhalten Sie die nächste Scheibe und wiederholen Sie die Schritte 5,2-5,8.
6. Aufnahme Spontan und Gq GPCR-Agonisten-evozierte Astrozytäre Ca 2 + Aktivität im Hippocampus
- Einrichten des konfokalen Mikroskop zur Abbildung:
- Begrenzung Scheibe Bestrahlung mit Laserlicht ist von größter Bedeutung, da hohe Exposition kann zu Bleich-und / oder Phototoxizität führen zu färben. Mit höheren optischen Vergrößerung oder eine erhöhte Zoom-Einstellung erhöht die Lichtexposition des abgebildeten Feld. Daher werden die Standardwerte für jeden Laser zu einem hohen Photomultiplier setting, 1x Verstärkung und 0,5% Laserausgangsleistung.
- Tragen Sie eine 1,5-fach-Zoom für eine bessere Visualisierung der Astrozyten-Prozessen.
- Setzen Sie das Feld Auflösung auf 512 x 512 Pixel.
- Stellen Sie die Scan-Geschwindigkeit zu den schnellsten möglich, was ist ~ 1,2 s pro Scan mit der Einbahnstraße Scan-Modus.
- Sammeln Emissionsspektren unter Verwendung von Bandpassfiltern 503 bis 548 nm für 488 nm-Laser und von 624 bis 724 nm für den 559-nm-Laser. Diese Einstellungen ermöglichen die Abbildung von einem Feld von ~ 5-8 Astrozyten mit einer relativ schnellen Geschwindigkeit bei einer Auflösung ausreicht, um Astrozyten Zellkörper und Hauptprozesse beobachten. Idealerweise Astrozyten im Feld wird hell genug, um deutlich zu sehen, aber ohne Pixelsättigung.
- Bestätigen der Identität der Zellen mit Ca 2 + beladen als Astrozyten Farbstoff durch die Visualisierung des SR-101 colabeling Verwendung des 559 nm-Lasers.
- Aufnahme Astrozyten Ca 2 +-Aktivität:
- Draw-Boxen mit der Bildaufnahme-Software über Regionen von Interesse (ROIst) innerhalb der Zelle, in diesem Fall über Astrozyten Zellkörpern. Die Boxen sollten keine Hintergrundpixel, um die beste Signal-zu-Rausch-Verhältnis zu erzielen. Zeichnen Sie eine Box auf Hintergrund als Referenz.
- Schalten Sie die Perfusion experimentellen ACSF plus 1 uM TTX (Abcam) durch den Rest des Experiments. Dadurch werden alle möglichen neuronalen AP-getrieben Astrozyten Kalzium Antworten. Rest steigt in Astrozyten Ca 2 +-Konzentration wird dann durch Quanten vesikulären Freisetzung konstitutive (basal) GPCR-Aktivität oder eine Kombination beider Mechanismen.
- Rekord Fluoreszenz mit der Zeit aus allen ROIs. Erhöhungen der Fluoreszenz über die Grundlinie zeigen Erhöhungen der cytoplasmatischen Ca 2 +-Konzentration 16 und damit GPCR-Aktivität in Astrozyten 10, 17, 18. Um mögliche Auswirkungen auf die frühen Skalierung Astrozyten Rezeptoren durch TTX vermeiden, komplett Experimente innerhalb von 40 min abom die Zeit, wenn die 1 uM TTX Perfusion begann.
- Nach Erhalt der Grundlinie 10 Min. Aufzeichnung der spontanen Ca 2 +-Aktivität gelten einen Agonisten von Interesse (wie DHPG) bei sequentiell steigenden Konzentrationen. Lassen Sie mindestens 5 Minuten zwischen den Anwendungen auf mögliche Rezeptor-Desensibilisierung zu reduzieren.
- Am Ende der Aufnahme, gelten ein Cocktail von Agonisten für andere Astrozyten Gq GPCRs als positive Kontrolle für intakte Astrozyten Gq GPCR-Signalwege. Komponenten des Agonisten Cocktail auf dem Rezeptor von Interesse abhängen. 10 &mgr; M von jedem der Gq GPCR-Agonisten Histamin, Carbachol und ATP-2Na, Histamin-H1-Rezeptor stimulieren [H1R] muskarinischen Acetylcholin-Rezeptoren [mAChR] und purinerger [P2YR] bzw. ist eine häufig verwendete Agonist Cocktail.
- Post-Experiment Bildaufnahme:
- Bei der Beendigung des Ca 2 +-Aufnahme, nehmen Standbildern mit 488 nm und 559 nm Laser, foder später Bestätigung der Identität Astrozyten-und ROI-Platzierung. Laserleistung und HV-Einstellungen können frei an dieser Stelle geändert werden, um ein optimales Bild zu erhalten, für die Co-Lokalisation, denn es ist nicht mehr eine Sorge über Laserlichtintensität, die die Daten (2A).
- Wiederholen Sie die Schritte 6.1-6.3 für insgesamt ca. 8 Scheiben schneiden und 40 Astrozyten / group. Scheiben sollten von einem Minimum von 3 verschiedenen Mäusen zu kommen.
7. Analyse der Astrocyte Ca 2 + Aktivität
- Definieren eines Ca 2 + Höhe: Standardisierung bei der Definition Ca 2 +-Transienten wurde nicht fest innerhalb der wissenschaftlichen Gemeinschaft etabliert. Was folgt, ist ein typisches Protokoll, Empfindlichkeit maximiert, während die Begrenzung Erkennung von falsch positiven Ereignisse aus der Basislinienrauschen.
- Haben ein anderes Mitglied Labor jede Scheibe einen numerischen Code zuweisen, um sie blind zu analysieren. Am Ende der Analyse, zu decodieren jede Scheibe.
- Analysieren spontane und evozierte Astrozyten Ca 2 +-Erhöhungen offline mit Bildanalyse-Software. Neu zeichnen und / oder die Größe, die Form und die Lage der ROIs, wie gewünscht.
- Score Erhöhungen in der Fluoreszenzintensität über die Grundlinie als Ca 2 +-Erhöhung, wenn die Spitzenamplitude von mehr als zwei Standardabweichungen (SD) oberhalb des Mittelwerts von 30 Sekunden des durchschnittlichen Grundlinienfluoreszenz für mindestens zwei aufeinanderfolgenden Abtastpunkten. In besonders lauten Aufnahmen (Low-Signal-zu-Rauschen), müssen diese Kriterien zu 3 SD über dem Mittelwert Fluoreszenzbasis eingestellt werden. Definiert den Beginn jedes Ca 2 + Höhe wie der letzten Datenpunkt, bevor die Fluoreszenzintensität einer Standardabweichung über dem Mittelwert überschreitet.
- Unterscheiden Sie zwischen Multipeak vs aufeinanderfolgenden Einzel-Peak-Events. Note ein Ereignis als "Multipeak", wenn die Fluoreszenzintensität nicht zum Ausgangswert (Baseline-Wert unter dem Durchschnitt +2 SD) für & Rückgabe# 8804; 9 aufeinanderfolgende Datenpunkte (10,8 sec) zwischen Spitzen. So werden einzelne Spitze Ereignisse 10 oder mehr aufeinanderfolgende Ausgangsdatenpunkte in-zwischen ihnen.
- Bewerte Ereignisse als Antworten "Plateau"-Typ, wenn die Fluoreszenzintensität hält Spitze-Amplitude (± 10% der Spitzenwert) für mindestens 3,6 Sekunden.
- Analysieren der Amplitude, Frequenz und die Kinetik der spontanen und Agonisten hervorgerufenen Calcium Transienten.
- Definieren Spitze-Amplitude des Ca 2 + Höhe wie der Datenpunkt mit der höchsten Intensitätswert (in Fällen von "Multipeak"-Antworten verwenden Sie den ersten Höhepunkt, siehe Abbildung 2B).
- Berechnen Anstiegszeit als der Unterschied zwischen der Antwort und dem Beginn der Zeit, die der Spitzenamplitude. HINWEIS: 0 bis 100% Anstiegszeit können müssen, um verwendet werden, um eine ausreichende Anzahl von Datenpunkten haben, um eine Zeitwert zu erhalten; Scan-Geschwindigkeit ist eine wichtige Variable hier.
- Berechnen Latenz als die Zeitzwischen dem Beginn der Perfusion Agonisten zu Beginn der Reaktion. Die Anstiegszeit kann eine weitere sinnvolle Maßnahme in Hirnschnitten, solange waschen-in-Zeiten schaffen eine verwechseln bei der Berechnung Latenzzeiten.
- Bestimmen, ob es signifikante Unterschiede zwischen den beiden Gruppen für jeden Parameter unter Verwendung unabhängiger t-Student-Test. Verwenden Anzahl der Astrozyten als 'n'. Verwenden Sie Chi-Quadrat-Test nach Pearson, die Ca 2 +-Aktivitätsmuster zwischen Kontroll-und Behandlungsgruppen zu vergleichen. Genaues 2-Tail-Fisher-Test, um bestimmte Prozentsätze Ca 2 +-Aktivitätsmuster zwischen Kontroll-und Behandlungsgruppen zu vergleichen. Ausdruck Unterschiede * p <0,05, ** p <0,01, *** und p <0,001.
Ergebnisse
Repräsentative Ergebnisse in Abbildung 3 zeigen die Wirkung der Inkubation von akuten Maus Hippocampus in TTX für 4-6 h auf sr Astrozyten Ca 2 +-Aktivität. Die Daten umfassen sowohl spontane Ca 2 +-Transienten und DHPG-evozierte Gruppe I mGluR Ca 2 +-Antworten, von den Scheiben in Steuer ACSF vs ACSF zzgl. TTX inkubiert. Anders als Grund charakteristischen morphologischen Merkmale, sternförmigen Prozess der Montage und kleine Soma Größe (~ 10 um), sind Astrozyten im sr durch Überlagerung der Ca 2 +-Indikator-OGB 1.00 mit der selektiven Astrozyten-Marker SR-101 19, 20 (identifiziert Figur 3A). Die nummerierten Boxen über Astrozyten Zellkörper entsprechen den nummerierten Fluoreszenz über in 3B gezeigt Zeitspuren. Die Gruppe 1 mGluR Agonisten (RS)-3.5-DHPG wird angewandt, um die spezifischen Auswirkungen auf die Skalierung der Gruppe 1 mGluRs in Astrozyten zu bestimmen. Um zwischen phys. diskriminiereniology in der Spezifität von dem Skalierungseffekt Gruppe 1 mGluRs im Vergleich zu anderen GPCRs Gq wird ein Cocktail von Agonisten am Ende jedes Experiments angewandt. Hier haben wir jede der 10 uM Gq GPCR-Agonisten Histamin, Carbamylcholin Chlorid (Carbachol) und Adenosin-5'-ATP-Dinatrium (Na-ATP). Der Agonist Cocktail dient auch als eine positive Kontrolle, um lebensfähige, reaktions Astrozyten in Fällen, in denen Zellen nicht auf DHPG reagieren identifizieren, vermutlich, weil diese insbesondere Astrozyten exprimieren keine ausreichenden Mengen des Rezeptors, eine Antwort zu entlocken DHPG.
Wir verwendeten verschiedenen Konzentrationen von DHPG einschließlich 5 um und 15 um (Fig. 3B) sowie 30 und 50 &mgr; m (4A) in offenbaren Veränderungen Astrozyten Gruppe I-mGluRs unterstützen. Die Beziehung zwischen zelluläres Ca 2 +-Antworten und Gq GPCR-Expressionsniveaus zuvor in vitro 21-24 untersucht worden. Erstens, dieSchwelle zu einer bestimmten Konzentration des Agonisten zu reagieren, hängt von der Dichte der Rezeptoren, die durch jede Zelle exprimiert. In einer Population von Zellen, mehr Zellen reagieren mit einem Ca 2 +-Erhebung in einer bestimmten Konzentration an Agonist, wenn die Zellen mit höherer Dichte von Rezeptoren transfiziert. Nach Inkubation Scheiben in TTX der Prozentsatz von Astrozyten in der Population reagieren, um eine feste Konzentration des Agonisten erhöht (Fig. 3B und 3C). Wir haben festgestellt, dass 5 um und 15 um DHPG zeigen deutliche Unterschiede im Anteil der reaktions Astrozyten zwischen der Steuerung und TTX behandelten Zellen, während 30 und 50 uM DHPG sind erforderlich, um der Gruppe I mGluR Antworten in 5,0 mM K + behandelt vs Kontrolle zu vergleichen Zellen (Fig. 4A).
Die Beziehung zwischen Astrozyten Ca 2 +-Antwort-Muster und Agonistenkonzentration wurde auch in situ untersucht. Die Erhöhung der AgonistenKonzentration verschiebt sich das Muster der Ca 2 +-Antwort in Astrozyten aus einzelnen Peak Ca 2 +-Anstiege auf Multipeak und Plateau-Ca 2 +-Erhebungen 25-27. Auf der Grundlage dieser früheren Befunden, sagten wir voraus, dass die Antwort-Muster auf einer einzigen Konzentration des Agonisten wird zu verschieben, wenn es Veränderungen in der Höhe der Rezeptorexpression. Somit kann in Abhängigkeit davon, welche der beiden Skalierungsverfahren wird verwendet (Hemmung neuronale Aktivität oder Erhöhung it) wird die Konzentration des Agonisten erforderlich, um eine bestimmte Antwort-Muster erzeugen zu erhöhen oder zu verringern. Zum Beispiel, Astrozyten in TTX inkubiert verlagern ihre DHPG-evozierte Ca 2 +-Antwort-Muster, mehr Plateau-Typ-Ca 2 +-Erhöhungen und reagieren auf Agonist-Konzentrationen im Vergleich zu Astrozyten (3C) steuern senken. Unter Berücksichtigung der früheren Studien legen diese Beobachtungen nahe, dass die Gruppe I mGluR Rezeptor-Expressionsniveaus in Astrozyten erhöht.
Anstiegszeit und dem Beginn (Latenz) der Ca 2 +-Erhöhungen haben auch gezeigt, direkt auf Änderungen Gq GPCR-Expressionsniveaus in kultivierten Zellen 22-24 korrelieren. Höhere Rezeptorexpressionsniveaus führen zu kürzeren Latenzzeiten und schnellere Anstiegszeiten während die Reduktion der Rezeptordichte erzeugt den gegenteiligen Effekt. Für Astrozyten in TTX, Ca 2 +-Transienten inkubiert durch Anwendung von DHPG evozierte deutlich schnellere Anstiegszeiten im Vergleich zu Astrozyten in Steuer ACSF (3D) inkubiert. Wie zuvor erwähnt, Amplituden-Agonisten hervorgerufene Ca 2 +-Antworten bleiben unverändert, unabhängig von der Konzentration des Agonisten oder des Skalierungsmodell 15 (Fig. 3D).
Neben den direkt aktivierende Gruppe beobachteten Veränderungen mGluRs ich mit DHPG, spontan Astrozyten Ca 2 +-Aktivität wird auch wesentlich durch diese Manipulation betroffen. Wir beobachtenda 2,26-fachen Anstieg des Anteils der spontan aktiven Astrozyten in TTX versus Kontrolle inkubiert. Dies ist ein Anstieg von nur 12,9% der Kontroll Astrozyten zeigen spontane Aktivität im Soma auf 42,1% in der TTX inkubiert Astrozyten (3E). Da es bekannt ist, dass GPCRs weisen "intrinsische" oder konstitutive Aktivität in Abwesenheit von Agonist 21, 26, 28, und dass das Niveau dieser intrinsischen Aktivität mit zunehmender Rezeptorexpressionsniveaus, legen diese Daten nahe, dass die Dichte der Astrozyten Gq GPCRs Erhöhungen folgende langfristige Reduktion der neuronalen Aktionspotential Brand. Ähnlich Agonisten hervorgerufenen Reaktionen werden die Anstiegszeiten der spontanen Ca 2 + Erhebungen erhöht (Fig. 3E).
Repräsentative Daten unter Verwendung des zweiten Protokolls, die Inkubation in erhöhten extrazellulären Kalium (5,0 mM) wird in Fi dargestelltengure 4. Eine Erhöhung der extrazellulären K + 2,5-5,0 mM zu einer signifikanten Zunahme der basalen CA3-Neuronen Aktionspotentialfrequenz 15. Höhere Konzentrationen von DHPG (30 um und 50 um) sind, um der Gruppe I mGluR Ca 2 +-Antworten von den Astrozyten in hohen Kalium (4A und 4B) inkubiert evozieren erforderlich. Dies ist konsistent mit einem reduzierten Niveau der Gruppe I mGluR Reaktionsfähigkeit in Astrozyten nach einer langfristigen Steigerung der neuronalen Aktionspotentiale. Darüber hinaus ist die evozierte Antwortmuster auf einen festen Konzentration von DHPG verschiebt plateauartigen Reaktionen auf schwächere Einzelpeak-Reaktion (Fig. 4B). Prüfung der Prozentsatz spontan aktiven Astrozyten in den beiden Kalium Bedingungen zeigt, dass weniger Astrozyten in hohem K + inkubiert Vergleich zu der Kontrollgruppe (Fig. 4C) werden spontan aktiv. Dieser Effekt ist in der opposite Richtung des TTX Zustand, in dem der Prozentsatz von Astrozyten zeigen spontane Ca 2 + Erhebungen erhöht wird. Last, hervorgerufen sowohl spontane und Ca 2 +-Erhebungen langsamer Anstiegszeiten in Astrozyten in hoher K + gegenüber der Kontrollbedingung (4C und 4D) inkubiert. Insgesamt legen diese Daten nahe, dass Astrozyten Gq GPCR-Expressionsniveaus skala bidirektional abhängig von der Höhe der neuronalen Aktionspotenzial Aktivität über einen längeren Zeitraum.

Fig. 1 ist. Scheibe Inkubationsraum Herstellung und eingerichtet. (A) Die Schublade Teil einer Pipette Lagerbehälter Brinkmann zusammen mit seiner luftdichten Deckel wird die Scheibe Brutraum zu konstruieren. (B) DRillen ein Loch in der Seite des Behälters etwa 1 ¼ von oben und ¼ von der Seite. Fit in einem Schlauchstück. (C) Verbinden der Microloader-Verteilervorrichtung an das eine Ende des flexiblen Schlauchs. Hinweis cut-to-fit Natur 200 ul Pipettenspitze (weißer Pfeil). (D) Sechs 20 ul Eppendorf Microloader geschnitten-to-fit zu einer Eins-zu-sechs Line-Verteiler, um eine Microloader-Verteilergeräte erstellen. (E) Bohren zwei kleine Löcher auf dem Deckel. (F) Ein Floating-Rack-Blase für die Herstellung der Scheibe Halter. (G) Die unteren "Beine" des Schwimmblase Zahnstange entfernt, so dass ein Stück Nylonmaschenmaterial kann mit dem Boden verklebt werden. (H) Füllen Sie den Brutraum mit einer ausreichenden Menge von ACSF, so dass die Scheibe Halter schwimmt. Stellen Sie die Schlauchlänge, so dass die Spitzen der Microloader kann an einer Ecke der Kammer Boden ruhen. Wenn Sie das Brutraum indas Wasserbad, sollte der Wasserstand in der Badewanne auf dem gleichen Niveau wie der ACSF in der Kammer sein. Klicken Sie hier für eine größere Ansicht.
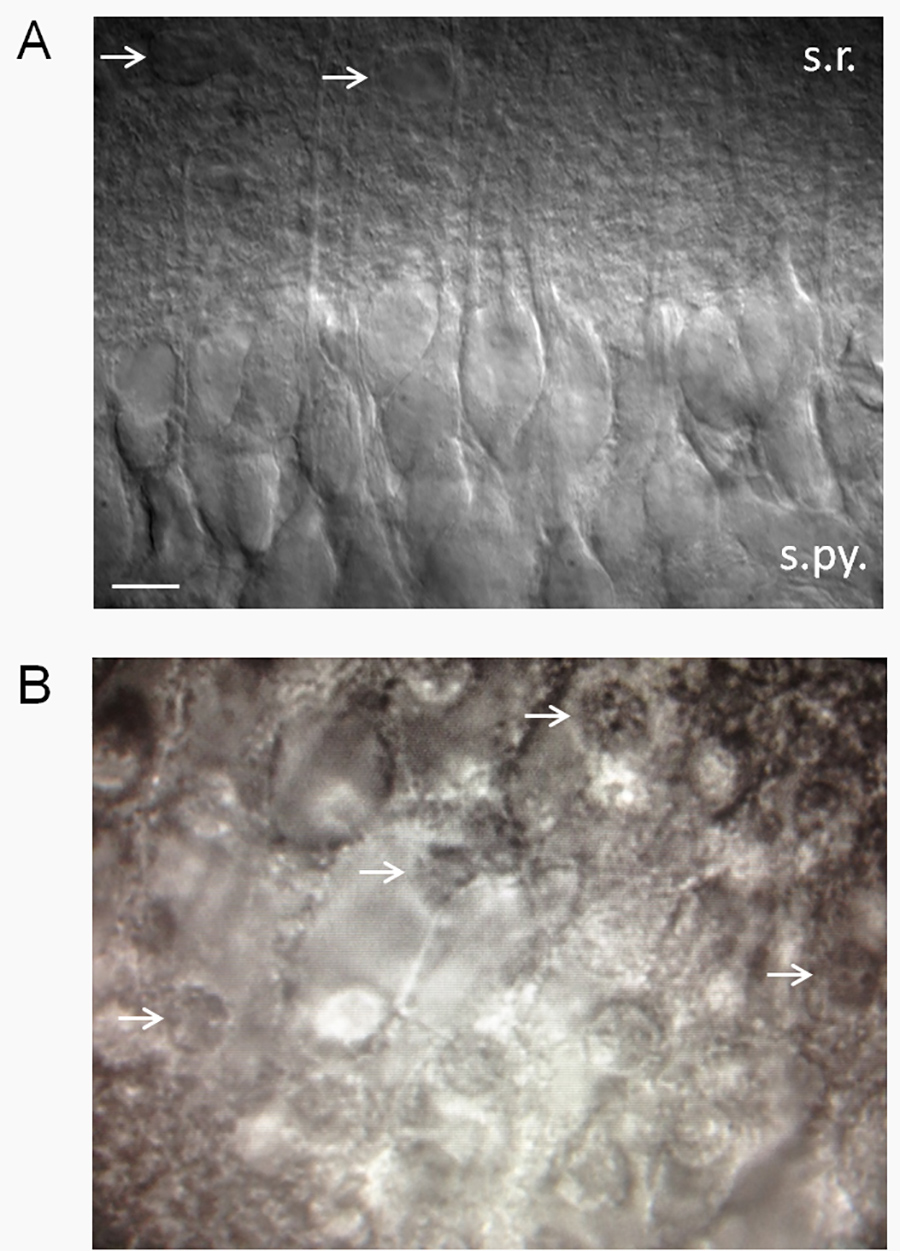
2. Die Einschätzung der Scheibe Gesundheit. (A) Eine gesunde aussehende Hippocampus-Scheibe mit Differentialinterferenzkontrast (DIC)-Optik. Gesunde Scheiben haben eine glatte, samtig Aussehen und einen hohen Anteil an gesunden CA1 Pyramidenzellen. Beachten Sie die apikalen Dendriten in Stratum radiatum vorsteht. Patch-Clamp von Neuronen, die wie die hier gezeigt aussehen zeigen einen niedrigen Ruhemembranpotential (-61 bis -62 mV) in Standard 2,5 mM K + ACSF mit wenigen spontanen Aktionspotentiale. Membranpotentials und Feuerraten als Funktion von Ex variierenzellulären K + (Xie et al. 15). Pfeile zeigen auf vermeintliche Astrozyten. Abkürzungen: sr, stratum radiatum; s.py., Stratum pyramidale. Maßstabsbalken, 10 um. (B) Ungesunde Scheiben haben einen hohen Prozentsatz an Toten CA1 Pyramidenzellen, die das Aussehen von gebratenen Eiern (weiße Pfeile zeigen auf Kerne von toten Neuronen - das "Eigelb" der Spiegelei) haben. Klicken Sie hier für eine größere Ansicht.
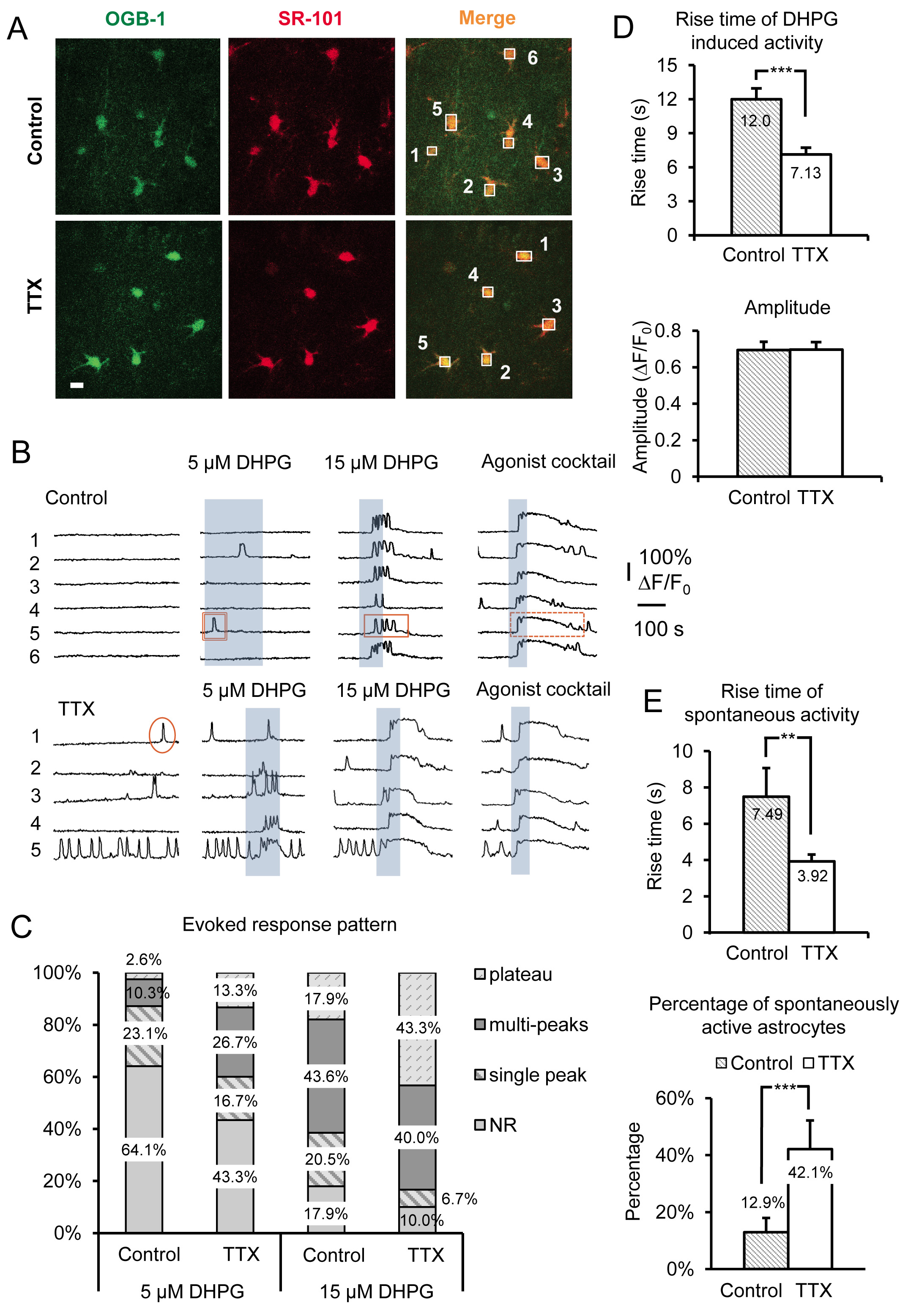
3. Aufnahme verstärkt Gq GPCR-Aktivität und evozierte Gruppe I mGluR Ca 2 +-Antworten nach Langzeit Hemmung der neuronalen APs durch Inkubation in TTX. (A) Repräsentative Bilder der Zellen in der Aufzeichnungsfeld in C inkubiertontrol Bedingungen (obere Felder) oder im TTX (untere Felder), die bis Oregon Green BAPTA-01.00 Ca 2 +-Indikator-Farbstoff (linke Felder) und SR-101 (Mitte Panels) genommen haben. Maßstabsbalken 10 um. Overlay der beiden Signale ("Merge") zeigt, dass Astrozyten Last mit Ca 2 +-Indikator. Die Boxen sind über die einzelnen Astrozyten soma gezogen, um Fluoreszenzintensität über die Zeit in den grünen Kanal aufzeichnen, um Ca 2 +-Aktivität in Astrozyten zu überwachen. (B) Probe Spuren von den Registrierkassen in A) von Ca 2 +-Aktivität in den Astrozyten. Astrozyten in TTX-Show inkubiert erhöhte spontane Aktivität und robuster evozierte Gruppe I mGluR Ca 2 +-Antworten, wie durch Änderungen in der Reaktionsmuster belegt. Beispiele einzelner Peak (Kreis), Multipeak (Rechteck) und Plateau (gestrichelte Rechteck) Ca 2 +-Transienten werden angezeigt. (C) Änderungen im Reaktionsmuster sind besonders deutlich mit verschiedenen concentRationen der Gruppe I mGluR Agonisten DHPG. Mehr Multipeak und Plateau-Antworten sind nach Inkubation in TTX im Vergleich zur Kontrolle zu einem bestimmten Agonisten-Konzentration deutlich. (D) Anstiegszeiten von DHPG-evozierte Ca 2 +-Antworten werden schneller in Astrozyten in TTX inkubiert Vergleich zur Kontrolle (oben), während die Amplituden ändern sich nicht (unten), was der "Alles-oder-nichts"-Antwort-Amplituden einmal die Schwelle zu reagieren erreicht wurde. (E) Anstiegszeiten der spontanen Astrozyten Ca 2 +-Transienten sind auch schneller in TTX vs Kontrolle inkubiert Astrozyten (oben), während der Anteil der Astrozyten in der Bevölkerung zeigen spontane Gq GPCR Ca 2 +-Aktivität steigt (unteres Bild). Klicken Sie hier für eine größere Ansicht.

4. Aufnahme vermindert Astrozyten Gq GPCR-Aktivität und evozierte Gruppe I mGluR Ca 2 +-Antworten folgende langfristige Steigerung der neuronalen APs durch Inkubation in erhöhten extrazellulären Kalium. (A) Repräsentative Spuren von Astrozyten Ca 2 +-Aufnahmen von den Scheiben in 5,0 mM K + ACSF inkubiert Neuronen zu depolarisieren und erhöhen ihre basalen Feuerrate im Vergleich zu ACSF (2,5 mM K + ACSF) zu steuern. Astrozyten mit 5,0 mM K + ACSF weisen weniger spontane somatische Ca 2 +-Transienten und schwächer DHPG inkubiert hervorgerufenen Reaktionen im Vergleich zu Astrozyten in Steuer ACSF inkubiert. (B) Ein Vergleich von Mustern hervorgerufenen Reaktionen auf mehrere Konzentrationen von DHPG zeigt schwächere Antworttypen nach langfristiger Anstieg der neuronalen APs. (C) Eine Verringerung des Anteils der Astrozyten im povölkerung spontane Ca 2 +-Aktivität zeigt nach langfristigen Inkubation in erhöhter K + beobachtet, verglichen mit ACSF (oben) steuern, während Anstiegszeiten der spontanen Aktivität langsamer werden (unten). (D) Anstiegszeiten der evozierten Astrozyten Ca 2 +-Reaktionen auf verschiedene Konzentrationen von DHPG langsamer folgenden 5,0 mM K + Behandlung im Vergleich zu Astrozyten in Steuer ACSF inkubiert. Klicken Sie hier für eine größere Ansicht.
Diskussion
Die beschriebenen Skalierung Modelle stellen praktische Methoden für die Erforschung von Langzeitplastizität von Astrozyten Gruppe I mGluRs. Imaging spontane und evozierte Ca 2 +-Ereignisse können empfindlicher Test für die Messung von Veränderungen in Astrozyten Gq GPCR-Aktivität, als feste Beweise wurde festgestellt, dass Astrozyten Ca 2 +-Erhöhungen treten nach der Entlassung von IP 3 R empfindlichen Läden hinter der Gq GPCR-Aktivierung 10, 12, 17, 18. Der Anteil der Astrozyten in der Bevölkerung reagiert auf Gruppe I mGluR-Agonisten und dem Muster solcher Ca 2 +-Antworten berichten Veränderungen in der Gruppe I mGluRs von Astrozyten.
Die spezifische Technik zur Astrozyten mit Ca 2 +-Indikator zu laden ist eine wichtige Überlegung bei der Gestaltung von Experimenten, um Änderungen in Astrozyten Gq GPCR-Aktivität zu suchen. Bolus-loading-oder Masse-Laden mehrerer Astrozyten oder pATCH-Clamp-Belastung der einzelnen Astrozyten, um die Bild Ca 2 +-Transienten in Astrozyten verwendet werden. Jeder Ansatz bietet gewisse Vorteile und Nachteile. Direktes Füllen Astrozyten mit Ca 2 +-Indikator durch Patch-Clamp ermöglicht eine eindeutige Identifikation der Zelle als Astrozyten ohne Notwendigkeit eines sekundären Marker, wie SR-101. Patch-Clamp Lieferung der Anzeige ermöglicht auch die Aufnahme von Ca 2 +-Aktivität von Astrozyten kleine Fächer mit den buschigen feinen Prozesse, möglicherweise tiefer in der Scheibe, wo Zellen sind gesünder und mit mehr intakt Interaktionen mit Synapsen (abhängig von der Laserleistung verfügbar). Jedoch leidet Patch-Clamp-Beladung von geringem Durchsatz, da die Daten zu einem Zeitpunkt einer Zelle gesammelt. Massenlade hingegen ermöglicht eine große Anzahl von Astrozyten mit Ca 2 +-Indikator beladen und gleichzeitig abgebildet werden. Jedoch nur Astrozyten in der Nähe der Oberfläche (<20 &mgr; m) der Scheibe geladen sind, zugeordnet Anliegens über die Zellgesundheit und intakte Synapsen.
Die hier vorgestellte Gegendruck Bolus-loading-Protokoll bietet einen Mittelweg, mit relativ hohen Durchsatz und die Fähigkeit, Ca 2 +-Aktivität zu überwachen tiefer innerhalb der Scheibe (40-75 um). Im Vergleich zu Massenbeladung Ein signifikanter Anstieg im Prozentsatz der spontan aktiven Astrozyten mit der Bolus-Beladungstechnik beobachtet, was darauf hindeutet, dass die Verbindungen zwischen neuronalen Synapsen und die Astrozyten Prozesse voll 15. Mit guten Laden, kann man oft beobachten Ca 2 +-Aktivität in Hauptprozesse von Astrozyten (Daten nicht gezeigt) oder möglicherweise sogar kleinere Fächer mit 2-Photonen-Mikroskopie. Allerdings wäre Pflege brauchen, um bei der Zuordnung der kleinere Prozesse zu einem bestimmten Astrozyten ausgeübt werden, da die Grenzen in die unspezifische Hintergrundfärbung mischen. Eine weitere Sorge mit der Verwendung von Großlade-oder Bolus-Ladeverfahren ist die Notwendigkeit für eine sekundäre marker für Astrozyten Identifikation. Während es schon seit vielen Jahren bekannt, dass Astrozyten bevorzugt nehmen AM Ester Ca 2 +-Indikatoren wird die Sekundär Marker SR-101 häufig verwendet, um die geladenen Zellen als Astrozyten zu überprüfen. SR-101 kann in sich selbst verändern die innere Erregbarkeit von Neuronen 29. Verwendung von SR-101 bestätigt die Notwendigkeit, alle Astrozyten Ca 2 +-Messungen in TTX durchführen, um mögliche SR-101 Effekte auf die neuronale Erregbarkeit zu begrenzen. Unter der Annahme, dass sowohl Kontroll-und Versuchsgruppen schließen SR-101, sollte der Marker an sich nicht für die in Astrozyten-Ca 2 +-Signal beobachteten Effekte nach der Langzeitmanipulation neuronaler Aktionspotentiale zu berücksichtigen. SR-101 kann mehr ein Anliegen sein, in hohen K + Experimente aber, wie kann es den Unterschied zwischen 2,5 mM K + vs reduzieren 5,0 mM K +, wenn die basale Feuerrate ist nicht proportional geändert.
Ein sehr vielversprechender Ansatz für die Ca 2 + liefern Anzeige Astrozyten hat vor kurzem entstanden, die eine attraktive Alternative zu den traditionellen Ansätzen bietet mit Ca 2 +-Farbstoffe. Bedeutende Fortschritte wurden in den letzten Jahren mit genetisch kodierte Kalzium-Indikatoren (GeCIS) Astrozyten 30-32 gezielt gemacht worden. GeCIS können Astrozyten durch in vivo-Mikroinjektion von Adeno-assoziierten viralen Vektoren in einer Hirnregion von Interesse, wie dem Hippocampus geliefert. Die Expression von GeCIS nach etwa zwei Wochen nach Virusinfektion 32 erreicht. Es gibt zahlreiche Vorteile durch die Verwendung von GeCIS in Astrozyten gekennzeichnet. Zuerst werden die Vektoren in Astrozyten mit einem Astrozyten-spezifischen Promotor richtet, so dass die markierten Zellen Astrozyten 32. Zweitens, das Signal-zu-Rausch scheint nun vergleichbar zu dem, was mit Patch-Clamp-Lieferung von Farbstoff erhalten werden, jedoch ohne die Invasivität, die eine Patchpipette auf die Zelle 32 hatte. Drittens können die Indikatoren sein delivered und in der Erwachsenengewebe, das mit Bulk-Loading-Versandmethoden problematisch ist, ausgedrückt. Weiterhin ist der Ausdruck Mosaik, bietet die Möglichkeit, unter mehreren Astrozyten differenzieren. So können mehrere Astrozyten potenziell gleichzeitig abgebildet werden, während die Aufnahme auch im Soma und feine Ästchen in der gleichen Zeit. Daher könnte eine einzige Technik, die in Platz drei separate Verfahren (bulk-loading, Bolus-Laden und Patch-Clamp-Belastung) verwendet werden, um die Skalierung Aktivität der Astrozyten Gq GPCRs aufzeichnen, Effizienz deutlich erhöht werden.
Ein möglicher Nachteil der Verwendung von viral-vermittelte Abgabe von Ca 2 +-Indikatoren Astrozyten die möglichen Auswirkungen auf die Gesundheit Scheibe 32. Die Adeno-assoziierte virale Vektoren verwendet, um die GeCIS liefern haben bereits gezeigt worden, um reaktive Gliose der Astrozyten 33 verursachen. Herstellung von Hirnschnitten im Allgemeinen wahrscheinlich initiiert frühen Stadien der Pathologie einschließlich der Freisetzung von inflammatory 10 Moleküle. Daher kombiniert mit den langen Inkubationszeiten erforderlich, um die Skalierung der Astrozyten-Rezeptoren induzieren, die Verwendung von GeCIS Verwendung viraler Vektoren geliefert müssten zusätzliche Gegenleistung im Rahmen von Schicht Gesundheit in dieser Art von Experimenten zu erhalten.
Bei der Verwendung dieses Protokoll, ist es wichtig zu beachten, dass der Antrag für die Zeit, um eine Antwort Agonisten produzieren wird als Funktion des Rezeptors Verfügbarkeit variieren. Für eine gegebene Konzentration des Agonisten wird die Anwendungszeit muss länger sein, wenn Rezeptoren unten skaliert kürzer, und wenn Rezeptoren haben, skaliert für das Medikament, eine angemessene Konzentration im Gewebe an Rezeptoren ausreichend zu aktivieren, um eine Ca 2 + zu erzeugen erreichen Antwort. Daher können Arzneimittel Anwendungszeiten und möglicherweise ihre Konzentrationen müssen in Abhängigkeit von der beabsichtigten Richtung der Skalierung eingestellt werden. Zum Beispiel muss die Agonistenkonzentration in der C abgesenktase von TTX zu vermeiden Sättigung Reaktionen und erhöhte nach Inkubation Scheiben in hohen K + noch eine Antwort finden. Insbesondere wurde die DHPG-Konzentration von 5 bis 15 uM nach TTX-Behandlung auf 30-50 uM nach 5,0 mM K + Behandlung, um die Ca 2 +-Antwort-Muster zu untersuchen, wie 5-15 uM war oft zu gering, um zuverlässige Antworten in verschobene Astrozyten nach Verkleinerung der Gruppe I mGluRs.
Aufzeichnung von Astrozyten Ca 2 +-Aktivität bietet keinen direkten Beweis von Rezeptor Internalisierung Einsetzen oder zu oder von der Plasmamembran. Jedoch, bezogen auf die bemerkenswerte Ähnlichkeit der Daten mit Daten aus früheren Untersuchungen in vitro, die die direkte Beziehung zwischen Gq GPCR-Expressionsniveaus und spontane sucht und evozierte Ca 2 +-Transienten 21-24, die logische Interpretation der Änderungen der Ca 2 + Signalisierung, daß die Astrozyten-Oberflächenrezeptor-Expressionsniveaus habengeändert. Ein komplementärer Ansatz kann ein wichtiger Aspekt sein, wenn man will, um zusätzliche Erkenntnisse über den Ort der Wirkung auf die Ca 2 +-Aktivität liefern. Eine Strategie, die wir verwendet wurde, um die Wirkung von TTX Inkubation auf Hippocampus von Astrozyten MrgA1R Mäusen zu untersuchen. Diese transgenen Mäuse exprimieren einen Fremd Gq GPCR (die MrgA1R) nur in Astrozyten. Da dieser Rezeptor nicht heimisch an das Gehirn, gibt es keinen endogenen Neurotransmitter vorhanden, seine Aktivität zu ändern. Frühere Arbeiten vorgeschlagen, dass dieser Rezeptor die gleiche intrazelluläre Signalmoleküle als endogene Gruppe I mGluRs in den gleichen Astrozyten 34 greift. Nach Langzeit-Inkubation von Scheiben von MrgA1R Mäuse in TTX, keine Unterschiede in der Agonisten-evozierte MrgA1R Antworten im Vergleich zu Kontrolle inkubiert Wurfscheiben wäre nachzuweisen, dass die Wirkung auf Astrozyten aufgrund von Änderungen an der Oberfläche lokalisierten Rezeptor Ca 2 +-Aktivität, vor allem wenn Gruppe I mGluR Antworten sind immer noch significantly in den gleichen Astrozyten verbessert. Eine alternative, wenn auch komplizierter Strategie wäre, Astrozyten aus den Scheiben für die Western-Blot-Analyse zu isolieren, solange einer Membranfraktion kann für Änderungen der Oberflächenrezeptorexpressionsniveaus analysiert. Fluoreszenz-aktivierte Zellsortierung (FACS) oder Durchflusszytometrie kann hier hilfreich sein.
Die möglichen Anwendungen dieser Technik auf die Untersuchung von Neuronen, Astrozyten und Astrozyten-neuronalen Interaktionen viele. In unseren Experimenten nur DHPG-evozierte Gruppe I mGluR Astrozyten Ca 2 +-Antworten untersucht wurden, in isolierten akuten Hippocampus von jungen Mäusen. Diese Vorbereitung hat nicht nur die intakten Afferenzen (Schaffer-Kollateralen), aber auch die Nervenzellen, die Anlass zu ihnen (CA3 Pyramidenzellen), so dass es möglich ist, die Feuerraten dieser glutamatergen Neuronen auf die postsynaptischen Zellen (CA1-Pyramidenzellen) zu manipulieren und die Astrozyten in Stratum radiatum deren Prozesse verbundee mit diesen Synapsen. Die akute Hippocampus-Scheibe ist vielleicht nicht die beste Vorbereitung für die Manipulation von Feuerraten von anderen Arten von Neuronen zu sein, aber, wie viele Afferenzen aus den Neuronen, die Anlass zu ihnen abgebrochen. Dennoch kann es in bestimmten Schnittpräparate sein, Plastizität der anderen Astrozyten Gq GPCR-Subtypen zu beobachten. Zum Beispiel könnte Scheiben mit cholinergen Neuronen des basalen Vorderhirns und ihre Projektionen hergestellt intakt Hippocampus. Inkubation dieser Scheiben in TTX oder erhöhter K + würde basalen Feuerraten von cholinergen Neuronen beeinflussen, was zu Skalierung mAChRs in Astrozyten des Stratum oriens, die einen wesentlichen Anteil des cholinergen Eingang 1 empfangen. Ein alternativer Ansatz für die noch nicht erprobt Astrozyten-Rezeptor-Skalierung in einem bestimmten Bereich des Gehirns, mit allen Verbindungen intakt studieren, während die Skalierung auftritt, könnte es sein, ein in vivo-Modell, bei dem eine anhaltende Freisetzung von TTX durch Implantation eines plast erreicht verwendenic Polymer Elvax 40W oberhalb der interessierenden Region 35. Dieser Ansatz wurde bereits in einer Studie von neuronalen Skalierung verwendet worden, aber sollte auch auf Astrozyten Skalierung sein. Schließlich, mit der richtigen Anzeige, zukünftige Studien könnten andere GPCR Familien, einschließlich der Änderungen in G s oder G i GPCRs zu untersuchen. Man könnte Astrozyten GABA B G vorherzusagen i GPCRs zu folgenden Hemmung der Brenn lokal vorstehende GABA Inter innerhalb einer Schnittpräparat betroffen sein. Entwicklung neuer Indikatoren, die gegen andere Signalmoleküle, wie eine Echtzeit-Anzeige der zweiten Botenstoffes cAMP, die Öffnung für ein völlig neues Gebiet der Forschung auf Neuron-zu-Astrozyten-Rezeptor-Kommunikation.
Bidirektionale Skalierung der Astrozyten mGluRs durch Manipulation der basalen Neuronenfeuerraten liefert ein Maß für die Empfindlichkeit der Astrozyten auf AP-vermittelte Freisetzung von Neurotransmitter. Astrozyten kann offenbar spüren spontanen APs und glutamate Freisetzung bei Schaffer Sicherheiten-CA1-Pyramidenzellen Synapsen auch bei extrazellulären K + ist in einem physiologischen Bereich. Während akute Anwendung der TTX ist die Häufigkeit der spontanen Astrozyten Ca 2 +-Aktivität 18, 36, 37, die Ca 2 +-Aktivität unter den Astrozyten in der Bevölkerung wird entkorreliert 36, den Nachweis, dass Astrozyten Rezeptoren sind AP-Detektoren nicht zu reduzieren. Dies deutet darauf hin, dass Astrozyten spüren spontanen neuronalen APs mit auf ihre Gesamt Ca 2 +-Aktivität nicht beeinflussen. Es wird allgemein akzeptiert, dass die intrazelluläre Konzentration von IP 3 benötigen, um einen Schwellenwert zu IP 3 Rs stimulieren ausreichend, um eine nachweisbare Ca 2 +-Erhöhung führen zu erreichen. Könnte spontanen neuronalen APs aktivieren Astrozyten GPCRs, ohne messbare Ca 2 +-Erhöhungen? Zukünftige Studien könnten Fluoreszenz-Resonanz-Energie-Transfer (FRET) oder eine ähnliche techn nutzen ique (wie BRET), um die Beziehung zwischen G-Protein-Kopplung an den Rezeptor (ein Maß für die Rezeptoraktivierung) und Ca 2 +-Freisetzung aus internen Speichern zu prüfen. BRET wurde ausführlich in vitro verwendet werden, um G-Protein-zu-GPCR-Kupplung 38 zu erkennen, auch wenn es einige Zeit dauern, bis diese Technologie wird für die Verwendung in intakten Gewebepräparate zur Verfügung. Es ist möglich, dass Astrozyten Gq GPCRs ist viel häufiger als mit der aktuell verfügbaren Ca 2 +-Imaging Werkzeuge aufgezeichnet werden aktiviert. Neben der Erfassung von Aktionspotentialen, können Astrozyten Gq GPCRs auch in der Lage, Miniatur-Quanten Freisetzung von Neurotransmitter zu erfassen, wie in einer aktuellen Studie 39 gemeldet werden. Die hier beschriebene bidirektionale Skalierungsverfahren kann in zukünftigen Studien genutzt werden, um ein Maß für den Umfang, in dem Astrozyten Gq GPCRs erkennen Quanten vesikulären Freisetzung von Neurotransmitter, indem Bafilomycin A1 im Inkubationsprotokoll bieten.
ntent "> So weit die Skalierungs Protokolle nur im Hippocampus von jungen Mäusen (p12-p18) verwendet worden. Daher ist es zur Zeit nicht bekannt, ob Astrozyten-Rezeptor-Skalierung könnte auch von erwachsenen Mäusen Gewebe induziert werden. Eine überzeugende neue Studie legt nahe, dass Gruppe I mGluR Expression in Astrozyten verringert erheblich nach der ersten Woche und weiter bis ins Erwachsenenalter zurückgehen, mit einem sehr niedrigen Niveau von Rezeptor-Expression in adulten Astrozyten 40. Es wäre daher interessant sein, festzustellen, ob Astrozyten mGluRs skalieren nach Lang tige Hemmung der neuronalen Erregung bei erwachsenen Hippocampus der Maus auf Werte, die denen in Astrozyten von jungen Mäusen gesehen. Dieser Befund legt nahe, dass Astrozyten-Rezeptor-Expression ist nicht statisch in einem bestimmten Alter, sondern kann schnell je nach Höhe des neuronalen Aktivität zu verändern. Im Gegensatz zu verminderte Expression von Gruppe I mGluRs in erwachsenen Mäusen, die Beweise ab, dass adrenergen Rezeptoren, einschließlich & #945; 1A, 2A α und β 1-Subtypen, werden überwiegend durch Astrozyten im Gehirn von Erwachsenen 3, 4 ausgedrückt. Die α 1A-adrenergen Gq GPCR kann ein attraktives Ziel für zukünftige Studien der Neuron-zu-Astrozyten-Kommunikation, einschließlich, ob diese Rezeptoren empfindlich auf Veränderungen der adrenergen Neuronenfeuerraten sein.Offenlegungen
Die Autoren möchten sich offenbaren, dass die Tetrodotoxin in diesen Studien verwendet wurde aus Abcam gekauft. Abcam nicht im Bereich der Hypothesen, Design, oder eine Sammlung von Daten. Die gesamte Kommunikation über das Sponsoring der Arbeit von Abcam trat nach dem Peer-Review-Prozess abgeschlossen war.
Danksagungen
Die Autoren bedanken sich bei UC Riverside Center for Neuronal Gliazellen-Interaktionen für wertvolle Diskussion der Skalierung Protokolle und Daten zu bestätigen. Die Autoren möchten auch ein aufrichtiges Dankeschön an Abcam für das Sponsoring der Veröffentlichung ihrer Arbeit zu geben.
Materialien
| Name | Company | Catalog Number | Comments |
| Chamber Supplies | |||
| Brinkmann pipette storage container | Fisher Scientific | 03-491 | Use the drawer portion as the incubation chamber |
| Electrical drill | |||
| Flexible tubing | Tygon | R-3603 | |
| Silicone seam sealant | Also called aquarium seam sealer | ||
| Gas tank | 95% oxygen, 5% carbon dioxide | ||
| Natural beveled pipette tip | USA Scientific | 1111-1000 | Cut-to-fit to connect oxygenate lines |
| One-to-six lines manifold | Warner Instruments | 64-0210 (MP-6) | For the microloader-manifold apparatus |
| Microloader | Eppendorf | 5242 956.003 | For the microloader-manifold apparatus, cut-to-fit |
| Floating Bubble Rack | Bel Art Scienceware | F18875-0400 | For slice holder |
| 600 µm Sefar Nitex Nylon mesh | ELKO Filtering Co. | 06-600/51 | For slice holder |
| Krazy Glue | For slice holder | ||
| Reagents | |||
| Isoflurane | Baxter | 1001936060 | |
| NaCl | Fisher | S271-3 | |
| KCl | Fisher | P333-500 | |
| CaCl2 | Fisher | C79-500 | |
| MgCl2 | Fisher | M33-500 | |
| NaH2PO4 | Fisher | S369-500 | |
| NaHCO3 | Fisher | S233-500 | |
| Glucose | Fisher | Fisher | |
| (±)-6-Hydroxy-2,5,7,8- tetramethylchromane-2-carboxylic acid (Trolox) | Acros Organics | 53188-07-1 | |
| Ascorbic acid | Acros Organics | 401471000 | |
| Tetrodotoxin citrate (TTX) | Abcam | ab120055 | |
| Sulforhodamine 101 (SR-101) | Sigma-Aldrich | 284912 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Pluronic Acid F-127 | Invitrogen, Molecular Probes | P6867 | |
| Oregon Green 488 BAPTA-1 AM *cell permeant (special packaging) | Invitrogen, Molecular Probes | O6807 | |
| (RS)-3,5-DHPG | Abcam | ab120020 | |
| Histamine | Sigma-Aldrich | H7125 | |
| Carbamoylcholine chloride (Carbachol) | Sigma-Aldrich | C4382 | |
| Adenosine 5’-ATP disodium (Na-ATP) | Sigma-Aldrich | A7699 | |
| Dissection Tools | |||
| Single-edge razor blade | GEM | 62-0161 | For bisection |
| Double edge razor blade | TED PELLA, INC. | 121-6 | For cutting slices |
| Mayo Scissors, supercut | WPI | 14010-15 | For decapitation |
| Fine iris scissors, straight | Fine Science Tools | 14094-11 | For cutting the skull |
| Iris forceps, curved | WPI | 15915 | To remove the skin and skull |
| Small spatula | To remove/transfer the brain | ||
| Dumostar Dumont #5 Biologie Tip forceps | Fine Science Tools | 11295-10 | For hippocampus dissection |
| Glass Pasteur pipette | Fisher | 13-678-20B | For transferring brain slices |
| Pasteur pipette rubber bulb | Fisher | 03-448-22 | For transferring brain slices |
| Polystyrene 100 mm tissue culture dishes | Corning | 25020 | |
| Vibratome | Leica | VT 1200S | |
| Water bath | Fisher | ISOTEMP 210 | For warm incubation |
| Micropipette puller | Narishige | PC-10 | For bolus-loading pipette |
| Confocal microscope | Olympus | Olympus Fluoview 1000 | |
| Low Profile Open Diamond Bath Imaging Chamber with PM-1 platform | Warner Instruments | RC-26GLP | diamond bath with low profile |
| Borosilicate glass pipette | World Precision Instruments | TW150F-4 | For bolus-loading pipette |
| Micromanipulator | Sutter Instrument | ROE-200 | For bolus-loading pipette |
| Spin-X centrifuge tube filter with 0.22 µm cellulose acetate | Costar | 8161 |
Referenzen
- Araque, A., Martin, E. D., Perea, G., Arellano, J. I., Buno, W. Synaptically released acetylcholine evokes Ca2+ elevations in astrocytes in hippocampal slices. J. Neurosci. 22, 2443-2450 (2002).
- Navarrete, M., Araque, A. Endocannabinoids mediate neuron-astrocyte communication. Neuron. 57, 883-893 (2008).
- Bekar, L. K., He, W., Nedergaard, M. Locus coeruleus alpha-adrenergic-mediated activation of cortical astrocytes in vivo. Cereb. Cortex. 18, 2789-2795 (2008).
- Hertz, L., Lovatt, D., Goldman, S. A., Nedergaard, M. Adrenoceptors in brain: cellular gene expression and effects on astrocytic metabolism and Ca2. Neurochem. Int. 57, 411-420 (2010).
- Porter, J. T., McCarthy, K. D. Hippocampal astrocytes in situ respond to glutamate released from synaptic terminals. J. Neurosci. 16, 5073-5081 (1996).
- Bernardinelli, Y., et al. Astrocytes display complex and localized calcium responses to single-neuron stimulation in the hippocampus. J. Neurosci. 31, 8905-8919 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Wang, X., et al. Astrocytic Ca2+ signaling evoked by sensory stimulation in vivo. Nat. Neurosci. 9, 816-823 (2006).
- Fiacco, T. A., Agulhon, C., McCarthy, K. D. Sorting out astrocyte physiology from pharmacology. Annu. Rev. Pharmacol. Toxicol. 49, 151-174 (2009).
- Agulhon, C., et al. Calcium Signaling and Gliotransmission in Normal vs Reactive Astrocytes. Front. Pharmacol. 3, 139 (2012).
- Nedergaard, M., Verkhratsky, A. Artifact versus reality--how astrocytes contribute to synaptic events. Glia. 60, 1013-1023 (2012).
- Nizar, K., et al. In vivo stimulus-induced vasodilation occurs without IP3 receptor activation and may precede astrocytic calcium increase. J. Neurosci. 33, 8411-8422 (2013).
- Sutton, M. A., et al. Miniature neurotransmission stabilizes synaptic function via tonic suppression of local dendritic protein synthesis. Cell. 125, 785-799 (2006).
- Ibata, K., Sun, Q., Turrigiano, G. G. Rapid synaptic scaling induced by changes in postsynaptic firing. Neuron. 57, 819-826 (2008).
- Xie, A. X., et al. Bidirectional scaling of astrocytic metabotropic glutamate receptor signaling following long-term changes in neuronal firing rates. PLoS ONE. 7, (2012).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol. Rev. 79, 1089-1125 (1999).
- Petravicz, J., Fiacco, T. A., McCarthy, K. D. Loss of IP3 receptor-dependent Ca2+ increases in hippocampal astrocytes does not affect baseline CA1 pyramidal neuron synaptic activity. J. Neurosci. 28, 4967-4973 (2008).
- Nett, W. J., Oloff, S. H., McCarthy, K. D. Hippocampal astrocytes in situ exhibit calcium oscillations that occur independent of neuronal activity. J. Neurophysiol. 87, 528-537 (2002).
- Garaschuk, O., Milos, R. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1, 380-386 (2006).
- Nimmerjahn, A., Kirchhoff, F., Kerr, J. N., Helmchen, F. Sulforhodamine 101 as a specific marker of astroglia in the neocortex in vivo. Nat. Methods. 1, 31-37 (2004).
- Prezeau, L., et al. Changes in the carboxyl-terminal domain of metabotropic glutamate receptor 1 by alternative splicing generate receptors with differing agonist-independent activity. Mol. Pharmacol. 49, 422-429 (1996).
- Shao, Y., McCarthy, K. D. Quantitative relationship between alpha 1-adrenergic receptor density and the receptor-mediated calcium response in individual astroglial cells. Mol. Pharmacol. 44, 247-254 (1993).
- Wang, S. S., Thompson, S. H. Measurement of changes in functional muscarinic acetylcholine receptor density in single neuroblastoma cells using calcium release kinetics. Cell Calcium. 15, 483-496 (1994).
- Ostasov, P., Krusek, J., Durchankova, D., Svoboda, P., Novotny, J. Ca2+ responses to thyrotropin-releasing hormone and angiotensin II: the role of plasma membrane integrity and effect of G11alpha protein overexpression on homologous and heterologous desensitization. Cell Biochem. Funct. 26, 264-274 (2008).
- Shelton, M. K., McCarthy, K. D. Hippocampal astrocytes exhibit Ca2+-elevating muscarinic cholinergic and histaminergic receptors in situ. J. Neurochem. 74, 555-563 (2000).
- Hermans, E., Challiss, R. A. Structural signalling and regulatory properties of the group I metabotropic glutamate receptors: prototypic family C G-protein-coupled receptors. Biochem. J. 359, 465-484 (2001).
- Zur Nieden, R., Deitmer, J. W. The Role of Metabotropic Glutamate Receptors for the Generation of Calcium Oscillations in Rat Hippocampal Astrocytes In Situ. Cortex. 16 (5), 676-687 (2005).
- de Ligt, R. A., Kourounakis, A. P., AP, I. J. Inverse agonism at G protein-coupled receptors: (patho)physiological relevance and implications for drug discovery. Br. J. Pharmacol. 130, 1-12 (2000).
- Kang, J., et al. Sulforhodamine 101 induces long-term potentiation of intrinsic excitability and synaptic efficacy in hippocampal CA1 pyramidal neurons. Neuroscience. 169, 1601-1609 (2010).
- Tong, X., Shigetomi, E., Looger, L. L., Khakh, B. S. Genetically encoded calcium indicators and astrocyte calcium microdomains. Neuroscientist. 19, 274-291 (2013).
- Akerboom, J., et al. Optimization of a GCaMP Calcium Indicator for Neural Activity Imaging. J. Neurosci. 32, 13819-13840 (2012).
- Shigetomi, E., et al. Imaging calcium microdomains within entire astrocyte territories and endfeet with GCaMPs expressed using adeno-associated viruses. J. Gen. Physiol. 141, 633-647 (2013).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nat. Neurosci. 13, 584-591 (2010).
- Fiacco, T. A., et al. Selective stimulation of astrocyte calcium in situ does not affect neuronal excitatory synaptic activity. Neuron. 54, 611-626 (2007).
- Echegoyen, J., Neu, A., Graber, K. D., Soltesz, I. Homeostatic plasticity studied using in vivo hippocampal activity-blockade: synaptic scaling, intrinsic plasticity and age-dependence. PLoS One. 2, (2007).
- Aguado, F., Espinosa-Parrilla, J. F., Carmona, M. A., Soriano, E. Neuronal activity regulates correlated network properties of spontaneous calcium transients in astrocytes in situ. J. Neurosci. 22, 9430-9444 (2002).
- Takata, N., Hirase, H. Cortical layer 1 and layer 2/3 astrocytes exhibit distinct calcium dynamics in vivo. PLoS ONE. 3, e2525 (2008).
- Salahpour, A., et al. BRET biosensors to study GPCR biology, pharmacology, and signal transduction. Front. Endocrinol. 3 (105), (2012).
- Di Castro, M. A., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat. Neurosci. 14, 1276-1284 (2011).
- Sun, W., et al. Glutamate-dependent neuroglial calcium signaling differs between young and adult. Science. 339, 197-200 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten