Method Article
Склонение пластичности астроцитов рецепторов манипуляциями нейронных уровней расхода топлива
В этой статье
Резюме
Здесь мы опишем адаптацию протоколов, используемых для индукции гомеостатическую пластичность нейронов для изучения пластичности астроцитарных G-белком. Недавно используется, чтобы исследовать изменения в астроцитов группы I мГлуР у мышей в отношении несовершеннолетних, метод может быть применен для измерения масштабирование различных астроцитарных GPCRs, в ткани из взрослых мышей в месте и в естественных условиях, и, чтобы получить лучшую оценку чувствительности астроцитарных рецепторов на изменения в активности нейронов.
Аннотация
Около двух десятилетий исследований было установлено, что астроциты в месте и в естественных условиях выразить многочисленные G-белком рецепторы (GPCR), что может стимулироваться нейронально-переносчика. Тем не менее, способность астроцитов рецепторов проявляют пластичность в ответ на изменения в активности нейронов уделяется мало внимания. Здесь мы описываем модель системы, которую можно использовать в глобальном масштабе вверх или вниз астроцитов группы I метаботропных глутаматных рецепторов (мГлуР) при острых срезах мозга. Включены методы о том, как подготовить парасагиттальных срезах гиппокампа, построить камер, пригодных для долгосрочного ломтик инкубации в двух направлениях манипулировать нейронов действий потенциал частоты, нагрузки астроциты и астроцитов процессы с флуоресцентным Са 2 + индикатор, и измерить изменения в астроцитов Gq GPCR деятельности по записи спонтанной и вызвала астроцитов Ca 2 + события с помощью конфокальной микроскопии. В сущности, "кальций гoadmap "является предусмотрено как измерить пластичность астроцитарных GPCRs GQ. Обсуждается применение метода для изучения астроцитов. Имея понимание того, как астроцитов сигнализации рецептора зависит от изменений в активности нейронов имеет важные последствия как для нормальной синаптической функции, а также процессов, лежащих неврологических расстройств и нейродегенеративных заболеваний.
Введение
Астроциты реагировать в течение нескольких секунд стимуляции нейронов или аксонов с увеличением цитоплазмы Ca 2 + в результате почти исключительно из активации астроцитов GPCRs GQ. Например, мускариновых рецепторов ацетилхолина 1, рецепторы каннабиноидов 2, α 1A адренорецепторов 3, 4, и группа Я мГлуР (см. ниже) все астроцитарных Gq GPCR подтипы, что остро реагируют на нейронной активности. Активация астроцитов группа I мГлуР было продемонстрировано наиболее широко, после стимуляции нейронных глутаматэргических афферентов на месте (например, острых срезах гиппокампа) 5-7, а также в коре головного мозга взрослой мыши в естественных следующее сенсорной стимуляции 8. Итогом активации астроцитов Gq GPCR сигнализации по биологии и физиологии астроциты, нейроны, или астроцитов-нейронных взаимодействий был предметом дискуссий 9-12. Это будет сОме время перед функцией сигнализации рецепторов нейронов-на-астроцитов в полной мере оценили.
Хотя ясно, что нейроны могут активировать астроцитов рецепторы использованием экспериментальных протоколов, есть аспекты нейрон-на-астроцитов рецепторов связи, которые остаются мало изучены. Во-первых, фактическое количество нейронной активности, необходимой для активации астроцитов Gq GPCRs не четко определены, и, во-вторых, способность астроцитов рецепторов выставлять использование зависит от пластичности уделяется мало внимания. Для начала, чтобы ответить на эти вопросы, мы недавно разработали протокол, чтобы побудить двунаправленную масштабирование астроцитов группы I мГлуР в острых несовершеннолетних срезах гиппокампа в ответ на долгосрочные изменения в нейронной потенциала действия (AP)-зависимых синаптической активности. Подобно тому, что было обнаружено для двунаправленного гомеостатического пластичности нейронов ионотропных рецепторов глутамата 13, 14, астроцитов группы я мГлуР расширению масштабов FOllowing блокада нервных потенциалов действия и уменьшать, когда нейронов потенциал действия частота увеличивается 15. Эти компенсационные изменения в астроцитарных рецепторов может быть измерена путем записи спонтанной и вызвала астроцитов Са 2 + переходных и сравнения свойств этих событий, чтобы те из астроцитов в контрольных условиях. В этой рукописи, мы опишем полную методологию для использования этого протокола, включая подготовку острых срезов гиппокампа, условий инкубации индуцировать астроцитов рецептора масштабирование, астроцитов Са 2 + индикатор загрузки краситель, Ca 2 + методы визуализации с использованием конфокальной микроскопии, и ожидаемые эффекты на астроцитов Gq GPCR деятельности. Прогнозируемые воздействия на астроцитов Ca 2 + сигнальные свойства - те, которые соответствуют предварительно записаны в культивируемых клетках, трансфецированных различных уровней экспрессии Gq GPCRs - предоставить «дорожную карту», которую можно использовать в дальнейших исследованиях для анализа изменений в качествеtrocytic выражение ХВГФ. Последствия и возможные приложения для использования этой техники будет способствовать нашему пониманию астроцитов-нейронов взаимодействий в здоровой и больного мозга.
протокол
Следующие процедуры были одобрены на Институциональная уходу и использованию животных комитета в Университете Калифорнии, Риверсайд на.
1. Строительство инкубации палаты и Slice держатель
- Построение инкубационный камеру: Построить инкубационный камеру от материала, который является нетоксичным. Убедитесь в том, что камера контролирует циркуляцию воздуха, имеет достаточное количество ACSF для держателя ломтик плавать, и достаточно большой, так что держатель кусочек может плавать на одном конце камеры, а дисперсия газа из кислородных линий происходит при Другой конец. Выдвижной ящик часть пипетки хранения контейнера с ее герметичной крышкой (рис. 1А) соответствует этим критериям хорошо.
- Просверлить маленькое отверстие на боковой стороне контейнера около 1 ¼ дюйма от верхней и ¼ от стороны. Установите кусок гибкой трубки через отверстие (рис. 1В). Будь осторожен, чтобы развернуть достаточно низко, так что трубка не будет сжат, когда крышка закрыта, все же достаточно высока, так что над раствором.
- Нанести силиконовый герметик на шов ("аквариум шов герметик"), чтобы создать водонепроницаемое уплотнение между кислородной линии и камерой.
- Подключите «вне» конец трубки к бензобак (95% кислорода, 5% углекислого газа) с использованием мужской Люэровский соединитель. Для пользовательских нужным, вырезать по подходят естественный скошенную 200 мкл пипетки (рис. 1С).
- Подключите "внутри" конец трубки к линии пластиковой коллекторе один-к-шести. Вырезать к монтажу шесть 20 мкл Эппендорф советы microloader пипеток для каждого коллектора входе (рис. 1D). Штраф открытие microloaders идеально подходит для производства устойчивый поток мелких пузырьков.
- Для обеспечения вентиляции, пробурить две крошечные отверстия на крышке контейнера (рис. 1E).
- Построение ломтик чстарше: Держатель ломтик сделан из Плавучий Bubble Rack (Рисунок 1F).
- Снимите нижнюю "ноги" пузыря стойке, и вырезать сверху примерно 1 ¾ дюйма
- Клей кусок сетки материала нейлона к нижней части круглого стойке с помощью цианакрилатный клей (например, стандартной Krazy клей), чтобы создать держатель ломтик восемь-а (рис. 1 г). Каждый хорошо может поместиться один мыши гиппокампа ломтик.
- Установите держатель среза на одном конце инкубационного камерой и microloader-многообразие аппарата на другом конце. Разрешить советы microloader отдыхать на полу камеры (рис. 1Н). Эта установка предназначена для обеспечения достаточной оксигенации в верхней и нижней части острых срезах гиппокампа, и, чтобы избежать пузырьков выходит непосредственно под держателем среза, с тем чтобы свести к минимуму перемешивание среза и предотвратить непосредственный контакт с пузырьками срезах гиппокампа.
- Промыть инкубатореТщательно держатели д ломтик с DDH 2 O после каждого эксперимента, и обеззараживать с 70% этанола в неделю. В случае инкубации срезов в различных растворах, держатели несколько камер / срез будет необходимо.
2. Решения и наркотики
- Искусственный спинномозговой жидкости (ACSF): Подготовка 4 л стандартного ACSF в DDH 2 O, используя следующие (в мм): 125 NaCl, 2,5 KCl, 2,5 CaCl 2, 1,3 MgCl 2, 1,25 NaH 2 PO 4, 26,0 NaHCO 3, 15 глюкозу и 0,1 Trolox. Измерьте осмолярность раствора с помощью осмометр; он должен прийти до ~ 310 мОсм. ACSF композиции для экспериментальных условиях, описаны ниже (см. протокол 3). Фильтр все решения с помощью бутылки верхнюю фильтр 0,22 мкм в автоклаве стеклянных бутылках. Решения стабильны в 4 ° С на срок до одного месяца.
- Нарезки буфера: Подготовка ломтики с использованием модифицированного ACSF содержащий (в мм): 125 NaCl, 2,5 KCl, 3,8 MGCл 2, 1,25 NaH 2 PO 4, 26,0 NaHCO 3, 15 глюкозы и 1,3 аскорбиновая кислота. Измерьте осмолярность раствора с помощью осмометр; он должен прийти до ~ 310 мОсм. Замена CaCl 2 с MgCl 2 в буфере нарезки улучшает здоровье ломтик.
- Сульфородамина 101 (SR-101, 1 мкМ) используется для идентификации астроциты в острых срезов гиппокампа. Сделать 1 мМ запас SR-101 путем разбавления 60,67 мг SR-101 в 100 мл модифицированной ACSF низкий кальция, полученный следующим образом (в мМ): 125 NaCl, 2,5 KCl, 0,5 CaCl 2, 6 MgCl 2, 1,25 NaH 2 PO 4, 26,0 NaHCO 3, 15 глюкозы и 1,3 аскорбиновая кислота. Убедитесь, что осмолярность низкой ACSF кальция составляет ~ 310 мОсм. Развести 1 мм SR-101 Stock 1000 раз в модифицированной низкой Са 2 + ACSF для погрузки. Хранить окончательный SR-101 раствор в 4 ° С в защищенном от света, пока это необходимо для эксперимента.
3. Манипуляция LОнг срок нейронов стрельбы цены при остром срезах гиппокампа
Используйте один из двух протоколов инкубации в отдельных экспериментах манипулировать долгосрочные нейронные теплотехнической:
- Запрет нейронов стрельбы: Выдержите в тетродотоксин (ТТХ, 1 мкм): ВНИМАНИЕ: Ручка ТТХ с осторожностью, поскольку это может привести к летальному исходу, если его проглотить в достаточных количествах. Перчатки и очки рекомендуются. ТТХ полностью отменяет AP-приводом нейронов стрельбу в острых ломтиками. Выдержите кусочки в 3,5 мм K + ACSF, плюс 1 мкМ ТТХ в экспериментальных условиях. В состоянии управления, инкубировать ломтики в 3,5 мм K + ACSF без ТТХ. Сравнение между двумя условиях выявляет эффект до-масштабирования в астроцитов деятельности Gq GPCR. 3,5 мМ K + ACSF служит в качестве контрольной группы (в отличие от сказать, 2,5 мМ К +), чтобы максимизировать эффект лечения ТТХ.
- ИЛИ -
- Увеличение нейронов стрельбы вышебазальные ставки: инкубируют в высокой калия: Увеличение внеклеточной концентрации К + деполяризует нейронов и увеличивает их базальную скорость стрельбы. Инкубационный в 5,0 мм K + ACSF значительно повышает нейронов потенциала действия частоту по сравнению с 2,5 мм K + ACSF 15. Инкубируйте срезов в 5,0 мМ К + ACSF для экспериментальных услови х, так и для контрольной группы, инкубировать ломтиками в стандартном 2,5 мМ K + ACSF. Сравнение между двумя условиях выявляет эффект вниз масштабирования в астроцитов деятельности Gq GPCR.
4. Острая гиппокампа ломтик Подготовка
- Настройка теплый камеру восстановления:
- Нагрейте на водяной бане до 35 ° С, затем поместите приготовленные инкубаторе внутри. Заполните водяной бане с водой до высоты ACSF в инкубаторе (рис. 1G).
- Кислородсодержащих экспериментальной и контрольной ACSF с 95% О 2, 5% CО 2. Пузырьки, испускаемые из microloader-многообразие аппарата должны быть небольшими и много, а также нежный; не должно быть видимых движение ACSF внутри камеры.
- Настройка ледяной рассечение камеру:
- Возьмите два ведра льда. Поместите бутылку около 300 мл нарезки буфер в один ведро льда и держите ее кислородом с 95% O 2, 5% CO 2 в течение 20 мин. Погрузите 100 мм чашки Петри в другой ведро со льдом, чуть ниже поверхности льда. Убедитесь, что сторона чашки Петри находится в непосредственном контакте со льдом. Налейте немного нарезки буфер в чашку Петри и держать его кислородом, а также.
- Охладите режущую кромку одного края лезвия бритвы, погружая его в ледяную буфера нарезки в чашке Петри в течение более 1 мин.
- Vibratome установки:
- Включите Vibratome и убедитесь, что дренаж закрыт.
- Закрепите режущую камеру в колеТоме и упаковка лед вокруг рабочей камеры. Предварительного охлаждения его до 0-4 ° С.
- Удалить завод смазок с двойной кромки бритвенного лезвия, погрузив его в 70% этанола в течение 5 мин и затем промывкой ddH2O. Вырежьте его пополам тщательно (не сгибайте лезвие) и смонтировать одну половину лезвие на режущей блока.
- Удаление мозг мыши:
- Обезболить с двенадцати до восемнадцати-дневных мыши C57BL/6J в небольшой камере с предустановленной 0,5 мл изофлураном смоченной в Kimwipe или ватным тампоном. Осторожно зажать пальцы животного, чтобы убедиться, нет боли рефлекс.
- Обезглавьте мышь, используя пару острых ножниц, затем снимите кожу головы с помощью небольших щипцов. Используйте маленькие ножницы костей разрезать череп из мозжечка в обонятельных луковиц вдоль продольной трещины. Удалить черепные закрылки, используя маленькие щипцы. Аккуратно снимите мозг с помощью шпателя, и погрузите его в ледяной кислородом буфере нарезки в чашке Петри.
- BISECт мозг мыши с охлажденной бритвой в чашке Петри, чтобы больше площадь поверхности для охлаждения и оксигенации. Пусть пополам полушариях сидеть в ледяной буфера нарезки в течение 2-3 мин. Мозг должен стать полностью здорово и солиднее.
- Нанесите тонкий слой цианакрилатного клея на платформе Vibratome. Приклейте оба полушария к разрезу платформа стороне вниз и боковых сторон вверх, с обонятельной луковице, обращенной вперед. Закрепите платформу в камеру дробления, а затем заполнить режущую камеру с ледяной, хорошо кислородом буфер нарезки.
- Продолжить кислородом режущую камеру во время подготовки 300 мкм парасагиттальных ломтики с помощью Vibratome. Нарежьте ломтиками на частоте 85 Гц, поступательная скорость 0,20 мм / сек, и амплитудой 1,40 мм. ПРИМЕЧАНИЕ: Мы обнаружили, что единственным наиболее важной переменной в подготовке здоровые острые срезах гиппокампа является качество Vibratome. Наша лаборатория использует Leica VT 1200 с магнитIC ездить Vibratome с vibrocheck сократить "Z" вибрации.
- После нарезки, препарировать гиппокамп и прилегающей энторинальной коры из каждого парасагиттальной ломтик помощью острых щипцов. Выполните эту процедуру в ледяной, хорошо кислородом буфере нарезки в режущей камере Vibratome. Острота пинцетом очень важно для здоровья среза как это сводит к минимуму обработку срезов.
- Сделать передачи пипетки разрывая длинный кончик стеклянной пипетки Пастера и дозаправки сломанную деталь с пипетки лампочки. Это позволяет использование большой конец пипетки для передачи фрагментов. Убедитесь, что заказали пипетки без ватный тампон в большом конце (см. материалы таблицу). Как ломтики готовят в нестерильных условиях, что нет необходимости в автоклаве пипетки перед использованием, хотя новый пипетки должны быть получены и использованы для каждого эксперимента.
- Передача каждого гиппокампа ломтик инкубаторе в 35 ° C водыванна, путем погружения передачи пипетки в ACSF внутри каждой лунке держателя среза и аспирации срез. Минимизировать движение ломтик во время этого процесса. Прямой перенос ломтиков к теплым результатов инкубации ванны в лучших ломтиками качества, чем "наращивает" температуру постепенно.
- Позвольте срезы гиппокампа восстановить в ванне теплой воды в общей сложности 45 минут, в следующей разбивке: Выдержите ломтики в течение 20 мин в 1 мкМ SR-101, разведенного в низкой ACSF кальция, а затем перенести их на низком ACSF кальция (без SR-101) в течение 10 мин. Впоследствии передать ломтики контролировать или экспериментальную ACSF для остальных 15 мин теплого инкубации.
- После 45 мин теплым восстановления, тщательно перемещать инкубаторе с водяной бане 35 ° C до рабочей поверхностью, а затем позволить ломтики продолжать инкубировали при комнатной температуре в течение всего времени инкубации 3 ч перед началом болюса загрузкой протокол (см. ниже).
5. Пилюля Загрузка астроциты с Ca 2 + индикатор
- Подготовка Са 2 + индикатор болюс загрузкой красителя:
- Для каждого флакона красителя (50 мкг), добавьте 3,87 мкл свежей диметилсульфоксид (ДМСО) и тщательно вихря. Свежесть ДМСО имеет важное значение для хорошей загрузке и поэтому, вскрывать свежий ампулы каждый раз.
- Смешайте в 9 мкл 20% плуроника кислоты и вихря тщательно. Смешайте краситель 100 мкл соответствующей экспериментальной или контрольной ACSF и вихря скважины, при концентрации красителя окончательного 10 мкМ.
- Раствор фильтруют с использованием центрифуги фильтра трубки. Этот шаг предотвращает загрузку пипетки от засорения во время выброса красителя.
- Подготовка пипетки из боросиликатного стекла капилляра вытащил к сопротивлением около 1,3 МОм при заполнении раствором красителя.
- Поместите гиппокампа ломтик в регистрирующей камере, предназначенной для использования с микроскопоми непрерывно заливать с кислородом ACSF того же состава, что инкубировали в (1.5 мл / мин). Переключение между контрольной и экспериментальной условиях при выборе гиппокампа ломтик.
- Откажитесь нездоровые выглядящие срезах гиппокампа. Качество срезов будет варьироваться даже в пределах данного эксперимента. Там не набор критериев для количественной здоровье ломтик, поэтому определение здоровья ломтик субъективна и основана в основном на опыте.
- Вообще говоря, держать кусочки, которые имеют гладкую поверхность и, появляющийся высокий процент здоровых CA1 пирамидальных клеток (рис. 2а). CA1 пирамидальные клетки особенно чувствительны и уязвимы для ЦНС оскорбления, так что наличие большой процент (≥ 75%) здоровых нейронов СА1 пирамидальных может быть полезным критерии принятия или отклонения кусочек.
- Откажитесь ломтики, которые имеют примерно> 25% погибших нейронов. Мертвые нейроны имеют жареное яйцо, как внешний вид (рис. 2б). ПРИМЕЧАНИЕ: Мы гаве отмечено, что угол среза играет важную роль в появляются ли нейроны здоровыми или нет. Если нейронные дендриты проектирование вверх (из плоскости среза), то нейроны в основном будет мертв. Предположительно это происходит потому такая большая доля объема нейронов содержится в дендритных дерева, что разрыва дендриты является смертельным для клеток. С другой стороны, если дендриты выступающий параллельно или под углом вниз от поверхности среза, будет высокий процент здоровых нейронов. Иногда, таким образом, нейроны в основном будет мертвым на одной стороне среза и здоровый вид на другой стороне.
- Найдите подходящую поле стер астроцитов 40-70 мкм от поверхности среза в зависимости от размера, морфологии и местоположение с помощью дифференциального интерференционного контраста (DIC) оптики.
- Загрузите стеклянную пипетку с раствором красителя и опустите его на поверхность среза выше этой области, используя стандартный патч-зажим микроэлектродной Holdeр. С помощью пипетки на поверхности среза, применять обратное давление в пипетку, чтобы начать выброса краски. Выброс красителя будет виден под обеими оптики ОПК, а также соответствующую лазера, такие как 488 линии для зеленого красителя.
- Медленно опустите пипетку примерно 40 мкм ниже поверхности среза с помощью микроманипулятора и позволяют краситель, чтобы извлечь примерно 45-60 сек. Затем опустите пипетки дополнительный 35 мкм (75 мкм ниже поверхности среза) и извлечь краситель примерно 45-60 сек. Медленно отведите пипетки от среза. Более короткое время инъекции может привести к загрузке недостаточной красителя, в то время как больше впрыска имеет тенденцию к увеличению фона загрузку, что уменьшает отношение сигнал-шум записи.
- Для того, чтобы большое количество астроцитов взять на себя краску, как правило, полезно вводить болюс второй красителя на небольшом расстоянии. Поднимите пипетки на поверхность среза, убедитесь, что пипетка не засорен, то мове пипетку примерно 80-100 мкм от первой инъекции, а также рогового radiatum. Повторите инъекцию на этом сайте.
- Разрешить 30-45 мин до визуализации для астроцитов взять на себя краску и для фонового сигнала, чтобы уменьшить. Оставьте кусочек в перфузии камеры в течение этого времени. Убедитесь, что это время инкубации встроен в общую лечения 4 часа эксперимента. Получить следующий кусочек и повторите шаги 5,2-5,8.
6. Запись Спонтанное и Gq ХВГФ агонистов-вызвали астроцитов Са 2 + активности в срезах гиппокампа
- Настройка конфокальной микроскопии для визуализации:
- Ограничение экспозиции ломтик лазерного света имеет первостепенное значение, так как высокая воздействие может привести к красить отбеливание и / или фототоксичность. Использование более высокую оптическое увеличение или повышенный настройку масштабирования увеличивает освещенность на распечатанных области. Таким образом, установить значения по умолчанию для каждого лазера на высоком ФЭУ SETTINг, 1x усиления и 0,5% выходная мощность лазера.
- Нанесите 1.5x зум для лучшей визуализации астроцитов процессов.
- Установите разрешение поля 512 х 512 пикселей.
- Установите скорость сканирования для максимально быстрого, которая составляет ~ 1.2 сек на сканирование в режиме сканирования в одну сторону.
- Сбор спектры излучения с помощью полосовых фильтров 503-548 нм для 488 нм лазера на и 624-724 нм для 559 нм лазера на. Эти настройки позволяют визуализации поля ~ 5-8 астроцитов при относительно быстрой скорости с разрешением достаточной для наблюдения астроцитов клеточных тел и основные процессы. В идеале, астроциты в области будет достаточно, чтобы четко увидеть яркий, но без насыщения пикселей.
- Подтверждение личности клеток, нагруженных Ca 2 + красить как астроциты визуализируя SR-101 colabeling использованием 559 нм лазер на.
- Запись астроцитов Са 2 + активность:
- Нарисуйте коробки с помощью программного обеспечения получения изображений над регионах, представляющих интерес (ROIs) в клетке, в данном случае через органы астроцитов клеток. Коробки не должны включать фоновые пикселей, для достижения наилучшего возможного коэффициента сигнал-шум. Нарисуйте одну коробку над фоне в качестве ссылки.
- Переключите перфузии экспериментальной ACSF плюс 1 мкМ ТТХ (Abcam) через оставшуюся часть эксперимента. Это исключает любые возможные нейронные AP-приводом ответов астроцитов кальция. Остальные увеличение астроцитов Са 2 + концентрации тогда будет за счет квантового везикулярного выпуска, учредительной (базальной) GPCR деятельности, или некоторая комбинация обоих механизмов.
- Запись флуоресценции с течением времени от всех трансформирования. Любое увеличение флуоресценции по сравнению с исходными показывают увеличение цитоплазматической концентрации Са 2 + 16, и, следовательно, активность GPCR в астроцитах 10, 17, 18. Во избежание возможных последствий раннего масштабирования на астроцитарных рецепторов ТТХ, полные эксперименты в течение 40 мин фром время, когда 1 мкМ ТТХ перфузии начал.
- После получения 10 мин разработки исходных записи спонтанного Са 2 + деятельности, применять агониста интерес (например, DHPG) в последовательно возрастающих концентрациях. Оставьте не менее 5 мин между приложениями, чтобы уменьшить возможный десенсибилизации рецептора.
- В конце записи, применять коктейль из агонистов для других астроцитарных GPCR, Gq в качестве положительного контроля для нетронутыми астроцитов Gq GPCR сигнальных путей. Компоненты агониста коктейль будет зависеть от рецептора, представляющего интерес. 10 мкМ каждого из Gq GPCR агонистов гистамин, карбахол и 2NA-АТФ, чтобы стимулировать гистамина H1 рецепторы [H1R], мускариновых рецепторов ацетилхолина [mAchR] и пуринергической рецепторы [P2YR], соответственно, является широко используемым агонист коктейль.
- Пост-эксперимент получения изображений:
- В завершении + записи Са 2, принять неподвижные изображения с 488 нм и 559 нм лазеров, Fили поздно подтверждение идентичности астроцитов и размещения ROI. Мощность лазера и высокого напряжения настройки не могут быть изменены свободно на данный момент для получения оптимального изображения для колокализации, так как больше не является забота о лазерной интенсивности света затрагивающем данные (рис. 2А).
- Повторите шаги 6.1-6.3 для в общей сложности около 8 ломтиков и 40 астроцитов / группы. Ломтики должны исходить от не менее 3-х различных мышей.
7. Анализ астроцитов Ca 2 + активность
- Определение Са 2 + высота: стандартизации в определении Ca 2 + переходных не было твердо установлено в рамках научного сообщества. Далее следует типичный протокол, который максимизирует чувствительность при ограничении обнаружение ложных положительных событий из базового шума.
- У другой член лаборатории назначить каждый ломтик числовой код для анализа их вслепую. По завершении анализа, декодировать каждый срез.
- Анализ спонтанным и вызвала астроцитов Ca 2 + высотах форума с помощью программного обеспечения для анализа изображений. Перерисовать и / или регулировать размер, форму и расположение трансформирования в соответствии с пожеланиями.
- Оценка увеличение интенсивности флуоресценции по сравнению с исходными как Ca 2 + высоты, если максимальная амплитуда больше двух стандартных отклонений (SD) выше среднего значения 30 сек средней базовой флуоресценции, по крайней мере, двух последовательных точек выборки. В частности шумных записи (низкое отношение сигнал-шум), этот критерий может должны быть скорректированы до 3 SD над средним исходным флуоресценции. Определить начало каждого Ca 2 + высоте как конечную точку данных перед интенсивность флуоресценции превышает одно стандартное отклонение выше среднего.
- Различия между multipeak против последовательных одно-пик событий. Оценка событие как "multipeak", когда интенсивность флуоресценции не возвращается к базовой линии (ниже среднего базового значения 2 SD) для &# 8804; 9 последовательных точек данных (10.8 сек) между пиками. Таким образом, один пик события будут иметь 10 или более последовательных базовых точек данных в период между ними.
- Оцените события как ответы «плато» типа, когда интенсивность флуоресценции поддерживает пиковую амплитуду (± 10% от пикового значения), по крайней мере 3,6 сек.
- Проанализируйте амплитуда, частота и кинетики спонтанного и агонистов-вызвали переходных кальция.
- Определите пик амплитуды + высоты Са 2 в качестве точки данных с наивысшим значением интенсивности (в случаях "multipeak" ответов использовать первый пик; см. рисунок 2В).
- Вычислить время нарастания как разность между началом реакции и время, соответствующее пиковой амплитуды. Примечание: от 0 до 100% время нарастания возможно, должны быть использованы для того, чтобы иметь достаточное количество точек данных, чтобы получить значение времени; Скорость сканирования является важной переменной здесь.
- Вычислить время ожидания как времямежду началом перфузии агониста к возникновению реакции. Время нарастания может быть более полезной мерой в срезах мозга, до тех пор, мыть-во времена создания конфликтовать при расчете задержки реагирования.
- Определите, есть ли статистически значимых различий между двумя группами для каждого параметра с помощью независимого т-тест Стьюдента. Используйте количество астроцитов как 'п'. Используйте хи-квадрат тест Пирсона сравнить модели Са 2 + активности между контрольными и группами лечения. Используйте точного критерия 2-хвост Фишера для сравнения процент конкретных моделей Са 2 + деятельности между контрольными и группами лечения. Экспресс различия как * Р <0,05, ** P <0,01, и *** р <0,001.
Результаты
Представитель результаты на рисунке 3 показано влияние инкубации острых ломтиками мыши гиппокампа в ТТХ для 4-6 часов на стер астроцитов Са 2 + деятельности. Данные включают в себя как спонтанные Са 2 + переходных и ДХПГ-вызвала группа Я mGluR Ca 2 + ответы, из кусочков инкубированных в контрольной ACSF против ACSF плюс ТТХ. Кроме основных характерных морфологических особенностей, монтаж технологического севрюга и небольшого размера сомы (~ 10 мкм), астроциты определены в ср на накладкой Са 2 + индикатор OGB-1 утра с селективным астроцитов маркер SR-101 19, 20 ( фиг.3А). Пронумерованные коробки более органов астроцитов клеток соответствуют пронумерованных флуоресценции по времени следов, показанных на фигуре 3В. MGluR агонист группа 1 (RS)-3.5-ДХПГ применяется для определения конкретных масштабирования воздействие на группы 1 мГлуР в астроциты. Чтобы различать физикеiology в специфичности масштабирование, эффект в группу 1 мГлуР по сравнению с другими GPCRs GQ, коктейль из агонистов применяется в конце каждого эксперимента. Здесь мы использовали 10 мкм каждый из Gq GPCR агонистов гистамина, хлорид carbamylcholine (карбахолом) и аденозин-5'-АТФ динатрия (Na-АТФ). Агонист коктейль также служит в качестве положительного контроля для выявления жизнеспособных, реагирующие астроцитов в случаях, когда клетки не отвечают на ДХПГ, по-видимому, потому что эти конкретные астроциты не выражают достаточное количество рецептора, чтобы вызвать реакцию на ДХПГ.
Мы использовали различные концентрации DHPG, в том числе 5 мкм и 15 мкм (рис. 3б), а также 30 мкм и 50 мкм (рис. 4А) для оказания помощи в выявлении изменений в астроцитов группы I мГлуР. Отношения между сотовыми Ca 2 + ответы и уровней экспрессии Gq GPCR из ранее проверенных в лабораторных 21-24. Во-первых,порог в ответ на определенной концентрации агониста, зависит от плотности рецепторов, выраженных каждой ячейки. В популяции клеток, больше клеток реагировать с высоты + Ca 2 до заданной концентрации агониста, когда клетки трансфицируют с более высокой плотности рецепторов. После инкубации срезов в ТТХ, процент астроцитов в популяции в ответ на фиксированной концентрации агониста возрастает (фиг. 3В и 3С). Мы обнаружили, что 5 мкМ и 15 мкМ ДХПГ показывают очевидных различий в процентном отношении чувствительных астроцитов между контролем и TTX обработанных клеток, тогда как 30 и 50 мкМ ДХПГ необходимо сравнить группы ответов I mGluR в 5,0 мМ К +, обработанной по сравнению с контролем клетки (рис. 4А).
Отношения между астроцитарных моделей Са 2 + реагирования и концентрации агониста также были рассмотрены на месте. Увеличение агонистКонцентрация сдвигает картину + ответ Ca 2 в астроциты от одного пика Ca 2 + фасады в multipeak и плато Ca 2 + возвышения 25-27. На основе этих предыдущими выводами, мы прогнозировали, что картина ответ на одной концентрации агониста сместится если есть изменения в уровне экспрессии рецептора. Таким образом, в зависимости от какой из двух методов масштабирования в настоящее время используется (ингибирующим воспаление нейронов или ее увеличение), концентрация агониста, необходимых для получения определенной схеме реакции будет увеличиваться или уменьшаться. Например, астроциты инкубировали в ТТХ перенести свое ДХПГ, вызвали Са 2 + картине реакции к более плато типа Ca 2 + фасады и отвечать снизить агонистов концентрации по сравнению с контролем астроциты (Рисунок 3C). Учитывая более ранние исследования, эти наблюдения позволяют предположить, что группа Я mGluR уровни экспрессии рецептора в астроциты возросла.
Время и начало (Задержка) от + высотах Ca 2 Повышение также было показано, что непосредственно коррелируют с изменением уровня экспрессии Gq GPCR в культивируемых клетках 22-24. Более высокие уровни экспрессии рецептора привести к сокращению задержек реагирования и более быстрое время нарастания в то время как снижение плотности рецепторов производит противоположный эффект. Для астроцитов инкубированных в ТТХ, Ca 2 + переходные вызванные применением DHPG значительно быстрее подняться раза по сравнению с астроцитов инкубированных в контрольной ACSF (рис. 3D). Как упоминалось ранее, амплитуды агонистов-вызвали Ca 2 + ответов остаются неизменными независимо от концентрации агониста или масштабирования модели 15 (рис. 3D).
В дополнение к изменениям наблюдаемых непосредственно активации группу я мГлуР с DHPG, спонтанное астроцитов Са 2 + активность также значительно пострадавших от этой манипуляции. Отметим,да увеличение 2,26 раза в процентах от спонтанно активных астроцитов инкубированной в ТТХ по сравнению с контролем. Это больше, чем в только 12.9% контрольных астроцитов, обладающих спонтанной активности в сомы до 42,1% в ТТХ инкубировали астроциты (Рисунок 3E). Потому что известно, что GPCRs выставка «внутренней», либо конструктивной деятельности в отсутствие агониста 21, 26, 28, и что уровень этого внутренняя активность возрастает с увеличением уровня экспрессии рецептора, эти данные свидетельствуют о том, что плотность астроцитов увеличивается Gq GPCRs после уменьшения долгосрочного нейронов потенциала действия стрельбы. Подобно агонистов, вызвали ответы, рост времена спонтанных Ca 2 + высотах также увеличилась (рис. 3Е).
Представительства данных с помощью второго протокола, инкубацию в повышенной внеклеточной калия (5,0 мм), изображен в ИнтернетGure 4. Увеличение внеклеточного К + от 2,5-5,0 мМ приводит к значительному увеличению базальной CA3 нейронов потенциала действия частоте 15. Более высокие концентрации DHPG (30 мкм и 50 мкм) необходимы для того, чтобы вызвать группу я mGluR Ca 2 + ответы от астроцитов инкубированных в высокой калия (4A и 4В). Это согласуется с пониженным уровнем групповой Я mGluR отзывчивость в астроциты следующей долгосрочной увеличения нейронных потенциалов действия. Кроме того, вызванных образец ответ на фиксированной концентрации ДХПГ переходит от платообразных ответов на слабых один пик ответов (фиг.4В). Изучение процент спонтанно активных астроцитов в двух условий показывает, что калия меньше астроциты, инкубированные в высокой K + спонтанно активны по сравнению с контрольной группы (фиг. 4C). Этот эффект в oppositе направление условии TTX, в котором процент астроцитов, обладающих спонтанные Ca 2 + высотах увеличивается. Последний, как вызвали и спонтанные Са 2 + фасады имеют более медленные время нарастания в астроциты инкубированных в высокой K + по сравнению с контрольной группы (рис. 4С и 4D). В целом эти данные предполагают, что уровни экспрессии астроцитарных Gq GPCR масштабе в двух направлениях в зависимости от уровня потенциала действия нейронов активности в течение длительного периода времени.

Рисунок 1. Изготовление Slice Инкубационный камера и настроить. (А) ящик порция Brinkmann хранения пипетки контейнере вместе с его герметичной крышки используется для построения ломтик инкубационный камеру. (B) Dпромоины отверстие в стороне контейнера около 1 ¼ от верхней и ¼ от стороны. Установите в кусок гибкой трубки. (С) Подключите microloader-многообразие аппарат к внутренней конце гибкой трубки. Примечание вырезать по форме естественно наконечник пипетки 200 мкл (белая стрелка). (D) Шесть 20 мкл Эппендорф microloaders разрезаются к монтажу на линии коллектора один-к-шести создать microloader-многообразие аппарат. (Е) Просверлите два маленьких отверстия на крышке. (F) с плавающей пузырь стойки для изготовления держатель ломтик. (G) Нижние "ноги" плавающего пузыря стойки удаляют так, что кусок сетки материала нейлона могут быть приклеены к основанию. (H) Заполните инкубационной камере с достаточным количеством ACSF так, что держатель ломтик плавает. Отрегулируйте длину трубки так кончики microloaders можете отдохнуть в одном углу камеры этаже. При размещении инкубационный камеру вводяная баня, уровень воды в ванне должна быть на том же уровне, что и ACSF в камере. Кликните здесь, чтобы посмотреть увеличенное изображение.
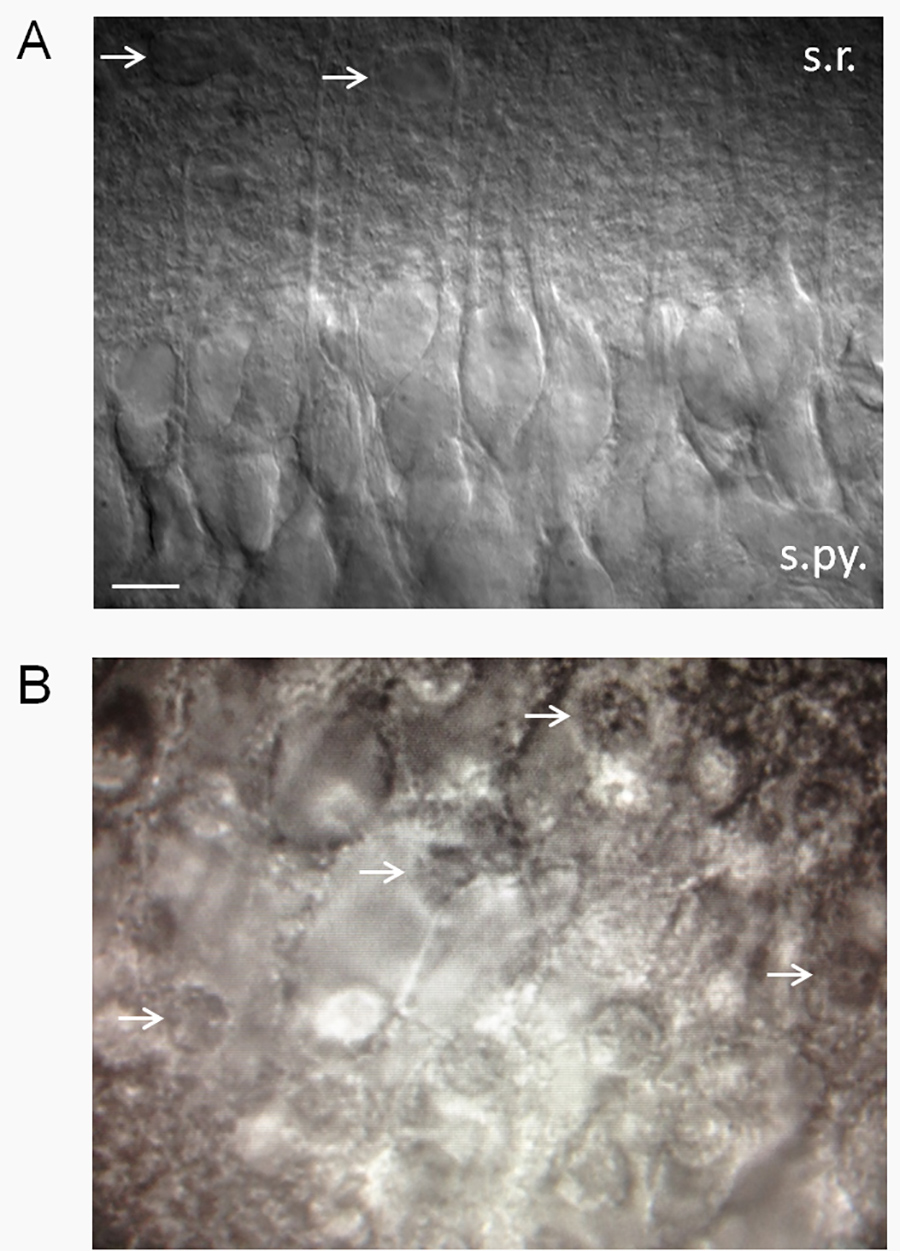
Рисунок 2. Оценка здоровья среза. (А), выглядящий здоровым гиппокампа ломтик использовании дифференциального интерференционного контраста (DIC) оптики. Здоровые кусочки иметь гладкую, бархатистую внешний вид и высокий процент здоровых нейронов СА1 пирамидальных. Обратите внимание на дендритов выступающие в роговом radiatum. Патч-зажим нейронов, которые выглядят так, как показано здесь показывают низкую мембранный потенциал покоя (-61 до -62 мВ) в стандартном 2,5 мМ K + ACSF с нескольких потенциалов спонтанной действий. Мембранный потенциал и увольнения ставки будут варьироваться в зависимости от эксвнеклеточного К + (Се и др.. 15). Стрелки указывают на предполагаемых астроциты. Сокращения: СР, слой radiatum; s.py., слой pyramidale. Шкала бар, 10 мкм. (В) ломтики Нездоровые будет иметь высокий процент погибших нейронов СА1 пирамидальных, которые имеют внешний вид яичницы (белые стрелки указывают на ядрах погибших нейронов - в "желток" из жареным яйцом). Кликните здесь, чтобы посмотреть увеличенное изображение.
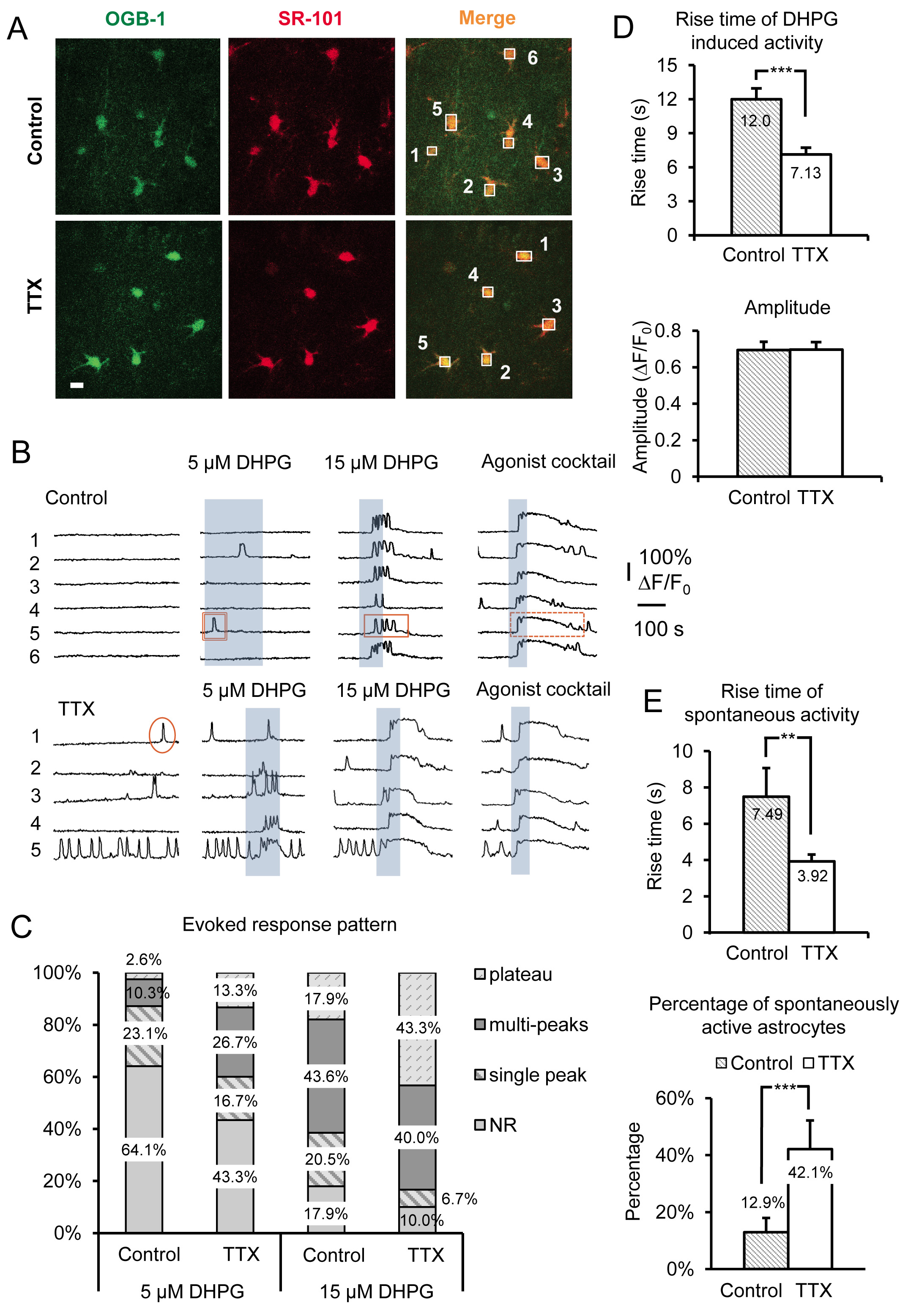
Рисунок 3. Запись усиливается Gq GPCR активность и вызывал группу я mGluR Са 2 + ответы после долгосрочного ингибирования нейронов точек доступа путем инкубации в ТТХ. (А) Типичные изображения клеток в области записи инкубировали в сontrol условия (верхние панели) или в ТТХ (нижние панели), которые включили Орегон Зеленый BAPTA-1 утра Ca 2 + индикатор красителя (слева панели) и SR-101 (средний панели). Шкала бар составляет 10 мкм. Наложение обоих сигналов («слить») указывает, что астроциты нагрузку с Ca 2 + индикатор. Коробки тянутся над отдельными астроцитов сомы записывать интенсивность флуоресценции с течением времени в зеленом канале следить Ca 2 + активность в астроциты. (B) Примеры следы от записывающих коробок в а) Ca 2 + активности в астроциты. Астроциты инкубировали в ТТХ шоу увеличился спонтанную активность и надежнее вызвала группа Я mGluR Са 2 + ответы о чем свидетельствует изменений в структуры ответов. Примеры одного пика (круг), multipeak (прямоугольник) и плато (пунктирный прямоугольник) Ca 2 + переходные показаны. (C) Изменения в характере реагирования особенно очевидно с использованием различных концентрациямирационы группы я mGluR агонист ДХПГ. Еще multipeak и плато ответы очевидны после инкубации в ТТХ по сравнению с контролем при данной концентрации агониста. (D) Повышение времена ДХПГ, вызвали Ca 2 + ответов будут быстрее в астроциты инкубированных в ТТХ по сравнению с контролем (верхняя панель), в то время как амплитуды не изменить (нижнюю панель), что свидетельствует о "все или ничего" амплитуд реагирования раз порог в ответ была достигнута. (Е) Подъем раз спонтанного астроцитов Ca 2 + переходных также быстрее в ТТХ инкубировали по сравнению с контролем инкубировали астроциты (верхняя панель), в то время как процент астроцитов в популяции выставке спонтанные Gq GPCR Ca 2 + увеличивает активность (нижняя панель). Кликните здесь, чтобы посмотреть увеличенное изображение.
Рисунок 4. Запись уменьшилась астроцитов Gq ХВГФ активность и вызывал группу я mGluR Ca 2 + ответы следующие долгосрочного увеличения нейронных точек доступа путем инкубации при повышенных внеклеточного калия. (A) Характерные следы астроцитов Ca 2 + записей из кусочков инкубированных в 5,0 мм K + ACSF деполяризовать нейронов и увеличение их базальной скорострельность по сравнению с контрольными ACSF (2,5 мм K + ACSF). Астроциты инкубировали с 5,0 мм K + ACSF выставке меньше спонтанных соматические Са 2 + переходных и слабой DHPG вызвала ответов по сравнению с астроцитов инкубированных в контрольной ACSF. (В) Сравнение моделей вызвали ответы на несколько концентраций DHPG показывает слабые типы реагирования после длительного увеличения нейронных точек доступа. (С) уменьшение процента астроцитов в Роpulation экспонирование спонтанное Ca 2 + активность наблюдается после длительного инкубации при повышенных K + по сравнению с контрольными ACSF (верхняя панель), в то время нарастания раз спонтанной активности замедлиться (нижняя панель). (D) Повышение времена вызывали астроцитов Ca 2 + Ответы на различных концентраций DHPG стал медленнее следующие 5,0 лечение мМ К + по сравнению с астроцитов инкубированных в контрольной ACSF. Кликните здесь, чтобы посмотреть увеличенное изображение.
Обсуждение
Описанные масштабирования модели представляют практические методы для исследования долгосрочных пластичность астроцитов группы I мГлуР. Визуализации спонтанные и вызванные Ca 2 + события обеспечивает чувствительный анализ для измерения изменений в астроцитов деятельности Gq GPCR, как твердых доказательств было установлено, что астроцитов Ca 2 + фасады происходят следующем выпуске от IP 3 R чувствительных магазинах ниже по течению от Gq GPCR активации 10, 12, 17, 18. Процент астроцитов в популяции в ответ на группы я mGluR агонистов и картины таких Ca 2 + ответов сообщать об изменениях в I группе мГлуР астроцитами.
Конкретный метод используется для загрузки астроциты с Ca 2 + индикатор является важным фактором при проектировании экспериментов, чтобы узнать про изменения в астроцитов деятельности Gq GPCR. Пилюля загрузкой или сыпучих загрузкой несколько астроциты, или рATCH-зажим загрузка отдельных астроцитов может быть использован для изображений Са 2 + переходных процессов в астроциты. Каждый подход имеет определенные преимущества и недостатки. Непосредственно заполнения астроциты с Ca 2 + индикатор через патч зажим позволяет однозначную идентификацию клетки как астроцитов без необходимости вторичного маркера, такого как SR-101. Патч-зажим поставка показателя также позволяет запись Ca 2 + деятельности от мелких астроцитарных отсеков включая густыми мелкими процессов, потенциально более глубоких на срезе, где клетки являются более здоровыми и с более нетронутыми взаимодействия с синапсов (в зависимости от мощности лазера имеется). Тем не менее, патч-зажим загрузка страдает от низкой пропускной как данные собраны на одну клетку за один раз. Массовая загрузка, напротив, позволяет большое количество астроцитов быть загружены с Ca 2 + индикатор и отображается одновременно. Тем не менее, только астроциты вблизи поверхности (<20 мкм) среза загружены, связанного с озабоченностьюс о здоровье клеток и неповрежденных синапсов.
Противодавление болюс-загрузке протокола, представленные здесь предлагает золотую середину, при относительно высокой пропускной способностью и возможностью контроля Ca 2 + активность в глубине среза (40-75 мкм). Значительное увеличение доли спонтанно активных астроцитов, используя технику болюс загрузкой наблюдается по сравнению с объемной загрузкой, предполагая, что соединения между нейронных синапсов и астроцитов процессов являются более полными 15. С хорошей загрузке, можно часто контролировать Ca 2 + активность в основных процессов астроцитов (данные не представлены) или потенциально даже более мелких отсеков с использованием 2-фотонной микроскопии. Тем не менее, уход необходимо будет осуществляться в присвоении более мелкие процессы для конкретного астроцитов, как границы сливаются в неспецифической фона окрашивания. Еще одна проблема с использованием объемной загрузкой или болюс загрузкой процедур является необходимость вторичного рынкег для идентификации астроцитов. В то время как он был известен в течение многих лет, что астроциты преимущественно занимают AM эфир Ca 2 + показатели, вторичный маркер SR-101 часто используется для проверки загруженных клетки как астроциты. SR-101 может само по себе изменить внутреннюю возбудимость нейронов 29. Использование SR-101 подтверждает необходимость выполнения всех астроцитов Ca 2 + измерения в ТТХ ограничить возможные SR-101 воздействие на возбудимости нейронов. Если предположить, что оба управления и экспериментальные группы включают SR-101, маркер в себе не должна учитывать эффектов, наблюдаемых в астроцитов Ca 2 +-сигнализации следующих долгосрочного манипулирования нейронных потенциалов действия. SR-101 может быть больше беспокойства в высокой K + экспериментов, однако, как это может уменьшить разницу между 2,5 мМ К + против 5.0 мМ К +, если базальная скорострельность не изменяется пропорционально.
Очень перспективный подход для доставки Са 2 + Индикатор астроцитов недавно возник который предлагает привлекательную альтернативу более традиционным подходам помощью Ca 2 + красители. Значительные успехи были достигнуты в течение последних нескольких лет с генетически кодируемых показателей кальция (GECIs), направленных на астроциты 30-32. GECIs может быть доставлен в астроцитах путем микроинъекции в естественных условиях адено-ассоциированные вирусные векторы в область мозга интерес, такие как гиппокампа. Выражение GECIs достигается примерно через две недели после вирусной инфекции 32. Существуют многочисленные преимущества, представленные использованием GECIs в астроциты. Во-первых, векторы направлены на астроциты с использованием промотора астроцитов по конкретным тем, чтобы меченые клетки астроциты 32. Во-вторых, шум сигнал-теперь похоже сопоставимы с тем, что можно получить с помощью патч-зажим доставку краски, но без инвазивности имея патч пипетки на 32 ячейки. В-третьих, показатели могут быть дельivered и выражается в взрослой ткани, которая является проблематичным с использованием методов объемной нагрузки доставки. Кроме того, выражение мозаика, обладает способностью дифференцироваться между несколькими астроциты. Таким образом, несколько астроциты потенциально могут быть отображены одновременно, а также записи в сомы и тонкой веточки одновременно. Таким образом, потенциально одна техника может быть использована вместо трех отдельных методов (основная загрузка, болюс-погрузочных и патч-зажим нагрузки) для записи масштабирования деятельность астроцитарных GPCRs GQ, значительно увеличивая эффективность.
Один потенциальный недостаток использования вирусного опосредованного доставку Ca 2 + показателей к астроцитов является возможное влияние на срез здоровья 32. В аденоассоциированные вирусные векторы, используемые для доставки GECIs было показано ранее, вызывают реактивные глиоз астроцитов 33. Подготовка срезах мозга в целом, вероятно, инициирует ранние стадии патологии, включая выпуска инфlammatory молекул 10. Таким образом, в сочетании с длинными времени инкубации, необходимых, чтобы вызвать масштабирование астроцитарных рецепторов, использование GECIs поставляемых с помощью вирусных векторов необходимо будет получить дополнительную рассмотрение в контексте здоровья среза в этих типах экспериментов.
При использовании этого протокола, важно иметь в виду, что время приложение для агониста для получения ответа будет варьироваться в зависимости от доступности рецепторов. Для данной концентрации агониста, время приложение должно быть больше, если рецепторы уменьшено, и короче, если рецепторы расширены, для лекарственного средства, чтобы достичь адекватной концентрации в ткани, чтобы активировать рецепторы достаточно, чтобы произвести Са 2 + ответ. Таким образом, применение препарата раз и, возможно, их концентрации, возможно, придется быть скорректирована в зависимости от предполагаемого направления масштабирования. Например, концентрации агониста, возможно, должны быть снижены в Cазы ТТХ, чтобы избежать насыщения ответов, и увеличивается после инкубации срезов в высокой K + даже увидеть ответ. В частности, концентрация ДХПГ был перенесен с 5-15 мкМ после лечения ТТХ к 30-50 мкМ после лечения 5,0 мМ К + в целях изучения Са 2 + модели реагирования, как 5-15 мкм часто слишком низкое для получения надежных ответов в астроциты после сворачивают группы I мГлуР.
Запись астроцитов Ca 2 + деятельности не дает прямых доказательств вставки рецепторов или интернализации на работу или с плазменной мембране. Однако, основываясь на замечательном сходстве данных с данными предыдущих исследований в пробирке которые рассмотрели прямую взаимосвязь между уровнем Gq GPCR экспрессии и спонтанным и вызванных Са 2 + переходных 21-24 наиболее логичным интерпретацию изменений в Ca 2 + сигнализации является то, что уровни экспрессии рецепторов на поверхности астроцитов иметьизменилось. Дополнительный подход может быть важным фактором, если кто-то хочет представить дополнительные доказательства о локус влияния на Ca 2 + деятельности. Стратегия, которую мы использовали, был изучить эффект ТТХ инкубации на срезах гиппокампа из астроцитов мышей MrgA1R. Эти трансгенные мыши выразить иностранный Gq GPCR (MrgA1R) только в астроциты. Поскольку этот рецептор не родной к мозгу, нет эндогенный медиатор присутствует изменить свои уровни активности. Предыдущая работа предположил, что этот рецептор участвует тот же внутриклеточной сигнализации молекулы в качестве эндогенного группа I мГлуР в тех же астроцитов 34. После длительного инкубация срезов от мышей MrgA1R в ТТХ, никаких различий в агонистов-вызвали MrgA1R ответов по сравнению с контролем однопометница не выдерживают ломтики бы представить доказательства, что эффект от астроцитов Са 2 + активность в связи с изменениями, локализованных на поверхности рецептора, особенно если ответы группа Я mGluR еще значиicantly усиливается в тех же астроциты. В качестве альтернативы, хотя, возможно, более активно участвовать стратегией было бы изолировать астроциты из срезов для вестерн-блоттинга, пока мембранной фракции могут быть проанализированы для изменения уровня поверхности рецепторных экспрессии. Флуоресценции Активированный сортировки клеток (FACS) или проточной цитометрии могут быть полезны здесь.
Возможности применения этой техники к изучению нейронов, астроциты и астроцитов-нейронов взаимодействия очень много. В наших экспериментах, только ДХПГ-вызвала группа Я mGluR астроцитарных Ca 2 + ответы были изучены, в изолированных острых срезов гиппокампа мышей несовершеннолетних. Этот препарат не только неповрежденные афференты (Schaffer залогов), но и нейроны, которые приводят к ним (СА3 пирамидальных клеток), что делает возможным манипулировать теплотехнической этих глутаматергических нейронов на постсинаптических клеток (СА1 пирамидальных клеток) и астроциты в роговом radiatum процессами, свяе с этих синапсов. Острая гиппокампа ломтик не может быть лучшая подготовка для работы огневые темпы других типов нейронов, однако, как и многие афференты отделена от нейронов, которые приводят к ним. Тем не менее, это может быть возможно в некоторых препаратах срезов наблюдать пластичность других подтипов астроцитарных Gq GPCR. Например, кусочки могут быть подготовлены с базальных отделах переднего мозга холинергических нейронов и их проекций на гиппокампе нетронутыми. Инкубационный из этих срезов в ТТХ или повышенной K + повлияет базальные теплотехнической холинергических нейронов, что приводит к масштабированию mAchRs в астроциты страты Oriens, которые получают значительную часть холинергической входа 1. Альтернативный пока непроверенной подход к изучению астроцитов рецептора масштабирование в пределах определенной области мозга, с все соединения неповрежденных а масштабирование происходит, может быть использование модели в естественных условиях, где с замедленным высвобождением ТТХ достигается путем имплантации пластIC полимер Elvax 40W выше интересующей области 35. Этот подход был ранее использовались в исследовании нейронов масштабирования, но также должны быть применимы к астроцитов масштабирования. Наконец, с надлежащим считывания, будущие исследования могли бы изучить другие семьи GPCR, в том числе изменений в G с или G I GPCRs. Можно было бы предсказать астроцитов ГАМК B G I GPCRs, будут затронуты следующие ингибирования стрельбы в локально проектирование ГАМК интернейроны в какой-либо подготовки среза. Разработка новых показателей, ориентированных на другие сигнальные молекулы, такие как в режиме реального времени индикатор вторичного мессенджера цАМФ, откроет целую новую область исследований на нейрон-на-астроцитов связи рецепторов.
Двунаправленный масштабирование астроцитарных мГлуР манипуляциями базальных ставок нейрон огневых обеспечивает измерение чувствительности астроцитов к AP-опосредованного высвобождения нейромедиатора. Астроциты-видимому, может ощущать спонтанные точки доступа и glutamaтэ-релиз на Шаффер залога-СА1 пирамидальных клеток синапсов даже когда внеклеточного К + находится в физиологическом диапазоне. В то время как острый применение ТТХ не уменьшает частоту спонтанных астроцитов Са + активность 2 18, 36, 37, + активность Са 2 среди астроцитов в популяции становится декоррелированной 36, что свидетельствует, что астроцитарных рецепторы AP детекторы. Это говорит о том, что астроциты ощутить спонтанные нейронные точек доступа с не влияет на их общее Са 2 + деятельности. Общепризнано, что внутриклеточные концентрации IP 3 должны достигнуть порогового уровня, чтобы стимулировать IP 3 Rs достаточно, чтобы привести к обнаружению Са 2 + высоты. Может спонтанные нейронные ТД активируйте астроцитов GPCRs не производя измеримые Ca 2 + высоты? Будущие исследования могут использовать флуоресценции резонансный перенос энергии (FRET) или аналогичный технич IQUE (например, BRET) для изучения взаимосвязи между G белка связывания с рецептором (мера активации рецептора) и Ca 2 +-релизе внутренних магазинах. BRET широко используется в пробирке, чтобы обнаружить G белок-на-GPCR муфту 38, хотя это может быть какое-то время, прежде чем эта технология станет доступной для использования в подготовке неповрежденной ткани. Вполне возможно, что астроцитарных GPCRs Gq активизируются гораздо чаще, чем могут быть записаны с использованием имеющихся в настоящее время инструменты Са 2 + визуализации. В дополнение к зондирования потенциалы действия, астроцитарных GPCRs Gq может также быть в состоянии обнаружить миниатюрный квантовых высвобождение нейромедиатора о чем сообщается в недавнем исследовании 39. Двунаправленный метод масштабирования описано здесь могут быть использованы в будущих исследованиях, чтобы обеспечить меры, в какой степени астроцитов Gq GPCRs выявления квантовых везикулярного высвобождение нейромедиатора, путем включения bafilomycin A1 в протоколе инкубации.
ntent "> До сих пор протоколы масштабирования использовались только в срезах гиппокампа мышей несовершеннолетних (p12-p18). Таким образом, в настоящее время неизвестно, если астроцитов масштабирование рецепторов также может быть вызван в ткани, полученных из взрослых мышей. убедительным Недавнее исследование предполагает, что группа Я mGluR выражение в астроциты значительно уменьшается после первой недели возраста и продолжает снижаться до совершеннолетия, с очень низким уровнем экспрессии рецепторов у взрослых астроцитов 40. Поэтому было бы интересно определить, если астроцитарных мГлуР масштабов следующая долго- Термин ингибирование нейронов стрельбы у взрослых ломтиками мыши гиппокампа до уровней, приближающихся к тем, которые наблюдаются в астроциты от мышей несовершеннолетних. Эта находка позволяет предположить, что астроцитов экспрессии рецептора не является статичным в данном возрасте, но могут быстро меняться в зависимости от уровней активности нейронов. В отличие от снижение экспрессии группа I мГлуР у взрослых мышей, информации поступает, что адренорецепторов, в т.ч. и #945; 1А, α 2А и β 1 подтипы, преимущественно выражается астроцитов в головном мозге взрослых 3, 4. Α 1А адренергических Gq ХВГФ может быть привлекательной целью для будущих исследований Нейрон-на-астроцитов связи, в том числе, являются ли эти рецепторы чувствительны к изменениям в адренергических ставок нейрон обжига.Раскрытие информации
Авторы описывают, что тетродотоксин используется в этих исследованиях был приобретен у Abcam. Abcam не было причастность к гипотез, проектирование, или сбора данных. Все коммуникации в отношении спонсорства работы по Abcam произошло после того, процесс экспертной оценки была завершена.
Благодарности
Авторы хотели бы выразить признательность центр UC Риверсайд для глиальных-нейронных взаимодействий для полноценного обсуждения протоколов, масштабирования и данных. Авторы также хотели бы дать искреннее спасибо к Abcam за спонсирование публикацию своей работы.
Материалы
| Name | Company | Catalog Number | Comments |
| Chamber Supplies | |||
| Brinkmann pipette storage container | Fisher Scientific | 03-491 | Use the drawer portion as the incubation chamber |
| Electrical drill | |||
| Flexible tubing | Tygon | R-3603 | |
| Silicone seam sealant | Also called aquarium seam sealer | ||
| Gas tank | 95% oxygen, 5% carbon dioxide | ||
| Natural beveled pipette tip | USA Scientific | 1111-1000 | Cut-to-fit to connect oxygenate lines |
| One-to-six lines manifold | Warner Instruments | 64-0210 (MP-6) | For the microloader-manifold apparatus |
| Microloader | Eppendorf | 5242 956.003 | For the microloader-manifold apparatus, cut-to-fit |
| Floating Bubble Rack | Bel Art Scienceware | F18875-0400 | For slice holder |
| 600 µm Sefar Nitex Nylon mesh | ELKO Filtering Co. | 06-600/51 | For slice holder |
| Krazy Glue | For slice holder | ||
| Reagents | |||
| Isoflurane | Baxter | 1001936060 | |
| NaCl | Fisher | S271-3 | |
| KCl | Fisher | P333-500 | |
| CaCl2 | Fisher | C79-500 | |
| MgCl2 | Fisher | M33-500 | |
| NaH2PO4 | Fisher | S369-500 | |
| NaHCO3 | Fisher | S233-500 | |
| Glucose | Fisher | Fisher | |
| (±)-6-Hydroxy-2,5,7,8- tetramethylchromane-2-carboxylic acid (Trolox) | Acros Organics | 53188-07-1 | |
| Ascorbic acid | Acros Organics | 401471000 | |
| Tetrodotoxin citrate (TTX) | Abcam | ab120055 | |
| Sulforhodamine 101 (SR-101) | Sigma-Aldrich | 284912 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Pluronic Acid F-127 | Invitrogen, Molecular Probes | P6867 | |
| Oregon Green 488 BAPTA-1 AM *cell permeant (special packaging) | Invitrogen, Molecular Probes | O6807 | |
| (RS)-3,5-DHPG | Abcam | ab120020 | |
| Histamine | Sigma-Aldrich | H7125 | |
| Carbamoylcholine chloride (Carbachol) | Sigma-Aldrich | C4382 | |
| Adenosine 5’-ATP disodium (Na-ATP) | Sigma-Aldrich | A7699 | |
| Dissection Tools | |||
| Single-edge razor blade | GEM | 62-0161 | For bisection |
| Double edge razor blade | TED PELLA, INC. | 121-6 | For cutting slices |
| Mayo Scissors, supercut | WPI | 14010-15 | For decapitation |
| Fine iris scissors, straight | Fine Science Tools | 14094-11 | For cutting the skull |
| Iris forceps, curved | WPI | 15915 | To remove the skin and skull |
| Small spatula | To remove/transfer the brain | ||
| Dumostar Dumont #5 Biologie Tip forceps | Fine Science Tools | 11295-10 | For hippocampus dissection |
| Glass Pasteur pipette | Fisher | 13-678-20B | For transferring brain slices |
| Pasteur pipette rubber bulb | Fisher | 03-448-22 | For transferring brain slices |
| Polystyrene 100 mm tissue culture dishes | Corning | 25020 | |
| Vibratome | Leica | VT 1200S | |
| Water bath | Fisher | ISOTEMP 210 | For warm incubation |
| Micropipette puller | Narishige | PC-10 | For bolus-loading pipette |
| Confocal microscope | Olympus | Olympus Fluoview 1000 | |
| Low Profile Open Diamond Bath Imaging Chamber with PM-1 platform | Warner Instruments | RC-26GLP | diamond bath with low profile |
| Borosilicate glass pipette | World Precision Instruments | TW150F-4 | For bolus-loading pipette |
| Micromanipulator | Sutter Instrument | ROE-200 | For bolus-loading pipette |
| Spin-X centrifuge tube filter with 0.22 µm cellulose acetate | Costar | 8161 |
Ссылки
- Araque, A., Martin, E. D., Perea, G., Arellano, J. I., Buno, W. Synaptically released acetylcholine evokes Ca2+ elevations in astrocytes in hippocampal slices. J. Neurosci. 22, 2443-2450 (2002).
- Navarrete, M., Araque, A. Endocannabinoids mediate neuron-astrocyte communication. Neuron. 57, 883-893 (2008).
- Bekar, L. K., He, W., Nedergaard, M. Locus coeruleus alpha-adrenergic-mediated activation of cortical astrocytes in vivo. Cereb. Cortex. 18, 2789-2795 (2008).
- Hertz, L., Lovatt, D., Goldman, S. A., Nedergaard, M. Adrenoceptors in brain: cellular gene expression and effects on astrocytic metabolism and Ca2. Neurochem. Int. 57, 411-420 (2010).
- Porter, J. T., McCarthy, K. D. Hippocampal astrocytes in situ respond to glutamate released from synaptic terminals. J. Neurosci. 16, 5073-5081 (1996).
- Bernardinelli, Y., et al. Astrocytes display complex and localized calcium responses to single-neuron stimulation in the hippocampus. J. Neurosci. 31, 8905-8919 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Wang, X., et al. Astrocytic Ca2+ signaling evoked by sensory stimulation in vivo. Nat. Neurosci. 9, 816-823 (2006).
- Fiacco, T. A., Agulhon, C., McCarthy, K. D. Sorting out astrocyte physiology from pharmacology. Annu. Rev. Pharmacol. Toxicol. 49, 151-174 (2009).
- Agulhon, C., et al. Calcium Signaling and Gliotransmission in Normal vs Reactive Astrocytes. Front. Pharmacol. 3, 139 (2012).
- Nedergaard, M., Verkhratsky, A. Artifact versus reality--how astrocytes contribute to synaptic events. Glia. 60, 1013-1023 (2012).
- Nizar, K., et al. In vivo stimulus-induced vasodilation occurs without IP3 receptor activation and may precede astrocytic calcium increase. J. Neurosci. 33, 8411-8422 (2013).
- Sutton, M. A., et al. Miniature neurotransmission stabilizes synaptic function via tonic suppression of local dendritic protein synthesis. Cell. 125, 785-799 (2006).
- Ibata, K., Sun, Q., Turrigiano, G. G. Rapid synaptic scaling induced by changes in postsynaptic firing. Neuron. 57, 819-826 (2008).
- Xie, A. X., et al. Bidirectional scaling of astrocytic metabotropic glutamate receptor signaling following long-term changes in neuronal firing rates. PLoS ONE. 7, (2012).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol. Rev. 79, 1089-1125 (1999).
- Petravicz, J., Fiacco, T. A., McCarthy, K. D. Loss of IP3 receptor-dependent Ca2+ increases in hippocampal astrocytes does not affect baseline CA1 pyramidal neuron synaptic activity. J. Neurosci. 28, 4967-4973 (2008).
- Nett, W. J., Oloff, S. H., McCarthy, K. D. Hippocampal astrocytes in situ exhibit calcium oscillations that occur independent of neuronal activity. J. Neurophysiol. 87, 528-537 (2002).
- Garaschuk, O., Milos, R. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1, 380-386 (2006).
- Nimmerjahn, A., Kirchhoff, F., Kerr, J. N., Helmchen, F. Sulforhodamine 101 as a specific marker of astroglia in the neocortex in vivo. Nat. Methods. 1, 31-37 (2004).
- Prezeau, L., et al. Changes in the carboxyl-terminal domain of metabotropic glutamate receptor 1 by alternative splicing generate receptors with differing agonist-independent activity. Mol. Pharmacol. 49, 422-429 (1996).
- Shao, Y., McCarthy, K. D. Quantitative relationship between alpha 1-adrenergic receptor density and the receptor-mediated calcium response in individual astroglial cells. Mol. Pharmacol. 44, 247-254 (1993).
- Wang, S. S., Thompson, S. H. Measurement of changes in functional muscarinic acetylcholine receptor density in single neuroblastoma cells using calcium release kinetics. Cell Calcium. 15, 483-496 (1994).
- Ostasov, P., Krusek, J., Durchankova, D., Svoboda, P., Novotny, J. Ca2+ responses to thyrotropin-releasing hormone and angiotensin II: the role of plasma membrane integrity and effect of G11alpha protein overexpression on homologous and heterologous desensitization. Cell Biochem. Funct. 26, 264-274 (2008).
- Shelton, M. K., McCarthy, K. D. Hippocampal astrocytes exhibit Ca2+-elevating muscarinic cholinergic and histaminergic receptors in situ. J. Neurochem. 74, 555-563 (2000).
- Hermans, E., Challiss, R. A. Structural signalling and regulatory properties of the group I metabotropic glutamate receptors: prototypic family C G-protein-coupled receptors. Biochem. J. 359, 465-484 (2001).
- Zur Nieden, R., Deitmer, J. W. The Role of Metabotropic Glutamate Receptors for the Generation of Calcium Oscillations in Rat Hippocampal Astrocytes In Situ. Cortex. 16 (5), 676-687 (2005).
- de Ligt, R. A., Kourounakis, A. P., AP, I. J. Inverse agonism at G protein-coupled receptors: (patho)physiological relevance and implications for drug discovery. Br. J. Pharmacol. 130, 1-12 (2000).
- Kang, J., et al. Sulforhodamine 101 induces long-term potentiation of intrinsic excitability and synaptic efficacy in hippocampal CA1 pyramidal neurons. Neuroscience. 169, 1601-1609 (2010).
- Tong, X., Shigetomi, E., Looger, L. L., Khakh, B. S. Genetically encoded calcium indicators and astrocyte calcium microdomains. Neuroscientist. 19, 274-291 (2013).
- Akerboom, J., et al. Optimization of a GCaMP Calcium Indicator for Neural Activity Imaging. J. Neurosci. 32, 13819-13840 (2012).
- Shigetomi, E., et al. Imaging calcium microdomains within entire astrocyte territories and endfeet with GCaMPs expressed using adeno-associated viruses. J. Gen. Physiol. 141, 633-647 (2013).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nat. Neurosci. 13, 584-591 (2010).
- Fiacco, T. A., et al. Selective stimulation of astrocyte calcium in situ does not affect neuronal excitatory synaptic activity. Neuron. 54, 611-626 (2007).
- Echegoyen, J., Neu, A., Graber, K. D., Soltesz, I. Homeostatic plasticity studied using in vivo hippocampal activity-blockade: synaptic scaling, intrinsic plasticity and age-dependence. PLoS One. 2, (2007).
- Aguado, F., Espinosa-Parrilla, J. F., Carmona, M. A., Soriano, E. Neuronal activity regulates correlated network properties of spontaneous calcium transients in astrocytes in situ. J. Neurosci. 22, 9430-9444 (2002).
- Takata, N., Hirase, H. Cortical layer 1 and layer 2/3 astrocytes exhibit distinct calcium dynamics in vivo. PLoS ONE. 3, e2525 (2008).
- Salahpour, A., et al. BRET biosensors to study GPCR biology, pharmacology, and signal transduction. Front. Endocrinol. 3 (105), (2012).
- Di Castro, M. A., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat. Neurosci. 14, 1276-1284 (2011).
- Sun, W., et al. Glutamate-dependent neuroglial calcium signaling differs between young and adult. Science. 339, 197-200 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены