Method Article
Induire la plasticité de Astrocytic récepteurs neuronaux par manipulation des taux de combustion
Dans cet article
Résumé
Nous décrivons ici une adaptation des protocoles utilisés pour induire la plasticité homéostatique dans les neurones de l'étude de la plasticité des G récepteurs couplés à la protéine astrocytaires. Récemment utilisé pour examiner les changements dans le groupe I mGluR astrocytes chez les souris jeunes, la méthode peut être appliquée pour mesurer l'échelle des différents RCPG astrocytaires, dans les tissus de souris adultes in situ et in vivo, et d'avoir une meilleure appréciation de la sensibilité des récepteurs astrocytaires aux variations de l'activité neuronale.
Résumé
Près de deux décennies de recherche a établi que les astrocytes in situ et in vivo expriment de nombreuses G récepteurs couplés aux protéines (RCPG) qui peuvent être stimulées par l'émetteur neuronale-publié. Cependant, la capacité des récepteurs astrocytaires à exposer la plasticité en réponse aux variations de l'activité neuronale a reçu peu d'attention. Ici, nous décrivons un système de modèle qui peut être utilisé à l'échelle au niveau mondial haut ou le bas groupe astrocytaire je récepteurs de glutamate métabotropique (mGluR) dans des tranches de cerveau de courte durée. Inclus sont des méthodes sur la façon de préparer des coupes d'hippocampe parasagittales, construire des chambres adaptées à long terme tranche incubation, manipuler bidirectionnelle d'action neuronale fréquence potentiel, les astrocytes de charge et les processus d'astrocytes avec fluorescent Ca 2 + indicateur, et mesurer les changements dans les astrocytes activité Gq GPCR par l'enregistrement astrocytes spontanée et évoquée Ca 2 + événements en utilisant la microscopie confocale. En essence, un "r calciumoadmap "est prévue à la façon de mesurer la plasticité des RCPG Gq astrocytaires. Les applications de la technique pour l'étude des astrocytes sont discutés. Avoir une compréhension de la façon dont la signalisation du récepteur astrocytaire est affecté par des changements dans l'activité neuronale a des implications importantes tant pour la fonction synaptique normale ainsi que les processus sous-jacents des troubles neurologiques et des maladies neurodégénératives.
Introduction
Les astrocytes répondent en quelques secondes à la stimulation des neurones ou axones neuronaux avec des augmentations de Ca 2 + cytoplasmique résultant presque exclusivement de l'activation des RCPG Gq astrocytaires. Par exemple, les récepteurs muscariniques de l'acétylcholine 1, les récepteurs cannabinoïdes 2, α 1A adrénergiques 3, 4, et le groupe I mGluR (voir ci-dessous) sont tous les sous-types astrocytaires Gq GPCR qui répondent aiguë de l'activité neuronale. L'activation du groupe I mGluR astrocytaire a été démontré plus largement, à la suite de la stimulation des afférences de neurones glutamatergiques in situ (tel que des coupes d'hippocampe de courte durée) 5-7, ainsi que dans le cortex de souris adulte in vivo suite à une stimulation sensorielle 8. Le résultat de l'activation des astrocytes Gq GPCR de signalisation sur la biologie et la physiologie des astrocytes, neurones, ou des interactions neurone-astrocyte a été un sujet de débat 9-12. Il sera some temps avant que la fonction de signalisation du récepteur neurone à astrocyte est pleinement apprécié.
S'il est clair que les neurones peuvent activer les récepteurs de astrocytaires en utilisant des protocoles expérimentaux, il ya des aspects de communication neurone à astrocyte récepteur qui restent mal compris. Tout d'abord, le montant réel de l'activité neuronale nécessaire pour activer les astrocytes Gq RCPG n'est pas bien définie, et d'autre part, la capacité des récepteurs astrocytaires exposer utilisation la plasticité a reçu peu d'attention. Pour commencer à répondre à ces questions, nous avons récemment mis au point un protocole pour induire échelle bidirectionnel de groupe I mGluR astrocytes dans des coupes d'hippocampe mineurs aiguë en réponse à des changements à long terme dans le potentiel d'action des neurones (AP)-dépendantes activité synaptique. Similaire à ce qui a été découvert pour la plasticité homéostatique bidirectionnel de neurones récepteurs ionotropiques du glutamate 13, 14, groupe astrocytaire je mGluRs Scale Up following blocus des potentiels d'action neuronaux et réduire lorsque l'action neuronale fréquence potentiel est augmenté de 15. Ces changements compensatoires dans les récepteurs astrocytaires peuvent être mesurées en enregistrant spontanée et évoqués astrocytes Ca 2 + transitoires et en comparant les propriétés de ces événements à ceux des astrocytes dans les conditions témoins. Dans ce manuscrit, nous décrivons la méthodologie complète pour l'utilisation de ce protocole, y compris la préparation de coupes d'hippocampe, conditions d'incubation de courte durée pour induire l'échelle du récepteur de l'astrocyte, astrocytes Ca 2 + colorant indicateur de chargement, Ca 2 + des techniques d'imagerie par microscopie confocale, et les effets attendus sur l'activité des astrocytes Gq GPCR. Effets prévisibles sur les astrocytes Ca 2 + propriétés de signalisation - qui correspondent à ceux enregistrés précédemment dans les cellules cultivées transfectées avec différents niveaux de GPCR Gq d'expression - fournir une "feuille de route" qui peut être utilisé dans de futures études pour analyser les changements dans le plusexpression de GPCR trocytic. Les ramifications et les applications potentielles pour l'utilisation de cette technique contribueront à notre compréhension des interactions entre les astrocytes neuronale dans le cerveau sain et malade.
Protocole
Les procédures qui suivent ont été approuvés par le Comité institutionnel de protection et d'utilisation des animaux de l'Université de Californie, Riverside.
Une. Construction d'incubation Chambre et titulaire Slice
- La construction de la chambre d'incubation: Construire la chambre d'incubation à partir de matériau qui n'est pas toxique. Assurez-vous que la chambre a contrôlé la circulation de l'air, est titulaire d'une quantité suffisante de l'ACSF pour un titulaire de part de flotter, et est assez grand pour que le titulaire de la tranche peut flotter à une extrémité de la chambre tandis que la dispersion de gaz à partir des lignes d'oxygène se produit à la l'autre extrémité. La partie de tiroir d'un conteneur de stockage de pipette avec son couvercle étanche à l'air (figure 1A) s'intègre parfaitement à ces critères.
- Percer un petit trou sur le côté du récipient d'environ 1 ¼ à partir du haut et ¼ à partir du côté. Placez un morceau de tuyau flexible à travers le trou (figure 1B). Faire attention à percer suffisamment faible pour que le tube ne sera pas comprimé lorsque le couvercle est fermé, mais assez haut de sorte qu'il est au-dessus de la solution.
- Appliquez de la silicone joint d'étanchéité ("joint d'étanchéité aquarium") pour créer un joint étanche à l'eau entre la ligne de l'oxygène et de la chambre.
- Connecter l'extrémité "à l'extérieur" de la tubulure à un réservoir de gaz (95% d'oxygène, 5% de dioxyde de carbone) à l'aide d'un raccord Luer mâle. Pour un ajustement personnalisé, coupe à monter un 200 pi biseauté pointe de la pipette naturel (figure 1C).
- Branchez l'extrémité "à l'intérieur" de la tubulure à une ligne plastique collecteur de un à six. Coupez-to-fit six 20 pi Eppendorf conseils microloader de pipette à chaque collecteur d'admission (figure 1D). L'amende ouverture des microloaders est idéale pour produire un flux régulier de petites bulles.
- Pour permettre la ventilation, percer deux petits trous sur le couvercle du récipient (figure 1E).
- La construction de la tranche hplus: Le titulaire de tranche est constituée d'un rack de bulle flottante (figure 1F).
- Retirez les "jambes" de fond de la grille de bulle, et couper le haut à environ 1 ¾ po
- Collez un morceau de nylon matériau maillé au fond de la baie ronde avec de la colle cyanoacrylate (comme Krazy Glue standard) pour créer un support de tranche de huit puits (figure 1G). Chaque puits peut s'adapter à une seule tranche de l'hippocampe de la souris.
- Mettre en place le support de tranche à une extrémité de la chambre d'incubation et de l'appareil de microloader-collecteur à l'autre extrémité. Permettre aux conseils de microloader de se reposer sur le plancher de la chambre (figure 1H). Cette installation est conçu pour assurer une oxygénation suffisante à la fois le haut et le bas des coupes d'hippocampe de courte durée, et pour éviter les bulles sortant directement au-dessous du support de tranche afin de minimiser tranche agitation et éviter le contact direct des bulles avec les tranches d'hippocampe.
- Rincer les chambres d'incubation unetitulaires d tranche abondamment avec le trou DDH 2 O après chaque expérience, et décontaminer avec EtOH à 70% par semaine. Dans le cas de l'incubation des tranches de solutions différentes, les titulaires de multiples chambres / tranche seront nécessaires.
2. Solutions et drogues
- Liquide céphalo-rachidien artificiel (ACSF): Préparer 4 L de l'ACSF standard dans le trou DDH 2 O en utilisant la suivante (en mM): 125 NaCl, KCl 2,5, 2,5 CaCl2, MgCl2 1,3, 1,25 NaH 2 PO 4, 26,0 NaHCO 3, 15 glucose, 0,1 et Trolox. Mesurer l'osmolarité de la solution à l'aide d'un osmomètre, il devrait venir à ~ 310 mOsm. compositions de l'ACSF pour les conditions expérimentales sont décrites ci-dessous (voir protocole n ° 3). Filtrer toutes les solutions en utilisant une bouteille-haut filtre de 0,22 um dans des bouteilles de verre autoclave. Les solutions sont stables à 4 ° C pendant jusqu'à un mois.
- Tranchage tampon: Préparer les tranches en utilisant un ACSF modifié contenant (en mM): 125 NaCl, KCl 2,5, 3,8 MgCl 2, 1,25 NaH 2 PO 4, NaHCO 3 26.0, glucose 15, et 1,3 d'acide ascorbique. Mesurer l'osmolarité de la solution à l'aide d'un osmomètre, il devrait venir à ~ 310 mOsm. Remplacement du CaCl 2 avec MgCl 2 dans le tampon de tranchage permet d'améliorer la santé de la tranche.
- Sulforhodamine 101 (SR-101, 1 M) est utilisé pour identifier les astrocytes dans des coupes d'hippocampe aigus. Faire un stock de 1 mM de SR-101 en diluant 60,67 mg SR-101 dans 100 ml d'une ACSF bas de calcium modifié préparé comme suit (en mM): 125 NaCl, 2,5 KCl, 0,5 CaCl2, 6 MgCl2, 1,25 NaH 2 PO 4, NaHCO 3 26.0, glucose 15, et 1,3 d'acide ascorbique. Vérifiez que l'osmolarité de la faible ACSF de calcium est d'environ 310 mOsm. Diluer le 1 mM SR-101 actions de 1000 fois en Ca 2 + ACSF bas modifié pour le chargement. Stocker la solution finale SR-101 à 4 ° C et à l'abri de la lumière jusqu'au moment de l'expérience.
3. Manipulation de Long terme neuronale tir Tarifs aiguë coupes d'hippocampe
Utilisez l'une des deux protocoles d'incubation dans des expériences séparées à manipuler neuronales taux de combustion à long terme:
- Inhiber la décharge neuronale: incuber dans la tétrodotoxine (TTX, 1 M): ATTENTION: Manipulez avec soin TTX car il peut être mortel en cas d'ingestion en quantités suffisantes. Gants et des lunettes est recommandé. TTX abolit complètement la décharge neuronale AP-entraîné en tranches aiguës. Incuber tranches de 3,5 mM K + ACSF, plus 1 uM TTX à l'état expérimental. Dans la condition contrôle, incuber tranches de 3,5 mM K + ACSF sans TTX. La comparaison entre les deux conditions révèle l'effet du changement d'échelle de l'activité Gq GPCR astrocytes. 3,5 mM de K + ACSF sert de condition de contrôle (par opposition à-dire, 2,5 mM de K +) dans le but de maximiser l'effet du traitement TTX.
- OU -
- Augmenter la décharge neuronale ci-dessusdébits de base: incuber en haute potassium: augmentation de la concentration extracellulaire de K + dépolarise les neurones et augmente leur taux d'allumage de base. Incubation dans 5,0 mM K + ACSF élève considérablement l'action neuronale fréquence potentiel comparativement à 2,5 mM K + ACSF 15. Incuber tranches de 5,0 mM K + ACSF pour la condition expérimentale, et pour la condition de contrôle, incuber les tranches dans la norme de 2,5 mM K + ACSF. La comparaison entre les deux conditions révèle l'effet down-scaling de l'activité Gq GPCR astrocytes.
4. Hippocampe Slice Préparation aiguë
- Mise en place de la chambre de récupération à chaud:
- Chauffer le bain d'eau à 35 ° C, puis placer les chambres d'incubation établis à l'intérieur. Remplir le bain d'eau avec de l'eau jusqu'à la hauteur de l'ACSF dans les chambres d'incubation (figure 1G).
- Oxygéner l'ACSF expérimental et de contrôle avec 95% d'O 2, 5% C. O 2 Les bulles émises par l'appareil de microloader-collecteur doivent être petits et abondante, mais aussi léger, il ne devrait pas y avoir de mouvement visible de l'ACSF dans la chambre.
- Mise en place de la chambre de dissection glacée:
- Prenez deux seaux de glace. Placez une bouteille de 300 ml environ trancher tampon dans un seau de glace et garder oxygéné avec 95% d'O 2, 5% de CO 2 pendant 20 min. Plonger un 100 mm boîte de Petri dans l'autre seau à glace, juste en dessous de la surface de la glace. S'assurer que le côté de la boîte de Petri est en contact direct avec la glace. Versez un peu de tampon de tranchage dans la boîte de Pétri et garder ainsi oxygéné.
- Réfrigérer la pointe de la lame de rasoir unique de bord en le submergeant dans la glace tampon de tranchage froid dans la boîte de Pétri pendant plus de 1 min.
- Vibratome configuration:
- Allumez le vibratome et s'assurer que le drainage est fermé.
- Fixez la chambre de coupe dans la vibrationtome et la banquise autour de la chambre de coupe. Prérefroidir à 0-4 ° C.
- Supprimer usine graisses de la lame de rasoir à double tranchant en le trempant dans EtOH à 70% pendant 5 minutes puis rincer à l'ddH2O. Coupez-le en deux moitiés soigneusement (ne pas plier la lame) et monter une demi lame sur le bloc de coupe.
- Retrait du cerveau de la souris:
- Anesthésier une souris C57BL/6J douze à dix huit-day-old dans une petite chambre préchargé avec 0,5 ml isoflurane trempé dans un Kimwipe ou boule de coton. Pincez doucement les pieds de l'animal pour s'assurer qu'il n'y a pas de réflexe de douleur.
- Décapiter la souris en utilisant une paire de ciseaux pointus, puis retirez le cuir chevelu à l'aide de petites pinces. Utilisez de petits ciseaux d'os à couper le crâne du cervelet aux bulbes olfactifs le long de la fissure longitudinale. Retirez les volets crâniens à l'aide des petites pinces. Retirez délicatement le cerveau d'une spatule, et le plonger dans le tampon de tranchage oxygéné glacée dans la boîte de Pétri.
- BISECt le cerveau de la souris avec la lame de rasoir réfrigérés dans la boîte de Petri pour permettre une plus grande surface pour le refroidissement et l'oxygénation. Laissez les hémisphères bissectés assis dans le tampon de coupe glacée pendant 2-3 min. Le cerveau doit devenir complètement frais et plus solide.
- Appliquez une fine couche de colle cyanoacrylate sur la plate-forme de la vibratome. Collez les deux hémisphères de la plate-forme coupe la tête en bas et les côtés latéraux jusqu'à, avec le bulbe olfactif vers l'avant. Fixez la plate-forme dans la chambre de coupe, puis remplir la chambre de coupe avec le froid de la glace, le tampon de tranchage bien oxygénée.
- Continuer oxygéner la chambre de coupe lors de la préparation de 300 um d'épaisseur des tranches parasagittales utilisant le vibratome. Couper les tranches à une fréquence de 85 Hz, une vitesse d'avancement de 0,20 mm / s, et une amplitude de 1,40 mm. NOTE: Nous avons constaté que la variable la plus importante dans la préparation des coupes d'hippocampe aigus en bonne santé est la qualité de la vibratome. Notre laboratoire utilise le S aimant Leica VT 1200ic conduire vibratome avec Vibrocheck réduire "z" vibration.
- Après la coupe, disséquer l'hippocampe et le cortex entorhinal adjacent sur chaque tranche parasagittale l'aide de pinces acérées. Effectuez cette procédure dans le tampon de tranchage bien oxygéné glacée dans la chambre de coupe de la vibratome. La netteté de la pince est très important pour la santé de la tranche car elle réduit au minimum la manipulation des tranches.
- Faire une pipette de transfert en rompant la longue pointe d'une pipette Pasteur en verre et en tête la partie cassée avec une ampoule de pipette. Ceci permet l'utilisation de la grande extrémité de la pipette de transfert de tranches. Assurez-vous de commander pipettes sans le tampon de coton dans la grande fin (voir le tableau des matériaux). Comme les tranches sont préparés dans des conditions non stériles, il n'est pas nécessaire de passer à l'autoclave la pipette avant l'utilisation, même si une nouvelle pipette doit être préparé et utilisé pour chaque expérience.
- Transférer chaque tranche de l'hippocampe pour les chambres d'incubation dans l'eau C 35 °bain, par immersion de la pipette de transfert dans l'ACSF à l'intérieur de chaque puits du support de tranche et la tranche d'aspiration. Minimiser le mouvement de la tranche pendant ce processus. Le transfert direct des tranches les résultats chaudes de bain d'incubation dans de meilleures tranches de qualité de "montée en puissance" de la température progressivement.
- Laisser les coupes d'hippocampe de récupérer dans le bain d'eau chaude pour un total de 45 minutes, se décomposant comme suit: Incuber tranches pendant 20 min dans 1 uM SR-101 dilué en basse ACSF de calcium, puis de les transférer à la faible ACSF de calcium (sans SR-101) pendant 10 min. Par la suite, transférer les tranches de contrôler ou ACSF expérimental pour le restant 15 minutes de l'incubation chaud.
- Après le 45 min de récupération chaude, déplacer soigneusement les chambres d'incubation du bain d'eau à 35 ° C à la paillasse, et puis laisser les tranches de continuer à incuber à température ambiante pendant un temps total d'incubation de 3 heures avant le début du bolus de chargement protocole (voir ci-dessous).
5. Bolus Chargement de astrocytes Ca 2 + indicateur
- Préparation Ca 2 + indicateur en bolus colorant de charge:
- Pour chaque flacon de colorant (50 ug), ajouter 3,87 ul de diméthyle frais (DMSO) et le vortex soigneusement. La fraîcheur du DMSO est important pour une bonne charge et donc, le crack ouvert une nouvelle ampoule à chaque fois.
- Mélanger dans 9 ul d'acide pluronique à 20% et complètement vortex. Mélanger le colorant avec 100 ul de l'ACSF et puits-tourbillon expérimental ou témoin approprié, pour une concentration de colorant finale de 10 uM.
- Filtrer la solution à l'aide d'un tube de filtre de centrifugation. Cette étape évite la pipette de chargement de colmatage lors de l'éjection du colorant.
- Préparer une pipette à partir d'un capillaire en verre de borosilicate tiré à une résistance d'environ 1,3 MQ lorsqu'elles sont remplies avec une solution de colorant.
- Placer une tranche de l'hippocampe dans une chambre d'enregistrement conçu pour être utilisé avec le microscopeet perfuser de façon continue avec l'ACSF oxygéné de la même composition que l'on a incubé à (1,5 ml / min). Alternez entre le contrôle et les conditions expérimentales lors de la sélection d'une tranche de l'hippocampe.
- Jeter malsains qui cherchent des coupes d'hippocampe. La qualité des tranches varie même au sein d'une expérience donnée. Il n'y a pas de critères établis pour quantifier la santé de tranche, par conséquent, la détermination de la santé de la tranche est subjective et basé principalement sur l'expérience.
- D'une manière générale, garder tranches qui ont une surface lisse et comparant un pourcentage élevé de cellules pyramidales CA1 sains (Figure 2A). Cellules pyramidales CA1 sont particulièrement sensibles et vulnérables aux insultes du SNC, afin d'avoir un pourcentage élevé (≥ 75%) des neurones pyramidaux CA1 sains peut être un des critères utiles pour accepter ou rejeter une tranche.
- Jeter les tranches qui ont environ> 25% des neurones morts. Neurones morts ont un aspect ovoïde frit (figure 2B). NOTE: Nous hadéjà observé que l'angle de la coupe joue un rôle majeur dans si les neurones semblent en bonne santé ou pas. Si dendrites neuronales projettent vers le haut (sur la tranche), puis les neurones seront la plupart du temps mort. C'est sans doute à cause d'une grande partie du volume de neurone tel est contenue à l'intérieur de l'arbre dendritique, qui sectionner les dendrites est létale pour les cellules. D'autre part, si les dendrites sont en saillie parallèlement à ou à un angle vers le bas à partir de la surface de la tranche, il y aura un fort pourcentage de neurones sains. Parfois, donc, les neurones seront la plupart du temps mort sur un côté de la tranche et en bonne santé de l'autre côté.
- Trouver un terrain convenable des astrocytes sr 40-70 um sous la surface de la tranche selon la taille, la morphologie et la localisation utilisant l'interférence différentiel (DIC) optique contraste.
- Chargez la pipette en verre avec une solution de colorant et le ramener à la surface de la tranche au-dessus de ce champ à l'aide d'une micro-électrode holde patch-clamp normer. Avec la pipette à la surface de la tranche, appliquer une contre-pression à la pipette pour commencer l'éjection de colorant. Éjection de colorant sera visible sous deux optiques DIC et un laser approprié comme une ligne 488 pour un colorant vert.
- Lentement abaisser la pipette d'environ 40 um sous la surface de la tranche à l'aide d'un micromanipulateur et laisser le colorant pour éjecter pendant environ 45 à 60 sec. Ensuite, abaisser la pipette un 35 um supplémentaire (75 um sous la surface de la tranche) et éjecter colorant environ 45-60 sec. Rétracter lentement la pointe de la pipette de la tranche. Réduction du temps d'injection est susceptible d'entraîner une insuffisance de charge de colorant, alors que plus l'injection tend à augmenter le fond de chargement, ce qui diminue le rapport signal sur bruit de l'enregistrement.
- Pour veiller à ce qu'un grand nombre d'astrocytes relever le colorant, il est généralement utile d'injecter un second bolus de colorant à une courte distance. Soulevez la pipette à la surface de la tranche, assurez-vous que la pipette n'est pas bouché, alors move la pipette d'environ 80 à 100 um à distance du premier point d'injection, le long de la stratum radiatum. Répéter l'injection d'un bolus à ce site.
- Laisser 30-45 minutes avant l'imagerie pour les astrocytes de prendre la teinture et pour le signal de fond à diminuer. Laisser la tranche dans la chambre de perfusion pendant cette période. Assurez-vous que ce temps d'incubation est construit dans le traitement totale de 4 heures de l'expérience. Obtenir la prochaine tranche et répétez les étapes 5.2 à 5.8.
6. Enregistrement Ca spontanée et Gq GPCR agoniste évoqué Astrocytic 2 + Activité en coupes d'hippocampe
- Mise en place du microscope confocal pour l'imagerie:
- Limiter l'exposition de la tranche à la lumière laser est de la plus haute importance, à une forte exposition peut conduire à teindre blanchiment et / ou de phototoxicité. Utilisation de grossissement optique supérieur ou un cadre augmenté de zoom augmente l'exposition de la lumière au champ imagé. Par conséquent, définir les valeurs par défaut pour chaque laser et le cadre est haute photomultiplicateurg, le gain 1x et 0,5% de la puissance de sortie du laser.
- Appliquer un zoom 1,5 x pour une meilleure visualisation des processus d'astrocytes.
- Réglez la résolution sur le terrain à 512 x 512 pixels.
- Réglez la vitesse de balayage de la plus rapide possible, qui est ~ 1.2 sec par balayage à l'aide du mode de balayage d'une façon.
- Recueillir des spectres d'émission en utilisant des filtres passe-bande de 503 à 548 nm pour le laser 488 nm, et de 624 à 724 nm pour le laser 559 nm. Ces paramètres permettent l'imagerie d'un champ de ~ 5-8 astrocytes à une vitesse relativement rapide à une résolution suffisante pour observer les corps cellulaires des astrocytes et des processus principaux. Idéalement, les astrocytes dans le domaine sera suffisant pour être vu clairement lumineux, mais sans aucune saturation de pixels.
- Confirmer l'identité des cellules chargées de Ca 2 + colorant comme les astrocytes en visualisant le co-marquage SR-101 à l'aide du laser 559 nm.
- Enregistrement astrocytes Ca 2 + activité:
- Dessiner des boîtes à l'aide du logiciel d'acquisition d'image sur des régions d'intérêt (ROEst) dans la même cellule, en l'occurrence sur les corps cellulaires d'astrocytes. Les boîtes devraient pas inclure des pixels de fond, pour obtenir le meilleur rapport signal sur bruit possible. Dessinez une case sur fond comme référence.
- Mettez la perfusion de l'ACSF expérimental plus 1 uM TTX (Abcam) à travers le reste de l'expérience. Ceci élimine les réponses astrocytes de calcium possibles neuronales AP-entraînés. Autres augmentations de la concentration des astrocytes de + Ca 2 sera alors due à la libération quantique vésiculaire, constitutive (basale) l'activité de GPCR, ou une combinaison des deux mécanismes.
- fluorescence d'enregistrement dans le temps de toutes les régions d'intérêt. Toute augmentation de la fluorescence sur base indiquent une augmentation de concentration de Ca2 + cytoplasmique 16, et donc l'activité des RCPG dans les astrocytes 10, 17, 18. Pour éviter des effets d'échelle sur les récepteurs début astrocytaires par TTX, des expériences complètes dans 40 min from moment où le 1 uM TTX perfusion a commencé.
- Après l'obtention de 10 min d'enregistrement de base de l'activité spontanée de Ca 2 +, appliquer un agoniste d'intérêt (tels que DHPG) à des concentrations croissantes de façon séquentielle. Laisser un minimum de 5 min entre les applications à réduire le risque de désensibilisation des récepteurs.
- A la fin de l'enregistrement, appliquer un cocktail d'agonistes pour d'autres GPCR Gq astrocytaires comme un contrôle positif pour astrocytaire intact Gq GPCR voies de signalisation. Des composants du cocktail agoniste dépendront du récepteur d'intérêt. 10 uM de chacun des agonistes de GPCR Gq histamine, carbachol, et 2Na-ATP pour stimuler les récepteurs de l'histamine H1 [H1R], des récepteurs muscariniques cholinergiques [mAChR], et les récepteurs purinergiques [P2YR], respectivement, est un agoniste cocktail couramment utilisé.
- Post-expérience acquisition d'image:
- À la fin de l'enregistrement + Ca 2, prendre des photos avec le 488 nm et 559 nm lasers, fou une confirmation ultérieure de l'identité des astrocytes et le placement de ROI. réglages de puissance laser et HT peuvent être modifiées librement à ce point pour obtenir une image optimale pour colocalisation, car il n'est plus un sujet de préoccupation à propos de l'intensité de la lumière laser affecter les données (figure 2A).
- Répétez les étapes 6.1 à 6.3 pour un total d'environ 8 tranches et 40 astrocytes / groupe. Tranches doivent provenir d'un minimum de 3 souris différentes.
7. Analyse des astrocytes Ca 2 + Activité
- Définition d'une élévation de Ca 2 +: la normalisation dans la définition de Ca 2 + transitoires n'a pas été fermement établi dans la communauté scientifique. Ce qui suit est un protocole typique qui maximise la sensibilité tout en limitant la détection des événements faux positifs sur le bruit de fond.
- Avez un autre membre du laboratoire attribuer à chaque tranche un code numérique afin de les analyser à l'aveuglette. A l'issue de l'analyse, décoder chaque tranche.
- Analyser astrocytes spontanée et évoquée Ca 2 + élévations hors ligne en utilisant un logiciel d'analyse d'imagerie. Redessiner et / ou ajuster la taille, la forme et l'emplacement des ROI comme vous le souhaitez.
- Score augmentations de l'intensité de fluorescence sur la ligne de base en tant que Ca 2 + élévation si l'amplitude de crête est supérieure à deux écarts-types (SD) au-dessus de la moyenne de 30 s de fluorescence de ligne de base moyenne pour au moins deux points d'échantillonnage consécutifs. Dans les enregistrements les plus bruyants (faible rapport signal-bruit), ce critère peut être nécessaire d'ajuster à 3 SD-dessus de la ligne de base moyenne de fluorescence. Définir le début de chaque élévation de Ca 2 + en tant que dernier point de données avant que l'intensité de fluorescence est supérieure à un écart type au-dessus de la moyenne.
- La différence entre du multi vs événements successifs seule pointe. Score un événement comme "du multi" lorsque l'intensité de fluorescence ne revient pas à la ligne de base (ci-après la valeur moyenne de référence 2 SD) pour &# 8804; 9 points de données consécutifs (10,8 sec) entre les pics. Ainsi, les événements de pointe simples auront plus de 10 points de données de référence consécutives entre-eux.
- Classer les événements comme des réponses de type «plateau» lorsque l'intensité de fluorescence maintient pic d'amplitude (± 10% de la valeur de crête) pendant au moins 3,6 sec.
- Analyser l'amplitude, la fréquence et la cinétique des transitoires de calcium spontanées et agonistes-évoqué.
- Définir amplitude crête du + élévation Ca 2 comme point de données avec la valeur d'intensité la plus élevée (en cas de réponses «du multi" utiliser le premier pic, voir figure 2B).
- Calculer le temps de montée comme étant la différence entre l'apparition de la réponse et le temps correspondant à l'amplitude de crête. NOTE: 0 à 100% du temps de montée peut avoir besoin d'être utilisé dans le but d'avoir un nombre suffisant de points de données pour obtenir une valeur de temps; numériser vitesse est une variable importante ici.
- Calculer la latence comme le tempsentre l'ouverture d'agoniste perfusion à l'apparition de la réponse. Temps de montée peut être une mesure plus utile dans des tranches de cerveau, tant lavage à l'époque de créer un facteur de confusion dans le calcul des latences de réponse.
- Déterminer s'il existe des différences statistiquement significatives entre les deux groupes pour chaque paramètre à l'aide du test t de Student indépendant. Utilisez nombre d'astrocytes comme le «n». Utilisez le test du chi-carré de Pearson pour comparer les modèles Ca 2 + de l'activité entre les groupes de contrôle et de traitement. Utilisez test exact 2 de queue de Fisher pour comparer les pourcentages de motifs Ca 2 + d'activités spécifiques entre les groupes de contrôle et de traitement. Exprimer les différences comme * p <0,05, ** p <0,01, et *** p <0,001.
Résultats
Les résultats représentatifs de la figure 3 montrent l'effet de l'incubation de courte durée des coupes d'hippocampe de souris en TTX pour 4-6 heures sur astrocyte sr Ca 2 + de l'activité. Les données comprennent les deux Ca 2 + transitoires spontanés et groupe DHPG évoqués Je mGluR Ca 2 + réponses, de tranches incubées en contrôle ACSF vs ACSF, plus TTX. Autres que les caractéristiques morphologiques caractéristiques de base, ensemble de processus stellaire et la petite taille de soma (~ 10 um), les astrocytes sont identifiés dans le sr par superposition de la Ca 2 + indicateur OGB-une heures avec le marqueur des astrocytes sélective SR-101 19, 20 ( Figure 3A). Les cases numérotées sur les corps cellulaires d'astrocytes correspondent à la fluorescence numérotée sur traces de temps indiquées dans la figure 3B. Le groupe 1 mGluR agoniste (RS)-3.5-DHPG est appliquée pour déterminer les effets d'échelle spécifiques sur le groupe 1 mGluR dans les astrocytes. Pour la distinction entre éducation physiqueiologie dans la spécificité de l'effet de mise à l'échelle à une mGluR de groupe par rapport à d'autres GPCR Gq, un cocktail d'agonistes est appliqué à la fin de chaque expérience. Ici, nous avons utilisé 10 uM chacun de GQ GPCR agonistes histamine, le chlorure de carbamylcholine (de carbachol) et adénosine 5'-ATP disodique (Na-ATP). Le cocktail d'agoniste sert aussi de témoin positif pour déterminer viables, des astrocytes réactifs dans les cas où les cellules ne répondent pas à DHPG, vraisemblablement parce que ces astrocytes notamment n'expriment pas des quantités suffisantes du récepteur à induire une réponse de DHPG.
Nous avons utilisé différentes concentrations de DHPG, dont 5 pM et 15 pM (figure 3B), ainsi que 30 pM et 50 pM (figure 4A) pour aider à révéler des changements dans le groupe astrocytaire je mGluR. La relation entre Ca 2 + réponses cellulaires et les niveaux d'expression Gq GPCR a été préalablement examiné in vitro 21-24. Tout d'abord, l'seuil pour répondre à une concentration de l'agoniste en particulier dépend de la densité des récepteurs exprimés par chaque cellule. Dans une population de cellules, les cellules répondent plus à une élévation de Ca 2 + à une concentration donnée d'agoniste lorsque les cellules sont transfectées avec des densités plus élevées de récepteurs. Après incubation de tranches dans la TTX, le pourcentage de la population dans les astrocytes en réponse à une concentration fixe d'agonistes augmente (figures 3B et 3C). Nous avons constaté que 5 pM et 15 pM DHPG révèlent des différences évidentes dans le pourcentage des astrocytes réactifs entre le contrôle et les cellules TTX traités, alors que 30 et 50 uM DHPG sont tenus de comparer les réponses groupe I mGluR dans 5,0 mM K + traités par rapport au témoin les cellules (figure 4A).
La relation entre les modèles de Ca 2 + de réponse astrocytaires et la concentration de l'agoniste a également été étudiée in situ. L'augmentation de l'agonisteconcentration décale le motif de la réponse + Ca2 dans les astrocytes de pointe unique Ca 2 + élévations pour du multi et plateau de Ca 2 + élévations 25-27. Sur la base de ces constatations antérieures, nous avons prédit que le modèle de réponse à une seule concentration de l'agoniste se déplacer en cas de changements dans le niveau d'expression du récepteur. Ainsi, en fonction de celui des deux modes de mise à l'échelle est utilisée (inhibant la décharge neuronale ou aggraver), la concentration d'agoniste nécessaire pour produire un profil de réponse particulière va augmenter ou diminuer. Par exemple, les astrocytes incubés dans TTX déplacer leur + modèle de réponse DHPG évoqués Ca 2 à plus plateau de type Ca 2 + élévations et de répondre à la baisse des concentrations d'agoniste par rapport à contrôler les astrocytes (figure 3C). En tenant compte des études antérieures, ces observations suggèrent que la je mGluR niveaux d'expression des récepteurs dans les astrocytes groupe a augmenté.
Le temps de montée et le début (temps de latence) des élévations de Ca 2 + ont également été montré une corrélation directe à des changements dans les niveaux d'expression Gq GPCR dans les cellules cultivées 22-24. Les niveaux d'expression des récepteurs plus élevées donnent des latences de réponse plus courts et plus rapides temps de montée alors que la réduction de la densité des récepteurs produit l'effet inverse. Pour les astrocytes incubés dans TTX, Ca 2 + transitoires évoquées par application de DHPG ont significativement plus rapide temps de montée par rapport aux astrocytes incubées en contrôle ACSF (figure 3D). Comme mentionné précédemment, les amplitudes des réponses Ca 2 + agonistes évoqués restent inchangées quelle que soit la concentration de l'agoniste ou le modèle de mise à l'échelle 15 (figure 3D).
Outre les changements observés par le groupe activant directement je mGluRs avec DHPG, astrocytes spontanée Ca 2 + activité est également affectée de façon significative par cette manipulation. Nous observonsda augmentation de 2,26 fois dans le pourcentage d'astrocytes spontanément actives incubées dans TTX par rapport au témoin. Cela représente une augmentation de 12,9% des astrocytes de contrôle présentant une activité spontanée dans le soma de 42,1% dans la TTX incubé astrocytes (figure 3E). Parce qu'il est connu que l'activité des GPCR exposition «intrinsèque» ou constitutive, en l'absence d'agoniste 21, 26, 28, et que le niveau de cette activité intrinsèque augmente avec l'augmentation des niveaux d'expression des récepteurs, ces données suggèrent que la densité de astrocytaires augmente Gq RCPG après réduction à long terme dans l'action neuronale tir potentiel. Semblable à des réponses agonistes évoqués, les temps de montée des Ca 2 + élévations spontanées sont également augmenté (figure 3F).
Des données représentatives à l'aide du deuxième protocole, l'incubation en potassium extracellulaire élevée (5,0 mM), est représenté dans Figure 4. Une augmentation de K + extracellulaire à partir des résultats 2,5-5,0 mM à une augmentation significative de l'action des neurones CA3 fréquence basale potentiel 15. Des concentrations plus élevées de DHPG (30 pM et 50 pM) sont nécessaires afin d'évoquer le groupe I mGluR Ca 2 + réponses des astrocytes incubées en haute potassium (figures 4A et 4B). Ceci est cohérent avec un niveau réduit de groupe I mGluR réactivité dans les astrocytes après une hausse à long terme de potentiels d'action neuronaux. En outre, le profil de réponse évoquée à une concentration fixe de DHPG déplace à partir des réponses des plateaux en forme de réponses plus faibles mono-pointe (Figure 4B). Examinant le pourcentage des astrocytes spontanément actifs dans les deux conditions de potassium révèle que moins élevé dans les astrocytes incubées K + sont spontanément actifs par rapport à la condition contrôle (Figure 4C). Cet effet se trouve dans la oppositdirection de l'e de TTX état dans lequel le pourcentage d'astrocytes présentant des élévations de Ca 2 + spontanées est augmentée. Enfin, à la fois évoquée et Ca 2 + élévations spontanées ont plus progressive dans les astrocytes incubées en haute K + par rapport à la condition de contrôle (figures 4C et 4D). Dans l'ensemble, ces données suggèrent que les niveaux d'expression astrocytaires Gq GPCR échelle bidirectionnelle en fonction du niveau d'action neuronale activité potentielle sur une période de temps prolongée.

Figure 1. Fabrication de la chambre d'incubation et de mettre en place une tranche. (A) Le passage de tiroir d'un conteneur de stockage de pipette Brinkmann avec son couvercle étanche à l'air est utilisé pour construire la tranche chambre d'incubation. (B) Drill un trou dans le côté du récipient d'environ 1 ¼ à partir du haut et dans ¼ du côté. Monter dans un morceau de tuyau flexible. (C) Branchez l'appareil de microloader-collecteur à l'extrémité intérieure du tube flexible. Remarque couper au montage pointe de la pipette 200 ul naturel (flèche blanche). (D) Six 20 pi microloaders Eppendorf sont coupées au montage à un collecteur d'une ligne à six pour créer un appareil de microloader-collecteur. (E) Percez deux petits trous sur le couvercle. (F) Un rack de bulle flottant pour faire le support de tranche. (G) Les "jambes" du fond de l'armoire de bulles flottantes sont retirées de telle sorte qu'un morceau de matériau à mailles en nylon peut être collé au fond. (H) Remplir la chambre d'incubation avec une quantité suffisante de l'ACSF de sorte que les flotteurs de support de tranche. Réglez la longueur du tube de sorte que les pointes des microloaders peuvent se reposer dans un coin de plancher de la chambre. Lors du placement de la chambre d'incubation enle bain d'eau, le niveau d'eau dans le bain doit être au même niveau que l'ACSF dans la chambre. Cliquez ici pour agrandir l'image.
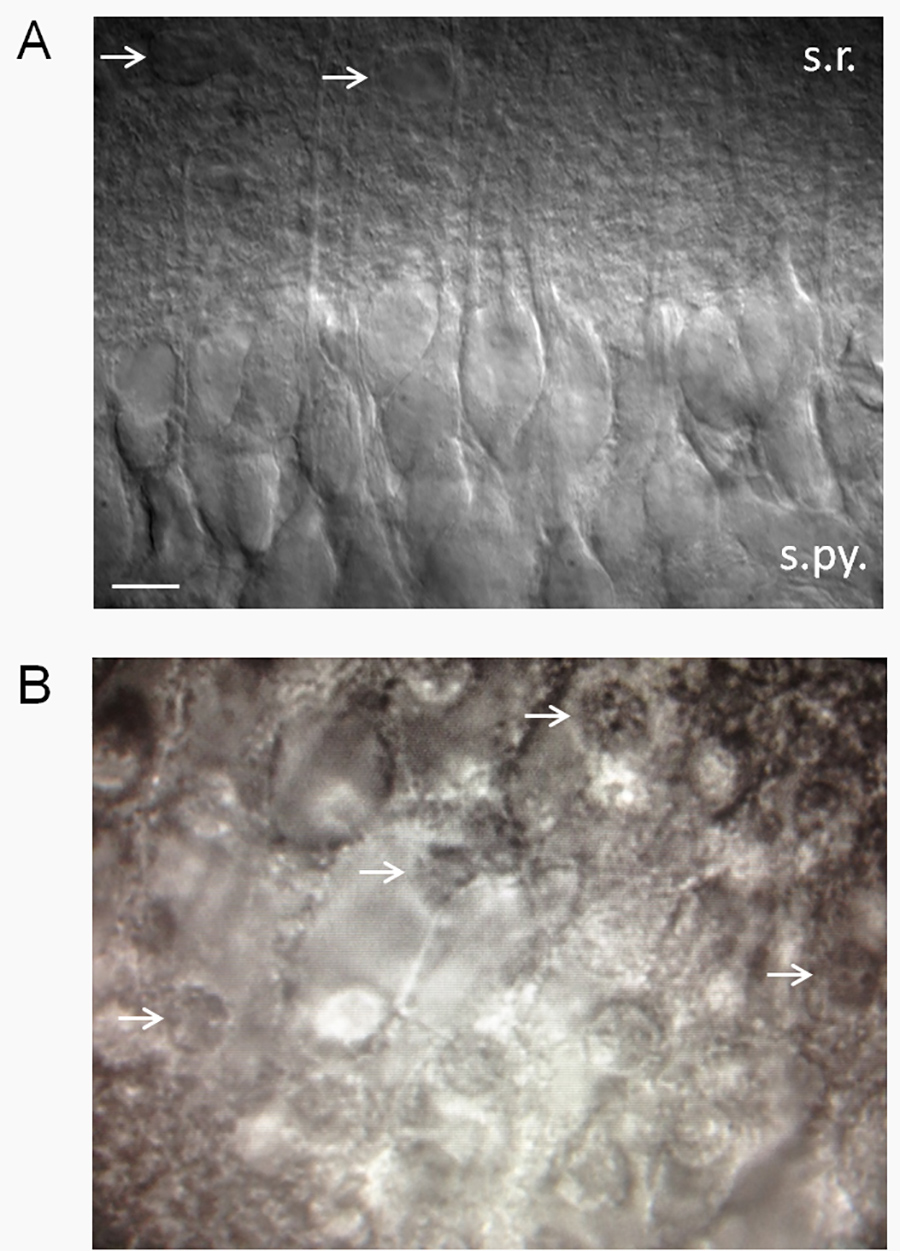
Figure 2. Estimation de la santé de la tranche. (A) Une tranche de l'hippocampe saine à l'aide d'interférence différentiel (DIC) optique contraste. Tranches en bonne santé ont une apparence veloutée et un pourcentage élevé de neurones pyramidaux CA1 sains. Notez les dendrites apicales saillie dans la strate radiatum. Patch-clamp de neurones qui ressemblent à ceux présentés ici révèlent un potentiel de repos de membrane faible (-61 à -62 mV) en standard de 2,5 mM K + ACSF avec quelques potentiels d'action spontanée. Les taux de potentiel de membrane et de cuisson varieront en fonction de l'exextracellulaire de K + (Xie et al. 15). Les flèches indiquent les astrocytes putatifs. Abréviations: sr, la stratum radiatum; s.py., strate pyramidale. La barre d'échelle, 10 um. (B) tranches malsaines auront un pourcentage élevé de morts neurones pyramidaux CA1, qui ont l'apparence d'œufs frits (flèches blanches indiquent les noyaux des neurones morts - le "jaune" de l'oeuf sur le plat). Cliquez ici pour agrandir l'image.
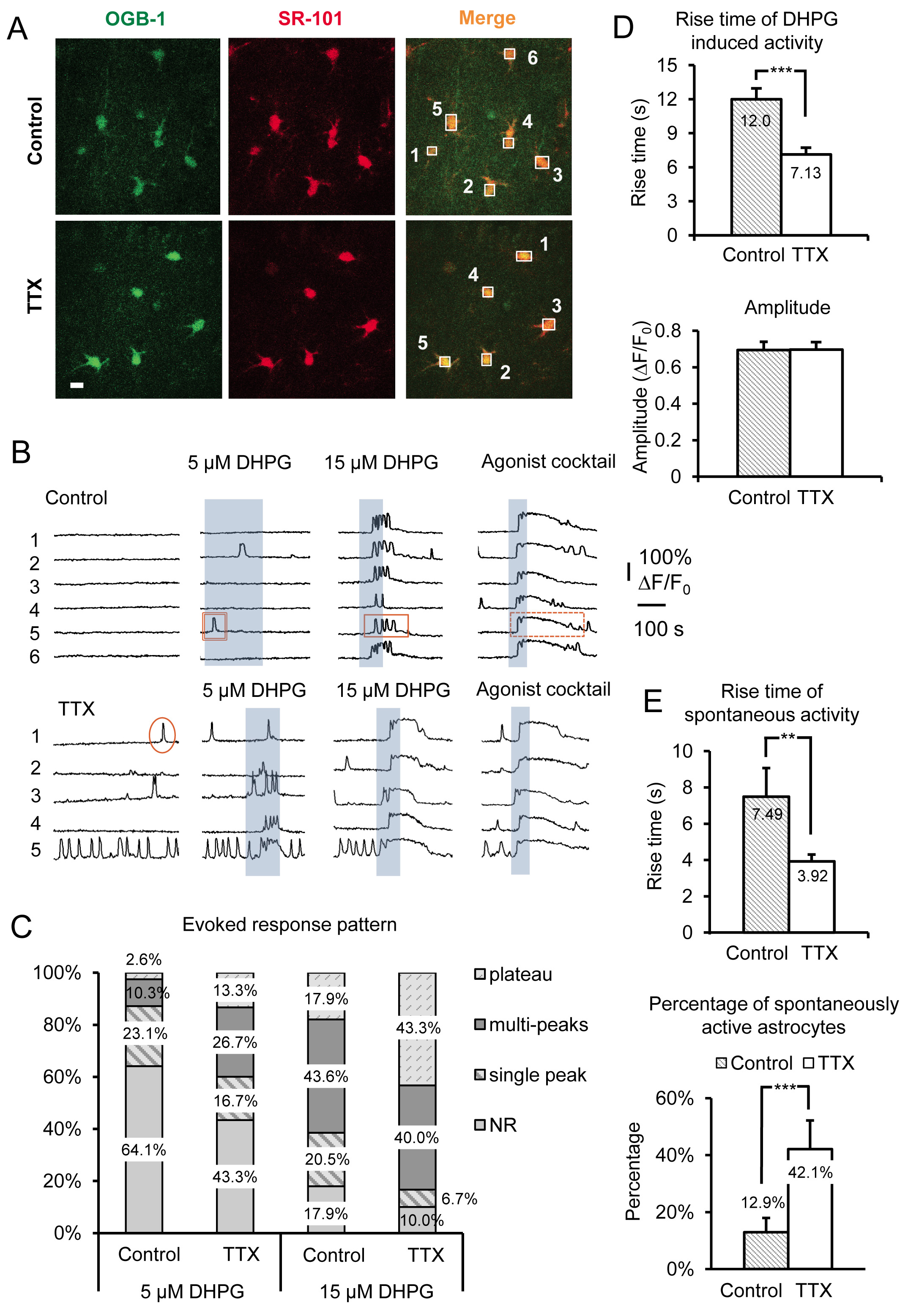
Figure 3. Enregistrement amplifié activité Gq GPCR et le groupe évoqué je mGluR Ca 2 + réponses après inhibition à long terme de points d'accès neuronales par incubation dans TTX. (A) des images représentatives de cellules dans le domaine de l'enregistrement incubées dans control conditions (panneaux supérieurs) ou dans TTX (panneaux inférieurs) qui ont pris Oregon Green BAPTA-une heures Ca 2 + colorant indicateur (panneaux de gauche) et SR-101 (panneaux intermédiaires). La barre d'échelle est de 10 um. Superposition de deux signaux («fusionner») indique que les astrocytes charge avec Ca 2 + indicateur. Les boîtes sont établis sur personne soma des astrocytes à enregistrer l'intensité de fluorescence au cours du temps dans le canal vert pour surveiller l'activité Ca 2 + dans les astrocytes. (B) Exemples de traces provenant des caisses enregistreuses par A) de l'activité de Ca 2 + dans les astrocytes. Astrocytes incubés dans TTX spectacle augmentation de l'activité spontanée et le groupe évoqué plus robuste je mGluR Ca 2 + réponses comme en témoigne par des changements dans le modèle de réponse. Exemples de pointe unique (cercle), du multi (rectangle), et le plateau (rectangle pointillé) Ca 2 + transitoires sont présentés. (C) les changements dans les modes d'intervention sont particulièrement évidents en utilisant concent différenterations du groupe I mGluR agoniste DHPG. Plus de réponses multi crête et de plateau sont évidents après incubation dans TTX par rapport au témoin à une concentration de l'agoniste donné. (D) Hausse temps de Ca 2 + réponses DHPG-évoqués sont plus rapides dans les astrocytes incubés dans TTX par rapport au contrôle (panneau supérieur), tandis que les amplitudes ne changent pas (panneau inférieur), indicatif d'amplitudes de réponse «tout ou rien», une fois le seuil de répondre a été atteinte. (E) Hausse temps de astrocyte spontanée Ca 2 + transitoires sont également plus rapides dans TTX incubé par rapport au témoin incubé astrocytes (panneau supérieur), tandis que le pourcentage des astrocytes dans la population présentant spontanées Gq GPCR Ca 2 + augmente l'activité (panneau inférieur). Cliquez ici pour agrandir l'image.

Figure 4. Enregistrement astrocytaire diminué activité Gq GPCR et groupes évoqués Je mGluR Ca 2 + réponses suivantes augmentation à long terme dans les points d'accès neuronales par incubation en potassium extracellulaire élevée. (A) des traces représentatives des astrocytes Ca 2 + enregistrements de tranches incubées dans 5,0 mM K + ACSF à dépolariser les neurones et augmenter leur cadence de tir de base par rapport à contrôler ACSF (2,5 mM K + ACSF). Astrocytes incubées avec 5,0 mM K + ACSF exposition somatiques Ca 2 + transitoires de moins spontanées et plus faible DHPG évoqués réponses par rapport aux astrocytes incubées en contrôle ACSF. (B) Une comparaison des modèles de réponses évoquées à plusieurs concentrations de DHPG révèle types de réponse plus faibles après l'augmentation à long terme dans les points d'accès neuronales. (C) Une réduction du pourcentage des astrocytes dans la population présentant Ca 2 + activité spontanée est observée après incubation à long terme en K + élevé comparé à contrôler ACSF (panneau supérieur), tandis que les temps de montée de l'activité spontanée deviennent plus lents (panneau inférieur). (D) Hausse temps de astrocyte évoqué Ca 2 + réponses à différentes concentrations de DHPG devenu plus lent suivant le traitement 5.0 mM K + par rapport aux astrocytes incubées en contrôle ACSF. Cliquez ici pour agrandir l'image.
Discussion
Les modèles d'échelle décrites représentent des méthodes pratiques pour la recherche plasticité à long terme d'un groupe astrocytaire je mGluR. Imagerie Ca 2 + événements spontanés et évoqués fournit un test sensible pour mesurer les changements dans l'activité Gq GPCR astrocytes, comme preuve solide a été établi que astrocytes Ca 2 + élévations se produisent suite à la libération de la propriété intellectuelle 3 magasins de R-sensible en aval de l'activation Gq GPCR 10, 12, 17, 18. Le pourcentage des astrocytes dans la population face au groupe I mGluR agoniste et le motif de ces Ca 2 + réponses signalent des changements dans le groupe I mGluR par les astrocytes.
La technique spécifique utilisée pour charger les astrocytes Ca 2 + indicateur est une considération importante dans la conception d'expériences pour chercher les changements dans l'activité Gq GPCR astrocytes. Bolus chargement ou plusieurs astrocytes de chargement en vrac, ou patch-clamp chargement des astrocytes individuels peut être utilisé pour l'image de Ca 2 + transitoires dans les astrocytes. Chaque approche offre des avantages et des inconvénients. Remplissant directement les astrocytes Ca 2 + indicateur via patch clamp permet l'identification sans équivoque de la cellule comme un astrocyte sans nécessité d'un marqueur secondaire tel que SR-101. Livraison de patch-clamp de l'indicateur permet également l'enregistrement de Ca 2 + activité de petits compartiments astrocytaires y compris les processus fines broussailleux, potentiellement plus profondes dans la tranche où les cellules sont en meilleure santé et avec des interactions plus intactes avec des synapses (en fonction de la puissance du laser disponible). Cependant, patch-clamp charge souffre d'une faible débit que les données sont recueillies une cellule à la fois. Bulk-chargement, au contraire, permet à un grand nombre d'astrocytes à être chargé avec du Ca 2 + et imager simultanément indicateur. Cependant, seulement astrocytes près de la surface (<20 mm) de la tranche sont chargés, avec préoccupation associées sur la santé des cellules et synapses intactes.
La contre-pression protocole bolus chargement présenté ici offre un terrain d'entente, relativement à haut débit et la capacité de surveiller l'activité Ca 2 + plus profondément dans la tranche (40-75 um). Une augmentation significative du pourcentage des astrocytes spontanément actifs en utilisant la technique bolus de chargement est observée par rapport à chargement en vrac, ce qui suggère que les liens entre les synapses neuronales et les processus astrocytaires sont plus complets 15. Avec une bonne charge, on peut souvent suivre Ca 2 + activité dans les principaux processus d'astrocytes (données non présentées) ou peut-être même petits compartiments en utilisant la microscopie à 2 photons. Cependant, il devra être exercé dans l'attribution des petits processus à un astrocyte particulier, que les limites se fondent dans le fond non spécifique coloration. Une inquiétude supplémentaire à l'utilisation de procédures en vrac chargement ou bolus de chargement est la nécessité d'un mar secondaireker pour l'identification des astrocytes. Bien qu'il ait connu depuis de nombreuses années que les astrocytes prennent préférentiellement jusqu'à ester AM Ca 2 + indicateurs, le marqueur secondaire SR-101 est souvent utilisé pour vérifier les cellules chargées que les astrocytes. SR-101 peut, en soi, de modifier l'excitabilité des neurones intrinsèques 29. L'utilisation de SR-101 corrobore la nécessité d'effectuer toutes les astrocytes Ca 2 + dans les mesures TTX pour limiter d'éventuels effets SR-101 sur l'excitabilité neuronale. En supposant que le groupe contrôle et expérimentaux comprennent SR-101, le marqueur en elle-même ne doit pas tenir compte des effets observés chez les astrocytes Ca 2 + signalisation suivants manipulation à long terme des potentiels d'action neuronaux. SR-101 peut être plus préoccupant en haute K + expériences, cependant, car il peut réduire la différence entre 2,5 mM K + vs 5,0 mM de K +, si le taux d'allumage de base n'est pas modifiée proportionnellement.
Une approche très prometteuse pour fournir Ca 2 + Indicateur aux astrocytes est apparue récemment qui offre une alternative intéressante aux approches plus traditionnelles utilisant Ca 2 + colorants. Des progrès significatifs ont été accomplis au cours des dernières années avec des indicateurs de calcium génétiquement codés (GECIS) destinés aux astrocytes 30-32. GECIS est acheminé en astrocytes par micro-injection de vecteurs viraux adéno-associés in vivo dans une région du cerveau d'intérêt telles que l'hippocampe. Expression de GECIS est atteinte après environ deux semaines après l'infection virale 32. Il existe de nombreux avantages présentés par l'utilisation de GECIS dans les astrocytes. Tout d'abord, les vecteurs sont ciblées sur les astrocytes en utilisant un promoteur spécifique des astrocytes, de sorte que les cellules marquées sont astrocytes 32. Deuxièmement, le rapport signal sur bruit, semble maintenant comparable à ce qui peut être obtenu en utilisant la livraison de patch-clamp de colorant, mais sans le caractère envahissant d'avoir eu une pipette de patch sur la cellule 32. Troisièmement, les indicateurs peuvent être delivered et exprimée dans les tissus adultes, ce qui est problématique en utilisant des méthodes de livraison en vrac de chargement. En outre, l'expression est en mosaïque, en offrant la possibilité de faire la différence entre de multiples astrocytes. Ainsi, plusieurs astrocytes peuvent potentiellement être visualisés simultanément, tout en enregistrant dans le soma et rameaux fins dans le même temps. Par conséquent, potentiellement une technique unique pourrait être utilisé à la place de trois techniques distinctes (chargement en vrac, bolus de chargement, et de patch-clamp chargement) pour enregistrer l'activité des RCPG échelle Gq astrocytaires, augmentant considérablement l'efficacité.
Un inconvénient potentiel de l'utilisation de la livraison à médiation virale de Ca 2 + indicateurs aux astrocytes est l'effet possible sur la santé de la tranche 32. Les vecteurs viraux adéno-associés utilisés pour livrer les GECIS ont été précédemment montré pour causer gliose réactive des astrocytes 33. Préparation des tranches de cerveau en général initie probablement parmi les premiers stades de la pathologie dont la libération de inflammatory 10 molécules. Par conséquent, combiné avec les temps d'incubation longs nécessaires pour induire l'échelle des récepteurs astrocytaires, l'utilisation de GECIS livré utilisant des vecteurs viraux aurait besoin de recevoir une contrepartie supplémentaire dans le contexte de la santé de la tranche dans ces types d'expériences.
Lors de l'utilisation de ce protocole, il est important de garder à l'esprit que le temps d'application pour agoniste à produire une réponse variera en fonction de la disponibilité des récepteurs. Pour une concentration donnée de l'agoniste, le temps d'application devra être plus longue si les récepteurs sont mis à l'échelle vers le bas, et la plus courte si les récepteurs sont mis à l'échelle vers le haut, pour le médicament d'atteindre une concentration suffisante dans les tissus pour activer les récepteurs suffisamment pour produire un rapport Ca 2 + réponse. Par conséquent, les temps d'application du médicament, et éventuellement de leurs concentrations, peuvent devoir être ajustés en fonction de la direction prévue de la mise à l'échelle. Par exemple, la concentration de l'agoniste peut avoir besoin d'être abaissé dans le case de TTX pour éviter de saturer les réponses, et a augmenté après l'incubation des tranches en haute K + voir même une réponse. Plus précisément, la concentration DHPG a été déplacé de 5-15 uM après le traitement TTX 30-50 uM après traitement 5,0 mM K + afin d'étudier les modèles de Ca 2 + de réponse, comme 5-15 uM était souvent trop faible pour produire des réponses fiables à astrocytes après révision à la baisse du groupe I mGluR.
Enregistrement des astrocytes Ca 2 + activité fournit pas de preuve directe de l'insertion ou de l'internalisation du récepteur ou à partir de la membrane plasmique. Cependant, sur la base de la similitude remarquable des données avec des données provenant d'études antérieures in vitro qui ont examiné la relation directe entre le niveau d'expression Gq GPCR et spontanée et évoquaient Ca 2 + transitoires 21-24, l'interprétation la plus logique des changements en Ca 2 + la signalisation est que les niveaux d'expression des récepteurs de surface d'astrocytes ontchangé. Une approche complémentaire peut être un facteur important si l'on veut fournir des preuves supplémentaires sur le lieu de l'effet sur l'activité Ca 2 +. Une stratégie que nous avons utilisé était d'examiner l'effet de TTX incubation sur des tranches d'hippocampe de souris MrgA1R astrocytaires. Ces souris transgéniques expriment un Gq GPCR étrangère (MrgA1R) que dans les astrocytes. Parce que ce récepteur n'est pas indigène au cerveau, il n'y a pas neurotransmetteur endogène présent de modifier ses niveaux d'activité. Des travaux antérieurs suggéré que ce récepteur engage le même que les molécules endogènes groupe I mGluR de signalisation dans les mêmes astrocytes 34 intracellulaire. Incubation après à long terme de tranches provenant de souris MrgA1R à la TTX, aucune différence dans les réponses MrgA1R agonistes évoqués par rapport au contrôle de la même portée incube les tranches ne fournissent la preuve que Ca 2 + activité de l'effet sur les astrocytes est due à des changements localisés au récepteur de la surface, en particulier si les réponses du groupe I mGluR sont encore Significantly renforcée dans les mêmes astrocytes. Une autre solution, bien que peut-être plus impliqué stratégie consisterait à isoler les astrocytes dans les tranches pour l'analyse Western blot, aussi longtemps que la fraction membranaire pouvait être analysée pour les changements dans les niveaux d'expression des récepteurs de surface. Cellulaire activé par fluorescence (FACS) ou la cytométrie en flux peut être utile ici.
Les applications possibles de cette technique pour l'étude des neurones, les astrocytes et les interactions neurones-astrocytes sont nombreux. Dans nos expériences, seul groupe DHPG évoqués Je mGluR Ca 2 + réponses astrocytaires ont été étudiés, dans les régions isolées des tranches d'hippocampe de souris aigus mineurs. Cette préparation a non seulement les afférences intactes (des collatérales de Schaffer), mais aussi les neurones qui sont à leur origine (cellules pyramidaux CA3), ce qui permet de manipuler les taux de ces neurones glutamatergiques de tir sur les cellules post-synaptiques (cellules pyramidales CA1) et les astrocytes dans la strate radiatum dont les processus assoe avec ces synapses. La tranche de l'hippocampe aiguë peut-être pas la meilleure préparation pour manipuler les taux d'autres types de neurones de tir, cependant, que de nombreux afférents sont séparées des neurones qui leur donnent naissance. Néanmoins, il peut être possible dans certaines préparations de tranche d'observer la plasticité des autres sous-types Gq GPCR astrocytaires. Par exemple, les tranches peuvent être préparées avec les neurones cholinergiques basales du cerveau antérieur et de leurs projections de l'hippocampe intact. L'incubation de ces tranches dans TTX ou K + élevée aurait une incidence sur les taux de mise à feu des neurones cholinergiques basaux, ce qui conduit à la mise à l'échelle de mAchRs dans les astrocytes du stratum oriens, qui reçoivent une partie importante de l'apport cholinergique 1. Une alternative encore d'approche non testé à étudier l'échelle des récepteurs astrocytes dans une zone spécifique du cerveau, avec toutes les connexions intacts tandis que l'échelle se produit, pourrait être d'utiliser un modèle in vivo où une libération prolongée de TTX est réalisé par l'implantation d'un plastic polymère Elvax 40W-dessus de la région d'intérêt 35. Cette approche a été utilisée précédemment dans une étude de mise à l'échelle des neurones, mais devrait également être applicable à l'échelle des astrocytes. Enfin, la lecture correcte, les études futures pourraient examiner d'autres familles de RCPG, y compris des changements dans l G ou G i RCPG. On pourrait prévoir des astrocytes GABA B G i GPCR d'être affectés suite à l'inhibition de tir à projeter localement interneurones GABA dans une préparation de tranche. Développement de nouveaux indicateurs visant d'autres molécules de signalisation, comme un indicateur en temps réel de la deuxième camp de messager, serait d'ouvrir un tout nouveau domaine de recherche sur la communication du récepteur des neurones-astrocytes à.
Mise à l'échelle bidirectionnel de mGluR astrocytaires en manipulant les taux basaux neurone de tir fournit une mesure de la sensibilité des astrocytes à libération médiée par AP de neurotransmetteur. Les astrocytes peuvent apparemment détecter les points d'accès spontanés et glutamate de presse à Schaffer garantie-CA1 synapses des cellules pyramidales, même si K + extracellulaire est dans une gamme physiologique. Bien que l'application de TTX aiguë ne réduit pas la fréquence spontanée des astrocytes activité de Ca 2 + 18, 36, 37, l'activité de Ca 2 + chez les astrocytes dans la population devient décorrélés 36, fournissant la preuve que les récepteurs sont des détecteurs astrocytaires AP. Ceci suggère que les astrocytes détectent les points d'accès neuronales spontanées avec aucun effet sur leur activité globale de Ca 2 +. Il est largement admis que les concentrations intracellulaires d'IP 3 doivent atteindre un niveau de seuil pour stimuler IP 3 Rs suffisamment pour entraîner une élévation de Ca 2 + détectable. AP neuronales spontanées pourraient activer GPCR astrocytaires sans produire mesurables Ca 2 + élévations? Les études futures pourraient utiliser Fluorescence Resonance Energy Transfer (FRET) ou un techn similaire ique (comme BRET) pour examiner la relation entre G couplage de la protéine au récepteur (une mesure de l'activation du récepteur) et Ca 2 + de presse dans les magasins internes. BRET a été largement utilisée in vitro pour détecter la protéine G à GPCR accouplement 38, même si elle peut être un certain temps avant que cette technologie sera disponible pour une utilisation dans des préparations de tissus intacts. Il est possible que les RCPG Gq astrocytaires sont activés beaucoup plus fréquemment que peuvent être enregistrées en utilisant les outils de Ca 2 + d'imagerie actuellement disponibles. En plus de la détection des potentiels d'action, GPCR Gq astrocytaires peuvent également être en mesure de détecter libération quantique miniature de neurotransmetteur tel que rapporté dans une étude récente 39. Procédé de mise à l'échelle bidirectionnel décrit ici peut être utilisé dans des études ultérieures pour fournir une mesure de la mesure dans laquelle les GPCR astrocytaire Gq détecter la libération de neurotransmetteur vésiculaire quantique, en incluant la bafilomycine A1 dans le protocole d'incubation.
ntent "> Jusqu'à présent, les protocoles d'échelle ont été utilisé que dans des coupes d'hippocampe de souris juvénile (p12-p18). Par conséquent, il est actuellement inconnu si l'échelle de récepteur astrocytes pourrait aussi être induite dans les tissus obtenus à partir de souris adultes. Une étude convaincante récente suggère que le groupe expression je mGluR dans les astrocytes diminue considérablement après la première semaine de l'âge et continue à diminuer jusqu'à l'âge adulte, avec de très faibles niveaux d'expression des récepteurs dans les astrocytes adultes 40. Il serait donc intéressant de déterminer si mGluRs astrocytaires s'adaptent à la suite de long l'inhibition de la durée de la décharge neuronale dans adultes tranches d'hippocampe de souris à des niveaux proches de ceux observés dans les astrocytes de souris juvéniles. Cette constatation suggère que l'expression du récepteur astrocytes n'est pas statique à un âge donné, mais peut changer rapidement en fonction des niveaux de l'activité neuronale. Contrairement à réduction de l'expression de groupe I mGluR chez la souris adulte, la preuve est en train d'émerger que les récepteurs adrénergiques, y compris & #945; 1A, 2A α, β et d'une sous-types, sont principalement exprimés par les astrocytes dans le cerveau adulte 3, 4. L'α 1A adrénergiques Gq GPCR peut être une cible intéressante pour de futures études de communication neurone à astrocyte, y compris si ces récepteurs sont sensibles aux variations de taux adrénergiques neurone de tir.Déclarations de divulgation
Les auteurs tiennent à indiquer la tétrodotoxine utilisée dans ces études a été acheté chez Abcam. Abcam n'était pas impliqué dans les hypothèses, la conception ou la collecte de données. Toute communication relative au parrainage de l'œuvre par Abcam a eu lieu après le processus d'examen par les pairs a été complète.
Remerciements
Les auteurs tiennent à remercier le Centre de l'UC Riverside pour gliales neuronaux Interactions de discussion précieux des protocoles et des données mise à l'échelle. Les auteurs souhaitent également donner un remerciement sincère à Abcam pour le parrainage de la publication de leurs travaux.
matériels
| Name | Company | Catalog Number | Comments |
| Chamber Supplies | |||
| Brinkmann pipette storage container | Fisher Scientific | 03-491 | Use the drawer portion as the incubation chamber |
| Electrical drill | |||
| Flexible tubing | Tygon | R-3603 | |
| Silicone seam sealant | Also called aquarium seam sealer | ||
| Gas tank | 95% oxygen, 5% carbon dioxide | ||
| Natural beveled pipette tip | USA Scientific | 1111-1000 | Cut-to-fit to connect oxygenate lines |
| One-to-six lines manifold | Warner Instruments | 64-0210 (MP-6) | For the microloader-manifold apparatus |
| Microloader | Eppendorf | 5242 956.003 | For the microloader-manifold apparatus, cut-to-fit |
| Floating Bubble Rack | Bel Art Scienceware | F18875-0400 | For slice holder |
| 600 µm Sefar Nitex Nylon mesh | ELKO Filtering Co. | 06-600/51 | For slice holder |
| Krazy Glue | For slice holder | ||
| Reagents | |||
| Isoflurane | Baxter | 1001936060 | |
| NaCl | Fisher | S271-3 | |
| KCl | Fisher | P333-500 | |
| CaCl2 | Fisher | C79-500 | |
| MgCl2 | Fisher | M33-500 | |
| NaH2PO4 | Fisher | S369-500 | |
| NaHCO3 | Fisher | S233-500 | |
| Glucose | Fisher | Fisher | |
| (±)-6-Hydroxy-2,5,7,8- tetramethylchromane-2-carboxylic acid (Trolox) | Acros Organics | 53188-07-1 | |
| Ascorbic acid | Acros Organics | 401471000 | |
| Tetrodotoxin citrate (TTX) | Abcam | ab120055 | |
| Sulforhodamine 101 (SR-101) | Sigma-Aldrich | 284912 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Pluronic Acid F-127 | Invitrogen, Molecular Probes | P6867 | |
| Oregon Green 488 BAPTA-1 AM *cell permeant (special packaging) | Invitrogen, Molecular Probes | O6807 | |
| (RS)-3,5-DHPG | Abcam | ab120020 | |
| Histamine | Sigma-Aldrich | H7125 | |
| Carbamoylcholine chloride (Carbachol) | Sigma-Aldrich | C4382 | |
| Adenosine 5’-ATP disodium (Na-ATP) | Sigma-Aldrich | A7699 | |
| Dissection Tools | |||
| Single-edge razor blade | GEM | 62-0161 | For bisection |
| Double edge razor blade | TED PELLA, INC. | 121-6 | For cutting slices |
| Mayo Scissors, supercut | WPI | 14010-15 | For decapitation |
| Fine iris scissors, straight | Fine Science Tools | 14094-11 | For cutting the skull |
| Iris forceps, curved | WPI | 15915 | To remove the skin and skull |
| Small spatula | To remove/transfer the brain | ||
| Dumostar Dumont #5 Biologie Tip forceps | Fine Science Tools | 11295-10 | For hippocampus dissection |
| Glass Pasteur pipette | Fisher | 13-678-20B | For transferring brain slices |
| Pasteur pipette rubber bulb | Fisher | 03-448-22 | For transferring brain slices |
| Polystyrene 100 mm tissue culture dishes | Corning | 25020 | |
| Vibratome | Leica | VT 1200S | |
| Water bath | Fisher | ISOTEMP 210 | For warm incubation |
| Micropipette puller | Narishige | PC-10 | For bolus-loading pipette |
| Confocal microscope | Olympus | Olympus Fluoview 1000 | |
| Low Profile Open Diamond Bath Imaging Chamber with PM-1 platform | Warner Instruments | RC-26GLP | diamond bath with low profile |
| Borosilicate glass pipette | World Precision Instruments | TW150F-4 | For bolus-loading pipette |
| Micromanipulator | Sutter Instrument | ROE-200 | For bolus-loading pipette |
| Spin-X centrifuge tube filter with 0.22 µm cellulose acetate | Costar | 8161 |
Références
- Araque, A., Martin, E. D., Perea, G., Arellano, J. I., Buno, W. Synaptically released acetylcholine evokes Ca2+ elevations in astrocytes in hippocampal slices. J. Neurosci. 22, 2443-2450 (2002).
- Navarrete, M., Araque, A. Endocannabinoids mediate neuron-astrocyte communication. Neuron. 57, 883-893 (2008).
- Bekar, L. K., He, W., Nedergaard, M. Locus coeruleus alpha-adrenergic-mediated activation of cortical astrocytes in vivo. Cereb. Cortex. 18, 2789-2795 (2008).
- Hertz, L., Lovatt, D., Goldman, S. A., Nedergaard, M. Adrenoceptors in brain: cellular gene expression and effects on astrocytic metabolism and Ca2. Neurochem. Int. 57, 411-420 (2010).
- Porter, J. T., McCarthy, K. D. Hippocampal astrocytes in situ respond to glutamate released from synaptic terminals. J. Neurosci. 16, 5073-5081 (1996).
- Bernardinelli, Y., et al. Astrocytes display complex and localized calcium responses to single-neuron stimulation in the hippocampus. J. Neurosci. 31, 8905-8919 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Wang, X., et al. Astrocytic Ca2+ signaling evoked by sensory stimulation in vivo. Nat. Neurosci. 9, 816-823 (2006).
- Fiacco, T. A., Agulhon, C., McCarthy, K. D. Sorting out astrocyte physiology from pharmacology. Annu. Rev. Pharmacol. Toxicol. 49, 151-174 (2009).
- Agulhon, C., et al. Calcium Signaling and Gliotransmission in Normal vs Reactive Astrocytes. Front. Pharmacol. 3, 139 (2012).
- Nedergaard, M., Verkhratsky, A. Artifact versus reality--how astrocytes contribute to synaptic events. Glia. 60, 1013-1023 (2012).
- Nizar, K., et al. In vivo stimulus-induced vasodilation occurs without IP3 receptor activation and may precede astrocytic calcium increase. J. Neurosci. 33, 8411-8422 (2013).
- Sutton, M. A., et al. Miniature neurotransmission stabilizes synaptic function via tonic suppression of local dendritic protein synthesis. Cell. 125, 785-799 (2006).
- Ibata, K., Sun, Q., Turrigiano, G. G. Rapid synaptic scaling induced by changes in postsynaptic firing. Neuron. 57, 819-826 (2008).
- Xie, A. X., et al. Bidirectional scaling of astrocytic metabotropic glutamate receptor signaling following long-term changes in neuronal firing rates. PLoS ONE. 7, (2012).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol. Rev. 79, 1089-1125 (1999).
- Petravicz, J., Fiacco, T. A., McCarthy, K. D. Loss of IP3 receptor-dependent Ca2+ increases in hippocampal astrocytes does not affect baseline CA1 pyramidal neuron synaptic activity. J. Neurosci. 28, 4967-4973 (2008).
- Nett, W. J., Oloff, S. H., McCarthy, K. D. Hippocampal astrocytes in situ exhibit calcium oscillations that occur independent of neuronal activity. J. Neurophysiol. 87, 528-537 (2002).
- Garaschuk, O., Milos, R. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1, 380-386 (2006).
- Nimmerjahn, A., Kirchhoff, F., Kerr, J. N., Helmchen, F. Sulforhodamine 101 as a specific marker of astroglia in the neocortex in vivo. Nat. Methods. 1, 31-37 (2004).
- Prezeau, L., et al. Changes in the carboxyl-terminal domain of metabotropic glutamate receptor 1 by alternative splicing generate receptors with differing agonist-independent activity. Mol. Pharmacol. 49, 422-429 (1996).
- Shao, Y., McCarthy, K. D. Quantitative relationship between alpha 1-adrenergic receptor density and the receptor-mediated calcium response in individual astroglial cells. Mol. Pharmacol. 44, 247-254 (1993).
- Wang, S. S., Thompson, S. H. Measurement of changes in functional muscarinic acetylcholine receptor density in single neuroblastoma cells using calcium release kinetics. Cell Calcium. 15, 483-496 (1994).
- Ostasov, P., Krusek, J., Durchankova, D., Svoboda, P., Novotny, J. Ca2+ responses to thyrotropin-releasing hormone and angiotensin II: the role of plasma membrane integrity and effect of G11alpha protein overexpression on homologous and heterologous desensitization. Cell Biochem. Funct. 26, 264-274 (2008).
- Shelton, M. K., McCarthy, K. D. Hippocampal astrocytes exhibit Ca2+-elevating muscarinic cholinergic and histaminergic receptors in situ. J. Neurochem. 74, 555-563 (2000).
- Hermans, E., Challiss, R. A. Structural signalling and regulatory properties of the group I metabotropic glutamate receptors: prototypic family C G-protein-coupled receptors. Biochem. J. 359, 465-484 (2001).
- Zur Nieden, R., Deitmer, J. W. The Role of Metabotropic Glutamate Receptors for the Generation of Calcium Oscillations in Rat Hippocampal Astrocytes In Situ. Cortex. 16 (5), 676-687 (2005).
- de Ligt, R. A., Kourounakis, A. P., AP, I. J. Inverse agonism at G protein-coupled receptors: (patho)physiological relevance and implications for drug discovery. Br. J. Pharmacol. 130, 1-12 (2000).
- Kang, J., et al. Sulforhodamine 101 induces long-term potentiation of intrinsic excitability and synaptic efficacy in hippocampal CA1 pyramidal neurons. Neuroscience. 169, 1601-1609 (2010).
- Tong, X., Shigetomi, E., Looger, L. L., Khakh, B. S. Genetically encoded calcium indicators and astrocyte calcium microdomains. Neuroscientist. 19, 274-291 (2013).
- Akerboom, J., et al. Optimization of a GCaMP Calcium Indicator for Neural Activity Imaging. J. Neurosci. 32, 13819-13840 (2012).
- Shigetomi, E., et al. Imaging calcium microdomains within entire astrocyte territories and endfeet with GCaMPs expressed using adeno-associated viruses. J. Gen. Physiol. 141, 633-647 (2013).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nat. Neurosci. 13, 584-591 (2010).
- Fiacco, T. A., et al. Selective stimulation of astrocyte calcium in situ does not affect neuronal excitatory synaptic activity. Neuron. 54, 611-626 (2007).
- Echegoyen, J., Neu, A., Graber, K. D., Soltesz, I. Homeostatic plasticity studied using in vivo hippocampal activity-blockade: synaptic scaling, intrinsic plasticity and age-dependence. PLoS One. 2, (2007).
- Aguado, F., Espinosa-Parrilla, J. F., Carmona, M. A., Soriano, E. Neuronal activity regulates correlated network properties of spontaneous calcium transients in astrocytes in situ. J. Neurosci. 22, 9430-9444 (2002).
- Takata, N., Hirase, H. Cortical layer 1 and layer 2/3 astrocytes exhibit distinct calcium dynamics in vivo. PLoS ONE. 3, e2525 (2008).
- Salahpour, A., et al. BRET biosensors to study GPCR biology, pharmacology, and signal transduction. Front. Endocrinol. 3 (105), (2012).
- Di Castro, M. A., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat. Neurosci. 14, 1276-1284 (2011).
- Sun, W., et al. Glutamate-dependent neuroglial calcium signaling differs between young and adult. Science. 339, 197-200 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon