Method Article
Indurre Plasticità di astrociti recettori per manipolazione del neuronali di cottura Prezzi
In questo articolo
Riepilogo
Qui si descrive un adattamento dei protocolli usati per indurre plasticità omeostatica nei neuroni per lo studio della plasticità dei recettori accoppiati a proteina G astrociti. Utilizzati di recente per esaminare i cambiamenti nel gruppo astrociti I mGluRs nei topi giovani, il metodo può essere applicato per misurare il ridimensionamento di diversi GPCR astrocitiche, in tessuto dai topi adulti in situ e in vivo, e di ottenere un migliore apprezzamento della sensibilità dei recettori astrocitici a cambiamenti nell'attività neuronale.
Abstract
Vicino a due decenni di ricerca ha stabilito che gli astrociti in situ e in vivo esprimono numerosi recettori accoppiati alla proteina G (GPCR) che possono essere stimolati da trasmettitore neuronally rilasciato. Tuttavia, la capacità dei recettori astrocitici esporre plasticità in risposta ai cambiamenti nell'attività neuronale ha ricevuto scarsa attenzione. Qui si descrive un modello di sistema che può essere usato per scalare a livello globale su o giù gruppo astrocitaria I metabotropici recettori del glutammato (mGluRs) in fettine di cervello acuto. Incluso sono metodi su come preparare fettine di ippocampo parasagittali, costruire camere adatte fetta di incubazione a lungo termine, bidirezionale manipolare azione neuronale potenziale di frequenza, astrociti carico e processi astrociti con fluorescente Ca 2 + indicatore e misurare le variazioni di astrociti attività Gq GPCR per la registrazione astrociti spontanea ed evocata Ca 2 + eventi utilizzando la microscopia confocale. In sostanza, un "calcio roadmap "è previsto come misurare la plasticità del astrocitiche GPCR Gq. Applicazioni della tecnica per lo studio di astrociti sono discussi. Avere una comprensione di come la segnalazione del recettore astrociti è influenzato da cambiamenti nell'attività neuronale ha importanti implicazioni sia per la normale funzione sinaptica, così come i processi sottostanti disturbi neurologici e malattie neurodegenerative.
Introduzione
Gli astrociti rispondono pochi secondi alla stimolazione dei neuroni o assoni neuronali con aumenti in citoplasmatica di Ca 2 + derivanti quasi esclusivamente dalla attivazione di astrocitiche GPCR Gq. Ad esempio, i recettori muscarinici 1, recettori dei cannabinoidi 2, α 1A recettori adrenergici 3, 4, e il gruppo I mGluRs (vedi sotto) sono tutti astrociti sottotipi Gq GPCR che acutamente rispondono all'attività neuronale. Attivazione del gruppo astrociti I mGluRs è stata dimostrata più ampiamente, in seguito a stimolazione di afferenze neuronali glutammatergici in situ (come fettine ippocampali acute) 5-7, nonché in adulto corteccia topo in vivo dopo stimolazione sensoriale 8. L'esito di attivazione di astrociti Gq GPCR segnalazione sulla biologia e fisiologia degli astrociti, neuroni, astrociti o interazioni dei neuroni è stato oggetto di dibattito 9-12. Sarà some tempo prima che la funzione di segnalazione dei recettori dei neuroni-to-astrociti è pienamente apprezzato.
Mentre è chiaro che i neuroni possono attivare i recettori astrociti utilizzando protocolli sperimentali, ci sono aspetti della comunicazione neurone recettore-to-astrociti che rimangono poco conosciute. In primo luogo, la quantità effettiva di attività neuronale necessaria per attivare astrociti Gq GPCR non è ben definito, e in secondo luogo, la capacità dei recettori astrocitiche di esporre uso-dipendente plasticità ha ricevuto scarsa attenzione. Per cominciare a rispondere a queste domande, abbiamo recentemente sviluppato un protocollo per indurre scala bidirezionale di gruppo astrociti I mGluRs in fettine di ippocampo giovanili acute in risposta a cambiamenti a lungo termine nel potenziale d'azione neuronale (AP)-dipendente l'attività sinaptica. Analogamente a quanto è stato scoperto per bidirezionale plasticità omeostatica delle neuronali recettori del glutammato ionotropici 13, 14, gruppo astrociti I mGluRs scalare following blocco dei potenziali d'azione neuronali e scala verso il basso quando l'azione neuronale potenziale frequenza è aumentata 15. Questi cambiamenti compensativi recettori astrociti possono essere misurati registrando spontanea e evocate astrociti Ca 2 + transitori e confrontando le proprietà di questi eventi a quelli di astrociti in condizioni di controllo. In questo manoscritto, si descrive la metodologia completa per l'utilizzo di questo protocollo, compresa la preparazione di fettine di ippocampo, condizioni acute di incubazione di indurre scala recettore astrociti, astrociti Ca 2 + colorante indicatore di carico, Ca 2 + tecniche di imaging utilizzando la microscopia confocale, e degli effetti attesi su astrociti attività Gq GPCR. Effetti prevedibili sulla astrociti Ca 2 + proprietà di segnalazione - che corrispondono a quelli registrati in precedenza in cellule in coltura trasfettate con diversi livelli di espressione di GPCR Gq - fornire una "roadmap" che può essere usato in studi futuri per eseguire il test per le modifiche comeespressione GPCR trocytic. Le ramificazioni e potenziali applicazioni per l'uso di questa tecnica contribuiranno alla nostra comprensione delle interazioni astrociti-neuroni nel cervello sano e malato.
Protocollo
Le procedure che seguono sono state approvate dal Comitato Istituzionale cura degli animali e uso della University of California, Riverside.
1. Costruzione di incubazione Camera e Slice Holder
- Costruire la camera di incubazione: Costruire la camera di incubazione da materiale che non è tossico. Assicurarsi che la camera ha controllato la circolazione dell'aria, detiene una quantità sufficiente di ACSF per un titolare fetta di galleggiare, ed è sufficientemente grande in modo che il titolare fetta può galleggiare ad una estremità della camera mentre la dispersione del gas da linea di ossigeno avviene alla all'altra estremità. La porzione cassetto di un contenitore di stoccaggio pipetta con il coperchio a tenuta d'aria (Figura 1A) approssima questi criteri ben.
- Praticare un piccolo foro sul lato del contenitore di circa 1 ¼ dalla parte superiore e ¼ dal lato. Montare un pezzo di tubo flessibile attraverso il foro (Figura 1B). Fare attenzione a forare sufficientemente bassa in modo che il tubo non sarà compresso quando il coperchio è chiuso, ma abbastanza alto in modo che è al di sopra della soluzione.
- Applicare cucitura silicone sigillante ("cucitura sigillante acquario") per creare una tenuta stagna tra la linea di ossigeno e la camera.
- Collegare l'estremità "esterno" del tubo ad un serbatoio di gas (95% ossigeno, 5% di anidride carbonica) utilizzando un raccordo Luer maschio. Per una calzata personalizzata, cut-to-fit naturale smussata 200 microlitri pipetta punta (Figura 1C).
- Collegare l'estremità "all'interno" del tubo ad un collettore di plastica uno a sei linea. Cut-to-fit sei 20 ml Eppendorf consigli microloader pipetta ad ogni collettore di aspirazione (Figura 1D). L'ammenda apertura dei microloaders è ideale per produrre un flusso costante di piccole bolle.
- Per consentire la ventilazione, praticare due piccoli fori sul coperchio del contenitore (Figura 1E).
- Costruire la fetta hanziani: il titolare fetta è costituito da una bolla galleggiante Rack (Figura 1F).
- Rimuovere il fondo "gambe" del rack bolla, e tagliare la parte superiore per circa 1 ¾ in
- Incollare un pezzo di materiale di nylon mesh fondo del rack rotondo con colla di cianoacrilato (quali la norma Krazy Glue) per creare un titolare fetta otto pozzetti (Figura 1G). Ogni bene può andare bene una sola fetta dell'ippocampo mouse.
- Montare il supporto della fetta ad una estremità della camera di incubazione e l'apparato microloader-collettore all'altra estremità. Lasciare le punte microloader di riposare sul pavimento della camera (Figura 1H). Questa configurazione è progettato per garantire ossigenazione sufficiente sia la parte superiore e la parte inferiore delle fettine ippocampali acute, e per evitare bolle che esce direttamente sotto il supporto fetta per minimizzare fetta agitazione e impedire il contatto diretto con le bolle fettine ippocampali.
- Sciacquare le camere di incubazione untitolari d fetta accuratamente con DDH 2 O dopo ogni esperimento, e decontaminare con il 70% EtOH settimanale. Nel caso di incubazione fette in diverse soluzioni, saranno necessari supporti camere multiple / fetta.
2. Soluzioni e droghe
- Artificiale liquido cerebrospinale (ACSF): Preparare 4 L di ACSF norma in DDH 2 O utilizzando il seguente (in mm): 125 NaCl, 2.5 KCl, 2,5 CaCl 2, 1.3 MgCl 2, 1.25 NaH 2 PO 4, 26.0 NaHCO 3, 15 glucosio, e 0,1 Trolox. Misurare l'osmolarità della soluzione utilizzando un osmometer, che dovrebbe venire a ~ 310 mOsm. Composizioni ACSF per le condizioni sperimentali sono descritte di seguito (vedi protocollo 3). Filtrare tutte le soluzioni utilizzando un filtro per bottiglia da 0,22 micron in bottiglie di vetro in autoclave. Le soluzioni sono stabili a 4 ° C per un mese.
- Affettare Buffer: Preparare le fette con un ACSF modificato contenente (in mm): 125 NaCl, 2.5 KCl, 3.8 MGCl 2, 1.25 NaH 2 PO 4, 26,0 NaHCO 3, 15 glucosio e 1,3 acido ascorbico. Misurare l'osmolarità della soluzione utilizzando un osmometer, che dovrebbe venire a ~ 310 mOsm. Sostituzione di CaCl 2 con MgCl 2 nel buffer di affettatura migliora la salute fetta.
- Sulforodamina 101 (SR-101, 1 mM) è usato per identificare astrociti a fettine ippocampali acute. Effettuare uno stock di 1 mm SR-101 diluendo 60,67 mg SR-101 in 100 ml di una ACSF bassa di calcio modificato preparata come segue (in mm): 125 NaCl, 2.5 KCl, 0,5 CaCl 2, 6 MgCl 2, 1.25 NaH 2 PO 4, 26.0 NaHCO3, 15 glucosio, 1.3 e acido ascorbico. Verificare che l'osmolarità della bassa ACSF calcio è ~ 310 mOsm. Diluire il 1 mM SR-101 stock 1000 volte a partire Ca 2 + ACSF modificato per il caricamento. Conservare la soluzione finale SR-101 a 4 ° C e al riparo dalla luce fino a quando necessario per l'esperimento.
3. Manipolazione di Long Term neuronale Firing tempi in acuta fettine di ippocampo
Utilizzare uno dei due protocolli di incubazione in esperimenti separati di manipolare i tassi di firing neuronale a lungo termine:
- Inibire firing neuronale: incubare in tetrodotossina (TTX, 1 mM): ATTENZIONE: Maneggiare TTX con cura in quanto può essere fatale se ingerito in quantità sufficienti. Si consigliano guanti e occhiali. TTX abolisce completamente AP-driven firing neuronale in fettine acute. Incubare fette in 3.5 mM K + ACSF, più 1 micron TTX nella condizione sperimentale. Nella condizione di controllo, incubare fette di 3,5 mm K + ACSF senza TTX. Il confronto tra le due condizioni rivela l'effetto up-scaling in astrocitaria attività Gq GPCR. 3,5 mM K + ACSF serve come condizione di controllo (in contrapposizione a dire, 2,5 mM K +) al fine di massimizzare l'effetto del trattamento TTX.
- OPPURE -
- Aumentare neuronale soprabasali: incubare in alto potassio: aumento della concentrazione extracellulare di K + depolarizza neuroni e aumenta la loro frequenza di scarica basale. L'incubazione in 5.0 mM K + ACSF eleva notevolmente azione neuronale potenziale frequenza rispetto a 2,5 mM K + ACSF 15. Incubare fette in 5,0 mM K + ACSF per la condizione sperimentale, e per la condizione di controllo, incubare fette in standard da 2,5 mM K + ACSF. Il confronto tra le due condizioni rivela l'effetto down-scala in astrocitaria attività Gq GPCR.
4. Acuta ippocampale Slice Preparazione
- Impostazione della camera di recupero caldo:
- Riscaldare il bagnomaria a 35 ° C, quindi posizionare le camere di incubazione preparati all'interno. Riempire la vasca con acqua fino all'altezza del ACSF entro le camere di incubazione (Figura 1G).
- Ossigenare il ACSF sperimentale e di controllo con il 95% O 2, 5% CO 2. Le bolle emesse dall'apparato microloader-collettore dovrebbe essere piccolo e abbondante, ma anche dolce, non ci dovrebbe essere alcun movimento visibile ACSF all'interno della camera.
- Impostazione della camera di dissezione ghiacciata:
- Prendete due secchi di ghiaccio. Mettere una bottiglia di affettare tampone in un secchio di ghiaccio di circa 300 ml e tenerlo ossigenato con il 95% O 2, 5% di CO 2 per 20 min. Immergere una capsula Petri 100 millimetri nell'altra ghiaccio, appena sotto la superficie di ghiaccio. Assicurarsi che il lato della piastra di Petri è in contatto diretto con il ghiaccio. Versare un po 'di buffer taglio nella piastra di Petri e tenerlo ossigenato pure.
- Raffreddare il tagliente della lama di un rasoio singolo bordo immergendo nel ghiaccio buffer di taglio freddo nella capsula di Petri per più di 1 min.
- Vibratome setup:
- Accendere il vibratome e assicurarsi che il drenaggio sia chiuso.
- Fissare la camera di taglio in vibrazionitome e impacco di ghiaccio intorno alla camera di taglio. Preraffreddare a 0-4 ° C.
- Rimuovere fabbrica grassi dalla lama di rasoio doppio bordo immergendolo in 70% EtOH per 5 minuti e poi risciacquare con ddH2O. Tagliare a metà con attenzione (non piegare la lama) e montare una lama metà sul blocco di taglio.
- Rimozione del cervello di topo:
- Anestetizzare un dodici a diciotto giorni di vecchio mouse C57BL/6J in una piccola camera precaricato con 0,5 ml di isoflurano imbevuto in una Kimwipe o batuffolo di cotone. Pizzicare delicatamente le dita della polizia per assicurarsi che non vi è alcun riflesso dolore.
- Decapitare il mouse usando un paio di forbici affilate, quindi rimuovere il cuoio capelluto con piccole pinze. Utilizzare piccole forbici per tagliare ossa del cranio dal cervelletto di bulbi olfattivi lungo la fessura longitudinale. Rimuovere i lembi cranici utilizzando le piccole pinze. Rimuovere delicatamente il cervello con una spatola, e immergerlo nel buffer affettare ossigenato ghiacciato nella capsula di Petri.
- BISECt cervello di topo con la lametta refrigerata nella scatola di Petri per consentire una maggiore area superficiale per il raffreddamento e l'ossigenazione. Lasciate che i emisferi bisecato siedono nel buffer di taglio freddo ghiaccio per 2-3 min. Il cervello dovrebbe diventare completamente freddo e più solida.
- Applicare uno strato sottile di colla cianoacrilato sulla piattaforma del vibratome. Incollare entrambi gli emisferi alla piattaforma di taglio laterale basso e fianchi laterali in su, con il bulbo olfattivo rivolto in avanti. Fissare la piattaforma nella camera di taglio, quindi riempire la camera di taglio con il freddo ghiaccio, buffer di affettare ben ossigenata.
- Continua l'ossigenazione della camera di taglio durante la preparazione di 300 micron fette spesse parasagittali utilizzando il vibratome. Tagliare le fette ad una frequenza di 85 Hz, una velocità di avanzamento di 0,20 mm / sec, e un'ampiezza di 1,40 mm. NOTA: Abbiamo trovato che l'unica variabile più importante nella preparazione sani fettine ippocampali acute è la qualità del vibratome. Il nostro laboratorio utilizza il magnete Leica VT 1200 Sic guidare vibratome con Vibrocheck per ridurre le vibrazioni "z".
- Dopo il taglio, sezionare l'ippocampo e la corteccia entorinale adiacente su ogni fetta parasagittale con pinze taglienti. Eseguire questa procedura nel buffer affettare ben ossigenata ghiacciata nella camera di taglio del vibratome. La nitidezza della pinza è molto importante per la salute sezione come si minimizza la manipolazione delle fette.
- Fai una pipetta di trasferimento rompendo la lunga punta di una pipetta Pasteur di vetro e in cima alla parte rotta con una lampadina pipetta. Questo consente di utilizzare l'estremità più grande della pipetta per trasferire fette. Assicurati di ordinare pipette senza il plug cotone nel grande finale (vedi tabella Materials). Come fette vengono preparate in condizioni sterili, non è necessario in autoclave la pipetta prima dell'uso, sebbene una nuova pipetta deve essere preparato ed utilizzato per ogni esperimento.
- Trasferire ogni fetta dell'ippocampo alle camere di incubazione in acqua 35 ° Cbagno, immergendo la pipetta di trasferimento nel ACSF all'interno di ogni pozzetto della titolare fetta ed aspirando la fetta. Minimizzare il movimento della fetta durante questo processo. Trasferimento diretto delle fette alle calde risultati bagno incubazione in fettine di qualità migliore di "rampa" la temperatura gradualmente.
- Lasciare le fettine di ippocampo di recuperare nel bagno d'acqua calda per un totale di 45 minuti, ripartiti come segue: incubare le fette per 20 minuti in 1 micron SR-101 diluito in basso ACSF calcio, poi trasferirli al basso ACSF calcio (senza SR-101) per 10 min. Successivamente, trasferire le fette di controllare o ACSF sperimentale per il restante 15 min di incubazione caldo.
- Dopo 45 min di recupero calda, spostare attentamente le camere di incubazione dal bagno di acqua a 35 ° C alla parte superiore del banco, e quindi consentire le fette di continuare ad incubare a temperatura ambiente per un tempo di incubazione totale di 3 ore prima di iniziare il bolo-loading protocollo (vedi sotto).
5. Bolo carico degli astrociti con Ca 2 + Indicator
- Preparazione Ca 2 + indicatore bolo-loading dye:
- Per ogni flaconcino di colorante (50 mg), aggiungere 3,87 ml di dimetil fresco (DMSO) e vortex accuratamente. La freschezza del DMSO è importante per una buona carico e quindi, crack aprire una nuova fiala ogni volta.
- Mescolare in 9 ml di 20% di acido pluronico e vortex accuratamente. Mescolare il colorante con 100 ml di appropriata ACSF e vortice ben sperimentale o di controllo, per una concentrazione di colorante finale di 10 pM.
- Filtrare la soluzione con un tubo filtro centrifuga. Questo passaggio impedisce la pipetta loading intasamento durante l'espulsione del colorante.
- Preparare una pipetta da un capillare di vetro borosilicato tirato ad una resistenza di circa 1,3 mW volta riempito di soluzione colorante.
- Mettere una fetta dell'ippocampo in una camera di registrazione da utilizzare con il microscopioe continuamente profumato con ACSF ossigenato della stessa composizione che è stata incubata in (1,5 ml / min). Alternate tra il controllo e le condizioni sperimentali quando si seleziona una fetta dell'ippocampo.
- Eliminare malsano che cercano fettine di ippocampo. La qualità di fette varierà anche entro un dato esperimento. Non esistono criteri stabiliti per quantificare la salute fetta, quindi, la determinazione della salute fetta è soggettivo e basato principalmente sull'esperienza.
- In generale, mantenere fette che hanno una superficie appare liscia e un'alta percentuale di cellule piramidali CA1 sane (Figura 2A). Cellule piramidali CA1 sono particolarmente sensibili e vulnerabili agli insulti del sistema nervoso centrale, in modo da avere una percentuale di grandi dimensioni (≥ 75%) dei neuroni CA1 piramidale sani può essere un criterio utile per accettare o rifiutare una fetta.
- Eliminare le fette che hanno circa il> 25% neuroni morti. Neuroni morti hanno un uovo-come l'apparenza fritti (Figura 2B). NOTA: Ci have osservato che l'angolo di taglio gioca un ruolo importante in se neuroni sembrano sani o no. Se dendriti neuronali stanno proiettando verso l'alto (fuori sezione), poi i neuroni saranno per lo più morti. Questo è presumibilmente perché una larga parte del volume neurone è contenuto all'interno dell'albero dendritico, che recisione dei dendriti è letale per le cellule. D'altra parte, se i dendriti proiettano parallelo o ad un angolo verso il basso dalla superficie fetta, ci sarà una percentuale di neuroni sani. A volte, quindi, i neuroni saranno principalmente morto su un lato della fetta e sano sull'altro lato.
- Individuare un campo adeguato di astrociti sr 40-70 micron sotto la superficie fetta in base alle dimensioni, la morfologia e la posizione utilizzando il contrasto di interferenza differenziale (DIC) ottica.
- Caricare la pipetta di vetro con la soluzione colorante e abbassarlo alla superficie della fetta di sopra di questo campo usando un patch-clamp microelettrodo holde normar. Con la pipetta sulla superficie della fetta, applicare una contropressione alla pipetta per iniziare eiezione di colorante. Espulsione del colorante sarà visibile sotto le due ottiche DIC e un laser appropriato quale una linea 488 per un colorante verde.
- Lentamente abbassare la pipetta a circa 40 micron sotto la superficie sezione utilizzando un micromanipolatore e consentire il colorante per espellere per circa 45-60 sec. Quindi, abbassare la pipetta un ulteriore 35 micron (75 micron sotto la superficie slice) ed espellere colorante per circa 45-60 secondi. Lentamente ritrarre la punta della pipetta dalla fetta. Tempo di iniezione più breve è suscettibile di provocare insufficiente colorante carico, mentre le iniezioni più tende ad aumentare caricamento in background, che diminuisce il rapporto segnale-rumore della registrazione.
- Per garantire che un gran numero di astrociti occupano il colorante, di solito è utile per iniettare un secondo bolo colorante a breve distanza. Sollevare la pipetta verso la superficie della fetta, assicurarsi che la pipetta non è intasato, quindi move la pipetta circa 80-100 micron di distanza dal primo sito di iniezione, lungo la radiatum strato. Ripetere l'iniezione in bolo in questo sito.
- Consentire 30-45 min prima di imaging per astrociti a raccogliere la tintura e per il segnale di fondo a diminuire. Lasciare la sezione nella camera di perfusione durante questo tempo. Assicurarsi che questo tempo di incubazione è incorporata nel trattamento totale 4 ore dell'esperimento. Ottenere la prossima fetta e ripetere i passaggi 5,2-5,8.
6. Registrazione spontanea e Gq GPCR agonista-evocato astrociti Ca 2 + libero in fettine di ippocampo
- Impostazione del microscopio confocale per l'imaging:
- Limitare l'esposizione fetta di luce laser è della massima importanza, in quanto elevata esposizione può portare a tingere sbiancamento e / o fototossicità. Utilizzando maggiore ingrandimento ottico o un impostazione di zoom maggiore aumenta l'esposizione alla luce al campo creata l'immagine. Pertanto, impostare i valori predefiniti per ogni laser ad alta Settin fotomoltiplicatoreg, guadagno 1x e potenza di uscita del laser 0,5%.
- Applicare uno zoom 1.5x per una migliore visualizzazione dei processi astrociti.
- Impostare la risoluzione campo a 512 x 512 pixel.
- Impostare la velocità di scansione per il più veloce possibile, che è ~ 1,2 secondi per scansione utilizzando la modalità di scansione a senso unico.
- Raccogliere spettri di emissione utilizzando filtri passa-banda di 503-548 nm per il laser 488 nm e 624-724 nm per il laser 559 nm. Queste impostazioni consentono di imaging di un campo di ~ 5-8 astrociti ad una velocità relativamente rapida ad una risoluzione sufficiente rilevare corpi cellulari astrociti e processi principali. Idealmente, astrociti in campo saranno abbastanza per essere visto in modo chiaro brillante, ma senza alcuna saturazione pixel.
- Confermare l'identità delle cellule caricate con Ca 2 + tingere come astrociti visualizzando la SR-101 colabeling utilizzando il laser 559 nm.
- Astrociti Registrazione Ca 2 + attività:
- Disegnare scatole utilizzando il software di acquisizione immagini su regioni di interesse (ROÈ) all'interno della cellula, in questo caso oltre corpi cellulari astrociti. Le scatole non devono includere pixel di sfondo, per ottenere il miglior rapporto segnale-rumore possibile. Disegnare una casella su sfondo come riferimento.
- Passare la perfusione di ACSF sperimentale più 1 micron TTX (Abcam) per il resto dell'esperimento. Questo elimina eventuali risposte astrociti calcio neuronali AP-driven. Aumenti rimanenti in astrociti Ca 2 + concentrazione sarà quindi dovuta al rilascio quantale vescicolare, costitutiva (basale) attività GPCR, o una combinazione di entrambi i meccanismi.
- Record di fluorescenza nel tempo da tutte le ROI. Qualsiasi aumento nella fluorescenza oltre basale indicano aumenti della concentrazione citoplasmatica di Ca 2 + 16, e quindi l'attività GPCR in astrociti 10, 17, 18. Al fine di evitare eventuali effetti di scala anticipo sui recettori astrociti da TTX, esperimenti completi entro 40 min from momento della TTX perfusione 1 pM iniziato.
- Dopo aver ottenuto 10 min di registrazione di base di attività spontanea Ca 2 +, applicare un agonista di interesse (ad esempio DHPG) in sequenza concentrazioni crescenti. Lasciare un minimo di 5 minuti tra le applicazioni per ridurre possibili desensibilizzazione dei recettori.
- Alla fine della registrazione, applicare un cocktail di agonisti di altri GPCR Gq astrociti come controllo positivo per astrocitaria intatta Gq GPCR vie di segnalazione. Componenti del cocktail agonista dipenderanno dal recettore di interesse. 10 mM di ciascuno dei Gq GPCR agonisti istamina, carbacolo, e 2Na-ATP per stimolare i recettori istaminici H1 [H1R], recettori muscarinici [mAChR], e recettori purinergici [P2YR], rispettivamente, è un cocktail agonista comunemente usato.
- Post-esperimento di acquisizione delle immagini:
- Al termine del Ca 2 + registrazione, prendere immagini fisse con la 488 nm e 559 nm laser, fo successiva conferma dell'identità astrociti e il posizionamento ROI. Impostazioni di potenza laser e HV possono essere modificate liberamente a questo punto per ottenere un'immagine ottimale per colocalizzazione, come non vi è più una preoccupazione per l'intensità della luce laser colpisce i dati (Figura 2A).
- Ripetere i passaggi 6,1-6,3 per un totale di circa 8 fette e 40 astrociti / gruppo. Fette dovrebbero provenire da un minimo di 3 diversi topi.
7. Analisi di astrociti Ca 2 + libero
- Definizione di una elevazione Ca 2 +: normalizzazione nella definizione Ca 2 + transitori non è stata affermata all'interno della comunità scientifica. Quello che segue è un protocollo tipico che massimizza la sensibilità pur limitando il rilevamento di eventi falsi positivi di rumore di fondo.
- Hanno un altro membro laboratorio assegnare ogni fetta un codice numerico al fine di analizzarli ciecamente. Al termine dell'analisi, decodificare ogni fetta.
- Analizzare astrociti spontanea ed evocata Ca 2 + elevazioni offline utilizzando software di analisi delle immagini. Ridisegnare e / o regolare le dimensioni, la forma e la posizione delle ROI come desiderato.
- Punteggio aumenta di intensità di fluorescenza oltre basale come Ca 2 + elevazione se l'ampiezza di picco è superiore a due deviazioni standard (SD) sopra la media di 30 sec di media fluorescenza basale per almeno due punti campione consecutivi. In registrazioni particolarmente rumorose (basso rapporto segnale-rumore), questo criterio può avere bisogno di essere regolato per 3 SD sopra la fluorescenza basale. Definire l'insorgenza di ciascuna Ca 2 + elevazione come ultimo punto dati prima della fluorescenza supera una deviazione standard sopra la media.
- Distinguere tra multipeak vs eventi single-picco successivi. Punteggio un evento come "multipeak" quando l'intensità di fluorescenza non ritorna al basale (al di sotto del valore medio basale +2 SD) per l'&# 8804, 9 punti di dati consecutivi (10.8 sec) tra i picchi. Pertanto, gli eventi di punta singoli avranno 10 o più punti di dati di base consecutivi in-tra di loro.
- Classificare gli eventi come risposte "plateau" di tipo quando l'intensità di fluorescenza mantiene ampiezza di picco (± 10% del valore di picco) per almeno 3.6 sec.
- Analizzare l'ampiezza, la frequenza e la cinetica di transienti di calcio spontanee e agonisti-evocato.
- Definire ampiezza di picco della Ca 2 + elevazione come punto di dati con il valore massimo di intensità (in caso di risposte "multipeak" utilizzare il primo picco; vedere la Figura 2B).
- Calcolare tempo di salita come differenza tra l'insorgenza risposta e il tempo corrispondente al picco di ampiezza. NOTA: 0 a 100% tempo di salita può essere necessario utilizzare al fine di disporre di un numero sufficiente di punti di dati per ottenere un valore di tempo; velocità di scansione è una variabile importante qui.
- Calcolare il tempo di latenzatra l'inizio di agonista perfusione della comparsa di risposta. Tempo di salita può essere una misura più utile in fettine cerebrali, purché wash-in tempi creare una confondere calcolo latenze di risposta.
- Determinare se vi sono differenze statisticamente significative tra i due gruppi per ciascun parametro utilizzando il test t di Student indipendente. Utilizzare il numero di astrociti come 'n'. Utilizzare test chi-quadro di Pearson di confrontare i modelli di Ca 2 + attività tra i gruppi di controllo e di trattamento. Utilizzare test esatto 2-coda di Fisher per confrontare le percentuali di specifici modelli di Ca 2 + attività tra i gruppi di controllo e di trattamento. Esprimere differenze come * p <0.05, ** p <0.01, e *** p <0.001.
Risultati
Risultati rappresentativi in Figura 3 mostrano l'effetto di incubazione di acuta fettine ippocampali di topo in TTX per 4-6 ore in astrociti sr Ca 2 + attività. I dati comprendono sia spontanee Ca 2 + transitori e di gruppo DHPG evocato I mGluR Ca 2 + risposte, dalle fette incubati in controllo ACSF vs ACSF più TTX. Altro che caratteristiche morfologiche tipiche di base, assemblaggio processo stellate e di piccole dimensioni soma (~ 10 micron), astrociti sono identificati nella sr dalla sovrapposizione del Ca 2 + indicatore di OGB-01:00 con il marcatore astrociti selettiva SR-101 19 20 ( Figura 3A). Le caselle numerate oltre corpi cellulari di astrociti corrispondono alla fluorescenza numerata su tracce di tempo mostrati in figura 3B. Il gruppo 1 mGluR agonista (RS)-3.5-DHPG viene applicato per determinare gli effetti di scala specifici sul gruppo 1 mGluRs negli astrociti. Per discriminare tra Physiology nella specificità dell'effetto di scala al gruppo 1 mGluRs contro altri GPCR GQ, un cocktail di agonisti viene applicato al termine di ogni dell'esperimento. Qui abbiamo usato 10 micron ciascuno di Gq GPCR agoniste istamina, cloruro carbamylcholine (carbachol) e adenosina 5'-ATP sodio (Na-ATP). Il cocktail agonista serve anche come controllo positivo per identificare vitali, gli astrociti reattivi nel caso in cui le cellule non rispondono alle DHPG, presumibilmente perché tali astrociti particolari non esprimono una quantità sufficiente di recettore per suscitare una risposta a DHPG.
Abbiamo utilizzato diverse concentrazioni di DHPG, tra cui 5 micron e 15 micron (Figura 3B), così come 30 micron e 50 micron (Figura 4A) per assistere a rivelare cambiamenti nel gruppo astrocitica I mGluRs. Il rapporto tra cellulari Ca 2 + risposte e livelli di espressione Gq GPCR è stato esaminato in precedenza in vitro 21-24. In primo luogo, lasoglia di rispondere ad una particolare concentrazione agonista dipende dalla densità di recettori espressi da ciascuna cella. In una popolazione di cellule, più celle rispondono con un Ca 2 + elevazione di una data concentrazione di agonista quando le cellule vengono trasfettate con maggiore densità di recettori. Dopo aver incubato fette in TTX, la percentuale di astrociti nella popolazione rispondere ad una concentrazione fissa di aumenti agonisti (Figure 3B e 3C). Abbiamo scoperto che 5 micron e 15 micron DHPG rivelano evidenti differenze nella percentuale di astrociti reattivi tra il controllo e cellule trattate TTX, mentre il 30 e 50 micron DHPG sono tenuti a confrontare gruppi di risposte che ho mGluR a 5,0 K mm + trattati vs controllo cellule (Figura 4A).
Il rapporto tra modelli di Ca 2 + risposta astrociti e la concentrazione agonista è stato esaminato anche in situ. Aumentare l'agonistaconcentrazione sposta il modello del Ca 2 + risposta in astrociti dal singolo picco Ca 2 + elevazioni per multipeak e plateau Ca 2 + elevazioni 25-27. Sulla base di questi risultati precedenti, abbiamo previsto che il modello di risposta ad una singola concentrazione di agonista si sposterà se ci sono cambiamenti nel livello di espressione del recettore. Quindi, a seconda di quale dei due metodi di ridimensionamento viene utilizzata (inibizione neuronale o aumentando), la concentrazione di agonista necessaria per produrre un particolare modello di risposta aumenta o diminuisce. Ad esempio, astrociti incubate in TTX spostare la loro DHPG-evocato Ca 2 + modello di risposta a più plateau di tipo Ca 2 + elevazioni e rispondere ad abbassare le concentrazioni di agonisti rispetto ai controlli astrociti (Figura 3C). Tenendo conto dei precedenti studi, queste osservazioni suggeriscono che il gruppo mi mGluR livelli di espressione del recettore in astrociti è aumentato.
Tempo di salita e insorgenza (latenza) di Ca 2 + prospetti sono stati anche dimostrato di correlare direttamente ai cambiamenti nei livelli di espressione Gq GPCR in cellule in coltura 22-24. Elevati livelli di espressione del recettore determinano latenze di risposta brevi e tempi di salita più veloci, riduzione della densità dei recettori produce l'effetto opposto. Per astrociti incubate in TTX, Ca 2 + transitori evocati dalla applicazione di DHPG hanno significativamente più veloce salire volte rispetto al astrociti incubate nel controllo ACSF (Figura 3D). Come precedentemente accennato, ampiezze di Ca 2 + risposte agonisti evocati rimangono invariati indipendentemente dalla concentrazione di agonista o il modello di scala 15 (Figura 3D).
Oltre ai cambiamenti osservati attivando direttamente gruppo I mGluRs con DHPG, astrociti spontanea Ca 2 + attività è significativamente influenzata da questa manipolazione. Osserviamoaumento da 2,26 volte della percentuale di astrociti spontaneamente attivi incubate in TTX contro controllo. Si tratta di un aumento da solo il 12,9% degli astrociti controllo espositrici attività spontanea nel soma al 42,1% nel TTX incubato astrociti (Figura 3E). Poiché è noto che l'attività GPCR mostra "intrinseca" o costitutiva in assenza di agonista 21, 26, 28, e che il livello di questa intrinseche attività aumenta con l'aumentare dei livelli di espressione del recettore, questi dati suggeriscono che la densità di astrocitici aumenti Gq GPCR seguente riduzione a lungo termine in azione neuronale potenziale cottura. Simile alle risposte agonisti evocati, i tempi di salita dei spontanee Ca 2 + prospetti sono anche aumentati (Figura 3E).
Dati rappresentativi che utilizzano il secondo protocollo, incubazione in elevati di potassio extracellulare (5,0 mm), è raffigurato in Figura 4. Un aumento del K + extracellulare 2,5-5,0 mM risultati in un aumento significativo basale azione neuroni CA3 potenziale frequenza 15. Sono necessari Concentrazioni più elevate di DHPG (30 mM e 50 mM) per evocare il gruppo I mGluR di Ca 2 + risposte dagli astrociti incubati in alta potassio (Figure 4A e 4B). Questo è coerente con un livello ridotto di gruppo I mGluR reattività in astrociti a seguito di un aumento a lungo termine in potenziali d'azione neuronali. Inoltre, il modello di risposta evocata ad una concentrazione fissa di DHPG sposta dalle risposte plateau simile a deboli risposte singolo picco (Figura 4B). Esaminando la percentuale di astrociti spontaneamente attivi nelle due condizioni di potassio rivela che meno astrociti incubate in alto K + sono spontaneamente attiva rispetto alla condizione di controllo (Figura 4C). Questo effetto è in opposite direzione della condizione TTX in cui viene aumentata la percentuale di astrociti esibiscono spontanee Ca 2 + elevazioni. Infine, sia evocata e spontanee Ca 2 + elevazioni avere tempi di salita più lenta negli astrociti incubate in alto K + contro la condizione di controllo (Figure 4C e 4D). Complessivamente questi dati suggeriscono che astrociti livelli di espressione Gq GPCR scala bidirezionale a seconda del livello di potenziale azione attività neuronale nel corso di un periodo di tempo prolungato.

Figura 1. Fabbricazione fetta camera di incubazione e configurare. (A) La porzione cassetto di un contenitore di stoccaggio pipetta Brinkmann insieme con il suo coperchio a tenuta d'aria viene utilizzato per costruire la camera di incubazione fetta. (B) Druscello un foro nel lato del contenitore circa 1 ¼ dalla parte superiore e ¼ dal lato. Montare in un pezzo di tubo flessibile. (C) Collegare l'apparecchio microloader-collettore alla estremità interna del tubo flessibile. Nota cut-to-fit naturale punta di pipetta 200 microlitri (freccia bianca). (D) sei 20 microlitri Eppendorf microloaders sono tagliati da posa di un collettore linea uno a sei per creare un apparato microloader-collettore. (E) Eseguire due piccoli fori sul coperchio. (F) Un galleggiante Bubble Rack per fare il titolare fetta. (G) Le "gambe" inferiore della bolla cremagliera mobile vengono rimossi in modo che un pezzo di materiale di nylon mesh può essere incollato al fondo. (H) Riempire la camera di incubazione con sufficiente quantità di ACSF in modo che i carri titolare fetta. Regolare la lunghezza del tubo in modo che le punte delle microloaders possono riposare in un angolo del pavimento della camera. Quando si posiziona la camera di incubazione inbagnomaria, il livello dell'acqua nella vasca deve essere allo stesso livello come il ACSF nella camera. clicca qui per vedere l'immagine ingrandita.
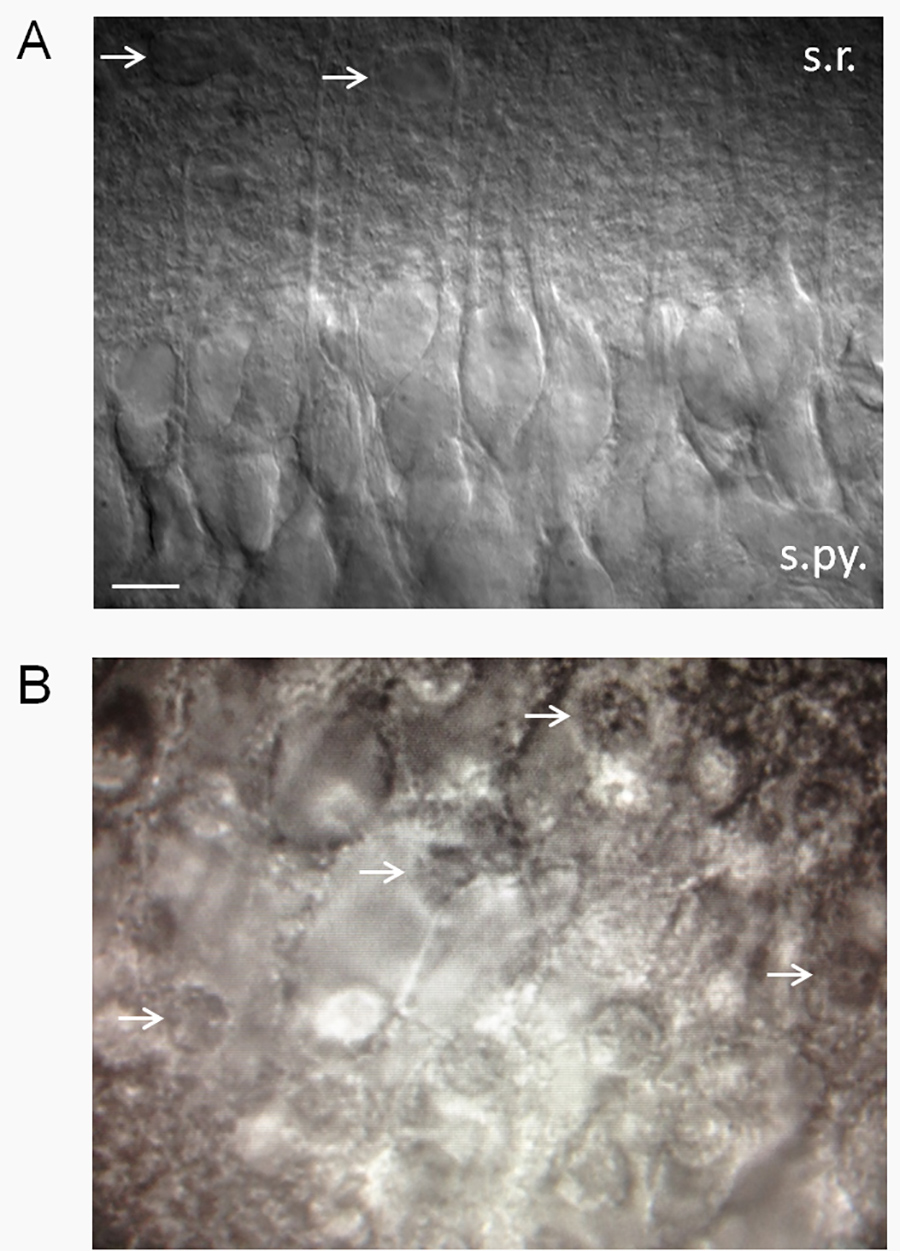
Figura 2. Stima della salute slice. (A) Una fetta ippocampo aspetto sano con contrasto di interferenza differenziale (DIC) ottica. Fette sani hanno una superficie liscia, aspetto vellutato e una percentuale elevata di neuroni CA1 piramidali sani. Nota: i dendriti apicali sporgenti in falda radiatum. Patch-clamp di neuroni che assomigliano a quelli mostrati qui rivelano un basso potenziale di membrana a riposo (-61 a -62 mV) in standard da 2,5 mm K + ACSF con pochi potenziali d'azione spontanea. Potenziale di membrana e cottura tariffe variano in funzione della exextracellulare K + (Xie et al. 15.) Le frecce indicano astrociti putativi. Abbreviazioni: sr, strato radiatum; s.py., strato pyramidale. Barra della scala, 10 micron. (B) fette malsano avranno un alta percentuale di morti neuroni CA1 piramidale, che hanno l'aspetto di uova fritte (frecce bianche indicano nuclei di neuroni morti - il "tuorlo" dell'uovo fritto). Clicca qui per vedere l'immagine ingrandita.
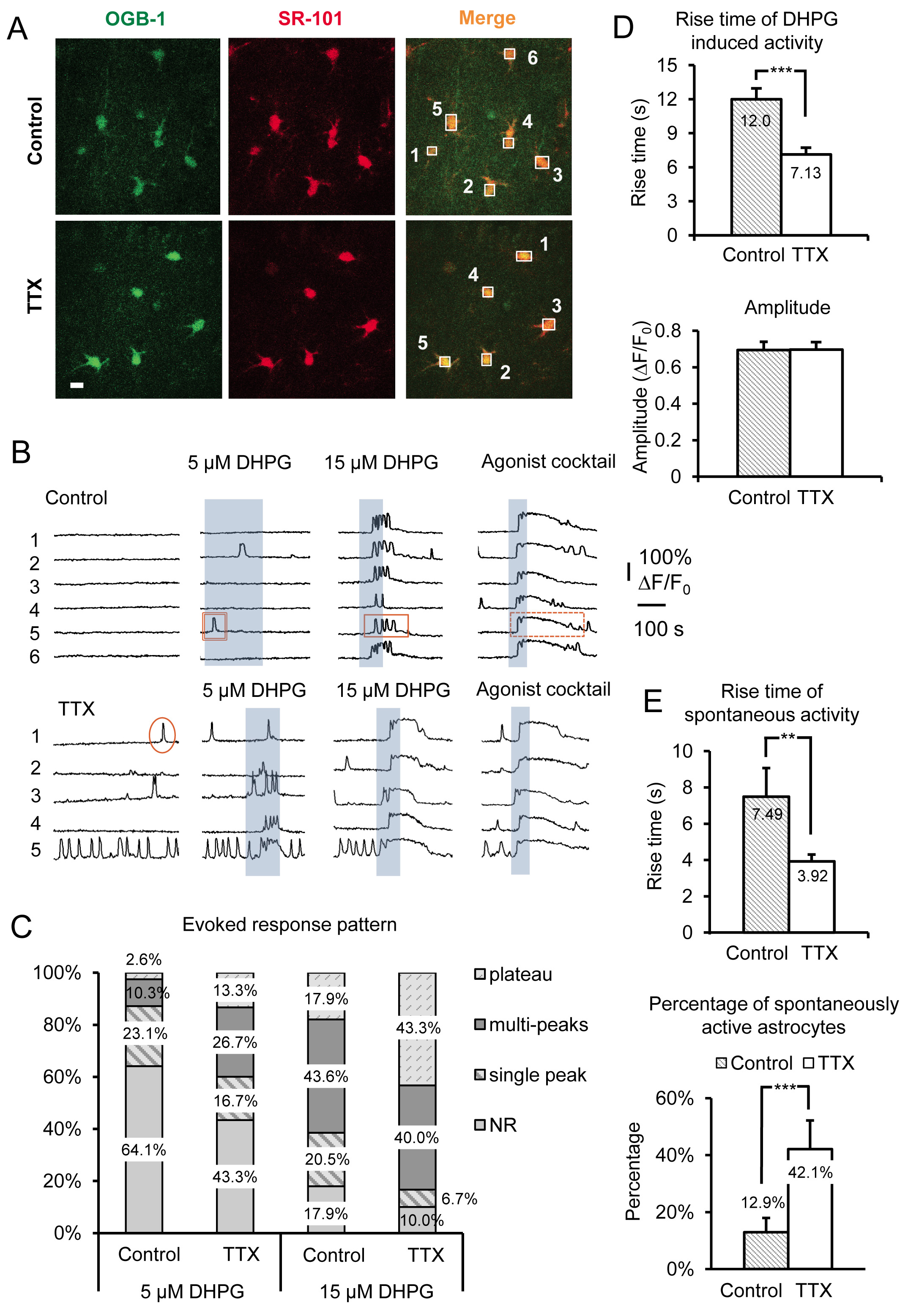
Figura 3. Registrazione amplificato attività Gq GPCR e gruppo evocata I mGluR Ca 2 + risposte dopo inibizione a lungo termine di AP neuronali mediante incubazione in TTX. (A) Immagini rappresentative di cellule nel campo di registrazione incubate in control condizioni (pannelli superiori) o in TTX (pannelli inferiori) che hanno preso Oregon Verde BAPTA-01:00 Ca 2 + colorante indicatore (pannelli a sinistra) e SR-101 (pannelli centrali). Barra della scala è di 10 micron. Sovrapposizione di entrambi i segnali ("merge") indica che gli astrociti carico con Ca 2 + indicatore. Le scatole sono disegnati sopra individuo soma astrociti registrare intensità di fluorescenza nel tempo del canale verde per monitorare Ca 2 + attività negli astrociti. (B) le tracce del campione dalle caselle di registrazione in A) di Ca 2 + attività negli astrociti. Gli astrociti incubate in TTX mostra un aumento dell'attività spontanea e più robusto gruppo evocata I mGluR Ca 2 + risposte come evidenziato dai cambiamenti nel modello di risposta. Esempi di unico picco (cerchio), multipeak (rettangolo), e plateau (rettangolo punteggiato) sono mostrati Ca 2 + transitori. (C) I cambiamenti nei modelli di risposta sono particolarmente evidenti utilizzando diversi concentrazioni del gruppo I mGluR agonista DHPG. Più multipeak e plateau risposte sono evidenti dopo incubazione in TTX rispetto al controllo ad una data concentrazione agonista. (D) Aumento tempi di Ca 2 + risposte DHPG evocati sono più veloci negli astrociti incubate in TTX rispetto al controllo (pannello superiore), mentre le ampiezze non cambiano (pannello inferiore), indicativo di "tutto-o-none" ampiezze di risposta una volta la soglia di rispondere è stato raggiunto. (E) tempi di astrociti spontanea salita Ca 2 + transitori sono anche più veloce in TTX incubate vs controllo incubato astrociti (pannello superiore), mentre la percentuale di astrociti nella popolazione esporre spontanee Gq GPCR di Ca 2 + aumenta l'attività (pannello inferiore). Clicca qui per vedere l'immagine ingrandita.

Figura 4. Registrazione astrociti diminuita attività Gq GPCR e di gruppo evocato io mGluR Ca 2 + risposte seguenti aumento a lungo termine in AP neuronali mediante incubazione in elevata di potassio extracellulare. (A) tracce rappresentativi di astrociti Ca 2 + registrazioni da fettine incubate in 5,0 mm K + ACSF a depolarizzare neuroni e aumentare la loro frequenza di scarica basale rispetto ai controlli ACSF (2,5 mm K + ACSF). Astrociti incubati con 5.0 mM K + ACSF mostra meno spontanee somatiche Ca 2 + transitori e più debole DHPG evocati risposte rispetto al astrociti incubate nel controllo ACSF. (B) Un confronto tra modelli di risposte evocate a più concentrazioni di DHPG rivela tipi di risposta più deboli dopo l'aumento a lungo termine in AP neuronali. (C) una riduzione della percentuale di astrociti nel POlazione esibendo spontanea Ca 2 + attività si osserva dopo incubazione a lungo termine ed elevata a K + rispetto ai controlli ACSF (pannello superiore), mentre i tempi di salita dell'attività spontanea diventano più lenti (pannello inferiore). (D) Aumento tempi di astrociti evocati Ca 2 + risposte a diverse concentrazioni di DHPG diventato più lento successivo trattamento 5.0 mM K + rispetto ad astrociti incubate nel controllo ACSF. Clicca qui per vedere l'immagine ingrandita.
Discussione
I modelli di scala descritti rappresentano metodi pratici per la ricerca di plasticità a lungo termine del gruppo astrocitica I mGluRs. Imaging spontanei ed evocati Ca 2 + eventi offre un test sensibile per variazioni di astrociti attività Gq GPCR di misura, come prova ditta è stato stabilito che astrociti Ca 2 + aumenti si verificano a seguito di rilascio da IP 3 negozi R-sensitive valle di Gq GPCR attivazione di 10, 12, 17, 18. La percentuale degli astrociti nella popolazione risposta al gruppo I mGluR agonista e il modello di tali Ca 2 + risposte segnalano cambiamenti nel gruppo I mGluRs dagli astrociti.
La tecnica specifica utilizzata per caricare astrociti con Ca 2 + indicatore è una considerazione importante nella progettazione di esperimenti per cercare variazioni di astrociti attività Gq GPCR. Bolo-carico o-bulk caricare più astrociti, o patch-clamp carico dei singoli astrociti può essere utilizzato per immagine Ca 2 + transitori negli astrociti. Ogni approccio offre alcuni vantaggi e svantaggi. Direttamente riempiendo astrociti con Ca 2 + indicatore tramite patch clamp consente l'identificazione univoca della cella come astrociti, senza bisogno di un marcatore secondario, come SR-101. Consegna Patch-clamp dell'indicatore permette anche la registrazione di Ca 2 + attività da piccoli scomparti astrociti comprese le folte processi sottili, potenzialmente più profonde nella sezione in cui le cellule sono più sani e con più interazioni intatti con sinapsi (a seconda della potenza del laser disponibile). Tuttavia, patch-clamp loading soffre di bassa capacità, come i dati sono raccolti una cella alla volta. Caricamento di massa, al contrario, permette un gran numero di astrociti deve essere caricato con Ca 2 + indicatore e ripreso simultaneamente. Tuttavia, solo gli astrociti in prossimità della superficie (<20 micron) della sezione vengono caricati, con preoccupazione associatas sulla salute delle cellule e sinapsi intatti.
Il protocollo bolo-loading contropressione qui presentata offre una via di mezzo, con relativamente elevato throughput e la possibilità di monitorare Ca 2 + attività più profondo all'interno della fetta (40-75 micron). Un aumento significativo della percentuale di astrociti spontaneamente attivi con la tecnica bolo-loading si osserva rispetto al caricamento di massa, suggerendo che le connessioni tra sinapsi neuronali ei processi astrociti sono più completi 15. Con un buon carico, spesso si possono monitorare Ca 2 + attività nelle principali processi di astrociti (dati non riportati) o potenzialmente anche compartimenti più piccoli usando la microscopia a 2 fotoni. Tuttavia, la cura dovrebbe essere esercitata nei assegnare i processi più piccoli ad una particolare astrociti, in quanto i confini si fondono con la colorazione di fondo aspecifica. Un ulteriore problema con l'utilizzo di procedure bulk-caricamento o bolo-caricamento è la necessità di un mar secondariaker per l'identificazione degli astrociti. Mentre è noto da molti anni che gli astrociti preferenzialmente occupano AM estere Ca 2 + indicatori, il marcatore secondario SR-101 è spesso usato per verificare le cellule caricate come astrociti. SR-101 può di per sé modificare l'eccitabilità intrinseca dei neuroni 29. Uso di SR-101 conferma la necessità di eseguire tutte astrociti Ca 2 + misurazioni in TTX per limitare possibili SR-101 effetti sulla eccitabilità neuronale. Supponendo che sia il controllo e gruppi sperimentali includono SR-101, il marcatore di per sé non dovrebbe tener conto degli effetti osservati negli astrociti Ca 2 + segnalazione seguenti manipolazione a lungo termine dei potenziali d'azione neuronali. SR-101 può essere più di una preoccupazione in alto K + esperimenti, tuttavia, come si può ridurre la differenza tra K mM + 2,5 vs 5.0 mM K + se il tasso di cottura basale non è alterata in proporzione.
Un approccio molto promettente per fornire Ca 2 + Indicatore di astrociti è emerso recentemente che offre una valida alternativa agli approcci più tradizionali utilizzando Ca 2 + coloranti. Progressi significativi sono stati compiuti nel corso degli ultimi anni, con indicatori di calcio geneticamente codificati (GECIS) mirati al astrociti 30-32. GeCIS può essere spedito a astrociti in vivo microiniezione di vettori virali adeno-associati in una regione del cervello di interesse come l'ippocampo. Espressione di GECIS si raggiunge dopo circa due settimane dopo l'infezione virale 32. Ci sono numerosi vantaggi presentati dall'uso di GeCIS negli astrociti. In primo luogo, i vettori sono mirati ad astrociti utilizzando un promotore specifico astrociti, in modo che le cellule marcate sono astrociti 32. In secondo luogo, il rapporto segnale-rumore-ora sembra paragonabile a quello ottenibile utilizzando consegna patch-clamp di colorante, ma senza l'invasività di aver avuto una pipetta di patch sulla cella 32. In terzo luogo, gli indicatori possono essere delivered ed espresso in tessuti adulti, che è problematico utilizzando metodi di consegna caricamento di massa. Inoltre, l'espressione è mosaico, offrendo la possibilità di differenziare tra più astrociti. Così, molti astrociti possono potenzialmente essere esposte contemporaneamente, mentre anche la registrazione nel soma e ramoscelli sottili allo stesso tempo. Pertanto, potenzialmente una singola tecnica potrebbe essere utilizzata in luogo di tre tecniche separate (caricamento di massa, bolo-carico, e patch-clamp carico) per registrare scalatura attività di astrocitici GPCR Gq, aumentando notevolmente l'efficienza.
Un potenziale svantaggio di utilizzare consegna virale-mediata di Ca 2 + indicatori astrociti è il possibile effetto sulla fetta di salute 32. I vettori virali adeno-associati di erogazione dei GeCIS hanno dimostrato in precedenza di causare gliosi reattiva di astrociti 33. Preparazione di fette di cervello in generale probabilmente inizia fasi iniziali della patologia, tra cui il rilascio di inflammatory molecole 10. Pertanto, in combinazione con i tempi di incubazione lunghi necessari per indurre scalatura dei recettori astrociti, uso di GeCIS forniti mediante vettori virali avrebbe bisogno di ricevere ulteriori considerazione nel contesto della salute fetta in questi tipi di esperimenti.
Quando impiegando questo protocollo, è importante tenere presente che il tempo di applicazione di agonista per produrre una risposta varierà in funzione della disponibilità recettore. Per una data concentrazione di agonista, il tempo di applicazione dovrà essere più lungo se recettori hanno ridimensionato, e più breve se recettori sono scalati, per il farmaco di raggiungere un'adeguata concentrazione nel tessuto per attivare recettori sufficiente per produrre un Ca 2 + risposta. Pertanto, tempi di applicazione della droga, e, potenzialmente, le loro concentrazioni, possono essere adattate a seconda della direzione prevista del ridimensionamento. Ad esempio, la concentrazione di agonista può essere necessario ridurre in case di TTX per evitare la saturazione risposte e aumentato dopo incubazione fette in alto K + a vedere anche una risposta. In particolare, la concentrazione DHPG stato spostato 5-15 mM dopo il trattamento TTX a 30-50 mM dopo il trattamento 5,0 mM K + per studiare Ca 2 + modelli di risposta, come 5-15 um era spesso troppo bassa per produrre risposte affidabili in astrociti dopo il ridimensionamento del gruppo I mGluRs.
Registrazione di astrociti Ca 2 + attività fornisce alcuna prova diretta di inserimento recettore o di internalizzazione da o verso la membrana plasmatica. Tuttavia, sulla base della notevole somiglianza dei dati con i dati provenienti da studi precedenti in vitro che hanno esaminato la relazione diretta tra livelli di espressione Gq GPCR e spontanea ed evocata Ca 2 + transitori 21-24, l'interpretazione più logica delle variazioni di Ca 2 + segnalazione è che i livelli di espressione del recettore di superficie astrociti hannocambiato. Un approccio complementare può essere una considerazione importante se si vuole fornire prove aggiuntive sul locus dell'effetto di Ca 2 + attività. Una strategia che abbiamo usato è stato quello di esaminare l'effetto della TTX incubazione in fettine di ippocampo di topi astrocitiche MrgA1R. Questi topi transgenici esprimono un Gq GPCR estera (MrgA1R) soltanto negli astrociti. Perché questo recettore non è nativo al cervello, non c'è neurotrasmettitore endogeno presente per cambiare i suoi livelli di attività. Il lavoro precedente ha suggerito che questo recettore impegna stesso intracellulare molecole di segnalazione come gruppo endogeno I mGluRs nelle stesse astrociti 34. Dopo incubazione a lungo termine di fette di topi MrgA1R in TTX, differenze nelle risposte MrgA1R agonisti evocata rispetto al controllo littermate incubata fette fornirebbe la prova che l'effetto sulla astrociti Ca 2 + attività è dovuta alle variazioni localizzate al recettore di superficie, in particolare se le risposte gruppo I mGluR sono ancora significativamente migliorato nelle stesse astrociti. Un'alternativa, se la strategia forse più coinvolti sarebbe isolare astrociti dalle fette per analisi Western blot, finché una frazione di membrana potrebbe essere analizzato per modifiche nei livelli di espressione del recettore di superficie. Fluorescence Activated cell sorting (FACS) o citometria a flusso possono essere utili qui.
Le possibili applicazioni di questa tecnica per lo studio dei neuroni, astrociti e interazioni astrociti-neuroni sono molti. Nei nostri esperimenti, unico gruppo DHPG evocato I mGluR astrociti Ca 2 + risposte sono state studiate, in isolati fettine di ippocampo acuti di topi giovani. Questa preparazione non solo le afferenze intatti (garanzie reali di Schaffer), ma anche i neuroni che danno origine a loro (cellule piramidali CA3), che permette di manipolare i tassi di cottura di questi neuroni glutamatergici sulle cellule post-sinaptiche (cellule piramidali CA1) e astrociti nello strato radiatum cui processi assoE Con queste sinapsi. La fetta dell'ippocampo acuta può non essere la migliore preparazione per manipolare i tassi di cottura di altri tipi di neuroni, tuttavia, come molte afferenze sono separabili dai neuroni che danno origine a loro. Tuttavia, può essere possibile in taluni preparati fetta di osservare la plasticità di altre astrocitiche sottotipi Gq GPCR. Ad esempio, le fette possono essere preparati con prosencefalo basale neuroni colinergici e le proiezioni per Hippocampus intatto. L'incubazione di queste fette in TTX o elevata K + inciderebbe tassi di cottura basali dei neuroni colinergici, che porta alla scala di mAchRs negli astrociti di Oriens falda, che ricevono una parte significativa degli input colinergici 1. Un approccio alternativo ancora testato per studiare scalatura recettore astrocitaria all'interno di una specifica area del cervello, con tutti i collegamenti intatti mentre si verifica scalatura, potrebbe essere quella di utilizzare un modello in vivo in cui un rilascio prolungato di TTX è ottenuta per impiantazione di un Plastic polimero Elvax 40W sopra la regione di interesse 35. Questo approccio è stato utilizzato in precedenza in uno studio su scala neuronale, ma dovrebbe essere applicabile anche a scala astrociti. Infine, con la giusta lettura, studi futuri potrebbero esaminare altre famiglie GPCR, comprese le variazioni di G s e G I GPCR. Si potrebbe prevedere astrociti GABA B G i GPCR di essere colpiti in seguito l'inibizione di sparare nel proiettare a livello locale interneuroni GABA all'interno di qualsiasi preparazione fetta. Sviluppo di nuovi indicatori di targeting altre molecole di segnalazione, come un indicatore in tempo reale del secondo messaggero cAMP, aprirebbe una nuova area di ricerca sulla comunicazione del recettore neurone-to-astrociti.
Scalatura bidirezionale di mGluRs astrocitici dalla manipolazione dei tassi neurone cottura basali fornisce una misura della sensibilità degli astrociti di rilascio AP-mediata di neurotrasmettitore. Gli astrociti possono apparentemente percepire AP spontanee e glutamarilascio di te a Schaffer collaterale-CA1 sinapsi delle cellule piramidali anche quando extracellulare K + è all'interno di un range fisiologico. Mentre l'applicazione acuta di TTX non riduce la frequenza di astrociti spontanea Ca 2 + attività 18, 36, 37, il Ca 2 + attività tra gli astrociti nella popolazione diventa decorrelati 36, fornendo la prova che i recettori astrociti sono rilevatori AP. Questo suggerisce che gli astrociti percepiscono AP neuronali spontanee senza incidere sulla loro attività complessiva Ca 2 +. E 'ampiamente accettato che le concentrazioni intracellulari di IP 3 devono raggiungere un livello di soglia per stimolare IP 3 R in misura sufficiente a portare ad un rilevabile Ca 2 + elevazione. Potrebbe AP neuronali spontanee attivare GPCR astrociti senza produrre misurabili Ca 2 + elevazioni? Studi futuri potrebbero utilizzare Fluorescence Resonance Energy Transfer (FRET) o un tecn simile ique (come BRET) per esaminare la relazione tra proteina G accoppiamento al recettore (una misura di attivazione del recettore) e Ca 2 + rilascio dai depositi interni. BRET è stato ampiamente utilizzato in vitro per rilevare G accoppiamento 38 proteina-to-GPCR, anche se può essere un po 'di tempo prima che questa tecnologia sarà disponibile per l'utilizzo nelle preparazioni dei tessuti intatti. E 'possibile che astrociti GPCR Gq vengono attivati molto più frequentemente di quanto può essere registrato utilizzando gli strumenti di Ca 2 + di imaging attualmente disponibili. Oltre a rilevare potenziali d'azione, astrociti GPCR Gq possono anche essere in grado di rilevare in miniatura rilascio quantico di neurotrasmettitori come riportato in un recente studio 39. Il metodo di scala bidirezionale qui descritto può essere usato in studi futuri per fornire una misura del grado in cui GPCR astrociti Gq rilevano quantale rilascio vescicolare del neurotrasmettitore, includendo bafilomycin A1 nel protocollo incubazione.
S copi "> Finora, sono solo stati utilizzati i protocolli di scala in fettine di ippocampo di topi giovanile (p12-p18). Pertanto, è attualmente noto se il ridimensionamento del recettore astrociti potrebbe anche essere indotta nei tessuti ottenuti da topi adulti. Un recente studio interessante suggerisce che il gruppo espressione che mGluR negli astrociti diminuisce notevolmente dopo la prima settimana di età e continua a diminuire fino all'età adulta, con bassi livelli di espressione del recettore negli astrociti adulti 40. Sarebbe pertanto interessante per determinare se mGluRs astrociti scala a seguito del lungo- inibizione termine di firing neuronale in adulti fettine di ippocampo di topo a livelli prossimi a quelli osservati negli astrociti dei topi giovani. Questa scoperta suggerisce che l'espressione del recettore astrociti non è statica ad una certa età, ma può cambiare rapidamente a seconda dei livelli di attività neuronale. In contrasto ridotta espressione del gruppo I mGluRs in topi adulti, la prova sta emergendo che i recettori adrenergici, tra cui & #945; 1A, 2A α, β e 1 sottotipi, sono prevalentemente espressi dagli astrociti nel cervello adulto 3, 4. Il adrenergico α 1A Gq GPCR può essere un bersaglio attraente per i futuri studi di comunicazione neurone-to-astrociti, tra questi se questi recettori sono sensibili alle variazioni dei tassi neurone cottura adrenergici.Divulgazioni
Gli autori desiderano rivelare che la tetrodotossina utilizzato in questi studi è stato acquistato da Abcam. Abcam ha avuto alcun coinvolgimento nelle ipotesi, design, o la raccolta di dati. Tutte le comunicazioni riguardanti la sponsorizzazione dei lavori da parte Abcam si è verificato dopo che il processo di peer review era completa.
Riconoscimenti
Gli autori desiderano ringraziare il Centro di UC Riverside per Gliali-neuronali Interazioni prezioso per la discussione dei protocolli di scala e dati. Gli autori desiderano anche per dare un ringraziamento sincero a Abcam per sponsorizzare la pubblicazione del loro lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| Chamber Supplies | |||
| Brinkmann pipette storage container | Fisher Scientific | 03-491 | Use the drawer portion as the incubation chamber |
| Electrical drill | |||
| Flexible tubing | Tygon | R-3603 | |
| Silicone seam sealant | Also called aquarium seam sealer | ||
| Gas tank | 95% oxygen, 5% carbon dioxide | ||
| Natural beveled pipette tip | USA Scientific | 1111-1000 | Cut-to-fit to connect oxygenate lines |
| One-to-six lines manifold | Warner Instruments | 64-0210 (MP-6) | For the microloader-manifold apparatus |
| Microloader | Eppendorf | 5242 956.003 | For the microloader-manifold apparatus, cut-to-fit |
| Floating Bubble Rack | Bel Art Scienceware | F18875-0400 | For slice holder |
| 600 µm Sefar Nitex Nylon mesh | ELKO Filtering Co. | 06-600/51 | For slice holder |
| Krazy Glue | For slice holder | ||
| Reagents | |||
| Isoflurane | Baxter | 1001936060 | |
| NaCl | Fisher | S271-3 | |
| KCl | Fisher | P333-500 | |
| CaCl2 | Fisher | C79-500 | |
| MgCl2 | Fisher | M33-500 | |
| NaH2PO4 | Fisher | S369-500 | |
| NaHCO3 | Fisher | S233-500 | |
| Glucose | Fisher | Fisher | |
| (±)-6-Hydroxy-2,5,7,8- tetramethylchromane-2-carboxylic acid (Trolox) | Acros Organics | 53188-07-1 | |
| Ascorbic acid | Acros Organics | 401471000 | |
| Tetrodotoxin citrate (TTX) | Abcam | ab120055 | |
| Sulforhodamine 101 (SR-101) | Sigma-Aldrich | 284912 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Pluronic Acid F-127 | Invitrogen, Molecular Probes | P6867 | |
| Oregon Green 488 BAPTA-1 AM *cell permeant (special packaging) | Invitrogen, Molecular Probes | O6807 | |
| (RS)-3,5-DHPG | Abcam | ab120020 | |
| Histamine | Sigma-Aldrich | H7125 | |
| Carbamoylcholine chloride (Carbachol) | Sigma-Aldrich | C4382 | |
| Adenosine 5’-ATP disodium (Na-ATP) | Sigma-Aldrich | A7699 | |
| Dissection Tools | |||
| Single-edge razor blade | GEM | 62-0161 | For bisection |
| Double edge razor blade | TED PELLA, INC. | 121-6 | For cutting slices |
| Mayo Scissors, supercut | WPI | 14010-15 | For decapitation |
| Fine iris scissors, straight | Fine Science Tools | 14094-11 | For cutting the skull |
| Iris forceps, curved | WPI | 15915 | To remove the skin and skull |
| Small spatula | To remove/transfer the brain | ||
| Dumostar Dumont #5 Biologie Tip forceps | Fine Science Tools | 11295-10 | For hippocampus dissection |
| Glass Pasteur pipette | Fisher | 13-678-20B | For transferring brain slices |
| Pasteur pipette rubber bulb | Fisher | 03-448-22 | For transferring brain slices |
| Polystyrene 100 mm tissue culture dishes | Corning | 25020 | |
| Vibratome | Leica | VT 1200S | |
| Water bath | Fisher | ISOTEMP 210 | For warm incubation |
| Micropipette puller | Narishige | PC-10 | For bolus-loading pipette |
| Confocal microscope | Olympus | Olympus Fluoview 1000 | |
| Low Profile Open Diamond Bath Imaging Chamber with PM-1 platform | Warner Instruments | RC-26GLP | diamond bath with low profile |
| Borosilicate glass pipette | World Precision Instruments | TW150F-4 | For bolus-loading pipette |
| Micromanipulator | Sutter Instrument | ROE-200 | For bolus-loading pipette |
| Spin-X centrifuge tube filter with 0.22 µm cellulose acetate | Costar | 8161 |
Riferimenti
- Araque, A., Martin, E. D., Perea, G., Arellano, J. I., Buno, W. Synaptically released acetylcholine evokes Ca2+ elevations in astrocytes in hippocampal slices. J. Neurosci. 22, 2443-2450 (2002).
- Navarrete, M., Araque, A. Endocannabinoids mediate neuron-astrocyte communication. Neuron. 57, 883-893 (2008).
- Bekar, L. K., He, W., Nedergaard, M. Locus coeruleus alpha-adrenergic-mediated activation of cortical astrocytes in vivo. Cereb. Cortex. 18, 2789-2795 (2008).
- Hertz, L., Lovatt, D., Goldman, S. A., Nedergaard, M. Adrenoceptors in brain: cellular gene expression and effects on astrocytic metabolism and Ca2. Neurochem. Int. 57, 411-420 (2010).
- Porter, J. T., McCarthy, K. D. Hippocampal astrocytes in situ respond to glutamate released from synaptic terminals. J. Neurosci. 16, 5073-5081 (1996).
- Bernardinelli, Y., et al. Astrocytes display complex and localized calcium responses to single-neuron stimulation in the hippocampus. J. Neurosci. 31, 8905-8919 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Wang, X., et al. Astrocytic Ca2+ signaling evoked by sensory stimulation in vivo. Nat. Neurosci. 9, 816-823 (2006).
- Fiacco, T. A., Agulhon, C., McCarthy, K. D. Sorting out astrocyte physiology from pharmacology. Annu. Rev. Pharmacol. Toxicol. 49, 151-174 (2009).
- Agulhon, C., et al. Calcium Signaling and Gliotransmission in Normal vs Reactive Astrocytes. Front. Pharmacol. 3, 139 (2012).
- Nedergaard, M., Verkhratsky, A. Artifact versus reality--how astrocytes contribute to synaptic events. Glia. 60, 1013-1023 (2012).
- Nizar, K., et al. In vivo stimulus-induced vasodilation occurs without IP3 receptor activation and may precede astrocytic calcium increase. J. Neurosci. 33, 8411-8422 (2013).
- Sutton, M. A., et al. Miniature neurotransmission stabilizes synaptic function via tonic suppression of local dendritic protein synthesis. Cell. 125, 785-799 (2006).
- Ibata, K., Sun, Q., Turrigiano, G. G. Rapid synaptic scaling induced by changes in postsynaptic firing. Neuron. 57, 819-826 (2008).
- Xie, A. X., et al. Bidirectional scaling of astrocytic metabotropic glutamate receptor signaling following long-term changes in neuronal firing rates. PLoS ONE. 7, (2012).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol. Rev. 79, 1089-1125 (1999).
- Petravicz, J., Fiacco, T. A., McCarthy, K. D. Loss of IP3 receptor-dependent Ca2+ increases in hippocampal astrocytes does not affect baseline CA1 pyramidal neuron synaptic activity. J. Neurosci. 28, 4967-4973 (2008).
- Nett, W. J., Oloff, S. H., McCarthy, K. D. Hippocampal astrocytes in situ exhibit calcium oscillations that occur independent of neuronal activity. J. Neurophysiol. 87, 528-537 (2002).
- Garaschuk, O., Milos, R. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1, 380-386 (2006).
- Nimmerjahn, A., Kirchhoff, F., Kerr, J. N., Helmchen, F. Sulforhodamine 101 as a specific marker of astroglia in the neocortex in vivo. Nat. Methods. 1, 31-37 (2004).
- Prezeau, L., et al. Changes in the carboxyl-terminal domain of metabotropic glutamate receptor 1 by alternative splicing generate receptors with differing agonist-independent activity. Mol. Pharmacol. 49, 422-429 (1996).
- Shao, Y., McCarthy, K. D. Quantitative relationship between alpha 1-adrenergic receptor density and the receptor-mediated calcium response in individual astroglial cells. Mol. Pharmacol. 44, 247-254 (1993).
- Wang, S. S., Thompson, S. H. Measurement of changes in functional muscarinic acetylcholine receptor density in single neuroblastoma cells using calcium release kinetics. Cell Calcium. 15, 483-496 (1994).
- Ostasov, P., Krusek, J., Durchankova, D., Svoboda, P., Novotny, J. Ca2+ responses to thyrotropin-releasing hormone and angiotensin II: the role of plasma membrane integrity and effect of G11alpha protein overexpression on homologous and heterologous desensitization. Cell Biochem. Funct. 26, 264-274 (2008).
- Shelton, M. K., McCarthy, K. D. Hippocampal astrocytes exhibit Ca2+-elevating muscarinic cholinergic and histaminergic receptors in situ. J. Neurochem. 74, 555-563 (2000).
- Hermans, E., Challiss, R. A. Structural signalling and regulatory properties of the group I metabotropic glutamate receptors: prototypic family C G-protein-coupled receptors. Biochem. J. 359, 465-484 (2001).
- Zur Nieden, R., Deitmer, J. W. The Role of Metabotropic Glutamate Receptors for the Generation of Calcium Oscillations in Rat Hippocampal Astrocytes In Situ. Cortex. 16 (5), 676-687 (2005).
- de Ligt, R. A., Kourounakis, A. P., AP, I. J. Inverse agonism at G protein-coupled receptors: (patho)physiological relevance and implications for drug discovery. Br. J. Pharmacol. 130, 1-12 (2000).
- Kang, J., et al. Sulforhodamine 101 induces long-term potentiation of intrinsic excitability and synaptic efficacy in hippocampal CA1 pyramidal neurons. Neuroscience. 169, 1601-1609 (2010).
- Tong, X., Shigetomi, E., Looger, L. L., Khakh, B. S. Genetically encoded calcium indicators and astrocyte calcium microdomains. Neuroscientist. 19, 274-291 (2013).
- Akerboom, J., et al. Optimization of a GCaMP Calcium Indicator for Neural Activity Imaging. J. Neurosci. 32, 13819-13840 (2012).
- Shigetomi, E., et al. Imaging calcium microdomains within entire astrocyte territories and endfeet with GCaMPs expressed using adeno-associated viruses. J. Gen. Physiol. 141, 633-647 (2013).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nat. Neurosci. 13, 584-591 (2010).
- Fiacco, T. A., et al. Selective stimulation of astrocyte calcium in situ does not affect neuronal excitatory synaptic activity. Neuron. 54, 611-626 (2007).
- Echegoyen, J., Neu, A., Graber, K. D., Soltesz, I. Homeostatic plasticity studied using in vivo hippocampal activity-blockade: synaptic scaling, intrinsic plasticity and age-dependence. PLoS One. 2, (2007).
- Aguado, F., Espinosa-Parrilla, J. F., Carmona, M. A., Soriano, E. Neuronal activity regulates correlated network properties of spontaneous calcium transients in astrocytes in situ. J. Neurosci. 22, 9430-9444 (2002).
- Takata, N., Hirase, H. Cortical layer 1 and layer 2/3 astrocytes exhibit distinct calcium dynamics in vivo. PLoS ONE. 3, e2525 (2008).
- Salahpour, A., et al. BRET biosensors to study GPCR biology, pharmacology, and signal transduction. Front. Endocrinol. 3 (105), (2012).
- Di Castro, M. A., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat. Neurosci. 14, 1276-1284 (2011).
- Sun, W., et al. Glutamate-dependent neuroglial calcium signaling differs between young and adult. Science. 339, 197-200 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon