Method Article
神経発火率を操作することによってアストロサイト受容体の可塑性を誘導すること
要約
ここでは、アストロサイトのGタンパク質共役受容体の可塑性の研究のためのニューロンにおいて恒常的な可塑性を誘導するために使用されるプロトコルの適合を記載している。最近、幼若マウスにおけるIのmGluRアストロサイトのグループ内の変化を調べるために使用される、この方法は、 インサイチューおよびインビボで 、成体マウスからの組織において、種々の星状細胞GPCRのスケーリングを測定し、星状細胞受容体の感受性のより良い理解を得るために適用することができる神経活動の変化に。
要約
研究の二十年に近いは、in situおよびin vivoでのアストロサイトはneuronallyリリース送信機によって刺激され得る多数のGタンパク質共役受容体(GPCR)を発現することを確立した。しかしながら、神経活動の変化に応じて可塑性を発揮する星状細胞受容体の能力はほとんど注目を受けている。ここでは、全体的にスケールアップまたはアストロサイトのグループの下、私は急性脳スライスにおけるグルタミン酸受容体(mGluR)の代謝調節に使用することができるモデルシステムについて説明します。含ま双方向に蛍光性Ca 2 +指示薬で神経細胞の活動電位周波数、負荷星状細胞およびアストロサイトのプロセスを操作し、長期的なスライスのインキュベーションに適し室を構築し、矢状海馬スライスを作成し、記録することにより、アストロサイトのGq GPCR活性の変化を測定する方法についての方法があります自発的な共焦点顕微鏡を用いて星状細胞のCa 2 +のイベントを引き起こした。本質的に、「カルシウムrをoadmap「アストロサイトのGqファンGPCRの可塑性を測定する方法のために提供される。アストロサイトの研究のための技術のアプリケーションが議論されている。アストロサイトの受容体シグナル伝達が神経活動の変化によってどのような影響を受けるかについての理解を持つことは、両方の正常なシナプス機能だけでなく、プロセスの基本的な神経疾患や神経変性疾患のための重要な意味を持っています。
概要
アストロサイトは、アストロサイトのGqのGPCRの活性化からほぼ独占的に生じた細胞質のCa 2 +の増加と神経細胞や神経細胞の軸索の刺激に数秒以内に応答します。例えば、ムスカリン性アセチルコリン受容体1、カンナビノイド受容体2、α1Aア ドレナリン受容体3、4、およびグループIのmGluR(下記参照)急性神経活動に反応する全てのアストロサイトのGq GPCRのサブタイプである。感覚刺激8次の生体内でのアストロサイトのグループI mGluRの活性化(例えば、急性海馬スライスなど)、その場で神経細胞のグルタミン酸作動性求心性神経の刺激5-7以下、最も広く実証されているだけでなく、大人のマウスの皮質で。アストロサイト、神経細胞、またはアストロサイトニューロン相互作用の生物学と生理学上のアストロサイトのGq GPCRシグナル伝達の活性化の結果は、9月12日の議論の問題となっている。それはSになりますニューロンへの星状細胞受容体シグナル伝達の機能の前に青梅時間が十分に理解される。
それはニューロンが実験プロトコルを使用してアストロサイトの受容体を活性化することができることは明らかであるが、よくわかっていないままニューロンへのアストロサイト受容体通信の側面があります。まず、星状細胞Gq共役GPCRを活性化するのに必要なニューロンの活動の実際の量は、明確に定義されておらず、第二、使用依存性可塑性を発揮する星状細胞受容体の能力はほとんど注目を受けている。これらの質問に対処するために開始するには、我々は最近、神経細胞の活動電位の長期的な変化(AP)依存性シナプス活動に応答して、星状細胞集団の急性少年海馬スライスにおけるI mGluRの双方向のスケーリングを誘導するためのプロトコルを開発しました。私のmGluRはfoをスケールアップし、神経細胞のイオンチャネル型グルタミン酸受容体13、14、アストロサイト、グループの双方向恒常的可塑性のために発見されたことと同様に神経細胞の活動電位のllowing遮断し、神経活動電位周波数は15に増加されたときにスケールダウン。アストロサイトの受容体におけるこれらの代償の変化は、自然発生的な記録することによって測定し、アストロサイトのCa 2 +トランジェントを誘発し、対照条件でのアストロサイトからのものに、これらのイベントの特性を比較することができます。本稿では、星状細胞受容体スケーリングを誘発する急性海馬スライス、インキュベーション条件の調製を含めて、このプロトコルを使用するための完全な方法論を記載し、星状細胞のCa 2 +指示薬色素負荷のCa 2 +イメージング、共焦点顕微鏡を用いた技術、および期待される効果アストロサイトのGq GPCR活性上。アストロサイトのCaに対する予測可能な効果2 +シグナル伝達特性-のGqのGPCRの異なる発現レベルでトランスフェクションした培養細胞において以前に記録されたものと一致する-などの変化を分析するために、今後の研究に使用可能な「ロードマップ」を提供trocytic GPCR発現。この技術の使用のための波及効果と潜在的なアプリケーションは、健康で病気にかかった脳内のアストロサイト、神経間相互作用の理解に貢献していきます。
プロトコル
以降の手順は、カリフォルニア大学リバーサイド校の制度的動物実験委員会によって承認されている。
1。インキュベーションチャンバーとスライスホルダーの構築
- インキュベーションチャンバーを構築する:毒性のない材料からインキュベーションチャンバーを構築します。チャンバは空気循環を制御していることを確認する、浮くスライスホルダのためACSFに十分な量を保持し、酸素ラインからのガス分散がで発生しながらスライスホルダは、チャンバの一端に浮くことができるように十分な大きさであるもう一方の端。その気密蓋( 図1A)とピペット貯蔵容器の引き出し部分がうまくこれらの基準に適合します。
- 約1¼の上から容器の側面に小さな穴をドリル側から¼。穴からフレキシブルチューブの部分に合わせます( 図1B)。ふたを閉じたときにチューブが、それが解決策を超えているので、十分に高く、まだ、圧縮されないように、十分に低く、ドリルするように注意してください。
- 酸素ラインとチャンバとの間の水密シールを形成するシリコーン継ぎ目シーラント(「水槽シームシーラー」)を適用する。
- 雄型ルアーフィッティングを使用して、ガスタンク(95%酸素、5%二酸化炭素)への管の「外側」端を接続します。カスタムフィットのため、カットに合い、自然なベベル200μlのピペットチップ( 図1C)。
- 1対6のラインプラスチックマニホールドにチューブの「内部」の端を接続します。カットにフィット各マニホールド入口( 図1D)に620μlをエッペンドルフmicroloaderピペットチップ。 microloadersの細かい開口部が小さい気泡の安定した流れを生成するのに最適です。
- 換気を可能にするために、コンテナ( 図1E)の蓋に2小さい穴を開けます。
- スライスhを構築する古い:スライスホルダーフローティングバブルラック( 図1F)から作られています。
- バブルラックの一番 "足"を削除し、約1¾インチにトップをカット
- 8ウェルスライスホルダー( 図1G)を作成する(このような標準クレイジー接着剤として)シアノアクリレート接着剤を使用した丸ラックの一番下にナイロンメッシュ素材の部分を接着します。各ウェルは、単一のマウス海馬スライスを収めることができます。
- 1インキュベーションチャンバーの最後に、他端にmicroloaderマニホールド装置のスライスホルダーを取り付けます。 microloaderのヒントチャンバ床( 図1H)に載ることができます。この設定は、上部および急性海馬スライスの底部の両方に十分な酸素化を確実にするために、気泡は、スライスの攪拌を最小限にし、海馬スライスでの気泡の直接接触を防止するために、直接スライスホルダの下方に抜けないように設計されている。
- インキュベーション室をすすぐ各実験後のddH 2 Oで徹底的にDスライスホルダー、そして、毎週70%エタノールで除染。異なる溶液内のスライスをインキュベートした場合に、複数のチャンバ/スライス·ホルダーが必要となる。
2。ソリューションや医薬品
- 人工脳脊髄液(ACSF):125のNaCl、2.5のKCl、2.5のCaCl 2、1.3のMgCl 2、1.25のNaH 2 PO 4、26.0炭酸水素ナトリウム、15:(単位:mm)は、次を使用してのddH 2 Oで標準ACSF 4Lのを準備しますグルコース、および0.1トロロックス。浸透圧計を用いて溶液の浸透圧を測定し、それは〜310ミリオスモルに来る必要があります。実験条件のためのACSF組成物は、(プロトコル3を参照)を以下に記載する。オートクレーブしガラス瓶に0.22μmのボトル·トップ·フィルターを使用してすべてのソリューションをフィルタリングします。解決策は、月まで4℃で安定している。
- スライスバッファ:125のNaCl、2.5のKCl、3.8のMgCl:(単位:mm)を含む修正されたACSFを使用してスライスを準備しますl 2は 、1.25のNaH 2 PO 4、26.0のNaHCO 3、15グルコース、および1.3アスコルビン酸。浸透圧計を用いて溶液の浸透圧を測定し、それは〜310ミリオスモルに来る必要があります。スライス·バッファ内の塩化マグネシウムと塩化カルシウムの交換は、スライスの健康を向上させます。
- ローダミン101(SR-101、1μM)は、急性海馬スライスにおける星状細胞を同定するために使用される。 125のNaCl、2.5のKCl、0.5のCaCl 2、6のMgCl 2、1.25のNaH 2:(単位:mm)を以下のように調製変性低カルシウムACSF 100mlに60.67 mgのSR-101を希釈することにより、SR-101の1 mMストックを作るPO 4、26.0のNaHCO 3、15グルコース、および1.3アスコルビン酸。低カルシウムACSFの浸透圧が約310 mOsmであることを確認します。ロード用の変性低Ca 2 +のACSFに1 mMのSR-101株を千倍に希釈する。 4℃で、最終的なSR-101のソリューションを保存し、実験に必要とされるまで、光から保護。
3。 Lの操作中期神経ONG急性海馬スライス料金発射
長期ニューロンの発火率を操作するために別の実験で2インキュベーションプロトコルのいずれかを使用します。
- 神経発火を抑制:テトロドトキシン(TTX、1μM)でインキュベート。注意:十分な量で摂取した場合、それは致命的なことができますように注意して、TTXに取り扱ってください。手袋とゴーグルを推奨します。 TTXは完全に急性スライスAP主導の神経発火を廃止。 3.5 mMのK + ACSFでスライスをインキュベート、プラス実験条件での1μMのTTX。対照条件では、TTXずに3.5 mMのK + ACSF内のスライスをインキュベートする。二つの条件を比較すると、アストロサイトのGq GPCR活性のアップスケーリングの効果を明らかにする。 TTX処理の効果を最大にするために(、2.5mMのK +を言うこととは対照的に)、3.5mMのK + ACSFは、制御条件となる。
- または -
- 上記の神経細胞の発火を高める基礎速度:高カリウムでインキュベート:細胞外のK +濃度を大きくすると神経細胞を脱分極し、その基礎発火率を向上させます。 5.0 mMのK + ACSF中でのインキュベーションを大幅に2.5 mMのK + ACSF 15と比較して、神経細胞の活動電位周波数を上昇させる。実験条件のために5.0 mMのK + ACSFでスライスをインキュベートし、制御条件のために、標準的な2.5 mMのK + ACSFでスライスをインキュベートする。 2条件間の比較は、アストロサイトのGq GPCR活性におけるダウンスケーリング効果を明らかにする。
4。急性海馬スライスの準備
- 暖かい回収室の設定:
- 35℃に水浴を温めると、内部の準備インキュベーション室を置く。インキュベーション室( 図1G)内ACSFの高さまで水で水浴を埋める。
- 95%O 2、5%のCと実験群と対照ACSFに酸素O 2。 microloaderマニホールド装置から放出された気泡が小さく、豊富でなく、穏やかである必要があります。室内のACSFの目に見える動きがあってはならない。
- 氷のように冷たい解剖室の設定:
- 氷の2バケツを取る。氷の1バケットにバッファをスライスして、約300ミリリットルのボトルを置き、20分間、95%のO 2、5%CO 2で酸素を保つ。ちょうど氷の表面の下に、他の氷のバケツに100ミリメートルペトリ皿水没。ペトリ皿の側面が氷に直接接触していることを確認してください。ペトリ皿にいくつかのスライスバッファを注ぎ、それは同様に酸素を保つ。
- 以上1分間ペトリ皿中の氷冷スライスバッファにそれを沈めることによって、単一のエッジかみそりの刃の刃先を冷やす。
- ビブラセットアップ:
- ビブラトームをオンにして、排水が閉じていることを確認してください。
- 振動切削室を確保登米切削室の周りの流氷。 0〜4℃に予冷
- 工場は5分間70%エタノールにそれを浸漬してからのddH2Oですすぐことによりダブルエッジかみそりの刃からグリース削除します。慎重に半分にカット(刃を曲げていない)と、切断ブロックの上半分ブレードをマウントします。
- マウス脳を削除する:
- キムワイプまたはコットンボールに染み込ん0.5ミリリットルイソフルランでプリロード小室に一二から一八日齢のC57BL/6Jマウスを麻酔。優しく痛み反射がないことを確認するために、動物の足の指を挟ま。
- 鋭いハサミを使用して、マウスを斬首し、小さなピンセットを用いて頭皮を削除します。縦の割れ目に沿って嗅球に小脳から頭蓋骨をカットし、小さな骨のはさみを使用してください。小さなピンセットを用いて頭蓋フラップを取り外します。優しくへらで脳を削除し、ペトリ皿中の氷冷酸素化スライスバッファにそれを沈める。
- Bisec冷却及び酸素化のためのより多くの表面積を可能にするために、ペトリ皿中で冷却かみそりの刃でマウス脳はt。二等分半球が2〜3分間、氷冷スライスバッファに座ってみましょう。脳は完全にクールで、より強固になる必要があります。
- ビブラトームのプラットフォーム上でシアノアクリレート接着剤の薄層を適用します。嗅球を前方に向けた状態で、最大のプラットフォームカットサイドダウンと側面に両半球を接着します。切削室内の作業台を固定し、その後、氷冷で十分に酸素スライスバッファを切断室を埋める。
- ビブラトームを使用して厚さ300μmの矢状スライスを準備している間、切断室を酸素化し続ける。 85 Hzで、0.20ミリメートル/秒の前進速度、および1.40ミリメートルの振幅の周波数でスライスを切った。注:私たちは健康的な急性海馬スライスを製造するのに単一の最も重要な変数はビブラトームの品質であることを見出した。当研究室では、ライカのVT 1200 S磁石を使用していますicは "z"の振動を低減するVibroCheckのビブラトームで駆動する。
- スライスした後、鋭利なピンセットを用いて、各矢スライスのうち海馬および隣接嗅内皮質を解剖。ビブラトームの切断室内の氷のように冷たい、よく酸素化スライスバッファにこの手順を実行します。それはスライスの取り扱いを最小限に抑えることが鉗子のシャープは、スライスの健康にとって非常に重要である。
- ガラスパスツールピペットの長い先端を破壊し、ピペット球で破損部品をトッピングによりトランスファーピペットを作る。これはスライスを転送するピペットの大端の使用を可能にする。 (材料の表を参照)大端に綿栓なしでピペットを注文してください。スライスは非滅菌条件下で調製されるように新しいピペットを調製し、各実験のために使用されるべきであるが、それは、使用前にピペットをオートクレーブする必要はない。
- 35℃の水中でのインキュベーション室にそれぞれ海馬スライスを転送する風呂、スライスホルダーの各ウェルの中にACSFにホールピペットを浸漬し、スライスを吸引することにより。このプロセスの間にスライスの動きを最小限に抑えることができます。徐々に温度を「ランプ」よりも品質が良いスライス暖かいインキュベーション風呂結果とスライスの直接転送。
- 海馬スライスは、次のように分解45分、合計、温水浴で回復することができ:なしに(低カルシウムACSFに転送して、低カルシウムACSF中に希釈し、1μMSR-101で20分間のスライスをインキュベートSR-101)で10分間。その後、温かいインキュベーションの残りの15分間制御するスライスまたは実験ACSFを転送します。
- 45分ウォーム回復後、慎重にベンチトップに35℃の水浴からインキュベーションチャンバーを移動し、スライスはボーラスロードを開始する前に、3時間の総インキュベーション時間、室温でインキュベートし続けることを可能にプロトコル(以下を参照)。
5。のCa 2 +指示薬とアストロサイトのボーラスのロード
- 準備のCa 2 +指示薬ボーラスローディング色素:
- 色素(50μg)を、各バイアルには、新鮮なジメチルスルホキシド(DMSO)、徹底的に渦の3.87を添加する。 DMSOの鮮度が良いのロードのために重要であるため、新鮮なアンプルを毎回開いて割れ。
- 徹底的に20%プルロニック酸と渦の9μlに混ぜる。 10μMの最終色素濃度のために、適切な実験または制御ACSF、よくボルテックス100μlの色素を混ぜる。
- 遠心フィルターチューブを用いて溶液を濾過する。このステップは、色素の排出中に目詰まりローディングピペットを防ぐことができます。
- ホウケイ酸ガラスキャピラリーからピペットを作製した色素溶液を充填したときに約1.3MΩの抵抗に引っ張ら。
- 顕微鏡で使用するために設計された記録室へ海馬スライスを置き連続的には(1.5ml /分)中でインキュベートした同じ組成の酸素化ACSFで灌流する。コントロールおよび実験条件間の代替の海馬スライスを選択する。
- 不健康探し海馬スライスを捨てる。スライスの品質にも指定された実験内で変化します。スライスの健康を定量化するには、設定された基準がありません、したがって、スライスの健康の決定は主観的で、主に経験に基づいている。
- 一般的に言って、滑らかで登場する面で健康的CA1錐体細胞の割合が高い( 図2A)を持つスライスを保つ。 CA1錐体細胞が中枢神経系の傷害に特に敏感で脆弱なので、健康的なCA1錐体ニューロンの大部分(≥75%)を有するスライスを受け入れるか、拒否するための便利な基準があります。
- 約> 25%死んだ神経細胞を持っているスライスを捨てる。死んだニューロンは目玉焼きのような外観( 図2B)を持っています。注:我々はヘクタールカットの角度が神経細胞が健康かどう表示されるかどうかに大きな役割を果たしていることを観察したVE。神経細胞の樹状突起は、(スライスの外に)上向きに突出している場合は、神経細胞は、ほとんどが死んでいるだろう。ニューロンボリュームのような大きな割合が、樹状ツリー内に含まれているので、これは樹状突起を切断する細胞に対して致死的であることが考えられる。樹状突起は、スライス面から下向きの角度にまたは並列に投影している一方、健康な神経細胞の割合が高いがあるでしょう。時には、そのため、ニューロンは反対側に見てスライスし、健康の一方の側にほとんどが死んでいるだろう。
- 微分干渉コントラスト(DIC)光学系を用いてサイズ、形態、および場所に基づいて40〜70ミクロンのスライス面の下SRアストロサイトの適切なフィールドを探します。
- 色素溶液をガラスピペットをロードし、標準のパッチクランプ微小電極holdeを使用して、このフィールドの上にスライスの表面にそれを下げるR。スライスの表面にピペットで、吐出染料を開始するために、ピペットに背圧を適用します。色素の排出は、DIC光学系と、このような緑色染料のための488のラインとして適切なレーザーの両方の下に表示されます。
- ゆっくりと約40μmマイクロマニピュレーターを用いて、スライス面の下にピペットを下げ、染料が約45〜60秒間取り出すことができます。その後、さらに35ミクロン(スライス表面下75μm)をピペットを下げ、約45〜60秒間の色素を取り出します。ゆっくりスライスからピペットチップを撤回。短い注入時間が長いほど噴射記録の信号対雑音比を減少させるバックグラウンドローディングを増加する傾向があるのに対して、不十分な色素負荷をもたらす可能性がある。
- アストロサイトの数が多い色素を取ることを確実にするために、少し離れ第2の色素のボーラスを注入するために、通常は便利です。バックのスライスの表面にピペットを上げ、ピペットが詰まっていないことを確認し、その後、MO放線層に沿って、約80〜100ミクロン離れて最初の注射部位からピペットを見る。このサイトでボーラス注射を繰り返します。
- アストロサイトは、色素を取るとバックグラウンド信号を減少させるためにするための撮像前に30〜45分を許可します。この時間の間に灌流チャンバー内のスライスにしておきます。このインキュベーション時間は、実験の合計4時間の処理に組み込まれていることを確認してください。次のスライスを取得し、ステップ5.2から5.8を繰り返します。
6。海馬スライスにおける記録自発的ではGq GPCRアゴニスト誘起アストロサイトのCa 2 +の活動
- イメージングのための共焦点顕微鏡を設定する:
- 高暴露を漂白および/または光毒性を染色するために導くことができるように、レーザ光のスライス曝露を制限することは、最も重要である。高い光学倍率または増加ズーム設定を使用すると、画像化されたフィールドへの露光が増加します。従って、高電子増倍settin各レーザのためのデフォルト値を設定するgで、1×利得および0.5%レーザ出力パワー。
- アストロサイトのプロセスのより良い視覚化のために1.5倍ズームを適用します。
- フィールドの解像度を512×512ピクセルに設定。
- 〜一方通行のスキャンモードを使用して、1スキャン当たり1.2秒である、最速、スキャン速度を設定します。
- 488nmのレーザの503から548ナノメートル、および559 nmレーザーのための624から724 nmのバンドパスフィルタを用いて発光スペクトルを収集する。これらの設定は、アストロサイトの細胞体および主要工程を観察するのに十分な解像度で比較的速いスピードで〜5-8アストロサイトの分野の画像化を可能にする。理想的には、フィールド内のアストロサイトがはっきり見ることが十分に明るいが、どのピクセルが飽和せずになります。
- + 559 nmのレーザーを使用して、SR-101 colabelingを可視化することにより、星状細胞のような色素のCa 2を搭載した細胞の同一性を確認する。
- アストロサイトのCa 2 +の活動を記録する。
- 関心領域にわたって画像取得ソフトウェアを使用してボックスを描画する(RO星状細胞の細胞体上に、この場合には、細胞内)である。ボックスは、可能な最良の信号対雑音比を達成するために、背景画素を含むべきではない。基準となる背景の上に1ボックスを描画します。
- 実験の残りを通じて実験ACSFプラス1μMのTTX(アブカム)に灌流を切り替えます。これは、任意の可能な神経細胞のAP主導のアストロサイトのカルシウム応答を排除します。アストロサイトのCa 2 +濃度の残りの増加はその後により量子的小胞リリース、構成的(基礎)GPCR活性、またはその両方のメカニズムのいくつかの組み合わせになります。
- すべてのROIからの時間の経過の記録蛍光。ベースラインを超える蛍光の任意の増加は、細胞質のCa 2 +濃度16の増加を示しており、アストロサイト10、17、18、したがって、GPCR活性。 TTXによるアストロサイトの受容体上の任意の可能な初期のスケーリング効果を避けるために、40分以内に完了FR実験OM時間は、1μMのTTX灌流が始まった。
- 自発的なCa 2 +の活動のベースライン記録の10分を取得した後、連続的に増加する濃度で(例えばDHPGなど)興味のアゴニストを適用する。可能な受容体脱感作を減少させるために、アプリケーション間の5分の最低限のままにしておきます。
- 録画の終了時に、そのままアストロサイトのGq GPCRシグナル伝達経路のポジティブコントロールとして、他のアストロサイトのGqファンGPCRのための薬のカクテルを適用します。アゴニストカクテルの構成要素は、目的の受容体に依存します。 Gq共役GPCRの各々の10μMの[肺mAchR】ムスカリン性アセチルコリン受容体、[H1R】ヒスタミンH1受容体を刺激するために、ヒスタミン、カルバコール、および2Naを-ATPアゴニスト、およびプリン受容体[P2YR]は、それぞれ、一般的に使用されるアゴニストのカクテルである。
- 後の実験画像取得:
- 記録のCa 2 +の完了時に、488 nmおよび559 nmのレーザーで静止画像を撮影、fはまたはアストロサイトのIDとROIの配置の後の確認。 ( 図2A)データに影響を与えるレーザ光 強度についての懸念が存在しなくなったように、レーザパワー及びHV設定は、共局在化のための最適な画像を得るために、この時点で自由に変更することができない。
- 繰り返しますが約8スライスと40アストロサイト/グループ合計で6.1から6.3を繰り返します。スライスは、3つの異なるマウスの最小値から来る必要があります。
7。アストロサイトのCa 2 +活性の分析
- Ca 2 +の上昇を定義する:Ca 2 +のトランジェントを定義する標準化はしっかりと科学界では確立されていない。以下は、ベースラインノイズから偽陽性事象の検出を制限しながら、感度を最大化する典型的なプロトコルである。
- 別の研究室部材は盲目的にそれらを分析するために、各スライスの数値コードを割り当てている。分析の最後に、それぞれのスライスをデコードします。
- オフライン画像解析ソフトウェアを使用して、自発的かつ誘発アストロサイトのCa 2 +上昇を分析します。再描画および/または所望に応じてサイズ、形状、およびROIの位置を調整する。
- のCa 2 +上昇としてベースラインを超える蛍光強度のスコアが増加するピーク振幅は、少なくとも2つの連続したサンプル点についての平均ベースライン蛍光の30秒の平均を超える2つの標準偏差(SD)よりも大きい場合。特にノイズの多いレコーディング(低い信号対ノイズ)では、この基準は、平均ベースライン蛍光上記3 SDに調整される必要があり得る。蛍光強度が平均を上回る標準偏差を超える前に、最後のデータ点として各々のCa 2 +上昇の開始を定義する。
- 多峰対の連続単峰事象を区別。 &用蛍光強度は(平均ベースライン値2 SD下回る)、ベースラインに戻らないとき、「多峰」などのイベントのスコア#8804;ピーク間の9連続したデータ·ポイント(10.8秒)。したがって、単一のピーク事象は、それらの間に、10以上の連続したベースラインのデータポイントを有するであろう。
- 蛍光強度が少なくとも3.6秒間ピーク振幅(ピーク値の±10%)を維持した場合に「プラトー」型応答などのイベントを分類します。
- 自発的なアゴニスト誘発カルシウムトランジェントの振幅、周波数、および動態を分析します。
- 最も高い強度値を持つデータポイントとしてCa 2 +の上昇のピーク振幅を定義します(「多峰」の回答例で最初のピークを使用し、 図2(b)参照 )。
- ピーク振幅に対応する応答の発症との間の時間差として立上り時間を算出する。 NOTE:0〜100%の立ち上がり時間は時間値を取得するためにデータポイントの十分な数を有するために使用される必要があることができ、走査速度は、ここで重要な変数である。
- 時間と待機時間を計算する応答発症に対するアゴニスト灌流の開始の間。時間がある限りウォッシュイン時間は、応答待ち時間を計算する際に交絡を作成し、脳スライスで、より有用な尺度である上昇。
- スチューデントの独立したt検定を用いて、各パラメータの2群間で統計的に有意な差があるかどうかを判断します。 'N'のように、星状細胞の数を使用してください。対照群と処置群の間のCa 2 +の活動パターンを比較するためにピアソンのカイ二乗検定を使用してください。対照群と処置群との間の特定のCa 2 +の活動パターンの割合を比較するためにフィッシャーの正確確率2テール·テストを使用してください。 * P <0.05、** P <0.01、及び***はp <0.001などの違いを表現する。
結果
図3の代表的な結果は、SRアストロサイトのCa 2 +活性への4-6時間のためのTTXの急性マウス海馬スライスのインキュベーションの効果を示す。データはACSFプラスTTX 対制御ACSF中でインキュベートスライスから、自発性Ca 2 +過渡とDHPG誘発グループIのmGluRのCa 2 +応答の両方が含まれる。基本的な特徴的な形態学的特徴、星状プロセスアセンブリと小さな細胞体の大きさ(〜10ミクロン)以外の、星状細胞を選択的星状細胞マーカーSR-101 19、20(とのCa 2 +指示薬OGB-1 AMのオーバーレイによってSRの識別されます図3A)。星状細胞の細胞体上の番号付けボックスは、 図3Bに示す時間トレース上の奇数蛍光に相当する。グループ1のmGluRアゴニスト(RS)-3.5-DHPGを、星状細胞におけるグループ1のmGluR上の特定のスケーリング効果を決定するために適用される。物理を区別するために他のGqファンGPCRに対してグループ1のmGluRにスケーリング効果の特異性iology、アゴニストのカクテルは、各実験の終了時に適用されます。ここでは、ヒスタミン、カルバ塩化(カルバコール)及びアデノシン5'-ATP二ナトリウム(のNa-ATPを)アゴニスト、10μMのGq GPCRのそれぞれを使用しました。アゴニストカクテルはまた、細胞がそれらの特定のアストロサイトはDHPGに対する応答を誘発するのに十分な量の受容体を発現しないので、おそらく、DHPGに応答しない場合において、生存、応答性星状細胞を同定するための陽性対照として役立つ。
私たちは、アストロサイトのグループIのmGluRの変化を明らかにすることを支援するために、5μM及び15μMの( 図3B)と同様に、30μMおよび50μM( 図4A)を含むDHPGの異なる濃度を使用しました。細胞性のCa 2 +応答およびGq共役GPCR発現レベルとの関係は、インビトロ 21-24 に以前に検討されている。まず、特定のアゴニスト濃度に対応するためのしきい値は、各細胞によって発現される受容体の密度に依存する。細胞の集団において、より多くの細胞は、細胞が受容体のより高い密度でトランスフェクトされたアゴニストの所与の濃度に対するCa 2 +上昇に応答する。 TTXのスライスをインキュベートした後、集団における星状細胞の割合は増加するアゴニストの固定濃度( 図3Bおよび3C)に応答する。私たちは、30および50μMDHPGは5.0 mMのK +対対照治療でグループIのmGluR応答を比較するために必要とされるのに対し、5μM及び15μMのDHPGは、制御、およびTTX処理された細胞間の反応性アストロサイトの割合の明らかな違いを明らかにすることを発見した細胞( 図4A)。
星状細胞のCa 2 +応答パターンおよびアゴニスト濃度との関係はまた、 その場で検討されている。アゴニストの増加濃度は、単一のピークからアストロサイトにおけるCa 2 +応答のパターンのCa 2 +多峰する標高と高原のCa 2 +上昇は25〜27にシフトします。これらの以前の知見に基づいて、我々は、受容体発現のレベルの変化がある場合にアゴニストの単一濃度に応じてパターンがシフトすると予測した。したがって、2つのスケーリング方法のどの(ニューロン発火を阻害するか、またはそれを増加させる)を利用しているに応じて、特定の応答パターンを生成するのに必要なアゴニストの濃度が増加または減少する。例えば、TTXでインキュベートした星状細胞は、より多くの高原型Ca 2 +標高へのDHPG誘発Ca 2 +の応答パターンをシフトし、アストロサイト( 図3C)と比較し 、アゴニストの濃度を下げるために応答します。考慮以前の研究を考慮して、これらの観察は、アストロサイトのグループIのmGluR受容体発現レベルが増加していることを示唆している。
Ca 2 +の上昇は時間と発症(レイテンシ)を上昇も直接培養細胞22〜24内のGq GPCR発現レベルの変化に相関することが示されている。受容体密度の減少は反対の効果を生成しながら、より高い受容体発現レベルは、より短い反応潜時より速い立ち上がり時間をもたらす。 TTXでインキュベートした星状細胞は、CA DHPGの適用により誘発2 +過渡が大幅に高速制御ACSF( 図3D)中でインキュベートアストロサイトと比較して倍に上昇している。前述のように、アゴニスト誘発性Ca 2 +応答の振幅に関係なく、アゴニスト濃度又はスケーリングモデル15( 図3D)の不変のままである。
DHPGを有するIのmGluRを直接活性化する基で観察された変化に加えて、自発的な星状細胞のCa 2 +活性も有意にこの操作により影響を受ける。私たちは、観察対照に対してTTX中でインキュベート自発的にアクティブアストロサイトの割合のDA 2.26倍の増加。これは、星状細胞( 図3E)インキュベートTTXで42.1%に相馬の自発活性を示す制御アストロサイトの唯一の12.9%から増加している。それが知られているので、そのアゴニスト21、26、28の非存在、および受容体の発現レベルを増加させると、この固有の活性のレベルが増加するが、これらのデータは示唆しているという点でのGPCRを示す「内因性」又は構成的活性そのアストロサイトGq共役するGPCRの密度が増加する神経細胞の活動電位発火の長期的な削減以下。アゴニスト誘発反応と同様に、自発性Ca 2 +の上昇の立ち上がり時間も( 図3E)増加する。
第二のプロトコル、高架外カリウム(5.0 mM)の中でのインキュベーションを使用した代表的なデータを、Fiの中で描かれているグレ4。基礎CA3ニューロン活動電位周波数15の有意な増加2.5〜5.0 mMの結果から、細胞外のK +の増加。 DHPGより高濃度(30μMおよび50μM)は、高カリウム( 図4Aおよび4B)中でインキュベートアストロサイトからのグループIのmGluRのCa 2 +応答を呼び起こすするために必要である。これは神経細胞の活動電位の長期的な増加が以下のアストロサイトでグループIのmGluRの応答性のレベルの低下と一致している。また、DHPGの一定濃度に誘発応答パターンが弱く単峰応答( 図4B)に高原のような応答からシフトします。 2カリウム条件で自発的にアクティブアストロサイトの割合を調べると、高K +でインキュベート少ないアストロサイトは、対照条件( 図4C)に比べて自然に活性であることを明らかにしている。この効果はoppositである自発性のCa 2 +の上昇を示す星状細胞の割合は増加するTTX条件のε方向。最終両方を誘発自発的Ca 2 +の上昇は、対照条件( 図4Cおよび4D)対高K +中でインキュベートしたアストロサイトに遅い立ち上がり時間を有する。全体的なこれらのデータは、星状細胞はGq GPCR発現レベルが双方向に長時間にわたってニューロンの活動電位活性のレベルに応じて拡大縮小することを示唆している。

図1。スライスインキュベーションチャンバーの製作と設置しました。(a)は気密蓋と一緒にブリンクマンピペット収納容器の引き出し部分はスライスインキュベーションチャンバーを構築するために使用されている。 (B)Dリル容器の側面にある穴に約1¼上から内および側から¼。柔軟性のあるチューブの一枚に収まる。 (C)は、柔軟なチューブの内側端にmicroloaderマニホールド装置を接続します。カットにフィット自然200μlのピペットチップ(白矢印)に注意してください。 (D)は、6つの20μlのエッペンドルフmicroloadersはカットにフィットしている1対6ラインマニホールドにmicroloaderマニホールド装置を作成する。 (E)の蓋の上二つの小さな穴を開けます。 (F)スライスホルダーを作るためのフローティングバブルラック。ナイロンメッシュ素材の部分が底に接着することができるように、(G)は 、フローティングバブルラックの一番下「足」は削除されます。 (H)ACSF十分な量のインキュベーションチャンバーを埋めるスライスホルダフロートするように。 microloadersの先端がチャンバ床の1コーナーで休むことができるように、チューブの長さを調整します。でインキュベーションチャンバーを配置するとき水浴、お風呂の水位は、チャンバー内のACSFと同じレベルにする必要があります。 拡大画像を表示するにはここをクリックしてください。
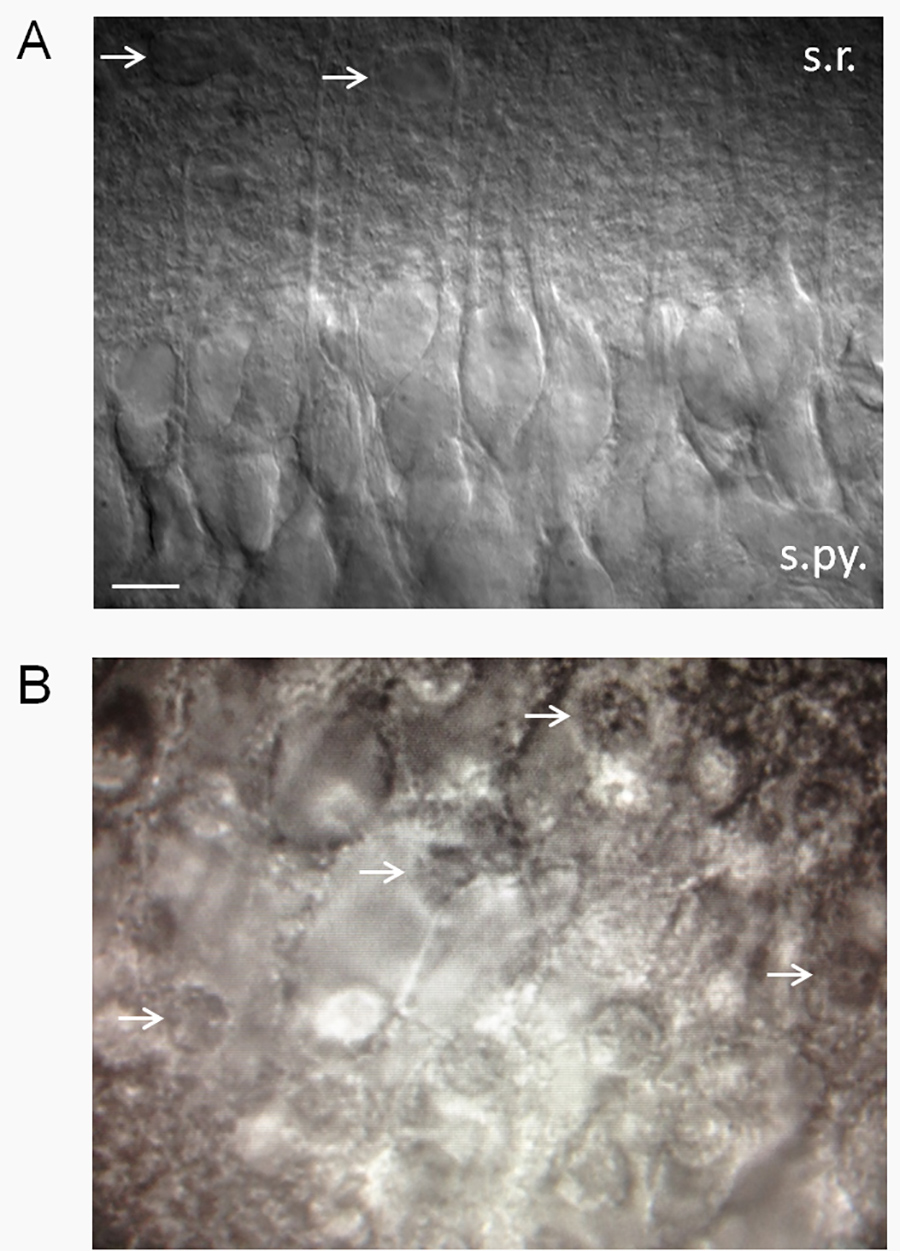
図2。スライスの健康の推定。(A)微分干渉コントラスト(DIC)光学系を用いて、健康そうな海馬スライス。健康的なスライスは滑らかで、ビロードのような外観と健康的なCA1錐体神経細胞の割合が高い。放線層に突出する先端樹状突起に注意してください。ここに示されたもののように見えるのニューロンのパッチクランプは、いくつかの自発的活動電位を標準2.5 mMのK + ACSF中の低静止膜電位(-61 -62にMV)を明らかにしている。膜電位および発火率は、元の関数として変化するtracellular K +(謝ら 15)。矢印は、推定されるアストロサイトを指している。略語:SR、放線層、s.py.、角質錐体。スケールバーは10μm。 (B)は不健康なスライスは目玉焼きの外観があり、デッドCA1錐体ニューロンの割合が高いがあります。(白矢印は死んだ神経細胞の核を指す-目玉焼きの「卵黄」)を拡大画像を表示するにはここをクリックしてください。
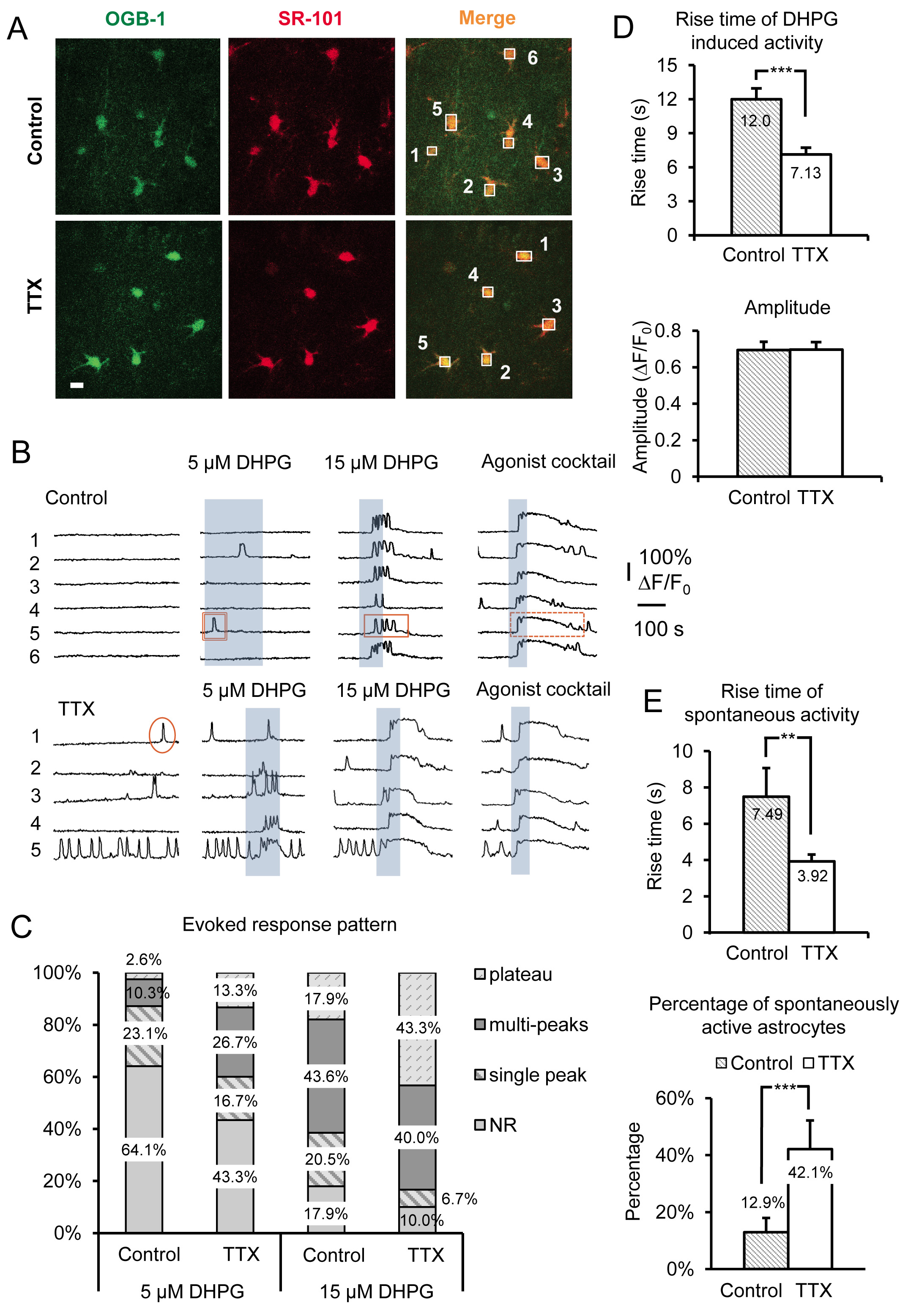
図3。のGq GPCR活性を増幅し、TTXでのインキュベーションにより神経細胞のAPの長期的な抑制後誘発グループIのmGluRのCa 2 +応答記録。(A)の記録領域内の細胞の代表的な画像は、CでインキュベートしontrolオレゴングリーンBAPTA-1 AMのCa 2 +指示薬色素(左パネル)とSR-101(中央のパネル)を取り上げている条件(上のパネル)またはTTX(下パネル)であった。スケールバーは10μmである。両信号のオーバーレイ(「マージ」)は、Ca 2 +の指標とそのアストロサイトの負荷を示している。ボックスは、アストロサイト内のCa 2 +の活動を監視するためにグリーンチャンネルでの経時的な蛍光強度を記録するために、個々の星状細胞体の上に描かれています。星状細胞中のCa 2 +活性のAにおける記録·ボックスから(B)サンプルトレース)。 TTXショーでインキュベートした星状細胞は、自発的な活動を増加させ、より強固な応答のパターンの変化によって証明されるように、グループIのmGluRのCa 2 +応答を誘発。単一ピーク(○)の例は、多峰(長方形)、および平坦域(点線の長方形)のCa 2 +トランジェントが示されている。応答パターン中の(C)の変更は、別のコンセントを使用して、特に明白であるグループIのmGluRアゴニストDHPGの配給。より多峰プラトー応答が与えられたアゴニスト濃度で対照と比較したTTXでのインキュベーション後に明らかである。振幅が(下のパネル)を変更しない間(D)は 「全か無か」の応答振幅を示す、コントロール(上のパネル)と比較して、TTXでインキュベートした星状細胞に速くDHPG誘発性Ca 2 +応答の時間をされて立ち上がり、一度対応する閾値に達した。 (E)の自発的なアストロサイトの倍の立ち上がりのCa 2 +過渡は集団のアストロサイトの割合は自発たGq GPCRのCa 2 +活性が上昇(下のパネル)を示しながら、アストロサイト(上のパネル)インキュベートも速くTTXでコントロール対インキュベートする。 拡大画像を表示するには、ここをクリックしてください。

図4。アストロサイトのGq GPCR活性を低下および上昇し、細胞外カリウム中でのインキュベーションによるニューロンのAPの長期的な増加は、以下のグループIのmGluRのCa 2 +応答を誘発記録。アストロサイトのCa(A)代表痕跡5.0 mMのK + ACSF中でインキュベートスライスから2 +レコーディングニューロンを脱分極し、ACSF(2.5mMのK + ACSF)と比較し、それらの基礎発火率を増加させる。 5.0 mMのK + ACSFの展示が少なく、自発体細胞のCa 2 +過渡弱いDHPGとインキュベートした星状細胞は、コントロールACSF中でインキュベートアストロサイトと比較して、応答を誘発。 (B)DHPGの複数の濃度に対する誘発反応のパターンを比較すると、神経細胞のAPの長期的な増加の後に弱い応答タイプを明らかにしている。 (C)POにおけるアストロサイトの割合の減少自発的活動の立ち上がり時間が遅く(下のパネル)になっている間の自発的Ca 2 +の活性を示すpulationは、上昇し、Kの長期のインキュベーション後に観察+ ACSF(上のパネル)と比較している。 (D)DHPGの異なる濃度に誘発アストロサイトの倍のCa 2 +応答立ち上がり制御ACSF中でインキュベートアストロサイトと比較して5.0 mMのK +処理後遅くなる。 拡大画像を表示するにはここをクリックしてください。
ディスカッション
記載されスケーリングモデルは、アストロサイトのグループI mGluRの長期的な可塑性を研究するための実用的な方法を表しています。イメージング自発および誘発のCa 2 +のイベントは、しっかりした証拠は、アストロサイトのCa 2 +上昇がGqをGPCR活性化10の下流、IP 3 Rの影響を受けやすい店舗からのリリースに続いて発生することが確立されているように、アストロサイトのGq GPCR活性の変化を測定するための高感度のアッセイを提供する12、17、18。グループIのmGluRアゴニストおよび例えばCa 2 +応答のパターンに応答する集団のアストロサイトの割合はアストロサイトによるグループIのmGluRの変化を報告している。
Ca 2 +の指標とアストロサイトをロードするために使用される特定の技術は、アストロサイトのGq GPCR活性の変化を調べるための実験の設計における重要な検討事項である。ボーラスロードまたはバルク·ロードの複数のアストロサイト、またはp個々のアストロサイトのATCHクランプ負荷はアストロサイト内の画像のCa 2 +過渡に使用することができます。各アプローチは、特定の利点と欠点があります。直接パッチクランプを介したCa 2 +の指標とアストロサイトを充填することは、SR-101のような2次マーカを必要とせずに、星状細胞のような細胞の明確な同定を可能にする。指標のパッチクランプ送達はまた、潜在的により深い細胞が健康で(利用可能なレーザパワーに依存)シナプスとより完全な相互作用にあるスライス内、毛細プロセスを含む小さな星状の区画からのCa 2 +の活動の記録を可能にします。データは一度に1セルを収集されるが、パッチクランプ負荷は低いスループットに苦しんでいる。バルク·ロードは、対照的に、星状細胞の大多数は、Ca 2 +指示薬を負荷し、同時に撮像することができる。ただし、アストロサイト表面付近にスライスの(<20μm)を関連する懸念で、ロードされている細胞の健康と完全なシナプス約S。
ここで紹介する背圧ボーラスローディングプロトコルは比較的高いスループットとスライス(40〜75ミクロン)の中に深くCa 2 +の活動を監視する機能を、妥協点を提供しています。ボーラスローディング技術を使用して自発的にアクティブアストロサイトの割合が大幅に増加は神経シナプスとアストロサイトのプロセス間の接続が15より完全であることを示唆し、バルクロードと比較して観察されている。良好なローディングでは、1つは、多くの場合、2光子顕微鏡を用いて星状細胞の主な処理(データは示していない)または潜在的にさらに小さな区画内のCa 2 +活性を監視することができる。ただし、注意が境界は、非特異的バックグラウンド染色に溶け込むように、特定のアストロサイトへの小さいプロセスを割り当てる際に行使される必要がある。バルク·ロードまたはボーラスローディング手順の使用と追加の懸念は、二次市場の必要性であるアストロサイトの識別のためのキブロン。それはアストロサイトが優先的にCa 2 +の指標を、AMエステルを取ることを長年知られてきたが、2次マーカのSR-101は、多くの場合、アストロサイトなどの負荷細胞を確認するために使用されている。 SR-101は、それ自体が、ニューロン29の固有の興奮性を変化させることができる。 SR-101の使用は、神経細胞の興奮上の可能なSR-101の効果を制限するためTTX内のすべての星状細胞のCa 2 +測定を実行する必要性を裏付ける。対照群と実験群の両方が、SR-101が含まれると仮定すると、それ自体がマーカーは、ニューロンの活動電位の長期的な操作次のアストロサイトのCa 2 +シグナル伝達に観察された効果を考慮してはいけません。それは、2.5mMのK +対の間の差を減少させることができるようにSR-101しかしながら、高K +の実験において懸念以上であってもよい5.0 mMのK +基礎発火率は比例して変更されていない場合。
Ca 2 +のを提供するための非常に有望なアプローチアストロサイトへの指標は、Ca 2 +染料を使用して、より伝統的なアプローチに魅力的な代替手段を提供していますこれは最近浮上している。重要な進歩は、アストロサイト30〜32を対象とし、遺伝的に符号化されたカルシウム指示薬(GECIs)で、過去数年にわたって行われてきた。 GECIsは、例えば海馬のような関心のある脳領域へのアデノ随伴ウイルスベクターのインビボでのマイクロインジェクションにより星状細胞に送達することができる。 GECIsの発現は、ウイルス感染32後約2週間後に達成される。アストロサイトにおけるGECIsの使用によって提示された多くの利点があります。まず、ベクターは、アストロサイト特異的プロモーターを使用して、星状細胞を標的とし、そのように標識された細胞は、アストロサイト32アールアール。第二に、信号対雑音がいますが、セル32上のパッチピペットを受けたことの侵襲性ではないが、色素のパッチクランプ送達を用いて得ることができるものに匹敵すると思われる。第三に、指標はデル可能iveredおよびバルク·ロードの配信方法を使用して問題がある成体組織で発現。さらに、発現は、複数のアストロサイトの中で分化する能力を提供し、モザイクである。同時に体細胞及び微細小枝で録音しつつ、いくつかの星状細胞は、潜在的に、同時に撮像することができる。したがって、潜在的に一つの技術は、大幅に効率が向上したGqアストロサイトのGPCRのスケーリング活性を記録するために3つの別々の技術(バルク·ロード、ボーラスローディング、パッチクランプローディング)の代わりに使用することができる。
アストロサイトへのCa 2 +指標のウイルス媒介送達を使用することの1つの潜在的な欠点は、スライスの健康32に可能な効果である。 GECIsを送達するために使用されるアデノ随伴ウイルスベクターは、星状細胞33の反応性神経膠症を引き起こすことが以前に示されている。一般に、脳切片の調製は、おそらくinfファイルの放出を含む病状の初期段階を開始するlammatory分子10。したがって、GECIsの使用は、ウイルスベクターを用いて送達星状細胞受容体のスケーリングを誘導するのに必要な長いインキュベーション時間と組み合わせ実験のこれらのタイプのスライスの健康との関連でさらなる考慮を受信する必要があろう。
このプロトコルを採用する場合には、応答を生成するためのアゴニスト印加時間は、受容体の可用性の関数として変化することに留意することが重要である。アゴニストの所与の濃度について、適用時間は、受容体が縮小され、より短いている場合、受容体は、Ca 2 +を生成するために十分に受容体を活性化する組織に適切な濃度に達するように薬物のために、スケールアップした場合に長くなる必 要があります応答。したがって、薬物適用時間、および潜在的にそれらの濃度は、スケーリングの意図した方向に応じて調整されなければならない。例えば、アゴニスト濃度は、Cが低下する必要があるかもしれないTTXのASE反応を飽和を回避するために、さらには反応を見るために高K +でスライスをインキュベートした後に増加した。 5-15μMは、多くの場合に高信頼性応答を生成するのには低すぎたとして具体的には、DHPG濃度のCa 2 +応答パターンを研究するために5.0mMのK +処理後30〜50μMにTTX処理後5-15μMからずれたグループI mGluRのダウンスケーリング後のアストロサイト。
アストロサイトのCa 2 +の活動の記録は、原形質膜へのまたはからの受容体の挿入や内在化の直接的な証拠を提供しない。しかし、GqをGPCR発現レベルと自発の間の直接の関係を検討し、カルシウム2 +過渡21〜24のCa 2 +の変化の最も論理的な解釈を誘発in vitroでのこれまでの研究からのデータとのデータの顕著な類似性に基づいてシグナリングは、星状細胞表面受容体の発現レベルが有することである変更しました。 1は、Ca 2 +活性に対する効果の軌跡についての追加の証拠を提供したい場合は、補完的なアプローチが重要な考慮事項があります。我々が使用される戦略は、アストロサイトMrgA1Rマウスから海馬スライスでのTTXのインキュベーションの効果を検討することであった。これらのトランスジェニックマウスは、星状細胞における外国のGq GPCR(MrgA1R)を発現する。この受容体は、脳へのネイティブではないため、その活動レベルを変更するために存在する内因性神経伝達物質ではありません。以前の研究は、この受容体が同じアストロサイト34の内因性グループIのmGluRなどのシグナル伝達分子を同じ細胞内に係合することが示唆された。後のTTXでMrgA1Rマウスからの切片の長期のインキュベーション、同腹仔対照と比較して、アゴニスト誘発MrgA1R応答の差はスライスがアストロサイトのCa 2 +活性に対する影響は、特に、表面受容体に局在化の変化によるものであるという証拠を提供するであろうインキュベートしていないグループIのmGluRの回答はまだSIGNIFある場合icantly同じアストロサイトに高めた。代替として、おそらくより複雑な戦略がある限り、膜画分は、表面受容体の発現レベルの変化について分析することができるように、ウェスタンブロット分析用スライスからアストロサイトを単離することであるけれども。蛍光活性化細胞選別(FACS)またはフローサイトメトリーは、ここで役に立つかもしれません。
ニューロン、星状細胞とアストロサイト、神経間相互作用の研究にこの技術の可能なアプリケーションは多い。我々の実験では、唯一のDHPG誘発グループIのmGluR星状細胞のCa 2 +応答は、幼若マウスから単離された急性海馬スライスにおいて、研究した。この製剤は、シナプス後細胞(CA1錐体細胞)上に、これらのグルタミン酸作動性ニューロンの発火率を操作することが可能となる、無傷の求心性神経(シャファー側枝)だけでなく、それらを引き起こすニューロン(CA3錐体細胞)を有するのみならず、およびそのプロセスassociat放線層におけるアストロサイトこれらのシナプスとE。急性海馬スライスは、他のタイプのニューロンの発火率を操作するための最善の準備ではないかもしれないが、しかし、などの多くの求心性神経は、それらを引き起こすニューロンから切断される。それにもかかわらず、他の星状細胞のGq GPCRサブタイプの可塑性を観察するために、特定のスライス標本において可能であってもよい。たとえば、スライスがそのまま海馬、前脳基底部のコリン作動性ニューロンとその突起を調製することができた。 TTXまたは上昇したK +でこれらのスライスのインキュベーションは、コリン作動性入力1のかなりの部分を受信角質オリエンスのアストロサイトにおけるmAChRはスケーリングをもたらす、コリン作動性ニューロンの基礎発火率に影響を与える。スケーリングが行われている間、TTXの持続放出をプラストの注入によって達成されるin vivoモデルを使用することができるすべての接続はそのままで、脳の特定の領域内での星状細胞受容体のスケーリングを研究するための代替アプローチまだテストされていない関心35の領域上のICポリマーエルバックス40W。このアプローチは、神経細胞のスケーリングの研究で以前に使用されているだけでなく、アストロサイトのスケーリングに適用可能であるべきである。最後に、適切な読み出しと、今後の研究は、G、SまたはGの変化私のGPCRを含む他のGPCRファミリーを調べることができます。一つは、 私のGPCRがローカルに任意のスライス標本内のGABA介在ニューロンを投影における焼成の阻害以下の影響を受けることがアストロサイトの GABA B Gを予測することがあります。このような二次メッセンジャーcAMPのリアルタイムの指標として他のシグナル伝達分子を標的とする新たな指標の開発は、神経細胞へのアストロサイト受容体通信の研究のまったく新しいエリアを開くだろう。
基礎ニューロン発火率を操作することによってアストロサイトmGluRの双方向のスケーリングは、神経伝達物質のAP媒介リリースにアストロサイトの感度の尺度を提供する。アストロサイトは、明らかに自発的なAPとglutamaを感知することができる細胞外のK +は生理的な範囲内であってもシェーファー担保CA1錐体細胞シナプスにおけるTEリリース。 TTXの急性適用は自発的なアストロサイトの頻度アストロサイトの受容体は、AP検出器であるという証拠を提供するのCa 2 +活性の18、36、37、となりますが、36の非相関集団のアストロサイトの中のCa 2 +活性を低下させないながら。これはアストロサイトはありません彼らの全体的なCa 2 +の活動に影響を与えるとの自発的な神経細胞のAPを検出することを示唆している。これは、広くIP 3の細胞内濃度が、検出可能なCa 2 +の上昇につながることが十分にIP 3 Rsのを刺激するための閾値レベルに到達する必要があることが認められている。自発的な神経細胞のAPは、測定可能なCa 2 +の上昇を生じることなく、アストロサイトのGPCRを活性化することができた?今後の研究では、蛍光共鳴エネルギー移動(FRET)または同様?と思ったらを利用することができる受容体へのGタンパク質結合(受容体活性化の尺度)および内部貯蔵からのCa 2 +放出との関係を調べるために(例えば、BRETなど)のiQue。この技術は、無傷の組織調製物における使用に利用可能になるまでにはしばらく時間がかかるかもしれないがBRETは、Gタンパク質のGPCRへのカップリング38を検出するためにインビトロで広く使用されてきた。これは、アストロサイトのGqのGPCRははるかに頻繁に、現在利用可能なのCa 2 +イメージングツールを使用して記録することができるよりも活性化されることが可能である。活動電位を感知することに加えて、星状細胞のGq共役GPCRはまた、最近の研究39で報告されたように神経伝達物質の小型の量子的放出を検出することができる。ここに記載の双方向スケーリング方法は、アストロサイトのGqのGPCRはインキュベーションプロトコルでバフィロマイシンA1を含むことにより、神経伝達物質の量子収率水疱性放出を検出する程度の尺度を提供するために、将来の研究に使用することができる。
>これまで、スケーリングプロトコルのみ幼若マウス(P12-P18)から海馬スライスにおいて使用されているntent「星状細胞受容体のスケーリングもまた、成体マウスから得られた組織において誘導されなかった場合。したがって、現在のところ不明である。説得力のある最近の研究アストロサイトにおけるグループIのmGluR式は時代の最初の週後にかなり減少し、成人のアストロサイト40内の受容体発現の非常に低いレベルで、成人期まで減少し続けていることを示唆している。アストロサイトのmGluRは、長期以下のスケールアップ場合は、それゆえ決定するために興味深いものになるだろう幼若マウスからの星状細胞に見られるものに近づくレベルにまで成熟マウスの海馬スライスにおける神経発火の長期抑制。この発見は、星状細胞受容体の発現が特定の年齢で、静的ではなく、神経活動のレベルに応じて迅速に変更することができることを示唆している。とは対照的に成体マウスにおけるグループI mGluRの発現低下、証拠が含む&#そのアドレナリン受容体を、浮上している945; 1A、α2Aは、β1サブタイプは、主に成人の脳3、4にあるアストロサイトによって表現されています。 α1AはアドレナリンのGq GPCRは、これらの受容体がアドレナリン作動性ニューロンの発火率の変化に敏感であるかどうかを含め、ニューロンへのアストロサイトのコミュニケーションの今後の研究のための魅力的な標的となる可能性がある。開示事項
著者らは、これらの研究で使用テトロドトキシンは、アブカム社から購入したことを開示する。アブカムは仮説、設計、またはデータの収集には関与していなかった。ピア·レビュー·プロセスが完了した後にアブカムの作品への協賛に関するすべての通信が発生しました。
謝辞
著者らは、スケーリングプロトコルとデータの貴重な議論のためのグリア - 神経相互作用のためのカリフォルニア大学リバーサイドのセンターを承認したいと思います。著者はまた、誠実に自分の仕事の出版を後援するためにアブカムに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Chamber Supplies | |||
| Brinkmann pipette storage container | Fisher Scientific | 03-491 | Use the drawer portion as the incubation chamber |
| Electrical drill | |||
| Flexible tubing | Tygon | R-3603 | |
| Silicone seam sealant | Also called aquarium seam sealer | ||
| Gas tank | 95% oxygen, 5% carbon dioxide | ||
| Natural beveled pipette tip | USA Scientific | 1111-1000 | Cut-to-fit to connect oxygenate lines |
| One-to-six lines manifold | Warner Instruments | 64-0210 (MP-6) | For the microloader-manifold apparatus |
| Microloader | Eppendorf | 5242 956.003 | For the microloader-manifold apparatus, cut-to-fit |
| Floating Bubble Rack | Bel Art Scienceware | F18875-0400 | For slice holder |
| 600 µm Sefar Nitex Nylon mesh | ELKO Filtering Co. | 06-600/51 | For slice holder |
| Krazy Glue | For slice holder | ||
| Reagents | |||
| Isoflurane | Baxter | 1001936060 | |
| NaCl | Fisher | S271-3 | |
| KCl | Fisher | P333-500 | |
| CaCl2 | Fisher | C79-500 | |
| MgCl2 | Fisher | M33-500 | |
| NaH2PO4 | Fisher | S369-500 | |
| NaHCO3 | Fisher | S233-500 | |
| Glucose | Fisher | Fisher | |
| (±)-6-Hydroxy-2,5,7,8- tetramethylchromane-2-carboxylic acid (Trolox) | Acros Organics | 53188-07-1 | |
| Ascorbic acid | Acros Organics | 401471000 | |
| Tetrodotoxin citrate (TTX) | Abcam | ab120055 | |
| Sulforhodamine 101 (SR-101) | Sigma-Aldrich | 284912 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Pluronic Acid F-127 | Invitrogen, Molecular Probes | P6867 | |
| Oregon Green 488 BAPTA-1 AM *cell permeant (special packaging) | Invitrogen, Molecular Probes | O6807 | |
| (RS)-3,5-DHPG | Abcam | ab120020 | |
| Histamine | Sigma-Aldrich | H7125 | |
| Carbamoylcholine chloride (Carbachol) | Sigma-Aldrich | C4382 | |
| Adenosine 5’-ATP disodium (Na-ATP) | Sigma-Aldrich | A7699 | |
| Dissection Tools | |||
| Single-edge razor blade | GEM | 62-0161 | For bisection |
| Double edge razor blade | TED PELLA, INC. | 121-6 | For cutting slices |
| Mayo Scissors, supercut | WPI | 14010-15 | For decapitation |
| Fine iris scissors, straight | Fine Science Tools | 14094-11 | For cutting the skull |
| Iris forceps, curved | WPI | 15915 | To remove the skin and skull |
| Small spatula | To remove/transfer the brain | ||
| Dumostar Dumont #5 Biologie Tip forceps | Fine Science Tools | 11295-10 | For hippocampus dissection |
| Glass Pasteur pipette | Fisher | 13-678-20B | For transferring brain slices |
| Pasteur pipette rubber bulb | Fisher | 03-448-22 | For transferring brain slices |
| Polystyrene 100 mm tissue culture dishes | Corning | 25020 | |
| Vibratome | Leica | VT 1200S | |
| Water bath | Fisher | ISOTEMP 210 | For warm incubation |
| Micropipette puller | Narishige | PC-10 | For bolus-loading pipette |
| Confocal microscope | Olympus | Olympus Fluoview 1000 | |
| Low Profile Open Diamond Bath Imaging Chamber with PM-1 platform | Warner Instruments | RC-26GLP | diamond bath with low profile |
| Borosilicate glass pipette | World Precision Instruments | TW150F-4 | For bolus-loading pipette |
| Micromanipulator | Sutter Instrument | ROE-200 | For bolus-loading pipette |
| Spin-X centrifuge tube filter with 0.22 µm cellulose acetate | Costar | 8161 |
参考文献
- Araque, A., Martin, E. D., Perea, G., Arellano, J. I., Buno, W. Synaptically released acetylcholine evokes Ca2+ elevations in astrocytes in hippocampal slices. J. Neurosci. 22, 2443-2450 (2002).
- Navarrete, M., Araque, A. Endocannabinoids mediate neuron-astrocyte communication. Neuron. 57, 883-893 (2008).
- Bekar, L. K., He, W., Nedergaard, M. Locus coeruleus alpha-adrenergic-mediated activation of cortical astrocytes in vivo. Cereb. Cortex. 18, 2789-2795 (2008).
- Hertz, L., Lovatt, D., Goldman, S. A., Nedergaard, M. Adrenoceptors in brain: cellular gene expression and effects on astrocytic metabolism and Ca2. Neurochem. Int. 57, 411-420 (2010).
- Porter, J. T., McCarthy, K. D. Hippocampal astrocytes in situ respond to glutamate released from synaptic terminals. J. Neurosci. 16, 5073-5081 (1996).
- Bernardinelli, Y., et al. Astrocytes display complex and localized calcium responses to single-neuron stimulation in the hippocampus. J. Neurosci. 31, 8905-8919 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Wang, X., et al. Astrocytic Ca2+ signaling evoked by sensory stimulation in vivo. Nat. Neurosci. 9, 816-823 (2006).
- Fiacco, T. A., Agulhon, C., McCarthy, K. D. Sorting out astrocyte physiology from pharmacology. Annu. Rev. Pharmacol. Toxicol. 49, 151-174 (2009).
- Agulhon, C., et al. Calcium Signaling and Gliotransmission in Normal vs Reactive Astrocytes. Front. Pharmacol. 3, 139 (2012).
- Nedergaard, M., Verkhratsky, A. Artifact versus reality--how astrocytes contribute to synaptic events. Glia. 60, 1013-1023 (2012).
- Nizar, K., et al. In vivo stimulus-induced vasodilation occurs without IP3 receptor activation and may precede astrocytic calcium increase. J. Neurosci. 33, 8411-8422 (2013).
- Sutton, M. A., et al. Miniature neurotransmission stabilizes synaptic function via tonic suppression of local dendritic protein synthesis. Cell. 125, 785-799 (2006).
- Ibata, K., Sun, Q., Turrigiano, G. G. Rapid synaptic scaling induced by changes in postsynaptic firing. Neuron. 57, 819-826 (2008).
- Xie, A. X., et al. Bidirectional scaling of astrocytic metabotropic glutamate receptor signaling following long-term changes in neuronal firing rates. PLoS ONE. 7, (2012).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol. Rev. 79, 1089-1125 (1999).
- Petravicz, J., Fiacco, T. A., McCarthy, K. D. Loss of IP3 receptor-dependent Ca2+ increases in hippocampal astrocytes does not affect baseline CA1 pyramidal neuron synaptic activity. J. Neurosci. 28, 4967-4973 (2008).
- Nett, W. J., Oloff, S. H., McCarthy, K. D. Hippocampal astrocytes in situ exhibit calcium oscillations that occur independent of neuronal activity. J. Neurophysiol. 87, 528-537 (2002).
- Garaschuk, O., Milos, R. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1, 380-386 (2006).
- Nimmerjahn, A., Kirchhoff, F., Kerr, J. N., Helmchen, F. Sulforhodamine 101 as a specific marker of astroglia in the neocortex in vivo. Nat. Methods. 1, 31-37 (2004).
- Prezeau, L., et al. Changes in the carboxyl-terminal domain of metabotropic glutamate receptor 1 by alternative splicing generate receptors with differing agonist-independent activity. Mol. Pharmacol. 49, 422-429 (1996).
- Shao, Y., McCarthy, K. D. Quantitative relationship between alpha 1-adrenergic receptor density and the receptor-mediated calcium response in individual astroglial cells. Mol. Pharmacol. 44, 247-254 (1993).
- Wang, S. S., Thompson, S. H. Measurement of changes in functional muscarinic acetylcholine receptor density in single neuroblastoma cells using calcium release kinetics. Cell Calcium. 15, 483-496 (1994).
- Ostasov, P., Krusek, J., Durchankova, D., Svoboda, P., Novotny, J. Ca2+ responses to thyrotropin-releasing hormone and angiotensin II: the role of plasma membrane integrity and effect of G11alpha protein overexpression on homologous and heterologous desensitization. Cell Biochem. Funct. 26, 264-274 (2008).
- Shelton, M. K., McCarthy, K. D. Hippocampal astrocytes exhibit Ca2+-elevating muscarinic cholinergic and histaminergic receptors in situ. J. Neurochem. 74, 555-563 (2000).
- Hermans, E., Challiss, R. A. Structural signalling and regulatory properties of the group I metabotropic glutamate receptors: prototypic family C G-protein-coupled receptors. Biochem. J. 359, 465-484 (2001).
- Zur Nieden, R., Deitmer, J. W. The Role of Metabotropic Glutamate Receptors for the Generation of Calcium Oscillations in Rat Hippocampal Astrocytes In Situ. Cortex. 16 (5), 676-687 (2005).
- de Ligt, R. A., Kourounakis, A. P., AP, I. J. Inverse agonism at G protein-coupled receptors: (patho)physiological relevance and implications for drug discovery. Br. J. Pharmacol. 130, 1-12 (2000).
- Kang, J., et al. Sulforhodamine 101 induces long-term potentiation of intrinsic excitability and synaptic efficacy in hippocampal CA1 pyramidal neurons. Neuroscience. 169, 1601-1609 (2010).
- Tong, X., Shigetomi, E., Looger, L. L., Khakh, B. S. Genetically encoded calcium indicators and astrocyte calcium microdomains. Neuroscientist. 19, 274-291 (2013).
- Akerboom, J., et al. Optimization of a GCaMP Calcium Indicator for Neural Activity Imaging. J. Neurosci. 32, 13819-13840 (2012).
- Shigetomi, E., et al. Imaging calcium microdomains within entire astrocyte territories and endfeet with GCaMPs expressed using adeno-associated viruses. J. Gen. Physiol. 141, 633-647 (2013).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nat. Neurosci. 13, 584-591 (2010).
- Fiacco, T. A., et al. Selective stimulation of astrocyte calcium in situ does not affect neuronal excitatory synaptic activity. Neuron. 54, 611-626 (2007).
- Echegoyen, J., Neu, A., Graber, K. D., Soltesz, I. Homeostatic plasticity studied using in vivo hippocampal activity-blockade: synaptic scaling, intrinsic plasticity and age-dependence. PLoS One. 2, (2007).
- Aguado, F., Espinosa-Parrilla, J. F., Carmona, M. A., Soriano, E. Neuronal activity regulates correlated network properties of spontaneous calcium transients in astrocytes in situ. J. Neurosci. 22, 9430-9444 (2002).
- Takata, N., Hirase, H. Cortical layer 1 and layer 2/3 astrocytes exhibit distinct calcium dynamics in vivo. PLoS ONE. 3, e2525 (2008).
- Salahpour, A., et al. BRET biosensors to study GPCR biology, pharmacology, and signal transduction. Front. Endocrinol. 3 (105), (2012).
- Di Castro, M. A., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat. Neurosci. 14, 1276-1284 (2011).
- Sun, W., et al. Glutamate-dependent neuroglial calcium signaling differs between young and adult. Science. 339, 197-200 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved