Method Article
טכניקת הכנה רב שלבים לשחזר חוגים מתחם המטבוליט מרובים לעומק וניתוח Metabolomic אינפורמטיבי
In This Article
Summary
האמינות של תוצאות בניסויי metabolomics תלוי באפקטיביות והשחזור של הכנת המדגם. תאר היא שיטה קפדנית ומעמיקה שבמאפשרת מיצוי של מטבוליטים מנוזלים ביולוגיים עם האפשרות של המשך ניתוח עד אלפי תרכובות, או רק את שיעורי המתחם של עניין.
Abstract
Metabolomics הוא תחום מתפתח אשר מאפשר אפיון של דגימות מיצורי חיים על מנת לקבל תובנות לגבי תהליכים ביולוגיים. היבט חיוני של metabolomics הוא הכנת מדגם לפיו עולות בקנה אחד טכניקות להפיק תוצאות לא אמינות. טכניקה זו כוללת משקעים חלבון, מיצוי נוזל נוזל, ומיצוי מוצק שלב כאמצעי fractionating מטבוליטים לארבע כיתות נפרדות. העשרה משופרת של מולקולות שפע נמוכות עם גידול וכתוצאה מרגישות מתקבלת, וסופו של דבר גורמת לזיהוי בטוח יותר של מולקולות. טכניקה זו הוחל על פלזמה, נוזל שטיפת רונכואלוואולרית, ודגימות נוזל השדרה עם נפחים נמוכים כמו 50 μl. דוגמאות יכולות לשמש ליישומים במורד הזרם מרובים; לדוגמא, את הכדור כתוצאה ממשקעי חלבון יכול להיות מאוחסן לניתוח מאוחר יותר. Supernatant מצעד שעובר מיצוי נוזל נוזל באמצעותמים וממס אורגני חזק כדי להפריד את התרכובות הידרופילי והידרופובי. ברגע שמופרד, שכבת הידרופילי יכולה להיות מעובד לצורך הניתוח מאוחר יותר או שהושלכה אם אין צורך. החלק הידרופובי מטופל נוסף עם סדרה של ממסים בשלושה צעדי חילוץ מוצק שלב כדי להפריד אותו לחומצות שומן, שומנים ניטראליים, ופוספוליפידים. זה מאפשר לטכנאי את הגמישות לבחור איזה סוג של תרכובות עדיפים לניתוח. זה גם מסייע בזיהוי המטבוליט אמין יותר שכן חלק הידע של כיתה כימית קיימת.
Introduction
תגובות ביולוגיות לייצר מטבוליטים כמוצרים סופיים של תהליכים תאיים. Metabolomics הוא אוסף של כל התרכובות קיימות באורגניזם כתוצאה מתהליכים אלה. הוא מספק תמונה של הפיסיולוגיה של תאים ומשקף תגובה של האורגניזם לגירויים חיצוניים או פנימיים 1, 2. גירויים כאלה יכולים להיות סביבתיים, טוקסיקולוגי, תרופתיים, תזונתיים, הורמונליים, או הקשורים למחלה. יש יישומי metabolomic רבים וכעת הם נחקרים על ידי חוקרים וכוללים סמנים ביולוגיים גילוי 3, לימודי תזונה 4, מדעי מזון 5, ובדיקות סמים 6. ללא תלות ביישום, שינויים בנתונים, זיהום, ונוכחות של תוצאות חיוביות שגויות צריכים להיות מופחתים או רצוי להסירו. בגילוי סמן ביולוגי או במקרה של קביעת הבדלים בין בקרה וקבוצת מחלה, או לחקור השפעות של תרופות על נושאים, ו ביולוגיluid נבחר מבוססת על השאלות שהוא שאל והסוגים של מטבוליטים נחקרים 7. לדוגמא, אם לומד את ההשפעות מיידיות של תרופה בשאיפה על הריאות של חולי אסתמה, ולאחר מכן לבחון מטבוליטים בנוזל שטיפה ברונכואלוואולרית (בלף) דגימות לפני ואחרי הנטילה יהיה מועדף. כדי להבטיח שנצפה הבדלים הם עקב וריאציה ביולוגית בפועל ולא מדגם טכניקת הכנה לא תקינה, פרוטוקול מעבדה סטנדרטי ועקבי הוא חיוני 8. מידע מדגם חייב להיות מתועד בקפידה כדי להבטיח שמשתנים כגון נוזל ביולוגי, זן בעלי חיים, זמן דגימה, גיל נושא, מין, עד כמה שם, כולם נחשבים ונלקח בחשבון במחקר 9. בנוסף, כדי לצמצם את האפשרות של זיהום או חיובי שגוי, מומלץ שחסר ממס ואת החסר מכשיר להיות מנותח 10.
עבור פרוטוקול זה, METABO המונח "לייט "ישמש להתייחס לתרכובות בפועל מזוהות. באמצעות ספק תוכנה, אלגוריתם ממצא שיא ראשוני משמש כדי לזהות פסגות רפאים המוניות. פסגות אלה מיושרים המבוססים על יחס בין מסה למטען (m / z) ושמירת זמן. אלגוריתם שני לאחר מכן נעשה שימוש כדי לשלב תכונות מרובות לתוך מתחם אחד. זה כולל תכונות כגון נתרן, אשלגן, או adducts אמוניום במצב היינון החיובי, וכלוריד במצב היונים השלילי. אפשרויות נוספות בתוכנה כוללות תכונות כגון הדימרים וadducts אחרים. שימוש בגלוקוז כדוגמא, עם פסגות ב181.0707 מ '/ z (M + H), 198.0972 מ' / z (M + NH 4), ו203.05261 מ '/ z (M + Na), יהיו שלוש פסגות המתאימות לאותו מתחם באמצעות האלגוריתם הראשון. עם זאת, כאשר האלגוריתם השני, המבוסס על נוסחה מולקולרית, מוחל שלושה adducts אלה הופך מקובצים יחד וכתוצאה ממתחם אחד.
מטבוליטים יכולים לגרום להפרעות בsamples בשל המורכבות של תרכובות הווה. נוכחותם של אלפי מטבוליטים בגורמי דגימה אחת לאותת דיכוי במיוחד של מטבוליטים שפע נמוכים יותר. ניקוי מדגם להסיר מפריע חלבונים, וההפרדה הבאה לשברים מרובים מפחיתה את המורכבות של המדגם ובכך לשפר את הפרדת שיא, הגדלת רזולוציה, והפחתת Coelution המטבוליט. לכן, נדרשים ניקוי מדגם משופר והפרדה של תרכובות. הוכח כי משקעים חלבון לבד, אפילו עם השימוש בממסים קוטבי שונים, לא יכול לפתור בעיה זו 11, 12. עם זאת, על ידי שילוב של ממס אורגני חזק כגון MTBE בצעד חלוקה שלאחר מכן, כיסוי המטבוליט הוא גדל. יאנג et al. 12 דיווחו על עלייה במטבוליטים מ1,851 או 2,073 עם מתנול או ממטרים מתנול אתנול בלבד בהתאמה, ל3,806 מטבוליטים באמצעות מיצוי בממסים MTBE בשילובאחרי מיצוי מוצק שלב צעדים (SPE). חפיפה מופחתת המטבוליט, הפרדת שיא משופרת ושפע המטבוליט מוגבר נצפו עם שיטה זו.
זיהום מהלא מטבוליטים, כגון פולימרים, יכול לנבוע מאיסוף דגימה, ממסים, או רעש של מכשיר, והוא יכול לגרום לדיכוי אות של מטבוליטים שעלולים להיות משמעותיים. מומלץ כי הטכנאי (ים) ומי לאסוף את הדגימות לפני לדגום הכנה באופן עקבי להשתמש באותו מותג, סוג וגודל בקבוקוני איסוף דגימה, הטיפים פיפטה וכל צינורות אחרים המשמשים במהלך האיסוף וההכנה של הדגימות. זה מאפשר לאנליסט נתונים יש ביטחון מלא שהשינויים שנצפו הם אמיתיים ולא בשל הבדלי רקע ממקורות אחרים. יעילות טיפול, הבדלים בין קבוצות מחלה ובקרה, או כל ניתוחים מטבוליים אחרים אז יכולים להיות שנחקרו בביטחון מוגבר.
ספידOD דן כאן מתמקד בשיטות משולבות מדגם הכנת 13-15 אשר יכול להיות מיושמות על פלזמה, בלף, או נוזל המוח והשדרה (CSF) דגימות לפרופיל metabolomic הלא ממוקד לספקטרומטריית נוזל כרומטוגרפיה מסה (LCMS) ניתוח מבוסס. שתי כרומטוגרפיה נוזלית (LC) וכרומטוגרפיה נוזלית אולטרה ביצועים (UPLC) יכולה להיות בשילוב טכניקות הפרדה לטרשת נפוצה לאחר הליך זה. חוקרים רבים מבצעים מחקרי metabolomic להשתמש גם בטכניקת משקעים חלבון ו / או טכניקת נוזל נוזל מיצוי 16, 17. במחקרים שלנו, כל זה הסתיים בפחות מטבוליטים שיראו. השיטה המתוארת כאן 12 מאפשרת איתור וזיהוי של מספר גדול יותר של מטבוליטים, המשתרע על מגוון רחב יותר של metabolome. גידול זה נובע מהטוהר גבוה יותר של הדגימות ואפקטי מטריצה מופחתות שנגרמו על ידי הפרדה מראש של שיעורי המטבוליט.
Prot ראשוניצעד ממטרים עין מתבצע באמצעות מתנול הקר (MeOH) כדי להסיר חלבון מן המדגם. מיצוי נוזל נוזל (איל) באמצעות אתר מתיל טרט בוטיל (MTBE) ומים משמש להפרדת התרכובות הידרופילי והידרופובי. ואז מיצוי מוצק שלב (SPE) מבוצע על השכבה הידרופובי להפריד את התרכובות הידרופובי לשלושה סוגים - חומצות שומן, שומנים ניטראליים, ופוספוליפידים. שברים הידרופובי מחדש במתנול 100%, ואילו חלק קטן הידרופילי הוא מחדש באצטוניטריל 5% במים. הצעד מוצק שלב חילוץ (SPE) מספק רמה נוספת של ביטחון בתוצאות על ידי צמצום מספר תרכובות coeluting אשר אחרת היה להיות נוכחים הייתה צעד הפרדה לא בוצע.
Protocol
1. שיקולים ראשוניים, הכנת מכשירים וההתקנים
- השתמש תמיד בזכוכית לאחסון (צינורות תרבות זכוכית, בקבוקוני autosampler זכוכית) או העברה (טפטפות זכוכית) שומנים וממסים אורגניים.
- לצמצם את החשיפה של כל דגימות השומנים בדם והסטנדרטים לאוויר. polytetrafluoroethylene החותם (PFTE) כובעים הדוקים, כדי למנוע חשיפה לאוויר ואידוי. מייד resuspend שומנים יבשים בממס הבא או לשמור אותם בזרם יציב של חנקן.
- שימוש במדגם 100 μl. במקרים שבם לדוגמה יותר (או פחות) זמין, להתאים כמויות בהתאם. עם זאת בחלוקת השומנים בעמודת SPE NH 2, הצהיר כרכים חייבים להישאר כפי שצוינו.
- הפעל צנטריפוגות ומוגדרת 0 מעלות לפני להתחיל של הכנת מדגם.
- טכניקה זו משתמשת רבים ממסים נדיפים כך לשמור את כל הממסים כתרים במהלך הכנת מדגם.
- הכן שני סוגים של סטנדרטים להמלצה.
- הכן את ביקורת שלילית וכוללת את כל ממוסמר-בסטנדרטים בריכוז קבוע. זה זינק לתוך כל הדגימות, כמו גם מדגם נקווה שמשמש כיצווה QC (מדגם נקווה זינק משמש לניטור מדגם שחזור הכנה בימים נפרדים) ומכשיר QC (זינק דגימות ונקוו שהוכנו קודם לכן, תת aliquoted, ונהגו לעקוב אחר תנאים / תנודות מכשיר במהלך ניתוח ובימים נפרדים).
- הכן את הבקרות חיוביות ב1x, 2x, וקוצים סטנדרטיים 4x. הבקרות החיוביות נוספות לכל הדגימות, כמו גם מדגם פלזמה ונקווה ומשמשות כתרכובות בקרת איכות עבור שני מדגם שלבי ההכנה ושלבי ניתוח סייע לנתח ולזהות את השינוי של פי ההבדלים בניתוח נתונים על מנת להבטיח כי כל ההיבטים של הכנה וניתוח אינסטרומנטלי בוצעו בצורה נכונה.
- סטנדרטים חנות ב -20 דגימות מעלות צלזיוס וחנות ב -80 ° C. עמדה פנימית מסוימתARDS אשר נוטים השפלה הבאה אחסון לטווח ארוך צריך להיות מאוחסן ב -80 ° C.
- הליך זה מחייב השימוש בממסים מסוכנים, דליקים או נדיפים כגון MTBE. לבצע את כל השלבים במנדף.
2. פנימי תקנים
- בחר סטנדרטים פנימיים (istD) המבוססים על פרויקטים אישיים ועיצוב הניסיון הספציפי שלהם. לbiofluids כגון פלזמה, בלף, או שתן, ISTDs כותרת isotopically אשר דומים באופי לאלה שנמצאו בדגימות ביולוגיות אלה יהיו אידיאליים. אלה כוללים, אך אינם מוגבלים לחומצות אמינו, הורמונים או שומנים. לקבלת דוגמיות metabolomic צמח, יכולים לשמש סטנדרטים שכותרת כגון פלבנואידים, או קרוטנואידים. הדבר נכון גם לגבי מחקרי metabolomic אחרים לפיה החוקר צריך לבחור תקן פנימי שהוא נציג של להיות מנותח סוג המדגם.
- ודא שistD נבחר מכסה מגוון רחב של הכרומתוגרמה; לדוגמא, אם לאהוא זמן רכישה הוא 20 דקות, סטנדרטים שelute כל 5 דקות יכולים לשמש.
- יצירת פתרונות מניות הידרופילי ב2 מ"ג / מיליליטר באמצעות מגוון של סטנדרטים שכותרת isotopically ו / או תרכובות קוטב אחרות שהנם אקסוגניים למדגם להיות מנותח. מפתרון מניות, ליצור פתרון אחד ב1:01 מתנול: מים בכל התקנים לריכוז סופי של 25 מיקרוגרם / מיליליטר קריאטינין-D 3, 100 מיקרוגרם / ליזין-D מיליליטר 4, ו200 מיקרוגרם / לין-D מיליליטר 8 .
- יצירת פתרונות מניות הידרופובי תוך שימוש במגוון של סטנדרטים שכותרת isotopically ו / או תרכובות לא קוטביים אחרות אשר הנן אקסוגניים למדגם להיות מנותח; ריכוזי מניות של חומצת 17:00 שומן (4 מ"ג / מיליליטר), חומצת שומן 19:01 (4 מ"ג / מיליליטר), 17:00 ceramide (2 מ"ג / מיליליטר), 17:00 PE (1.75 מ"ג / מיליליטר), 15 : 0 מחשב (2 מ"ג / מיליליטר), וטסטוסטרון-D 2 (1 מ"ג / מיליליטר). מכל אחת מהמניות, ליצור פתרון אחד ב01:01 כלורופורם: מתנול בכל התקנים לריכוז סופי של 50מיקרוגרם / מיליליטר 17:00 ceramide, 100 מיקרוגרם / מיליליטר 15:00 מחשב,, 200 מיקרוגרם / מיליליטר 17:00 חומצות שומן, 200 מיקרוגרם / מיליליטר 19:01 חומצה 100 מיקרוגרם / טסטוסטרון-D 2 מיליליטר שומן, ו200 מיקרוגרם / מיליליטר 17:00 PE בתמהיל הסטנדרטי.
- בדוק את מידת היינון של כל תקן מראש באמצעות לפחות חמישה ריכוזים שונים עבור כל תקן כדי לקבוע את גבול הגילוי והליניאריות של המכשיר לתרכובות אלה. הריכוז של פתרון המניות עבור כל תקן בודד ישתנה בהתאם לתכנון ניסוי, והריכוז של כל תקן בתקן ממוסמר המשולב עשוי לנוע בין 20 מיקרוגרם / מיליליטר עד 2 מ"ג / מיליליטר, תלוי כמה טוב הם היינן.
- ליצור תמהיל ספייק של בקרות חיוביות ולהוסיף אותם לדגימות ב1x, 2x, או רמות ריכוז 4x לפקח כמותית את עוצמתה של הכנת המדגם ודיוק נתוני אינסטרומנטלי. ריכוז סופי של בקרות חיוביות יכוללהיות: 2 מ"ג / מיליליטר D-גלוקוז, 100 מיקרוגרם / מיליליטר אלנין-D 3, חומצה-D methylmalonic 200 מיקרוגרם / מיליליטר 3, 20 מיקרוגרם / הטריגליצרידים-D מיליליטר 5, ו / או סטנדרטים הידרופובי והידרופילי אחרים. התאם את הריכוזים סטנדרטיים המבוססים על הרגישות של מכשור MS וHPLC משמש לניתוח.
3. משקעים חלבון
- דגימות הפשירו לRT וספייק 10 μl של istD מדגם זה כפי שיתואר להלן.
- ספייק 10 μl של שני פתרונות הידרופילי ו הידרופובי הסטנדרטי (שנוצרו מהמניות בצעדים 2.3 ו2.4) לכל דגימה. התאם את הריכוזים סטנדרטי צורך כמבוסס על הרגישות של מכשור MS וHPLC משמש לניתוח
- ספייק 10 μl של או 1x, 2x, או פתרון בקרה החיובי 4x (שנוצר מהמניות בשלב 2.6) לכל דגימה. התאם את הריכוזים סטנדרטי צורך כמבוסס על הרגישות של MS ו-HPמכשור LC המשמש לניתוח
- ורטקס כל מדגם ל10 שניות לפני צעד המשקעים חלבון
- להוסיף 400 μl של מתנול הקר כקרח (מאוחסן ב -20 מעלות צלזיוס) לכל דגימה.
- ורטקס עבור 10 שניות לכל צינור.
- צנטריפוגה ב C ° 0 במשך 15 דקות ב 18,000 X גרם.
- להעביר את כל supernatant לצינור תרבות זכוכית חדש, ולאחר מכן יבש תחת N 2.
- אם ניתוח שבריר גלולה חלבון, המשך צעדים 3.8-3.11. אם לא ניתוח גלולה החלבון, דלג לסעיף 4.
הערה: גלולה החלבון עשויה להכיל תרכובות עם הידרופוביות גבוהה, שתהיינה שימושיים בעת ביצוע מחקרי סמים 18, מזון מנתח מעורב פלבנואידים הידרופובי 19 או לימודי metabolomic הקשורים למחלות שבו תרכובות מאוד הידרופובי לצבור, כגון ceroid-lipofuscinoses העצבי 20 ואחסון שומנים lysosomal מחלות 21. - הוסף 1 מיליליטר של MTBE כדי לאהוא גלולה חלבון לבנה (או בצבע שמנת), מערבולת ל30 שניות לכל צינור, אז צנטריפוגות ב 0 מעלות צלזיוס במשך 15 דקות ב 18,000 X גרם. למזוג את שכבת MTBE לצינור תרבות זכוכית חדשה.
זהו צעד קריטי כמו טעויות פה יהיו דרסטי להשפיע על תוצאות (ראה איור 5 בתוצאות נציג).- באופן עקבי לשאוב את אותה כמות של MTBE עבור כל דגימות שכן הגודל של גלולה ישתנה בין דגימות. לכן, אם ניתן יצק רק 900 μl למדגם עם הסכום הנמוך ביותר של supernatant, ולאחר מכן למזוג 900 μl עבור כל הדגימות.
- חזור על שלב 3.9, ולשלב את השכבה האורגנית לאותו צינור תרבות הזכוכית מוכן בשלב 3.7.
- דגימות יבשים על ידי N 2 זרימה ו resuspend ב 200 μl של 1:1 כלורופורם: מתנול. בקצרה מערבולת.
- מעביר צינור צנטריפוגות. צנטריפוגה ב C ° 0 במשך 15 דקות ב 18,000 XG, לאחר מכן להעביר את supernatant לAutosampler בקבוקוני כובע בורג באמצעות זכוכיתטפטפות.
4. הפקת נוזל הנוזל
- בעזרת פיפטה זכוכית, להוסיף MTBE 3 מיליליטר למתנול היבש שיורי (מסעיף 3, שלב 6), מערבולת 30 שניות, להוסיף 750 μl של מים, ואז מערבולת 10 שניות לכל צינור.
- ספין ~ XG 200 עבור 10 דקות בצנטריפוגה ב RT.
- לשאוב 2.5 מיליליטר של שכבת MTBE (בלי לקבל מים) ולהעביר צינור תרבות זכוכית נקי.
הערה: זה הוא שלב קריטי כמו הבדלים כאן ישפיעו על תוצאות. 2.5 מיליליטר של MTBE יש יצקו בזהירות מהשכבה העליונה, כי זה מאפשר נפח קבוע שיצק מבלי pipetting השכבה המימית להלן. אם הנפח של מדגם בתחילת הניסוי היה פחות מ 100 μl המצוין לשיטה זו, בהיקף של היקף MTBE כדי לשקף את זה מדגם ההתחלה נפח באופן יחסי. - הוסף 3 מיליליטר MTBE לחלק מים הנותר של מדגם, ומערבולת 10 שניות לכל צינור.
- ספין ~ 200XG עבור 10 דקות בצנטריפוגה ב RT.
- לשאוב 3 מיליליטר של MTBE (בלי לקבל מים) ולשלב עם צינור MTBE.
- לרכז את השכבה המימית שנותרה על ידי ייבוש תחת N 2.
- Re-להשעות שאריות במים 100 μl.
- להוסיף 400 μl של MeOH הקר כקרח לצינור תרבות זכוכית, בקצרה המערבולת, ולאחר מכן להעביר לצינור microcentrifuge.
- עזוב ב -80 מעלות צלזיוס למשך 20-30 דקות. ספין על 0 מעלות צלזיוס במשך 15 דקות ב 18,000 X גרם.
הערה: מומלץ למקם את כל ארון תקשורת המדגם במקפיא -80 ° C כמו זה יאפשר לכל חלבון שנותר כדי לזרז במתנול. אם מקפיא -80 ° C אינו זמין, אפשרויות אחרות הן: אחסון ב -20 ° C, הצבת הדגימות על קרח יבש, או לשמור אותם בדלי קרח. חשוב לאחסן את הדגימות באופן עקבי בסביבה קרה ובאותה הטמפרטורה, כדי לאפשר למשקעים. - לשאוב 450 μl של supernatant והעברה לצינור microcentrifuge נקי. להתייבש לחלוטין ברכז צנטריפוגלי ואקום על לא יותר מ 45 ° C. (לוקח כ 1-2 שעות).
- Resuspend supernatant מיובש ב200 μl של 5% אצטוניטריל / מים. בקצרה מערבולת. להקפיא ב -80 ° C.
5. הפקה מוצק שלב
- ייבש את שבריר MTBE תחת חנקן ב35 ° C עם זרימה טובה של חנקן (לוקח בערך 10-15 דקות).
- כאשר יבש לחלוטין, לעצור את הזרימה של חנקן ובמהירות resuspend ב 1 מיליליטר כלורופורם (CHCl 3) באמצעות פיפטה זכוכית. בקצרה מערבולת.
שים לב: יש לי ממסים כגון CHCl 3 צמיגות נמוכה. במהלך pipetting, מתח פנים נמוך גורם לאובדן ממס מפיפטה. מומלץ שקצה פיפטה להיות prewet לפחות פעמיים כדי לאפשר איזון בין הממס שpipetted והחלל בפיפטה. גם מזרק גז חזק יכול לשמש אם זמין. - הגדר את סעפת ואקום SPE וNH 2 עמודות SPE לחלוקה.
- דגימות חמות לRT ותמיד לשמור מושעה תחת זרם קבוע של N 2. מתחמם לRT יאפשר resuspension שומנים בדם והחנקן יהיה למנוע חמצון ופילמור של שומנים.
- 2x מחסנית לשטוף וSPE המצב עם 400 הקסאן μl. השלך פסולת ולהחליף עם צינור איסוף זכוכית חדש.
- הוספת מדגם לעמודת SPE, לאסוף לזרום בצינורות זכוכית.
- עם פיפטה הזכוכית להוסיף 1 מיליליטר של 2:1 CHCl 3: IPA, לאסוף לזרום באותו צינורות זכוכית (זה חלק ניטרלי).
- ייבש את החלק הניטרלי תחת N 2 כדי למזער חמצון (לוקח בערך 10-15 דקות).
- עם פיפטה הזכוכית להוסיף 1 מיליליטר של 5% חומצה אצטית באתר diethyl, לאסוף לזרום בצינורות זכוכית חדשים (זה חלק חומצת שומן).
- ייבש את החלק היחסי של חומצות שומן תחת N 2 כדי למזער חמצון (לוקח בערך 10-15 דקות).
- השתמש בעצות פלסטיק להוסיף 800 &181 #; ליטר של מתנול למחסנית SPE, ולאסוף זרימה דרך ב15 צינורות חרוטי פלסטיק מיליליטר (זה חלק פוספוליפידים).
- העבר חלק פוספוליפידים 1.5 צינורות צנטריפוגה מיליליטר. ייבש את הדגימות עם רכז צנטריפוגלי ואקום ב 45 ° C (לוקח בערך 1-1.5 hr).
- Resuspend כל אחת מהדגימות משלושת שברים ב200 μl של מתנול 100%, מערבולת, והעברה לAutosampler בקבוקוני בורג יתר לאחסון.
6. לדוגמא תנאי אחסון
- אחסן את כל הדגימות ב-80 ° C עד מוכן לניתוח מכשיר.
שים לב: דגימות שחולצו, מחדש בממס אורגני יכולות להיות מאוחסנות ב -20 ° C. עם זאת זו אינה מומלצת כמטבוליטים עניינים פוטנציאליים יהיו לבזות בטמפרטורה זו. אחסון חנקן נוזלי גם אינו מומלץ כחוקרים דיווחו על בעיות זיהום, יש צורך בקבוקוני אחסון מיוחד, ויש חוסר הומוגניות בCAU קאמרילשיר תנודות טמפרטורה רחבה. - אם כרכי מדגם קטנים (<100 μl), להשתמש מוסיף בבקבוקונים כדי למנוע אידוי ממס באמיץ במהלך האחסון.
- הימנע מהפשרת הקפאה של הדגימות. הפשירו הדגימות רק פעם אחת, ממש לפני ניתוח מכשיר. הקפאה מפשירה חוזרת ונשנית לגרום להשפלה לדוגמא.
7. נוזלי תנאי כרומטוגרפיה
- השתמש 2.1 מ"מ x 50 מ"מ C-18 (1.8 מיקרומטר) עמודה אנליטית עם 2.1 מ"מ x 12.5 מ"מ C-18 (5 מיקרומטר) עמודת שומר לנתח את החלק הידרופובי.
- הגדר את טמפרטורת autosampler עד 4 מעלות צלזיוס, טמפרטורת העמודה ל60 ° C, נפח ההזרקה ל2 μl ואת קצב הזרימה ל0.25 מיליליטר / דקה.
- השתמש 0.1% חומצה פורמית במים לשלב נייד, ו0.1% חומצה פורמית בisopropanol: אצטוניטריל: מים (60:36:4) לB. שלב נייד
- הפעל את פרופיל elution השיפוע הבא: התחלt 30% B, ועלייה ל70% B בין 0 ל -1 דקות, ולאחר מכן יעלו ל 100% B 1-15 דקות וחזקות למשך 5 דקות, ואחרי 5 דקות 10% B כביסה ו5 דקות לאחר ריצה.
- השתמש 2.1 HILIC מ"מ x 50 מ"מ (2.6 מיקרומטר) עמודה אנליטית עם עמודת שומר לנתח את החלק הידרופילי.
- הגדר את טמפרטורת autosampler עד 4 מעלות צלזיוס, טמפרטורת העמודה ל20 ° C, נפח ההזרקה ל2 μl ואת קצב הזרימה ל0.5 מיליליטר / דקה.
- השתמש אצטוניטריל 50% ביצטט 10 מ"מ אמוניום, pH 5.8 לשלב נייד, ואצטוניטריל 90% ב10 pH מ"מ אמוניום אצטט 5.8 לB. שלב נייד
- הפעל את הפרופיל הבא שיפוע elution: התחל מ100% B 0-2 דקות, ולאחר מכן ירידה ל50% B 2-15 דקות, ואחרי 5 דקות 0% B כביסה ו10 דקות לאחר ריצה.
תוצאות
כל טכניקת הכנת המדגם בוצעה כפי שתוארה לעיל וההיבטים החשובים ו / או רלוונטיים ביותר מוצגים להלן. סטנדרטים פנימיים הידרופילי ו הידרופובי היו ממוסמרים לדגימות פלזמה נקוו לבצע השוואה ישירה של הסטנדרטים הפנימיים ושכיחותם מטבוליט אנדוגני בשיטות חילוץ שונות. נתוני כרומטוגרפיה ספקטרומטריית מסה נוזלית (LC-MS) נותח באמצעות תוכנה איכותית וכמותית והביאו להתאוששות והפרדה של שתי תרכובות אנדוגני והסטנדרטים פנימיים מצוינות. איור 1 מדגים את האפקטיביות של שיטת MTBE-SPE בחילוץ שני סטנדרטים שומנים בדם (א) ותרכובות אנדוגני (ב ').
בסך הכל, חילוץ וכיסוי של מטבוליטים טובים יותר התקבלו בהשוואה לשיטות אחרות, כגון מיצוי מתנול, או מיצוי 'MTBE רק' כאשר מספר oתכונות f הושוותה באמצעות תוכנה איכותית וכמותיים הבאים ניתוח LC-MS. לדוגמא, רק באמצעות מיצוי מתנול, הווריאציה לקריאטינין-D 3 הייתה 15.2%. עם זאת, עם MTBE איל, זה ירד לקורות חי 1.04%. שימוש MTBE, שחזור של שומנים ותרכובות מימיות היו <8% ו< 5% בהתאמה, בהשוואה לחילוץ מתנול פשוט שהביא לשינוי גדול יותר של 29% ו15% בהתאמה לשומנים ותרכובות מימיות. הסטנדרטים הפנימיים המשמשים לניטור החלמה שומנים בדם - טסטוסטרון-D 2, ceramide C17, 15:00 מחשב, ו17:00 PE גדל ב 26%, 200%, 100%, 400% בהתאמה בהשוואה לשימוש במתנול לבד. עליות דומות התגלו לסטנדרטי חומצת שומן פנימיים וphosphotidylcholine ומטבוליטים אנדוגני phosphotidylethanolamine. מטבוליטים אנדוגני אחרים כגון sphingosines, סרמידים, diacylglycerols, triacylglycerols, כולסטרול, וsphingomyelin היו או לא זוהושימוש במתנול או התגלו ברמות זניחות. עם זאת שומני אנדוגני אלה התגלו בקלות באמצעות מיצוי MTBE.
בניתוח שלנו השוואת פרוטוקולים סטנדרטיים, את התוצאות הבאות התקבלו: הממטרים מתנול הביאו לבד ב1,851 מטבוליטים, הממטרים מתנול אתנול נתנו 2,073 מטבוליטים, MTBE עם מיצוי נוזל נוזל נתן 3,125, וMTBE עם נוזל נוזל ומיצוי מוצק שלב התאושש 3,806 מטבוליטים. לכן גישה זו גורמת למספר רב יותר של מטבוליטים חילוץ, ככל הנראה בשל דיכוי יון מופחת ודגימות נקיות לפני LC-MS.
איור 2 מדגים את היעילות בהפרדת מטבוליטים הידרופובי למעמדות הכימית שלהם לזיהוי המטבוליט בטוח יותר. יש חפיפה מינימאלית של התרכובות שזוהו בשלושה שברי השומנים הבאים SPE. בתמיכה, איור 3 מראהההתאוששות של הסטנדרטים הפנימיים הוכחת כי istD של היו eluted בשבריר הקשורים לכיתה הכימית שלהם.
דגימות בקרת איכות משמשות כדי להעריך את האיכות של הכנת המדגם, כדי לקבוע כל תופעות אצווה כאשר ימים מרובים של ניתוח נדרשים עבור קבוצת מדגם גדולה, וכדי לפקח על שחזור מכשיר. Chromatograms נבדקים כדי לוודא שסטנדרטים ממוסמר-בהם יותר מ 90% התאוששו עם שגיאת מסה של פחות מ ± חלון זמן 3 עמודים לדקה ושמירה של פחות מ 5% ±. אם קריטריונים אלה לא ייענו, התוצאות מבוטלות ודגימות ניתוח מחודשות. במקרה של תופעות אצווה לפיה שינוי בשייר הוא ציין למנה, התוכנה לניתוח הנתונים יכול לתקן את זה. אצווה הכינו בעבר של דגימות פלזמה נקוו עבר הכנת מדגם. השברים היו אז משנה aliquoted לתוך צלוחיות autosampler ומאוחסנים ב -80 ° C לשימוש במכשיר ניטור קונדיtions לאורך כל ניתוח מדגם. טבלת 1 מציגה את התוצאות מהסטנדרטים ספייק-באלה. שבריר מצב יינון השלילי של חומצות שומן (מידע לא מוצג בטבלה) לא היה בשימוש לניתוח, כי קורות החיים% מסטנדרטי ספייק-למדגם QC היה גדולים יותר מ10%. בסיס הנתונים לחלק שכן הושלך והמכשיר נבדק ומתוחזק. טבלה 2 מראה את התוצאות ממטבוליטים אנדוגני בדגימות לאחר שלושה ימים שונים של הכנת מדגם וזריקות מכשיר בשלושה עותקים. מטבוליטים אנדוגני במדגם דגימות QC הכנה כולם לשחזור, המסמלים את כוחה של הכנת המדגם, כמו גם את שחזור זריקת המכשיר.
כאשר אינם אחריו כראוי שלבי הכנת מדגם, לעומת זאת, תוצאות לא אמינות ולא עקביות מתקבלות. איור 4 מראה את התוצאות כאשר צעד המשקעים החלבון של השיטהלא אחריו כפי שתואר. שלושה מפעילים, A, B, ו-C ביצעו את אותו הליך הכנת מדגם על דגימות פלזמה ונקווה. מפעיל, ולא pipetting את הכמות הנדרשת של supernatant לפרוטוקול הניסוי, במקום pipetted> מיליליטר 1 עבור שני שוטף עם כמה מגלול. זה הביא לא רק במספר גבוה יותר של תוצאות חיוביות שגויות לחלק זה, אבל הגדיל את ההשתנות של נתונים.
שחזור chromatographic של הנתונים ניתן לראות באיור 7. דגימות פלזמה נקוו הוכנו בשלושה עותקים בימים נפרדים באמצעות משקעים חלבון, מיצוי נוזל נוזל, ומיצוי מוצק שלב כפי שתוארו בפרוטוקול זה. כל שבריר נותח באמצעות הפרדת chromatographic המתוארת בסעיף 7 לפרוטוקול. דוגמאות לאחר מכן הוזרקו בשלושה עותקים בLC-MS להעריך שחזור הכנת מכשיר ומדגם. חפיפה עקבית זה מדגימה גם את strengה של שחזור של הכנת המדגם כאשר הכינו בשלושה ימים שונים, כמו גם את כוחה של שיטת chromatographic בהפקת תוצאות לשחזור. עלייה ברעש כימי הוא ציין למצב היינון השלילי של חלק קטן של חומצות שומן. זה עשוי להתרחש עקב מזהמים בממסי LC-MS ויכול לגרום לתוצאות metabolomic כמותית עולות בקנה אחד. לכן רק מטבוליטים שeluted לפני 9 דקות נותחו.
בעת הפעלת worklists הארוך, אובדן רגישות מכשיר והשינוי בריכוזי חיץ יכול להתרחש לאורך הזמן וכתוצאה מכך ירידה בעוצמת אות ושינוי זמן שמירה. אם הווריאציה החפיפה זמן שמירה היא פחות מ -5% ואת הווריאציה עוצמת האות היא פחות מ -10%, הנתונים עדיין בגבולות מעבדה סטנדרטיים. תוכנה לניתוח יכול לשמש גם כדי ליישר ולנרמל את הנתונים כדי לתקן את מכשיר ולהיסחף זמן שמירה. עם זאת, אם הווריאציה היא large, אז הסיבה צריכה להיות נחושה. ברגע זה הוא לתקן, יכול להיות מחדש ניתחו את הדגימות.
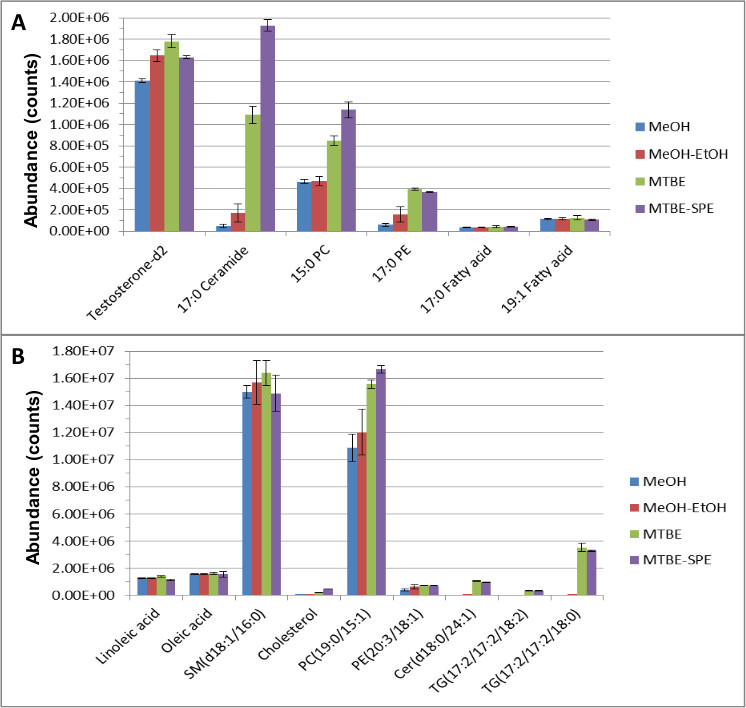
איור 1. השפע של ISTDs שומנים בדם () ומטבוליטים אנדוגני (ב ') לאחר מיצוי וכרומטוגרפיה התהפך שלב (RPC) 12. חילוץ בוצע דגימות וכתוצאה מכך הופרדו באמצעות RPC ונותח באמצעות LC-MS במצב יינון חיובי ושלילי. נתון זה שונה מיאנג ואח', כתב העת של כרומטוגרפיה 1300, 217-226 (2013).
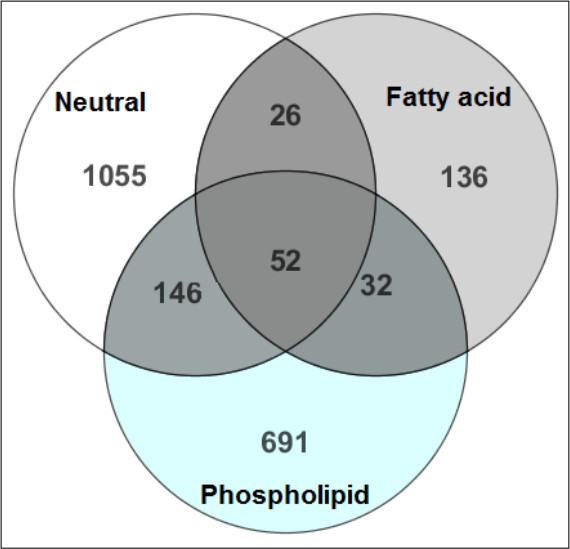
איור 2. השוואה של MTBE-SPE שברים 12. מטבוליטים שזוהו בכל frפעולה הושוו לזהות את כמות החפיפה במהלך חלק SPE של ההכנה. המספרים בדיאגרמת ון לשקף את מספר מטבוליטים שזוהו בכל חלק. חפיפה כאן קטין הוא ציין בין שלושה השברים, המייצגים את החילוץ מוצלח מתחם והפרדה ברמת המטבוליט במהלך שלב SPE. נתון זה שונה מיאנג ואח', כתב העת של כרומטוגרפיה 1300, 217-226 (2013).
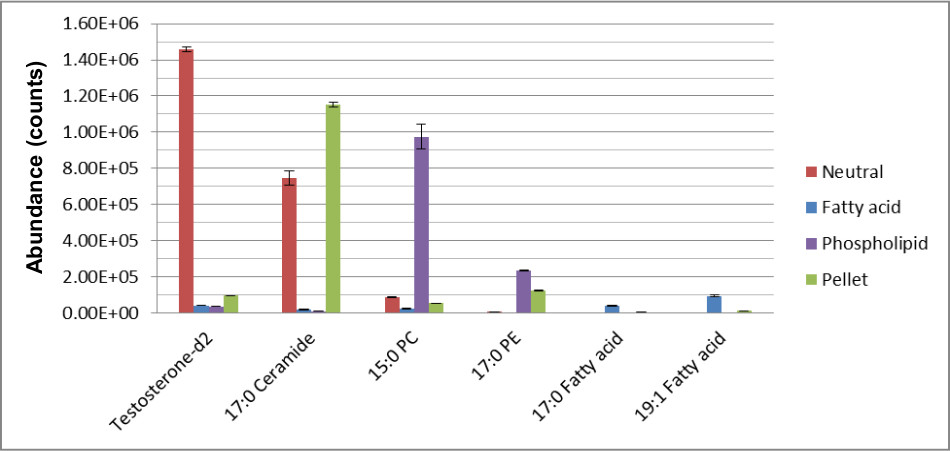
איור 3. ההתאוששות של ISTDs בשברים בשיטת MTBE-SPE 12. חילוץ בוצע דגימות וכתוצאה מכך הופרדו באמצעות RPC ונותח באמצעות LCMS במצב חיובי ושלילי כפי שמתואר בטקסט. נתון זה שונה מיאנג ואח', כתב העת של כרומטוגרפיה 1300, 217-226 (2013).
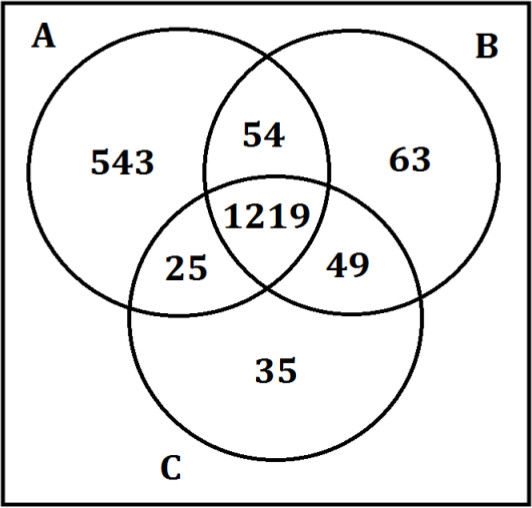
איור 4. תוצאות משבריר גלולה שהוכן על ידי שלושה מפעילים. דוגמא לשלושה מפעילי הכנה, B, ו-C ביצעו את אותו צעד הכנת חלבון בדגימות פלזמה ונקווה. המספרים בדיאגרמת ון לשקף את מספר מטבוליטים שזוהו על ידי כל מפעיל. מפעילי B ו-C pipetted הנפח הנדרש למדגם פרוטוקול ההכנה ואילו מפעיל pipetted כל supernatant וחלק של גלולה, וכתוצאה מכך על 500 יותר מטבוליטים, הרוב להיות חיובי שגויה שלשבריר ספציפי.

איור 5. כינונה של גלולה חלבון במהלך צעד משקעים חלבון <. / Strong> () של פלזמה אנושית 100 μl לפני לדגום הכנה; פלזמה (ב ') לאחר תוספת של מתנול הקרח הקר; גלולה חלבון (C) נוצרה בחלק תחתון של צינור לאחר צנטריפוגה ב 0 מעלות צלזיוס במשך 15 דקות ב 18,000 x גרם.

איור 6. הפרדת השכבות הידרופילי והידרופובי במהלך חילוץ נוזל נוזל צעד (איל). אתר האורגני מתיל ממס טרט בוטיל (MTBE) ומים שימשו להפרדת מטבוליטים הידרופילי ו הידרופובי. שכבת MTBE נמסה תרכובות לא קוטבית ושכבת המים נמסה תרכובות קוטביות () supernatant פלזמה לאחר הסרת חלבון;. פלזמה (ב ') לאחר הייבוש תחת חנקן; פלזמה (C) לאחר תוספת של MTBE; אונג> בנוסף (ד ') של מים לפלזמה ו MTBE; שכבת MTBE מים (ה) נוצרה לאחר צנטריפוגה, ההסרה (F) של שכבה העליונה MTBE; (G) בעיקר שכבה הידרופילי שנותרה לאחר הסרת MTBE.
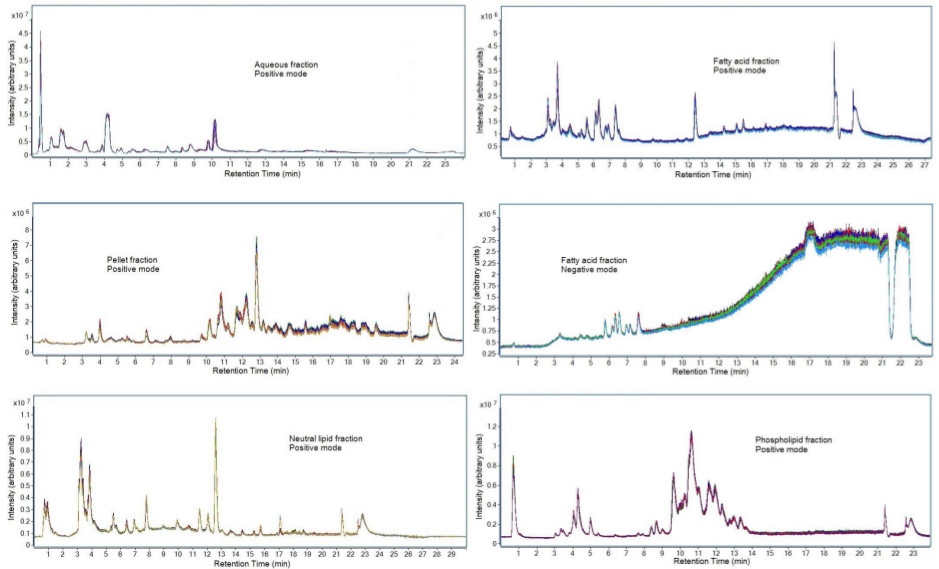
איור 7. Chromatograms של שברים מבסיס נתונים שנבחרו. להכנת דגימות בוצעו בשלוש דגימות QC הפלזמה נקוותה נפרדות וכל דגימה שהוזרק בשלושה עותקים על מכשיר LC-MS. מיוצג הם chromatograms יון הכולל של דגימות הפלזמה שנרכשו באמצעות פרמטרי LC-MS שצוינו בסעיף 7 לפרוטוקול השיטה. ייצוג chromatographic של נוזלים ביולוגיים אחרים ישתנה עקב הבדלים בהרכב המטבוליט.k "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| חלק | מצב יינון | תקן פנימי | n | אזור השיא הממוצע | קורות חיים% אזור השיא |
| מימיים | חיובי | קריאטינין-D 3 | ביום 31 | 2217311 | 3.8% |
| שומנים ניטראליים | חיובי | הטריגליצרידים-D 5 | ביום 31 | 4837032 | 9.9% |
| C17 Ceramide | ביום 31 | 12736707 | .7.9% | ||
| פוספוליפידים | חיובי | 15:00 מחשב | 32 | 1248929 | .9.3% |
| 17:00 PE | 32 | 517,234 | .7.9% |
תוצאות טבלה 1. בקרת איכות מסטנדרטים פנימיים ממוסמר. דגימות פלזמה נקוו מבסיס נתוני מודל עכבר אמפיזמה נותחו על מנת לפקח על תנאי מכשיר על בסיס יומי למחקר רב בשבוע זה. תוכנה לניתוח כמותי היה בשימוש כדי לקבוע את אזורי השיא של הסטנדרטים הפנימיים, (n = מספר זריקות QC מכשיר).
DG (16:0 / 16:1 / 0:0) .2.9%| חלק | מצב יינון | מטבוליטים אנדוגני | אזור השיא הממוצע | קורות חיים% אזור השיא |
| מימיים | חיובי | קריאטינין | 2554574 | 2.3% |
| לין | 3712151 | .3.3% | ||
| גלוקוז | 2669190 | 6.9% | ||
| שומנים ניטראליים | חיובי | 3-Dehydrosphinganine | 226,644 | .3.9% |
| 11301 | .8.2% | |||
| DG (P-14: 0/18: 1) | 364,119 | 1.9% | ||
| פוספוליפידים | חיובי | מחשב (24:0 / 0:0) | 27599 | 0.9% |
| PC16: 0/22: 6) | 2873326 | 4.5% | ||
| PI (16:0 / 18:1) | 112,998 | 4.4% | ||
| חומצת שומן | חיובי | 10-אוקסו-5 חומצה ,8-decadienoic | 1363284 | 2.3% |
| 16-אוקסו heptadecanoic חומצה | 83700 | |||
| חומצה ולריו 2-מתיל | 285,782 | 5.7% | ||
| חומצת שומן | שלילי | חומצה 10-הידרוקסי-8-octadecenoic | 10042 | 4.9% |
| -Laballenic חומצה (R) | 173,929 | 6.5% | ||
| חומצה ולריו 2-קטו | 35,488 | .6.0% |
תוצאות טבלה 2. בקרת איכות ממטבוליטים אנדוגני. דגימות פלזמה נקוו מבסיס נתוני מחלה אנושי נותחו על מנת לפקח על מדגם שחזור הכנה בימים נפרדים. דוגמאות הוכנו בשלושה עותקים בשלושה ימים, (n = 9 הכנת זריקות QC).
Discussion
אחת ממטרות מחקרי metabolomic הקליניים היא לזהות שינויים בmetabolome הקשורים למחלה או טיפולים. לכן טכניקות הכנת מדגם צריכים להיות חזק, עקבי וניתנים להעברה מטכנאי לטכנאי וממעבדה למעבדה 22. את הנתונים המתקבלים צריך להיות נציג של המדגם, ושינויים שזוהו צריכים לשקף את המדגם שנקבע ולא שגיאות הכנת מדגם. לכן pipetting מדויק, טמפרטורה נכונה, decanting יעיל של שכבות immiscible, ייבוש תחת חנקן, ושימוש באותו המותגים וגדלים של כלי זכוכית וטיפים נחוצים.
במהלך שלב המשקעים חלבון, זה קריטי, כי את אותה הכמות של פתרון יצקה מכל גלולה. הפעולה זו מפחיתה את השונות בעוצמת קול ובתור שכזו מפחיתה את השונות בנתונים לדוגמה. צעד משקעים חלבון זה הוא הכרחי ללימודי metabolomic ולא ניתן לדלג שכן הוא מסיר את החלבון מןהדגימות לפני המולקולה קטנה פרופיל ניתוח על ספקטרומטר המסה. זה מבטל פתוגנים ומקרומולקולות גדולות, ומשחרר מחויבים מטבוליטים מחלבונים 7. חוסר הצטברות חלבון בדגימות מרחיב את החיים עמודת HPLC ומגביר את הדיוק ואת איכות תוצאות. איור 5 הוא תיאור של גלולה החלבון שנוצרה בעת ביצוע טכניקה זו על דגימות פלזמה. זה מאפשר זיהוי של המולקולות קטנות, משפר שפע יון, ומפחית את השפעות מטריצה מחלבונים במדגם. בנוסף, מאחר שהנחה הוא שכל החלבונים מוסרים בשלב זה, חומצות אמינו, המתגלים במהלך ניתוח LC-MS יהיו מקורן שינויים מטבוליים ולא מפירוק חלבון.
שלב חילוץ נוזל הנוזל הוא קריטי שכן הוא מפריד בין מטבוליטים הידרופילי ו הידרופובי לשתי שכבות immiscible. איור 6 מציג את הליך האיל ונציגresentation של שכבת האיל. הפרדה לא תקינה של שתי שכבות התוצאה מטבוליטים או ללכת לאיבוד או להיות eluted בשני השברים. יישום זהיר של צעד זה מפחית את מספר התרכובות הידרופיליות המופיעות בחלק הידרופובי. התוצאות עבור התרכובות אלה הופכים בלתי אמינות שכן הוא לא ניתן לקבוע שחלק מכיל את תוצאות הנציג. כאשר נעשה בצורה נכונה, חפיפה המטבוליט מצטמצמת.
כדי למנוע השפלה חמצוני, במיוחד בשומנים, אלא גם במולקולות קטנות שיכול להכיל קבוצות תיאול לדוגמא, חשיפה לחמצן צריכה להישמר עד למינימום. לפיכך, הליך זה תמיד מבוצע תחת חנקן להפחתה / מניעת חמצון של שומנים בדם או תרכובות המכילה תיאול. בנוסף, העברת המדגם ו / או הפתרון היא מהירה (בדקה הראשונה) כדי להפחית את החשיפה לחמצן, ולאחר מכן דגימות מונחות תחת זרם יציב של חנקן במהירות להתייבש למטה. יבש פעם אחת, הם היא מידresuspended ately במתנול 100% מהסיבות שפורטו לעיל.
מעבדות יכולות להפיק תועלת משיטה מקיפה זו במספר הדרכים; חוקרים מחפשים לבודד סוג אחד של תרכובות יכולים לבחור חלק מהשיטה שמתאימה ביותר לצרכיהם. אלה המבקשים לבצע משקעים חלבון רק כדי להשיג בריכה של מטבוליטים יכולים לעשות כן. אם מטבוליטים הידרופילי הם רצויים, כגון תרופות רבות תרופות, חומצות אמינו, וסוכרים, או אם רק מטבוליטים הידרופובי הם רצויים, כגון טריגליצרידים, אפוקסים, ויטמינים מסיסים בשומן, פוספוליפידים ולמשל, אז חוקרים יכולים לבצע שאיבת נוזל הנוזל הצעד הבא משקעים חלבון וזורקים את החלק רצוי. חוקרים שדורשים סיווג משנה נוסף של התרכובות הידרופוביות (שומנים ניטראליים, חומצות שומן, פוספוליפידים ו) יכולים להמשיך לשלב חלוקה.
שיקולי חפצים חשובים בmaintaining את הכדאיות של דגימות לצורך הניתוח מאוחר יותר. אם דגימות מאוחסנות בצורה לא נכונה, השפלה או פירוק יכולה להתרחש. באופן אידיאלי, יש לאחסן דגימות בבקבוקוני ענבר כובע בורג במרחק של אור כדי למנוע השפלה של מינים רגישים לאור. צריכים גם להישמר דגימות קפואות ב -80 מעלות צלזיוס כדי למנוע השפלה המטבוליט 23-25. למרות שלא נידונו בפירוט כאן, דגימות נשמרות תמיד על 4 מעלות צלזיוס במגש autosampler במהלך ניתוח LC-MS. הדבר מבטיח כי כל הדגימות נשמרות בטמפרטורה קבועה, וכי שינויים בטמפרטורת הסביבה אינו משפיעים על הצמיגות, מסיסות, או היציבות של הדגימות. מומלץ כי ההיבטים ידניים של הליך זה, כגון איל וSPE, להיות מתורגל כדי לרכוש את אמונו ונוחות עם הצעדים מעורבים.
כמה מגבלות קיימות לטכניקה זו. הפרדה דיסקרטית של מטבוליטים הידרופובי והידרופילי אינה מובטחת כמו תרכובות מסוימות inher תהיהently לחלק לשני השברים בשל מצב ההרכב כימי ותשלום שלהם. בנוסף, כפי שמוצג באיור 4, טכניקה פסולה בשלב חילוץ גלולה חלבון יכול לגרום לשחזור המטבוליט עניים בשתי הדגימות ובקרת איכות. זה משפיע על הסטטיסטיקה, במיוחד במערכי נתונים קטנים בגלל הכוח הסטטיסטי אינו זמין. לכן זה קריטי, כי צעד זה יבוצע בדיוק באותו הזמן בכל עבור כל דגימה. מגבלה נוספת היא זמן. למרות שיש נקודות עצירה לאורך כל הפרוטוקול הזה שבו אפשר להקפיא דגימות וההכנה המשיכה ביום שלמחרת, יש לקבוע יום שלם הצידה כדי לבצע הליך זה. שלישית, לא כל מתחם בתוך מדגם ביולוגי ניתן להעריך לדיכוי יון. מאחר שלא ניתן לזהות כיצד המטריצה משפיעה על כל המטבוליט בודד, האפשרות הנוכחית היא להעריך את הסטנדרטים הפנימיים אשר באופן תיאורטי לחקות כמה סוגים של endogenouמטבוליטים של. לבסוף, לא ניתן לבצע זיהוי מוחלט אך ורק בשיטה זו. טנדם MS בשיתוף עם חיפושים במאגר נתונים ותקנים הנדרשים לזיהוי המטבוליט מוחלט.
חלק חשוב של metabolomics הוא זיהוי של תרכובות. למרות שלא נידון בפירוט כאן, דגימות בקרת האיכות נותחו באמצעות LC-MS. כדורי סרק מרובים מדגם הכנה ואת החסר מכשיר הוכנו לשימוש כרקע חיסור כדי להפחית את השיעור של תוצאות חיוביות שגויות ממזהמים, ובכך וכתוצאה מלהיטי המטבוליט אמינים יותר. בעקבות צעד זה, מספר "תכונות מולקולריות" קובצו יחד על בסיס מ '/ z, זמן שמירה, יחס איזוטופ, וadducts לייצר רשימה של תרכובות בפועל. למרות שהרשימה של תרכובות הייתה פחותה בהרבה, התוצאות היו אמינות יותר כפי שהם אינם מבוססים על adducts מרובה מאותו המתחם. השיטה המלאה היא מקיפה ומאפשרת isolation של מטבוליטים הידרופובי כגון שומנים ניטראליים, פוספוליפידים, חומצות שומן, טריגליצרידים, וסטרואידים, אך גם בידוד כיתות הידרופילי בחלק המימית, מתוכם eicosanoids, סוכרים, פלבנואידים, וחומצות אמינו זוהו 12, 26.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
ההדרכה שהוצגה בוצעה ופותחה בתוך מתקן Core ספקטרומטריית המסה בבית הלאומי יהודית הבריאות. מתקן NJH MS נתמך בחלקו על ידי CCSTI UL1 TR000154. מימון ממענקי NIH P20 HL-113445 וR01 HL-095,432 נתמכים גם על עבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Fisher Scientific | A955-4 | |
| Methanol | Fisher Scientific | L-6815 | |
| Chloroform | Fisher Scientific | C606-1 | |
| Hexane | Sigma Aldrich | 34859 | |
| Acetic acid | Sigma Aldrich | 49199-50ML-F | |
| Methyl tert-butyl ether | J.T. Baker | 9042-03 | |
| Isopropyl alcohol | Sigma Aldrich | 34965-2.5L | |
| Water | Honeywell Burdick Jackson | 365-4 | |
| OA-SYS heating system | Organomation Associates, Inc | Used to keep samples under a constant flow of nitrogen while at 35 °C | |
| 12-position vacuum manifold | Phenomenex | ||
| Strata NH2 (55 µM, 70Å) 100 mg/ml SPE cartridges | Phenomenex | 8B-S009-EAK | |
| Glass pipette tips | Fisher Scientific | 13-678-20C | Used to transfer sample to SPE column |
| Plastic pipette tips | USA Scientific | 1182-1830 | Used when glass tips are not necessary |
| Microcentrifuge tubes | Fisher Scientific | 02-681-320 | |
| Graduated glass pipets | Fisher Scientific | 13-678-27B | Used to transfer organic solvents during sample prep |
| Pyrex glass culture tubes | Corning Incorporated | 99499-16X | Used to store aqueous and lipid fractions until the next step |
| Autosampler vials | Agilent Technologies | 5182-0545 | |
| Snap cap vials for autosampler vials | Agilent Technologies | 5182-0541 | |
| Glass inserts | Agilent Technologies | 5183-2085 | Used for small sample volumes |
| Mass Hunter Qualitative Analysis software | Agilent Technologies | Version B.06.00 | Used to monitor retention times and pressure curves |
| Mass Hunter Quantitative Analysis software | Agilent Technologies | Version B.05.02 | Used to analyze quality control and sample data |
| Mass Profiler Professional software | Agilent Technologies | Version B.12.50 | Used to determine statistics, fold changes, and perform metabolite identification |
References
- Beckonert, O., et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nature Protocols. 2, 2692-2703 (2007).
- Clarke, C. J., Haselden, J. N. Metabolic Profiling as a Tool for Understanding Mechanisms of Toxicity. Toxicologic Pathology. 36, 140-147 (2008).
- Wang, X., Zhang, A., Sun, H. Power of Metabolomics in Diagnosis and Biomarker Discovery of Hepatocellular Carcinoma. Hepatology. 57, 2072-2077 (2013).
- Collino, S., Martin, F. -. P. J., Kochhar, S., Rezzi, S. Monitoring Healthy Metabolic Trajectories with Nutritional Metabonomics. Nutrients. 1, 101-110 (2009).
- Cevallos-Cevallos, J. M., Reyes-De-Corcuera, J. I., Etxeberria, E., Danyluk, M. D., Rodrick, G. E. Metabolomic analysis in food science: a review. Trends in Food Scienc., & Technology. 20, 557-566 (2009).
- Nicholson, J. K., Connelly, J., Lindon, J. C., Holmes, E. Metabonomics: a platform for studying drug toxicity and gene function. Nature reviews. Drug Discovery. 1, 153-161 (2002).
- Wishart, D., et al. . Metabolome Analysis: An Introduction. , 253-288 (2006).
- Vuckovic, D. Current trends and challenges in sample preparation for global metabolomics using liquid chromatography–mass spectrometry. Analytical and Bioanalytical Chemistry. 403, 1523-1548 (2012).
- Bollard, M. E., Stanley, E. G., Lindon, J. C., Nicholson, J. K., Holmes, E. NMR-based metabonomic approaches for evaluating physiological influences on biofluid composition. NMR in Biomedicine. 18, 143-162 (2005).
- Dong, M. W. . Modern HPLC for Practicing Scientists. , (2006).
- Want, E. J., et al. Solvent-dependent metabolite distribution, clustering, and protein extraction for serum profiling with mass spectrometry. Analytical Chemistry. 78, 743-752 (2006).
- Yang, Y., et al. New sample preparation approach for mass spectrometry-based profiling of plasma results in improved coverage of metabolome. Journal of Chromatography A. 1300, 217-226 (2013).
- Folch, J., Lees, M., Stanley, G. H. S. A simple method for the isolation and purification of total lipides from animal tissues. The Journal of Biological Chemistry. 226, 497-509 (1957).
- Matyash, V., Liebisch, G., Kurzchalia, T. V., Shevchenko, A., Schwudke, D. Lipid extraction by methyl-tert-butyl ether for high-throughput lipidomics. Journal of Lipid Research. 49, 1137-1146 (2008).
- Bligh, E. G., Dyer, W. J. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology. 37, 911-917 (1957).
- Ferreiro-Vera, C., Priego-Capote, F., Luque de Castro, M. D. Comparison of sample preparation approaches for phospholipids profiling in human serum by liquid chromatography–tandem mass spectrometry. Journal of Chromatography A. 1240, 21-28 (2012).
- Michopoulos, F., Lai, L., Gika, H., Theodoridis, G., Wilson, I. UPLC-MS-Based Analysis of Human Plasma for Metabonomics Using Solvent Precipitation or Solid Phase Extraction. Journal of Proteome Research. 8, 2114-2121 (2009).
- Kerns, E. H., Di, L. . Drug-like Properties: Concepts, Structure Design and Methods: from ADME to toxicity optimization. First edn. , (2008).
- Manach, C., Scalbert, A., Morand, C., Rémésy, C., Jiménez, L. Polyphenols: food sources and bioavailability. American Journal of Clinical Nutrition. 79, 727-747 (2004).
- Weimer, J. M., Kriscenski-Perry, E., Elshatory, Y., Pearce, D. A. The neuronal ceroid lipofuscinoses. Mutations in different proteins result in similar disease. NeuroMolecular Medicine. 1, 111-124 (2002).
- Schulze, H., Sandhoff, K. Lysosomal lipid storage diseases. Cold Spring Harbor Perspectives in Biology. 3, (2011).
- Kuhn, E., et al. Interlaboratory evaluation of automated, multiplexed peptide immunoaffinity enrichment coupled to multiple reaction monitoring mass spectrometry for quantifying proteins in plasma. Molecular and Cellular Proteomics. 11, (2012).
- Rist, M. J., et al. Influence of Freezing and Storage Procedure on Human Urine Samples in NMR-Based Metabolomics. Metabolites. 3, 243-258 (2013).
- Boomsma, F., Alberts, G., van Eijk, L., Manin‘t Veld, A. J., Schalekamp, M. A. Optimal Collection and Storage Conditions for Catecholamine Measurements in Human Plasma and Urine. Clinical Chemistry. 39, 2503-2508 (1993).
- Wood, J. T., et al. Comprehensive profiling of the human circulating endocannabinoid metabolome: clinical sampling and sample storage parameters. Clinical Chemistry and Laboratory. 46, 1289-1295 (2008).
- Bahr, T. M., et al. Peripheral blood mononuclear cell gene expression in chronic obstructive pulmonary disease. American Journal of Respiratory Cell and Molecular Biology. 49, 316-323 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved