Method Article
Multivelocidad Técnica Preparación recuperar múltiples clases de compuestos de metabolitos para en profundidad y análisis de Metabolómica Informativo
En este artículo
Resumen
La fiabilidad de los resultados en experimentos metabolómica depende de la eficacia y reproducibilidad de la preparación de la muestra. Se describe un método riguroso y en profundidad que permite la extracción de metabolitos a partir de fluidos biológicos con la opción de analizar posteriormente hasta miles de compuestos, o sólo las clases de compuestos de interés.
Resumen
La metabolómica es un campo emergente que permite perfiles de muestras de organismos vivos con el fin de obtener información sobre los procesos biológicos. Un aspecto vital de la metabolómica es la preparación de muestras mediante el cual las técnicas inconsistentes generan resultados poco fiables. Esta técnica abarca la precipitación de proteínas, extracción líquido-líquido, y extracción en fase sólida como un medio de fraccionamiento de metabolitos en cuatro clases distintas. Se obtiene Mejora enriquecimiento de moléculas de baja abundancia con un incremento resultante de la sensibilidad, y en última instancia se traduce en la identificación de moléculas con más confianza. Esta técnica se ha aplicado a plasma, fluido de lavado broncoalveolar, y muestras de líquido cefalorraquídeo con volúmenes tan bajas como 50 l. Las muestras se pueden utilizar para múltiples aplicaciones posteriores; Por ejemplo, el sedimento resultante de la precipitación de proteínas se puede almacenar para su posterior análisis. El sobrenadante de este paso se somete a extracción líquido-líquido utilizandoagua y disolvente orgánico fuerte para separar los compuestos hidrófilos e hidrófobos. Una vez fraccionado, la capa hidrófila puede ser procesada para el análisis posterior o se descarta si no es necesario. La fracción hidrófoba se trata adicionalmente con una serie de disolventes durante tres etapas de extracción en fase sólida para separar en ácidos grasos, lípidos neutros y fosfolípidos. Esto permite que el técnico de la flexibilidad de elegir la que se prefiere clase de compuestos para su análisis. También ayuda en la identificación de metabolitos más fiable, ya un cierto conocimiento de que existe la clase química.
Introducción
Las reacciones biológicas generan metabolitos como productos finales de los procesos celulares. Metabolómica es una colección de todos los compuestos presentes en un organismo como resultado de estos procesos. Proporciona una imagen de la fisiología de las células y refleja la respuesta de un organismo a estímulos externos o internos 1, 2. Tales estímulos pueden ser ambientales, toxicológicos, farmacológicos, dietéticos, hormonales, o relacionados con la enfermedad. Muchas aplicaciones de metabolómica tienen y están siendo estudiados por los investigadores e incluyen el descubrimiento de biomarcadores 3, 4 estudios de nutrición, ciencia de los alimentos 5, y las pruebas de drogas 6. Independientemente de la aplicación, las variaciones en los datos, la contaminación, y la presencia de falsos positivos necesitan ser reducido o preferiblemente eliminado. En el descubrimiento de biomarcadores o en el caso de la determinación de las diferencias entre un control y un grupo de enfermedad, o investigación de los efectos de los fármacos sobre los sujetos, un f biológicaluid se elige sobre la base de las preguntas que se hacen y los tipos de metabolitos siendo investigado 7. Por ejemplo, si el estudio de los efectos inmediatos de un fármaco inhalado en los pulmones de los asmáticos, a continuación, la exploración de metabolitos en el líquido de lavado broncoalveolar (BALF) muestras antes y después de la administración sería preferencial. Para garantizar que las diferencias observadas son debidas a la variación biológica real en lugar de la técnica de preparación de la muestra inadecuada, protocolo de laboratorio normalizado y coherente es esencial 8. Información de la muestra debe ser cuidadosamente documentado para asegurar que las variables tales como fluido biológico, la cepa animal, tiempo de muestreo, la edad del sujeto, de género, por nombrar unos pocos, son todos considerados y en cuenta en el estudio 9. Además, para reducir la posibilidad de contaminación o falsos positivos, se recomienda que los espacios en blanco de disolvente y espacios en blanco del instrumento se analizaron 10.
Para este protocolo, el término "metabolismolites "se utiliza para referirse a los compuestos reales identificados. El uso de software de proveedores, un algoritmo de pico inicial hallazgo se utiliza para detectar los picos del espectro de masas. Estos picos se alinean sobre la base de (m / z) Relación y la retención de masa a carga del tiempo. Un segundo algoritmo se utiliza entonces para combinar múltiples características en un solo compuesto. Esta incluye características tales como sodio, potasio, o aductos de amonio en el modo de ionización positiva, y cloruro en el modo de ion negativo. Las opciones adicionales en el software incluyen características tales como dímeros y otros aductos. El uso de la glucosa como ejemplo, con picos a 181.0707 m / z (M + H), 198,0972 m / z (M + NH4), y 203,05261 m / z (M + Na), habría tres picos correspondientes a la misma compuesto usando el primer algoritmo. Sin embargo, cuando el segundo algoritmo, que se basa en fórmula molecular, se aplica estos tres aductos se convierten agrupado resultante en un compuesto.
Los metabolitos pueden causar interferencias en sampLes debido a la complejidad de los compuestos presentes. La presencia de miles de metabolitos en una muestra de la señal de supresión de causas en particular de los metabolitos de menor abundancia. La limpieza de la muestra para eliminar la interferencia de proteínas, y la posterior separación en fracciones múltiples reduce la complejidad de la muestra mejorando de este modo la separación de pico, el aumento de resolución, y la reducción de la elución simultánea metabolito. Por lo tanto, se requiere la limpieza de la muestra y una mejor separación de los compuestos. Se ha demostrado que la precipitación de la proteína por sí sola, incluso con el uso de diversos disolventes de polaridad, no puede resolver este problema 11, 12. Sin embargo, mediante la combinación de un disolvente orgánico fuerte, tal como el MTBE con una etapa de fraccionamiento posterior, se aumenta la cobertura de metabolito. Yang et al. 12 reportaron un aumento de metabolitos de 1851 o 2073 con metanol o precipitación de metanol-etanol por sí sola, respectivamente, a 3.806 metabolitos mediante extracción con disolventes MTBE combinadoseguido de la extracción en fase sólida (SPE) pasos. Reducción de la superposición metabolito, la mejora de la separación máxima y mayor abundancia de metabolitos se observó con este método.
La contaminación de los no-metabolitos, tales como polímeros, puede ser resultado de la recogida de muestras, disolventes, o el ruido del instrumento, y puede resultar en supresión de la señal de metabolitos potencialmente significativos. Se recomienda que el técnico (s) y los que recogen las muestras antes de la preparación de la muestra utiliza constantemente la misma marca, tipo y tamaño de los frascos de recogida de muestras, puntas de pipetas y otros tubos utilizados durante la recolección y preparación de las muestras. Esto permite que el analista de datos para tener plena confianza de que los cambios observados son reales y no debido a las diferencias de fondo procedentes de otras fuentes. La efectividad del tratamiento, las variaciones entre las enfermedades y grupos de control, o cualquier otro análisis metabólicos pueden ser investigados con mayor confianza.
La metanfetaminaod discutido aquí se centra en los métodos de preparación de muestras combinadas de 13-15 que se pueden aplicar a la del plasma, BALF o líquido cefalorraquídeo (LCR) para las muestras de perfiles metabolómicos no dirigido por espectrometría de cromatografía-masa líquida (LCMS) análisis basado. Tanto la cromatografía líquida (LC) y la cromatografía líquida de ultra-desempeño (UPLC) técnicas de separación se pueden acoplar a MS después de este procedimiento. Muchos investigadores que realizan estudios metabolómicos utilizan ya sea una técnica de precipitación de proteínas y / o una técnica de extracción líquido-líquido 16, 17. En nuestros estudios, esto se tradujo en un menor número de metabolitos que se detectan. El método descrito aquí 12 permite la detección e identificación de un mayor número de metabolitos, que cubre una gama más amplia de la metaboloma. Este aumento se debe a la mayor pureza de las muestras y los efectos de matriz reducidos causados por la separación previa de las clases de metabolitos.
Un prot inicialetapa de precipitación ein se realiza usando metanol frío (MeOH) para eliminar la proteína de la muestra. Extracción líquido-líquido (LLE) utilizando metil terc-butil éter (MTBE) y el agua se utiliza para separar los compuestos hidrófilos e hidrófobos. Entonces extracción en fase sólida (SPE) se realiza en la capa hidrófoba para separar los compuestos hidrófobos en tres clases - ácidos grasos, lípidos neutros y fosfolípidos. Las fracciones hidrófobas se reconstituyen en metanol al 100%, mientras que la fracción hidrófila se reconstituye en acetonitrilo 5% en agua. La extracción (SPE) paso de fase sólida proporciona un nivel adicional de confianza en los resultados al reducir el número de compuestos coeluyentes que de otro modo estar presente no había una etapa de separación se lleva a cabo.
Protocolo
1. Consideraciones Iniciales, Preparación de instrumentos y normas
- Utilice siempre el vidrio para almacenar (tubos de cultivo de vidrio, frascos para muestreador automático de vidrio) o transferir (pipetas de vidrio) lípidos y disolventes orgánicos.
- Minimizar la exposición de todas las muestras de lípidos y estándares en abierto. Politetrafluoroetileno Seal (PTFE) tapas herméticamente para evitar la exposición al aire y la evaporación. Resuspender Inmediatamente lípidos secos en la próxima disolvente o mantenerlos en un flujo constante de nitrógeno.
- Utilice 100 l de muestra. En los casos en que más (o menos) de la muestra está disponible, ajustar los volúmenes en consecuencia. Sin embargo durante el fraccionamiento de lípidos en la columna de la NH 2 SPE, declaró volúmenes deben permanecer tal como se indica.
- Encienda centrífuga y se pone a 0 ° C antes del inicio de la preparación de muestras.
- Esta técnica utiliza muchos solventes volátiles a fin de mantener todos los disolventes tapados durante la preparación de la muestra.
- Prepare dos tipos de normas por recomendación.
- Preparar un control negativo compuesto de pinchos-en todas las normas a una concentración constante. Esto se disparó en todas las muestras, así como un grupo de muestras que se utiliza como un lote de control de calidad (muestra combinada de pinchos se utiliza para controlar la preparación de muestras reproducibilidad en días separados) y el instrumento de control de calidad (enriquecida prepararon muestras mezcladas previamente, sub-dividen en partes alícuotas, y se utilizan para monitorear instrumentos condiciones / fluctuaciones durante el análisis y en días distintos).
- Preparar controles positivos a 1x, 2x, 4x y picos estándar. Los controles positivos se añaden a todas las muestras, así como una muestra de plasma reunido y se utilizan como compuestos de control de calidad, tanto para los pasos de preparación de muestras y pasos de análisis fundamental para analizar e identificar las diferencias de cambio de veces durante el análisis de datos para asegurar que todos los aspectos de la preparación y análisis instrumental se realizaron correctamente.
- Normas Almacenar a -20 ° C y almacenar las muestras a -80 ° C. Cierta soporte internoestándares que son propensas a la degradación tras el almacenamiento a largo plazo deben ser almacenados a -80 ° C.
- Este procedimiento requiere el uso de disolventes peligrosos, inflamables o volátiles tales como MTBE. Realice todos los pasos en una campana de humos.
2. Normas internos
- Elija normas internas (ISTD) sobre la base de proyectos individuales y su diseño experimental específico. Para biofluidos tales como el plasma, BALF, o en la orina, istDS marcados isotópicamente, que son de naturaleza similar a las que se encuentran biológicamente en estas muestras sería ideal. Estos incluyen pero no se limitan a aminoácidos, hormonas o lípidos. Para las muestras de metabolómica de plantas, se podrían utilizar los estándares etiquetados como los flavonoides, o carotenoides. Lo mismo sucede con otros estudios metabolómicos mediante el cual el investigador debe elegir un estándar interno que es representativo del tipo de muestra que se está analizando.
- Asegúrese de que el ISTD elegido cubre una amplia gama de cromatograma; por ejemplo, si tque el tiempo de adquisición es de 20 minutos, las normas que eluyen cada 5 min se podrían utilizar.
- Crear soluciones madre hidrófilos a 2 mg / ml usando una variedad de estándares marcados isotópicamente y / u otros compuestos polares que son exógenos a la muestra que se está analizando. De cada solución madre, crear una solución en metanol: agua 1:1 con todas las normas a una concentración final de 25 mg / ml de creatinina-D 3, 100 g / ml de lisina-D 4, y 200 mg / ml de valina-D 8 .
- Crear soluciones madre hidrófobos usando una variedad de estándares marcados isotópicamente y / u otros compuestos no polares que son exógenos a la muestra que se está analizando; concentraciones del stock de ácido graso 17:00 (4 mg / ml), ácido graso 19:01 (4 mg / ml), 17:00 ceramida (2 mg / ml), 17:00 PE (1,75 mg / ml), 15 : 0 PC (2 mg / ml), y la testosterona-D 2 (1 mg / ml). De cada población, crear una solución en cloroformo: metanol 1:1 con todas las normas a una concentración final de 50g / ml 17:00 ceramida, 100 mg / ml 15:00 PC, 100 g / ml de testosterona-D 2, ml de ácido graso 200 g / 17:00, / ml de ácido 200 g 19:01 graso, y 200 g / ml 17:00 PE en la mezcla estándar.
- Pruebe el grado de ionización de cada estándar antes de tiempo el uso de al menos cinco concentraciones diferentes para cada estándar para determinar el límite de detección y la linealidad del instrumento para estos compuestos. La concentración de la solución madre para cada norma individual variará dependiendo del diseño experimental, y la concentración de cada estándar en el estándar de pinchos combinado puede variar de 20 mg / ml a 2 mg / ml dependiendo de lo bien que se ionizan.
- Crea una mezcla pico de controles positivos y añadirlos a las muestras a 1x, 2x, 4x o niveles de concentración para controlar cuantitativamente la concentración de la preparación de la muestra y la exactitud de los datos instrumentales. La concentración final de los controles positivos puedenser: 2 mg / ml de D-glucosa, 100 g / ml alanina-D 3, 200 g / ml de ácido D-metilmalónico 3, 20 g / ml de triglicéridos-D 5, y / o otras normas hidrófobos e hidrófilos. Ajustar las concentraciones estándar basados en la sensibilidad de la instrumentación de MS y HPLC utilizado para el análisis.
3. Precipitación de Proteínas
- Descongelar las muestras a temperatura ambiente y Spike 10 l de ISTD a cada muestra como se describe a continuación.
- Pico de 10 l de las dos soluciones estándar hidrófilos e hidrófobos (creados a partir de la acción en los pasos 2.3 y 2.4) a cada muestra. Ajuste las concentraciones estándar según sea necesario basándose en la sensibilidad de la instrumentación de MS y HPLC utilizado para el análisis
- Pico 10 l de cualquiera de 1x, 2x, o solución de control positivo 4x (creado a partir de la población en el paso 2.6) a cada muestra. Ajuste las concentraciones estándar según sea necesario basándose en la sensibilidad de la MS y HPLC instrumentación usada para el análisis
- Vortex cada muestra durante 10 s antes de la etapa de precipitación de proteínas
- Añadir 400 l de metanol enfriado con hielo (almacenado a -20 ° C) a cada muestra.
- Vortex durante 10 segundos por tubo.
- Centrifugar a 0 ° C durante 15 min a 18.000 x g.
- Transferir todo el sobrenadante a un nuevo tubo de cultivo de vidrio, y luego seca bajo N2.
- Si el análisis de la fracción de proteína de pellets, continúe con los pasos 3.8 a 3.11. Si no es el análisis de la proteína de pellets, vaya a la Sección 4.
Nota: La proteína de pellets puede contener compuestos con alta hidrofobicidad que serían útiles cuando se realizan los estudios de drogas 18, comida analiza la participación de los flavonoides hidrofóbicas 19 o estudios metabolómicos relacionados con enfermedades en las que los compuestos muy hidrófobos se acumulan, como neuronales ceroides-lipofuscinosis 20 y el almacenamiento de lípidos lisosomal enfermedades 21. - Añadir 1 ml de MTBE a la tque el blanco (o blanco) proteína de pellets, vortex durante 30 segundos por tubo y centrifugar a 0 ° C durante 15 minutos a 18.000 x g. Decantar la capa de MTBE a un nuevo tubo de cultivo de vidrio.
Este es un paso crítico como errores aquí afectarán drásticamente los resultados (véase la Figura 5 en resultados representativos).- Consistentemente aspirar la misma cantidad de MTBE para todas las muestras ya que el tamaño de la pastilla variará entre las muestras. Por lo tanto, si sólo 900 l se puede decantar para la muestra con la menor cantidad de sobrenadante, a continuación decantar 900 l para todas las muestras.
- Repita el paso 3.9, y combinar la capa orgánica con el mismo tubo de cultivo de vidrio preparada en el paso 3.7.
- Las muestras secas por un flujo de N2 y resuspender en 200 l de cloroformo: metanol 1:1. Brevemente Vortex.
- Transferir a un tubo de centrífuga. Centrifugar a 0 ° C durante 15 minutos a 18.000 xg, a continuación, transferir el sobrenadante a viales del muestreador automático con tapón de rosca con vidriopipetas.
4. Extracción líquido-líquido
- Con una pipeta de vidrio, añadir 3 ml de MTBE al metanol secado residual (de la sección 3, paso 6) y agitar 30 segundos, añadir 750 l de agua, luego vortex 10 seg por tubo.
- Girar ~ 200 xg durante 10 min en una centrífuga a TA.
- Aspirar 2,5 ml de la capa de MTBE (sin conseguir agua) y transferir a un tubo de cultivo de vidrio limpio.
Nota: Este es un paso crítico como diferencias aquí afectarán a los resultados. 2,5 ml de MTBE debe ser cuidadosamente decantó de la capa superior, ya que permite un volumen fijo que se decanta sin pipeteando la capa acuosa a continuación. Si el volumen de la muestra en el comienzo del experimento era menos de los indicados 100 l para este método, escala el volumen de MTBE para reflejar proporcionalmente este volumen de la muestra de partida. - Añadir 3 ml de MTBE a la parte del agua restante de la muestra, y agitar 10 segundos por tubo.
- Girar ~ 200xg durante 10 min en la centrífuga a TA.
- Aspirar 3 ml de MTBE (sin que le entre agua) y se combinan con el tubo de MTBE.
- Se concentra la capa acuosa restante por secado bajo N 2.
- Vuelva a suspender los residuos en 100 l de agua.
- Añadir 400 l de hielo MeOH frío al tubo de cultivo de cristal, agitar brevemente, y luego se transfieren a tubos de microcentrífuga.
- Deja a -80 ° C durante 20-30 min. Giran a 0 ° C durante 15 min a 18.000 x g.
Nota: Se recomienda colocar la totalidad del soporte de muestras en un congelador de -80 ° C, ya que esto permitirá que cualquier proteína restante se precipite en el metanol. Si un -80 ° C congelador no está disponible, hay otras opciones: almacenar a -20 ° C, colocando las muestras en hielo seco, o mantenerlos en un cubo de hielo. Es importante para almacenar consistentemente las muestras en un ambiente frío y a la misma temperatura para permitir la precipitación. - Aspirar 450 l de sobrenadante y la transferencia aun tubo de microcentrífuga limpio. Secar completamente en un concentrador de centrífuga de vacío a no más de 45 ° C. (Tarda cerca de 1-2 horas).
- Resuspender sobrenadante seco en 200 l de 5% de acetonitrilo / agua. Brevemente Vortex. Congelar a -80 ° C.
5. Extracción en fase sólida
- Secar la fracción MTBE en nitrógeno a 35 ° C con un buen flujo de nitrógeno (se tarda unos 10-15 minutos).
- Cuando está completamente seco, detener el flujo de nitrógeno y rápidamente resuspender en 1 ml de cloroformo (CHCl3) usando una pipeta de vidrio. Brevemente Vortex.
Nota: Los solventes como CHCl3 tienen baja viscosidad. Durante pipeteo, baja tensión superficial provoca la pérdida de disolvente de la pipeta. Se recomienda que la punta de la pipeta se prehumedecido al menos dos veces para permitir el equilibrio entre el disolvente se pipeteó y el espacio en la pipeta. Una jeringa hermética a los gases también se puede utilizar si está disponible. - Establecer un colector de vacío SPE y NH 2 columnas SPE para el fraccionamiento.
- Muestras calentar a TA y siempre siguen suspendidas bajo un flujo constante de N2. El calentamiento hasta la temperatura ambiente permitirá resuspensión de lípidos y el nitrógeno evitará la oxidación y polimerización de los lípidos.
- Lava y acondiciona el SPE 2x cartucho con 400 l de hexano. Deseche los residuos y reemplazar con el nuevo tubo de recogida de vidrio.
- Añadir la muestra a la columna SPE, recoge el flujo a través de tubos de vidrio.
- Con una pipeta de vidrio añadir 1 ml de 02:01 CHCl3: IPA, recoge el flujo a través de tubos de vidrio mismas (esta es la fracción neutra).
- Secar la fracción neutra en N2 para minimizar la oxidación (se tarda unos 10-15 minutos).
- Con una pipeta de vidrio añadir 1 ml de ácido acético al 5% en éter dietílico, recoger el flujo a través de los nuevos tubos de vidrio (esta es la fracción de ácido graso).
- Secar la fracción de ácidos grasos en N2 para minimizar la oxidación (se tarda unos 10-15 minutos).
- Utilice puntas de plástico para agregar 800 &# 181; l de metanol al cartucho SPE, y recoger de flujo a través en 15 tubos cónicos de plástico ml (esta es la fracción de fosfolípidos).
- Traslado fracción de fosfolípidos de 1,5 ml tubos de centrífuga. Secar las muestras con un concentrador centrífugo vacío a 45 º C (se tarda aproximadamente 1 a 1,5 h).
- Resuspender cada una de las muestras de las tres fracciones en 200 l de metanol al 100%, vórtice, y traslado al muestreador automático viales con tapón de rosca para el almacenamiento.
6. Ejemplo de Condiciones de almacenamiento
- Guarde todas las muestras a -80 ° C hasta que esté listo para el análisis de instrumentos.
Nota: Las muestras extraídas, reconstituida en disolvente orgánico se pueden almacenar a -20 ° C. Sin embargo, esto no se recomienda como posibles metabolitos de interés se degradarán a esta temperatura. Tampoco se recomienda el almacenamiento de nitrógeno líquido como investigadores han informado de problemas de contaminación, se necesitan frascos especiales de conservación, y hay una falta de homogeneidad en la cau cámaracantar amplias fluctuaciones de temperatura. - Si los volúmenes de las muestras son pequeños (<100 l), usar insertos en los viales para evitar la evaporación de disolvente en el espacio de cabeza durante el almacenamiento.
- Evite congelar y descongelar las muestras. Descongele las muestras sólo una vez, justo antes de que el análisis de instrumentos. Congelamientos deshielos repetidos resultan en la degradación de la muestra.
7. Condiciones de cromatografía de líquidos
- Utilice un C-18 de 2,1 mm x 50 mm (1,8 micras) con una columna analítica C-18 2,1 mm x 12,5 mm columna de seguridad (5 m) para analizar la fracción hidrofóbica.
- Ajuste la temperatura del inyector automático a 4 ° C, la temperatura de la columna a 60 ° C, el volumen de inyección de 2 l y la tasa de flujo de 0,25 ml / min.
- Use 0,1% de ácido fórmico en agua durante la fase móvil A y 0,1% de ácido fórmico en isopropanol: acetonitrilo: agua (60:36:4) para la fase móvil B.
- Ejecute el siguiente perfil de elución de gradiente: Inicie unt 30% de B, y el aumento al 70% de B de 0 a 1 min, luego aumentar a 100% B de 1 a 15 minutos y se mantienen durante 5 minutos, seguido de 5 min 10% lavado B y 5 después de la carrera min.
- Utilice un HILIC 2,1 mm x 50 mm (2,6 micras) columna analítica con una columna de seguridad para analizar la fracción hidrófila.
- Ajuste la temperatura del inyector automático a 4 ° C, la temperatura de la columna a 20 ° C, el volumen de inyección de 2 l y la tasa de flujo de 0,5 ml / min.
- Utilice 50% de acetonitrilo en acetato de amonio 10 mM, pH 5,8 para la fase móvil A y acetonitrilo al 90% en 10 mM de acetato de amonio pH 5.8 para la fase móvil B.
- Ejecutar el siguiente perfil de elución en gradiente: Inicio a 100% de B de 0 a 2 min, luego disminuir a 50% de B de 2 a 15 min, seguido de 5 min 0% de lavado B y 10 después de la ejecución min.
Resultados
Toda la técnica de preparación de la muestra se realizó como se ha descrito anteriormente y los aspectos más importantes y / o relevantes se presentan a continuación. Normas internas hidrófilas e hidrófobas se enriquecieron en las muestras de plasma agrupados para realizar comparaciones directas de las normas internas y las abundancias de metabolitos endógenos usando varios métodos de extracción. Datos de espectrometría de cromatografía de líquido-de masas (LC-MS) se analizó usando el software cualitativa y cuantitativa y dio como resultado una excelente recuperación y separación de ambos los compuestos endógenos y estándares internos. Figura 1 demuestra la eficacia del método de MTBE-SPE en la extracción de ambos estándares de lípidos (A) y los compuestos endógenos (B).
En general, se obtuvieron mejor extracción y la cobertura de los metabolitos en comparación con otros métodos, tales como extracción con metanol, o 'sólo MTBE' extracción cuando el número ocaracterísticas f se comparó el uso de software cualitativo y cuantitativo siguiente análisis LC-MS. Por ejemplo, usando sólo la extracción de metanol, la variación para la creatinina-D 3 fue 15,2%. Sin embargo, con MTBE LLE, este se redujo a 1,04% CV. El uso de MTBE, la reproducibilidad de los lípidos y compuestos acuosos fueron <8% y <5%, respectivamente, en comparación con una extracción con metanol más simple que resultó en mayor variación de 29% y 15%, respectivamente, para los lípidos y compuestos acuosos. Las normas internas utilizadas para monitorear la recuperación de lípidos - testosterona-D 2, la ceramida C17, 15:00 PC y 17:00 PE aumentó un 26%, 200%, 100%, 400%, respectivamente, en comparación con el uso de metanol solo. Se detectaron aumentos similares para las normas y fosfotidilcolina internos de ácidos grasos y metabolitos endógenos phosphotidylethanolamine. O bien no se detectaron otros metabolitos endógenos, tales como esfingosinas, ceramidas, diacilgliceroles, triacilgliceroles, colesterol y esfingomielinautilizando metanol o se detectaron a niveles insignificantes. Sin embargo estos lípidos endógenos se detectaron fácilmente mediante la extracción de MTBE.
En nuestro análisis comparando protocolos estándar, se obtuvieron los siguientes resultados: la precipitación metanol solo dio lugar a 1,851 metabolitos, la precipitación de metanol-etanol dio 2,073 metabolitos, el MTBE con extracción líquido-líquido dio 3,125, y MTBE con líquido-líquido y extracción en fase sólida recuperada 3.806 metabolitos. Por tanto, este enfoque da como resultado un mayor número de metabolitos que se extrae, muy probablemente debido a la reducción de la supresión de iones y muestras limpias antes de LC-MS.
La Figura 2 muestra la eficiencia en la separación de los metabolitos hidrofóbicas en sus respectivas categorías de productos químicos para la identificación de metabolitos más confianza. No es mínimo solapamiento de los compuestos identificados en las tres fracciones de lípidos siguientes SPE. En apoyo, la figura 3 muestrala recuperación de los estándares internos que demuestran que ISTD de se eluyeron en la fracción relacionada con su clase química.
Muestras de control de calidad se utilizan para evaluar la calidad de la preparación de la muestra, para determinar los efectos de lote cuando se requieren varios días de análisis de un conjunto de muestras grandes, y para controlar la reproducibilidad del instrumento. Se examinan cromatogramas para garantizar que las normas de pinchos-en son mayores que el 90% se recuperó con el error de masa inferior a ± 3 ppm y retención ventana de tiempo de menos de ± 5%. Si no se cumplen estos criterios, los resultados se descartan y las muestras se volvieron a analizar. En un caso de efectos de proceso por lotes mediante el cual se observa un cambio en la retención de un lote, el software de análisis de datos puede corregir esto. Un lote preparado previamente de las muestras de plasma reunidas se sometió a la preparación de muestras. Las fracciones se dividen en partes alícuotas a continuación, sub-en viales de muestreador automático y se almacenaron a -80 ° C para su uso en condiciones instrumento de seguimientociones a través de cada análisis de la muestra. Tabla 1 muestra los resultados de estos estándares de pico-a. La fracción modo de ionización negativo de ácido graso (datos no mostrados en la tabla) no se utilizó para el análisis porque el CV% de los estándares de pico-a para la muestra de control de calidad era mayor que 10%. Por consiguiente, el conjunto de datos para esa fracción se desechó y el instrumento inspeccionado y mantenido. Tabla 2 muestra los resultados de metabolitos endógenos en las muestras siguientes tres días diferentes de la preparación de muestras por triplicado y las inyecciones de instrumentos. Los metabolitos endógenos en la preparación de muestras de control de calidad de la muestra son todos reproducible, lo que significa la fuerza de la preparación de la muestra, así como la reproducibilidad del instrumento de inyección.
Cuando los pasos de preparación de muestras no se siguen correctamente, sin embargo, se obtienen resultados poco fiables e inconsistentes. Figura 4 muestra los resultados cuando la etapa de precipitación de proteína del métodono es seguido como se indica. Tres operadores, A, B, y C llevan a cabo el mismo procedimiento de preparación de la muestra en muestras de plasma agrupadas. Operador A, en lugar de pipeteando la cantidad requerida de sobrenadante por el protocolo experimental, en lugar pipeteó> 1 ml para ambos lavados con algunos de los pellets. Esto no sólo dio lugar a un mayor número de falsos positivos para esa fracción, pero aumentó la variabilidad de los datos.
La reproducibilidad cromatográfica de los datos se puede ver en la Figura 7. Muestras de plasma reunidas se prepararon por triplicado en días separados usando precipitación de proteínas, extracción líquido-líquido, y extracción en fase sólida como se describe en este protocolo. Cada fracción se analizó mediante la separación cromatográfico descrito en el apartado 7 del protocolo. Las muestras fueron inyectadas por triplicado en la LC-MS para evaluar instrumentos y la preparación de muestras de reproducibilidad. Esta superposición coherente demuestra tanto la Strengª de la reproducibilidad de la preparación de la muestra cuando se prepara en tres días diferentes, así como la fuerza del método cromatográfico en la producción de resultados reproducibles. Se observa un aumento en el ruido químico para el modo de ionización negativo de la fracción de ácido graso. Esto puede ocurrir debido a los contaminantes en los disolventes LC-MS y puede dar lugar a resultados cuantitativos metabolómicos inconsistentes. Por lo tanto, sólo se analizaron los metabolitos que eluyeron antes del 9 min.
Cuando se ejecuta listas de trabajo largas, una pérdida de la sensibilidad del instrumento y el cambio en concentraciones de tampón puede ocurrir con el tiempo que resulta en la disminución de intensidad de la señal y el cambio de tiempo de retención. Si la variación de superposición tiempo de retención es menor que 5% y la variación de la intensidad de la señal es menos de 10%, los datos aún está dentro de los límites normales de laboratorio. Software de análisis se puede utilizar para alinear y normalizar los datos para corregir la deriva para instrumento y tiempo de retención. Sin embargo, si la variación es LARGE, entonces la razón tiene que ser determinada. Una vez que esto se rectifica, las muestras se pueden volver a analizarse.
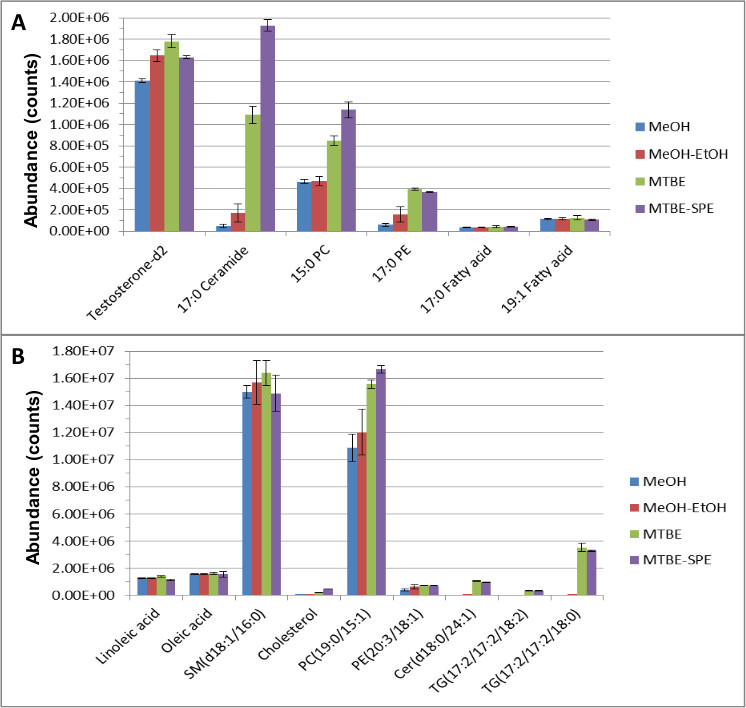
Figura 1. La abundancia de istDS lípidos (A) y metabolitos endógenos (B) después de la extracción y la cromatografía de fase inversa (RPC) 12. La extracción se realizó y las muestras resultantes se separaron mediante RPC y se analizó usando LC-MS en el modo de ionización positivo y negativo. Esta cifra ha sido modificado de Yang y otros, Journal of Chromatography A 1300, 217-226 (2013).
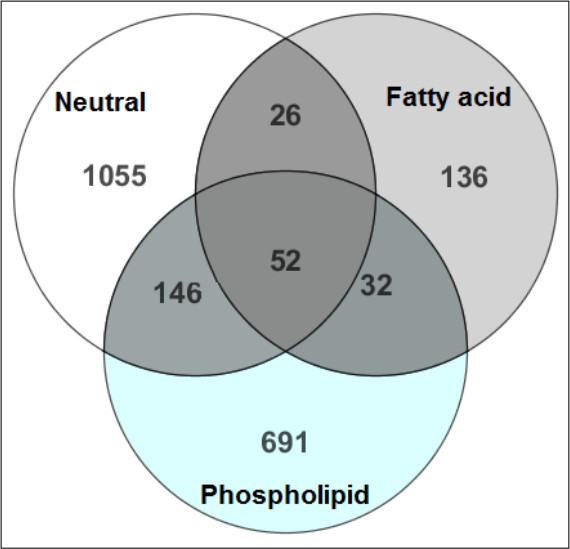
Figura 2. Una comparación de MTBE-SPE fracciones 12. Los metabolitos identificados en cada FRacción se compararon para identificar la cantidad de solapamiento durante la parte de la SPE de la preparación. Los números en el diagrama de Venn reflejan el número de metabolitos detectados en cada fracción. Aquí menor solapamiento se observa entre las tres fracciones, lo que representa la extracción compuesto exitoso y metabolito separación de clases durante el paso de la SPE. Esta cifra ha sido modificado de Yang y otros, Journal of Chromatography A 1300, 217-226 (2013).
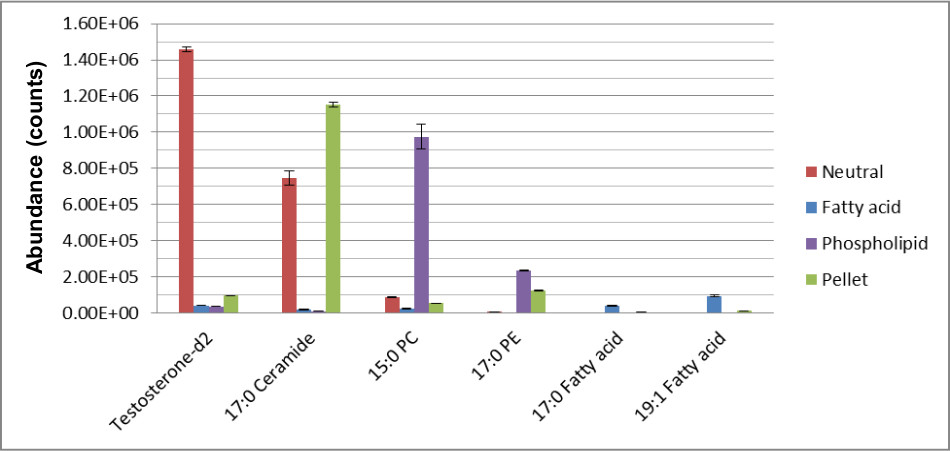
Figura 3. La recuperación de istDS en fracciones usando el método de MTBE-SPE 12. La extracción se realizó y las muestras resultantes se separaron mediante RPC y se analizó usando LCMS en modo positivo y negativo como se describe en el texto. Esta cifra ha sido modificado de Yang y otros, Journal of Chromatography A 1300, 217-226 (2013).
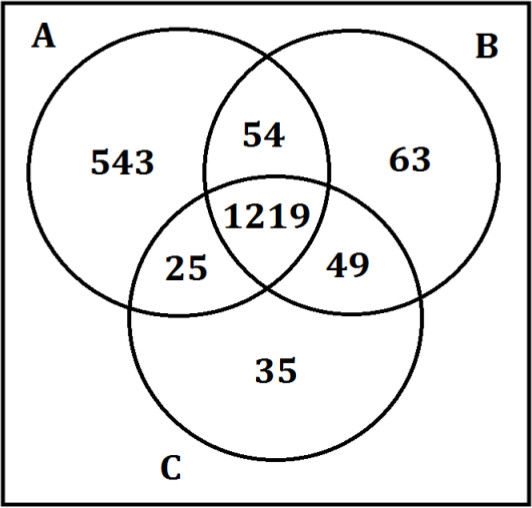
Figura 4. Resultados de la fracción de sedimento preparada por tres operadores. Tres operadores preparación de muestras A, B, y C realizaron el mismo paso de preparación de proteínas en muestras de plasma agrupados. Los números en el diagrama de Venn reflejan el número de metabolitos detectados por cada operador. Operadores B y C pipetearon el volumen requerido por el protocolo de preparación de la muestra, mientras que el operador A pipeteó todo el sobrenadante y algunos de los pellets, lo que resulta en más de 500 más metabolitos, la mayoría son falsos positivos para esa fracción específica.

Figura 5. Formación de precipitado de proteína durante la etapa de precipitación de proteína <. / Fuerte> (A) 100 l de plasma humano antes de la preparación de la muestra, (B) en plasma después de la adición de metanol enfriado con hielo; (C) de pellets de proteína formada en la parte inferior del tubo después de la centrifugación a 0 ° C durante 15 min a 18.000 x g.

Figura 6. Separación de las capas hidrófilas e hidrófobas durante la extracción líquido-líquido (LLE) paso. El metil éter disolvente orgánico terc-butilo (MTBE) y el agua se utilizan para separar los metabolitos hidrófilos e hidrófobos. La capa de MTBE se ha disuelto compuestos no polares y la capa de agua se ha disuelto compuestos polares (A) sobrenadante de plasma después de la eliminación de proteínas;. (B) en plasma después de secado en atmósfera de nitrógeno, (C) en plasma después de la adición de MTBE; Ong> (D) adición de agua al plasma y MTBE; (E) de la capa de agua de MTBE formado después de la centrifugación; (F) eliminación de la capa de MTBE superior; (G) principalmente capa hidrófila restante después de la eliminación de MTBE.
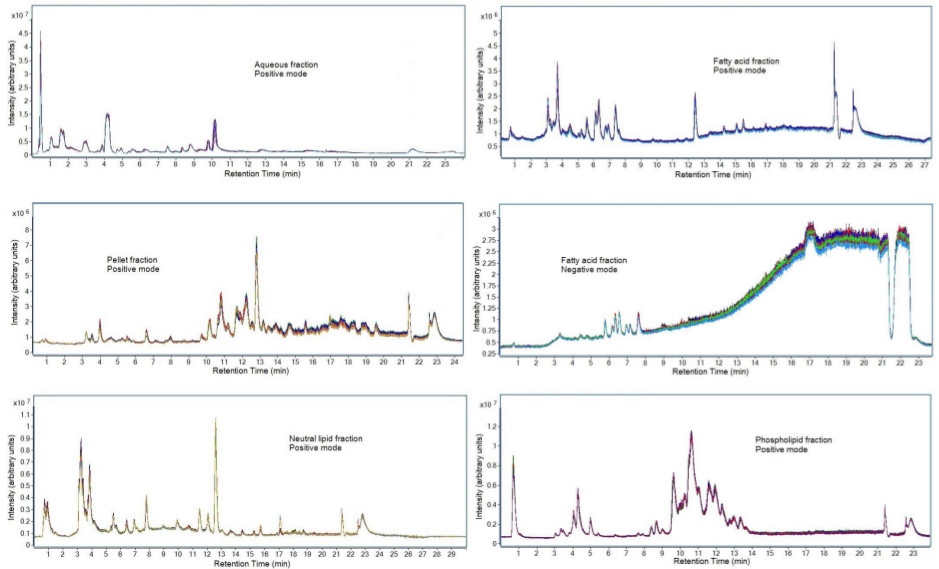
Figura 7. Cromatogramas de fracciones de un conjunto de datos seleccionado. Preparación de la muestra se realizó en tres muestras de control de calidad de mezclas de plasma separados y cada muestra se inyecta en triplicado en el instrumento LC-MS. Representados son cromatogramas de iones totales de las muestras de plasma adquiridos utilizando los parámetros LC-MS indicados en la sección 7 del protocolo del método. La representación cromatográfica de otros fluidos biológicos puede variar debido a las diferencias en la composición de metabolito.k "> Haga clic aquí para ver una versión más grande de esta figura.
| Fracción | Modo de ionización | Estándar Interno | n | Medio zona Pico | Área del pico% CV |
| Acuoso | Positivo | La creatinina-D 3 | 31 | 2217311 | 3,8% |
| Lípido neutral | Positivo | Triglicéridos-D 5 | 31 | 4837032 | 9,9% |
| C17 Ceramide | 31 | 12736707 | 7,9% | ||
| Fosfolípido | Positivo | 15:00 PC | 32 | 1248929 | 9,3% |
| 17:00 PE | 32 | 517234 | 7,9% |
Resultados de la Tabla 1. Control de calidad de las normas internas de pinchos. Se analizaron las muestras de plasma agrupados de un conjunto de datos modelo de ratón enfisema para monitorear las condiciones del instrumento sobre una base diaria para este estudio multi-semana. Software de análisis cuantitativo se utilizó para determinar las áreas de los picos de los patrones internos, (n = número de inyecciones de instrumentos de control de calidad).
| Fracción | Modo de ionización | Metabolitos endógenos | Medio zona Pico | Área del pico% CV |
| Acuoso | Positivo | La creatinina | 2554574 | 2,3% |
| Valina | 3712151 | 3,3% | ||
| Glucosa | 2669190 | 6,9% | ||
| Lípido neutral | Positivo | 3-Dehydrosphinganine | 226644 | 3,9% |
| DG (16:00 / 16:01 / 0:0) | 11301 | 8,2% | ||
| DG (P-14: 0/18: 1) | 364119 | 1,9% | ||
| Fosfolípido | Positivo | PC (24:0 / 0:0) | 27599 | 0,9% |
| PC16: 0/22: 6) | 2873326 | 4,5% | ||
| PI (16:00 / 18:01) | 112998 | 4,4% | ||
| Ácido graso | Positivo | 5 10-oxo-ácido ,8-decadienoic | 1363284 | 2,3% |
| Ácido 16-oxo-heptadecanoico | 83700 | 2,9% | ||
| Ácido valérico 2-metil | 285782 | 5,7% | ||
| Ácido graso | Negativo | Ácido 10-hidroxi-8-octadecenoico | 10042 | 4,9% |
| (R)-ácido laballenic | 173929 | 6,5% | ||
| Ácido valérico 2-ceto | 35488 | 6,0% |
Resultados de la Tabla 2. Control de calidad de los metabolitos endógenos. Se analizaron las muestras de plasma agrupados de un conjunto de datos de enfermedades humanas para supervisar la preparación de muestras de reproducibilidad en días separados. Las muestras se prepararon por triplicado durante tres días, (n = 9 preparación de inyecciones de control de calidad).
Discusión
Uno de los objetivos de los estudios metabolómicos clínicos es identificar los cambios en el metabolome relacionados con la enfermedad o los tratamientos. Por lo tanto, las técnicas de preparación de muestras deben ser robustas, consistentes y transferibles de técnico a técnico y de un laboratorio a 22. Los datos resultantes debe ser representativa de la muestra, y cambios identificados deben reflejar la muestra establecida en lugar de errores de preparación de muestras. Por lo tanto precisa de pipeteado, la temperatura correcta, decantación eficiente de capas inmiscibles, secado en atmósfera de nitrógeno, y el uso de las mismas marcas y tamaños de artículos de vidrio y consejos son necesarios.
Durante la etapa de precipitación de proteínas, es crucial que la misma cantidad de solución se decantó de cada sedimento. Esto reduce la variación en volumen y, como tal, reduce la variación en los datos de muestra. Esta etapa de precipitación de proteínas es necesario para los estudios metabolómicos y no puede ser omitido ya que elimina la proteína delas muestras antes de la pequeña molécula de perfiles de análisis en el espectrómetro de masas. Elimina los patógenos y las grandes macromoléculas, y libera obligado metabolitos a partir de proteínas 7. La falta de acumulación de proteínas en las muestras se expande la duración de la columna de HPLC y aumenta la exactitud y calidad de los resultados. Figura 5 es una representación de la proteína de pellets formado al realizar esta técnica en muestras de plasma. Esto permite la detección de las moléculas pequeñas, aumenta la abundancia de iones, y reduce los efectos de matriz de proteínas en la muestra. Además, ya que se supone que todas las proteínas se eliminan en este paso, los aminoácidos que son detectados durante el análisis de LC-MS se originarían a partir de los cambios metabólicos en lugar de a partir de la descomposición de proteínas.
La etapa de extracción líquido-líquido es crítico ya que separa los metabolitos hidrófilos e hidrófobos en dos capas inmiscibles. La Figura 6 muestra el procedimiento de LLE y un representantesentación de la capa de LLE. Una separación inadecuada de las dos capas da lugar a metabolitos, ya sea que se pierden o se eluyó en dos fracciones. La aplicación cuidadosa de este paso reduce el número de compuestos hidrófilos que aparecen en la fracción hidrófoba. Los resultados para estos compuestos se convierten en poco fiables, ya que no se puede determinar que fracción contiene los resultados representativos. Cuando se hace correctamente, se reduce la superposición metabolito.
Para prevenir la degradación oxidativa, en particular en los lípidos, sino también en pequeñas moléculas que pueden contener grupos tiol por ejemplo, la exposición al oxígeno tiene que ser mantenido a un mínimo. Por lo tanto, este procedimiento siempre se lleva a cabo en atmósfera de nitrógeno para reducir / evitar la oxidación de lípidos o compuestos que contienen tiol. Además, la transferencia de la muestra y / o solución es rápida (dentro de la primera minutos) para reducir la exposición al oxígeno, a continuación, las muestras se colocan rápidamente bajo una corriente constante de nitrógeno para secar abajo. Una vez seco, que son inmediatamentetamente resuspendió en metanol al 100% por las razones anteriormente discutidos.
Los laboratorios pueden beneficiarse de este método integral en un número de maneras; Los investigadores que buscan aislar a una clase de compuestos pueden elegir la parte del método que mejor se adapte a sus necesidades. Aquellos que tratan de realizar sólo una precipitación de proteínas para obtener un conjunto de metabolitos pueden hacerlo. Si se desean metabolitos hidrófilos, tales como muchos fármacos, aminoácidos y azúcares, o si se desean sólo metabolitos hidrófobos, tales como triglicéridos, epóxidos, vitaminas solubles en grasa, y fosfolípidos, por ejemplo, a continuación, los investigadores pueden realizar la extracción líquido-líquido paso después de la precipitación de proteínas y deseche la fracción no deseado. Los investigadores que requieren mayor sub-clasificación de los compuestos hidrofóbicos (lípidos neutros, ácidos grasos y fosfolípidos) pueden pasar a la etapa de fraccionamiento.
Consideraciones sobre el almacenamiento son importantes en maintaining de la viabilidad de las muestras para su posterior análisis. Si las muestras se almacenan de forma incorrecta, pueden producirse degradación o descomposición. Idealmente, las muestras deben ser almacenadas en viales ámbar con tapón de rosca lejos de la luz para evitar la degradación de las especies sensibles a la luz. Las muestras también deben mantenerse congeladas a -80 ° C para evitar la degradación del metabolito 23-25. Aunque no se discute en detalle aquí, muestras siempre se mantienen a 4 ° C en la bandeja de inyector automático durante el análisis de LC-MS. Esto asegura que todas las muestras se mantienen a una temperatura constante y que los cambios en la temperatura ambiente no afectan a la viscosidad, solubilidad, o la estabilidad de las muestras. Se recomienda que los aspectos manuales de este procedimiento, como LLE y SPE, pueden practicar con el fin de ganar la confianza y la comodidad con los pasos a seguir.
Existen unas pocas limitaciones para esta técnica. Discreta separación de los metabolitos hidrofóbicos e hidrofílicos no está garantizada ya que ciertos compuestos voluntad inherentetemente particionar en ambas fracciones debido a su composición química y estado de carga. Además, como se muestra en la Figura 4, una técnica inadecuada durante la etapa de extracción de proteína de pellets puede resultar en una mala reproducibilidad metabolito en las muestras y de los controles de calidad. Esto afecta a las estadísticas, especialmente en pequeños conjuntos de datos debido a que el poder estadístico no está disponible. Por lo tanto, es crucial que este paso se lleva a cabo exactamente la misma hora todos para cada muestra. Otra limitación es el tiempo. Aunque hay puntos de parada a lo largo de este protocolo donde las muestras pueden ser congeladas y la preparación continuaron al día siguiente, un día entero debe dejarse de lado para llevar a cabo este procedimiento. En tercer lugar, no todos los compuestos dentro de una muestra biológica puede ser evaluado para la supresión de iones. Dado que no es posible identificar la forma en la matriz está afectando cada metabolito individual, la opción actual es el de evaluar las normas internas que teóricamente imitan algunas clases de endogenous metabolitos. Por último, las identificaciones absolutas no pueden realizarse únicamente con este método. Tandem MS en colaboración con las búsquedas y las normas de base de datos son necesarios para la identificación del metabolito absoluta.
Una parte importante de la metabolómica es la identificación de compuestos. Aunque no se discute en detalle aquí, se analizaron muestras de control de calidad utilizando LC-MS. Múltiples piezas en bruto de preparación de muestras y los espacios en blanco de instrumentos se prepararon para su uso como sustracción de fondo para reducir la tasa de falsos positivos de contaminantes, resultando así en los accesos de metabolitos más fiables. Después de esta etapa, se agrupó el número de "características moleculares" juntos sobre la base de m / z, tiempo de retención y la relación isotópica, y aductos de producir una lista de compuestos reales. Aunque la lista de compuestos se ha reducido en gran medida, los resultados eran más fiables, ya que no se basan en múltiples aductos de un mismo compuesto. El método completo es completo y permite isolation de metabolitos hidrófobos tales como lípidos neutros, fosfolípidos, ácidos grasos, triglicéridos, y los esteroides, mientras que también aislar clases hidrófilos en la fracción acuosa, de los cuales los eicosanoides, azúcares, flavonoides, aminoácidos y se han identificado 12, 26.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
El tutorial se presenta se realizó y desarrolló dentro de la facilidad de la base de Espectrometría de Masas de National Jewish Health. La instalación NJH MS es apoyado en parte por CCSTI UL1 TR000154. La financiación de las subvenciones del NIH P20 HL-113445 y R01 HL-095432 también apoya este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Fisher Scientific | A955-4 | |
| Methanol | Fisher Scientific | L-6815 | |
| Chloroform | Fisher Scientific | C606-1 | |
| Hexane | Sigma Aldrich | 34859 | |
| Acetic acid | Sigma Aldrich | 49199-50ML-F | |
| Methyl tert-butyl ether | J.T. Baker | 9042-03 | |
| Isopropyl alcohol | Sigma Aldrich | 34965-2.5L | |
| Water | Honeywell Burdick Jackson | 365-4 | |
| OA-SYS heating system | Organomation Associates, Inc | Used to keep samples under a constant flow of nitrogen while at 35 °C | |
| 12-position vacuum manifold | Phenomenex | ||
| Strata NH2 (55 µM, 70Å) 100 mg/ml SPE cartridges | Phenomenex | 8B-S009-EAK | |
| Glass pipette tips | Fisher Scientific | 13-678-20C | Used to transfer sample to SPE column |
| Plastic pipette tips | USA Scientific | 1182-1830 | Used when glass tips are not necessary |
| Microcentrifuge tubes | Fisher Scientific | 02-681-320 | |
| Graduated glass pipets | Fisher Scientific | 13-678-27B | Used to transfer organic solvents during sample prep |
| Pyrex glass culture tubes | Corning Incorporated | 99499-16X | Used to store aqueous and lipid fractions until the next step |
| Autosampler vials | Agilent Technologies | 5182-0545 | |
| Snap cap vials for autosampler vials | Agilent Technologies | 5182-0541 | |
| Glass inserts | Agilent Technologies | 5183-2085 | Used for small sample volumes |
| Mass Hunter Qualitative Analysis software | Agilent Technologies | Version B.06.00 | Used to monitor retention times and pressure curves |
| Mass Hunter Quantitative Analysis software | Agilent Technologies | Version B.05.02 | Used to analyze quality control and sample data |
| Mass Profiler Professional software | Agilent Technologies | Version B.12.50 | Used to determine statistics, fold changes, and perform metabolite identification |
Referencias
- Beckonert, O., et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nature Protocols. 2, 2692-2703 (2007).
- Clarke, C. J., Haselden, J. N. Metabolic Profiling as a Tool for Understanding Mechanisms of Toxicity. Toxicologic Pathology. 36, 140-147 (2008).
- Wang, X., Zhang, A., Sun, H. Power of Metabolomics in Diagnosis and Biomarker Discovery of Hepatocellular Carcinoma. Hepatology. 57, 2072-2077 (2013).
- Collino, S., Martin, F. -. P. J., Kochhar, S., Rezzi, S. Monitoring Healthy Metabolic Trajectories with Nutritional Metabonomics. Nutrients. 1, 101-110 (2009).
- Cevallos-Cevallos, J. M., Reyes-De-Corcuera, J. I., Etxeberria, E., Danyluk, M. D., Rodrick, G. E. Metabolomic analysis in food science: a review. Trends in Food Scienc., & Technology. 20, 557-566 (2009).
- Nicholson, J. K., Connelly, J., Lindon, J. C., Holmes, E. Metabonomics: a platform for studying drug toxicity and gene function. Nature reviews. Drug Discovery. 1, 153-161 (2002).
- Wishart, D., et al. . Metabolome Analysis: An Introduction. , 253-288 (2006).
- Vuckovic, D. Current trends and challenges in sample preparation for global metabolomics using liquid chromatography–mass spectrometry. Analytical and Bioanalytical Chemistry. 403, 1523-1548 (2012).
- Bollard, M. E., Stanley, E. G., Lindon, J. C., Nicholson, J. K., Holmes, E. NMR-based metabonomic approaches for evaluating physiological influences on biofluid composition. NMR in Biomedicine. 18, 143-162 (2005).
- Dong, M. W. . Modern HPLC for Practicing Scientists. , (2006).
- Want, E. J., et al. Solvent-dependent metabolite distribution, clustering, and protein extraction for serum profiling with mass spectrometry. Analytical Chemistry. 78, 743-752 (2006).
- Yang, Y., et al. New sample preparation approach for mass spectrometry-based profiling of plasma results in improved coverage of metabolome. Journal of Chromatography A. 1300, 217-226 (2013).
- Folch, J., Lees, M., Stanley, G. H. S. A simple method for the isolation and purification of total lipides from animal tissues. The Journal of Biological Chemistry. 226, 497-509 (1957).
- Matyash, V., Liebisch, G., Kurzchalia, T. V., Shevchenko, A., Schwudke, D. Lipid extraction by methyl-tert-butyl ether for high-throughput lipidomics. Journal of Lipid Research. 49, 1137-1146 (2008).
- Bligh, E. G., Dyer, W. J. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology. 37, 911-917 (1957).
- Ferreiro-Vera, C., Priego-Capote, F., Luque de Castro, M. D. Comparison of sample preparation approaches for phospholipids profiling in human serum by liquid chromatography–tandem mass spectrometry. Journal of Chromatography A. 1240, 21-28 (2012).
- Michopoulos, F., Lai, L., Gika, H., Theodoridis, G., Wilson, I. UPLC-MS-Based Analysis of Human Plasma for Metabonomics Using Solvent Precipitation or Solid Phase Extraction. Journal of Proteome Research. 8, 2114-2121 (2009).
- Kerns, E. H., Di, L. . Drug-like Properties: Concepts, Structure Design and Methods: from ADME to toxicity optimization. First edn. , (2008).
- Manach, C., Scalbert, A., Morand, C., Rémésy, C., Jiménez, L. Polyphenols: food sources and bioavailability. American Journal of Clinical Nutrition. 79, 727-747 (2004).
- Weimer, J. M., Kriscenski-Perry, E., Elshatory, Y., Pearce, D. A. The neuronal ceroid lipofuscinoses. Mutations in different proteins result in similar disease. NeuroMolecular Medicine. 1, 111-124 (2002).
- Schulze, H., Sandhoff, K. Lysosomal lipid storage diseases. Cold Spring Harbor Perspectives in Biology. 3, (2011).
- Kuhn, E., et al. Interlaboratory evaluation of automated, multiplexed peptide immunoaffinity enrichment coupled to multiple reaction monitoring mass spectrometry for quantifying proteins in plasma. Molecular and Cellular Proteomics. 11, (2012).
- Rist, M. J., et al. Influence of Freezing and Storage Procedure on Human Urine Samples in NMR-Based Metabolomics. Metabolites. 3, 243-258 (2013).
- Boomsma, F., Alberts, G., van Eijk, L., Manin‘t Veld, A. J., Schalekamp, M. A. Optimal Collection and Storage Conditions for Catecholamine Measurements in Human Plasma and Urine. Clinical Chemistry. 39, 2503-2508 (1993).
- Wood, J. T., et al. Comprehensive profiling of the human circulating endocannabinoid metabolome: clinical sampling and sample storage parameters. Clinical Chemistry and Laboratory. 46, 1289-1295 (2008).
- Bahr, T. M., et al. Peripheral blood mononuclear cell gene expression in chronic obstructive pulmonary disease. American Journal of Respiratory Cell and Molecular Biology. 49, 316-323 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados