Method Article
Multi-étape de préparation technique pour récupérer plusieurs classes de composés de métabolites pour approfondie et analyse métabolomique informatif
Dans cet article
Résumé
La fiabilité des résultats dans les expériences de la métabolomique dépend de l'efficacité et la reproductibilité de la préparation de l'échantillon. Décrit une méthode rigoureuse et en profondeur qui permet l'extraction de métabolites à partir de fluides biologiques avec l'option de la suite à l'analyse des milliers de composés, ou seulement les classes de composés d'intérêt.
Résumé
La métabolomique est un domaine émergent qui permet le profilage des échantillons d'organismes afin d'obtenir un aperçu des processus biologiques vivantes. Un aspect essentiel de la métabolomique est la préparation des échantillons de sorte que les techniques incompatibles génèrent des résultats peu fiables. Cette technique comprend la précipitation des protéines, de l'extraction liquide-liquide, et l'extraction en phase solide comme moyen de fractionnement de métabolites en quatre classes distinctes. Amélioration de l'enrichissement de molécules de faible abondance avec une augmentation résultante de la sensibilité est obtenue, et aboutit finalement à l'identification de molécules plus confiant. Cette technique a été appliquée au plasma, le liquide de lavage broncho-alvéolaire, et des échantillons de liquide céphalorachidien avec des volumes aussi faibles que 50 ul. Les échantillons peuvent être utilisés pour de multiples applications en aval; par exemple, le culot résultant de la précipitation des protéines peut être stockée pour une analyse ultérieure. Le surnageant de cette étape est soumis à une extraction liquide-liquide à l'aidel'eau et un solvant organique solide pour séparer les composés hydrophiles et hydrophobes. Une fois fractionné, la couche hydrophile peut être traité pour une analyse ultérieure ou jeté s'il n'est pas nécessaire. La fraction hydrophobe est en outre traité avec une série de solvants au cours de trois étapes d'extraction en phase solide pour la séparer en acides gras, des lipides neutres et des phospholipides. Cela permet au technicien la possibilité de choisir la classe de composés est préféré pour analyse. Il contribue également à l'identification des métabolites plus fiable, car une certaine connaissance de la classe chimique existe.
Introduction
Générer des métabolites des réactions biologiques en tant que produits finaux de processus cellulaires. La métabolomique est une collection de tous les composés présents dans l'organisme à la suite de ces procédés. Il donne une image de la physiologie des cellules et reflète la réponse de l'organisme à des stimuli externes ou internes 1, 2. Ces stimuli peuvent être environnementales, toxicologiques, pharmacologiques, alimentaires, hormonaux, ou liées à une maladie. De nombreuses applications ont métabolomique et sont actuellement à l'étude par des chercheurs et notamment la découverte de biomarqueurs 3, 4 études sur la nutrition, sciences de l'alimentation 5, et le dépistage des drogues 6. Quelle que soit l'application, les variations de données, la contamination et la présence de faux-positifs doivent être réduite ou de préférence éliminée. Dans la découverte de biomarqueurs ou dans le cas de la détermination des différences entre un témoin et un groupe de maladie, ou d'enquêter sur les effets des médicaments sur des sujets, une f biologiqueLUID est choisi sur la base des questions posées et les types de métabolites à l'étude 7. Par exemple, si l'étude des effets immédiats d'un médicament inhalé sur les poumons des asthmatiques, alors explorer métabolites dans le liquide de lavage broncho-alvéolaire (LBA) des échantillons avant et après l'administration serait préférentiel. Afin de s'assurer que les différences observées sont dues à la variation biologique réelle plutôt que mauvaise technique de préparation des échantillons, le protocole de laboratoire normalisée et cohérente est essentielle 8. Exemple d'informations doit être soigneusement documenté afin de s'assurer que les variables tels que le liquide biologique, souche animale, le temps d'échantillonnage, l'âge du sujet, le sexe, pour n'en nommer que quelques-uns, sont tous considérés et pris en compte dans l'étude 9. En outre, pour réduire la possibilité de contamination ou de faux positifs, il est recommandé de flans ébauches de solvants et de l'instrument d'analyser 10.
Pour ce protocole, le terme «métabolismelites »seront utilisés pour désigner les composés réels identifiés. Utiliser un logiciel de fournisseur, un algorithme initial de pointe de recherche est utilisé pour détecter des pics de spectrométrie de masse. Ces pics sont alignés sur la base de (m / z) rapport et rétention de masse à temps de charge. Un deuxième algorithme est ensuite utilisé pour combiner plusieurs fonctions dans un seul composé. Cela comprend des caractéristiques telles que le sodium, le potassium, ou des produits d'addition d'ammonium dans le mode d'ionisation positif et de chlorure dans le mode ion négatif. Des options supplémentaires dans le logiciel incluent des fonctionnalités telles que les dimères et d'autres produits d'addition. Utilisation de glucose, par exemple, avec des pics à 181.0707 m / z (M + H), 198,0972 m / z (M + NH 4), et 203,05261 m / z (M + Na), il y aura trois pics correspondant à la même composer à l'aide du premier algorithme. Cependant, lorsque le second algorithme, qui est basé sur la formule moléculaire, on applique ces trois produits d'addition deviennent regroupés en un composé résultant.
Métabolites peuvent causer des interférences dans samples en raison de la complexité des composés présents. La présence de milliers de métabolites dans un échantillon causes signal de suppression notamment des métabolites de faible abondance. le nettoyage de l'échantillon pour éliminer les protéines interférant, et une séparation ultérieure en plusieurs fractions réduit la complexité de l'échantillon ce qui améliore la séparation des pics, ce qui augmente la résolution, et la réduction de métabolite co-élution. Par conséquent, le nettoyage de l'échantillon et une meilleure séparation des composés est nécessaire. Il a été montré que la précipitation des protéines seules, même avec l'utilisation de différents solvants de polarité, ne peut résoudre ce problème 11, 12. Cependant, par combinaison d'un solvant organique forte telle que le MTBE avec une étape de fractionnement ultérieure, la couverture de métabolite est augmentée. Yang et al. 12 ont signalé une augmentation des métabolites de 1851 ou 2073 avec du méthanol ou de précipitation méthanol-éthanol seuls respectivement, à 3,806 métabolites utilisant MTBE combinée extraction par solvantsuivie d'une extraction en phase solide (SPE) étapes. Réduit le chevauchement de métabolite, l'amélioration de la séparation de pic et une abondance accrue de metabolites a été observée avec cette méthode.
Contamination de non-métabolites, tels que les polymères, peut entraîner de la collecte de l'échantillon, de solvants ou de bruit de l'instrument, et peut conduire à la suppression du signal de métabolites potentiellement importants. Il est recommandé que le technicien (s) et ceux qui collectent les échantillons avant de goûter à la préparation utiliser toujours la même marque, le type et la taille des flacons de prélèvement d'échantillons, embouts de pipette et tous les autres tubes utilisés lors de la collecte et la préparation des échantillons. Cela permet à l'analyste de données pour avoir pleine confiance que les changements observés sont réels et non en raison de différences de fond provenant d'autres sources. L'efficacité du traitement, les variations entre la maladie et les groupes de contrôle, ou d'autres analyses métaboliques peuvent alors être étudiées avec une confiance accrue.
La method discuté ici se concentre sur l'échantillon des méthodes de préparation combinées 13-15 qui peuvent être appliqués à plasma, BALF, ou le liquide céphalorachidien (LCR) des échantillons de profilage métabolomique non ciblée pour la spectrométrie de chromatographie liquide de masse (LCMS) l'analyse comparative. Les deux Chromatographie liquide (LC) et la Chromatographie liquide ultra performance (UPLC) des techniques de séparation peuvent être couplés à MS après cette procédure. De nombreux chercheurs effectuant métabolomique utilisent soit une technique de précipitation des protéines et / ou d'une technique d'extraction liquide-liquide 16, 17. Dans nos études, ce qui a entraîné en moins de métabolites détectés. Le procédé décrit ici 12 permet la détection et l'identification d'un plus grand nombre de métabolites, couvrant une large gamme de métabolome. Cette augmentation est due à la plus grande pureté des échantillons et des effets de matrices réduites provoquées par la séparation préalable des classes de metabolites.
Une prot initialeein étape de précipitation est effectuée en utilisant du methanol froid (MeOH) pour éliminer les protéines de l'échantillon. Extraction liquide-liquide (LLE) en utilisant de l'éther de tert-butyle et de méthyle (MTBE) et de l'eau est utilisée pour séparer les composés hydrophiles et hydrophobes. Ensuite, l'extraction en phase solide (SPE) est effectuée sur la couche hydrophobe afin de séparer les composés hydrophobes en trois classes - des acides gras, des lipides neutres et des phospholipides. Les fractions hydrophobes sont reconstitués dans 100% de methanol, tandis que la fraction hydrophile est reconstituée dans 5% d'acétonitrile dans l'eau. L'extraction en phase solide (SPE) étape fournit un niveau supplémentaire de confiance dans les résultats en réduisant le nombre de composés coélution qui autrement serait présent avait une étape de séparation pas été effectuée.
Protocole
1. Considérations initiales, préparation des instruments et des normes
- Toujours utiliser pour stocker verre (tubes de culture en verre, des flacons auto-échantillonneurs de verre) ou de transfert (pipettes en verre) des lipides et des solvants organiques.
- Minimiser l'exposition de tous les échantillons de lipides et de normes à l'air. polytétrafluoroéthylène Seal (PFTE) bouchons hermétiquement pour éviter l'exposition de l'air et de l'évaporation. Remettre en suspension immédiatement lipides séchés dans le solvant prochaine ou les conserver dans un flux constant d'azote.
- Utilisez 100 ul d'échantillon. Dans les cas où plus (ou moins) l'échantillon est disponible, ajuster les volumes en conséquence. Cependant, durant le fractionnement des lipides sur la colonne NH 2 SPE, a déclaré volumes doivent rester comme indiqué.
- Mettez centrifugeuse et mis à 0 ° C avant le début de la préparation des échantillons.
- Cette technique utilise de nombreux solvants volatils donc garder tous les solvants plafonnés pendant la préparation de l'échantillon.
- Préparer deux types de normes par recommandation.
- Préparer un témoin négatif composé de tous enrichis-normes à une concentration constante. Ceci est ajouté dans tous les échantillons ainsi que d'un échantillon composite qui est utilisé comme un lot QC (sur mélange d'échantillons dopés utilisé pour surveiller la préparation des échantillons reproductibilité des jours différents) et instrument QC (échantillons enrichis communs préalablement préparées, sous-aliquotées, et utilisés pour surveiller instruments conditions / fluctuations lors de l'analyse et des jours différents).
- Préparer des témoins positifs à 1x, 2x, et des pointes standard 4x. Les contrôles positifs sont ajoutés à tous les échantillons ainsi que d'un échantillon de plasma mis en commun et sont utilisés comme composés de contrôle de la qualité, tant pour les étapes de préparation des échantillons et les étapes d'analyse instrumentale pour analyser et identifier les différences de facteur de changement au cours de l'analyse des données afin de s'assurer que tous les aspects de la préparation et l'analyse instrumentale ont été effectuées correctement.
- normes de conserver à -20 ° C et stocker les échantillons à -80 ° C. Certains support internenormes qui sont sujettes à la dégradation après un stockage à long terme doivent être conservés à -80 ° C.
- Cette procédure nécessite l'utilisation de solvants dangereux, inflammables ou volatiles tels que le MTBE. Effectuez toutes les étapes dans une hotte.
2. Normes internes
- Choisissez normes internes (ISTD) sur la base de projets individuels et leur conception expérimentale spécifique. Pour les liquides biologiques tels que le plasma, BALF, ou de l'urine, ISTDS marqués par des isotopes qui sont de nature similaire à ceux trouvés dans ces échantillons biologiquement serait idéal. Celles-ci comprennent mais ne sont pas limités à des acides aminés, des hormones ou des lipides. Pour les échantillons végétaux métabolomique, normes marqués tels que les flavonoïdes, les caroténoïdes, ou pourraient être utilisés. La même chose s'applique à d'autres métabolomique lequel l'enquêteur doit choisir un étalon interne qui est représentatif du type de l'échantillon analysé.
- Assurez-vous que l'étalon interne choisi couvre un large éventail de chromatogramme; par exemple si til le temps d'acquisition est de 20 min, les normes qui éluent toutes les 5 minutes peuvent être utilisés.
- Créer des solutions mères hydrophiles à 2 mg / ml en utilisant une variété de normes marqués par des isotopes et / ou d'autres composés polaires qui sont exogènes à l'échantillon en cours d'analyse. De chaque solution mère, créer une solution 1:1 méthanol: eau à toutes les normes à une concentration finale de 25 pg / ml de créatinine-D 3, 100 pg / ml lysine-D 4 et 200 pg / ml valine-D 8 .
- Créer des solutions mères hydrophobes en utilisant une variété de normes marqués par des isotopes et / ou d'autres composés non-polaires, qui sont exogènes à l'échantillon en cours d'analyse; Les concentrations des images de 17:00 d'acide gras (4 mg / ml), 19:01 acides gras (4 mg / ml), 17:00 céramide (2 mg / ml), 17:00 PE (1,75 mg / ml), 15 : 0 cp (2 mg / ml), et de la testostérone-D 2 (1 mg / ml). De chaque stock, créer une solution 1:1 chloroforme: méthanol à toutes les normes à une concentration finale de 50ug / ml de 17:00 céramide, 100 pg / ml 15 heures 00 PC, 100 ug / ml de testostérone-D 2, 200 pg / ml 17 heures 00 un acide gras, 200 pg / ml 19 heures 01 un acide gras, et 200 ug / 17h00 ml PE dans le mélange standard.
- Tester le degré d'ionisation de chaque norme à l'avance en utilisant au moins cinq concentrations différentes pour chaque niveau afin de déterminer la limite de détection et la linéarité de l'instrument pour ces composés. La concentration de la solution de stock pour chaque norme individuelle varie en fonction de la conception expérimentale, et la concentration de chaque niveau dans la norme pointes combinée peut aller de 20 pg / ml à 2 mg / ml en fonction de la façon dont ils ionisent.
- Créer un mélange de pointe de contrôles positifs et les ajouter aux échantillons à des concentrations 4x 1x, 2x, ou de suivre quantitativement la force de la préparation des échantillons et l'exactitude des données instrumentales. Concentration finale de contrôles positifs peuventêtre: 2 mg / ml de D-glucose, 100 pg / ml d'alanine-D 3, 200 ug / ml d'acide méthylmalonique D-3, 20 pg / ml triglycéride-D 5, et / ou d'autres normes hydrophobes et hydrophiles. Ajuster la concentration des étalons en fonction de la sensibilité de l'instrumentation MS et HPLC utilisées pour l'analyse.
3. Précipitation de Protéines
- Décongeler les échantillons à température ambiante et Spike 10 pi de DTST à chaque échantillon comme décrit ci-dessous.
- De Spike 10 pi de deux solutions standard hydrophiles et hydrophobes (créés à partir du stock dans les étapes 2.3 et 2.4) à chaque échantillon. Ajuster la concentration des étalons selon les besoins sur la base de la sensibilité de l'instrumentation MS et HPLC utilisées pour l'analyse
- De Spike 10 ul de 1x, 2x, ou la solution de contrôle positif de 4x (créé à partir du stock à l'étape 2.6) pour chaque échantillon. Ajuster les concentrations standards nécessaires en fonction de la sensibilité de la MS et HPLC instrumentation utilisée pour l'analyse
- Vortexer chaque échantillon pendant 10 secondes avant l'étape de précipitation de protéine
- Ajouter 400 pi de methanol froid (glace stockées à -20 ° C) pour chaque échantillon.
- Vortex pendant 10 secondes par tube.
- Centrifugeuse à 0 ° C pendant 15 min à 18 000 x g.
- Transférer tout le surnageant dans un nouveau tube de culture en verre, puis sec sous N2.
- Si l'analyse de la fraction protéique de pastilles, procéder aux étapes 3.8 à 3.11. Si ce n'est pas l'analyse de la boulette de protéine, passez à la Section 4.
Remarque: Le culot de protéine peut contenir des composés à forte hydrophobie qui seraient utiles lors de la réalisation d'études de médicament 18, l'alimentation des analyses impliquant des flavonoïdes hydrophobes 19 ou métabolomique liés aux maladies où des composés très hydrophobes s'accumulent, comme neuronales céroïde-lipofuscinose 20 et lysosomale stockage des lipides 21 maladies. - Ajouter 1 ml de MTBE à til blanc (ou blanc cassé) culot protéique, vortex pendant 30 secondes par tube, puis centrifuger à 0 ° C pendant 15 min à 18 000 x g. Décanter la couche de MTBE dans un nouveau tube de culture en verre.
Il s'agit d'une étape critique que les erreurs ici va considérablement influer sur les résultats (voir Figure 5 à des résultats représentatifs).- Aspirer toujours la même quantité de MTBE pour tous les échantillons puisque la taille de la pastille peut varier selon les échantillons. Par conséquent, si seulement 900 pi peuvent être décantés pour l'échantillon avec le moins de surnageant, puis décanter 900 pi pour tous les échantillons.
- Répéter l'étape 3.9, et de combiner la phase organique à la même tube de culture en verre préparé à l'étape 3.7.
- Les échantillons secs par flux de N 2 et de remettre en suspension dans 200 ul de chloroforme: méthanol 01:01. brièvement Vortex.
- Transférer dans un tube de centrifugation. Centrifugeuse à 0 ° C pendant 15 min à 18 000 xg, puis transférer le surnageant dans échantillonneur automatique flacons à bouchon à vis en utilisant du verrepipettes.
4. Extraction liquide-liquide
- En utilisant une pipette en verre, ajouter 3 ml de MTBE à l'methanol résiduel séché (à partir de la section 3, étape 6), vortex 30 sec, ajouter 750 ul d'eau, puis vortex 10 secondes par tube.
- Spin ~ 200 xg pendant 10 min dans une centrifugeuse à température ambiante.
- Aspirer 2,5 ml de la couche de MTBE (sans mettre de l'eau) et transférer dans un tube de culture en verre propre.
Note: Ceci est une étape cruciale que les différences ici affectera les résultats. 2,5 ml de MTBE doit être soigneusement décanté à partir de la couche supérieure, car il permet à un volume fixe devant être décanté sans pipetage de la couche aqueuse ci-dessous. Si le volume de l'échantillon au début de l'expérience était inférieur aux 100 pi indiquées pour ce procédé, à l'échelle le volume de MTBE pour tenir compte de cette proportion du volume de l'échantillon de départ. - Ajouter 3 ml de MTBE à la partie restante de l'eau de l'échantillon, et le vortex 10 secondes par tube.
- Spin ~ 200xg pendant 10 minutes dans la centrifugeuse à température ambiante.
- Aspirer 3 ml de MTBE (sans mettre de l'eau) et de combiner avec le tube de MTBE.
- On concentre la couche aqueuse résiduelle par séchage sous N2.
- Re-suspendre résidu dans 100 pi d'eau.
- Ajouter 400 ul de glace MeOH froid au tube de culture en verre, vortex brièvement, puis transfert à microtube.
- Ajouter à -80 ° C pendant 20-30 min. Centrifuger à 0 ° C pendant 15 min à 18 000 x g.
Note: Il est recommandé de placer la grille de l'échantillon entier dans un congélateur à -80 ° C ce qui permettra une protéine restant à précipiter dans le méthanol. Si un congélateur à -80 ° C n'est pas disponible, d'autres options sont: le stockage à -20 ° C, plaçant les échantillons sur de la glace sèche, ou de les maintenir dans un seau à glace. Il est important pour stocker constamment les échantillons dans un environnement froid et à la même température pour permettre la précipitation. - Aspirer 450 pi de surnageant et le transfert àun microtube propre. Sécher complètement dans un concentrateur centrifuge sous vide à pas plus de 45 ° C. (Prend environ 1-2 heures).
- Remettre en suspension le surnageant séché dans 200 ul de 5% d'acétonitrile / eau. brièvement Vortex. Congeler à -80 ° C.
5. Extraction en phase solide
- Séchez la fraction de MTBE sous azote à 35 ° C avec un bon flux d'azote (environ 10-15 min).
- Quand il est complètement sec, arrêter l'écoulement de l'azote et rapidement remettre en suspension dans 1 ml de chloroforme (CHCl 3) en utilisant une pipette en verre. brièvement Vortex.
Remarque: Les solvants tels que CHCl 3 ont une faible viscosité. Au cours de pipetage, une faible tension superficielle provoque la perte de solvant à partir de la pipette. Il est recommandé que la pointe de pipette être pré-imbibé au moins deux fois afin de permettre un équilibrage entre le solvant est introduit à la pipette et de l'espace dans la pipette. Une seringue étanche au gaz peut également être utilisée si elle est disponible. - Mettre en place un collecteur de vide SPE et NH 2 colonnes SPE pour fractionnement.
- Échantillons réchauffer à température ambiante et gardez toujours suspendus sous un flux constant de N 2. Le réchauffement à la température ambiante permettra la remise en suspension des lipides et l'azote permettra d'éviter l'oxydation et la polymérisation des lipides.
- Lavez et l'état SPE cartouche 2x avec 400 pi hexane. Jeter les déchets et remplacer par un nouveau tube de collecte de verre.
- Ajouter l'échantillon à la colonne SPE, collecter s'écouler à travers dans des tubes de verre.
- Avec une pipette en verre ajouter 1 ml de 02h01 CHCl3: IPA, collecter traverser en mêmes tubes de verre (ce qui est la fraction neutre).
- Sécher la fraction neutre sous le N 2 pour minimiser l'oxydation (prend environ 10-15 min).
- Avec une pipette en verre ajouter 1 ml d'acide acétique à 5% dans de l'éther de diéthyle, collecter traverser dans de nouveaux tubes de verre (ce qui est la fraction des acides gras).
- Séchez la fraction d'acide gras sous le N 2 pour minimiser l'oxydation (prend environ 10-15 min).
- Utiliser des embouts en plastique d'ajouter 800 &# 181; litre de methanol à une cartouche SPE, et recueillir écoulement continu dans 15 ml tubes coniques en matière plastique (ce qui est la fraction phospholipidique).
- Transférer fraction phospholipidique de 1,5 ml des tubes à centrifuger. Sécher les échantillons avec un concentrateur centrifuge sous vide à 45 ° C (prend environ 1-1,5 heures).
- Reprendre chacun des échantillons des trois fractions de 200 ul de méthanol à 100%, vortex, et le transfert à échantillonneur automatique flacons à bouchon à vis pour le stockage.
6. Exemple de conditions de stockage
- Stocker tous les échantillons à -80 ° C jusqu'au moment de l'analyse de l'instrument.
Remarque: Les échantillons extraits, reconstituées dans un solvant organique peuvent être conservés à -20 ° C. Cependant ce n'est pas recommandé sous forme de métabolites d'intérêts potentiels se dégradent à cette température. Stockage d'azote liquide n'est pas recommandé que les enquêteurs ont signalé des problèmes de contamination, des flacons de stockage spéciaux sont nécessaires, et il ya un manque d'homogénéité dans la prudence de la chambrechanter fluctuations de température. - Si les volumes d'échantillons sont de petite taille (<100 pi), utiliser des inserts dans les flacons pour éviter l'évaporation du solvant dans l'espace de tête au cours du stockage.
- Évitez de congélation-décongélation des échantillons. Décongeler les échantillons une seule fois, juste avant l'analyse de l'instrument. Gel-dégel répétés conduisent à la dégradation de l'échantillon.
7. Liquides Conditions chromatographie
- Utilisez un 2.1 mm x 50 mm C-18 (1,8 um) de la colonne analytique avec un 2,1 mm x 12,5 mm C-18 (5 um) de colonne de garde d'analyser la fraction hydrophobe.
- Réglez la température de l'échantillonneur automatique à 4 ° C, la température de la colonne à 60 ° C, le volume d'injection de 2 ul et le débit d'écoulement de 0,25 ml / min.
- Utilisation de l'acide formique à 0,1% dans l'eau pendant la phase mobile A, et 0,1% d'acide formique dans de l'isopropanol: acétonitrile: eau (60:36:4) pour la phase mobile B.
- Exécutez le profil d'élution de gradient suivant: Lancer unt 30% de B, et une augmentation de 70% de B de 0 à 1 min, puis augmente jusqu'à 100% de B de 1 à 15 min et maintenir pendant 5 min, puis 5 min à 10% de B à laver et 5 min après l'exécution.
- Utilisez un x 50 mm HILIC 2,1 mm (2,6 um) de la colonne analytique avec une colonne de garde d'analyser la fraction hydrophile.
- Réglez la température de l'échantillonneur automatique à 4 ° C, la température de la colonne à 20 ° C, le volume d'injection de 2 ul et le débit à 0,5 ml / min.
- Utiliser 50% d'acétonitrile dans de l'acétate 10 mM d'ammonium, pH 5,8 pour la phase mobile A et 90% d'acétonitrile dans de l'acétate d'ammonium 10 mM pH 5,8 pour la phase mobile B.
- Exécutez le gradient profil d'élution suivant: Commencez à 100% B de 0 à 2 min, puis baisser à 50% de B de 2 à 15 minutes, puis 5 min 0% lavage B et 10 min après l'exécution.
Résultats
La technique de préparation de l'échantillon entier a été effectuée comme décrit ci-dessus et des aspects les plus importants et / ou pertinentes sont présentées ci-dessous. Normes internes hydrophiles et hydrophobes sont injectés dans des échantillons de plasma mis en commun pour effectuer des comparaisons directes des normes internes et de l'abondance des métabolites endogènes à l'aide de diverses méthodes d'extraction. Liquide spectrométrie de chromatographie de masse (LC-MS) Les données ont été analysées en utilisant le logiciel qualitative et quantitative, et a donné lieu à une excellente récupération et la séparation de ces deux composés endogènes et des normes internes. Figure 1 met en évidence l'efficacité du procédé MTBE-SPE en extrayant les deux normes de lipides (A) et des composés endogènes (B).
Dans l'ensemble, une meilleure extraction et la couverture des métabolites ont été obtenus par rapport à d'autres méthodes telles que l'extraction de méthanol, ou «MTBE ne 'extraction lorsque le nombre ofonctions f ont été comparées en utilisant le logiciel qualitative et quantitative après analyse LC-MS. Par exemple, en utilisant seulement une extraction au méthanol, la variation de la créatinine-D 3 était de 15,2%. Toutefois, le MTBE LLE, cela a été réduit à 1,04% CV. Utilisation de MTBE, la reproductibilité des lipides et des composés aqueux étaient <8% et <à 5%, respectivement, par rapport à une extraction au méthanol simple qui a donné lieu à plus grande variation de 29% et 15% respectivement pour les lipides et les composés aqueux. Les normes internes utilisés pour surveiller les recouvrements de lipides - testostérone-D 2, C17 céramide, 15h00 PC et 17h00 PE a augmenté de 26%, 200%, 100%, 400% respectivement par rapport à l'utilisation de méthanol seul. Des augmentations similaires ont été détectées pour les étalons internes d'acides gras et de phosphatidylcholine et de métabolites endogènes phosphotidylethanolamine. D'autres métabolites endogènes tels que les céramides, les sphingosines, les diacylglycérols, triglycérides, du cholestérol, de la sphingomyéline et ont été soit non détectésen utilisant du méthanol ou ont été détectés à des niveaux négligeables. Toutefois, ces lipides endogènes ont été facilement détectés en utilisant l'extraction de MTBE.
Dans notre analyse comparant les protocoles standards, les résultats suivants ont été obtenus: Méthanol précipitation seul a donné lieu à 1 851 métabolites, les précipitations méthanol-éthanol a donné 2073 métabolites, le MTBE à l'extraction liquide-liquide a 3125, et le MTBE avec du liquide-liquide et l'extraction en phase solide récupéré 3806 métabolites. Par conséquent, cette approche se traduit par un plus grand nombre de métabolites étant extraites, probablement en raison de la suppression d'ions réduits et des échantillons propres avant LC-MS.
La figure 2 montre l'efficacité de la séparation des métabolites hydrophobes dans leurs classes chimiques respectives pour l'identification des métabolites plus confiant. Il ya un chevauchement minimal des composés identifiés dans les trois fractions lipidiques suivantes SPE. À l'appui, la figure 3 montrela récupération des étalons internes qui démontrent que de ISTD ont été élues dans la fraction liée à leur classe chimique.
Des échantillons de contrôle de qualité sont utilisées pour évaluer la qualité de la préparation de l'échantillon, afin de déterminer les effets de lot lorsque plusieurs jours d'analyse sont nécessaires pour un grand ensemble d'échantillons, et pour contrôler la reproductibilité instrument. Les chromatogrammes sont examinées pour s'assurer que les normes sont dopés en plus de 90% en masse récupérée avec une erreur inférieure à ± 3 ppm et la rétention fenêtre de temps de moins de ± 5%. Si ces critères ne sont pas satisfaits, les résultats sont jetés et les échantillons sont analysés de nouveau. Dans le cas d'effets de traitement par lots grâce à quoi un déplacement de rétention est observée pour un lot, le logiciel d'analyse de données peut corriger ce. Un lot préparé au préalable d'échantillons de plasma mis en commun a subi la préparation des échantillons. Les fractions ont ensuite été sous-aliquotes dans des flacons auto-échantillonneurs et stockés à -80 ° C pour une utilisation dans l'instrument de surveillance conditions tout au long de chaque analyse d'échantillon. tableau 1 montre les résultats de ces normes en pointes dans. La fraction en mode d'ionisation négative d'acide gras (données non présentées dans le tableau) n'a pas été utilisé pour l'analyse en raison de la CV% des normes en pointes dans de l'échantillon QC était supérieure à 10%. L'ensemble de données pour cette fraction a donc été mis au rebut et l'instrument contrôlé et maintenu. Tableau 2 montre les résultats de métabolites endogènes dans les échantillons suivants trois jours différents de la préparation des échantillons et des injections de l'instrument en triple. Les métabolites endogènes dans les échantillons de CQ préparation de l'échantillon sont toutes reproductibles, ce qui signifie la résistance de la préparation de l'échantillon, ainsi que la reproductibilité de l'instrument d'injection.
Lorsque les étapes de préparation de l'échantillon ne sont pas correctement respectées, cependant, on obtient des résultats non fiables et incohérents. Figure 4 montre les résultats lorsque l'étape de précipitation de protéine de la méthoden'est pas suivi comme indiqué. Trois opérateurs, A, B, C et réalisées le même échantillon sur la procédure de préparation des échantillons de plasma mis en commun. Un opérateur, au lieu de pipetage de la quantité requise de surnageant par le protocole expérimental, au lieu> pipette 1 ml pour les deux lavages avec une partie de la pastille. Cela permet non seulement conduit à un nombre élevé de faux positifs pour cette fraction, mais a augmenté la variabilité des données.
La reproductibilité chromatographique des données peut être vu sur la figure 7. Ont été préparés les échantillons de plasma gestion commune en triple à des jours différents en utilisant la précipitation des protéines, de l'extraction liquide-liquide, et l'extraction en phase solide tel que décrit dans ce protocole. Chaque fraction a été analysée en utilisant la séparation chromatographique décrit dans l'article 7 du protocole. Les échantillons ont ensuite été injectés en trois exemplaires sur la LC-MS pour évaluer l'instrument et la préparation des échantillons reproductibilité. Ce chevauchement cohérente démontre à la fois la Strenge de la reproductibilité de la préparation de l'échantillon quand il est préparé sur trois jours différents, de même que la force de la méthode chromatographique en produisant des résultats reproductibles. Une augmentation du bruit chimique est observée pour le mode d'ionisation négative de la fraction d'acide gras. Cela peut se produire en raison de contaminants dans les solvants LC-MS et peut entraîner des résultats métabolomique quantitatives incompatibles. Par conséquent, seuls les métabolites qui sont élues avant 9 min ont été analysés.
Lors de l'exécution de longues listes de travail, une perte de sensibilité et de changement dans les concentrations de tampons instrument peut se produire au fil du temps entraînant une diminution de l'intensité du signal et le décalage de temps de rétention. Si la variation de chevauchement de temps de rétention est inférieur à 5% et la variation d'intensité du signal est inférieure à 10%, les données sont toujours dans des limites classiques de laboratoire. Logiciel d'analyse peut être utilisée pour aligner et normaliser les données pour corriger la dérive de l'instrument et le temps de rétention. Cependant, si la variation est large, alors la raison doit être déterminée. Une fois cela est rectifié, les échantillons peuvent être analysés de nouveau.
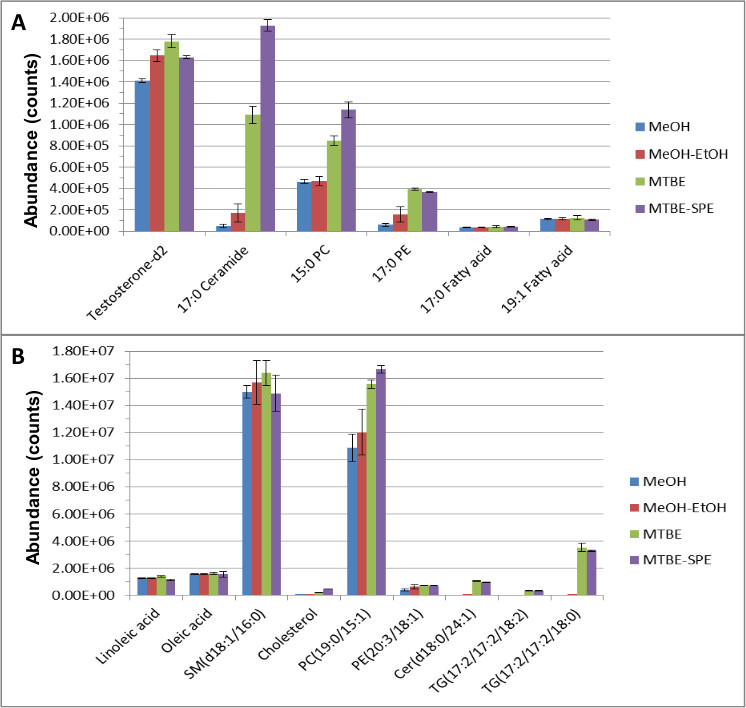
Figure 1. L'abondance des lipides ISTDS (A) et des métabolites endogènes (B) après extraction et chromatographie en phase inverse (RPC) 12. L'extraction a été effectuée et les échantillons ainsi obtenus ont été séparés en utilisant RPC et analysées par CL-SM en mode d'ionisation positive et négative. Ce chiffre a été modifié depuis Yang et al, Journal of Chromatography A 1300, 217-226 (2013).
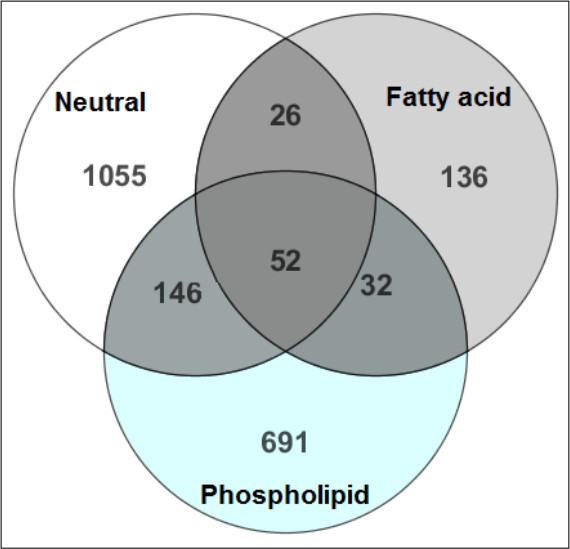
Figure 2. Une comparaison de MTBE-SPE fractions 12. Les métabolites identifiés dans chaque frOn a comparé l'action de déterminer la quantité de chevauchement au cours de la partie de SPE de la prep. Les chiffres dans le diagramme de Venn reflètent le nombre de métabolites détectés dans chaque fraction. Ici chevauchement mineur est observée entre les trois fractions, ce qui représente l'extraction du composé avec succès et la séparation des classes de metabolites pendant l'étape de SPE. Ce chiffre a été modifié depuis Yang et al, Journal of Chromatography A 1300, 217-226 (2013).
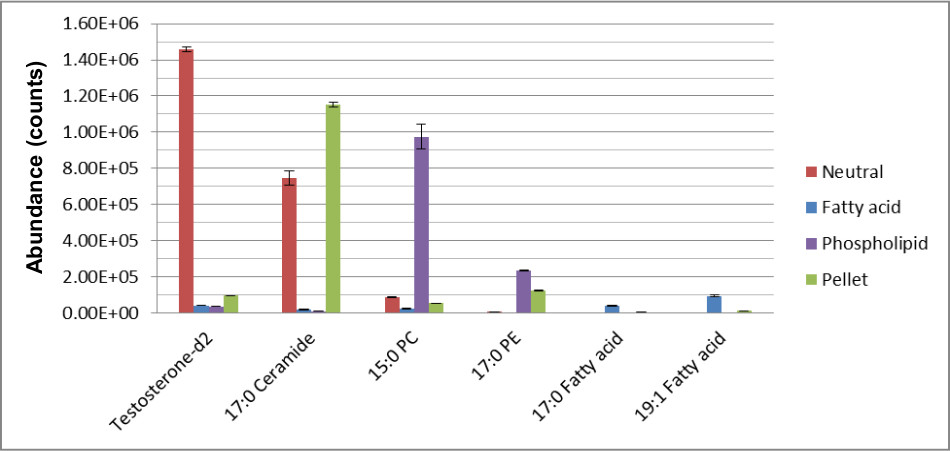
Figure 3. La reprise de ISTDS dans les fractions en utilisant la méthode du MTBE-SPE 12. L'extraction a été effectuée et les échantillons obtenus ont été séparés en utilisant RPC et analysé à l'aide LCMS en mode positif et négatif, comme décrit dans le texte. Ce chiffre a été modifié depuis Yang et al, Journal of Chromatography A 1300, 217-226 (2013).
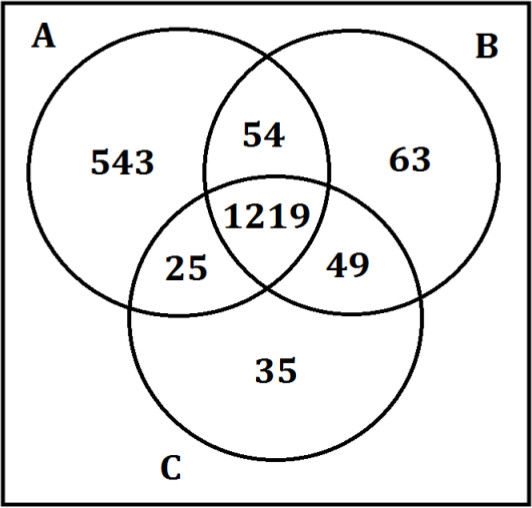
Figure 4. Réponses de la fraction de granulés préparés par trois opérateurs. Trois opérateurs de préparation des échantillons A, B, et C réalisées la même étape de préparation de protéines sur des échantillons de plasma mis en commun. Les chiffres dans le diagramme de Venn reflètent le nombre de métabolites détectés par chaque opérateur. Les opérateurs B et C à la pipette le volume requis par le protocole de préparation de l'échantillon tandis que l'opérateur A l'ensemble du surnageant à la pipette et une partie de la pastille, ce qui entraîne de plus de 500 plus de métabolites, la majorité étant des faux positifs pour cette fraction spécifique.

Figure 5. Formation de protéines au cours de culot protéique étape de précipitation <. / Strong> (A) 100 ul de plasma humain avant la préparation des échantillons, (B) le plasma après addition de glace méthanol froid; (C) culot protéique formé sur la base du tube après centrifugation à 0 ° C pendant 15 min à 18 000 x g.

Figure 6. Séparation des phases hydrophiles et hydrophobes lors de l'extraction liquide-liquide (LLE) étape. Le solvant organique l'éther de méthyle et de tert-butyle (MTBE) et de l'eau ont été utilisés pour séparer les metabolites hydrophiles et hydrophobes. La couche de MTBE a dissous les composés non-polaires et la couche d'eau a dissous les composés polaires (A) surnageant de plasma après élimination des protéines; (B). Plasma après séchage sous atmosphère d'azote, (C) le plasma après addition de MTBE; ong> (D) l'addition d'eau à du plasma et du MTBE; (E)-couche MTBE eau formée après centrifugation, (F) la suppression de la couche supérieure de MTBE; (G) principalement couche hydrophile restant après l'élimination de MTBE.
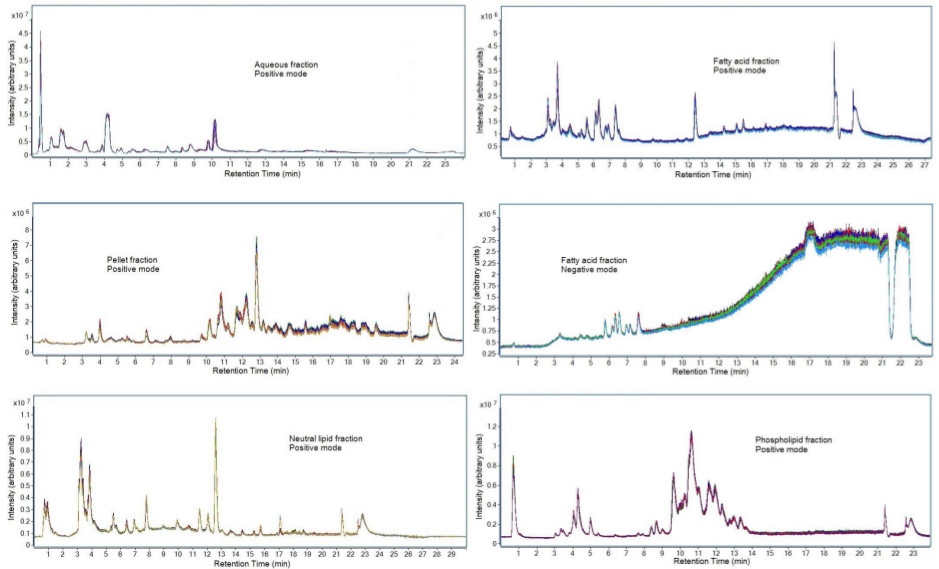
Figure 7. Chromatogrammes des fractions à partir d'un ensemble de données sélectionné Préparation de l'échantillon. Été réalisée sur trois échantillons de plasma mis en commun QC séparées et chaque échantillon a été injecté en triple exemplaire sur l'instrument LC-MS. Représentés sont chromatogrammes totaux d'ions des échantillons de plasma acquises en utilisant les paramètres LC-MS indiquées à l'article 7 du protocole de la méthode. La représentation chromatographique d'autres fluides biologiques peuvent varier en raison des différences dans la composition du métabolite.k "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Fraction | mode d'ionisation | Standard interne | n | Zone moyenne pic | Peak% CV |
| Aqueux | Positif | Créatinine-D 3 | 31 | 2217311 | 3,8% |
| Lipide neutre | Positif | Triglycérides-D 5 | 31 | 4837032 | 9,9% |
| C17 céramide | 31 | 12736707 | 7,9% | ||
| Phospholipides | Positif | 15:00 PC | 32 | 1248929 | 9,3% |
| 17:00 PE | 32 | 517234 | 7,9% |
Les résultats du contrôle de la qualité Tableau 1. Des normes internes à pointes. Des échantillons de plasma mis en commun à partir d'un ensemble de données de modèle de souris de l'emphysème ont été analysés pour surveiller les conditions de l'instrument sur une base quotidienne pour cette étude de plusieurs semaines. Un logiciel d'analyse quantitative a été utilisée pour déterminer les aires de pic des étalons internes, (n = nombre d'instruments QC injections).
| Fraction | mode d'ionisation | Métabolites endogènes | Zone moyenne pic | Peak% CV |
| Aqueux | Positif | Créatinine | 2554574 | 2,3% |
| Valine | 3712151 | 3,3% | ||
| Glucose | 2669190 | 6,9% | ||
| Lipide neutre | Positif | 3-Dehydrosphinganine | 226644 | 3,9% |
| DG (16:00 / 16:01 / 00:00) | 11301 | 8,2% | ||
| DG (P-14: 0/18: 1) | 364119 | 1,9% | ||
| Phospholipides | Positif | PC (24:0 / 0:0) | 27599 | 0,9% |
| PC16: 0/22: 6) | 2873326 | 4,5% | ||
| PI (16:00 / 18:01) | 112998 | 4,4% | ||
| acide gras | Positif | 5-10-oxo ,8-decadienoic | 1363284 | 2,3% |
| Acide 16-oxo-heptadécanoïque | 83700 | 2,9% | ||
| 2-méthyle acide valérique | 285782 | 5,7% | ||
| acide gras | Négatif | L'acide 10-hydroxy-8-octadécénoïque | 10042 | 4,9% |
| (R)-laballenic acide | 173929 | 6,5% | ||
| L'acide valérique acide 2-céto | 35488 | 6,0% |
Les résultats du contrôle de la qualité Tableau 2. Des métabolites endogènes. Échantillons de plasma en gestion commune d'un ensemble de données sur les maladies humaines ont été analysées pour surveiller la préparation des échantillons reproductibilité des jours différents. Les échantillons ont été préparés en triple sur trois jours, (n = 9 préparation QC injections).
Discussion
Un des objectifs de métabolomique clinique est d'identifier les changements dans le métabolome liée à la maladie ou des traitements. Par conséquent techniques de préparation des échantillons doivent être robustes, cohérente et transférable de technicien à technicien et d'un laboratoire à 22. Les données résultant doit être représentative de l'échantillon, et les changements identifiés doivent refléter l'échantillon plutôt que de définir les erreurs de préparation des échantillons. Par conséquent pipetage précis, bonne température, décantation efficace des couches non miscibles, séchage sous azote, et l'utilisation des mêmes marques et les tailles de la verrerie et des conseils sont nécessaires.
Au cours de l'étape de précipitation de protéine, il est essentiel que la même quantité de solution est décantée à partir de chaque pastille. Cela permet de réduire la variation de volume et en tant que tel réduit la variation dans les données d'échantillon. Cette étape de précipitation de protéine est nécessaire pour la métabolomique et ne peut pas être ignoré car il supprime la protéine à partir deles échantillons avant l'analyse de profilage petite molécule sur le spectromètre de masse. Il élimine les agents pathogènes et les grandes macromolécules, et libère lié métabolites de protéines 7. L'absence d'accumulation de la protéine dans les échantillons étend la durée de vie de la colonne HPLC et augmente la précision et la qualité des résultats. Figure 5 est une représentation du culot protéique formé lors de l'exécution de cette technique à des échantillons de plasma. Ceci permet la détection de petites molécules, augmente l'abondance d'ions, et réduit les effets de matrice de protéines dans l'échantillon. En outre, étant donné que l'on suppose que toutes les protéines sont éliminées à cette étape, les acides aminés qui sont détectées lors de l'analyse LC-MS proviendraient des changements métaboliques et non à partir de la dégradation des protéines.
L'étape d'extraction liquide-liquide est essentielle car elle sépare les metabolites hydrophiles et hydrophobes en deux couches non miscibles. Figure 6 montre la procédure LLE et un repsentation de la couche LLE. Une mauvaise séparation des deux couches en résulte métabolites étant soit perdu ou être élues dans les deux fractions. Application rigoureuse de cette étape réduit le nombre de composés hydrophiles qui apparaissent dans la fraction hydrophobe. Les résultats obtenus pour ces composés deviennent peu fiables, car il est impossible de déterminer quelle fraction contient les résultats représentatifs. Une fois fait correctement, métabolite chevauchement est réduite.
Pour éviter une dégradation par oxydation, en particulier dans les lipides, mais également en petites molécules qui peuvent contenir des groupes thiol, par exemple, l'exposition à l'oxygène doit être maintenu à un minimum. Par conséquent, cette procédure est toujours effectuée sous atmosphère d'azote afin de réduire / prévenir l'oxydation des lipides ou des composés contenant un thiol. En outre, le transfert de l'échantillon et / ou de la solution est rapide (dans la première minute) pour réduire l'exposition à l'oxygène, des échantillons sont rapidement placés sous un courant constant d'azote à sécher. Une fois séchés, ils sont immédiatementment remis en suspension dans 100% de méthanol pour les raisons ci-dessus évoquées.
Les laboratoires peuvent bénéficier de cette méthode globale dans un certain nombre de façons; Les chercheurs cherchent à isoler une classe de composés peuvent choisir la partie de la méthode qui convient le mieux à leurs besoins. Ceux qui cherchent à effectuer seulement une précipitation des protéines à obtenir un pool de métabolites peuvent le faire. Si les métabolites hydrophiles sont souhaités, tels que de nombreux produits pharmaceutiques, des acides aminés et des sucres, ou si seulement les métabolites hydrophobes sont souhaitées, telles que les triglycérides, les époxydes, les vitamines liposolubles, et les phospholipides, par exemple, les chercheurs peuvent effectuer l'extraction liquide-liquide l'étape suivante précipitation des protéines et jetez la fraction indésirable. Les enquêteurs qui ont besoin de davantage de sous-classification des composés hydrophobes (lipides neutres, des acides gras, phospholipides) et peuvent passer à l'étape de fractionnement.
Les conditions de conservation sont importantes dans maintaining de la viabilité des échantillons pour une analyse ultérieure. Si les échantillons sont stockés de manière incorrecte, la dégradation ou la décomposition peuvent se produire. Idéalement, les échantillons doivent être conservés dans des flacons ambrés de bouchon à vis loin de la lumière pour éviter la dégradation des espèces sensibles à la lumière. Les échantillons doivent être conservés congelés à -80 ° C pour éviter la dégradation de métabolite 23-25. Bien que n'étant pas décrit en détail ici, les échantillons sont toujours conservés à 4 ° C dans le plateau d'auto-échantillonneur pendant l'analyse LC-MS. Cela garantit que tous les échantillons sont maintenus à une température constante et que les variations de la température ambiante n'affectent pas la viscosité, la solubilité, la stabilité ou des échantillons. Il est recommandé que les aspects manuels de cette procédure, comme LLE et SPE, être pratiquées afin de gagner la confiance et le confort avec les étapes.
Quelques limitations existent pour cette technique. Séparation discrète des métabolites hydrophobes et hydrophiles n'est pas garanti que certains composés sera inherpartitionner ently en deux fractions en raison de leur état de composition chimique et de la charge. En outre, comme indiqué sur la figure 4, une mauvaise technique au cours de l'étape d'extraction des protéines de granule peut entraîner une mauvaise reproductibilité des métabolites dans les deux échantillons et des contrôles de qualité. Cela affecte les statistiques, en particulier dans les petits jeux de données parce que la puissance statistique n'est pas disponible. Il est donc crucial que cette étape sera effectuée exactement au même moment chaque pour chaque échantillon. Une autre limite est le temps. Bien qu'il existe des points d'arrêt tout au long de ce protocole où les échantillons peuvent être congelés et la préparation a continué le lendemain, une journée entière devrait être mis de côté pour effectuer cette procédure. En troisième lieu, et non pas chaque composé au sein d'un échantillon biologique peut être évalué pour la suppression d'ions. Comme il n'est pas possible d'identifier la façon dont la matrice affecte chaque metabolite particulier, l'option courante est d'évaluer les étalons internes qui miment théoriquement certaines classes de endogenous métabolites. Enfin, les identifications absolus ne peuvent pas être effectués exclusivement avec cette méthode. Tandem MS en collaboration avec les recherches et les normes de base de données sont nécessaires pour l'identification des métabolites absolue.
Une partie importante de la métabolomique est l'identification des composés. Bien que n'étant pas décrit en détail ici, les échantillons de contrôle de qualité ont été analysés par LC-MS. Plusieurs ébauches de préparation des échantillons et des blancs de l'appareil ont été préparés pour servir de fond soustraction de réduire le taux de faux positifs de contaminants, ce qui entraîne dans les coups de métabolites plus fiables. Après cette étape, le nombre de «caractéristiques moléculaires" ont été regroupés en fonction de m / z, temps de rétention, rapport isotopique, et des produits d'addition pour produire une liste de composés réels. Bien que la liste des composés a été considérablement réduit, les résultats sont plus fiables car ils ne sont pas fondées sur plusieurs produits d'addition de la même composé. La méthode complète est complet et permet isolation de métabolites hydrophobes tels que des lipides neutres, des phospholipides, des acides gras, des triglycérides, et les stéroïdes, tout en isolant également les classes hydrophiles dans la fraction aqueuse, dont les eicosanoïdes, les sucres, les flavonoïdes et les acides aminés ont été identifiés 12, 26.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Le tutoriel présenté a été réalisé et développé dans le Core Facility spectrométrie de masse de Santé national juif. L'installation NJH MS est financé en partie par le CCSTI UL1 TR000154. Le financement de subventions des NIH P20 HL-113445 et R01 HL-095432 également soutenu ce travail.
matériels
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Fisher Scientific | A955-4 | |
| Methanol | Fisher Scientific | L-6815 | |
| Chloroform | Fisher Scientific | C606-1 | |
| Hexane | Sigma Aldrich | 34859 | |
| Acetic acid | Sigma Aldrich | 49199-50ML-F | |
| Methyl tert-butyl ether | J.T. Baker | 9042-03 | |
| Isopropyl alcohol | Sigma Aldrich | 34965-2.5L | |
| Water | Honeywell Burdick Jackson | 365-4 | |
| OA-SYS heating system | Organomation Associates, Inc | Used to keep samples under a constant flow of nitrogen while at 35 °C | |
| 12-position vacuum manifold | Phenomenex | ||
| Strata NH2 (55 µM, 70Å) 100 mg/ml SPE cartridges | Phenomenex | 8B-S009-EAK | |
| Glass pipette tips | Fisher Scientific | 13-678-20C | Used to transfer sample to SPE column |
| Plastic pipette tips | USA Scientific | 1182-1830 | Used when glass tips are not necessary |
| Microcentrifuge tubes | Fisher Scientific | 02-681-320 | |
| Graduated glass pipets | Fisher Scientific | 13-678-27B | Used to transfer organic solvents during sample prep |
| Pyrex glass culture tubes | Corning Incorporated | 99499-16X | Used to store aqueous and lipid fractions until the next step |
| Autosampler vials | Agilent Technologies | 5182-0545 | |
| Snap cap vials for autosampler vials | Agilent Technologies | 5182-0541 | |
| Glass inserts | Agilent Technologies | 5183-2085 | Used for small sample volumes |
| Mass Hunter Qualitative Analysis software | Agilent Technologies | Version B.06.00 | Used to monitor retention times and pressure curves |
| Mass Hunter Quantitative Analysis software | Agilent Technologies | Version B.05.02 | Used to analyze quality control and sample data |
| Mass Profiler Professional software | Agilent Technologies | Version B.12.50 | Used to determine statistics, fold changes, and perform metabolite identification |
Références
- Beckonert, O., et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nature Protocols. 2, 2692-2703 (2007).
- Clarke, C. J., Haselden, J. N. Metabolic Profiling as a Tool for Understanding Mechanisms of Toxicity. Toxicologic Pathology. 36, 140-147 (2008).
- Wang, X., Zhang, A., Sun, H. Power of Metabolomics in Diagnosis and Biomarker Discovery of Hepatocellular Carcinoma. Hepatology. 57, 2072-2077 (2013).
- Collino, S., Martin, F. -. P. J., Kochhar, S., Rezzi, S. Monitoring Healthy Metabolic Trajectories with Nutritional Metabonomics. Nutrients. 1, 101-110 (2009).
- Cevallos-Cevallos, J. M., Reyes-De-Corcuera, J. I., Etxeberria, E., Danyluk, M. D., Rodrick, G. E. Metabolomic analysis in food science: a review. Trends in Food Scienc., & Technology. 20, 557-566 (2009).
- Nicholson, J. K., Connelly, J., Lindon, J. C., Holmes, E. Metabonomics: a platform for studying drug toxicity and gene function. Nature reviews. Drug Discovery. 1, 153-161 (2002).
- Wishart, D., et al. . Metabolome Analysis: An Introduction. , 253-288 (2006).
- Vuckovic, D. Current trends and challenges in sample preparation for global metabolomics using liquid chromatography–mass spectrometry. Analytical and Bioanalytical Chemistry. 403, 1523-1548 (2012).
- Bollard, M. E., Stanley, E. G., Lindon, J. C., Nicholson, J. K., Holmes, E. NMR-based metabonomic approaches for evaluating physiological influences on biofluid composition. NMR in Biomedicine. 18, 143-162 (2005).
- Dong, M. W. . Modern HPLC for Practicing Scientists. , (2006).
- Want, E. J., et al. Solvent-dependent metabolite distribution, clustering, and protein extraction for serum profiling with mass spectrometry. Analytical Chemistry. 78, 743-752 (2006).
- Yang, Y., et al. New sample preparation approach for mass spectrometry-based profiling of plasma results in improved coverage of metabolome. Journal of Chromatography A. 1300, 217-226 (2013).
- Folch, J., Lees, M., Stanley, G. H. S. A simple method for the isolation and purification of total lipides from animal tissues. The Journal of Biological Chemistry. 226, 497-509 (1957).
- Matyash, V., Liebisch, G., Kurzchalia, T. V., Shevchenko, A., Schwudke, D. Lipid extraction by methyl-tert-butyl ether for high-throughput lipidomics. Journal of Lipid Research. 49, 1137-1146 (2008).
- Bligh, E. G., Dyer, W. J. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology. 37, 911-917 (1957).
- Ferreiro-Vera, C., Priego-Capote, F., Luque de Castro, M. D. Comparison of sample preparation approaches for phospholipids profiling in human serum by liquid chromatography–tandem mass spectrometry. Journal of Chromatography A. 1240, 21-28 (2012).
- Michopoulos, F., Lai, L., Gika, H., Theodoridis, G., Wilson, I. UPLC-MS-Based Analysis of Human Plasma for Metabonomics Using Solvent Precipitation or Solid Phase Extraction. Journal of Proteome Research. 8, 2114-2121 (2009).
- Kerns, E. H., Di, L. . Drug-like Properties: Concepts, Structure Design and Methods: from ADME to toxicity optimization. First edn. , (2008).
- Manach, C., Scalbert, A., Morand, C., Rémésy, C., Jiménez, L. Polyphenols: food sources and bioavailability. American Journal of Clinical Nutrition. 79, 727-747 (2004).
- Weimer, J. M., Kriscenski-Perry, E., Elshatory, Y., Pearce, D. A. The neuronal ceroid lipofuscinoses. Mutations in different proteins result in similar disease. NeuroMolecular Medicine. 1, 111-124 (2002).
- Schulze, H., Sandhoff, K. Lysosomal lipid storage diseases. Cold Spring Harbor Perspectives in Biology. 3, (2011).
- Kuhn, E., et al. Interlaboratory evaluation of automated, multiplexed peptide immunoaffinity enrichment coupled to multiple reaction monitoring mass spectrometry for quantifying proteins in plasma. Molecular and Cellular Proteomics. 11, (2012).
- Rist, M. J., et al. Influence of Freezing and Storage Procedure on Human Urine Samples in NMR-Based Metabolomics. Metabolites. 3, 243-258 (2013).
- Boomsma, F., Alberts, G., van Eijk, L., Manin‘t Veld, A. J., Schalekamp, M. A. Optimal Collection and Storage Conditions for Catecholamine Measurements in Human Plasma and Urine. Clinical Chemistry. 39, 2503-2508 (1993).
- Wood, J. T., et al. Comprehensive profiling of the human circulating endocannabinoid metabolome: clinical sampling and sample storage parameters. Clinical Chemistry and Laboratory. 46, 1289-1295 (2008).
- Bahr, T. M., et al. Peripheral blood mononuclear cell gene expression in chronic obstructive pulmonary disease. American Journal of Respiratory Cell and Molecular Biology. 49, 316-323 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon