A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידה של קצב חילוף החומרים ב
In This Article
Summary
הפרעות מטבוליות הן בין אחת המחלות הנפוצות ביותר בבני אדם. אורגניזם המודל גנטי הצייתן ד melanogaster יכול לשמש כדי לזהות גנים רומן שמווסתים את חילוף חומרים. מאמר זה מתאר שיטה פשוטה יחסית המאפשרת ללמוד את קצב חילוף חומרים בזבובים על ידי מדידת ייצור CO 2 שלהם.
Abstract
הפרעות מטבוליות הן בעיה שכיחה המשפיעה על בריאות אדם. לכן, הבנת המנגנונים המווסתים את חילוף חומרים היא משימה מדעית חשובה. יש גנים מחלה גורמת רבים בבני האדם homologue לטוס, מה שהופך את דרוזופילה מודל טוב ללמוד מסלולי איתות מעורבים בהתפתחות של הפרעות שונות. בנוסף, העקיבות של דרוזופילה מפשטת מסכי גנטיים כדי לסייע בזיהוי מטרות טיפוליות חדשניות שעשויים לווסת את חילוף החומרים. על מנת לבצע מסך כזה שיטה פשוטה ומהירה לזיהוי שינויים במצב מטבולים של זבובים היא הכרחית. באופן כללי, ייצור פחמן דו חמצני הוא אינדיקטור טוב של הוצאה חמצון המצע והאנרגיה מתן מידע על מצב מטבולים. בפרוטוקול זה אנו מציגים שיטה פשוטה למדידת CO 2 פלט מזבובים. טכניקה זו יכולה באופן פוטנציאלי לסייע בזיהוי של הפרעות גנטיות המשפיעות על קצב חילוף חומרים.
Introduction
המחזור של Kreb יוכימיים מייצר ATP באמצעות החמצון של אצטט נגזרים מפחמימות, שומנים, חלבונים וייצור CO 2. בדרוזופילה, O 2 קלט בקורלציה ישירה עם CO 2 פלט ומשקף את רמת חילוף החומרים 1. לכן, מדידה של CO פלט 2 בהצלחה נעשתה שימוש במחקרים הקשורים להזדקנות ואת חילוף חומרים של 2-5. הנה המעבדה שלנו שינתה הגדרות ניסיוניות תוכננו בעבר, המאפשרת מדידה של 2 CO בייצור עד שמונה עשר דגימות ללא צורך בציוד מיוחד. אחרים ויש לנו השתמשנו בעבר בשיטה זו כדי להראות הבדלים בקצב חילוף חומרים בזבובים שחסרים בחלבון ניוון השרירים קשור, Dystroglycan (DG) 6-8.
O 2 המשמשים לחילוף חומרי חמצוני מומר CO 2, אשר גורש כפסולת בדרכי הנשימה. Construction של respirometers יד מתואר המאפשר לקביעת שיעור O 2 נצרכים. זבובים ממוקמים במכל אטום בחומר שסופג גורש CO 2, ביעילות לחסל אותו ממצב צבירת הגזים. השינוי בנפח גז (לחץ ירד) נמדד על ידי העקירה של נוזל בנימי זכוכית מחוברת לrespirometer הסגור.
היתרון העיקרי של שיטה זו על פני אחרים הוא העלות. מחקרים קודמים נמדדו CO 2 על ידי ייצור דרוזופילה באמצעות גז מנתחי מערכות וrespirometry טכני מתקדמות 1,9. למרות הציוד המורכב יותר, הרגישות של השיטה המתוארת כאן היא דומה לערכים מדווחים (טבלה 1). בנוסף, מספר קבוצות אחרות השתמשו וריאציות של טכניקה זו על מנת לקבוע את קצב חילוף חומרים יחסית בדרוזופילה 4-6. לכן, assay זה יכול לשמש כדי ליצור reliable, נתונים לשחזור רלוונטיים לחילוף חומרי דרוזופילה ללא רכישת ציוד מיוחד אשר יכולה להיות התקנה בכל מעבדה וניתן להשתמש בם למטרות חינוכיות.
באופן כללי, הטכניקות המקובלות לקבוע את חילוף החומרים של אורגניזם היא למדוד את ה-CO 2 המיוצרים, O 2 צרכו, או שניהם 3,4,9. אמנם, ניתן להניח כי שווה ערך אחד O 2 מייצר שווה ערך אחד של CO 2, היחס המדויק של CO 2 שנוצר תלוי במצע חילוף החומרים מנוצלים 10. לפיכך, על מנת לקבוע את קצב חילוף חומרים ביחידות אנרגיה בצורה מדויקת יש צורך למדוד גם O 2 ו-CO 2 צרך הפיק. בשל כך, בשיטה המתוארת כאן היא דווקא רלוונטית להשוואת הבדלים בCO 2 ייצור בין בעלי חיים ולא הערך המוחלט. הטכניקה שלנו משלבת ייצור CO 2 של בעלי חיים רבים על פני תקופה של timדואר (1-2 שעות) ולכן חוזרת ממוצעת של פעילותם של בעלי החיים. אם יש סיבה להאמין שחיות ניסוי הן פחות פעילה מאשר חיות בקרת המדידה יכולה לשקף את הרמות שונות של פעילות ולא בהכרח חילוף חומרים.
Protocol
1. הכנת Respirometers
- חותכים את קצה פיפטה 1,000 μl בסכין גילוח כדי לאפשר החדרה של micropipette נימי 50 μl, לנסות להשיג את קצה פיפטה ישרה ככל האפשר.
- מניחים פיסת הקצף לתוך פיפטה ולדחוף אותו בקצה פיפטה.
- להוסיף כמות קטנה של CO 2 סופגים ולהכיל אותו על ידי פיסת הקצף שנייה.
- החל דבק במקום שבו micropipette מוכנס לתוך קצה פיפטה.
- השאר את respirometer לילה כדי לאפשר לדבק להתייבש.
סכמטי של respirometer מוצג באיור 1 א.
2. הכנה של לשכת המדידה
- הכן את פתרון התא על ידי ערבוב מים עם eosin ביחס שיגרום לצביעה נראית לעין.
- יוצקים את פתרון eosin / מים לתוך התא.
- לייבל אחד הצדדים של החדר עם סולם סנטימטר.
= "Jove_title"> ילדה 3. הצבת זבובים לRespirometers
- תווית respirometers הבודד עם סמן.
- הרדימי זבובים באמצעות שיטה חלופית ל-CO 2 ומקום 3-5 זבובים של הגנוטיפ הרצוי בתוך כל respirometer.
- לאטום respirometers בחוזקה בראש באמצעות שפכטל פלסטלינה.
- לאפשר זבובים להתאושש מהרדמה כ 15 דקות.
- הכן respirometer אחד בלי זבובים, אשר ישמש כשליטה באטמוספרה.
4. ביצוע הניסוי
- לתלות את respirometers בתא על ידי הצמדת בעל צינור Eppendorf 1.5 מיליליטר כי הוא פתוח בחלק העליון והחלק התחתון בחלק העליון של החדר.
- הכנס respirometers עם קצה micropipette למטה לתוך התא המאפשר את הקצה לצלול לתוך התמיסה בצבע.
- הוספת זלין בין כיסוי המכסה והקאמרי כדי לספק בידוד חזק יותר מfluct הטמפרטורה והלחץuations.
- סגור את המכסה ולאפשר למערכת כדי לאזן במשך 15 דקות.
- קח את תמונה של החדר ולוודא כי רמת הנוזל בתוך כל micropipette גלויה וכך גם בקנה מידה (ראה דוגמא שמוצגת באיור 1 ב ').
- לאחר 1-2 hr, לצלם תמונה נוספת.
- כאשר הניסוי נגמר, להסיר את הזבובים מrespirometers ולשקול אם תרצה בכך או להעביר אותם בחזרה לבקבוקון במידת צורך נוסף.
5. ניתוח התוצאות
- פתוח רכש תמונות באמצעות תוכנת ImageJ 11.
- תוך שימוש בסולם בכל תמונה, להגדיר את קנה המידה פיקסל בתוכנה.
- מדוד את המרחק (Δd) כי הנוזל נסע מנקודת התייחסות נחושה בתמונות שצולמו בתחילת (ד 1) וסופו של הניסוי (D2). דוגמא סכמטית מוצגת באיור 1 ג.
- לחשב את כמות מיוצר CO 2 (μl / שעה / זבוב) עם הנוסחה:
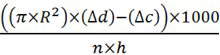
R = רדיוס של צינור micropipette בסנטימטרים
Δd = מרחק הנוזל עבר בmicropipette של דגימות בדיקה נמדד בסנטימטרים
Δc = מרחק הנוזל עבר בmicropipette של מדגם הביקורת השלילית (בלי זבובים)
n = מספר הזבובים המשמשים
= H שעות
תוצאות
על מנת להראות כי השיטה היא רגישה מדדנו CO 2 ייצור מסוג בר (אורגון R) זכר עף ב18, 25, ו29 מעלות צלזיוס וזבובים שעברו מוטציה לDG. זבובים הועלו ב ° C25 ולאחר מכן עברו לטמפרטורה הניסיונית במשך 5 ימים לפני המדידה. כצפוי למיני ectothermic זה, כמות ה-CO 2 המיוצרת גדל עם טמפ...
Discussion
בפרוטוקול זה, אנו מתארים שיטה זולה ואמינה למדידת 2 ייצור CO בזבובים. מצאנו כי ניסוי זה הוא קל, מהיר לביצוע ומייצר נתונים לשחזור כי הוא בהסכם עם מחקרים אחרים 1, 6, 9. הפרוטוקול המתואר כאן ניתן לשנות בקלות כדי להתאים את חומרי התקציב וזמין של כל מעבדה. הבנייה של כל ...
Disclosures
יש לנו מה למסור.
Acknowledgements
ברצוננו להודות לאגודת מקס פלנק למימון המחקר שלנו.
Materials
| Name | Company | Catalog Number | Comments |
| BlauBrand IntraMark 50 µl micropipettes | VWR | 612-1413 | |
| Soda Lime | Wako | CDN6847 | |
| Eosine | Sigma | 031M4359 | Any dye that can create visible colorization of liquid can be used |
| Thin Layer Chromatorgaphy (TLC) Developing Chamber | VWR | 21432-761 | Any transparent glass chamber that can be closed with the lid |
| Anesthetizer, Lull-A-Fly Kit | Flinn | FB1438 | |
| Power Gel Glue | Pritt | ||
| 1 ml pipett tips | Any | ||
| Foam | Any | ||
| Plaesticine Putty | Any | ||
| Scalpel | Any | ||
| Tweezers | Any |
References
- Van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Testing the "rate of living" model: further evidence that longevity and metabolic rate are not inversely correlated in Drosophila melanogaster. J Appl Physiol. 97, 1915-1922 (2004).
- Ross, R. E. Age-specific decrease in aerobic efficiency associated with increase in oxygen free radical production in Drosophila melanogaster. Journal of Insect Physiology. 46, 1477-1480 (2000).
- van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Selected contribution: long-lived Drosophila melanogaster. lines exhibit normal metabolic rates. J Appl Physiol. 95, 2605-2613 (2003).
- Hulbert, A. J., et al. Metabolic rate is not reduced by dietary-restriction or by lowered insulin/IGF-1 signalling and is not correlated with individual lifespan in Drosophila melanogaster. Experimental Gerontology. 39, 1137-1143 (2004).
- Ueno, T., Tomita, J., Kume, S., Kume, K. Dopamine modulates metabolic rate and temperature sensitivity in Drosophila melanogaster. PLoS ONE. 7, (2012).
- Takeuchi, K., et al. Changes in temperature preferences and energy homeostasis in dystroglycan mutants. Science. 323, 1740-1743 (2009).
- Kucherenko, M. M., Marrone, A. K., Rishko, V. M., Magliarelli Hde, F., Shcherbata, H. R. Stress and muscular dystrophy: a genetic screen for dystroglycan and dystrophin interactors in Drosophila. identifies cellular stress response components. Developmental Biology. 352, 228-242 (2011).
- Marrone, A. K., Kucherenko, M. M., Wiek, R., Gopfert, M. C., Shcherbata, H. R. Hyperthermic seizures and aberrant cellular homeostasis in Drosophila dystrophic. muscles. Scientific Reports. 1, 47 (2011).
- Khazaeli, A. A., Van Voorhies, W., Curtsinger, J. W. Longevity and metabolism in Drosophila melanogaster: genetic correlations between life span and age-specific metabolic rate in populations artificially selected for long life. Genetics. 169, 231-242 (2005).
- Elia, M. Energy equivalents of CO2 and their importance in assessing energy expenditure when using tracer techniques. The American Journal of Physiology. 260, (1991).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Bharucha, K. N. The epicurean fly: using Drosophila melanogaster. to study metabolism. Pediatric Research. 65, 132-137 (2009).
- Rajan, A., Perrimon, N. Of flies and men: insights on organismal metabolism from fruit flies. BMC Biology. 11, 38 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved