Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Metabolik Oranı Ölçümü
Bu Makalede
Özet
Metabolik bozukluklar, insanlarda en yaygın hastalıklardan biri arasında yer alıyor. Genetik uysal bir model organizma D. melanogaster metabolizmasını düzenleyen yeni genleri tanımlamak için kullanılabilir. Bu çalışma da CO 2 üretimini ölçerek sinekler metabolizma hızı okuyan sağlayan nispeten basit bir yöntem tarif etmektedir.
Özet
Metabolik bozukluklar, insan sağlığını etkileyen sık görülen bir problemdir. Bu nedenle, metabolizmayı düzenleyen mekanizmaları anlamak çok önemli bilimsel bir iştir. İnsanlarda birçok hastalığa neden olan genler Drosophila farklı hastalıkların gelişiminde rol sinyal yolları incelemek için iyi bir model yapma, bir sinek homologunu var. Buna ek olarak, Drosophila tractability metabolizmasını düzenleyen yönelik yeni terapötik hedeflerin belirlenmesine yardımcı olması için genetik ekranlar kolaylaştırır. Bu türdeki bir süzgeçle gerçekleştirmek için sinekler metabolik durum değişiklikleri belirlemek için basit ve hızlı bir yöntem gereklidir. Genel olarak, karbon dioksit üretim substrat oksidasyon ve enerji harcaması, metabolik durumu hakkında bilgi veren iyi bir göstergedir. Bu protokolde sinekler CO 2 çıkışını ölçmek için basit bir yöntem tanıtmak. Bu teknik potansiyel metabolik hızını etkileyen genetik pertürbasyonların belirlenmesinde yardımcı olabilir.
Giriş
Biyokimyasal Krebs döngüsü karbonhidratlar, yağlar, ve CO2 üretimi proteinlerden türetilen asetat oksidasyonu ile ATP üretir. Drosophila, O 2 giriş, doğrudan CO 2 çıkışı ile ilişkilidir ve metabolizma 1 düzeyini yansıtır. Bu durumda, CO2 çıkışının ölçümü başarılı yaşlanma ve metabolizma 2-5 ile ilgili çalışmalarda kullanılmıştır. İşte laboratuar herhangi bir özel ekipman gerektirmeden kadar onsekiz örneklerinde CO 2 üretimi ölçümü sağlayan, önceden tasarlanmış deney düzeneklerini değiştirdi. Diğerleri ve daha önce müsküler distrofi ilişkili protein, distroglikan (DG) 6-8 eksiktir sinekler metabolik oranlarındaki farklılıkları göstermek için bu yöntemi kullandık.
O oksidatif metabolizma için kullanılan 2 solunum atık olarak atılır CO 2, dönüştürülür. Inşaatel yapımı respirometers tion of O 2 tüketilen oranının belirlenmesi için izin veren tarif edilmektedir. Sinekler verimli gaz fazdan ortadan kaldırarak, CO2 absorbe sürülen bir madde ile kapalı bir kap içine yerleştirilir. Gaz hacmi (azalan basınç) içindeki değişiklik kapalı respirometredeki bağlı bir cam kılcal sıvı değiştirmesi ile ölçülür.
Diğerleri üzerinde bu tekniğin önemli avantajı maliyetidir. Önceki çalışmalar gaz analizörleri ve teknik olarak gelişmiş Respirometrik sistemlerini 1,9 kullanarak Drosophila CO 2 üretimini ölçtük. Daha karmaşık ekipman rağmen, burada tarif edilen yöntemin duyarlılığı rapor edilen değerlere (Tablo 1) benzer. Ayrıca, çeşitli gruplar Drosophila 4-6 göreceli metabolik oranlarını belirlemek için bu tekniğin varyasyonları kullandık. Bu nedenle, bu deney, reliab oluşturmak için kullanılabilirle, herhangi bir laboratuarda kurulum olabilir ve eğitim amaçlı kullanılabilecek özel ekipman alımı olmadan Drosophila metabolizması ile ilgili tekrarlanabilir veri.
Genel olarak, bir organizmanın metabolizmasını belirlemek için kabul edilen teknikler CO2 üretilen ölçmek için, tüketilen O 2, 3,4,9 ya da her ikisi. Olsa da, O 2 bir eşdeğer CO 2 bir eşdeğer oluşturur varsayılabilir, CO 2'nin tam oranı, üretilen 10, kullanılan alt-tabaka metabolik bağlıdır. Bu nedenle, doğru bir enerji birimi metabolik oranını belirlemek it O 2 tüketilen ve CO2 üretilen iki ölçmek gereklidir. Bu nedenle, burada tarif edilen yöntem, hayvanlara olup mutlak değeri arasındaki CO2 üretimi farklılıkların karşılaştırılması için özel olarak uygundur. Bizim teknik tim bir süre içinde birden fazla hayvan CO2 üretimi entegreBu nedenle e (1-2 saat) ve hayvanların aktivitesinin bir ortalamasını verir. Deney hayvanları ölçümü farklı aktivite düzeyleri ve ille metabolizmasını yansıtan olabilir kontrol hayvanlara göre daha az aktif olduğuna inanmak için bir neden varsa.
Protokol
Respirometers 1. Hazırlanması
- 50 ul kılcal mikropipet sokulmasına izin verecek şekilde bir jilet ile 1000 ul pipet Kes, mümkün olduğunca düz pipet almaya çalışın.
- Pipet içine köpük bir parça koyun ve pipet aşağı itin.
- CO emici 2 küçük bir miktar ilave edin ve bir köpük ikinci bir parça içermesi.
- Mikropipet pipet ucu sokulur yerde yapıştırıcı uygulanır.
- Tutkal kuruması için bir gecede respirometredeki bırakın.
Bir respirometredeki şematik Şekil 1A'da gösterilmiştir.
Ölçüm Odası 2. Hazırlanması
- Görünür bir renklendirme neden olur bir oranda eosin ile su karıştırılarak oda çözelti hazırlayın.
- Bölmenin içine eosin / su çözeltisi dökün.
- Bir santimetre ölçekli bölmenin iki biri etiketleyin.
3. Respirometers içine Sinekler yerleştirme
- Bir işaretleyici ile bireysel respirometers etiketleyin.
- 2 CO ve her respirometredeki içindeki istenen genotip 3-5 sinekleri yerleştirmek için alternatif bir yöntem kullanarak sinek anestezisi.
- Mumlu macunu kullanmanızı sıkıca üstündeki respirometers mühür.
- Sinekler, yaklaşık 15 dakika boyunca anesthetization kurtarmak için izin verin.
- Atmosferik kontrol olarak kullanılacak olan, sinekler olmadan tek solunumu hazırlayın.
4.. Experiment Sahne
- Odasının üstündeki üst ve alt açık olan bir 1.5 ml Eppendorf tüp tutucu takılarak odası içindeki respirometers asın.
- Aşağı ucu renkli bir çözelti içine daldırın izin bölmenin içine mikro pipet ile respirometers yerleştirin.
- Sıcaklık ve basınç fluct daha güçlü izolasyon sağlamak için kapak örtüsü ve odası arasında vazelin eklekarışma-sının önlenmesidir.
- Kapağı kapatın ve sistem 15 dakika boyunca dengelenmeye bırakın.
- Her mikropipet içerisindeki sıvının seviyesi görünür olduğundan emin odasının bir fotoğraf çekmek ve böylece ölçek (Şekil 1B gösterildiği örneğe bakınız).
- 1-2 saat sonra, başka resim çekmek.
- Deney bittiğinde, respirometers gelen sinekler kaldırmak ve istenirse tartmak ya da daha fazla gerekirse flakon onları geri aktarın.
Sonuçlar 5. Analizi
- Açık ImageJ yazılımı 11 kullanarak görüntüleri satın aldı.
- Her resimde ölçeği kullanılarak, yazılım piksel ölçekleme ayarlayın.
- Sıvı başında (d1) alınan görüntülerde belirlenen referans noktaya gitti ki mesafeyi (Δd) ve deney sonu (d2) ölçün. Şematik bir örnek, Şekil 1C 'de gösterilmiştir.
- Formül üretilen CO2 (ul / saat / sinek) miktarını hesaplayın:
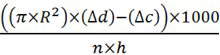
Santimetre mikropipet borunun yarıçapı R =
Δd = mesafe sıvı santimetre ölçülen test numunelerinin mikropipet kadar taşındı
Δc = mesafe sıvı (sinekler olmayan) negatif kontrol numunesinin Mikropipet içine taşındı
kullanılan sinek n =
h = saat
Sonuçlar
Yöntem, yaban tip (Oregon R) CO 2 üretimini erkek, 18, 25 uçar ve 29 ° C ve Dg için mutantını uçan ölçülen duyarlı olduğunu göstermek için. Sinekler 25 ° C yükseltilmiş ve daha sonra ölçümden önce 5 gün boyunca deney sıcaklığına kadar kaydırılmıştır. Bu ectothermic türler için beklendiği gibi, CO2 miktarı sıcaklığında (Şekil 2) ile artış üretti. Biz geçmişte şekersiz diyet hem vahşi tip metabolik hızı azaltı...
Tartışmalar
Bu protokol, biz sinekler CO 2 üretimini ölçmek için ucuz ve güvenilir bir yöntem açıklanmaktadır. Biz bu deney yapmak için hızlı, kolay ve diğer çalışmalar 1, 6, 9 ile uyum içinde olan tekrarlanabilir verilerini oluşturur bulundu. Burada özetlenen protokol kolayca herhangi bir laboratuvarın bütçe ve mevcut materyalleri uyacak şekilde modifiye edilebilir. Her bir respirometredeki inşaat sürece odacık hava geçirmez olarak kalır uyarlanabilir. Ancak, daha uzun, daha ince m...
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Biz araştırma için fon Max-Planck Toplum teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BlauBrand IntraMark 50 µl micropipettes | VWR | 612-1413 | |
| Soda Lime | Wako | CDN6847 | |
| Eosine | Sigma | 031M4359 | Any dye that can create visible colorization of liquid can be used |
| Thin Layer Chromatorgaphy (TLC) Developing Chamber | VWR | 21432-761 | Any transparent glass chamber that can be closed with the lid |
| Anesthetizer, Lull-A-Fly Kit | Flinn | FB1438 | |
| Power Gel Glue | Pritt | ||
| 1 ml pipett tips | Any | ||
| Foam | Any | ||
| Plaesticine Putty | Any | ||
| Scalpel | Any | ||
| Tweezers | Any |
Referanslar
- Van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Testing the "rate of living" model: further evidence that longevity and metabolic rate are not inversely correlated in Drosophila melanogaster. J Appl Physiol. 97, 1915-1922 (2004).
- Ross, R. E. Age-specific decrease in aerobic efficiency associated with increase in oxygen free radical production in Drosophila melanogaster. Journal of Insect Physiology. 46, 1477-1480 (2000).
- van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Selected contribution: long-lived Drosophila melanogaster. lines exhibit normal metabolic rates. J Appl Physiol. 95, 2605-2613 (2003).
- Hulbert, A. J., et al. Metabolic rate is not reduced by dietary-restriction or by lowered insulin/IGF-1 signalling and is not correlated with individual lifespan in Drosophila melanogaster. Experimental Gerontology. 39, 1137-1143 (2004).
- Ueno, T., Tomita, J., Kume, S., Kume, K. Dopamine modulates metabolic rate and temperature sensitivity in Drosophila melanogaster. PLoS ONE. 7, (2012).
- Takeuchi, K., et al. Changes in temperature preferences and energy homeostasis in dystroglycan mutants. Science. 323, 1740-1743 (2009).
- Kucherenko, M. M., Marrone, A. K., Rishko, V. M., Magliarelli Hde, F., Shcherbata, H. R. Stress and muscular dystrophy: a genetic screen for dystroglycan and dystrophin interactors in Drosophila. identifies cellular stress response components. Developmental Biology. 352, 228-242 (2011).
- Marrone, A. K., Kucherenko, M. M., Wiek, R., Gopfert, M. C., Shcherbata, H. R. Hyperthermic seizures and aberrant cellular homeostasis in Drosophila dystrophic. muscles. Scientific Reports. 1, 47 (2011).
- Khazaeli, A. A., Van Voorhies, W., Curtsinger, J. W. Longevity and metabolism in Drosophila melanogaster: genetic correlations between life span and age-specific metabolic rate in populations artificially selected for long life. Genetics. 169, 231-242 (2005).
- Elia, M. Energy equivalents of CO2 and their importance in assessing energy expenditure when using tracer techniques. The American Journal of Physiology. 260, (1991).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Bharucha, K. N. The epicurean fly: using Drosophila melanogaster. to study metabolism. Pediatric Research. 65, 132-137 (2009).
- Rajan, A., Perrimon, N. Of flies and men: insights on organismal metabolism from fruit flies. BMC Biology. 11, 38 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır