Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение скорости обмена веществ в
В этой статье
Резюме
Нарушения обмена веществ являются одним одним из наиболее распространенных заболеваний у людей. Генетически послушный модель организма Д. MELANOGASTER могут быть использованы для идентификации новых генов, которые регулируют обмен веществ. Эта статья описывает относительно простой метод, который позволяет изучать скорость метаболизма у мух путем измерения их производство CO 2.
Аннотация
Нарушения обмена веществ часто являются проблемой, затрагивающей здоровье человека. Таким образом, понимание механизмов, которые регулируют обмен веществ является одним из важнейших научной задачей. Многие гены болезнетворные у человека есть летать гомолог, что делает дрозофилы хорошей моделью для изучения сигнальных путей, участвующих в развитии различных заболеваний. Кроме того, уступчивость дрозофилы упрощает генетические экраны, чтобы помочь в идентификации новых терапевтических целей, которые могут регулировать обмен веществ. Для того чтобы выполнить такой экран простой и быстрый способ для идентификации изменения в метаболического состояния мух необходимо. В целом, производство углекислого газа является хорошим показателем расходы субстрат окисления и энергии предоставляя информацию о метаболического состояния. В этом протоколе введем простой метод для измерения CO 2 выхода от мух. Этот метод может потенциально помочь в идентификации генетических возмущений, влияющих на скорость метаболизма.
Введение
Цикл биохимических Кребса генерирует АТФ за счет окисления ацетата, полученного из углеводов, жиров и белков, производящих CO 2. У дрозофилы O 2 вход непосредственно коррелирует с CO 2 выхода, и отражает уровень обмена веществ 1. Таким образом, измерение CO 2 выхода успешно применяется в исследованиях, связанных со старением и метаболизма 2-5. Здесь наша лаборатория изменение ранее разработанные экспериментальные установки, что позволяет измерять CO 2 производства в до восемнадцати проб, не требуя никакого специального оборудования. Другие и мы ранее использовали этот метод, чтобы показать различия в скорости метаболизма в мух, которые испытывают дефицит мышечной дистрофии, связанной белка, дистрогликана (DG) 6-8.
O 2 используется для окислительного метаболизма преобразуется в CO 2, который выбрасывается в качестве дыхательного отходов. Строительции ручной респирометров описано, что позволяет для определения скорости O 2 потребляется. Мухи помещают в герметичный контейнер с веществом, которое абсорбирует СО 2 исключен, эффективно исключает его из газовой фазы. Изменение объема газа (пониженное давление) измеряется перемещению жидкости в стеклянном капилляре, прикрепленной к закрытой респирометре.
Основным преимуществом этого метода по сравнению с другими является стоимость. Предыдущие исследования измеряется CO 2 производства по дрозофилы с помощью газоанализаторов и технически совершенных респирометрии системы 1,9. Несмотря на более сложного оборудования, чувствительность метода, описанного здесь аналогична сообщенных значений (табл. 1). Кроме того, несколько других групп использовали вариации этого метода для определения относительных скоростей обмена веществ в Drosophila 4-6. Таким образом, этот анализ может быть использован для создания reliabле, воспроизводимые данные, относящиеся к Drosophila метаболизма без приобретения специализированного оборудования, которые могут быть установлены в любой лаборатории и могут быть использованы в образовательных целях.
В общем, принятые методы для определения метаболизм организма заключается в измерении CO 2 производится, потребляется O 2, или оба ,3,4,9. Хотя, можно предположить, что один эквивалент O 2 генерирует один эквивалент CO 2, точное соотношение СО 2 генерируется зависит от метаболического субстрата, используемого 10. Таким образом, для точного определения скорости обмена веществ в энергетических единицах необходимо измерить как O 2 потребляется и СО 2 производится. В связи с этим, метод, описанный здесь, в частности, отношение к сравнивая различия в CO 2 производства между животными и не абсолютного значения. Наша методика объединяет несколько животных СО 2 производства в течение тиме (1-2 ч) и, следовательно, возвращает в среднем деятельности животных. Если есть основания полагать, что опытные животные менее активны, чем у контрольных животных измерение может отражать различные уровни деятельности и не обязательно метаболизм.
протокол
1. Подготовка респирометров
- Разрежьте пипетки 1000 мкл с лезвием бритвы, чтобы можно было вставить в 50 мкл капиллярной микропипетки, попытайтесь получить пипетки как можно более прямо.
- Место кусок пены в пипетку и толкать ее вниз в кончика пипетки.
- Добавить небольшое количество абсорбента CO 2 и содержать его на второй кусок пены.
- Нанесите клей в месте, где микропипетки вставляется в наконечником пипетки.
- Оставьте респирометре ночь, чтобы клей для просушки.
Схематическое изображение респирометре показано на фиг.1А.
2. Подготовка измерительной камеры
- Подготовьте камеру решение путем смешивания воды с эозином в соотношении, которое приведет к видимым раскрашивания.
- Налейте раствор эозин / воды в камеру.
- Этикетка одну из сторон камеры со шкалой сантиметр.
3. Размещение летит в респирометров
- Этикетка индивидуальные респирометров с маркером.
- Обезболить мух с использованием альтернативного метода в СО 2 и поместите 3-5 мух желаемого генотипа внутри каждого респирометре.
- Запечатайте респирометров плотно в верхней использованием пластилина замазку.
- Разрешить мухи, чтобы оправиться от наркоза в течение примерно 15 мин.
- Подготовьте респирометре без мух, которые будут использованы в качестве атмосферного управления.
4. Проведения эксперимента
- Повесьте респирометров в камере путем присоединения 1,5 мл Eppendorf держатель трубки, которая открыта на верхней и нижней в верхней части камеры.
- Вставьте респирометров кончиком пипетки вниз в камеру, позволяя верхушка погружаться в окрашенного раствора.
- Добавить вазелин между крышкой крышкой и камерой, чтобы обеспечить более сильное изоляцию от температуры и давления fluctuations.
- Закрыть крышку и позволить системе для уравновешивания в течение 15 мин.
- Сфотографировать камеры, убедившись, что уровень жидкости внутри каждого микропипетки видна и так является шкала (см. пример, показанный на рисунке 1b).
- После 1-2 часов, принять другую картину.
- Когда эксперимент закончен, удалите мух от респирометров и весят при желании или передавать их обратно в пузырек, если это необходимо в дальнейшем.
5. Анализ результатов
- Открыть полученных изображений с помощью программного обеспечения ImageJ 11.
- Используя шкалу в каждой картине, установите пикселей масштабирование в программном обеспечении.
- Измерьте расстояние (SD), что жидкость путешествовал из определенной опорной месте в снимках, сделанных в начале (D1) и конец эксперимента (D2). Схематический пример показан на рисунке 1С.
- Рассчитайте количество произведенного CO 2 (мкл / ч / лету) с формулой:
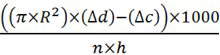
R = радиус микропипетки трубы в сантиметрах
Δd = расстояние жидкость поднялась в микропипетки тестовых образцов измеряется в сантиметрах
Δc = расстояние жидкость поднялась в микропипетки образца отрицательный контроль (без мух)
п = количество мух, используемых
ч = часы
Результаты
Для того чтобы показать, что метод чувствителен мы измерили CO 2 производства от дикого типа (Орегон R) мужской летает в 18, 25 и 29 ° C и летит мутанта для Dg. Мухи были подняты при 25 ° С и затем перенесен на экспериментальной температуре в течение 5 дней до измерений. Как и ожидало...
Обсуждение
В этом протоколе, мы описываем недорогой и надежный метод для измерения CO 2 производства в мух. Мы обнаружили, что этот эксперимент просто, быстро провести и генерирует воспроизводимое данные, которые согласуются с другими исследованиями 1, 6, 9. Протокол изложил здесь могут б?...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Макса Планка Общество для финансирования наших исследований.
Материалы
| Name | Company | Catalog Number | Comments |
| BlauBrand IntraMark 50 µl micropipettes | VWR | 612-1413 | |
| Soda Lime | Wako | CDN6847 | |
| Eosine | Sigma | 031M4359 | Any dye that can create visible colorization of liquid can be used |
| Thin Layer Chromatorgaphy (TLC) Developing Chamber | VWR | 21432-761 | Any transparent glass chamber that can be closed with the lid |
| Anesthetizer, Lull-A-Fly Kit | Flinn | FB1438 | |
| Power Gel Glue | Pritt | ||
| 1 ml pipett tips | Any | ||
| Foam | Any | ||
| Plaesticine Putty | Any | ||
| Scalpel | Any | ||
| Tweezers | Any |
Ссылки
- Van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Testing the "rate of living" model: further evidence that longevity and metabolic rate are not inversely correlated in Drosophila melanogaster. J Appl Physiol. 97, 1915-1922 (2004).
- Ross, R. E. Age-specific decrease in aerobic efficiency associated with increase in oxygen free radical production in Drosophila melanogaster. Journal of Insect Physiology. 46, 1477-1480 (2000).
- van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Selected contribution: long-lived Drosophila melanogaster. lines exhibit normal metabolic rates. J Appl Physiol. 95, 2605-2613 (2003).
- Hulbert, A. J., et al. Metabolic rate is not reduced by dietary-restriction or by lowered insulin/IGF-1 signalling and is not correlated with individual lifespan in Drosophila melanogaster. Experimental Gerontology. 39, 1137-1143 (2004).
- Ueno, T., Tomita, J., Kume, S., Kume, K. Dopamine modulates metabolic rate and temperature sensitivity in Drosophila melanogaster. PLoS ONE. 7, (2012).
- Takeuchi, K., et al. Changes in temperature preferences and energy homeostasis in dystroglycan mutants. Science. 323, 1740-1743 (2009).
- Kucherenko, M. M., Marrone, A. K., Rishko, V. M., Magliarelli Hde, F., Shcherbata, H. R. Stress and muscular dystrophy: a genetic screen for dystroglycan and dystrophin interactors in Drosophila. identifies cellular stress response components. Developmental Biology. 352, 228-242 (2011).
- Marrone, A. K., Kucherenko, M. M., Wiek, R., Gopfert, M. C., Shcherbata, H. R. Hyperthermic seizures and aberrant cellular homeostasis in Drosophila dystrophic. muscles. Scientific Reports. 1, 47 (2011).
- Khazaeli, A. A., Van Voorhies, W., Curtsinger, J. W. Longevity and metabolism in Drosophila melanogaster: genetic correlations between life span and age-specific metabolic rate in populations artificially selected for long life. Genetics. 169, 231-242 (2005).
- Elia, M. Energy equivalents of CO2 and their importance in assessing energy expenditure when using tracer techniques. The American Journal of Physiology. 260, (1991).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Bharucha, K. N. The epicurean fly: using Drosophila melanogaster. to study metabolism. Pediatric Research. 65, 132-137 (2009).
- Rajan, A., Perrimon, N. Of flies and men: insights on organismal metabolism from fruit flies. BMC Biology. 11, 38 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены