É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A medição da taxa metabólica em
Neste Artigo
Resumo
Distúrbios metabólicos estão entre uma das doenças mais comuns em humanos. O modelo de organismo geneticamente tratável D. melanogaster pode ser utilizado para identificar novos genes que regulam o metabolismo. Este artigo descreve um método relativamente simples, que permite estudar a taxa metabólica em moscas, medindo a sua produção de CO2.
Resumo
Distúrbios metabólicos são um problema freqüente que afeta a saúde humana. Portanto, a compreensão dos mecanismos que regulam o metabolismo é uma tarefa científica crucial. Muitos genes que causam doenças nos seres humanos têm um homólogo mosca, tornando Drosophila um bom modelo para estudar vias de sinalização envolvidas no desenvolvimento de doenças diferentes. Além disso, a rastreabilidade de Drosophila simplifica telas genéticos para ajudar a identificar novos alvos terapêuticos que podem regular o metabolismo. A fim de realizar tal tela um método simples e rápido para identificar alterações no estado metabólico de moscas é necessário. Em geral, a produção de dióxido de carbono é um bom indicador de oxidação de substrato e gasto de energia fornecendo informações sobre o estado metabólico. Neste protocolo, apresentamos um método simples de medir CO 2 saída de moscas. Esta técnica pode potencialmente auxiliar na identificação de perturbações genéticas que afectam a taxa metabólica.
Introdução
O ciclo de Krebs bioquímica gera ATP por meio da oxidação do derivado de acetato de hidratos de carbono, gorduras e proteínas produtoras de CO 2. Em Drosophila, O 2 entrada é diretamente correlacionado com CO 2 de saída e reflete o nível de metabolismo 1. Assim, a medição de CO 2 saída de sucesso tem sido utilizado em estudos relacionados ao envelhecimento e metabolismo 2-5. Aqui nosso laboratório tem modificado montagens experimentais previamente elaborados, permitindo a medição da produção de CO 2 em até dezoito amostras sem necessidade de qualquer equipamento especializado. Outros e nós já usou esse método para mostrar as diferenças nas taxas metabólicas em moscas que são deficientes na proteína associada muscular distrofia, Dystroglycan (GD) 6-8.
O 2 usado para o metabolismo oxidativo é convertido em CO2, o qual é expelido como resíduos respiratória. A construçãoção de respirômetros feito à mão é descrito que permite a determinação da taxa de O 2 consumido. As moscas são colocadas em um recipiente vedado com uma substância que absorve o CO2 expelido, eliminando-o de forma eficiente a partir da fase gasosa. A variação do volume do gás (diminuição da pressão) é medido por deslocamento de fluido num capilar de vidro ligado ao respirómetro fechada.
A principal vantagem desta técnica sobre os outros é o custo. Estudos anteriores já haviam medido produção de CO 2 por Drosophila usando analisadores de gás e sistemas de respirometria tecnicamente avançados 1,9. Apesar do equipamento mais complexo, a sensibilidade do método aqui descrito é semelhante aos valores relatados (Tabela 1). Além disso, vários outros grupos usaram variações desta técnica para determinar as taxas metabólicas relativas em Drosophila 4-6. Por isso, este ensaio pode ser usado para gerar reliable, dados reprodutíveis relevantes ao metabolismo Drosophila sem a aquisição de equipamento especializado, que pode ser configurado em qualquer laboratório e pode ser usado para fins educacionais.
Em geral, as técnicas aceites para determinar o metabolismo de um organismo é medir a produção de CO 2, O 2 consumido, ou ambos 3,4,9. Porém, pode ser assumido que um equivalente de O 2 gera um equivalente de CO 2, a relação precisa de CO 2 gerado é dependente do substrato metabólico utilizado 10. Assim, para determinar com precisão a taxa de metabolismo em unidades de energia, é necessário medir ambos O 2 consumido e do CO 2 produzido. Devido a isto, o método descrito aqui é especificamente relevante para comparar diferenças na produção de CO 2 entre os animais e não os valores absolutos. Nossa técnica integra vários animais CO 2 da produção durante um período de time (1-2 horas) e, portanto, retorna uma média da actividade dos animais. Se não há razão para acreditar que os animais experimentais são menos ativas do que os animais de controle a medida pode refletir diferentes níveis de atividade e metabolismo não necessariamente.
Protocolo
1. Preparação de respirômetros
- Corte a ponteira 1000 mL com uma lâmina de barbear para permitir a inserção da micropipeta capilar 50 ul, para tentar obter a ponteira o mais reto possível.
- Coloque um pedaço de espuma para a pipeta e empurrá-lo para baixo na ponta da pipeta.
- Adicionar uma pequena quantidade de CO 2 absorvente e conter por um segundo pedaço de espuma.
- Aplicar cola no local onde a micropipeta é inserida a ponta da pipeta.
- Deixar o respirómetro durante a noite para permitir que a cola seque.
Um diagrama esquemático de um respirómetro é mostrado na Figura 1A.
2. Preparação da câmara de medição
- Preparar a solução de câmara através da mistura de água com eosina numa proporção que vai resultar numa coloração visível.
- Verter a solução eosina / água para dentro da câmara.
- Rotular um dos lados da câmara com uma escala de centímetros.
3. Colocando Moscas em respirômetros
- Identifique os respirômetros individuais com um marcador.
- Anestesiar moscas usando um método alternativo ao CO 2 e colocar 3-5 moscas do genótipo desejado dentro de cada respirômetro.
- Vedar as respirômetros firmemente no topo usando plasticina massa de vidraceiro.
- Permitir que as moscas se recuperar da anestesia para cerca de 15 min.
- Preparar um respirómetro sem moscas, que vai ser utilizado como o controlo atmosférico.
4. Realização do experimento
- Pendure as respirômetros na câmara, anexando um porta-tubos de 1,5 ml Eppendorf que está aberto na parte superior e na parte inferior, na parte superior da câmara.
- Insira respirômetros com a ponta micropipeta para dentro da câmara permitindo a ponta para submergir na solução colorida.
- Adicionar vaselina entre a tampa da tampa e da câmara para fornecer isolamento mais forte de temperatura e pressão flucttuações.
- Fechar a tampa e permite que o sistema atinja o equilíbrio durante 15 minutos.
- Tire uma foto da câmara certificando-se que o nível de líquido dentro de cada micropipeta é visível e por isso é a escala (veja o exemplo mostrado na Figura 1B).
- Depois de 1-2 horas, tirar outra foto.
- Quando experimento estiver concluído, remova as moscas de respirômetros e pesar se desejado ou transferi-los de volta para o frasco, se necessário ainda mais.
5. Análise dos Resultados
- Abrir adquiriu imagens usando software ImageJ 11.
- Usando a escala em cada imagem, definir a escala de pixels no software.
- Meça a distância (Δd) que o líquido viajaram de um ponto de referência determinado em imagens tiradas no início (d1) e no final do experimento (d2). Um exemplo esquemático é mostrado na Figura 1C.
- Calcular a quantidade de CO 2 produzido (il / hr / mosca) com a fórmula:
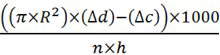
R = raio do tubo em centímetros de micropipeta
Δd = distância do líquido subiu na micropipeta de amostras medidas em centímetros
Ac = distância do líquido subiu na micropipeta da amostra de controlo negativo (sem moscas)
n = número de moscas utilizadas
h = horas
Resultados
A fim de mostrar que o método é sensível à medida que a produção de CO 2 a partir do tipo selvagem (Oregon R) moscas macho de 18, 25, e 29 ° C e opera mutante para Dg. As moscas foram colocadas a 25 ° C e, em seguida, deslocado para a temperatura experimental, durante 5 dias antes da medição. Tal como esperado para esta espécie ectotérmicos, a quantidade de CO 2 produzido aumentou com a temperatura (figura 2). Temos no passado mostraram que uma dieta l...
Discussão
Neste protocolo, descrevemos um método barato e confiável para medir a produção de CO 2 em moscas. Descobrimos que esta experiência é fácil, rápido para conduzir e gera dados reprodutível que está de acordo com outros estudos 1, 6, 9. O protocolo descrito aqui pode ser facilmente modificado para se adequar orçamento e materiais disponíveis de qualquer laboratório. A construção de cada um respirómetro indivíduo pode ser adaptado, enquanto mantém a câmara hermética. No entanto, o ...
Divulgações
Não temos nada a divulgar.
Agradecimentos
Gostaríamos de agradecer a Sociedade Max-Planck para financiar nossa pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| BlauBrand IntraMark 50 µl micropipettes | VWR | 612-1413 | |
| Soda Lime | Wako | CDN6847 | |
| Eosine | Sigma | 031M4359 | Any dye that can create visible colorization of liquid can be used |
| Thin Layer Chromatorgaphy (TLC) Developing Chamber | VWR | 21432-761 | Any transparent glass chamber that can be closed with the lid |
| Anesthetizer, Lull-A-Fly Kit | Flinn | FB1438 | |
| Power Gel Glue | Pritt | ||
| 1 ml pipett tips | Any | ||
| Foam | Any | ||
| Plaesticine Putty | Any | ||
| Scalpel | Any | ||
| Tweezers | Any |
Referências
- Van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Testing the "rate of living" model: further evidence that longevity and metabolic rate are not inversely correlated in Drosophila melanogaster. J Appl Physiol. 97, 1915-1922 (2004).
- Ross, R. E. Age-specific decrease in aerobic efficiency associated with increase in oxygen free radical production in Drosophila melanogaster. Journal of Insect Physiology. 46, 1477-1480 (2000).
- van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Selected contribution: long-lived Drosophila melanogaster. lines exhibit normal metabolic rates. J Appl Physiol. 95, 2605-2613 (2003).
- Hulbert, A. J., et al. Metabolic rate is not reduced by dietary-restriction or by lowered insulin/IGF-1 signalling and is not correlated with individual lifespan in Drosophila melanogaster. Experimental Gerontology. 39, 1137-1143 (2004).
- Ueno, T., Tomita, J., Kume, S., Kume, K. Dopamine modulates metabolic rate and temperature sensitivity in Drosophila melanogaster. PLoS ONE. 7, (2012).
- Takeuchi, K., et al. Changes in temperature preferences and energy homeostasis in dystroglycan mutants. Science. 323, 1740-1743 (2009).
- Kucherenko, M. M., Marrone, A. K., Rishko, V. M., Magliarelli Hde, F., Shcherbata, H. R. Stress and muscular dystrophy: a genetic screen for dystroglycan and dystrophin interactors in Drosophila. identifies cellular stress response components. Developmental Biology. 352, 228-242 (2011).
- Marrone, A. K., Kucherenko, M. M., Wiek, R., Gopfert, M. C., Shcherbata, H. R. Hyperthermic seizures and aberrant cellular homeostasis in Drosophila dystrophic. muscles. Scientific Reports. 1, 47 (2011).
- Khazaeli, A. A., Van Voorhies, W., Curtsinger, J. W. Longevity and metabolism in Drosophila melanogaster: genetic correlations between life span and age-specific metabolic rate in populations artificially selected for long life. Genetics. 169, 231-242 (2005).
- Elia, M. Energy equivalents of CO2 and their importance in assessing energy expenditure when using tracer techniques. The American Journal of Physiology. 260, (1991).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Bharucha, K. N. The epicurean fly: using Drosophila melanogaster. to study metabolism. Pediatric Research. 65, 132-137 (2009).
- Rajan, A., Perrimon, N. Of flies and men: insights on organismal metabolism from fruit flies. BMC Biology. 11, 38 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados