Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure des taux métabolique dans
Dans cet article
Résumé
Les troubles métaboliques sont parmi l'une des maladies les plus communes chez les humains. Le modèle organisme génétiquement traitable D. melanogaster peut être utilisé pour identifier de nouveaux gènes qui régulent le métabolisme. Ce document décrit une méthode relativement simple qui permet d'étudier le taux métabolique chez les mouches par la mesure de leur production de CO 2.
Résumé
Les troubles métaboliques sont un problème fréquent qui affecte la santé humaine. Par conséquent, la compréhension des mécanismes qui régulent le métabolisme est une tâche cruciale scientifique. De nombreux gènes causant des maladies chez les humains ont un homologue à la mouche, la drosophile faire un bon modèle pour étudier les voies de signalisation impliquées dans le développement de différents troubles. En outre, la traçabilité de la drosophile simplifie écrans génétiques pour aider à l'identification de nouvelles cibles thérapeutiques susceptibles de réguler le métabolisme. Pour effectuer un tel écran une méthode simple et rapide pour identifier les changements dans l'état métabolique des mouches est nécessaire. En général, la production de dioxyde de carbone est un bon indicateur de la dépense d'oxydation du substrat et de l'énergie fournissant des informations sur l'état métabolique. Dans ce protocole, nous introduisons une méthode simple pour mesurer le CO 2 émis par les mouches. Cette technique peut potentiellement contribuer à l'identification de perturbations génétiques affectant le taux métabolique.
Introduction
Le cycle de la biochimique Krebs génère de l'ATP par l'oxydation de l'acétate dérivé de glucides, les lipides et les protéines de production de CO 2. Chez la drosophile, O 2 entrée est directement corrélée à la production de CO 2 et reflète le niveau de métabolisme 1. Ainsi, la mesure de la production de CO 2 a été utilisé avec succès dans les études liées au vieillissement et le métabolisme 2-5. Voici notre laboratoire a modifié montages expérimentaux conçus antérieurement, permettant la mesure de la production de CO 2 dans un maximum de dix-huit échantillons sans nécessiter aucun équipement spécialisé. Autres et que nous avons déjà utilisé cette méthode pour montrer les différences dans les taux métaboliques chez les mouches qui sont déficientes dans la protéine de dystrophie musculaire associée, Dystroglycan (Dg) 6-8.
O 2 utilisé pour le métabolisme oxydatif est converti en CO 2, qui est expulsé en tant que déchets respiratoire. La constructiontion de respiromètres réalisés à la main est décrite qui permet la détermination du taux de consommation d'O 2. Les mouches sont placés dans un récipient scellé avec une substance qui absorbe le CO 2 expulsé, il en éliminant de manière efficace à partir de la phase gazeuse. Le changement de volume de gaz (diminution de la pression) est mesurée par le déplacement du fluide dans un capillaire en verre fixé à la respiromètre fermé.
Le principal avantage de cette technique par rapport aux autres est le coût. Des études antérieures ont mesuré la production de CO2 par la drosophile en utilisant des analyseurs de gaz et systèmes de respirométrie techniquement avancés 1,9. En dépit de l'équipement plus complexe, la sensibilité de la méthode décrite ici est similaire aux valeurs rapportées (tableau 1). En outre, plusieurs autres groupes ont utilisé des variantes de cette technique pour déterminer les taux métaboliques relatifs dans Drosophila 4-6. Par conséquent, ce dosage peut être utilisé pour générer reliable, des données reproductibles pertinentes au métabolisme chez la drosophile sans l'achat d'équipement spécialisé qui peut être installé dans n'importe quel laboratoire et peut être utilisé à des fins éducatives.
En général, les techniques admises pour déterminer le métabolisme d'un organisme est de mesurer le CO 2 produit, l'O 2 consommé, ou les deux 3,4,9. Cependant, il peut être supposé que un équivalent d'O 2 génère un équivalent de CO 2, le rapport exact de CO 2 produite dépend du substrat métabolique utilisé 10. Ainsi, pour déterminer avec précision le taux métabolique en unités d'énergie, il est nécessaire de mesurer tous les deux O 2 et CO 2 consommée produite. Pour cette raison, le procédé décrit ici est particulièrement pertinent pour comparer les différences dans la production de CO 2 entre les animaux et non la valeur absolue. Notre technique intègre multiples CO 2 de la production animale sur une période de time (1-2 heures) et retourne donc une moyenne de l'activité des animaux. S'il ya des raisons de croire que les animaux de laboratoire sont moins actives que les animaux de contrôle de la mesure pourrait refléter les différents niveaux de l'activité et pas nécessairement le métabolisme.
Protocole
Une. Préparation de respiromètres
- Couper l'extrémité de la pipette de 1000 pi avec une lame de rasoir pour permettre l'insertion de la 50 pi capillaire micropipette, essayez d'obtenir la pointe de la pipette aussi droit que possible.
- Placez un morceau de mousse dans la pipette et pousser vers le bas dans la pointe de la pipette.
- Ajouter une petite quantité d'absorbant de CO 2 et de le contenir par un second morceau de mousse.
- Appliquez de la colle à l'endroit où la micropipette est insérée dans l'embout de pipette.
- Laissez le spiromètre nuit pour permettre à la colle de sécher.
Un schéma d'un respiromètre est représentée sur la Figure 1A.
2. Préparation de la Chambre de mesure
- Préparer la solution de la chambre par mélange d'eau avec de l'éosine, dans un rapport qui se traduira par une colorisation visible.
- Verser la solution d'éosine / eau dans la chambre.
- Étiqueter l'un des côtés de la chambre avec une échelle centimétrique.
3. Placer mouches dans respiromètres
- Étiqueter les respiromètres individuels avec un marqueur.
- Anesthésier les mouches en utilisant une méthode alternative au CO 2 et placer 3-5 mouches du génotype souhaitée à l'intérieur de chaque spiromètre.
- Sceller les respiromètres étroitement au sommet en pâte à modeler mastic.
- Permettre aux mouches de se remettre de l'anesthésie pendant environ 15 min.
- Préparer un spiromètre sans mouches, qui sera utilisé comme contrôle atmosphérique.
4. Exécution de l'expérience
- Accrocher les respiromètres dans la chambre par la fixation d'un support d'Eppendorf de 1,5 ml de tube qui est ouvert sur le haut et le bas dans la partie supérieure de la chambre.
- Insérez respiromètres avec la pointe de micropipette vers le bas dans la chambre permettant la pointe de plonger dans la solution colorée.
- Ajouter Vaseline entre le couvercle et le couvercle de la chambre pour assurer une isolation plus forte de la température et de la pression fluctuations.
- Fermez le couvercle et laissez le système s'équilibrer pendant 15 min.
- Prendre une photographie de la chambre en s'assurant que le niveau de liquide à l'intérieur de chaque micropipette est visible et est donc l'échelle (voir l'exemple représenté à la figure 1B).
- Après 1-2 heures, prendre une autre photo.
- Lorsque expérience est terminée, retirez les mouches de respiromètres et peser si vous le souhaitez ou de les transférer vers le flacon si nécessaire encore.
5. Analyse des résultats
- Ouvrir des images acquises en utilisant le logiciel ImageJ 11.
- Utilisation de l'échelle dans chaque image, réglez la mise à l'échelle du pixel dans le logiciel.
- Mesurer la distance (Dd) que le liquide a voyagé d'un endroit de référence déterminé dans les images prises au début (d1) et à la fin de l'expérience (d2). Un exemple schématique est représentée sur la Figure 1C.
- Calculer la quantité de CO 2 produite (pi / h / mouche) avec la formule:
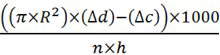
R = rayon du tube de micropipette en centimètres
Dd = distance le liquide s'est déplacé vers le haut dans la micropipette d'échantillons d'essai mesurée en centimètres
Ac = distance du liquide a progressé dans la micropipette de l'échantillon de contrôle négatif (sans vol)
n = nombre de mouches utilisés
h = heure
Résultats
Afin de montrer que la méthode est sensible, nous avons mesuré la production de CO 2 de type sauvage (Oregon R) mâle vole à 18, 25, et 29 ° C et les mouches mutantes pour Dg. Les mouches ont été soulevées à 25 ° C, puis déplacés à la température expérimentale pendant 5 jours avant la mesure. Comme attendu pour cette espèce ectotherme, la quantité de CO 2 produite augmente avec la température (figure 2). Nous avons par le passé démontré qu'...
Discussion
Dans ce protocole, nous décrivons une méthode peu coûteuse et fiable pour mesurer la production de CO 2 en vol. Nous avons constaté que cette expérience est facile, rapide à réaliser et génère des données reproductibles qui est en accord avec d'autres études 1, 6, 9. Le protocole décrit ici peut être facilement modifié pour s'adapter budgétaires disponibles et les matériaux de tout laboratoire. La construction de chaque respiromètre individuel peut être adapté aussi longt...
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Nous tenons à remercier Max-Planck pour le financement de nos recherches.
matériels
| Name | Company | Catalog Number | Comments |
| BlauBrand IntraMark 50 µl micropipettes | VWR | 612-1413 | |
| Soda Lime | Wako | CDN6847 | |
| Eosine | Sigma | 031M4359 | Any dye that can create visible colorization of liquid can be used |
| Thin Layer Chromatorgaphy (TLC) Developing Chamber | VWR | 21432-761 | Any transparent glass chamber that can be closed with the lid |
| Anesthetizer, Lull-A-Fly Kit | Flinn | FB1438 | |
| Power Gel Glue | Pritt | ||
| 1 ml pipett tips | Any | ||
| Foam | Any | ||
| Plaesticine Putty | Any | ||
| Scalpel | Any | ||
| Tweezers | Any |
Références
- Van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Testing the "rate of living" model: further evidence that longevity and metabolic rate are not inversely correlated in Drosophila melanogaster. J Appl Physiol. 97, 1915-1922 (2004).
- Ross, R. E. Age-specific decrease in aerobic efficiency associated with increase in oxygen free radical production in Drosophila melanogaster. Journal of Insect Physiology. 46, 1477-1480 (2000).
- van Voorhies, W. A., Khazaeli, A. A., Curtsinger, J. W. Selected contribution: long-lived Drosophila melanogaster. lines exhibit normal metabolic rates. J Appl Physiol. 95, 2605-2613 (2003).
- Hulbert, A. J., et al. Metabolic rate is not reduced by dietary-restriction or by lowered insulin/IGF-1 signalling and is not correlated with individual lifespan in Drosophila melanogaster. Experimental Gerontology. 39, 1137-1143 (2004).
- Ueno, T., Tomita, J., Kume, S., Kume, K. Dopamine modulates metabolic rate and temperature sensitivity in Drosophila melanogaster. PLoS ONE. 7, (2012).
- Takeuchi, K., et al. Changes in temperature preferences and energy homeostasis in dystroglycan mutants. Science. 323, 1740-1743 (2009).
- Kucherenko, M. M., Marrone, A. K., Rishko, V. M., Magliarelli Hde, F., Shcherbata, H. R. Stress and muscular dystrophy: a genetic screen for dystroglycan and dystrophin interactors in Drosophila. identifies cellular stress response components. Developmental Biology. 352, 228-242 (2011).
- Marrone, A. K., Kucherenko, M. M., Wiek, R., Gopfert, M. C., Shcherbata, H. R. Hyperthermic seizures and aberrant cellular homeostasis in Drosophila dystrophic. muscles. Scientific Reports. 1, 47 (2011).
- Khazaeli, A. A., Van Voorhies, W., Curtsinger, J. W. Longevity and metabolism in Drosophila melanogaster: genetic correlations between life span and age-specific metabolic rate in populations artificially selected for long life. Genetics. 169, 231-242 (2005).
- Elia, M. Energy equivalents of CO2 and their importance in assessing energy expenditure when using tracer techniques. The American Journal of Physiology. 260, (1991).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Bharucha, K. N. The epicurean fly: using Drosophila melanogaster. to study metabolism. Pediatric Research. 65, 132-137 (2009).
- Rajan, A., Perrimon, N. Of flies and men: insights on organismal metabolism from fruit flies. BMC Biology. 11, 38 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon