Method Article
כותרות תפוקה גבוהה של וירוסי רקומביננטי לוציפראז- להביע
In This Article
Summary
This article presents a high-throughput luciferase expression-based method of titrating various RNA and DNA viruses using automated and manual liquid handlers.
Abstract
Standard plaque assays to determine infectious viral titers can be time consuming, are not amenable to a high volume of samples, and cannot be done with viruses that do not form plaques. As an alternative to plaque assays, we have developed a high-throughput titration method that allows for the simultaneous titration of a high volume of samples in a single day. This approach involves infection of the samples with a Firefly luciferase tagged virus, transfer of the infected samples onto an appropriate permissive cell line, subsequent addition of luciferin, reading of plates in order to obtain luminescence readings, and finally the conversion from luminescence to viral titers. The assessment of cytotoxicity using a metabolic viability dye can be easily incorporated in the workflow in parallel and provide valuable information in the context of a drug screen. This technique provides a reliable, high-throughput method to determine viral titers as an alternative to a standard plaque assay.
Introduction
Classical viral plaque assays continue to be a mainstay in virus research even though they can be notoriously time-consuming and constitute a significant bottleneck to obtaining results from experiments. More rapid indirect virus quantification methods have emerged including quantitative polymerase chain reaction (qPCR), ELISA, and flow cytometry1-4. Recent innovations such as the Virocyt virus counter can directly count viruses using advanced flow sorting technology and through a combination of protein and DNA/RNA dyes5. While all of these methods have undoubtedly quickened the pace of virus research, each method has its advantages and drawbacks. For example, qPCR can allow for quantification of specific viral genome sequence but cannot effectively discriminate infectious from defective virions6. ELISAs can be very specific however require a suitable antibody against the desired target viral protein and can be very expensive. While flow cytometry technology offers many advantages and has improved significantly, throughput and accessibility to highly specialized equipment nonetheless remains a hurdle. Importantly, all of these techniques are not ideally suited for high-throughput screening, for which the ease and time requirement of the virus quantification step is of critical importance.
Here we describe a high-throughput and easily automatable technique to titer viruses that express a Firefly luciferase (Fluc) transgene. This method generates approximate viral titers in a test sample based on luminescence signal reads through the parallel use of a standard curve of known amounts of virus. Samples containing unknown quantities of luciferase-expressing virus are transferred on to a permissive “plaquing” cell line in parallel with the standard virus dilution curve and virus-associated luminescence is read after a few hours incubation time. This allows for rapid, quantitative, often same-day generation of results, unlike classic plaque assay protocols which typically require several days of incubation in order to manually count visible plaques7-9.
The protocol outlines the steps of our titration method using oncolytic Vesicular Stomatitis Virus encoding a Fluc transgene (VSV∆51-Fluc) as an example and provides an overview of 1. Sample preparation 2. The plating of a permissive cell line for virus titration using an automated dispenser 3. The preparation of the viral standard curve 4. The transfer of the sample supernatants onto the permissive cell line using a 96-well manual pipettor 5. The assessment of sample cytotoxicity using a cell viability reagent 6. The preparation of the luciferin substrate 7. Reading of bioluminescence and 8. Data analysis.
Protocol
הכנת .1 לדוגמא
- להשיג דגימות המכילות נגיף להביע לוציפראז (להלן VSVΔ51-Fluc כדוגמא) לטיטרציה והעברה ל96-גם צלחות. לחלופין, לבצע זיהומים ב96-גם צלחות תרבית הרקמה וsupernatants שימוש ישירות.
- להשאיר את שתי עמודות שלא טופלו להכללתה של עקומות סטנדרטיים. בניסויים שנעשו בצלחות 96 היטב, כייל ישירות בסוף הניסוי (לאחר זיהום 40 hr) או בחנות ב-80 מעלות צלזיוס וכייל במועד מאוחר יותר.
.2 הכנת תאים מתירנית לכותרות וירוס
- 24 שעות לפני titering, להכין השעיה של תאי Vero בריכוז של 2.5 x 10 5 תאים / מ"ל במדיום הנשר שונה Dulbecco (DMEM) המכיל 10% בסרום שור העובר (FBS), 30 HEPES מ"מ, ו -1% פניצילין / סטרפטומיצין. הערה: למרות שפרוטוקול זה משתמש בתאי Vero, כל שורת תאים מתירנית מתאימה לזיהום VSV יכולה bדואר בשימוש.
- זרעי 2.5 x 10 4 תאים (100 μl) בצלחות שטוחות תחתונה מוצקות 96, גם לבנים באמצעות מתקן microplate.
- הכן 12 מ"ל של השעיה תא לכל צלחת בתוספת 5 מ"ל לתחול.
- קלטת נקייה microplate מתקן על ידי שטיפת צינורות עם 50 מ"ל של מים סטריליים.
- מלא את קווי מנפק microplate עם השעיה תא ולתת 5 מ"ל של השעיה תא לזרום.
- בחר תכנית שלוותר 100 μl בכל טוב של צלחת 96 היטב עם קירות לבנים. לוותר, וחזור לפי צורך לצלחות נוספות. גם זרע כמה בארות בצלחת שטוחות תחתונה ברורה 96, גם אם צלחות לבן קירות אטומות התחתונה משמשות לאימות של בריאות תא וצפיפות.
- תאים כאשר סיימו, סומק בחזרה לתוך מיכל מקורי. נקה את הקלטת על ידי הפעלת 50 מ"ל של אתנול 70% אחרי 50 מ"ל של מים סטריליים חמים דרך צינורות.
- הפוך קלטת בטוחה וצינורות הם apניקה propriately בין שימושים.
- דגירה תאים ל24 שעות על 37 מעלות צלזיוס חממת humidified 5% CO 2.
.3 הכנת עקומת סטנדרט ויראלי
- הכן עקומה סטנדרטית של VSVΔ51-Fluc בסרום ללא DMEM כך שהריכוז הסופי של יחידות שלט יוצרים (pfu) לכל מ"ל לאחר העברה על גבי תאי Vero הוא כדלקמן: 10 8 מ"ל / pfu, 10 7 מ"ל / pfu, 10 6 מ"ל pfu /, 10 5 מ"ל / pfu, 10 4 מ"ל / pfu, 10 3 מ"ל / pfu, 10 2 מ"ל / pfu, ו10 1 מ"ל / pfu. הכן 50 μl של כל ריכוז לכל צלחת של תאי Vero תוספת נוספים 10%.
הערה: כייל של מניות וירוס לוציפראז תצטרך להיות מוערכת באופן קלאסי 10 כדי ליצור עקומה סטנדרטית שתאפשר לכימות מוחלט. אחרת כימות יחסי יכול להיות מושגת ללא מידע כייל מדויק על ידי כייל נגיף באופן שרירותי קביעת מבוססתעל צעדי דילול. לדוגמא הדילול הראשון של העקומה סטנדרטית עשוי להיות מוגדר 10 8 יחידות נגיפיות ו1/10 הדילול ל10 7 וכן הלאה הבא. בהקשר זה, אחד צריך לבטא ערכים כמו מתקפל שינוי בהשוואה למדגם שנקבע מראש ככימות מוחלט לא יהיה מדויק.
.4 העברת Supernatants לדוגמא על תאים מתירנית
- בדקו תאי Vero מצופים בצלחת 96 היטב ברורה התחתונה תחת מיקרוסקופ אור כדי לוודא שmonolayers לפחות 95% ומחוברות.
- העבר את 25 μl של supernatant מדגם על תאי Vero זורעים בצלחות הלבנות מוקפות חומה. אל תעביר את supernatants לתוך 2 עמודים המיועדים לעקומות סטנדרטיים. הערה: ניתן לעשות זאת בו זמנית לכל הבארות בצלחת אחת באמצעות מטפל נוזלי 96 ערוצים.
- באמצעות pipettor מרובים ערוצים 8 או 12 ערוצים, להוסיף 25 μl של כל דילול של העקומה סטנדרטית מוכן בשלב 3 לתאי Vero ב2 עמודות מיועדות.
- צלחות צנטריפוגה במשך 5 דקות ב430 XG ב RT.
- דגירה של 5 שעות ב37 מעלות צלזיוס ב5% CO 2 באינקובטור humidified.
.5 הערכה של כדאיויות תא
- הערה: כאשר החל מsupernatants התקבל מניסויי זיהום נעשו ב96-גם צלחות ברורות, כדאיות מדגם ניתן להעריך לפני כימות עם צבע מחוון כדאיות תא כגון resazurin.
- הוספת resazurin בסכום השווה ל10% מההיקף בכל טוב של 96 גם הצלחת של דגימות המכילות וירוס ותאים. כולל תא רק שולט, כמו גם שליטה בתקשורת רק כדי לקבוע ערכים עבור 100% ו0 כדאיות% בהתאמה.
- אחרי 2-4 שעה (זמן דגירה משתנה בהתאם לסוג תא ועל הריכוז של אבקה זמינה מסחרי או מחדש של הצבע), לקרוא ולהקליט את האות באמצעות קורא צלחת פלואורסצנטי (530-560 עירור, 590 פליטה). viabili התא דווחty למדגם על פי נוסחת פעילות = ((אות מבחן מדגם - אות בקרה שלילית) / (Cell לשלוט רק אות - אות בקרה שלילית)) יחסית מטבולית x 100%
.6 הכנת מצע Luciferin
- 30 דקות לפני סוף הדגירה 5 שעות, להכין את וציפרין כדי להשיג פתרון / מ"ל 2 מ"ג בתמיסת מלח סטרילית פוספט (PBS). הכן 2.5 מ"ל לכל צלחת בתוספת 2 מ"ל נוסף. הגן על פתרון מהאור. הערה: וציפרין יכול גם להיות מוכן מוקדם יותר ביום ומאוחסן על 4 מעלות צלזיוס עד לשימוש.
.7 קריאת פליטת אור
- לאחר תקופת הדגירה 5 שעות, להוסיף 25 μl של וציפרין היטב בכל תאי Vero בצלחות מוצקות הלבנות. הוספת וציפרין באופן ידני או עם מתקן אוטומטי המשולב בluminometer. הערה: השימוש במכשיר עם נקודה אחת וסופו של דבר רק קוראת עשוי לדרוש תוספת של buf תמוגה התואם לוציפראזfer לפני הוספת מצע luciferin כדי לשפר את העקביות.
- קראו את הצלחות עם הפרמטרים הבאים:
- לנער במשך 5 שניות.
- המתן 30 שניות.
- קראו הארה בערך רגישות / חשיפה קבועה מתאים. אם האפשרות זמינה במכשיר, להשתמש בריבוי נקודות קוראת (לדוגמא, 3 x 3 מטריצה) כדי לשפר את הדיוק.
- רשומה ולשמור את עוצמת bioluminescent לכמת.
- אם מתקן אוטומטי היה בשימוש כדי להוסיף luciferin לטהר את וציפרין וראש הקווים עם מים סטריליים חמים.
ניתוח .8 נתונים
- לקבלת תוצאות מדויקות, לפתור רגרסיה שאינה ליניארי כדי ליצור משוואת היל מהעקומות סטנדרטית. החל משוואה זו לדגימות titered לחשב יחידות ביטוי ויראלי. וירוסים או מצבים מסוימים עשויים לייצר עקומה סטנדרטית עם קשר לינארי; במקרה זה פתר למשוואה ליניארית.
תוצאות
סיכום של העבודה המתארת את שיטת התפוקה הגבוהה מתואר באיור 1. איור 2 מראה את התוצאות של עקומת סטנדרט טיפוסית ofVSVΔ51-Fluc. ארבעה פרמטר ניתוח רגרסיה שאינו ליניארי שנוצר עלילת היל שממנו pfu קלט לא ידועים (הערכה של כייל נגיף) יכולים להיות באינטרפולציה. ההערכה היא titers אלה מכונים יחידות ביטוי נגיפיות (VEU). איור 3 א מציג VEUs וtiters מתקבלים על ידי ביצוע assay פלאק סטנדרטי עם אותו הדגימות 10. דגימות שמקורם ניסוי שבו כימיקלים שונים המשמשים כדי לשפר את השכפול ואת ההתפשטות של VSVΔ51-Fluc ב786-0 תאים. VEUs אינטרפולציה מהעקומה סטנדרטית יש להכפיל בפקטור המבוסס על הדילול של supernatants המדגם מועבר לתאי Vero (במקרה זה, גורם לדילול הוא 5). קשר לינארי בין titers וVEU מוצג באיור 3 ב עם ציון r של פירסון של .899 (p <0.0001) R 2 של .8083 ו. באיור 4, נתונים cytotoxicity התא טיפוסיים המתקבלים מassay חילוף חומרים מוצגים ל786-0 תאים שטופלו בכימיקלים לפני הדבקה עם VSVΔ51-Fluc. לבסוף, איור 5 מראה עקומות טיפוסיות סטנדרטית שהושגו עם וירוסים שונים (וירוס הרפס סימפלקס (HSV), וירוס Vaccinia, וAdeno הקשורים וירוס (AAV), כל לוציפראז Firefly להביע) ומתאר פעמים דגירה ולהקפיא להפשיר מחזורים, כנדרש.

איור 1 זרימת עבודה של titering תפוקה גבוהה וירוס וassay cytotoxicity באמצעות VSV Δ 51-Fluc. (א) זרעים 2.5 x 10 4 תאי Vero לכל טוב (100 μl) ו לדגור על 37 ° C. (B) 24ההעברה מאוחר יותר לשעה 25 μl של עקומת סטנדרט לתאי Vero (2 עמודים לכל צלחת). העברה (C) 25 μl של דגימות להיות titered על תאי Vero שנותרו. הצלחות וצנטריפוגה לדגור על 37 מעלות צלזיוס. (ד) בסכום השווה ל10% מהנפח בבאר, להוסיף מגיב resazurin לצלחת המכילה את הדגימות המקוריות. דגירה צלחות על 37 מעלות צלזיוס. (E) לאחר 3 שעות, לקרוא וקרינת שיא ולהעריך רעילה. (F) אחרי 5 שעות, להוסיף 25 μl של פתרון 2 מ"ג / מ"ל של וציפרין היטב בכל תאי Vero. קראו הארה ולחשב יחידות ביטוי ויראלי.
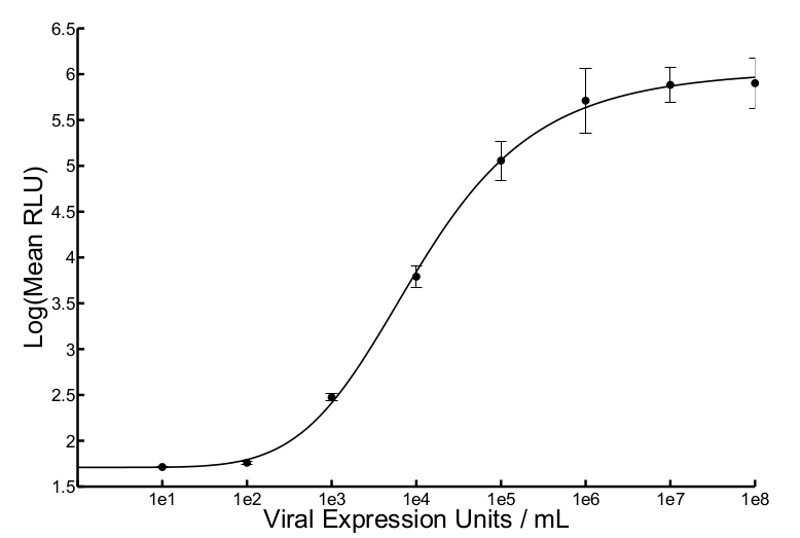
איור 2 צפוי עקומה סטנדרטית של VSV Δ 51-Fluc. ביטוי לוציפראז- היה ליasured 5 העברת ההודעה supernatant שעה בחמש נקודות שונות בתוך גם באמצעות luminometer ופליטת האור באה לידי הביטוי בממוצע יחידות יחסי אור (RLU). אומר RLU היה להתוות נגד קלט ידוע pfu / מ"ל כדי לפתור את רגרסיה שאינה ליניארי וליצור משוואת היל. הממוצע של שתי עקומות לשכפל וברים שגיאה סטנדרטיים מוצג (r 2 = .9993).

איור 3 השוואה בין titers assay פלאק הסטנדרטי עם אלו המתקבלות בשיטת תפוקה גבוהה. () Titers ויראלי בpfu / מתקבל על ידי assay פלאק הסטנדרטי על תאי Vero הושוו עם titers מחושב נגיפי (VEU / מ"ל) מאותו הדגימות titered באמצעות assay לוציפראז תפוקה הגבוהה. (ב) קשר לינארי בין מ"ל VEU / מ"ל וכייל להשיג באמצעות p הסטנדרטיassay laque. עקומת רגרסיה ליניארית ומקדם של נחישות (R 2) מוצגים.

איור 4 דוגמא כדאיות. כדאיות לדוגמא לפני העברת supernatant על תאי Vero נקבעה על ידי הערכת פעילות המטבולית סלולרית באמצעות פתרון resazurin זמין מסחרי. ערכי הקרינה גלם היו מנורמלים לזה של בארות שלא טופלו, נגוע.
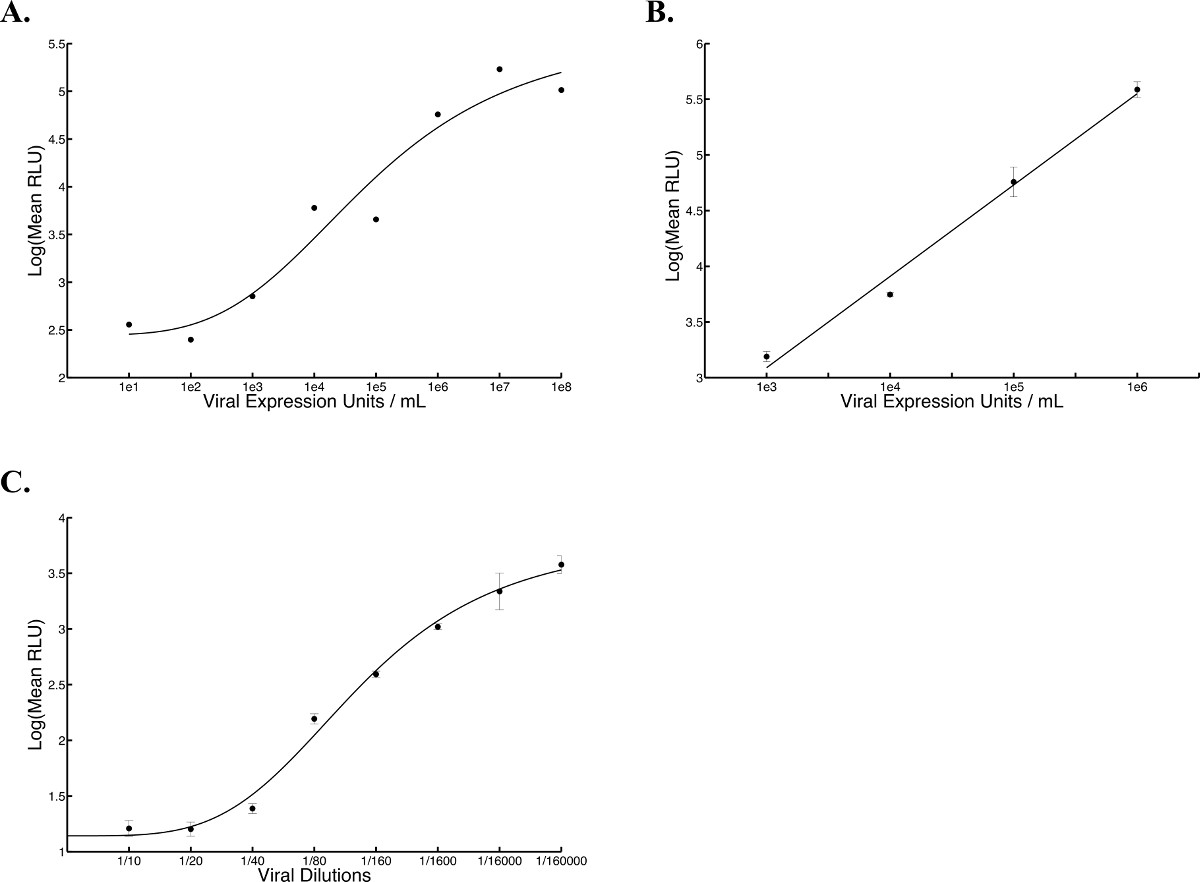
איור 5 צפוי עקומות סטנדרטיים עם HSV, Vaccinia, ווירוסים AAV. ביטוי לוציפראז- נמדד בחמש נקודות שונות בתוך גם באמצעות luminometer ופליטת האור באה לידי ביטוי ברלה הממוצעתיחידות אור מופרזות (RLU). () העקומה סטנדרטית HSV נוספה על תאי Vero מצופה 24 שעות קודם לכן בצפיפות של 2.5 x 10 4 תאים לכל טוב (100 μl) ומדידת לוציפראז נעשתה העברת ההודעה supernantant 17 שעה (R 2 = .9489, N = 1). משוואת היל נוצרה על ידי פתרון רגרסיה שאינה ליניארי. העקומה סטנדרטית (B) Vaccinia נוספה על תאי Vero מצופה 24 שעות קודם לכן צפיפות של 2.5 x 10 4 תאים לכל טוב (100 μl) וטופחו במשך 2.5 שעה על 37 מעלות C, לאחר שמדידות לוציפראז נלקחו (R 2 = .9892). משוואה ליניארית נוצרה על ידי הפתרון לרגרסיה ליניארית. (C) AAV עקומה סטנדרטית נוספה על תאים אנושיים קרצינומה של ריאה (A549) מצופה 24 שעות קודם לכן בצפיפות של 2.5 x 10 4 תאים לכל טוב (100 μl) ומדידת לוציפראז נעשה 24 הודעה שעה זיהום. משוואת היל נוצרה על ידי פתרון רגרסיה שאינה ליניארי. הממוצעשל חמש עקומות לשכפל וברים שגיאה סטנדרטיים מוצגים (R 2 = .9926).
Discussion
הגישה מבוססת לוציפראז המתואר כאן מספקת מספר היתרונות על פני שיטות קיימות אחרות, כוללים קלות, זריזות, צורך ציוד מינימאלי, ועלות נמוכה יחסית. גורם עיקרי בזה הוא ההימנעות מצעד דילול סדרתי. יחד עם זאת, נגזרים מבוססי דילול סדרתי של פרוטוקול זה בהחלט אפשריים והיו בשימוש לאחרונה להעריך titers אבולה להביע לוציפראז במסך אנטי תפוקה גבוהה 11. בעוד מטבעו זמן רב יותר ויקר יותר, עיבודים כזה עשויים לספק טווח דינמי גדול יותר לכימות נגיפית בעת צורך. בנוסף להיות גם מתאים במיוחד להערכת titers ויראלי בהקשר של מסכי תפוקה גבוהה, השיטה הנגיפית הכימות מבוסס לוציפראז צעד אחד שלנו יוצרת הערכות מדויקות של virions זיהומיות במקרה של שכפול וירוסים. יתר על כן, מונה המציין הארה, יחד עם נתונים רעילים מאותו הניסוי לתת יותרתמונה של ההשפעה של תנאי ניסוי על תאי יעד מלא, וזה שימושי במיוחד בהקשר של וירוסי oncolytic ומסכי סמים.
הדוגמא מאוירת כאן משתמשת וירוס RNA משכפלים שלילי גדיל בודד; עם זאת, פרוטוקול זה יכול להיות מותאם למספר משכפלים ולא משכפלים את וירוסים עם כמה התאמות פרוטוקול קטין. זה כולל וירוסי DNA כגון Vaccinia, HSV, וAAV (ראה איור 5). דגימות נגועות בוירוסים תאיים, כגון וירוס Vaccinia למשל, דורשות צעד שחרור וירוס לפני כימות (למשל, מחזור ההפשרה הקפאה לפחות אחד). כאשר מיישם את הטכניקה הזאת לוירוסים אחרים, יש צורך לייעל את זמן דגירה מהעברת supernatant או lysate הנגיפיים לקריאה של הצלחות על ידי luminometer. פרמטר זה יהיה תלוי בעיקר במחזור השכפול של הנגיף בתא הקו מתירני ואת כוחו של עמ 'romoter נהיגה ביטוי בלוציפראז. זה נעשה הכי טוב על ידי שימוש בעקומה סטנדרטית המלאה בצעד אופטימיזציה. כדי לעשות זאת, יש להדביק את שורת התאים מתירנית המתאימה עם משכפל שונים של העקומה סטנדרטית מוכנה ולקרוא כל לשכפל בכל פעם שונה מצביע הודעה העברה. באופן אידיאלי, נקודת זמן דגירה נבחרה שמובילה לקשר לינארי בין LOG (RLU) וLOG (כייל) פורש מגוון כייל המדגם הצפוי. לVSVΔ51-Fluc, זה בדרך כלל מ10 4 pfu / מ"ל -10 7 pfu / מ"ל לזמן דגירה 5 שעות. אם titers נמוך יותר או גבוה יותר צפויים מדגימות, אפשר פשוט להגדיל או להקטין את זמן הדגירה בהתאמה. לחלופין, דגימות עשויות להיות מדוללים ליפול בטווח הרבה כפי שנעשה בדרך כלל עבור ELISA.
כפי שצוין לעיל, שיטה זו מתאימה גם לביצוע מסכי תרופת תפוקה גבוהה באמצעות ספריות סמים כמו רוב הצעדים יכולים להיות אוטומטיים. יכולים להיות מצופים תאים דוארfficiently באמצעות מתקן microplate אוטומטי, ספריית התרופה ניתן להוסיף באמצעות מטפל נוזלי 96 ערוצים, ניתן להוסיף וירוס באמצעות מתקן microplate וצלחות לקרוא באמצעות luminometer אוטומטי. בתאוריה, זה יכול גם להיות מותאם ל384 גם או פורמטים קטנים יותר; עם זאת, ההגבלה לשם כך הוא מספר התאים שיכולים להיות מצופה, תאים פחות נתונה מובילה למגוון צר יותר בליניאריות של LOG (RLU) לLOG מערכת יחסים (כייל). לבסוף, הערכה של כדאיות תא באמצעות resazurin או צבעים מטבולים אחרים ניתן לשלב בקלות בזרימת העבודה, המאפשר לאפליה של תרכובות רעילות לתאים במסכים אנטי או זיהוי של תרכובות שהובילו להרג סינרגיסטי בשילוב עם וירוסים 12. עם זאת, מגבלות של שיטה זו כוללות את הדרישה של וירוס transgene להביע לוציפראז, וזה לא תמיד אפשרי, ואת הזמינות של שורת תאים מספיק מתירנית. עם זאת, סביר להניח ניתן להתאיםהשיטה לשימוש עם גני כתב אחרים (למשל, GFP) בתנאים שיש שיטת כימות כתב ליניאריות מתאימה ויחס אות לרעש. בסך הכל, שיטת התפוקה גבוהה שתוארה יכולה להיות שונה כדי להתאים לוירוסים רבים ושונים ומותאם ליישומים מגוונים.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vanessa Garcia is funded by a Queen Elizabeth II Ontario Graduate Scholarship in Science and Technology and Cory Batenchuk by a Natural Sciences and Engineering Research Council fellowship.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbeccos' Modified Eagle's Medium (DMEM) | Corning | SH30243.01 | |
| Fetal bovine serum | NorthBio Inc. | NBSF-701 | |
| Phosphate buffered saline | Corning | 21-040-CV | |
| HEPES | Fisher Scientific | BP310-1 | Prepare a 1 mM solution, pH 7.3 |
| alamarBlue | AbD Serotec | BUF012B | |
| D-Luciferin potassium salt | Biotium | 10101-2 | |
| 96-well solid white flat bottom polystyrene TC-treated microplates | Corning | 3917 | 384-well plates can also be used for higher throughput |
| Synergy Mx | BioTek | SMTBL | Monochromator microplate reader |
| Liquidator96 | Mettler Toledo | LIQ-96-200 | 96 tip manual pipetting system |
| Liquidator96 LTS Tips sterilized with filters | Mettler Toledo | LQR-200F | Any sterile filtered tips compatible with pipettors of choice are appropriate |
| Microflo | BioTek | 111-206-21 | Used to plate cells in a 96-well plate |
| Fluoroskan Ascent FL | Thermo Scientific | 5210450 | Microplate fluorometer |
References
- Grigorov, B., Rabilloud, J., Lawrence, P., Gerlier, D. Rapid titration of measles and other viruses: optimization with determination of replication cycle length. PLoS One. 6 (e24135), (2011).
- Lizee, G., et al. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum Gene Ther. 14, 497-507 (2003).
- McSharry, J. J. Uses of flow cytometry in virology. Clin Microbiol Rev. 7, 576-604 (1994).
- Watcharatanyatip, K., et al. Multispecies detection of antibodies to influenza A viruses by a double-antigen sandwich ELISA. J Virol Methods. 163, 238-243 (2010).
- Dawson, E. Rapid, Direct Quantification of Viruses in Solution Using the ViroCyt Virus Counter. Journal of Biomolecular Techniques. 23 (S10), (2012).
- Snyder, R. O. AAV and RT-PCR: true or false. Mol Ther. 1, 389-390 (2000).
- Diallo, J. S., Roy, D., Abdelbary, H., De Silva, N., Bell, J. C. Ex vivo infection of live tissue with oncolytic viruses. J Vis Exp. 52, (2011).
- Gaush, C. R., Smith, T. F. Replication and plaque assay of influenza virus in an established line of canine kidney cells. Appl Microbiol. 16, 588-594 (1968).
- Green, M., Loewenstein, P. M. Human adenoviruses: propagation, purification, quantification, and storage. Curr Protoc Microbiol. 14 (14C 11), (2006).
- Diallo, J. S., Vaha-Koskela, M., Le Boeuf, F., Bell, J. Propagation, purification, and in vivo testing of oncolytic vesicular stomatitis virus strains. Methods Mol Biol. 797, 127-140 (2012).
- Hoenen, T., Groseth, A., Callison, J., Takada, A., Feldmann, H. A novel Ebola virus expressing luciferase allows for rapid and quantitative testing of antivirals. Antiviral Res. 99, 207-213 (2013).
- Diallo, J. S., et al. A high-throughput pharmacoviral approach identifies novel oncolytic virus sensitizers. Mol Ther. 18, 1123-1129 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved