Method Article
Le titrage à haut débit de la luciférase-virus recombinants exprimant
Dans cet article
Résumé
This article presents a high-throughput luciferase expression-based method of titrating various RNA and DNA viruses using automated and manual liquid handlers.
Résumé
Standard plaque assays to determine infectious viral titers can be time consuming, are not amenable to a high volume of samples, and cannot be done with viruses that do not form plaques. As an alternative to plaque assays, we have developed a high-throughput titration method that allows for the simultaneous titration of a high volume of samples in a single day. This approach involves infection of the samples with a Firefly luciferase tagged virus, transfer of the infected samples onto an appropriate permissive cell line, subsequent addition of luciferin, reading of plates in order to obtain luminescence readings, and finally the conversion from luminescence to viral titers. The assessment of cytotoxicity using a metabolic viability dye can be easily incorporated in the workflow in parallel and provide valuable information in the context of a drug screen. This technique provides a reliable, high-throughput method to determine viral titers as an alternative to a standard plaque assay.
Introduction
Classical viral plaque assays continue to be a mainstay in virus research even though they can be notoriously time-consuming and constitute a significant bottleneck to obtaining results from experiments. More rapid indirect virus quantification methods have emerged including quantitative polymerase chain reaction (qPCR), ELISA, and flow cytometry1-4. Recent innovations such as the Virocyt virus counter can directly count viruses using advanced flow sorting technology and through a combination of protein and DNA/RNA dyes5. While all of these methods have undoubtedly quickened the pace of virus research, each method has its advantages and drawbacks. For example, qPCR can allow for quantification of specific viral genome sequence but cannot effectively discriminate infectious from defective virions6. ELISAs can be very specific however require a suitable antibody against the desired target viral protein and can be very expensive. While flow cytometry technology offers many advantages and has improved significantly, throughput and accessibility to highly specialized equipment nonetheless remains a hurdle. Importantly, all of these techniques are not ideally suited for high-throughput screening, for which the ease and time requirement of the virus quantification step is of critical importance.
Here we describe a high-throughput and easily automatable technique to titer viruses that express a Firefly luciferase (Fluc) transgene. This method generates approximate viral titers in a test sample based on luminescence signal reads through the parallel use of a standard curve of known amounts of virus. Samples containing unknown quantities of luciferase-expressing virus are transferred on to a permissive “plaquing” cell line in parallel with the standard virus dilution curve and virus-associated luminescence is read after a few hours incubation time. This allows for rapid, quantitative, often same-day generation of results, unlike classic plaque assay protocols which typically require several days of incubation in order to manually count visible plaques7-9.
The protocol outlines the steps of our titration method using oncolytic Vesicular Stomatitis Virus encoding a Fluc transgene (VSV∆51-Fluc) as an example and provides an overview of 1. Sample preparation 2. The plating of a permissive cell line for virus titration using an automated dispenser 3. The preparation of the viral standard curve 4. The transfer of the sample supernatants onto the permissive cell line using a 96-well manual pipettor 5. The assessment of sample cytotoxicity using a cell viability reagent 6. The preparation of the luciferin substrate 7. Reading of bioluminescence and 8. Data analysis.
Protocole
Préparation de l'échantillon 1
- Obtenir des échantillons contenant des virus exprimant la luciférase (ci-VSVΔ51 Fluc, par exemple) pour le titrage et le transfert dans des plaques à 96 puits. Sinon, effectuer les infections dans des plaques 96 puits de culture de tissus et utilisation surnageants directement.
- Laisser deux colonnes non traitées pour l'inclusion de courbes standards. Pour les expériences effectuées directement dans des plaques à 96 puits, titre à la fin de l'expérience (40 heures post-infection) ou conserver à -80 ° C et le titre à une date ultérieure.
2 Préparation des cellules permissives pour le virus de titrage
- 24 heures avant le titrage, préparer une suspension de cellules Vero à une concentration de 2,5 x 10 5 cellules / ml dans du milieu de Eagle modifié par Dulbecco (DMEM) contenant 10% de sérum bovin fœtal (FBS), HEPES 30, et 1% de pénicilline / streptomycine. REMARQUE: Bien que ce protocole utilise des cellules Vero, une lignée cellulaire permissive approprié pour infection par le VSV pourrait be utilisée.
- Graine 2,5 x 10 4 cellules (100 ul) dans des plaques à fond plat à 96 puits solides blancs à l'aide d'un distributeur de microplaques.
- Préparez 12 ml de suspension cellulaire par plaque plus 5 ml pour l'amorçage.
- Clean microplaque distributeur de cassette par le tube de rinçage avec 50 ml d'eau stérile.
- Remplissez les lignes microplaque de distribution avec suspension cellulaire et laissez 5 ml de suspension cellulaire traversent.
- Sélectionnez un programme qui va se passer 100 pi dans chaque puits d'une plaque de 96 puits murs blancs. Distribuer, et répéter au besoin pour les plaques supplémentaires. SEED a aussi quelques puits dans une plaque à fond plat de 96 puits clairement si les plaques aux murs blancs opaques-bas sont utilisés pour la vérification de la santé des cellules et de la densité.
- Lorsque vous avez terminé, les cellules Rincer de nouveau dans le conteneur original. Nettoyer la cassette en cours d'exécution par 50 ml d'éthanol à 70% puis 50 ml d'eau stérile chaude à travers le tube.
- Assurez-vous que la cassette et le tube sont appropriée nettoyé entre chaque utilisation.
- Incuber les cellules pendant 24 heures à 37 ° C dans 5% humidifié un incubateur à CO 2.
3 Préparation de la courbe standard virale
- Préparer une courbe d'étalonnage de VSVΔ51-Fluc dans du milieu DMEM sans sérum de telle sorte que la concentration finale d'unités formant des plages (PFU) par ml, après transfert sur des cellules Vero est la suivante: 10 8 pfu / ml, 10 7 pfu / ml, 10 6 pfu / ml, 10 5 pfu / ml, 10 4 pfu / ml, 10 3 pfu / ml, 10 2 pfu / ml et une 10 pfu / ml. Préparer 50 pi de chaque concentration par plaque de cellules Vero, plus un supplément de 10%.
REMARQUE: titre de la luciférase stock de virus devra être évalué de façon classique 10 afin de générer une courbe standard qui permettra de quantification absolue. Sinon quantification relative peut être réalisée sans l'information de titre précis en réglant arbitrairement titre viral basésur les mesures de dilution. Par exemple la première dilution de la courbe d'étalonnage peut être réglé à 10 8 unités virales et la dilution 1/10 à 10 7 suivant et ainsi de suite. Dans ce contexte, il faut exprimer les valeurs en tant que facteur de variation par rapport à un échantillon pré-déterminé la quantification absolue ne seront pas exactes.
4 Transfert des exemples surnageants sur des cellules permissives
- Vérifiez cellules Vero plaqués dans la plaque de 96 puits à fond transparent sous un microscope optique à confirmer que les monocouches sont au moins 95% de confluence.
- Transférer 25 ul de surnageant de l'échantillon sur cellules Vero ensemencées dans des plaques aux murs blancs. Ne pas transférer les surnageants dans les 2 colonnes désignées pour les courbes standard. NOTE: Ceci peut être fait en même temps pour tous les puits sur une plaque unique en utilisant un manipulateur de liquides à canal 96.
- L'utilisation d'une pipette multi-canaux à 8 ou 12 canaux, ajouter 25 ul de chaque dilution de la courbe d'étalonnage préparée à l'étape 3 pour les cellules Vero dansles deux colonnes désignées.
- Plaques de centrifugation pour 5 min à 430 xg à la température ambiante.
- Incuber pendant 5 heures à 37 ° C dans 5% humidifié un incubateur à CO 2.
5. évaluation de la viabilité cellulaire
- Remarque: Lors du démarrage à partir des surnageants obtenus à partir des expériences d'infection par le fait dans des plaques à 96 puits claires, viabilité de l'échantillon peut être évaluée avant la quantification avec un colorant indicateur de viabilité cellulaire tels que la résazurine.
- Ajouter resazurine d'un montant égal à 10% du volume dans chaque puits de la plaque de 96 puits d'échantillons contenant des virus et des cellules. Inclure cellule ne contrôle ainsi que le contrôle des médias uniquement à déterminer les valeurs de 100% et 0% respectivement viabilité.
- Après 2-4 heures (temps d'incubation varie en fonction du type de cellule et de la concentration de poudre de colorant disponible ou reconstitué dans le commerce), de lire et d'enregistrer le signal en utilisant un lecteur de plaque à fluorescence (530 à 560 d'excitation, 590 émissions). Rapport cellule viabilité pour un échantillon selon la formule relative Activité métabolique = ((signal de l'échantillon d'essai - signal de contrôle négatif) / (cellulaire seulement le signal de commande - signal de contrôle négatif)) x 100%
6 Préparation du substrat luciférine
- 30 min avant la fin de l'incubation de 5 heures, préparer la luciférine pour obtenir une solution / ml à 2 mg dans une solution saline tamponnée au phosphate stérile (PBS). Préparer 2,5 ml par plaque, plus un supplément de 2 ml. Protéger la solution de la lumière. REMARQUE: La luciférine peut également être préparé plus tôt dans la journée, et stocké à 4 ° C jusqu'à utilisation.
7. lecture bioluminescence
- Après la période d'incubation de 5 heures, ajouter 25 pl de luciférine à chaque puits de cellules Vero dans des plaques solides blancs. Ajouter luciférine manuellement ou avec un distributeur automatique intégré dans le luminomètre. NOTE: L'utilisation d'un instrument avec seulement un seul point et à la fin se lit peut nécessiter l'ajout d'une lyse buf compatible luciférasefer avant d'ajouter le substrat luciférine d'améliorer la cohérence.
- Lire les plaques avec les paramètres suivants:
- Agiter pendant 5 sec.
- Attendez 30 secondes.
- Lire luminescence à une valeur fixe appropriée sensibilité / exposition. Si l'option est disponible sur l'instrument, utilisez multi-point lit (par exemple, 3 x 3 matrice) pour améliorer la précision.
- Enregistrer et enregistrer l'intensité de bioluminescence quantifié.
- Si un distributeur automatique a été utilisé pour ajouter luciférine purger la luciférine et amorcer les lignes à l'eau chaude stérile.
Analyse 8. données
- Pour des résultats précis, résoudre la régression non linéaire pour générer une équation de Hill à partir des courbes standards. Appliquer cette équation pour les échantillons titrés pour calculer les unités d'expression viraux. Certains virus ou situations ne peuvent produire une courbe standard avec une relation linéaire; dans ce cas résoudre une équation linéaire.
Résultats
Un résumé de la description de flux du procédé à haut débit est illustrée sur la figure 1. Figure 2 montre les résultats d'une courbe standard typique ofVSVΔ51-Fluc. Quatre paramètres de l'analyse de régression non linéaire généré une courbe à partir de laquelle la Colline inconnu pfu d'entrée (estimation du titre viral) peut être interpolée. Ces titres estimés sont appelées unités d'expression viraux (VEU). Figure 3A montre VeUS et les titres obtenus en effectuant un essai de plaque standard avec les mêmes échantillons 10. Les échantillons provenaient d'une expérience où divers produits chimiques ont été utilisés pour améliorer la réplication et la propagation de VSVΔ51-Fluc en cellules 786-0. VeUS interpolée à partir de la courbe d'étalonnage doit être multipliée par un facteur qui est basé sur la dilution du surnageant de l'échantillon est transféré à des cellules Vero (dans ce cas, le facteur de dilution est de 5). La corrélation linéaire entre les titres et VEU est représenté sur la figure 3B Avec un R 2 de 0,8083 et r le score de Pearson de 0,899 (p <0,0001). Sur la figure 4, les données typiques de cytotoxicité cellulaire obtenues à partir d'une analyse métabolique est signalée 786-0 pour les cellules traitées avec des produits chimiques avant l'infection avec VSVΔ51-Fluc. Enfin, la figure 5 montre des courbes typiques de standards obtenus avec différents virus (Herpes Simplex Virus (HSV), le virus de la vaccine, et virus adéno-associé (AAV), tout en exprimant la luciférase Firefly) et décrit les temps d'incubation et des cycles de gel-dégel, selon les besoins.

Figure 1: Flux de travail de haut débit virus titrage et test de cytotoxicité utilisant VSV Δ 51-Fluc. (A) Seed 2,5 x 10 4 cellules Vero par puits (100 pi) et incuber à 37 ° C. (B) 24h transfert plus tard 25 pi de courbe standard sur de cellules Vero (2 colonnes par plaque). (C) de transfert de 25 ul d'échantillons à titré sur des cellules Vero restants. plaques de centrifugation et incuber à 37 ° C. (D) d'un montant égal à 10% du volume dans le puits, ajouter réactif REMA à la plaque contenant les échantillons originaux. Incuber les plaques à 37 ° C. (E) Après 3 heures, lire et enregistrer la fluorescence et d'évaluer la cytotoxicité. (F) Après 5 h, ajouter 25 ul de solution à 2 mg / ml de luciférine dans chaque puits de cellules Vero. Lire luminescence et de calculer les parts de l'expression virale.
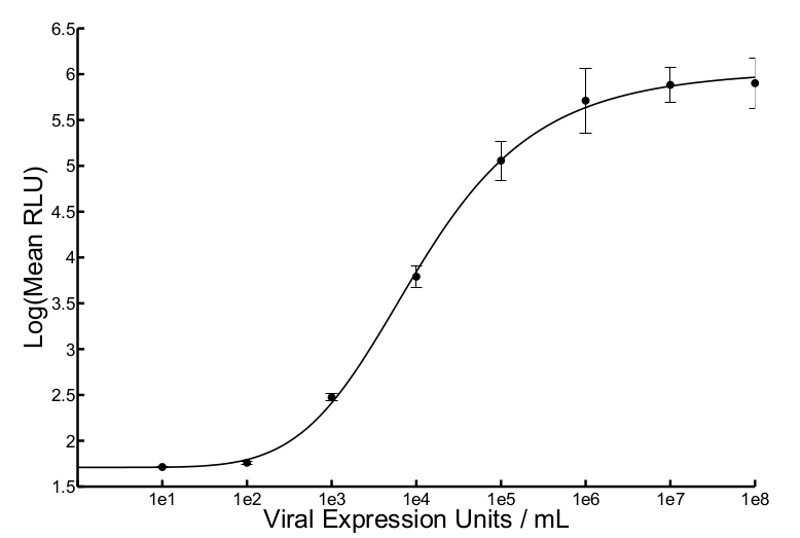
Figure 2 attendu courbe standard de VSV Δ 51-Fluc. Expression de la luciférase moi étaitasured 5 transfert, après surnageant h en cinq points différents dans un puits à l'aide d'un luminomètre et bioluminescence a été exprimée en unités relatives de lumière moyennes (RLU). Moyenne RLU a été tracée en fonction de l'entrée connue pfu / ml pour résoudre la régression non linéaire et générer une équation de Hill. La moyenne des deux courbes répétées et les barres d'erreur standard sont affichés (r 2 = 0,9993).

Figure 3: Comparaison des titres de standards de dosage sur plaque avec ceux obtenus par la méthode à haut débit. (A) Les titres viraux en pfu / ml obtenue par dosage de plaque standard sur des cellules Vero ont été comparés aux titres viraux calculées (VEU / ml) à partir des mêmes échantillons titrés en utilisant l'analyse à haut débit de la luciférase (B). Relation linéaire entre VEU / ml et le titre obtenu par standard ptest laque. Courbe de régression linéaire et le coefficient de détermination (R 2) sont affichés.

Figure 4 Exemple de viabilité. Viabilité de l'échantillon avant le transfert de surnageant sur des cellules Vero a été déterminée par l'évaluation de l'activité métabolique cellulaire en utilisant une solution résazurine disponible dans le commerce. Valeurs de fluorescence brutes ont été normalisées à celle des non traités, des puits non infectées.
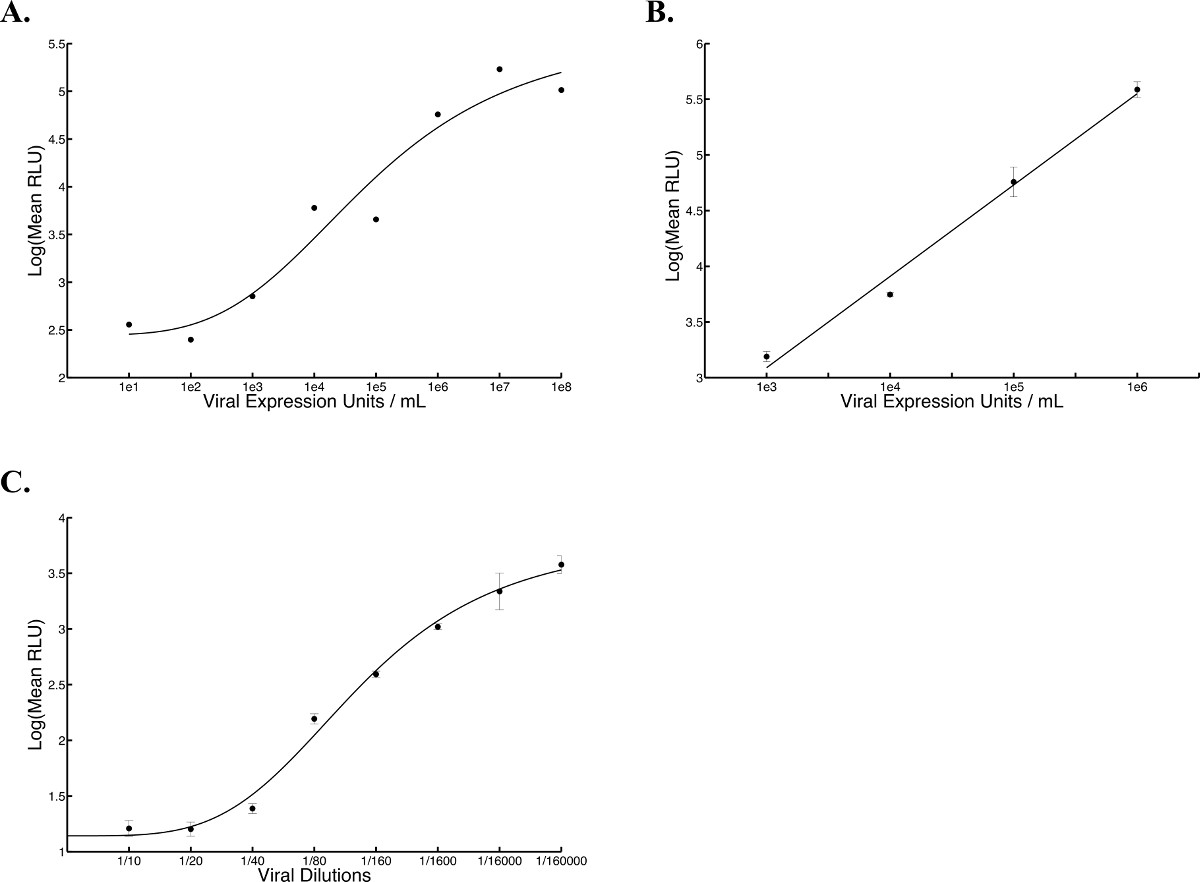
Figure 5 attendus courbes standard avec HSV, la vaccine et les virus AAV. Expression de la luciférase a été mesurée en cinq points différents dans un puits à l'aide d'un luminomètre et bioluminescence a été exprimée en rela moyennesunités légères tifs (AVC). (A) courbe standard HSV a été ajouté sur cellules Vero plaqué 24 heures plus tôt, à une densité de 2,5 x 10 4 cellules par puits (100 pi) et la mesure de la luciférase a été faite 17 h transfert post surnageant (R 2 = 0,9489, n = 1). Une équation de Hill a été généré en résolvant la régression non-linéaire. Courbe de référence (B) de la vaccine a été ajouté sur les cellules Vero plaqué 24 h plus tôt une densité de 2,5 x 10 4 cellules par puits (100 pl) et on incube pendant 2,5 heure à 37 ° C, après quoi les mesures de luciférase ont été prises (R2 = 0,9892). Une équation linéaire est généré en résolvant la régression linéaire (C). AAV courbe standard a été ajouté sur les cellules de carcinome de poumon humain (A549) plaqué 24 heures plus tôt à une densité de 2,5 x 10 4 cellules par puits (100 ul) et de la mesure de la luciférase a été faite 24 h post infection. Une équation de Hill a été généré en résolvant la régression non-linéaire. La moyenne desde cinq courbes répétées et les barres d'erreur standard sont affichés (R 2 = 0,9926).
Discussion
L'approche basée sur la luciférase décrit ici fournit un certain nombre d'avantages par rapport à d'autres méthodes existantes, y compris la facilité, la rapidité, la nécessité d'un minimum d'équipement, et un coût relativement faible. Un contributeur clé pour cela est l'évitement d'une étape de dilution en série. Néanmoins, les dérivés à base de dilution-série de ce protocole sont certainement faisable et ont récemment été utilisées pour évaluer les titres Ebola luciférase exprimant dans un écran de antiviral à haut débit 11. Bien que par nature plus de temps et plus cher, ces adaptations peuvent offrir une plus grande gamme dynamique pour la quantification virale lorsque cela est nécessaire. En plus d'être particulièrement bien adapté pour évaluer les titres viraux dans le contexte d'écrans à haut débit, notre méthode de quantification sur la base virale à une seule étape de la luciférase produit des estimations précises des virions infectieux dans le cas de la multiplication de virus. En outre, des lectures de luminescence ainsi que des données de cytotoxicité de la même expérience donnent un plusimage complète de l'effet des conditions expérimentales sur des cellules cibles, ce qui est particulièrement utile dans le contexte du virus oncolytiques et les écrans de médicaments.
L'exemple illustré ici utilise un virus répliquant à ARN simple brin négatif; Cependant, ce protocole peut être adapté à un nombre de réplication et les virus ne se répliquant pas avec quelques ajustements mineurs de protocole. Cela comprend des virus à ADN tels que la vaccine, HSV, et AAV (voir figure 5). Les échantillons infectés par des virus intracellulaires, tels que le virus de la vaccine, par exemple, nécessitent une étape de libération de virus avant quantification (par exemple, au moins un cycle de congélation-décongélation). Lors de l'application de cette technique à d'autres virus, il est nécessaire d'optimiser le temps d'incubation du transfert du surnageant viral ou lysat à la lecture des plaques par le luminomètre. Ce paramètre dépend principalement sur le cycle de replication du virus dans la lignée cellulaire permissive et la force de la pimpresario conduite expression de la luciférase. Ceci est mieux fait en utilisant la courbe d'étalonnage complète dans l'étape d'optimisation. Pour ce faire, il faut infecter la lignée cellulaire permissive appropriée avec diverses répétitions de la courbe standard préparé et lu chaque répétition à un autre moment des points post-transfert. Idéalement, un point de temps d'incubation est choisi qui mène à une relation linéaire entre LOG (AVC) et LOG (titre) couvrant la gamme échantillon de titre prévu. Pour VSVΔ51-Fluc, elle est généralement de 10 4 pfu / ml à 10 7 pfu / ml pour un temps d'incubation de 5 heures. Si les titres plus faibles ou plus fortes sont attendues à partir d'échantillons, on peut simplement augmenter ou de réduire le temps d'incubation respectivement. Alternativement, les échantillons peuvent être dilués à tomber dans la gamme beaucoup comme on le fait généralement pour ELISA.
Comme mentionné ci-dessus, ce procédé est bien adapté pour effectuer des écrans de médicaments à haut débit utilisant des banques de drogues comme la plupart des étapes peuvent être automatisées. Les cellules peuvent être étalées efficiently l'aide d'un distributeur automatique de microplaque, la bibliothèque de médicaments peuvent être ajoutés à l'aide d'un gestionnaire de canaux de liquide 96, le virus peut être ajouté à l'aide d'un distributeur de plaques de microplaque et lue à l'aide d'un luminomètre automatique. En théorie, cela peut également être adapté à 384 puits et de petits formats; Toutefois, la limitation à cette fin est le nombre de cellules qui peuvent être étalées, moins de cellules données conduit à une gamme plus étroite dans la linéarité du LOG (AVC) à LOG relation (titre). Enfin, l'évaluation de la viabilité des cellules en utilisant la résazurine ou d'autres colorants métaboliques peut être facilement incorporé dans le flux de production, ce qui permet la discrimination des composés cytotoxiques dans les écrans antiviraux ou identifier des composés qui conduisent à la mise à mort synergique en combinaison avec des virus 12. Néanmoins, les limites de ce procédé comprennent l'exigence d'un virus transgénique exprimant la luciférase, ce qui n'est pas toujours possible, et la disponibilité d'une lignée cellulaire permissive suffisamment. Cependant, il est possible d'adapter probableProcédé pour l'utilisation avec d'autres gènes rapporteurs (par exemple, GFP) à condition que le procédé de quantification reporter a une linéarité appropriée et le rapport signal sur bruit. Dans l'ensemble, la méthode à haut débit décrit peut être modifié pour convenir à de nombreux virus différents et adaptés à diverses applications.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Vanessa Garcia is funded by a Queen Elizabeth II Ontario Graduate Scholarship in Science and Technology and Cory Batenchuk by a Natural Sciences and Engineering Research Council fellowship.
matériels
| Name | Company | Catalog Number | Comments |
| Dulbeccos' Modified Eagle's Medium (DMEM) | Corning | SH30243.01 | |
| Fetal bovine serum | NorthBio Inc. | NBSF-701 | |
| Phosphate buffered saline | Corning | 21-040-CV | |
| HEPES | Fisher Scientific | BP310-1 | Prepare a 1 mM solution, pH 7.3 |
| alamarBlue | AbD Serotec | BUF012B | |
| D-Luciferin potassium salt | Biotium | 10101-2 | |
| 96-well solid white flat bottom polystyrene TC-treated microplates | Corning | 3917 | 384-well plates can also be used for higher throughput |
| Synergy Mx | BioTek | SMTBL | Monochromator microplate reader |
| Liquidator96 | Mettler Toledo | LIQ-96-200 | 96 tip manual pipetting system |
| Liquidator96 LTS Tips sterilized with filters | Mettler Toledo | LQR-200F | Any sterile filtered tips compatible with pipettors of choice are appropriate |
| Microflo | BioTek | 111-206-21 | Used to plate cells in a 96-well plate |
| Fluoroskan Ascent FL | Thermo Scientific | 5210450 | Microplate fluorometer |
Références
- Grigorov, B., Rabilloud, J., Lawrence, P., Gerlier, D. Rapid titration of measles and other viruses: optimization with determination of replication cycle length. PLoS One. 6 (e24135), (2011).
- Lizee, G., et al. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum Gene Ther. 14, 497-507 (2003).
- McSharry, J. J. Uses of flow cytometry in virology. Clin Microbiol Rev. 7, 576-604 (1994).
- Watcharatanyatip, K., et al. Multispecies detection of antibodies to influenza A viruses by a double-antigen sandwich ELISA. J Virol Methods. 163, 238-243 (2010).
- Dawson, E. Rapid, Direct Quantification of Viruses in Solution Using the ViroCyt Virus Counter. Journal of Biomolecular Techniques. 23 (S10), (2012).
- Snyder, R. O. AAV and RT-PCR: true or false. Mol Ther. 1, 389-390 (2000).
- Diallo, J. S., Roy, D., Abdelbary, H., De Silva, N., Bell, J. C. Ex vivo infection of live tissue with oncolytic viruses. J Vis Exp. 52, (2011).
- Gaush, C. R., Smith, T. F. Replication and plaque assay of influenza virus in an established line of canine kidney cells. Appl Microbiol. 16, 588-594 (1968).
- Green, M., Loewenstein, P. M. Human adenoviruses: propagation, purification, quantification, and storage. Curr Protoc Microbiol. 14 (14C 11), (2006).
- Diallo, J. S., Vaha-Koskela, M., Le Boeuf, F., Bell, J. Propagation, purification, and in vivo testing of oncolytic vesicular stomatitis virus strains. Methods Mol Biol. 797, 127-140 (2012).
- Hoenen, T., Groseth, A., Callison, J., Takada, A., Feldmann, H. A novel Ebola virus expressing luciferase allows for rapid and quantitative testing of antivirals. Antiviral Res. 99, 207-213 (2013).
- Diallo, J. S., et al. A high-throughput pharmacoviral approach identifies novel oncolytic virus sensitizers. Mol Ther. 18, 1123-1129 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon