Method Article
Hochdurchsatz-Titration von Luciferase-exprimierenden rekombinanten Viren
In diesem Artikel
Zusammenfassung
This article presents a high-throughput luciferase expression-based method of titrating various RNA and DNA viruses using automated and manual liquid handlers.
Zusammenfassung
Standard plaque assays to determine infectious viral titers can be time consuming, are not amenable to a high volume of samples, and cannot be done with viruses that do not form plaques. As an alternative to plaque assays, we have developed a high-throughput titration method that allows for the simultaneous titration of a high volume of samples in a single day. This approach involves infection of the samples with a Firefly luciferase tagged virus, transfer of the infected samples onto an appropriate permissive cell line, subsequent addition of luciferin, reading of plates in order to obtain luminescence readings, and finally the conversion from luminescence to viral titers. The assessment of cytotoxicity using a metabolic viability dye can be easily incorporated in the workflow in parallel and provide valuable information in the context of a drug screen. This technique provides a reliable, high-throughput method to determine viral titers as an alternative to a standard plaque assay.
Einleitung
Classical viral plaque assays continue to be a mainstay in virus research even though they can be notoriously time-consuming and constitute a significant bottleneck to obtaining results from experiments. More rapid indirect virus quantification methods have emerged including quantitative polymerase chain reaction (qPCR), ELISA, and flow cytometry1-4. Recent innovations such as the Virocyt virus counter can directly count viruses using advanced flow sorting technology and through a combination of protein and DNA/RNA dyes5. While all of these methods have undoubtedly quickened the pace of virus research, each method has its advantages and drawbacks. For example, qPCR can allow for quantification of specific viral genome sequence but cannot effectively discriminate infectious from defective virions6. ELISAs can be very specific however require a suitable antibody against the desired target viral protein and can be very expensive. While flow cytometry technology offers many advantages and has improved significantly, throughput and accessibility to highly specialized equipment nonetheless remains a hurdle. Importantly, all of these techniques are not ideally suited for high-throughput screening, for which the ease and time requirement of the virus quantification step is of critical importance.
Here we describe a high-throughput and easily automatable technique to titer viruses that express a Firefly luciferase (Fluc) transgene. This method generates approximate viral titers in a test sample based on luminescence signal reads through the parallel use of a standard curve of known amounts of virus. Samples containing unknown quantities of luciferase-expressing virus are transferred on to a permissive “plaquing” cell line in parallel with the standard virus dilution curve and virus-associated luminescence is read after a few hours incubation time. This allows for rapid, quantitative, often same-day generation of results, unlike classic plaque assay protocols which typically require several days of incubation in order to manually count visible plaques7-9.
The protocol outlines the steps of our titration method using oncolytic Vesicular Stomatitis Virus encoding a Fluc transgene (VSV∆51-Fluc) as an example and provides an overview of 1. Sample preparation 2. The plating of a permissive cell line for virus titration using an automated dispenser 3. The preparation of the viral standard curve 4. The transfer of the sample supernatants onto the permissive cell line using a 96-well manual pipettor 5. The assessment of sample cytotoxicity using a cell viability reagent 6. The preparation of the luciferin substrate 7. Reading of bioluminescence and 8. Data analysis.
Protokoll
1. Probenvorbereitung
- Proben, die erhalten Luciferase-exprimierenden Virus (hierin VSVΔ51-Fluc als Beispiel) für die Titration und Übertragung in 96-Well-Platten. Alternativ führen Infektionen in 96-Well-Gewebekulturplatten und Nutzung Ständen direkt.
- Verlassen zwei Säulen unbehandelt für die Aufnahme von Standardkurven. Für Experimente direkt in 96-Well-Platten,-Titer am Ende des Experiments (40 h nach Infektion) oder bei -80 ° C und Titer zu einem späteren Zeitpunkt erfolgen.
2. Herstellung von permissiven Zellen für Virustitration
- 24 Stunden vor der Titrierung Eine Suspension von Vero-Zellen bei einer Konzentration von 2,5 x 10 5 Zellen / ml in Dulbeccos modifiziertem Eagle-Medium (DMEM), das 10% fötales Rinderserum (FBS), 30 mM HEPES und 1% Penicillin / Streptomycin. HINWEIS: Dieses Protokoll Vero-Zellen verwendet, kann jede geeignete permissive Zelllinie für die VSV-Infektion be verwendet.
- Saatgut 2,5 x 10 4 Zellen (100 ul) in 96-Well-weißer Feststoff-Flachbodenplatten unter Verwendung eines Mikrospender.
- Bereiten Sie 12 ml Zellsuspension pro Platte plus 5 ml zur Grundierung.
- Saubere Mikrospender Kassette durch Spülen der Rohrleitung mit 50 ml sterilem Wasser.
- Füllen Sie die Mikrospender Linien mit Zellsuspension und lassen 5 ml Zellsuspension durch fließen.
- Wählen Sie ein Programm, das 100 ul in jede Vertiefung einer weißen Mauern 96-Well-Platte verzichtet werden. Verzichtet werden, und wiederholen Sie nach Bedarf für zusätzliche Platten. Saatgut auch ein paar Vertiefungen in einer 96-Well-Flachboden klar Platte, wenn undurchsichtige Boden weißen Mauern Platten werden zur Überprüfung der Zellgesundheit und Dichte verwendet.
- Wenn Sie fertig sind, spülen Zellen wieder in Originalbehälter. Reinigen der Kassette laufen 50 ml 70% Ethanol, gefolgt von 50 ml warmem sterilem Wasser durch die Rohrleitung.
- Stellen Sie sicher, Kassette und Schläuche sind appropriately zwischen den Anwendungen zu reinigen.
- Zellen für 24 h bei 37 ° C inkubieren in einer befeuchteten 5% CO 2-Inkubator.
3. Herstellung von Viral Standardkurve
- Vorbereitung einer Standardkurve von VSVΔ51-Fluc in Serum-freiem DMEM, so dass die Endkonzentration des Plaque-bildenden Einheiten (pfu) pro ml nach Transfer auf Vero-Zellen ist wie folgt: 10 8 pfu / ml, 10 7 pfu / ml, 10 6 pfu / ml, 10 5 pfu / ml, 10 4 pfu / ml, 10 3 pfu / ml, 10 2 PBE / ml, und 10 1 pfu / ml. Bereiten Sie 50 ul jeder Konzentration pro Platte von Vero-Zellen sowie eine zusätzliche 10%.
HINWEIS: Titer des Luciferase-Virus Lager müssen in einem klassischen Weg 10, um eine Standardkurve, die zur absoluten Quantifizierung ermöglicht erzeugen bewertet werden. Ansonsten relative Quantifizierung kann ohne genaue Titer Informationen willkürlich Einstellung virale Titer erreicht werden kannauf Verdünnungsschritte. Beispielsweise die erste Verdünnung der Standardkurve kann bis zu 10 8 Viruseinheiten und der folgenden Verdünnung 1:10 bis 10 7 und so weiter eingestellt werden. In diesem Zusammenhang sollte man Werte als-fache Veränderung gegenüber einer vorbestimmten Probe als eine absolute Quantifizierung ist nicht genau auszudrücken.
4. Übertragung der Probe auf Überstände permissiven Zellen
- Überprüfen Vero-Zellen in der klaren Boden 96-Well-Platte unter einem Lichtmikroskop überzogen, um zu bestätigen, dass Monoschichten sind mindestens 95% konfluent.
- Transfer 25 ul Probe Stand auf Vero-Zellen in der weißen Wandplatten ausgesät. Überstände in die 2 Spalten für Standardkurven bezeichnet nicht übertragen. HINWEIS: Dies kann gleichzeitig für alle Vertiefungen auf einer einzigen Platte mit einem 96-Kanal-Liquid Handler erfolgen.
- Verwendung einer 8 oder 12-Kanal-Multi-Kanal-Pipette, fügen Sie 25 ul jeder Verdünnung der Standardkurve in Schritt 3 auf die Vero-Zellen hergestellt inDie 2 bezeichneten Spalten.
- Zentrifuge Platten für 5 min bei 430 · g bei RT.
- Inkubation für 5 h bei 37 ° C in einer befeuchteten 5% CO 2-Inkubator.
5. Bewertung der Lebensfähigkeit der Zellen
- HINWEIS: Wenn ausgehend von Überständen von Infektionsversuche in klaren 96-Loch-Platten durchgeführt erhalten, können Proben Lebensfähigkeit vor der Quantifizierung mit einer Lebensfähigkeit der Zellen beurteilt werden Indikatorfarbstoff wie Resazurin.
- Hinzufügen Resazurin in einer Menge gleich 10% des Volumens in jedem Well der 96-Well-Platte der Proben Virus und Zellen enthält. Schließen Zell nur steuert sowie Medien-Kontrolle nur, um Werte für 100% und 0% Lebensfähigkeit bzw. zu bestimmen.
- Nach 2-4 Stunden (Inkubationszeit je nach Zelltyp und von der Konzentration der im Handel erhältlich oder rekonstituierte Pulver des Farbstoffes kann variieren), lesen und notieren Sie die Signal mit einem Fluoreszenz-Plattenlesegerät (530-560 Anregung, 590 Emission). Bericht Zelle viability für eine Probe nach der Formel Relative Stoffwechselaktivität = ((Test Probensignal - negativen Steuersignal) / (Cell nur das Steuersignal - negativen Steuersignal)) x 100%
6. Vorbereitung des Luciferinsubstrat
- 30 min vor dem Ende der 5-stündigen Inkubation bereiten Luciferin, eine 2 mg / ml Lösung in steriler Phosphat-gepufferter Salzlösung (PBS) erhalten. Bereiten Sie 2,5 ml pro Platte plus ein extra 2 ml. Schutz-Lösung von Licht. Hinweis: Das Luciferin kann auch früher am Tag hergestellt und bei 4 ° C bis zur Verwendung gelagert werden.
7. Lesen Biolumineszenz
- Nach 5 h Inkubation werden 25 ul Luciferin zu jeder Vertiefung der Vero-Zellen in den weißen Festplatten. Hinzufügen Luciferin manuell oder mit einem automatischen Spender im Luminometer integriert. HINWEIS: Die Verwendung von einem Gerät mit nur Einzel-und Endpunkt liest kann die Zugabe eines Luciferase-kompatibel Lyse buf erforderlichfer vor der Zugabe des Luciferin-Substrat, um die Konsistenz zu verbessern.
- Lesen Sie die Platten mit den folgenden Parametern:
- 5 Sekunden schütteln.
- Warten Sie 30 Sekunden.
- Lesen Lumineszenz bei einer entsprechenden Fest Empfindlichkeit / Belichtungswert. Wenn die Option auf dem Gerät verfügbar ist, verwenden Multi-Point liest (zB 3 x 3-Matrix), um die Genauigkeit zu verbessern.
- Notieren und die Intensität quantifiziert Biolumineszenz.
- Wenn ein automatisierter Spender wurde verwendet, um hinzuzufügen Luciferin spülen Luciferin und Minister die Linien mit warmem sterilem Wasser.
8. Datenanalyse
- Für genaue Ergebnisse, löst das nicht-lineare Regression, um eine Hill-Gleichung aus den Standardkurven zu erzeugen. Wenden Sie diese Gleichung, um die Proben titriert viralen Expressionseinheiten zu berechnen. Einige Viren oder Situationen kann eine Standardkurve mit einer linearen Beziehung herzustellen; in diesem Fall löst für eine lineare Gleichung.
Ergebnisse
Ein Überblick über die Arbeitsweisen durch die Hochdurchsatz-Verfahren ist in Abbildung 1 dargestellt. Abbildung 2 zeigt die Ergebnisse eines typischen Standardkurve ofVSVΔ51-Fluc. Vier-Parameter-nichtlinearen Regressionsanalyse erzeugt eine Hill-Kurve, aus dem unbekannten Eingangs pfu (Schätzung der Virustiter) interpoliert werden kann. Diese geschätzten Titer werden als viralen Expressionseinheiten (VEU). 3A zeigt VEUS und Titer durch Ausführen eines Standard-Plaque-Assay mit den gleichen Proben 10 erhalten. Proben stammten von einem Experiment, in dem verschiedene Chemikalien wurden verwendet, um die Replikation zu erhöhen und von VSVΔ51-Fluc verbreitet in Zellen 786-0. VEUS aus der Standardkurve interpoliert, um einen Faktor, der von der Verdünnung der Probenüberstände beruht zu multiplizieren, die auf Vero-Zellen überführt (in diesem Fall ist der Verdünnungsfaktor 5). Die lineare Korrelation zwischen dem Titer und VEU ist in 3B gezeigt, Mit einem R 2 von 0,8083 und einer Pearson-r-Score von 0.899 (p <0,0001). In Figur 4 ist typisch Zytotoxizität von Daten von einem metabolischen Assay erhaltenen 786-0 für Zellen mit Chemikalien vor der Infektion mit VSVΔ51-Fluc behandelt gezeigt. Schließlich zeigt 5 typische Standardkurven mit verschiedenen Viren erhalten (Herpes Simplex Virus (HSV), Vaccinia-Virus und Adeno-assoziierte Virus (AAV), die alle exprimierenden Firefly Luziferase) und beschreibt Inkubationszeiten und Gefrier-Auftau-Zyklen, wie gewünscht.

Abbildung 1. Workflow-Hochdurchsatz-Virus Titerung und Zytotoxizität-Test unter Verwendung VSV Δ 51-Fluc. (A) Samen, 2,5 x 10 4 Vero-Zellen pro Vertiefung (100 ul) und Inkubation bei 37 ° C. (B) 24h später Transfer 25 ul Standardkurve auf Vero-Zellen (2 Spalten pro Platte). (C) Transfer von 25 ul Proben, die auf die verbleibenden Vero-Zellen titriert werden. Zentrifuge Platten und bei 37 ° C. (D) in einer Höhe von 10% des Volumens in die gut, fügen Resazurin Reagenz zu der Platte mit den Originalproben. Platten bei 37 ° C. (E) inkubieren Nach 3 h, lesen und beschreiben und zu bewerten Fluoreszenz Zytotoxizität. (F) Nach 5 h, fügen Sie 25 ul von 2 mg / ml Lösung von Luciferin in jede Vertiefung der Vero-Zellen. Lesen Lumineszenz und berechnen viralen Expressionseinheiten.
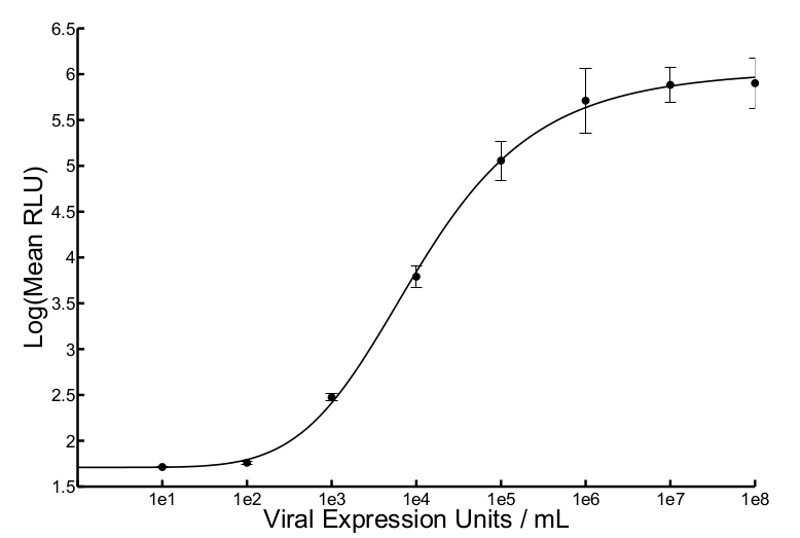
Abbildung 2. Erwartete Standardkurve von VSV Δ 51-Fluc. Mich Luciferaseexpressiongesicherter 5 Stunden nach der Überstand Übertragung an fünf verschiedenen Punkten innerhalb eines gut mit einem Luminometer und Biolumineszenz wurde im mittleren relativen Lichteinheiten (RLU) angegeben. Bedeuten RLU wurde gegen bekannte Eingangs aufgetragen pfu / ml, die nicht-lineare Regression gelöst und erzeugen eine Hill-Gleichung. Der Durchschnitt von zwei Wiederholungs Kurven und Standardfehlerbalken dargestellt (r 2 = 0,9993).

Figur 3 Vergleich von Standard-Plaque-Assay-Titer mit denjenigen von Hochdurchsatz-Verfahren erhalten. (A) Virustiter in pfu / ml durch Standard-Plaque-Assay auf Vero-Zellen erhalten wurden, berechnet die viralen Titer (VEU / ml) aus den gleichen Proben titriert mit der Hochdurchsatz-Luciferase-Assay verglichen. (B) lineare Beziehung zwischen VEU / ml und Titer über Standard-p erhaltenLaque-Assay. Lineare Regressionskurve und der Bestimmungskoeffizient (R 2) dargestellt sind.

Abbildung 4. Beispiel Lebensfähigkeit. Beispiels Lebensfähigkeit vor der Überstand Übertragung auf Vero-Zellen wurde durch die Bewertung zelluläre metabolische Aktivität mit einem handelsüblichen Resazurin-Lösung bestimmt. Raw Fluoreszenzwerte wurden normalisiert, um die von unbehandelten, nicht infizierten Brunnen.
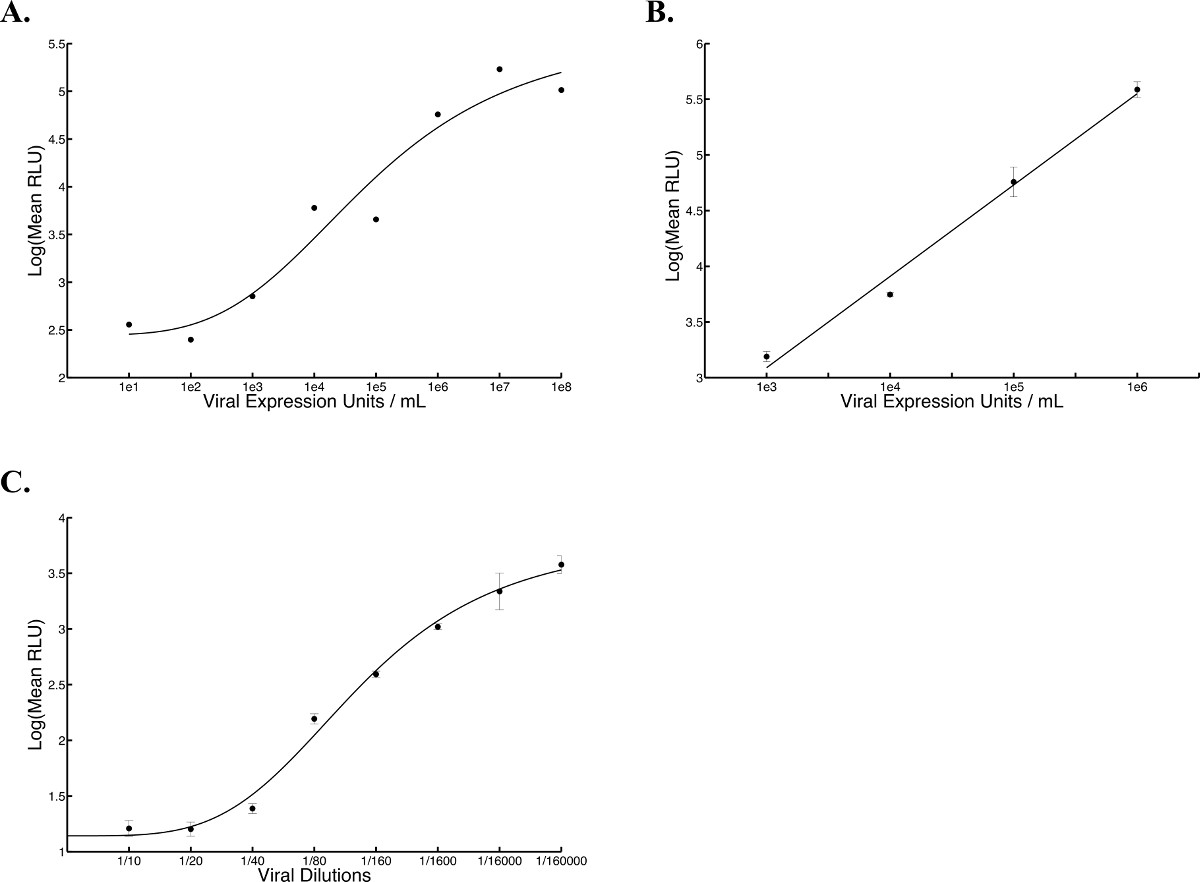
Abbildung 5. Erwartete Standardkurven mit HSV, Vaccinia und AAV-Viren. Luciferase-Expression wurde an fünf verschiedenen Punkten innerhalb eines gut mit einem Luminometer gemessen und Biolumineszenz wurde im mittleren rela ausgedrückttive Lichteinheiten (RLU). (A) HSV-Standardkurve wurde auf Vero-Zellen gegeben plattierten 24 Stunden vorher mit einer Dichte von 2,5 x 10 4 Zellen pro Vertiefung (100 ul) und die Luciferase-Messung erfolgte 17 h nach der Übertragung überstehende (R 2 = 0,9489, n = 1). Eine Hill-Gleichung wurde durch die Lösung der nicht-linearen Regression erzeugt. (B) Vaccinia-Standardkurve wurde auf Vero-Zellen gegeben plattierten 24 Stunden vorher eine Dichte von 2,5 x 10 4 Zellen pro Vertiefung (100 ul) und 2,5 h bei 37 ° inkubiert, C, wonach Luciferase Messungen vorgenommen wurden (R 2 = 0,9892). Eine lineare Gleichung wurde durch die Lösung für die lineare Regression erzeugt. (C) AAV-Standardkurve wurde auf menschlichen Lungenkarzinomzellen (A549) zugegeben plattierten 24 Stunden vorher mit einer Dichte von 2,5 x 10 4 Zellen pro Vertiefung (100 ul) und die Luciferase-Mess wurde 24 Stunden nach der Infektion. Eine Hill-Gleichung wurde durch die Lösung der nicht-linearen Regression erzeugt. Die durchschnittlichevon fünf Wiederholungs Kurven und Standardfehlerbalken dargestellt (R 2 = 0,9926).
Diskussion
Die hier beschriebene Luciferase basierenden Ansatz bietet eine Reihe von Vorteilen gegenüber anderen bestehenden Methoden einschließlich der Leichtigkeit, Schnelligkeit, Minimalausstattung notwendig und relativ niedrigen Kosten. Ein wichtiger Beitrag dazu ist die Vermeidung eines Verdünnungsschritt. Dennoch sind Verdünnungsbasierte Derivate dieses Protokoll sicherlich möglich und wurden vor kurzem zur Luciferase-exprimierenden Ebola-Titer in einem Hochdurchsatz-Antivirus-Bildschirm von 11 zu bewerten. Während naturgemäß zeitaufwändig und teurer, können solche Anpassungen größeren Dynamikbereich für die virale Quantifizierung bieten, wenn nötig. Zusätzlich dazu, dass sich besonders gut zur Auswertung Virustiter im Rahmen der Hochdurchsatz geeignet ist, erzeugt unser Ein-Schritt-Luciferase-basierte virale Quantifizierungsverfahren genaue Schätzungen von infektiösen Virionen bei der Replikation von Viren. Weiterhin Auslesungen der Lumineszenz mit Zytotoxizität von demselben Experiment ergeben einvollständiges Bild der Wirkung der Versuchsbedingungen auf Zielzellen, die besonders nützlich im Zusammenhang mit der onkolytischen Viren und Drogen-Bildschirme ist.
Das hier dargestellte Beispiel wird eine Replikation von negativen Einzelstrang RNA-Virus; Jedoch kann dieses Protokoll auf eine Anzahl von replizierenden und nicht-replizierende Viren mit einigen geringfügigen Anpassungen Protokoll angepasst werden. Dazu gehören DNA-Viren, wie Vaccinia, HSV und AAV (siehe Abbildung 5). Proben mit intrazelluläre Viren, wie Vaccinia-Virus infiziert sind beispielsweise, eine Virentrennschritt vor der Quantifizierung (zB mindestens einem Gefrier-Auftau-Zyklus). Bei der Anwendung dieser Technik auf andere Viren, ist es notwendig, die Reaktionszeit von der Übertragung des viralen Überstand oder Lysat, um das Lesen der Platten durch das Luminometer zu optimieren. Dieser Parameter wird in erster Linie auf der Replikationszyklus des Virus in der permissiven Zelllinie und der Stärke der p hängenromoter Fahr Luciferase-Expression. Dies geschieht am besten mit Hilfe der Standardkurve voll in die Optimierung Schritt getan. Um dies zu tun, muß man die entsprechende permissive Zellinie mit verschiedenen Wiederholungen des hergestellten Standardkurve zu infizieren und zu lesen jede Wiederholung bei einer verschiedenen Zeitpunkten nach der Übertragung. Idealerweise wird eine Inkubationszeit Punkt gewählt, die zu einer linearen Beziehung zwischen log (RLE) und LOG (Titer) führt überspannt den erwarteten Proben Titerbereich. Für VSVΔ51-Fluc ist dies typischerweise von 10 4 pfu / ml bis 10 7 pfu / ml für 5 Stunden Inkubationszeit. Wenn niedrigeren oder höheren Titer von Proben erwartet, kann man einfach mit höheren oder niedrigeren die Inkubationszeit. Alternativ können Proben verdünnt werden, um in dem Bereich viel, wie es typischerweise für ELISA getan fallen.
Wie oben erwähnt, ist dieses Verfahren gut geeignet, um hohen Durchsatz Drogen-Bildschirme mit Wirkstoffbibliotheken meisten Schritte können automatisiert durchzuführen. Zellen plattiert efficiently unter Verwendung eines automatisierten Mikroplatten-Dispenser kann die Medikamentenbibliothek unter Verwendung eines 96-Kanal-Handler Flüssigkeit zugegeben werden kann, kann unter Verwendung eines Mikroplatten-Virus Spender zugesetzt, und die Platten gelesen unter Verwendung eines automatisierten Luminometer. Theoretisch kann dies auch für 384er oder kleinere Formate angepasst werden; jedoch die Einschränkung zu diesem Zweck ist die Anzahl der Zellen, die plattiert werden können, da weniger Zellen führt zu einem engeren Bereich in der Linearität der LOG (RLU) bis (Titer) Beziehung Protokoll. Schließlich können Beurteilung der Lebensfähigkeit der Zellen unter Verwendung von Resazurin oder andere Stoffwechsel Farbstoffe leicht in den Workflow integriert werden, so dass für die Diskriminierung von zytotoxischen Verbindungen in der antiviralen Bildschirmen oder zur Identifizierung von Verbindungen, die an synergistische Tötung in Kombination mit Viren 12 führen. Dennoch Beschränkungen dieses Verfahrens umfassen das Erfordernis eines Luciferase-Transgen exprimierenden Virus, was nicht immer möglich ist, und die Verfügbarkeit eines ausreichend permissive Zelllinie. , Wahrscheinlich möglich, anzupassen, ist es jedochVerfahren zur Verwendung mit anderen Reportergene (zB GFP) bereitgestellt Reporter Quantifizierungsverfahren eine geeignete Linearität und das Signal-Rausch-Verhältnis. Insgesamt können die beschriebenen Verfahren mit hohem Durchsatz angepasst werden, um viele verschiedene Viren entsprechen und unterschiedliche Anwendungen zugeschnitten.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Vanessa Garcia is funded by a Queen Elizabeth II Ontario Graduate Scholarship in Science and Technology and Cory Batenchuk by a Natural Sciences and Engineering Research Council fellowship.
Materialien
| Name | Company | Catalog Number | Comments |
| Dulbeccos' Modified Eagle's Medium (DMEM) | Corning | SH30243.01 | |
| Fetal bovine serum | NorthBio Inc. | NBSF-701 | |
| Phosphate buffered saline | Corning | 21-040-CV | |
| HEPES | Fisher Scientific | BP310-1 | Prepare a 1 mM solution, pH 7.3 |
| alamarBlue | AbD Serotec | BUF012B | |
| D-Luciferin potassium salt | Biotium | 10101-2 | |
| 96-well solid white flat bottom polystyrene TC-treated microplates | Corning | 3917 | 384-well plates can also be used for higher throughput |
| Synergy Mx | BioTek | SMTBL | Monochromator microplate reader |
| Liquidator96 | Mettler Toledo | LIQ-96-200 | 96 tip manual pipetting system |
| Liquidator96 LTS Tips sterilized with filters | Mettler Toledo | LQR-200F | Any sterile filtered tips compatible with pipettors of choice are appropriate |
| Microflo | BioTek | 111-206-21 | Used to plate cells in a 96-well plate |
| Fluoroskan Ascent FL | Thermo Scientific | 5210450 | Microplate fluorometer |
Referenzen
- Grigorov, B., Rabilloud, J., Lawrence, P., Gerlier, D. Rapid titration of measles and other viruses: optimization with determination of replication cycle length. PLoS One. 6 (e24135), (2011).
- Lizee, G., et al. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum Gene Ther. 14, 497-507 (2003).
- McSharry, J. J. Uses of flow cytometry in virology. Clin Microbiol Rev. 7, 576-604 (1994).
- Watcharatanyatip, K., et al. Multispecies detection of antibodies to influenza A viruses by a double-antigen sandwich ELISA. J Virol Methods. 163, 238-243 (2010).
- Dawson, E. Rapid, Direct Quantification of Viruses in Solution Using the ViroCyt Virus Counter. Journal of Biomolecular Techniques. 23 (S10), (2012).
- Snyder, R. O. AAV and RT-PCR: true or false. Mol Ther. 1, 389-390 (2000).
- Diallo, J. S., Roy, D., Abdelbary, H., De Silva, N., Bell, J. C. Ex vivo infection of live tissue with oncolytic viruses. J Vis Exp. 52, (2011).
- Gaush, C. R., Smith, T. F. Replication and plaque assay of influenza virus in an established line of canine kidney cells. Appl Microbiol. 16, 588-594 (1968).
- Green, M., Loewenstein, P. M. Human adenoviruses: propagation, purification, quantification, and storage. Curr Protoc Microbiol. 14 (14C 11), (2006).
- Diallo, J. S., Vaha-Koskela, M., Le Boeuf, F., Bell, J. Propagation, purification, and in vivo testing of oncolytic vesicular stomatitis virus strains. Methods Mol Biol. 797, 127-140 (2012).
- Hoenen, T., Groseth, A., Callison, J., Takada, A., Feldmann, H. A novel Ebola virus expressing luciferase allows for rapid and quantitative testing of antivirals. Antiviral Res. 99, 207-213 (2013).
- Diallo, J. S., et al. A high-throughput pharmacoviral approach identifies novel oncolytic virus sensitizers. Mol Ther. 18, 1123-1129 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten