Method Article
RNAi טריגר משלוח לתוך
In This Article
Summary
RNA interference (RNAi) is an extremely valuable tool for uncovering gene function. However, the ability to target genes using RNAi during pre-adult stages is limited in the major human malaria vector Anopheles gambiae. We describe an RNAi protocol to reduce gene function via direct injection during pupal development.
Abstract
RNA interference (RNAi), a naturally occurring phenomenon in eukaryotic organisms, is an extremely valuable tool that can be utilized in the laboratory for functional genomic studies. The ability to knockdown individual genes selectively via this reverse genetic technique has allowed many researchers to rapidly uncover the biological roles of numerous genes within many organisms, by evaluation of loss-of-function phenotypes. In the major human malaria vector Anopheles gambiae, the predominant method used to reduce the function of targeted genes involves injection of double-stranded (dsRNA) into the hemocoel of the adult mosquito. While this method has been successful, gene knockdown in adults excludes the functional assessment of genes that are expressed and potentially play roles during pre-adult stages, as well as genes that are expressed in limited numbers of cells in adult mosquitoes. We describe a method for the injection of Serine Protease Inhibitor 2 (SRPN2) dsRNA during the early pupal stage and validate SRPN2 protein knockdown by observing decreased target protein levels and the formation of melanotic pseudo-tumors in SRPN2 knockdown adult mosquitoes. This evident phenotype has been described previously for adult stage knockdown of SRPN2 function, and we have recapitulated this adult phenotype by SRPN2 knockdown initiated during pupal development. When used in conjunction with a dye-labeled dsRNA solution, this technique enables easy visualization by simple light microscopy of injection quality and distribution of dsRNA in the hemocoel.
Introduction
מלריה היא מחלה זיהומית יתושים המשפיעה מיליונים רבים של אנשים בכל שנה. ארגון הבריאות העולמי (WHO) מדווח כי בשנת 2013 היו כ 584,000 מקרי מוות עקב מלריה, 78 אחוזים מהם התרחשו אצל ילדים מתחת לגיל חמש שנים 1. הפתוגנים שגורמים מלרית אדם הם טפילים נבגוניות בתוך Plasmodium הסוג והם מועברים בין מארחי האדם שלהם על ידי יתושי אנופלס נקבה. הילוכים מתרחשים כאשר היתוש לוקח ארוחת דם ביחיד נגוע, ולאחר מכן פיקדונות טפילים מזהם בתוך אדם נגוע בארוחת דם עוקבת. בתוך הסוג אנופלס, אנופלס gambiae הוא המין עם קיבולת וקטורים הגדולה הוא וקטור מלריה הבולטים באפריקה שמדרום לסהרה 1-3.
נכון לעכשיו, בקרת וקטור יתושים על ידי פריסה של הדברה ממשיכה bדואר השיטה הגדולה מועסקת על מנת להפחית את הניטל של מלרית אדם. למרות השימוש הדברה מאז 1960 הוכיחה להיות מוצלח מאוד, עליית התנגדות חרקים העלתה צורך בפיתוח חומרי הדברה הרומן ואסטרטגיות בקרת וקטור אלטרנטיבה 4-7. במהלך שנת 2010, סך של 49 מתוך 63 מדינות דיווח ארגון הבריאות העולמי הצביע על התרחשות של התנגדות הדברה וקטורים מלריה 1. בנוסף, הכלי Mapper IR, אשר מנצל ספרות ביקורת עמיתים להעריך נתונים התנגדות באזורים Afrotropical, מדווח כי בין השנים 2001 ו -2012 היו 46% ו -27% עליות התנגדות pyrethroids ו dichlorodiphenyltrichloroethane (DDT), בהתאמה 7.
התערבות RNA (RNAi) זוהה בתחילת 1990 כטכניקה שיכול להיות מועסק על מנת להשבית את הגנים בצמח פטוניה 8,9 וב הפטרייה Neurospora crassa 9,10. זמןקצר לאחר מכן,בשנת 1998, RNAi תועדה לראשונה ב elegans Caenorhabditis כאמצעי לצמצום ביטוי גנים במודל חיה על ידי כניסתה של antisense או RNA פעמיים גדיל (dsRNA) באמצעות שיטות הזרקה או האכלה 9,11. מאז גילויו, RNAi יש מהפכה במרדף עידן הגנומיקה בכך שהוא מאפשר לחוקרים לנצל גנטיקה הפוכה כדי לחקור את התפקידים התפקודיים במהירות של גנים של עניין באמצעות מנגנון להשתקת גנים סלקטיבית מאוד שלאחר תעתיק. באורגניזמים מסוימים, כגון תסיסנית, שימוש האורגניזם מהונדס מבטאים בונים RNA מפריע הצליח נרחב עבור מציאת גן (KD). למרות השימוש transgenes ב An. gambiae עבור RNAi נוצל ועשוי להיות שימושי עבור מסכים בקנה מידה גדולה, הדור של זני יתושים מהונדסים הוא גם העבודה וזמן אינטנסיבי, לוקח בדרך כלל שניים עד שלושה חודשים כדי לעבור את זיהוי של גן המעניין את generatiעל של מנייה מהונדסת מתאימה 12. נכון לעכשיו, השיטה העיקרית של KD גן ב An. gambiae הוא בזריקה לתוך hemolymph, בשלב המבוגר, של dsRNA ספציפי גן מסוים 12,13. תהליך זה בדרך כלל לוקח בערך חודש ללכת מהזדהות של גן של עניין להערכה של KD הגן, להוכיח להיות הרבה יותר מהיר מאשר שיטות מהונדסות 12. שיטות-בשלב הזחל RNAi הוקמו לאחרונה ב An. gambiae ו Aedes aegypti באמצעות ננו-חלקיקי האכלת 14-17 או על ידי משלוח אוראלי של microalgae המבוסס dsRNA מולקולות 18, המציעות הזדמנויות לבצע ניתוח גנומי תפקודי במהלך בשלבים מוקדמים של פיתוח. ב הזרקה ישירה, האכלה, ושיטות משלוח nanoparticle, dsRNA נלקח באופן אוטונומי על ידי התא היעד ביקע ידי האנזים דייסר לתוך 21-25 נוקליאוטידים-ארוך "קצר מפריעים RNAs" (siRNAs) 19,20. siRNAs אלה אז incorporated לתוך השתקה המושרה RNA מורכב (RISC), שממנו גדיל אחד ייפסל, המאפשר במתחם RISC הנכנס RNA להיקשר ודבק mRNA היעד ובכך להפחית את רמתו ומעכבות ותרגומו 19,20.
מאפיינים מהותיים רבים של ביולוגית יתוש בסיסית לווסת קיבולת וקטורים, לרבות נטייתו מארח (למשל, חוש ריח, gustation), הזדווגות, רבייה וחסינה. לאור החשיבות של תהליכים ביולוגיים אלה, סביר להניח כי האפנון שלהם ברמה גנטית או תרופתית יציע הזדמנויות חדשות עבור בקרת וקטור, כוללים עקיפה של התנגדות חרקים, ולספק כלים חדשים גישות משולבות רחב יותר לניהול וקטור. השימוש גנומיקה תפקודי להעריך את התפקידים של גנים הבסיסיים תכונות ביולוגיות המהותיות אלה יאפשר זיהוי של מטרות חדשות ולספק תובנה חדשות על איך אנחנו יכולים ליצור ביעילות חדשה, strateg שליטה אפקטיבית יותרies. אנו מתארים את הפיתוח ושימוש שיטת הזרקה מהירה לייזום RNAi בשלב הגלמים של An. gambiae. אנו צופים כי הזרקה בשלב גלמים של טריגר RNAi מאפשרת תצפית של פנוטיפים כתוצאה במבוגרים בשלב מוקדם, כלומר, במוקדם לאחר הופעתה מ יהיה ציין אם גן המציאה הופעל מבוגרים שלאחר הופעתה. שיטות זה מאפשרת מציאת גן מתחיל בזמן ההפסקה התפתחותי הגלמים והארכה לשלבים בוגרים, כך מציאת גן היזם במהלך התפתחות גלמי יכולה להתמיד להשפיע סוגי תאי hemolymph נגיש בוגרים מוקדמים, כמו גם סוגי תאים, כי הם יותר hemolymph-נגישים במהלך המטמורפוזה מאשר מבוגר, כגון עצב סנסורי נמצא נספחים מבוגרים לאחר הופעתה.
Protocol
סינתזה 1. הכנת dsRNA
- לזיהוי אזור 200-800 נ"ב מציאה (על מנת ליצור את dsRNA המקביל) בתוך הגן של עניין כי הוא נבא כי אין השפעות חוץ-המטרה מזוהות (למשל, לא נ"ב רצף הומולוגיה ≥18 בתוך גן אחר) ו שליטה שלילית (למשל , רצף Heterologous כי הוא אינו נוכח בתוך הגנום חרק היעד, כגון הגן lacZ Escherichia coli (GenBank ג'ין מזהה: 945,006). לחלופין, להשתמש כביקורת חיובית (למשל, אשר מניב פנוטיפ ציין בקלות, כגון SRPN2 21,22 ג'ין מזהה, GenBank:. 1270169) רצף של SRPN2 מיקוד dsRNA מוגדר מישל ואח '(2005) 21..
הערה: E-RNAi הוא משאב bioinformatic קוד פתוח כי הוא שימושי עבור זיהוי של אזורים כאלה ועבור בתהליך של תכנון פריימרים oligonucleotide 23. - בצע standard PCR הגברה (כלומר, הופיעה עם תקי DNA פולימראז באמצעות 30-35 מחזורים) באמצעות הדנ"א הגנומי או תבנית cDNA להשיג תבנית סינתזה dsRNA מוקף רצף האמרגן T7 (5'-TAATACGACTCACTATAGGG-3 ') ו ממשיך בהכנות dsRNA ו לנקות בעזרת ערכת שעתוק מסחרית במבחנה לפי הוראות יצרן. השתמש SRPN2 PCR תנאי הגברה ומידע פריימר כפי שהוצג ב An et al. (2011) 22.
- לכמת תשואות amplicon RNA מטוהרים על ידי ספקטרוסקופיה ספיגת אולטרה סגול באורך גל של 260 ננומטר ולהתאים את הריכוז הרצוי (למשל, 3 מיקרוגרם / μl) במים RNase חינם.
- לפתרון בעיות ריכוזים RNA נמוך, להפחית נפח הנוזל על ידי ספינינג דגימות למטה בצנטריפוגה ואקום בטמפרטורת החדר או על ידי lyophilizing דגימות reconstituting בכמויות קטנות יותר של מים. הזמן הדרוש lyophilization מדגם ישתנה בהתאםעל כרכי מדגם ראשונים ריכוזי dsRNA.
- בדוק את איכות ואורך של dsRNA על ג'ל 2% agarose מוכן עם 1x TBE או טה חיץ מוכתם ברומיד ethidium (EtBr), יחד עם תבנית ה- DNA משמש התגובה שעתוק. DsRNA יהגר לאט יותר תבנית ה- DNA. איכות ואורך ניתן להעריך על ידי ומבטיח לא קיימים מוצרים dsRNA הלא ספציפית על ידי השוואת מוצרים בטוש DNA סטנדרטי, בהתאמה.
הערה: EtBr הוא mutagen חזק יש לטפל בהתאם.
הערה: בריכוז dsRNA של 3 מיקרוגרם / μl, 0.5 μl של המדגם הוא יותר מהדרוש להדמיה על הג'ל agarose מוכתם EtBr. - אחסן dsRNA ב -20 ° C עד הצורך. מחזורי הקפאה / פשרה מרובות עלולים לגרום שפלה, כך aliquots אמור להיות מוכן עבור כמויות גדולות של dsRNA.
2. כן המהיר גרין FCF דיי (FGD) צינורות
- לדלל צבע ירוק FCF מהירמפתרון המניות (תוכן לצבוע ≥85%) ל -0.1% (v / v) (הפתרון עובד) במים RNase חינם.
- פיפטה 1 μl של צבע לתוך החלק התחתון של צינור 1.5 מ"ל microcentrifuge.
- המקום צינורות בתוך גוש חום 65 מעלות צלזיוס למשך כ 3 שעות להתאדות צינורות במקום נוזל, אז בטמפרטורת החדר למשך 30 דקות לפחות, כדי לקרר לפני השימוש. מוצק צבע יבש זה יהיה לשקם בתמיסה resuspension dsRNA.
3. מחט הזרקת Pull
- משוך מחטים זכוכית בורוסיליקט באמצעות חולץ מחט מחוממת בקוטר טיפ של 10-30 מיקרומטר. משוך הגדרות מתאימות: מחמם התאמה לא. 1 = 100, התאמת מחמם לא. 2 = 70.
- כדי למנוע ניזק טיפ הנאה של המחט, למקם את כל מחטי המשך אופקיים בצלחת פטרי על רצועת קריצה מרק.
הערה: פרטים נוספים על מחט נימי משייכת שיטות ניתן למצוא פרטים נוספים על מחקר המלריה והפנית מגיב מרכז משאבי MR4 ידנית 24.
4. כן תחנת הזרקה
- אסוף חומרים דרושים: מחטי הזכוכית microcapillary משכו עד קצה קנס, microinjector, נייר סינון דק נייר סינון עבה, צלחות פטרי, טפטפות העברה, מברשת צבע מיקרוסקופ אור לנתח.
- הכן את microinjector כפי שהורה במדריך microinjector, ולהגדיר נפח הזרקת נפח רצוי לכל דופק (למשל, לכל היותר 69 nl לכל דופק).
- על פלטפורמה קלה לתמרן במיקרוסקופ (למשל, צד שטוח של מתלת צינור קלקר), לערום את גיליונות נייר שני פילטר עם נייר הסינון הדק על גבי, ובטוח עם קלטת מסביב לקצוות.
- Resuspend 10 μl של כל פתרון dsRNA צינורות לצבוע בצבע נפרד, ומניחים על קרח.
5. איסוף גלמים עבור הזרקה
- ממלאים קטן 60 מ"מ x 15 מ"מ צלחת פטרי עם 10 מ"ל של מים ללא יונים, ולאסוף ~ 50 גלמים חיוור (דוריng התגלמות 24 שעות לאחר הראשון) מתוך מגש insectary בעזרת פיפטה העברת פלסטיק חד פעמיות.
- הסר גלמים שיש בינוני עד שיזוף לציפורן כהה.
הערה: לאחר לציפורן מתחילה להשתזף, הוא הופך להיות יותר קשה לחדור לציפורן, ותוצאות הזרקה קטלנית גבוהה בהרבה.
6. הזרקת dsRNA
- תחת המיקרוסקופ לנתח, לנתק את קצה דיסטלי של מחט הזריקה עם זוג מלקחיים בסדר.
- הכן את מחט הזריקה ידי למלא את משבצות המחט עם שמן מינרלים (באמצעות מזרק עם מחט 3 אינץ ', 30 מד), וגירוש עודפי שמן עם microinjector.
- חזית למלא מחט זריקה עם סכום מקסימאלי של dsRNA, והוצא דופק אחד תחת מיקרוסקופ כדי להבטיח את המחלק של נוזל. בכל מקרה שבו לא נוזלי נלקח למעלה / או גורשו, לבדוק את קצה דיסטלי של המחט עבור כל חסימה ולהבטיח כי המחט מאובטח היטב microinjector.
- פיק 1-3 גלמים, ומניחים אותם על נייר הסינון.
- באמצעות המכחול, מקם את הגלמים על נייר פילטר עם גב לציפורן נגיש, ולהשתמש במכחול לדחוף על נייר סינון ולספוג של עודפי מים.
- ייצב את הגולם עם קצה המכחול, ולהכניס את המחט לתוך לציפורן הגבה בין בית החזה והבטן בזווית של כ 30 מעלות ביחס לפני השטח הגבי של הגולם. הזרקת צריכה להיות מופנית כלפי הקצה האחורי של גולם ואת המחט צריך להתרגש בכיוון הקדמי אל האחורי.
- להזריק שני פולסים (69 nl לכל הדופק) של 3 מיקרוגרם / פתרון dsRNA μl לתוך hemolymph, ולבדוק לחלוקת צבע בכל הגוף. אם אין צבע מזוהה, להעביר את מיקום המחט הזרקת מעט כדי לנקות את קצה מחסימה וחזור משלוח נוזלי.
- השתמש מכחול הרטוב לעבור גולם בעדינות את המחט לתוך מים עבור culturing. Tהוא גולם צריך להיצמד המכחול לנוגע אור.
7. תנאים לאחר הזרקה
- מניחים צלחת פטרי עם גלמים מוזרק לתוך כלוב יתושים עם זרימת אוויר מתאים (למשל, כלוב רשת או מיכל עם מכסה רשת). תנאי גידול גלמי צריכים להישאר עקבי 27 ± 3 ° C טמפרטורה, 75 לחות ± 5% ולהיות תחת אור: חושך מחזור של 16: 8 שעות.
- כן 10% (w / v) פתרון גלוקוז, ומניח כדור צמר גפן רווי פתרון כלוב יתושי רשת האכלה מבוגרת.
8. הערכת מציאה
- בשלב נקודות הרצוי (ים), להעריך פנוטיפים בחרקים ניסיוני dsRNA מוזרק, בהשוואה לקבוצת הביקורת.
- להעריך חרקי dsSRPN2 ו dsLacZ מדי יום על ידי מצמרר למטה מבוגרים במשך כ 2-3 דקות ב -20 מעלות צלזיוס, והעביר צלחת קרה ב -2 מעלות צלזיוס וזיהוי כל היווצרות פסאודו-סרטנית על ידי ניצול של מיקרוסקופ לנתח ב 15Xגדלה עם תאורת brightfield. לאחר הערכה, לחזור מבוגרים לתנאי insectary (27 ± 3 מעלות צלזיוס, 75 ± 5% לחות).
הערה: dsRNAs הניסיון ושליטה מועסק בפרוטוקול זה dsSRPN2 ו dsLacZ, בהתאמה. ישנן אפשרויות רבות מתאימות שולטים; עם זאת, הוא הציע כי שליטה חיובית עבורו פנוטיפ ו / או הביטוי היא דמיינו בקלות (למשל, על ידי לנתח מיקרוסקופיה) ו / או לכמת [למשל, בזמן אמת PCR כמותי (qRT-PCR), כתם המערבי] אמור לשמש כאשר לומדים את הטכניקה הזו. חלבון SRPN2 וכימות תמליל באמצעות כתם המערבי qRT-PCR, בהתאמה, מתוארים מישל et al. (2005) 21.
- להעריך חרקי dsSRPN2 ו dsLacZ מדי יום על ידי מצמרר למטה מבוגרים במשך כ 2-3 דקות ב -20 מעלות צלזיוס, והעביר צלחת קרה ב -2 מעלות צלזיוס וזיהוי כל היווצרות פסאודו-סרטנית על ידי ניצול של מיקרוסקופ לנתח ב 15Xגדלה עם תאורת brightfield. לאחר הערכה, לחזור מבוגרים לתנאי insectary (27 ± 3 מעלות צלזיוס, 75 ± 5% לחות).
תוצאות
הזרקת גלמים עבור תשואות KD גן תוצאות אופטימליות כאשר ההזרקה מתבצעת בשלב הגלמים מוקדם, כאשר רמות שיזוף לציפורן נמוכות (איור 1 א ', שמאל, ו -1 B). גברת שיזוף והתקשות של לציפורן, בדרך כלל לאחר 24 שעות, תוצאות במוות גלמי עלה בעקבות הזרקה (איור 1 א, מרכז וימין). קצב ההתפתחות גלמי יכול להשתנות בהתאם לתנאי insectary וצפיפות בעלי חיים 24,25; ולכן, עדיף להעריך פיגמנטציה חזותית.
במהלך תהליך ההזרקה, מחט הנימים מוכנס לתוך לציפורן הגב בזווית של כ -30 מעלות הקדמיות לכיוון אחורי (איור 2 א). לאחר המחט מוחדרת ואת dsRNA + 0.01% (w / v) FGD הוא חילק, חלוקת לצבוע ניכר ברחבי hemolymph (figuמחדש 2B).
הערכת הופעתה מבוגרת גלמים הזריקה 0.01% (w / v) FGD חשף בשיעור ממוצע של הופעתה 70%, בהשוואה ל -96.7% הופעתה של בקרות שאינן מוזרק (איור 3 א). מן הראוי לציין כי הופעתה חלקית ממקרה גלמי נצפתה עבור מספר רב של יתושים שאינם שורדים (איור 3 ב). חיות מוזרקות להפגין ללא עיכובים בזמן הופעתה (איור 4 א) או השפעה מוטה משני המגדר (האיור 4B). הערכה נוספת של בוגר ששרד ביצע עד היום 10 הופעתה פוסט חושף שום השפעה ניכרת על הישרדות מבוגר שלאחר הופעתה (איור 4C).
אימות של איכות KD הוערכה על ידי פסאודו הגידול melanotic (אשכול פיגמנט כהה רקמה) פנוטיפ הקשורים SRPN2 מציאה 21,22 כביקורת חיובית עבור מציאה ואת בהעדר פנוטיפים הקשורים הזרקת dsLacZ כביקורת שלילית. יתושים למבוגרים שצצו דורגו ביום 8 לאחר הזרקה (יום 6-7 שלאחר ההופעה). Melanotic-גידולים פסאודו (איור 5 א ו 5 ב) נצפו באמצעות לציפורן של 93.5% של dsSRPN2 לעומת 0% מכלל היתושים הבוגרים dsLacZ (איור 6 א). אשכולות של רקמת melanized בקדרות זוהו על דיסקציה של טלאים פיגמנט (5C איור). פסיאודו גידולים נראו על לציפורן המבוגרת מוקדם ככל 3 יום-הופעתה פוסט ונכחו גם קבוצת משנה של hemolymph dsSRPN2 ורקמות בטן (מידע לא מוצג). בשעה 5 לאחר ההזרקה (בשלב הבוגר מוקדם), ירד משמעותית SRPN2 רמות dsSRPN2, אבל לא dsLacZ או מבודד חלבון hemolymph מוזרק הלא נצפתה (איור 6).
ftp_upload / 53,738 / 53738fig1.jpg "/>
איור 1: היערכות התפתחותית להזרקת dsRNA גלמי הזרקת גלמים מוקדם של תוצאות dsRNA בהישרדות והתקדמות אופטימליות לתוך לשלב בוגר.. רמות נמוכות של פיגמנטציה לציפורן (A, עזבו, ו- B) ניתן להבחין בתוך ההתגלמות הבאה 0-24 השעות הראשונות. שיזוף של הזריקה הקודמת לציפורן גלמים (A, מרכז וימין) תוצאות בינוניות עד הישרדות עניה.
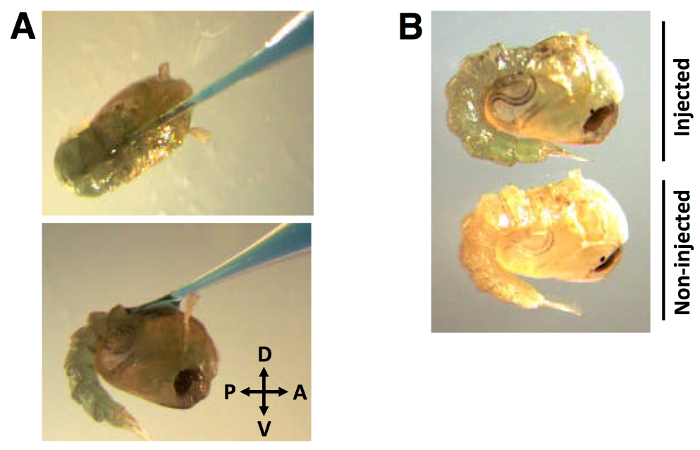
איור 2:. עמדת הזרקה והפצה של שכותרתו לצבוע dsRNA (א) הזרקת מחט נימים של dsRNA שכותרתו צבע לתוך לציפורן הגב בזווית של כ -30 מעלות, ב קדמי אל אחורי כיוון. (ב) הצבע מופץ בעליל hemolymph הגלמים. נפח הזרקה dsRNA של 138 NL, שכותרתו עם 0.01% FGD (w / v).

איור 3:. הופעתה הבוגרת לאחר ההזרקה (א) 70% של גלמים הזריקו 0.01% FGD (w / v) יצא בהצלחה (n = 60), בהשוואה ל -96.7% בקבוצת הביקורת הלא מוזרק (n = 60). שלושה ביולוגי משכפל בוצע. (ב) הופעתה חלקית ממקרה גלמי נצפתה עבור מספר רב של יתושים שאינם שורדים. ברים שגיאה מייצגים את שגיאת התקן של הממוצע (SEM).
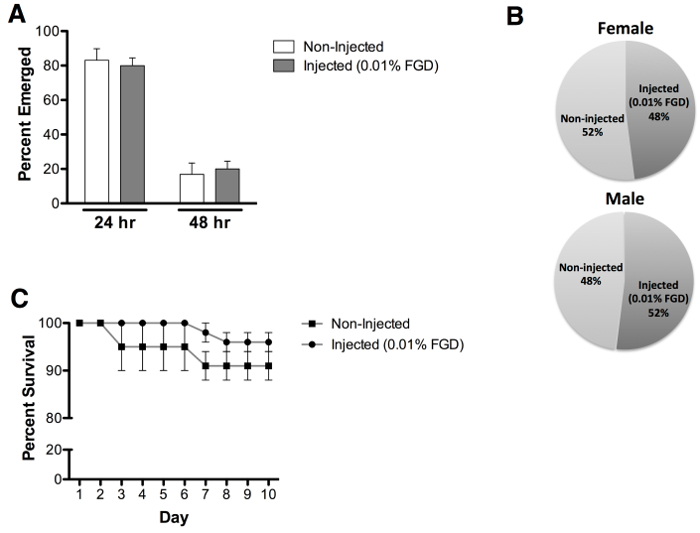
איור 4: צמיחת שיעור, הערכת מין והישרדות מבוגרים (א) זמני הופעתה להשוואה נצפו לאחר ההזרקה גלמי עם 0.01% FGD (24 hr = 80% ו 48 שעות = 20%), לעומת גלמים שאינם מוזרק (24. hr = 83% ו -48 שעות = 17%). (B ) הופעתה זכר מבוגר הנקבה השווה כ נצפתה גלמים מוזרקים 0.01% FGD (נקבה = 48% וגבריים = 52%) וגלמים הלא מוזרק (נקבה = 52% וגבריים = 48%). (ג) ניתוח ההישרדות מגלה כי הזרקה עם 0.01% FGD אינה משפיע בוגר ששרד, הערך עד יום 10 הופעתה פוסט. תוצאות מייצגי נתונים משלושה ניסויים עצמאיים עם 0.01% FGD המוזרקים (n = 60) ולא מוזרק (n = 60) גלמים (מספר שווה של זכרים ונקבות). ברים שגיאה מייצגים את שגיאת התקן של הממוצע (SEM).

איור 5: פנוטיפ בקרה חיובית גידולים פסאודו משקף מציאה מוצלחת-גידולים פסאודו נצפו על הבטן (א) ו- (ב) לציפורן החזי של dsSRPN2 -injected, אבל לא dsLacZ יתושים בוגרים -injected ב 8 יום לאחר ההזרקה..(ג) גדלה גבוהה (400X) הדמיה (א) של לציפורן דיסקציה של טלאי פיגמנט (ב) מגלה אשכולות של תאי melanized בקדרות.
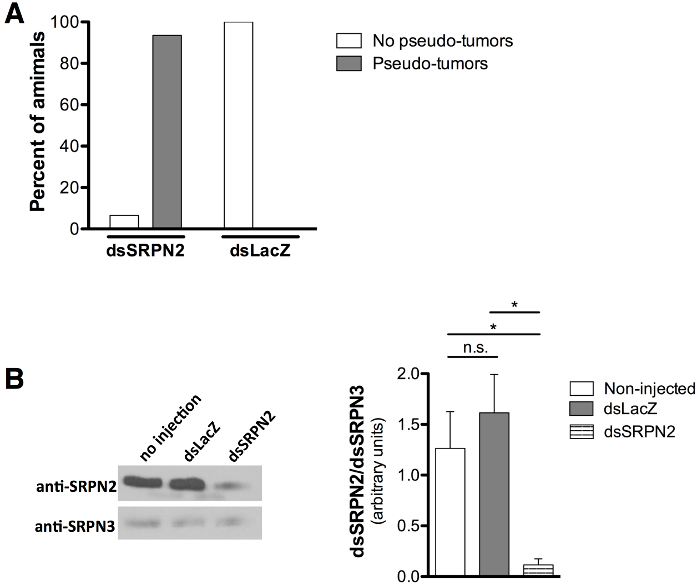
איור 6: כימות של היווצרות פסאודו הגידול וירידה רמות החלבון SRPN2 (א) זריקות בשלב גלמי לגרום להיווצרות פסאודו-גידול 93.5% מהמבוגרים dsSRPN2 (n = 21) לעומת 0% בקבוצת הביקורת dsLacZ (n = 19). . התוצאות שהתקבלו ביום 8 לאחר ההזרקה. (ב) כתם המערבי (משמאל) מראה ירידה SRPN2 רמות dsSRPN2, אבל לא dsLacZ או מבודד חלבון hemolymph הלא מוזרק (יום 5 לאחר ההזרקה). תוצאות מבוססות על שלושה ניסויים בלתי תלויים. Anti-SRPN2 21 ואנטי SRPN3 26 דילולים נוגדן השתמשו היו 1: 1,000 ו 1: 2,000, בהתאמה. עיזים אנטי-rabbit IgG-HRP (מוצר SC-2004, סנטה קרוז ביוטכנולוגיה, דאלאס TX) שימש ב 1: 5,000. כל רמות החלבון היו לכמת (מימין) לפי עוצמה הלהקה (ImageJ תוכנה, NIH, Bethesda, MD), מנורמל SRPN3, ולעומת סטטיסטית על ידי מבחן t מזווג. P <0.05: *, P ≥0.05: NS (לא משמעותי). ברים שגיאה מייצגים את שגיאת התקן של הממוצע (SEM).
Discussion
שיטות קיימות כיום גרימה הלא מהונדס RNAi ב יתושים כרוכים הזרקה ישירה של dsRNA לתוך מבוגר hemocoel 12,13 או האכלת זחל של RNAi מצופה הדק חלקיקי 14-17 או microalgae מבוסס dsRNA מולקולות 18. מיקוד היתוש הבוגר, בעוד יקר מאוד, יכול לכלול מספר רב של גנים שפועלים בתקופות התפתחותי מוקדם יותר. מציאה ביוזמת האכלת זחל עשויה להניב פנוטיפים עקביים במהלך לשלב הבוגר הנובע, בין שאר, על הפוטנציאל של התמדת חלבון משתנית דרך שלב הגלמים. לכן, מציג שיטה נוספת כי הוא מכוון באופן ספציפי על ייזום RNAi במהלך התפתחות גלמי יספק אמצעי באופן מלא יותר להעריך פונקציות גנים במהלך שלבי התפתחות טרום מבוגר, כמו גם יכול משופרים להעריך תפקוד גן בשלבי בוגרים. כמו עם גישת גן מציאה המבוססת על הזרקת dsRNA או ביטוי, ההתמדה של גן המציאהלא ניתן לחזות. לכן, רמות תעתיק או חלבון יש לבחון עבור הגן של עניין בתקופות ההתפתחותי של עניין. למרות שאנו רואים המשך של ירידה ברמות חלבון ביום 5 לאחר ההזרקה עבור SRPN2 ב SRPN2 חיות dsRNA מוזרקות, גורמים כגון מחזור חלבון מחצית חיים יכולים להיות שונים עבור מטרות שונות. זה קריטי כדי להבטיח, כמו גם, כי dsRNA לשמש להזרקה הוא גם מרוכז ומופיע ללא פגע על ג'ל agarose. אנו ממליצים הנסיינים מחדש גורמים אלה אם תוצאות מציאה אינן מספיקות, וריכוזים בהתאמה של dsRNA ייתכן שיהיו הצורך להיבדק באופן אמפירי עבור מטרות גן ספציפיות.
אנו מתארים שיטה לייזום של התערבות RNA בשלב הגלמים של An. פיתוח gambiae. שיטה זו מסתמכת על כניסתה באמצעות microinjection של dsRNA ישירות לתוך hemocoel של גלמים מוקדמים ומאפשרת הערכה של איכות הזרקה ידישימוש dsRNA שכותרתו לצבוע. היכולת לחזות איכות הזרקה מהווה שיפור חיוני להבטחת מציאה מוצלחת ומהווה היבט של מציאת גן מבוסס הזרקה כי לא נדונה פרוטוקולים ביותר שדווחו בעבר מבוסס dsRNA התמקדות בשלב הבוגר. על ידי מיקוד הגולם בתחילת תקופה התפתחותית זו, גנים שעשויים לשחק תפקיד בפרק זמן התפתחותי קריטי זה, או במהלך השלבים המוקדמים של בגרות ניתן להעריך מבחינה תפקודית. בנוסף, שיטה זו עשויה לאפשר משלוח dsRNA לתאים, והקמת התערבות RNA בתאים נגישים במהלך המטמורפוזה, אבל פחות נגישה יתושים בוגרים נוצרו באופן מלא.
ניתוח microarray לאחרונה על ידי הארקר et al. (2012) זיהו 560 An. תמלילי gambiae שהיו למעלה מוסדר או למטה מוסדר על ידי פי 4 לפחות בשלבים התפתחותיים שונים, הנעים בין העובר לבוגר. של 560 תמלילים מזוהים, סט של 309 היה למעלה מוסדר במהלך התפתחות גלמי 27. ממצאים אלה מראים כי יש דרישות רבות עבור ביטוי גני הפרש לאורך פיתוח יתושים, כוללות אלה המתרחשים בשלב הגלמים, מרווח שבמהלכו האורגניזם עובר מטמורפוזה. במינים רבים של חרקים, כולל. gambiae, גנים המעורבים בתהליכים כגון פיתוח (כלומר, cuticular גלמי וחלבונים קושרי כיטין) 27-31 התגובה החיסונית (כלומר, חלבונים דמויי קולטן אגרה) 27,32-34 מתבטאים ביותר בשלב גלמי. לאחר מבוגר מגובש לגמרי התפתח, שם הוא המשיך ביטוי גנים בתגובה סביבתי פיסיולוגי משנה 35. יש לציין, במהלך ההתפתחות הבוגרת מוקדם, יש עלייה בביטוי של גנים התפתחותיים (כלומר, cuticular מבוגר וחלבונים sarcoplasmic) 36, וכן גנים מרכזיים אחרים (כלומר , חלבון הזרע ספציפי ציטוכרום P450 אנזימי מטבוליזם) 27,36.
הביקורת החיובית לשמש בפיתוח של זה פרוטוקול, SRPN2, הוא An. מעכב פרוטאז סרין gambiae (סרפין). SRPN2 ממלא תפקיד חשוב בוויסות שלילית של melanization חרקים, תגובה חיסונית מולדת קשת רחבה בחרקים 21,22. מציאה של SRPN2 בתוצאות יתושים בוגרים היווצרות פסאודו גידול 21,22, פנוטיפ כי הוא ציין בקלות על ידי השימוש במיקרוסקופ אור. בהתחשב בכך פנוטיפ המובחן זה יכול להיות בקיע בקלות חרקי חיים, השתמשנו SRPN2 זריקות RNAi בשלב גלמים ראשוניים. בנוסף, SRPN2 מתבטא במהלך כל שלבי התפתחות 37, ובכך לספק מטרה טובה להזרקת RNAi בשלב גלמים והערכה של תפקוד אצל מבוגר מוקדם. אנו מראים כי השיטה שפיתחנו מסוגלת pseud דומה למבוגרים melanotic התרמה היווצרות o גידולים כתוצאת זריקות dsRNA בצעו בשלב הגלמים של פיתוח. בפיתוח פרוטוקול זה, ראינו הזרקה כי במהלך התפתחות גלמי מוקדם (כלומר, השעה 24 הראשונים שלאחר נשירת זחל-הגלמים) היא קריטית להשגת הופעתה המבוגרת אופטימלית. במקרה הופעתה עניה מתקבלת לאחר הזרקה, מומלץ זמני זחלים עם דיוק רב יותר, כדי להשיג גלמים עם התקשות לציפורן נרחבת פחות ולהבטיח הזרקה בשלב גלמים מוקדם מושגת. יתר על כן, מזעור ניזק התוצאות לציפורן בשיעורי הופעתה אופטימליים גדלת הגדלה במהלך ההזרקה יכול לעזור להבטיח שהאזור המיועד אך ורק של החיה הוא נקב. אם המחט צריכה לנקב דרך לציפורן הגחון, והאיגום הנוזל צבען שכותרתו יהיה ניכר על הצד החיצוני של הגולם או יהיה להרוות את נייר הסינון. מומלץ מאוד להשליך מעליו כל גלמים שיש להן יותר לנקב לציפורן אחת.
jove_content "> עם החוויות הנרחבות של מעבדות רבות עם הביצועים של זריקות יתושים בוגרות, גישות microinjection זוהו בעבר ניתן להתאים עם שינויי פרוטוקול פשוטים לשימוש בניסויי RNAi גלמים. בסך הכל, המטרה של שיטה זו היא לספק לחוקרים את היכולת ניתן לבצע להרחיב את מסגרת הזמן שבמהלכה הפוכה אנליזה גנטית, נוסף המאפשר מחקר יתמוך בפיתוח של אסטרטגיות בקרת וקטור הרומן. מעניין לציין, כי ניסויים במינים אחרים, כגון Rhodnius prolixus ו frugiperda Spodoptera, לחשוף גן תופעות השתקה נוטים להיות הרבה יותר באופן יזום במהלך מבוגר מראש טיולי 38,39. במהלך כל שלבי פיתוח, הגן בתיווך RNAi מציאה כפוף לשיקולים בדבר המהירות וההתמדה של להשתקת גנים, ואת היציבות של חלבונים המקודדים על ידי גנים ממוקדים. מטרת RNAi האידיאלית גנים נוטים להיות אלה לקודד protein או RNA כי יש זמן מחצית חיים קצר ושיעור תחלופה גבוהה 11,40.בעוד אסטרטגיות RNAi מהונדסות יכולות להיות מועסקות גם לטפל שיקולים לגבי מהירות והתמדה של RNAi בשלבי טרום מבוגר, טכניקות מהונדסות יש חסרונות רבים (למשל, זמן הנדרש לייצור קווים מהונדסים, מסגרות זמן ניסוי עבור הזדווגויות יתושים לייצר חרקים עם ביטוי dsRNA מוסדר, ותחזוקה של מניות מהונדסות). לעומת זאת, הפרוטוקול שלנו מספק לו שיטה קלה ומהירה עבור ייזום מציאת גן במהלך התפתחות גלמי ו בסוגי תאים שמקורם והם נגישים במהלך המטמורפוזה אבל הם פחות נגישים במבוגרים. שימוש השעיות dsRNA שכותרתו לצבוע מאפשר הערכה קלה של הצלחת הזרקה ופיזור החומר הציג בתוך גלמים. הנתונים שלנו על תחילת היווצרות גידולים אצל מבוגרי גלמים מוזרקים, לעומת חיות המוזרקות כמבוגרים, עולים בקנה אחד עם initiation של RNAi בתיווך מציאה בשלב הגלמים. באמצעות קו יתוש G3 שלנו ובתנאי insectary שלנו, אנו רואים את ההיווצרות פסאודו גידול melanotic המבוגר מוקדם ככל 10 ימים לאחר ההזרקה של מבוגרים מוזרקות שלושה עד חמישה ימים הופעתה פוסט. על ידי ביצוע הזרקה גלמי בשלב מוקדם, אנו צופים היווצרות פסאודו הגידול melanotic גלוי מוקדם ככל חמישה ימים לאחר ההזרקה (כלומר, שלושה עד ארבעה ימים לפרסם הופעתה). נתונים אלו מרמזים כי שיטה זו מאפשרת התחלת מציאת הגן במהלך תקופה התפתחותית תת למדה בעבר (כלומר, פיתוח גלמים). שיטת התיוג לצבוע שלנו יכולה להיות יעילה גם עבור פיתוח פרוטוקולי הזרקת זחל חדשים, בשל האופי השקוף של לציפורן במהלך כל instars הזחל. בעוד השליטה בשימוש במחקר זה דורשת התקדמות לתוך לשלב בוגר כדי להציג פנוטיפ מציאה, בניסויים עתידיים להעריך פנוטיפים בשלב ספציפי גולם לאחר הזרקה של גלמים מוקדם תספקתובנה חשובה לגבי ההתרחבות של שיטה זו לתוך תקופות התפתחותיות נוספות כגון פיתוח גלמים מאוחר. לסיכום, שיטה זו מספקת פרוטוקול RNAi ערך עבור ייזום בשלב גלמים של מציאת גן בתיווך RNAi ומרחיבה את כלי גנום התפקודי זמין לשימוש בתוך קהילת מחקר חרקי וקטור.
Disclosures
גישה פתוחה עבור מאמר וידאו זה הוא שלם על ידי ביוג'ן.
Acknowledgements
We would like to thank Dr. Flaminia Catteruccia and her research group (Harvard School of Public Health, Boston, MA) for providing our laboratory with the G3 colony used in this research and for the LacZ template DNA. We thank Adam Jenkins (Boston College, Chestnut Hill, MA) for his assistance in maintaining the insectary. The Biology Department of Boston College generously funded the research associated with the development of this technique.
Materials
| Name | Company | Catalog Number | Comments |
| MEGAscript RNAi kit | Ambion | AM1626 | |
| Nanoject II injector | Drummond | 3-000-204 | |
| Nanoject II foot switch | Drummond | 3-000-026 | |
| Borosilicate glass capillaries | Drummond | 3-000-203-G/X | |
| Glass micropipette puller | Narishigne | PB-7 | |
| Fast Green FCF dye | Sigma | F7258 | Can substitute with a non-toxic food dye. |
| Plastic transfer pipettes | Thermo Scientific | 1371150 | ¼ inch cut from tip to create a wider opening. |
| Whatman “thin” filter paper | GE Healthcare | 1001-090 | This is 9 cm diameter Grade 1, but can be altered depending on size of injection pad. |
| Western blot “thick” filter paper | BioRad | 107-3931 | This is the filter paper generally used for Western blots. |
| Petri dishes (60 mm x 15 mm) | Fisher Scientific | FB0875713A | |
| Paint brush (size 0) | Michael’s Art | 10474940 | Brush size and brand can vary based on availability and user preference. |
| Dissecting light microscope | ---- | ----- | This can vary based on availability and user preference. |
References
- Kelly-Hope, L. A., McKenzie, F. E. The multiplicity of malaria transmission: a review of entomological inoculation rate measurements and methods across sub-Saharan Africa. Malar. J. 8 (1), 1-16 (2009).
- The malERA Consultative Group on Vector Control. A Research Agenda for Malaria Eradication: Vector Control. PLoS Med. 8 (1), e1000401 (2011).
- Enyati, A., Hemmingway, J. Malaria Management: Past, Present, and Future. Annu. Rev. of Entomol. 55 (1), 569-591 (2010).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genet. 10 (3), 1004236 (2014).
- Mitchell, S. N., et al. Metabolic and Target-Site Mechanisms Combine to Confer Strong DDT Resistance in Anopheles gambiae. PLoS ONE. 9 (3), e92662 (2014).
- Knox, T. B., et al. An online tool for mapping insecticide resistance in major Anopheles vectors of human malaria parasites and review of resistance status for the Afrotropical region. Parasite Vector. 7 (76), 1-14 (2014).
- Napoli, C., Lemieux, C., Jorgensen, R. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes. Plant Cell. 2, 279-289 (2002).
- Sen, G. L., Blau, H. M. A brief history of RNAi: the silence of the genes. FASEB J. 20 (9), 1293-1299 (2006).
- Romano, N., Macino, G. Quelling: transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences. Mol. Microbiol. 6 (22), 3343-3353 (1992).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Catteruccia, F., Levashina, E. A. RNAi in the Malaria Vector, Anopheles gambiae: Therapeutic Applications of RNAi: Methods and Protocols. Methods Mol. Biol. 555, 63-75 (2009).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A). gambiae). J. Vis. Exp. (5), e230 (2007).
- Mysore, K., Andrews, E., Li, P., Duman-Scheel, M. Chitosan/siRNA nanoparticle targeting demonstrates a requirement for single-minded during larval and pupal olfactory system development of the vector mosquito Aedes aegypti. BMC Dev. Biol. 14 (9), 1-16 (2014).
- Mysore, K., Flannery, E. M., Tomchaney, M., Severson, D. W., Duman-Scheel, M. Disruption of Aedes aegypti Olfactory System Development through Chitosan/siRNA Nanoparticle Targeting of semaphorin-1a. PLoS Negl. Trop. Dis. 7 (5), (2013).
- Zhang, X., Zhang, J., Zhu, K. Y. Chitosan/double-stranded RNA nanoparticle-mediated RNA interference to silence chitin synthase genes through larval feeding in the African malaria mosquito (Anopheles gambiae). Insect Mol. Biol. 19 (5), 683-693 (2010).
- Zhang, X., et al. Chitosan/Interfering RNA Nanoparticle Mediated Gene Silencing in Disease Vector Mosquito Larvae. J. Vis. Exp. (97), e52523 (2015).
- Kumar, A., Wang, S., Ou, R., Samrakandi, M., Beerntsen, B. T., Sayre, R. T. Development of an RNAi based microalgal larvicide to control mosquitoes. Malaria World J. 4 (6), 1-7 (2013).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: A review. J. Insect Physiol. 56 (3), 227-235 (2010).
- Burand, J. P., Hunter, W. B. RNAi: Future in insect management. J. Invertebr. Pathol. 112, S68-S74 (2013).
- Michel, K., Budd, A., Pinto, S., Gibson, T. J., Kafatos, F. C. Anopheles gambiae SRPN2 facilitates midgut invasion by the malaria parasite Plasmodium berghei. EMBO Rep. 6 (9), 891-897 (2005).
- An, C., Budd, A., Kanost, M. R., Michel, K. Characterization of a regulatory unit that controls melanization and affects longevity of mosquitoes. Cell Mol. Life Sci. 68 (11), 1929-1939 (2011).
- Horn, T., Boutros, M. E-RNAi: a web application for the multi-species design of RNAi reagents--2010 update. Nucleic Acids Res. 38, W332-W339 (2010).
- Benedict, M. Q. . Methods in Anopheles Research. , (2014).
- Lyimo, E. O., Takken, W., Koella, J. C. Effect of rearing temperature and larval density on larval survival, age at pupation and adult size of Anopheles gambiae. Entomol. Exp. Appl. 63, 265-271 (1992).
- Michel, K., et al. Increased melanizing activity in Anopheles gambiae does not affect development of Plasmodium falciparum. Proc. Natl. Acad. Sci. 103 (45), 16858-16863 (2006).
- Harker, B. W., et al. Transcription Profiling Associated With Life Cycle of Anopheles gambiae. J Med Entomol. 49 (2), 316-325 (2012).
- Dotson, E. M., Cornel, A. J., Willis, J. H., Collins, F. H. A family of pupal-specific cuticular protein genes in the mosquito Anopheles gambiae. Insect Biochem. Molec. Biol. 28, 459-472 (1998).
- Hopkins, T. L., Krchma, L. J., Ahmad, S. A., Kramer, K. J. Pupal cuticle proteins of Manduca sexta: characterization and profiles during sclerotization. Insect Biochem. Molec. Biol. 30, 19-27 (1999).
- Liang, J., Zhang, L., Xiang, Z., He, N. Expression profile of cuticular genes of silkworm, Bombyx mori. BMC Genomics. 11 (173), 1-13 (2010).
- Zhou, X., Riddiford, L. M. Broad specifies pupal development and mediates the "status quo" action of juvenile hormone on the pupal-adult transformation in Drosophila and Manduca. Development. 129, 2259-2269 (2002).
- Luna, C., Wang, X., Huang, Y., Zhang, J., Zheng, L. Characterization of four Toll related genes during development and immune responses in Anopheles gambiae. Insect Biochem. Molec. Biol. 32, 1171-1179 (2002).
- Tauszig, S., Jouanguy, E., Hoffmann, J. A., Imler, J. -. L. Toll-related receptors and the control of antimicrobial peptide expression in Drosophila. Proc. Natl. Acad. Sci. 97 (19), 10520-10525 (2000).
- Tryselius, Y., Samakovlis, C., Kimbrell, D. A., Hultmark, D. CecC, a cecropin gene expressed during metamorphosis in Drosophila pupae. Eur. J. Biochem. 204, 1-5 (1992).
- Goodisman, M. A. D., Isoe, J., Wheeler, D. E., Wells, M. A. Evolution of Insect Metamorphosis: a Microarray-Based Study of Larval and Adult Gene Expression in the Ant Camponotus Festinatus. Evolution. 59 (4), 858-870 (2005).
- Cook, P. E., Sinkins, S. P. Transcriptional profiling of Anopheles gambiae mosquitoes for adult age estimation. Insect Mol. Bio. 19 (6), 745-751 (2010).
- Suwanchaichinda, C., Kanost, M. R. The serpin gene family in Anopheles gambiae. Gene. 442 (1-2), 47-54 (2009).
- Araujo, R. N., et al. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug Rhodnius prolixus (Hemiptera: Reduviidae) by dsRNA ingestion or injection. Insect Biochem. Molec. Biol. 36 (9), 683-693 (2006).
- Griebler, M., Westerlund, S. A., Hoffmann, K. H., Meyering-Vos, M. RNA interference with the allatoregulating neuropeptide genes from the fall armyworm Spodoptera frugiperda and its effects on the JH titer in the hemolymph. J. Insect Physiol. 54 (6), 997-1007 (2008).
- Scott, J. G., et al. Towards the elements of successful insect RNAi. J. Insect Physiol. 59 (12), 1212-1221 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved