Method Article
RNAi Trigger поставки в
В этой статье
Резюме
RNA interference (RNAi) is an extremely valuable tool for uncovering gene function. However, the ability to target genes using RNAi during pre-adult stages is limited in the major human malaria vector Anopheles gambiae. We describe an RNAi protocol to reduce gene function via direct injection during pupal development.
Аннотация
RNA interference (RNAi), a naturally occurring phenomenon in eukaryotic organisms, is an extremely valuable tool that can be utilized in the laboratory for functional genomic studies. The ability to knockdown individual genes selectively via this reverse genetic technique has allowed many researchers to rapidly uncover the biological roles of numerous genes within many organisms, by evaluation of loss-of-function phenotypes. In the major human malaria vector Anopheles gambiae, the predominant method used to reduce the function of targeted genes involves injection of double-stranded (dsRNA) into the hemocoel of the adult mosquito. While this method has been successful, gene knockdown in adults excludes the functional assessment of genes that are expressed and potentially play roles during pre-adult stages, as well as genes that are expressed in limited numbers of cells in adult mosquitoes. We describe a method for the injection of Serine Protease Inhibitor 2 (SRPN2) dsRNA during the early pupal stage and validate SRPN2 protein knockdown by observing decreased target protein levels and the formation of melanotic pseudo-tumors in SRPN2 knockdown adult mosquitoes. This evident phenotype has been described previously for adult stage knockdown of SRPN2 function, and we have recapitulated this adult phenotype by SRPN2 knockdown initiated during pupal development. When used in conjunction with a dye-labeled dsRNA solution, this technique enables easy visualization by simple light microscopy of injection quality and distribution of dsRNA in the hemocoel.
Введение
Малярия является комарами инфекционное заболевание, которое затрагивает многие миллионы людей каждый год. Всемирная организация здравоохранения (ВОЗ) сообщает , что в 2013 году насчитывалось около 584000 случаев смерти от малярии, 78 процентов из которых имел место у детей в возрасте до пяти лет 1. Возбудители , которые вызывают малярии человека являются апикомплексы паразиты в пределах рода Plasmodium и передаются между своими человеческими хостах самок комаров Anopheles. Передача инфекции происходит, когда комар берет крови еды от индивидуума, который заражен, а затем отложения заразных паразитов в неинфицированных человека в последующем кровяной муки. В роду Anopheles, Anopheles gambiae является вид с наибольшей мощностью и векторную является наиболее известным переносчиками малярии в странах Африки южнее Сахары 1-3.
В настоящее время управление вектором комаров путем развертывания инсектицидов продолжает бе основной метод, используемый, чтобы уменьшить бремя малярии человека. Хотя использование инсектицидов с 1960 года оказалась чрезвычайно успешной, повышение резистентности к инсектицидам вбила необходимость разработки новых инсектицидов и стратегий управления вектора альтернативного 4-7. В течение 2010 года в общей сложности 49 из 63 стран , представивших данные ВОЗ указывают на возникновение резистентности к инсектицидам переносчиков малярии 1. Кроме того, средство ИК Mapper, который использует рецензированную литературу для оценки данных сопротивления в афротропических регионах, сообщает , что в период между 2001 и 2012 годах было 46% и 27% увеличение устойчивости к пиретроидов и дихлордифенилтрихлорэтана (ДДТ), соответственно 7.
РНК - интерференция (RNAi) был идентифицирован в начале 1990 - х годов как метод , который может быть использован для инактивации генов в растении Petunia 8,9 и в грибка нейроспора густая 9,10. Вскоре после этого,в 1998 году RNAi была впервые зарегистрирована в Caenorhabditis Элеганс как средство снижения экспрессии генов в животной модели путем введения антисмысловых или двухцепочечной РНК (дцРНК) посредством инъекции или кормления методами 9,11. С момента своего открытия, RNAi произвела революцию в погоне за функциональной геномики, позволяя исследователям использовать обратной генетики быстро исследовать функциональные роли генов, представляющих интерес с помощью высокой селективностью пост-транскрипционный механизм молчанием генов. В некоторых организмов, таких как дрозофилы, использование трансгенных организмов , которые экспрессируют интерферирующих РНК конструкции была широко успешным для гена нокдауна (KD). Хотя использование трансгенов в An. gambiae для RNAi была использована и может оказаться полезным для крупномасштабных экранов, поколение трансгенных штаммов комаров как труд и время интенсивной, как правило , принимают два-три месяца , чтобы перейти от идентификации гена , представляющего интерес к generatiна соответствующей трансгенной складе 12. В настоящее время основным методом генной KD в An. gambiae является инъекцией в гемолимфе, во взрослой стадии, дцРНК специфический для данного гена 12,13. Этот процесс обычно занимает около одного месяца , чтобы перейти от идентификации гена , представляющего интерес к оценке гена KD, оказывается гораздо более быстрым , чем трансгенными методами 12. Методы личиночной стадии RNAi были созданы недавно в. gambiae и комар жёлтолихорадочный через наночастице кормления 14-17 или путем перорального введения микроводорослей на основе дцРНК молекул 18, предлагая возможности для выполнения функционального геномного анализа на ранних стадиях развития. В прямой инъекции, кормление, и способы доставки наночастицами, дцРНК ресуспендировали автономно клетки - мишени и расщепляется ферментом Dicer в 21-25 нуклеотида длинные "коротких интерферирующих РНК» (киРНК) 19,20. Эти миРНК затем incorporованные в РНК-индуцированного глушителей комплекса (RISC), из которых одна нить будет отброшен, позволяя РНК-связанный комплекс RISC - связываться с и расщепляют мРНК - мишени , и тем самым снизить его уровень и ингибировать его перевод 19,20.
Многие внутренние особенности основного москитной биологии модулировать векторную потенциала, включая предпочтения хозяина (например, обоняния, дегустации), вязки, воспроизводства и иммунитета. Учитывая важность этих биологических процессов, вполне вероятно, что их модуляция на генетической или фармакологической уровне будет предлагать новые возможности для борьбы с переносчиками, включая обход устойчивости к инсектицидам, а также обеспечить новые инструменты для более широко интегрированных подходов к векторного управления. Использование функциональной геномики для оценки роли генов, лежащих в основе этих внутренних биологических особенностей позволит выявить новые цели и обеспечить новое понимание того, как мы можем эффективно создавать новые, более эффективного управления Strategх годов. Мы опишем разработку и использование экспресс - метода впрыска для инициирования RNAi во время стадии куколки Ап. gambiae. Заметим , что куколки инъекции этап триггера RNAi обеспечивает наблюдение полученных фенотипов на ранних стадиях взрослых, то есть, скорее после появления , чем наблюдалось бы , если ген нокдаун были инициированы у взрослых после появления всходов. Этот метод позволяет нокдаун гена начиная во куколки интервала развития и опускающийся взрослых стадий таким образом, что ген нокдаун инициирована во время развития куколки могут сохраняться и влияют на раннее взрослых гемолимфы доступных типов клеток, а также типы клеток, которые являются более гемолимфы доступной во время метаморфоза чем у взрослого человека, таких, как сенсорные нейроны, обнаруженных у взрослых придатков после появления всходов.
протокол
1. Синтез и подготовка дсРНК
- Определить нокдаун область 200-800 пар оснований (для создания соответствующего дцРНК) в пределах интересующего гена , который предсказан не иметь идентифицируемые эффекты вне цели (например, отсутствие гомологии последовательностей ≥18 пар оснований в пределах другого гена) и отрицательный контроль (например , , гетерологичную последовательность , которая не присутствует в геноме целевого насекомого, такой как ген LacZ кишечной палочки (GenBank , гена ID: 945006). в качестве альтернативы, использовать позитивный контроль (например, которое дает легко наблюдать фенотип, такой как SRPN2 21,22 , GenBank Gene ID:. 1270169) последовательность ориентации SRPN2 дсРНК определяется Мишель и др (2005) 21..
Примечание: E-RNAi является открытым исходным кодом биоинформатики ресурс , который полезен для определения таких регионов и для процесса разработки олигонуклеотидных праймеров 23. - Выполнение секtandard ПЦР - амплификации (то есть выполняется с Taq - ДНК - полимеразы с использованием циклов 30-35) с использованием геномной ДНК или кДНК шаблон для получения шаблона синтеза дцРНК фланкированную последовательностью промотора Т7 (5'-TAATACGACTCACTATAGGG-3 ') и продолжить процесс подготовки дсРНК и вычищать с использованием коммерческого в пробирке транскрипции комплект в соответствии с инструкциями изготовителя. Использование SRPN2 ПЦР Условия амплификации и праймер информация, представлена в др. (2011) 22.
- Количественная очищенные урожаи РНК ампликона от ультрафиолетовых лучей спектроскопии при длине волны 260 нм и регулировать до желаемой концентрации (например, 3 мкг / мкл) в РНКазы без воды.
- Для поиска неисправностей низких концентраций РНК, уменьшить объем жидкости путем прядения пробы вниз в вакуумной центрифуге при комнатной температуре или путем лиофилизации образцов и воссоздании в меньших объемах воды. Время, необходимое для образца лиофилизации будет изменяться в зависимостина начальных объемов проб и концентрации дцРНК.
- Проверьте качество и длину дцРНК на агарозном геле 2%, полученного с 1x КЭ или TAE буфер и окрашивали бромистым этидием (EtBr), вместе с ДНК-матрицей, используемой для реакции транскрипции. ДсРНК будет мигрировать медленнее, чем ДНК-матрицы. Качество и длина могут быть оценены путем обеспечения нет неспецифических продуктов дцРНК и путем сравнения продуктов со стандартным маркером ДНК, соответственно.
Примечание: EtBr является мощным мутагенным и должны быть обработаны соответствующим образом.
Примечание: При концентрации дсРНК от 3 мкг / мкл, 0,5 мкл образца более чем достаточно для визуализации на EtBr окрашенных агарозном геле. - Храните дсРНК при -20 ° С до тех пор, пока это необходимо. Несколько циклов замораживания / оттаивания может привести к деградации, поэтому аликвоты должны быть подготовлены для больших объемов дцРНК.
2. Подготовка Fast Green FCF красителе (ДДГ) Трубы
- Разведите краситель Fast Green FCFот маточного раствора (содержание красителя ≥85%) до 0,1% (об / об) (рабочий раствор) в РНКазы без воды.
- Пипетка 1 мкл красителя в нижней части 1,5 мл трубки микроцентрифужных.
- Место труб в блоке тепла 65 ° С в течение примерно 3 часов для испарения жидкости, а затем поместить пробирки при комнатной температуре в течение по крайней мере 30 минут, чтобы остыть перед дальнейшим использованием. Этот сухой твердый краситель будет воссоздавать в растворе ресуспендирования дсРНК.
3. Иглы Прицепные Инъекции
- Потянуть боросиликатного стекла иглы с помощью нагретой иглы съемник с диаметром кончика 10-30 мкм. Выдвижные настройки соответствуют: регулировки нагревателя нет. 1 = 100, регулировка нагревателя нет. 2 = 70.
- Во избежание повреждения тонкого кончика иглы, поместите все дергают иглы горизонтально в чашке Петри на полосе формования шпатлевки.
Примечание: Дополнительная информация для капиллярной иглы, потянув методы можно найти более подробно в Malaria исследования и справочных Реагент Ресурсный центр MR4 по эксплуатации 24.
4. Подготовить Injection Station
- Собрать необходимые материалы: стекло микрокапиллярной иглы вытащил тоненького кончика, microinjector, тонкой бумаги фильтра и толстой фильтровальной бумаги, чашки Петри, трансфертных пипеток, кисточка и рассекает световым микроскопом.
- Подготовьте microinjector , как указано в руководстве microinjector, и установить объем впрыска до требуемого объема на импульс (например, максимум 69 нл на импульс).
- На платформе, которая легко маневрировать под микроскопом (например, плоская сторона стойки Пенополистирол трубки), укладывают два фильтра бумажные листы с тонкой фильтровальной бумаги на вершине, и закрепите скотчем по краям.
- Ресуспендируют 10 мкл каждого раствора дсРНК в отдельных цветных трубок красителя, и место на льду.
5. Соберите Куколки для инъекций
- Заполните небольшой 60 мм х 15 мм чашки Петри с 10 мл деионизированной воды, а также сбор ~ 50 бледно-куколки (Duriнг первые 24 часа после окукливания) из инсектарий лотка с помощью одноразовой пластиковой пипетки передачи.
- Удалите куколки, которые имеют от среднего до темного кутикулы дубления.
Примечание: После того, как кутикула начинает загар, становится все труднее проникать в кутикулу, и результаты инъекции в гораздо более высокой летальностью.
6. дсРНК Инъекции
- Под микроскопом рассекает, прекращаться дистальный кончик инъекционной иглы с парой тонких щипцов.
- Подготовьте инъекции иглу засыпки иглу с минеральным маслом (используя шприц с 3 дюйма, 30 калибра иглы), и вытесняя излишки масла с microinjector.
- Передняя заполнения инъекционной иглой с максимальным количеством дцРНК, и извлечь один импульс под микроскопом, чтобы обеспечить раздачу жидкости. В том случае, если жидкость не поглощается и / или изгнали, проверьте дистального кончика иглы для любого закупорки и убедитесь, что игла прочно закреплен в microinjectoр.
- Выберите 1-3 куколок, и поместите их на фильтровальную бумагу.
- Используя кисть, установите куколок на фильтровальную бумагу с спинные кутикула доступны, и используйте кисть, чтобы нажать на фильтровальную бумагу и поглощать любой избыток воды.
- Стабилизировать куколку с кончиком кисти, и вставить иглу в спинной кутикулы между грудной клетки и брюшной полости под углом примерно 30 ° по отношению к дорсальной поверхности куколки. Инъекция должна быть направлена к заднему концу куколок и иглы должны быть перемещены в передне-к-заднем направлении.
- Вводят два импульса (69 Нл на импульс) 3 мкг / мкл раствора дсРНК в гемолимфе и проверьте распределение цвета по всему телу. Если цвет не определен, сдвиг положения иглы инъекции слегка очистить наконечник от препятствий и повторите доставку жидкости.
- Используйте смоченную кисть, чтобы аккуратно переместить куколку из иглы в воду для культивирования. Tон куколки должен придерживаться кисти при легком контакте.
7. Условия после инъекции
- Поместите чашку Петри с закачиваемой куколок в москитной клетку с подходящим потоком воздуха (например, сетчатый каркас или контейнер с крышкой меш). Куколочные условия выращивания должны оставаться последовательно на 27 ± 3 ° C температура, влажность 75 ± 5% и находиться под светом: темный цикл 16: 8 ч.
- Приготовьте 10% (вес / объем) раствора глюкозы, и поместите раствор насыщенного ватный шарик на москитную клетку сетки для кормления взрослых.
8. Оценка нокдауна
- В желаемой временной точке (ы), оценки фенотипов в экспериментальных дцРНК инжектированных насекомых, по сравнению с контрольной группой.
- Оценка dsSRPN2 и dsLacZ насекомых ежедневно охлаждая вниз взрослых в течение приблизительно 2-3 мин при -20 ° С, передачи их в холодную пластину при 2 ° С и выявляющий образование псевдо-опухоли путем использования препаративным микроскопом при 15Xувеличение с светлопольному подсветкой. После оценки возврата взрослых в инсектарий условиях (27 ± 3 ° C, 75 ± 5% влажности).
Примечание: Экспериментальные и контрольные дцРНК , используемые в настоящем протоколе являются dsSRPN2 и dsLacZ соответственно. Есть много вариантов, подходящих для управления; Тем не менее, предполагается , что положительный контроль , для которого фенотип и / или выражение легко визуализируется (например, путем рассечения микроскопии) и / или количественно [например, количественный ПЦР в реальном времени (QRT-ПЦР), Вестерн - блот] должен быть использован при изучении этой техники. SRPN2 белков и транскриптов количественно оценить с помощью Вестерн - блоттинга и QRT-PCR, соответственно, описаны в Michel и др. (2005) 21.
- Оценка dsSRPN2 и dsLacZ насекомых ежедневно охлаждая вниз взрослых в течение приблизительно 2-3 мин при -20 ° С, передачи их в холодную пластину при 2 ° С и выявляющий образование псевдо-опухоли путем использования препаративным микроскопом при 15Xувеличение с светлопольному подсветкой. После оценки возврата взрослых в инсектарий условиях (27 ± 3 ° C, 75 ± 5% влажности).
Результаты
Куколки инъекции для гена KD урожайности оптимальные результаты при выполнении инъекции во время ранней стадии куколки, когда уровень дубления кутикулы являются низкими (рис 1A, слева, и 1В). Увеличение дубления и затвердевание кутикулы, как правило , после 24 часов, приводит к увеличению куколки смерти после инъекции (рис 1А, в центре и справа). Скорость развития куколки может варьироваться в зависимости от условий инсектарий и плотности животных 24,25; Поэтому, лучше всего оценить пигментацию визуально.
Во время процесса впрыска, капиллярная игла вводится в спинной кутикулы под углом примерно 30 ° в переднем направлении к заднему (фиг.2А). После того , как игла вставлена и дцРНК + 0,01% (вес / объем) ДДГ дозируется, распределение красителя видно на всей гемолимфе (FIGUповторно 2B).
Оценка имаго для куколок вводили 0,01% (вес / объем) ДДГ показал среднюю скорость 70% появления, по сравнению с 96,7% появлением неинъекционные управления (рис 3 , а ). Следует отметить, что наблюдалось частичное появление из куколки случае для большого количества недействующих выживших комаров (рис 3б). Введенные животные не проявляют никаких задержек во времени появления (рис 4а) или сместиться воздействия на обоих полов (рис 4В). Дополнительная оценка выживаемости взрослых особей осуществляется до дня 10 после появления всходов не обнаруживает очевидное влияние на взрослых выживания после появления всходов (рис 4в).
Проверка качества KD оценивали по меланотический псевдо опухоли (кластера темно пигментированные ткани) фенотипа , связанного с SRPN2 нокдаун 21,22 в качестве положительного контроля для нокдауна а отсутствие фенотипов , связанных с dsLacZ инъекции в качестве отрицательного контроля. Взрослые комары, которые появились были забиты на 8-й день после инъекции (6-7 сут после появления всходов). Меланотический псевдо-опухоли (рис 5А и 5В) наблюдались через кутикулу 93,5% от dsSRPN2 vs. 0% от dsLacZ взрослых комаров (рис 6А). Кластеры загадочно melanized ткани были идентифицированы при вскрытии пигментных пятен (рис 5в). Псевдо-опухоли были видны на взрослых кутикулы уже в 3 -й день после появления всходов и также присутствовали в подгруппе dsSRPN2 гемолимфе и тканях кишечника (данные не показаны). В 5 после инъекции (начало взрослой стадии), значительно снизился уровень SRPN2 в dsSRPN2, но не наблюдалось dsLacZ или не инъецировали белковые изоляты гемолимфы (рисунок 6б).
ftp_upload / 53738 / 53738fig1.jpg "/>
Рисунок 1: Развивающее плацдармом для куколки дсРНК инъекции Раннее куколки инъекция результатов дсРНК в оптимальном выживания и прогрессии во взрослую стадию.. Низкие уровни кутикулы пигментации (А, слева, и В) можно наблюдать в течение первых 0-24 ч следующего окукливания. Дубление куколки кутикулы предшествующей инъекции (А, в центре и справа) приводит к умеренной до плохой выживаемости.
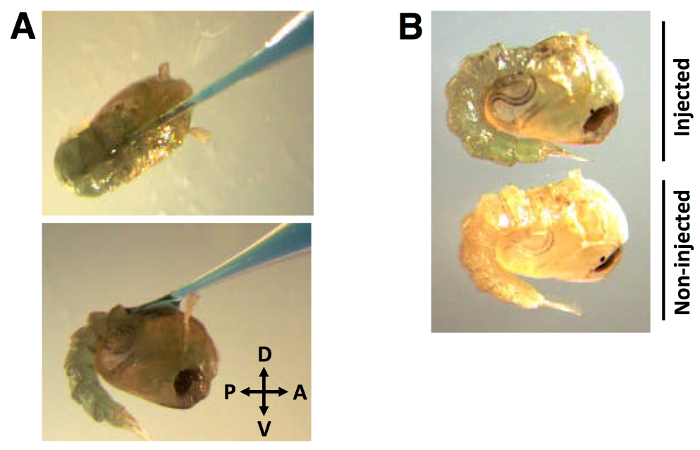
Рисунок 2:. Положение впрыска и распределение красителя меченных дцРНК (А) капиллярный иглы инъекции красителя меченных дцРНК в дорсальную кутикулы под углом приблизительно 30 °, в передних к задним направлении. (В) Краситель заметно распределяется в куколки гемолимфы. дцРНК объем инъекции 138 нл, метили 0,01% FGD (вес / объем).

Рисунок 3:. После инъекции имаго (А) 70% куколок вводили 0,01% ДДГ (вес / об) успешно возникла (п = 60), по сравнению с 96,7% не вводили контрольной группе (п = 60). были проведены три биологических повторностях. (Б) Частичный выход из куколки случае наблюдалось для большого числа недействующих выживших комаров. Столбики ошибок обозначают стандартное отклонение от среднего (SEM).
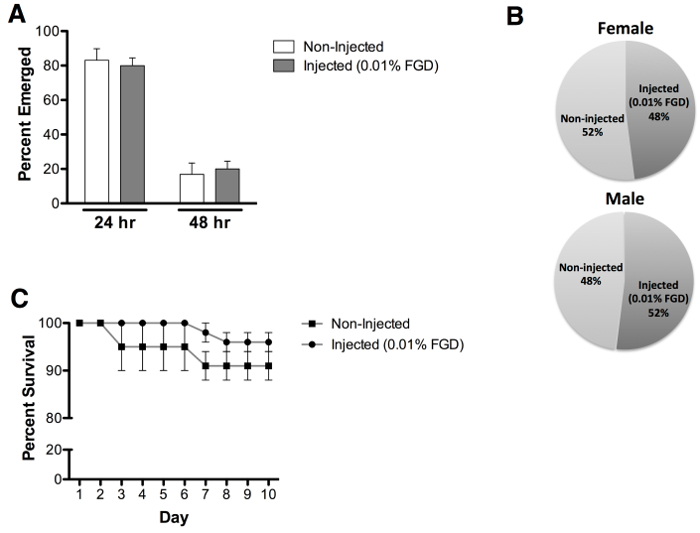
Рисунок 4: скорость возникновения, оценка пола и взрослых выживаемость (А) наблюдались Сопоставимые раз всходов следующие куколки инъекции 0,01% ДДГ (24 ч = 80% и 48 ч = 20%), по сравнению с не-впрыскивается куколок (24. ч = 83% и 48 ч = 17%). (В ) наблюдалась примерно равная взрослых мужчин и женщин появление на 0,01% ДДГ закачиваемой куколок (женский = 48% и мужчина = 52%) и не впрыскивается куколок (женский = 52% и мужчина = 48%). Анализ (C) Выживание показывает , что введение с 0,01% ДДГ не влияет на взрослую выживание, оценивается до 10 -й день после появления всходов. Результаты представляют данные из трех независимых экспериментов с 0,01% ДДГ инжектированных (n = 60) и не вводили (п = 60) куколок (равное число мужчин и женщин). Столбики ошибок обозначают стандартное отклонение от среднего (SEM).

Рисунок 5: Псевдо-опухолевого фенотипа положительный контроль отражает успешную нокдаун наблюдались Псевдо-опухоли на (А) брюшной полости и (б) торакальной кутикулы dsSRPN2 -injected, но не dsLacZ -injected взрослых москитов на 8 -й день после инъекции..(C) более высокое увеличение (400X) визуализация (а) кутикулы и рассечения пигментных пятен (б) показывает кластеры загадочно melanized клеток.
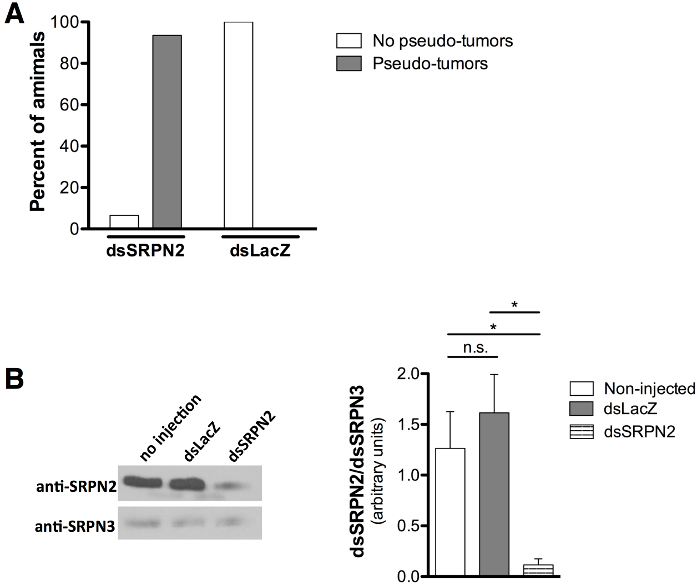
Рисунок 6: Количественное формирования псевдо-опухоли и снижение уровня белка SRPN2 (A) инъекции куколки приводит к образованию псевдо-опухоли в 93,5% dsSRPN2 взрослых (п = 21) по сравнению с 0% в контрольной группе dsLacZ (п = 19). , Результаты, полученные в 8-й день после инъекции. (B) Вестерн - блот (слева) показывает уровни снизились SRPN2 в dsSRPN2, но не dsLacZ или не инъецировали гемолимфы белковые изоляты (5 -й день после инъекции). Результаты основаны на трех независимых экспериментов. Анти-SRPN2 21 и анти-SRPN3 разведений 26 антитела были использованы 1: 1000 и 1: 2000 соответственно. Коза анти-раBBIT IgG-HRP (Product SC-2004, Santa Cruz Biotechnology, Dallas TX) использовали в масштабе 1: 5000. Все уровни белка были определены количественно (справа) по интенсивности полос (ImageJ Software, NIH, Bethesda, MD), нормированная на SRPN3, и статистически сравнивали с помощью непарного теста т. P <0,05: *, P ≥0.05: нс (не значительные). Столбики ошибок обозначают стандартное отклонение от среднего (SEM).
Обсуждение
Современные методы индукции не-трансгенной RNAi в комаров включать прямую инъекцию дсРНК во взрослую hemocoel 12,13 или личиночного кормления наночастиц триггерных покрытием RNAi или 14-17 лет микроводорослей на основе дцРНК молекул 18. Ориентация взрослого комара, в то время чрезвычайно ценным, может исключить большое количество генов, которые функционируют в более ранние периоды развития. Нокдаун инициирована питания личинок может давать непредсказуемые фенотипы во взрослой стадии должно, частично, к потенциалу Переменное послесвечение белка через стадии куколки. Поэтому, вводя дополнительный метод, который нацелен конкретно на инициирование RNAi в ходе развития куколки будет обеспечивать средства для более полной оценки функции гена во время предварительного взрослых стадиях развития, а также расширенные возможности для оценки функции гена во взрослых стадиях. Как и при подходе гена нокдаун на основе дсРНК инъекции или экспрессии, сохранением гена нокдаунне может быть предсказано. Таким образом, транскрипт или белковые уровни должны быть оценены на предмет интересующего гена во время периодов развития, представляющих интерес. Хотя мы наблюдаем продолжение пониженные уровни белка на 5 -й день после инъекции для SRPN2 в SRPN2 дцРНК-инъецированных животных, такие факторы, как оборот белка и период полураспада может различаться для разных целей. Это имеет решающее значение для обеспечения, а также, что дцРНК, которые будут использоваться для инъекций хорошо концентрированная и появляется нетронутым на агарозном геле. Мы рекомендуем экспериментаторы пересмотреть эти факторы, если нокдаун результаты не являются достаточными, а также соответствующие концентрации дсРНК, возможно, должны быть проверены эмпирически для конкретных целей генов.
Мы опишем метод инициации РНК - интерференции во время стадии куколки Ап. Развитие gambiae. Этот метод основан на введении через микроинъекции дсРНК непосредственно в hemocoel раннего куколок и позволяет для оценки качества впрыска с помощьюиспользование красителя меченных дцРНК. Способность визуализировать качество впрыска является критически важной повышение для обеспечения успешного нокдаун и представляет собой аспект инъекции на основе гена нокдаун, который не был рассмотрен в большинстве ранее сообщенных дсРНК протоколы на основе сосредоточенных на взрослой стадии. Ориентируясь куколки в начале этого периода развития, гены, которые могут играть определенную роль в этот критический интервал развития или на ранних этапах взрослой жизни могут быть оценены функционально. Кроме того, этот метод может позволить доставку дсРНК к клеткам, а также создание РНК-интерференции в клетках, которые доступны во время метаморфоза, но менее доступны в полностью сформированных взрослых комаров.
Недавний анализ микрочипов по Харкер и др. (2012) идентифицировали 560 An. gambiae стенограммы , которые были повышающей регуляции или понижающей регуляции , по крайней мере , в 4 раза в течение различных стадий развития, начиная от эмбриона до взрослого. Из 560 транскрипты идентифицированы, набор 309 был вверх регулируется во время развития куколки 27. Эти данные позволяют предположить, что существует множество требований к дифференциальной экспрессии генов в ходе развития комара, в том числе те, которые происходят во время стадии куколки, интервал, в течение которого организм подвергается метаморфозу. У многих видов насекомых, в том числе. gambiae, гены , участвующие в процессах , таких как развитие (т.е. куколки кутикулярной и хитин-связывающих белков) 27-31 и иммунный ответ (т.е. Toll рецептор-подобные белки) 27,32-34 высоко экспрессируется во время стадии куколки. После того, как полностью сформированный взрослый возник, там продолжают экспрессию генов в ответ на экологические и физиологические изменения 35. Примечательно, что во время раннего развития взрослых, наблюдается увеличение в экспрессии генов развития (т.е. взрослых кутикулярной и белки саркоплазмы) 36, а также других ключевых генов (т.е. , Сперма и специфический белок цитохром Р450 ферментов метаболизма) 27,36.
Положительный контроль используется в разработке этого протокола, SRPN2, является An. ингибитор протеазы серина gambiae (Серпин). SRPN2 играет важную роль в негативной регуляции меланизации насекомых, широкий спектр врожденного иммунного ответа у насекомых 21,22. Нокдаун SRPN2 у взрослых приводит москиты в формировании псевдо-опухолевой 21,22, фенотип , который легко наблюдается при использовании световой микроскопии. Учитывая , что это отличный фенотип может быть легко забито в живых насекомых, мы использовали SRPN2 для начальных куколки инъекций этап RNAi. Кроме того, SRPN2 выражается во всех стадиях развития 37, обеспечивая тем самым хорошую мишень для стадии куколки RNAi инъекции и оценки функции в раннем взрослом. Показано, что метод, который мы разработали способен вызывать подобное взрослого меланотический позер образование O-опухоль как следствие дцРНК инъекций, выполняемых во время стадии куколки развития. При разработке этого протокола, мы обнаружили , что инъекции во время раннего развития куколки (то есть первые 24 ч после личиночной-куколки линьки) имеет решающее значение для получения оптимального имаго. В том случае, если бедные получают появление после инъекции, рекомендуется постановка личинок с большей точностью, чтобы получить куколок с менее обширным кутикулы твердения и обеспечивают раннее куколки инъекции стадии достигается. Кроме того, сведение к минимуму ущерба результатам кутикулы в оптимальных дозах возникновение и большее увеличение во время инъекции может помочь гарантировать, что только предполагаемая область животного прокалывается. Если игла должна прокалывать через брюшную кутикулы, жидкости в зону красителя меченных будет видно на внешней стороне куколки или насытит фильтровальную бумагу. Настоятельно рекомендуется отказаться от любых куколок, которые имеют более одного кутикулы прокол.
jove_content "> С обширным опытом многих лабораторий с производительностью взрослых инъекций от комаров, которые ранее были определены подходы микроинъекции могут быть адаптированы с помощью простых модификаций протокола для использования в куколки экспериментов RNAi. В целом, цель этого метода заключается в предоставлении исследователям способность расширить временные рамки , в течение которого обратный генетический анализ может выполняться, дополнительно позволяя исследование , которое будет поддерживать разработку новых стратегий борьбы с переносчиками болезней . Интересно отметить , что эксперименты в других видах, таких как Rhodnius prolixus и Spodoptera frugiperda, показывают , что ген глушителей эффекты имеют тенденцию быть намного больше , когда инициируется во время предварительного взрослых стадий 38,39. на всех этапах развития, RNAi-опосредованной ген нокдаун подлежит соображения относительно быстроты и сохранения молчанием генов и устойчивости белков , кодируемых генами целевых. идеальная мишень RNAi гены, как правило, те, которые кодируют PROTEIп или РНК , которая имеет короткий период полураспада и скорость 11,40 высокая текучесть кадров.В то время как трансгенные стратегии RNAi также могут быть использованы для решения соображения относительно быстроты и сохранение RNAi во время предварительного взрослых стадий, трансгенные методы имеют много недостатков (например, время , необходимое для получения трансгенных линий, экспериментальные временные рамки для москитных вязки для генерации насекомых с регулируемой экспрессии дцРНК, и содержание трансгенных запасов). В противоположность этому, наш протокол обеспечивает более легкий и быстрый способ для инициирования гена нокдаун во время развития куколки и в типах клеток, которые происходят и доступны во время метаморфоза, но менее доступны у взрослых. Использование красителей меченных дсРНК суспензий позволяет легко оценки успеха впрыска и рассеивания вводимого материала в куколок. Наши данные о начале формирования опухоли в куколки-впрыскивается взрослых, по сравнению с животными, инъецированных как взрослые, согласуется с INITтельная часть из RNAi-опосредованной нокдаун во время стадии куколки. Используя наш G3 москитной линию и в наших инсектарий условиях, мы наблюдаем формирование взрослого меланотический псевдо-опухоли уже через 10 дней после инъекции взрослых впрыскивается трех до пяти дней после появления всходов. Выполняя раннюю инъекцию куколку стадии, мы наблюдаем формирование видимого меланотический псевдо-опухоли уже в пять дней после инъекции (т.е., от трех до четырех дней после появления). Эти данные указывают на то, что этот метод позволяет инициации гена нокдаун во время ранее под изученного периода развития (т.е. развития куколки). Наш способ маркировки краситель может также оказаться полезным для разработки новых протоколов личиночной инъекции, из полупрозрачной природы кутикулу во всех личиночных возрастов. В то время как элемент управления, используемый в данном исследовании, требует прогрессии во взрослой стадии, чтобы отобразить нокдаун фенотип, будущие эксперименты по оценке пупальный фенотипы стадиеспецифический после инъекции ранних куколок обеспечитценную информацию относительно распространения этого метода в дополнительные периоды развития, такие как позднего развития куколки. Таким образом, этот метод представляет собой ценный протокол RNAi для стадии куколки инициирования RNAi-опосредованной гена нокдаун и расширяет функциональные геномные инструменты, доступные для использования в рамках научного сообщества вектор насекомых.
Раскрытие информации
Открытый доступ для этого видео-статьи оплачиваются Biogen.
Благодарности
We would like to thank Dr. Flaminia Catteruccia and her research group (Harvard School of Public Health, Boston, MA) for providing our laboratory with the G3 colony used in this research and for the LacZ template DNA. We thank Adam Jenkins (Boston College, Chestnut Hill, MA) for his assistance in maintaining the insectary. The Biology Department of Boston College generously funded the research associated with the development of this technique.
Материалы
| Name | Company | Catalog Number | Comments |
| MEGAscript RNAi kit | Ambion | AM1626 | |
| Nanoject II injector | Drummond | 3-000-204 | |
| Nanoject II foot switch | Drummond | 3-000-026 | |
| Borosilicate glass capillaries | Drummond | 3-000-203-G/X | |
| Glass micropipette puller | Narishigne | PB-7 | |
| Fast Green FCF dye | Sigma | F7258 | Can substitute with a non-toxic food dye. |
| Plastic transfer pipettes | Thermo Scientific | 1371150 | ¼ inch cut from tip to create a wider opening. |
| Whatman “thin” filter paper | GE Healthcare | 1001-090 | This is 9 cm diameter Grade 1, but can be altered depending on size of injection pad. |
| Western blot “thick” filter paper | BioRad | 107-3931 | This is the filter paper generally used for Western blots. |
| Petri dishes (60 mm x 15 mm) | Fisher Scientific | FB0875713A | |
| Paint brush (size 0) | Michael’s Art | 10474940 | Brush size and brand can vary based on availability and user preference. |
| Dissecting light microscope | ---- | ----- | This can vary based on availability and user preference. |
Ссылки
- Kelly-Hope, L. A., McKenzie, F. E. The multiplicity of malaria transmission: a review of entomological inoculation rate measurements and methods across sub-Saharan Africa. Malar. J. 8 (1), 1-16 (2009).
- The malERA Consultative Group on Vector Control. A Research Agenda for Malaria Eradication: Vector Control. PLoS Med. 8 (1), e1000401 (2011).
- Enyati, A., Hemmingway, J. Malaria Management: Past, Present, and Future. Annu. Rev. of Entomol. 55 (1), 569-591 (2010).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genet. 10 (3), 1004236 (2014).
- Mitchell, S. N., et al. Metabolic and Target-Site Mechanisms Combine to Confer Strong DDT Resistance in Anopheles gambiae. PLoS ONE. 9 (3), e92662 (2014).
- Knox, T. B., et al. An online tool for mapping insecticide resistance in major Anopheles vectors of human malaria parasites and review of resistance status for the Afrotropical region. Parasite Vector. 7 (76), 1-14 (2014).
- Napoli, C., Lemieux, C., Jorgensen, R. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes. Plant Cell. 2, 279-289 (2002).
- Sen, G. L., Blau, H. M. A brief history of RNAi: the silence of the genes. FASEB J. 20 (9), 1293-1299 (2006).
- Romano, N., Macino, G. Quelling: transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences. Mol. Microbiol. 6 (22), 3343-3353 (1992).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Catteruccia, F., Levashina, E. A. RNAi in the Malaria Vector, Anopheles gambiae: Therapeutic Applications of RNAi: Methods and Protocols. Methods Mol. Biol. 555, 63-75 (2009).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A). gambiae). J. Vis. Exp. (5), e230 (2007).
- Mysore, K., Andrews, E., Li, P., Duman-Scheel, M. Chitosan/siRNA nanoparticle targeting demonstrates a requirement for single-minded during larval and pupal olfactory system development of the vector mosquito Aedes aegypti. BMC Dev. Biol. 14 (9), 1-16 (2014).
- Mysore, K., Flannery, E. M., Tomchaney, M., Severson, D. W., Duman-Scheel, M. Disruption of Aedes aegypti Olfactory System Development through Chitosan/siRNA Nanoparticle Targeting of semaphorin-1a. PLoS Negl. Trop. Dis. 7 (5), (2013).
- Zhang, X., Zhang, J., Zhu, K. Y. Chitosan/double-stranded RNA nanoparticle-mediated RNA interference to silence chitin synthase genes through larval feeding in the African malaria mosquito (Anopheles gambiae). Insect Mol. Biol. 19 (5), 683-693 (2010).
- Zhang, X., et al. Chitosan/Interfering RNA Nanoparticle Mediated Gene Silencing in Disease Vector Mosquito Larvae. J. Vis. Exp. (97), e52523 (2015).
- Kumar, A., Wang, S., Ou, R., Samrakandi, M., Beerntsen, B. T., Sayre, R. T. Development of an RNAi based microalgal larvicide to control mosquitoes. Malaria World J. 4 (6), 1-7 (2013).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: A review. J. Insect Physiol. 56 (3), 227-235 (2010).
- Burand, J. P., Hunter, W. B. RNAi: Future in insect management. J. Invertebr. Pathol. 112, S68-S74 (2013).
- Michel, K., Budd, A., Pinto, S., Gibson, T. J., Kafatos, F. C. Anopheles gambiae SRPN2 facilitates midgut invasion by the malaria parasite Plasmodium berghei. EMBO Rep. 6 (9), 891-897 (2005).
- An, C., Budd, A., Kanost, M. R., Michel, K. Characterization of a regulatory unit that controls melanization and affects longevity of mosquitoes. Cell Mol. Life Sci. 68 (11), 1929-1939 (2011).
- Horn, T., Boutros, M. E-RNAi: a web application for the multi-species design of RNAi reagents--2010 update. Nucleic Acids Res. 38, W332-W339 (2010).
- Benedict, M. Q. . Methods in Anopheles Research. , (2014).
- Lyimo, E. O., Takken, W., Koella, J. C. Effect of rearing temperature and larval density on larval survival, age at pupation and adult size of Anopheles gambiae. Entomol. Exp. Appl. 63, 265-271 (1992).
- Michel, K., et al. Increased melanizing activity in Anopheles gambiae does not affect development of Plasmodium falciparum. Proc. Natl. Acad. Sci. 103 (45), 16858-16863 (2006).
- Harker, B. W., et al. Transcription Profiling Associated With Life Cycle of Anopheles gambiae. J Med Entomol. 49 (2), 316-325 (2012).
- Dotson, E. M., Cornel, A. J., Willis, J. H., Collins, F. H. A family of pupal-specific cuticular protein genes in the mosquito Anopheles gambiae. Insect Biochem. Molec. Biol. 28, 459-472 (1998).
- Hopkins, T. L., Krchma, L. J., Ahmad, S. A., Kramer, K. J. Pupal cuticle proteins of Manduca sexta: characterization and profiles during sclerotization. Insect Biochem. Molec. Biol. 30, 19-27 (1999).
- Liang, J., Zhang, L., Xiang, Z., He, N. Expression profile of cuticular genes of silkworm, Bombyx mori. BMC Genomics. 11 (173), 1-13 (2010).
- Zhou, X., Riddiford, L. M. Broad specifies pupal development and mediates the "status quo" action of juvenile hormone on the pupal-adult transformation in Drosophila and Manduca. Development. 129, 2259-2269 (2002).
- Luna, C., Wang, X., Huang, Y., Zhang, J., Zheng, L. Characterization of four Toll related genes during development and immune responses in Anopheles gambiae. Insect Biochem. Molec. Biol. 32, 1171-1179 (2002).
- Tauszig, S., Jouanguy, E., Hoffmann, J. A., Imler, J. -. L. Toll-related receptors and the control of antimicrobial peptide expression in Drosophila. Proc. Natl. Acad. Sci. 97 (19), 10520-10525 (2000).
- Tryselius, Y., Samakovlis, C., Kimbrell, D. A., Hultmark, D. CecC, a cecropin gene expressed during metamorphosis in Drosophila pupae. Eur. J. Biochem. 204, 1-5 (1992).
- Goodisman, M. A. D., Isoe, J., Wheeler, D. E., Wells, M. A. Evolution of Insect Metamorphosis: a Microarray-Based Study of Larval and Adult Gene Expression in the Ant Camponotus Festinatus. Evolution. 59 (4), 858-870 (2005).
- Cook, P. E., Sinkins, S. P. Transcriptional profiling of Anopheles gambiae mosquitoes for adult age estimation. Insect Mol. Bio. 19 (6), 745-751 (2010).
- Suwanchaichinda, C., Kanost, M. R. The serpin gene family in Anopheles gambiae. Gene. 442 (1-2), 47-54 (2009).
- Araujo, R. N., et al. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug Rhodnius prolixus (Hemiptera: Reduviidae) by dsRNA ingestion or injection. Insect Biochem. Molec. Biol. 36 (9), 683-693 (2006).
- Griebler, M., Westerlund, S. A., Hoffmann, K. H., Meyering-Vos, M. RNA interference with the allatoregulating neuropeptide genes from the fall armyworm Spodoptera frugiperda and its effects on the JH titer in the hemolymph. J. Insect Physiol. 54 (6), 997-1007 (2008).
- Scott, J. G., et al. Towards the elements of successful insect RNAi. J. Insect Physiol. 59 (12), 1212-1221 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены