Method Article
RNAi gatilho para o interior
Neste Artigo
Resumo
RNA interference (RNAi) is an extremely valuable tool for uncovering gene function. However, the ability to target genes using RNAi during pre-adult stages is limited in the major human malaria vector Anopheles gambiae. We describe an RNAi protocol to reduce gene function via direct injection during pupal development.
Resumo
RNA interference (RNAi), a naturally occurring phenomenon in eukaryotic organisms, is an extremely valuable tool that can be utilized in the laboratory for functional genomic studies. The ability to knockdown individual genes selectively via this reverse genetic technique has allowed many researchers to rapidly uncover the biological roles of numerous genes within many organisms, by evaluation of loss-of-function phenotypes. In the major human malaria vector Anopheles gambiae, the predominant method used to reduce the function of targeted genes involves injection of double-stranded (dsRNA) into the hemocoel of the adult mosquito. While this method has been successful, gene knockdown in adults excludes the functional assessment of genes that are expressed and potentially play roles during pre-adult stages, as well as genes that are expressed in limited numbers of cells in adult mosquitoes. We describe a method for the injection of Serine Protease Inhibitor 2 (SRPN2) dsRNA during the early pupal stage and validate SRPN2 protein knockdown by observing decreased target protein levels and the formation of melanotic pseudo-tumors in SRPN2 knockdown adult mosquitoes. This evident phenotype has been described previously for adult stage knockdown of SRPN2 function, and we have recapitulated this adult phenotype by SRPN2 knockdown initiated during pupal development. When used in conjunction with a dye-labeled dsRNA solution, this technique enables easy visualization by simple light microscopy of injection quality and distribution of dsRNA in the hemocoel.
Introdução
A malária é uma doença infecciosa transmitida por mosquitos que afeta muitos milhões de pessoas a cada ano. A Organização Mundial de Saúde (OMS) relata que em 2013 havia cerca de 584.000 mortes por malária, 78 por cento dos quais ocorreram em crianças com idade inferior a cinco anos 1. Os patógenos que causam a malária humana são parasitas apicomplexa dentro do Plasmodium género e são transmitidos entre seus hospedeiros humanos por mosquitos Anopheles fêmea. A transmissão ocorre quando o mosquito tem uma refeição de sangue de um indivíduo que está infectado e, em seguida depósitos parasitas infecciosos em um indivíduo não infectado em uma refeição de sangue subseqüente. Dentro do género Anopheles, Anopheles gambiae é a espécie com maior capacidade vetorial e é o vetor da malária mais proeminente na África sub-saariana 1-3.
Atualmente, o controle de vetores de mosquito por implantação de inseticidas continua a bÊ O principal método utilizado para reduzir o fardo da malária humana. Embora o uso de insecticidas desde os anos 1960 demonstrou ser extremamente bem sucedida, o surgimento de resistência a insecticidas tem impulsionado uma necessidade para o desenvolvimento de novos insecticidas e estratégias de controlo alternativa vector 4-7. Em 2010, um total de 49 de 63 países que notificaram a OMS indicou a ocorrência de resistência a inseticidas em vetores da malária 1. Além disso, a ferramenta IR Mapper, que utiliza a literatura peer-reviewed para avaliar dados de resistência em regiões Afrotropicais, relata que entre 2001 e 2012 houve 46% e 27% de aumento na resistência aos piretróides e diclorodifeniltricloroetano (DDT), respectivamente 7.
Interferência de RNA (RNAi) foi identificado na década de 1990, como uma técnica que pode ser empregue para inactivar genes na planta petúnia 8,9 e em que o fungo Neurospora crassa 9,10. Pouco depois,em 1998, ARNi foi documentada pela primeira vez em Caenorhabditis elegans como um meio de reduzir a expressão de genes num modelo animal pela introdução de anti-sentido ou ARN de cadeia dupla (ARNcd), através de injecção ou por métodos de alimentação 9,11. Desde a sua descoberta, RNAi revolucionou a busca da genómica funcional, permitindo que os pesquisadores utilizem genética reversa para investigar rapidamente os papéis funcionais de genes de interesse através de um mecanismo de silenciamento gênico pós-transcricional altamente seletivo. Em alguns organismos, tais como Drosophila melanogaster, o uso de organismos transgénicos que expressam as construções de ARN interferentes tem sido largamente usado com sucesso para silenciamento de genes (KD). Embora o uso de transgenes em An. gambiae para RNAi tem sido utilizada e pode ser útil para telas de grande escala, a geração de linhagens de mosquitos transgênicos é ao mesmo tempo de trabalho e tempo intensivo, geralmente tendo dois a três meses para ir a partir da identificação de um gene de interesse para os geraçãna de um estoque transgénico apropriado 12. Actualmente, o principal método de KD gene num. gambiae é por injecção na hemolinfa, durante a fase adulta, de ARNdc específico para um dado gene 12,13. Esse processo geralmente leva cerca de um mês para ir desde a identificação de um gene de interesse para avaliação da KD gene, provando ser muito mais rápida do que os métodos transgênicos 12. Métodos para larval estágio RNAi foram estabelecidos recentemente em um. baseada em microalgas gambiae e Aedes aegypti por meio de nanopartículas alimentação 14-17 ou por entrega oral de dsRNA moléculas 18, oferecendo oportunidades para realizar análise genômica funcional durante os estágios iniciais de desenvolvimento. Na injecção directa, a alimentação, e métodos de entrega de nanopartículas, o dsRNA é retomado por autonomamente na célula alvo e clivado pela enzima Dicer em 21-25 nucleótidos de comprimento "curto ARN interferentes" (ARNsi) 19,20. Estes são, em seguida, siRNAs IncorporATED para o silenciamento complexo (RISC) induzido por ARN, a partir da qual um fio vai ser descartado, permitindo que o complexo ligado RISC-RNA para se ligar e clivar o ARNm alvo e, assim, reduzir o seu nível e inibir a sua tradução 19,20.
Muitas características intrínsecas da biologia básica mosquito modular a capacidade vetorial, incluindo preferências de acolhimento (por exemplo, olfato, gustação), acasalamento, reprodução e imunidade. Dada a importância destes processos biológicos, é provável que a sua modulação em um nível genético ou farmacológica vai oferecer novas oportunidades para o controle de vetores, incluindo a evasão de resistência a inseticidas, e fornecer novas ferramentas para abordagens mais amplamente integrados para controle de vetores. O uso de genômica funcional para avaliar os papéis de genes subjacentes a estas características biológicas intrínsecas vai permitir a identificação de novos alvos e fornecer novos insights sobre como podemos efetivamente criar novos strateg controle, mais eficazs. Nós descrevemos o desenvolvimento ea utilização de um método de injeção rápida para iniciar RNAi durante a fase de pupa de An. gambiae. Observamos que a injeção fase de pupa de um gatilho RNAi permite a observação de fenótipos resultantes em adultos em fase inicial, ou seja, mais cedo após a emergência do que seria observado caso gene knockdown foram iniciadas em adultos pós-emergência. Este métodos permite gene knockdown começando durante o intervalo de desenvolvimento de pupa e estendendo-se em estágios adultos, tais tipos de células que silenciamento de genes iniciado durante o desenvolvimento das pupas podem persistir e afetar início de adultos hemolinfa acessível, bem como tipos de células que são mais hemolinfa acessível durante a metamorfose do que no adulto, tais como neurónios sensoriais encontrados em apêndices adultos após a emergência.
Protocolo
1. Síntese e Preparação ARNcd
- Identificar uma região knockdown 200-800 pb (para gerar o ARNcd correspondente) dentro do gene de interesse que é previsto para ter não identificáveis efeitos fora do alvo (por exemplo, nenhuma homologia de sequência de ≥18 pb dentro de um outro gene) e um controlo negativo (por exemplo, , uma sequência heteróloga que não está presente dentro do genoma de insectos alvo, tal como o gene lacZ de Escherichia coli (GenBank gene ID: 945006). em alternativa, utilizar um controlo positivo (por exemplo, o que origina um fenótipo facilmente observado, tais como 21,22 SRPN2 , Gene GenBank ID:. 1270169) a sequência do SRPN2 segmentação ARNcd é definido em Michel et al (2005) 21..
Nota: E-ARNi é um recurso bioinformática-fonte aberto que é útil para a identificação de tais regiões e para o processo de concepção de iniciadores oligonucleotídicos 23. - execute standard amplificação de PCR (ou seja, realizada com Taq DNA polimerase, utilizando 30-35 ciclos) utilizando um ADN genómico ou de ADNc molde para obter a síntese de molde ARNcd flanqueado por uma sequência de promotor de T7 (5'-TAATACGACTCACTATAGGG-3 ') e prosseguir com a preparação e ARNdc limpar-se utilizando um kit comercial de transcrição in vitro de acordo com as instruções do fabricante. Use SRPN2 PCR condições de amplificação e informações iniciador, tal como apresentado em An et al. (2011) 22.
- Quantificar os rendimentos de ARN amplicon purificado por espectroscopia de absorção de ultravioletas a comprimento de onda de 260 nm e ajustar-se a concentração desejada (por exemplo, 3 mg / mL) em água isenta de RNase.
- Para solucionar problemas de baixas concentrações de RNA, reduzir o volume de líquido por fiação amostras numa centrífuga de vácuo à temperatura ambiente ou por liofilização de amostras e reconstituindo em menores volumes de água. O tempo necessário para a liofilização da amostra irá variar dependendoem volumes de amostras iniciais e as concentrações de ARNdc.
- Verificar a qualidade ea duração do ARNcd num gel de agarose a 2% preparada com 1 x TBE ou TAE tampão e coradas com brometo de etídio (EtBr), juntamente com o ADN molde utilizado para a reacção de transcrição. O ARNcd migrarão mais lentamente do que o ADN molde. Qualidade e comprimento pode ser avaliada por assegurando que não há produtos não específicos de ARNdc e por com um marcador de ADN padrão comparando produtos, respectivamente.
Nota: EtBr é um mutagênico potente e deve ser tratado em conformidade.
Nota: Para uma concentração de ARNcd de 3 mg / mL, 0,5 mL da amostra é mais do que suficiente para a visualização do gel de agarose manchado-EtBr. - ARNcd armazenar a -20 ° C até ser necessário. Múltiplos ciclos de congelamento / descongelamento podem causar degradação, de modo alíquotas deve ser preparado para grandes volumes de ARNcd.
2. Prepare verde rápido Dye Tubes (FGD)
- Diluir rápida corante verde FCFa partir de solução-mãe (≥85% de teor de corante) a 0,1% (v / v) (solução de trabalho), em água isenta de RNase.
- Pipetar 1 mL de corante no fundo de um tubo de microcentrífuga de 1,5 ml.
- Colocar os tubos em um bloco de calor a 65 ° C durante aproximadamente 3 horas para evaporar, em seguida Colocar os tubos líquidos à temperatura ambiente durante pelo menos 30 minutos, para arrefecer antes de usar. Este corante sólido seco irá reconstituir a ressuspensão em solução ARNcd.
3. Agulhas Pull injeção
- Puxar agulhas de vidro de borosilicato, utilizando um extrator de agulhas aquecido a uma diâmetro da ponta de 10-30 mm. Pull configurações correspondem a: ajuste aquecedor não. 1 = 100, o ajuste aquecedor não. 2 = 70.
- Para evitar danos ao fina ponta da agulha, colocar todas as agulhas puxado horizontalmente numa placa de Petri sobre uma tira de moldagem de massa de vidraceiro.
Nota: Informações adicionais para agulha capilar métodos puxando pode ser encontrada em mais detalhe na Malaria Research and Reference Reagent Resource Center MManual de R4 24.
4. Prepare Station Injection
- Recolha materiais necessários: agulhas microcapilares vidro puxado para ponta fina, microinjetor, papel de filtro fino e papel de filtro grosso, placas de Petri, pipetas de transferência, pincel e dissecando microscópio de luz.
- Prepare o microinjetor conforme as instruções no manual microinjetor, e ajustar o volume de injeção de volume desejado por pulso (por exemplo, máximo de 69 nl por pulso).
- Em uma plataforma que é fácil de manobrar sob um microscópio (por exemplo, o lado liso de um suporte de tubos de isopor), empilhar as duas folhas de papel de filtro com o papel de filtro fino no topo, e prenda com fita em torno das bordas.
- Ressuspender 10 ml de cada solução de dsRNA em tubos de corante de cor separados, e colocar no gelo.
5. Recolher Pupae para Injecção
- Encha uma pequena 60 milímetros x 15 mm placa de Petri com 10 ml de água deionizada, e recolher ~ 50 pupas pálido (During a 24 h depois da primeira formação da pupa) a partir de uma bandeja insectary usando uma pipeta de transferência de plástico descartável.
- Remova qualquer pupas que têm médio e escuro bronzeamento cutícula.
Nota: Uma vez que a cutícula começa a curtir, torna-se mais difícil de penetrar a cutícula, e os resultados de injeção em muito maior letalidade.
6. Injeção de dsRNA
- Sob o microscópio de dissecação, parta a ponta distal da agulha de injecção com um par de fórceps finos.
- Prepara-se o enchimento por agulha de injecção a agulha com óleo mineral (usando uma seringa com uma agulha de calibre 30 de 3 polegadas), e expelir o excesso de óleo com o microinjector.
- Frente preencher agulha de injecção com uma quantidade máxima de dsRNA, e ejectar um impulso ao microscópio para assegurar a distribuição de líquido. No caso em que o líquido não é absorvido e / ou expelido, verificar a ponta distal da agulha para qualquer bloqueio e assegurar que a agulha está firmemente fixada na microinjector.
- Escolha 1-3 pupas, e colocá-los no papel de filtro.
- Usando o pincel, posicionar o pupas no papel de filtro com dorsal cutícula acessível, e usar o pincel para empurrar em papel de filtro e absorver qualquer excesso de água.
- Estabilizar a pupa com a ponta do pincel, e inserir a agulha na cutícula dorsal entre o tórax e do abdómen, num ângulo de aproximadamente 30 ° em relação à superfície dorsal da pupa. A injecção deve ser dirigida para a extremidade posterior da pupa e agulha deve ser movido numa direcção anterior para posterior.
- Injectar dois pulsos (69 nl por pulso) de solução de 3 mg / mL dsRNA na hemolinfa, e verificar se há a distribuição de cor ao longo do corpo. Se nenhuma cor é identificada, mudar a posição da agulha de injeção ligeiramente para limpar a ponta da obstrução e repetir a entrega líquido.
- Use o pincel molhado para mover suavemente pupa da agulha na água para a cultura. Tele pupa deve ficar para o pincel em cima do contato luz.
7. Condições pós-injeção
- Coloque uma placa de Petri com pupas injectado numa gaiola de mosquitos com um fluxo de ar adequado (por exemplo, gaiola de malha ou recipiente com tampa de malha). condições de criação pupa deve permanecer consistentemente em 27 ± 3 ° C de temperatura, 75 ± 5% de umidade e estar sob uma luz: ciclo escuro de 16: 8 hr.
- Prepara-se uma a 10% (w / v) de solução de glucose, e colocar uma bola de algodão saturado com solução na gaiola de mosquitos malha para a alimentação de adultos.
8. Avaliar Knockdown
- No ponto de tempo desejado (s), em avaliar os fenótipos experimentais insectos injectados com ARNcd, em comparação com os controlos.
- Avaliar dsSRPN2 e dsLacZ insectos diariamente por refrigeração para baixo adultos durante cerca de 2-3 min a -20 ° C, transferindo-os para uma placa fria a 2 ° C e a identificação de qualquer formação de pseudo-tumoral por utilização de um microscópio de dissecação em 15Xampliação com iluminação de campo claro. Após a avaliação, o retorno adultos às condições insetário (27 ± 3 ° C, 75 ± 5% de umidade).
Nota: Os dsRNAs experimentais e de controlo utilizados neste protocolo são dsSRPN2 e dsLacZ, respectivamente. Há muitas opções adequadas para os controlos; no entanto, sugere-se que um controlo positivo para o qual fenótipo e / ou expressão é facilmente visualizado (por exemplo, por meio de dissecção microscopia) e / ou quantificada [por exemplo, quantitativa PCR em tempo real (qRT-PCR), Western blot] deve ser utilizada quando aprender esta técnica. SRPN2 proteína e quantificação transcrição através de Western blot e qRT-PCR, respectivamente, são descritos em Michel et al. (2005) 21.
- Avaliar dsSRPN2 e dsLacZ insectos diariamente por refrigeração para baixo adultos durante cerca de 2-3 min a -20 ° C, transferindo-os para uma placa fria a 2 ° C e a identificação de qualquer formação de pseudo-tumoral por utilização de um microscópio de dissecação em 15Xampliação com iluminação de campo claro. Após a avaliação, o retorno adultos às condições insetário (27 ± 3 ° C, 75 ± 5% de umidade).
Resultados
Injeção de pupa para os rendimentos KD gene óptimos resultados quando a injecção é realizada durante a fase de pupa precoce, quando os níveis de bronzeamento cutícula são baixos (Figura 1A, à esquerda, e 1B). Aumento de bronzeamento e endurecimento de cutícula, geralmente após 24 horas, resulta no aumento da morte de pupa após a injecção (Figura 1A, central e direito). A taxa de desenvolvimento de pupa pode variar dependendo das condições insetário e densidade de animais 24,25; Portanto, é melhor para avaliar visualmente a pigmentação.
Durante o processo de injecção, a agulha capilar é inserido na cutícula dorsal com um ângulo de aproximadamente 30 ° na direcção anterior para posterior (Figura 2A). Uma vez que a agulha é inserida e o ARNcd + 0,01% (w / v) de FGD é distribuído, a distribuição de corante é evidente através da hemolinfa (Figure 2B).
Avaliação de emergência dos adultos para pupas injectados com 0,01% (w / v) de DGC revelou uma taxa média de 70% de emergência, em comparação com 96,7% de emergência de controlos não injectados (Figura 3A). É de notar que foi observada a emergência parcial a partir do caso de pupa para um grande número de mosquitos não sobreviventes (Figura 3B). Animais injectados não apresentam atrasos no tempo de emergência (Figura 4A) ou impacto tendenciosa em ambos os sexos (Figura 4B). Avaliação adicional de sobrevivência de pacientes adultos realizadas até ao dia 10 pós-emergência revela nenhum impacto evidente no pós-emergência sobrevivência de pacientes adultos (Figura 4C).
Validação de qualidade KD foi avaliada pelo fenótipo pseudo-tumoral melanótico (aglomerado de tecido pigmentadas) associado com SRPN2 21,22 knockdown como um controlo positivo para o knockdown e ausência de fenótipos associados com injecção dsLacZ como um controlo negativo. mosquitos adultos que surgiram foram marcados no dia 8 após a injecção (dia 6-7 pós-emergência). Pseudo-melanotic tumores (Figura 5A e 5B) foram observadas através da cutícula de 93,5% do dsSRPN2 vs. 0% dos mosquitos adultos dsLacZ (Figura 6A). Clusters de tecido escuro melanizados foram identificados após a dissecação de manchas pigmentadas (Figura 5C). Pseudo-tumores eram visíveis sobre a cutícula adulto tão cedo como o dia 3 pós-emergência e também estavam presentes em um subconjunto de dsSRPN2 hemolinfa e tecidos do intestino (dados não mostrados). Em 5 de pós-injecção (fase adulta), diminuiu de forma significativa em níveis SRPN2 dsSRPN2, mas não foi observada dsLacZ ou isolados de proteína não-injectado hemolinfa (Figura 6B).
ftp_upload / 53738 / 53738fig1.jpg "/>
Figura 1: preparo do Desenvolvimento para a injeção de pupa dsRNA injeção de pupa precoce de dsRNA resulta em sobrevivência e progressão ideal para a fase adulta.. Os baixos níveis de pigmentação cutícula (A, à esquerda, e B) pode ser observada na primeira 0-24 h pupation seguinte. Tanning da cutícula anterior injeção de pupa (A, central e direito) resultados de moderada a sobrevida.
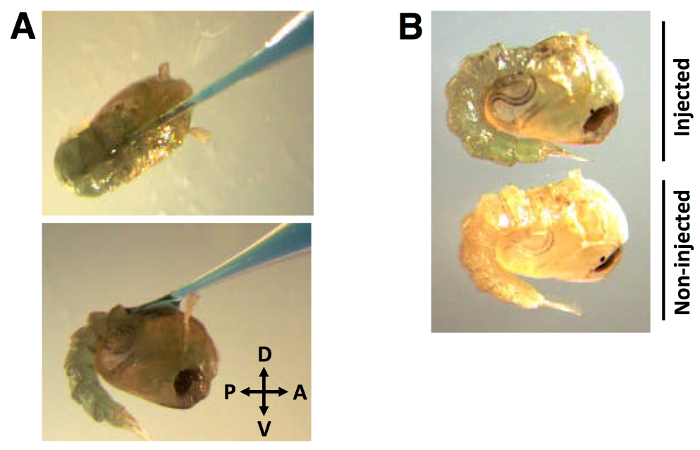
Figura 2:. Posição de injecção e a distribuição de injecção de ARNcd de agulha (A) Capilar marcadas com corante de ARNcd marcado com corante na cutícula dorsal em um ângulo de aproximadamente 30 °, na direcção anterior para posterior. (B) O corante é distribuída visivelmente na hemolinfa de pupas. O volume da injecção de ARNcd de 138 nl, marcado com 0,01% FGD (w / v).

Figura 3:. Pós-injecção adulto emergência (a) 70% de pupas injectados com 0,01% FGD (w / v) surgiram com sucesso (n = 60), em comparação com 96,7% dos controlos não injectados (n = 60). Foram realizadas três réplicas biológicas. Observou-se (B) a emergência parcial a partir do caso de pupa para um grande número de mosquitos não sobreviventes. As barras de erro representam o erro padrão da média (SEM).
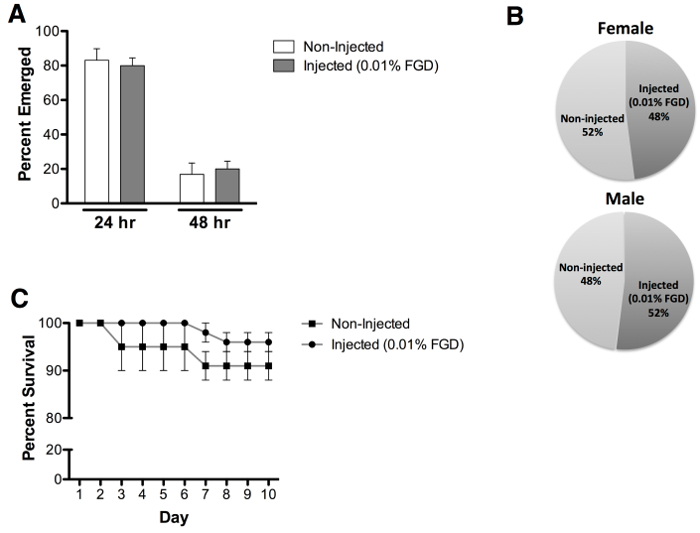
Figura 4: velocidade de emergência, a avaliação sexo e adulto sobrevivência (A) foram observados tempos de despertar comparáveis após a injecção de pupa com 0,01% FGD (24 HR = 80% e 48 HR = 20%), em comparação com pupas não injectada (24. HR = 83% e 48 HR = 17%). (B ) aproximadamente igual masculino e feminino adulto emergência foi observada para 0,01% FGD pupas injectado (feminino = 48% e masculino = 52%) e pupas não injectada (feminino = 52% e masculino = 48%). Análise (C) Survival revela que a injeção com 0,01% FGD não afeta a sobrevivência de adultos, avaliada até ao dia 10 pós-emergência. Os resultados representam dados de três experiências independentes com 0,01% FGD injectados (n = 60) e não injectada (n = 60) pupas (números iguais de machos e fêmeas). As barras de erro representam o erro padrão da média (SEM).

Figura 5: Pseudo-tumor fenótipo controlo positivo reflete knockdown sucesso Pseudo-tumores foram observados no (A) abdominal e (B) cutícula torácica de dsSRPN2 -injected, mas não dsLacZ mosquitos adultos -injected no dia 8 após a injecção..(C) Maior ampliação (400X) de imagem (a) da cutícula e dissecção de manchas pigmentadas (b) revela aglomerados de células melanizadas escura.
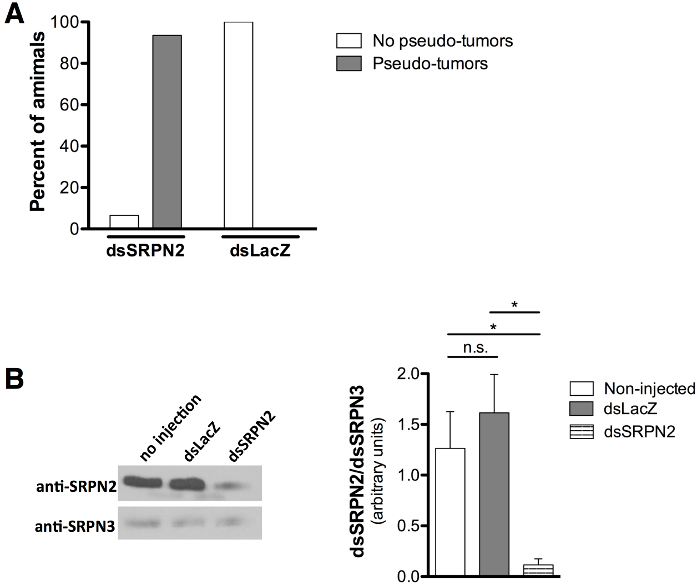
Figura 6: A quantificação da formação de pseudo-tumor e diminuiu os níveis de proteína SRPN2 (A) injecções fase de pupa resultar na formação de pseudo-tumor em 93,5% dos adultos dsSRPN2 (n = 21), comparativamente com 0% dos controles dsLacZ (n = 19). . Os resultados obtidos dia 8 após a injecção. (B) Western blot (esquerda) mostra diminuiu SRPN2 níveis em dsSRPN2, mas não dsLacZ ou isolados não injectados proteína hemolinfa (dia 5 pós-injecção). Resultados obtidos em três experiências independentes. Anti-SRPN2 21 e anti-26 SRPN3 diluições de anticorpos utilizados foram 1: 1.000 e 1: 2.000, respectivamente. Cabra anti-rabbit IgG-HRP (Produto sc-2004, Santa Cruz Biotechnology, Dallas TX) foi utilizado a 1: 5000. Todos os níveis de proteína foram quantificados (direita) pela intensidade da banda (ImageJ Software, NIH, Bethesda, MD), normalizado para SRPN3 e comparados estatisticamente pelo teste t não pareado. P <0,05: *, P ≥0.05: ns (não significativo). As barras de erro representam o erro padrão da média (SEM).
Discussão
Os métodos actuais para induzir RNAi não transgénicos em mosquitos envolver a injecção directa de ARNcd no hemocelo 12,13 adulto ou a alimentação das larvas de ARNi nanopartículas revestidas de gatilho ou 14-17-microalgas baseado ARNcd 18 moléculas. Segmentação do mosquito adulto, embora extremamente valioso, pode excluir um grande número de genes que funcionam durante períodos de desenvolvimento anteriores. Knockdown iniciado pela alimentação das larvas podem produzir fenótipos inconsistentes durante a fase adulta, devido, em parte, ao potencial de persistência proteína variável através da fase de pupa. Portanto, a introdução de um método adicional que é voltado especificamente para iniciar RNAi durante o desenvolvimento da pupa irá fornecer um meio para avaliar mais detalhadamente as funções dos genes durante estágios de desenvolvimento pré-adultos, bem como capacidades melhoradas para avaliar a função do gene durante os estágios adultos. Tal como com a abordagem de gene knockdown com base em injecção de ARNcd ou expressão, a persistência do gene knockdownnão pode ser prevista. Portanto, os níveis de transcritos ou proteínas devem ser avaliadas para o gene de interesse durante períodos de desenvolvimento de interesse. Embora observamos uma continuação da diminuição dos níveis de proteína no dia 5 pós-injeção para SRPN2 em animais SRPN2 dsRNA-injetados, fatores como a rotatividade de proteína e meia-vida pode ser diferente para diferentes alvos. É crítico para garantir, assim, que o ARNcd para ser utilizado para injecção é bem concentrada e parece intacto num gel de agarose. Recomendamos experimentadores reavaliar esses fatores se os resultados knockdown não são suficientes, e respectivas concentrações de dsRNA pode precisar de ser testado empiricamente para genes alvos específicos.
Descreve-se um método para a iniciação da interferência de ARN durante a fase de pupa de An. desenvolvimento gambiae. Este método baseia-se na introdução através de micro-injecção de ARNcd directamente no hemocelo de pupas precoce e permite a avaliação da qualidade da injecção pelautilização de ARNcd marcado com corante. A habilidade de visualizar a qualidade injecção constitui uma melhoria importante para garantir uma knockdown bem sucedida e constitui um aspecto do silenciamento de genes com base em injecção que não tenha sido considerada em protocolos baseados em ARNcd mais previamente relatados centrados na fase adulta. Ao direccionar a pupa no início deste período de desenvolvimento, genes que podem desempenhar um papel no desenvolvimento durante este intervalo crítico, ou durante as fases iniciais da vida adulta pode ser avaliada funcionalmente. Além disso, este método pode permitir a entrega dsRNA para as células, e o estabelecimento de interferência de RNA em células que são acessíveis durante a metamorfose, mas menos acessível em mosquitos adultos completamente formados.
Uma análise recente por microarranjo Harker et al. (2012) identificaram 560 An. transcrições gambiae que foram up-regulamentados ou para baixo-regulados por pelo menos 4 vezes durante diferentes estágios de desenvolvimento, desde o embrião a adulto. Dos 560 transcrições identificado, um conjunto de 309 foi up-regulada durante o desenvolvimento da pupa 27. Estas descobertas sugerem que há muitas exigências para expressão diferencial de genes ao longo do desenvolvimento do mosquito, incluindo aqueles que ocorrem durante a fase de pupa, um intervalo durante o qual o organismo sofre metamorfose. Em muitas espécies de insectos, incluindo uma. gambiae, os genes envolvidos em processos de desenvolvimento, tais como (ou seja, cuticular da pupa e proteínas de ligação a quitina) 27-31 e resposta imunitária (isto é, proteínas de receptores Toll-like) 27,32-34 são altamente expresso durante a fase de pupa. Uma vez que um adulto completamente formado emergiu, não é continuada a expressão do gene em resposta a alterações fisiológicas e ambientais 35. Nomeadamente, durante o desenvolvimento precoce de adultos, há um aumento na expressão de genes de desenvolvimento (isto é, adulto cuticular e proteínas sarcoplasmáticas) 36, bem como outros genes chave (ou seja , Proteína específica de esperma e citocromo P450 enzimas do metabolismo) 27,36.
O controlo positivo utilizado no desenvolvimento deste protocolo, SRPN2, é um AN. gambiae inibidor de protease de serina (serpina). SRPN2 desempenha um papel importante na regulação negativa da melanização de insectos, um amplo espectro de resposta imune inata em insectos 21,22. Knockdown de SRPN2 em mosquitos adultos resulta na formação de pseudo-tumor de 21,22, um fenótipo que é facilmente observada por utilização de microscopia de luz. Tendo em conta que este fenótipo distinto pode ser facilmente marcado em insetos vivos, usamos SRPN2 para injectáveis estágio RNAi pupa iniciais. Além disso, SRPN2 é expresso em todas as fases de desenvolvimento 37, proporcionando desse modo um bom alvo para a fase de pupa ARNi injecção e avaliação da função no início adulto. Nós demonstramos que o método que desenvolvemos é capaz de induzir adulto semelhante pseud melanótico a formação de O-tumor como uma consequência de injecções de dsRNA executadas durante a fase de pupa de desenvolvimento. No desenvolvimento deste protocolo, temos observado que a injeção durante o desenvolvimento da pupa precoce (isto é, a primeira 24 horas após a muda larva-pupa) é fundamental para a obtenção de emergência de adultos ideal. No caso de má emergência é obtido após a injecção, recomendamos a encenação larvas com maior precisão, para obter pupas com menos extensa endurecimento cutícula e assegurar a injeção fase de pupa início é alcançado. Além disso, minimizar os danos aos resultados da cutícula das taxas de emergência óptimas e aumentando a ampliação durante a injeção pode ajudar a garantir que apenas a região pretendida do animal é perfurado. Se a agulha deve perfurar através da cutícula ventral, o agrupamento de líquido marcado com corante será evidente no exterior da pupa, ou vai saturar o papel de filtro. É altamente recomendável para descartar qualquer pupas que têm mais de uma punção cutícula.
jove_content "> Com as extensas experiências de muitos laboratórios com o desempenho de injeções de mosquitos adultos, as abordagens microinjeção previamente identificados pode ser adaptada com modificações de protocolo simples para uso em experimentos RNAi pupa. No geral, o objetivo deste método é o de fornecer aos pesquisadores a capacidade de ampliar o prazo durante o qual reverter análises genéticas pode ser realizada, permitindo uma pesquisa mais adicional que irá apoiar o desenvolvimento de estratégias de controle de vetores novos. Curiosamente, as experiências em outras espécies, como Rhodnius prolixus e Spodoptera frugiperda, revelam que o gene efeitos silenciadores tendem a ser muito maior quando iniciado durante a pré-adulto estágios 38,39. durante todas as fases de desenvolvimento, gene RNAi mediada knockdown está sujeita a considerações sobre a rapidez ea persistência de silenciamento de genes, e a estabilidade das proteínas codificadas por genes-alvo. o alvo ideal RNAi genes tendem a ser aqueles que codificam uma protein ou de ARN que tem uma meia-vida curta e elevada taxa de rotação 11,40.Enquanto estratégias transgénicos ARNi também podem ser empregues para tratar as considerações sobre a rapidez e a persistência de ARNi durante as fases de pré-adulto, técnicas transgénicas têm muitos inconvenientes (por exemplo, o tempo necessário para a geração de linhas transgénicas, experimentais prazos de acasalamentos de mosquitos para gerar insectos com expressão dsRNA regulamentado, e manutenção de populações transgénicas). Por outro lado, o nosso protocolo proporciona um método mais fácil e mais rápido para iniciar silenciamento de genes durante o desenvolvimento da pupa e em tipos de células que se originam e são acessíveis durante a metamorfose, mas são menos acessíveis em adultos. A utilização de suspensões de dsRNA marcadas com corante permite a fácil avaliação do sucesso de injecção e a dispersão do material introduzido dentro de pupas. Os nossos dados sobre o início da formação de tumor em adultos pupa-injectado, em comparação com animais injectados como adultos, é consistente com o initiation de knockdown RNAi-mediada durante a fase de pupa. Usando nossa linha G3 mosquito e sob nossas condições insetário, observa-se o adulto melanotic formação de pseudo-tumor tão cedo quanto 10 dias após a injecção de adultos injetados três a cinco dias pós-emergência. Ao realizar a injeção início de pupa estágio, observamos a formação melanotic pseudo-tumor visível tão cedo quanto cinco dias após a injecção (ou seja, três a quatro dias após a emergência). Estes dados implicam que este método permite início de silenciamento de genes durante um período de desenvolvimento anteriormente sob estudado (ou seja, o desenvolvimento de pupa). O nosso método de marcação corante pode também ser útil para o desenvolvimento de novos protocolos de injecção larvais, devido à natureza translúcida da cutícula durante todas as fases larvares. Enquanto o controlo utilizadas neste estudo requer a progressão para a fase adulta para exibir um fenótipo de knockdown, futuras experiências para avaliar os fenótipos específicos da fase de pupa após a injecção de pupas cedo irá fornecerinformações valiosas sobre a expansão deste método em períodos de desenvolvimento adicionais, tais como o desenvolvimento de pupa tardia. Em resumo, este método fornece um protocolo de RNAi valiosa para a iniciação fase de pupa de silenciamento de genes RNAi-mediada e amplia as ferramentas de genômica funcional disponível para uso dentro da comunidade de investigação inseto vetor.
Divulgações
Acesso aberto para este vídeo-artigo é pago pela Biogen.
Agradecimentos
We would like to thank Dr. Flaminia Catteruccia and her research group (Harvard School of Public Health, Boston, MA) for providing our laboratory with the G3 colony used in this research and for the LacZ template DNA. We thank Adam Jenkins (Boston College, Chestnut Hill, MA) for his assistance in maintaining the insectary. The Biology Department of Boston College generously funded the research associated with the development of this technique.
Materiais
| Name | Company | Catalog Number | Comments |
| MEGAscript RNAi kit | Ambion | AM1626 | |
| Nanoject II injector | Drummond | 3-000-204 | |
| Nanoject II foot switch | Drummond | 3-000-026 | |
| Borosilicate glass capillaries | Drummond | 3-000-203-G/X | |
| Glass micropipette puller | Narishigne | PB-7 | |
| Fast Green FCF dye | Sigma | F7258 | Can substitute with a non-toxic food dye. |
| Plastic transfer pipettes | Thermo Scientific | 1371150 | ¼ inch cut from tip to create a wider opening. |
| Whatman “thin” filter paper | GE Healthcare | 1001-090 | This is 9 cm diameter Grade 1, but can be altered depending on size of injection pad. |
| Western blot “thick” filter paper | BioRad | 107-3931 | This is the filter paper generally used for Western blots. |
| Petri dishes (60 mm x 15 mm) | Fisher Scientific | FB0875713A | |
| Paint brush (size 0) | Michael’s Art | 10474940 | Brush size and brand can vary based on availability and user preference. |
| Dissecting light microscope | ---- | ----- | This can vary based on availability and user preference. |
Referências
- Kelly-Hope, L. A., McKenzie, F. E. The multiplicity of malaria transmission: a review of entomological inoculation rate measurements and methods across sub-Saharan Africa. Malar. J. 8 (1), 1-16 (2009).
- The malERA Consultative Group on Vector Control. A Research Agenda for Malaria Eradication: Vector Control. PLoS Med. 8 (1), e1000401 (2011).
- Enyati, A., Hemmingway, J. Malaria Management: Past, Present, and Future. Annu. Rev. of Entomol. 55 (1), 569-591 (2010).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genet. 10 (3), 1004236 (2014).
- Mitchell, S. N., et al. Metabolic and Target-Site Mechanisms Combine to Confer Strong DDT Resistance in Anopheles gambiae. PLoS ONE. 9 (3), e92662 (2014).
- Knox, T. B., et al. An online tool for mapping insecticide resistance in major Anopheles vectors of human malaria parasites and review of resistance status for the Afrotropical region. Parasite Vector. 7 (76), 1-14 (2014).
- Napoli, C., Lemieux, C., Jorgensen, R. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes. Plant Cell. 2, 279-289 (2002).
- Sen, G. L., Blau, H. M. A brief history of RNAi: the silence of the genes. FASEB J. 20 (9), 1293-1299 (2006).
- Romano, N., Macino, G. Quelling: transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences. Mol. Microbiol. 6 (22), 3343-3353 (1992).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Catteruccia, F., Levashina, E. A. RNAi in the Malaria Vector, Anopheles gambiae: Therapeutic Applications of RNAi: Methods and Protocols. Methods Mol. Biol. 555, 63-75 (2009).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A). gambiae). J. Vis. Exp. (5), e230 (2007).
- Mysore, K., Andrews, E., Li, P., Duman-Scheel, M. Chitosan/siRNA nanoparticle targeting demonstrates a requirement for single-minded during larval and pupal olfactory system development of the vector mosquito Aedes aegypti. BMC Dev. Biol. 14 (9), 1-16 (2014).
- Mysore, K., Flannery, E. M., Tomchaney, M., Severson, D. W., Duman-Scheel, M. Disruption of Aedes aegypti Olfactory System Development through Chitosan/siRNA Nanoparticle Targeting of semaphorin-1a. PLoS Negl. Trop. Dis. 7 (5), (2013).
- Zhang, X., Zhang, J., Zhu, K. Y. Chitosan/double-stranded RNA nanoparticle-mediated RNA interference to silence chitin synthase genes through larval feeding in the African malaria mosquito (Anopheles gambiae). Insect Mol. Biol. 19 (5), 683-693 (2010).
- Zhang, X., et al. Chitosan/Interfering RNA Nanoparticle Mediated Gene Silencing in Disease Vector Mosquito Larvae. J. Vis. Exp. (97), e52523 (2015).
- Kumar, A., Wang, S., Ou, R., Samrakandi, M., Beerntsen, B. T., Sayre, R. T. Development of an RNAi based microalgal larvicide to control mosquitoes. Malaria World J. 4 (6), 1-7 (2013).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: A review. J. Insect Physiol. 56 (3), 227-235 (2010).
- Burand, J. P., Hunter, W. B. RNAi: Future in insect management. J. Invertebr. Pathol. 112, S68-S74 (2013).
- Michel, K., Budd, A., Pinto, S., Gibson, T. J., Kafatos, F. C. Anopheles gambiae SRPN2 facilitates midgut invasion by the malaria parasite Plasmodium berghei. EMBO Rep. 6 (9), 891-897 (2005).
- An, C., Budd, A., Kanost, M. R., Michel, K. Characterization of a regulatory unit that controls melanization and affects longevity of mosquitoes. Cell Mol. Life Sci. 68 (11), 1929-1939 (2011).
- Horn, T., Boutros, M. E-RNAi: a web application for the multi-species design of RNAi reagents--2010 update. Nucleic Acids Res. 38, W332-W339 (2010).
- Benedict, M. Q. . Methods in Anopheles Research. , (2014).
- Lyimo, E. O., Takken, W., Koella, J. C. Effect of rearing temperature and larval density on larval survival, age at pupation and adult size of Anopheles gambiae. Entomol. Exp. Appl. 63, 265-271 (1992).
- Michel, K., et al. Increased melanizing activity in Anopheles gambiae does not affect development of Plasmodium falciparum. Proc. Natl. Acad. Sci. 103 (45), 16858-16863 (2006).
- Harker, B. W., et al. Transcription Profiling Associated With Life Cycle of Anopheles gambiae. J Med Entomol. 49 (2), 316-325 (2012).
- Dotson, E. M., Cornel, A. J., Willis, J. H., Collins, F. H. A family of pupal-specific cuticular protein genes in the mosquito Anopheles gambiae. Insect Biochem. Molec. Biol. 28, 459-472 (1998).
- Hopkins, T. L., Krchma, L. J., Ahmad, S. A., Kramer, K. J. Pupal cuticle proteins of Manduca sexta: characterization and profiles during sclerotization. Insect Biochem. Molec. Biol. 30, 19-27 (1999).
- Liang, J., Zhang, L., Xiang, Z., He, N. Expression profile of cuticular genes of silkworm, Bombyx mori. BMC Genomics. 11 (173), 1-13 (2010).
- Zhou, X., Riddiford, L. M. Broad specifies pupal development and mediates the "status quo" action of juvenile hormone on the pupal-adult transformation in Drosophila and Manduca. Development. 129, 2259-2269 (2002).
- Luna, C., Wang, X., Huang, Y., Zhang, J., Zheng, L. Characterization of four Toll related genes during development and immune responses in Anopheles gambiae. Insect Biochem. Molec. Biol. 32, 1171-1179 (2002).
- Tauszig, S., Jouanguy, E., Hoffmann, J. A., Imler, J. -. L. Toll-related receptors and the control of antimicrobial peptide expression in Drosophila. Proc. Natl. Acad. Sci. 97 (19), 10520-10525 (2000).
- Tryselius, Y., Samakovlis, C., Kimbrell, D. A., Hultmark, D. CecC, a cecropin gene expressed during metamorphosis in Drosophila pupae. Eur. J. Biochem. 204, 1-5 (1992).
- Goodisman, M. A. D., Isoe, J., Wheeler, D. E., Wells, M. A. Evolution of Insect Metamorphosis: a Microarray-Based Study of Larval and Adult Gene Expression in the Ant Camponotus Festinatus. Evolution. 59 (4), 858-870 (2005).
- Cook, P. E., Sinkins, S. P. Transcriptional profiling of Anopheles gambiae mosquitoes for adult age estimation. Insect Mol. Bio. 19 (6), 745-751 (2010).
- Suwanchaichinda, C., Kanost, M. R. The serpin gene family in Anopheles gambiae. Gene. 442 (1-2), 47-54 (2009).
- Araujo, R. N., et al. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug Rhodnius prolixus (Hemiptera: Reduviidae) by dsRNA ingestion or injection. Insect Biochem. Molec. Biol. 36 (9), 683-693 (2006).
- Griebler, M., Westerlund, S. A., Hoffmann, K. H., Meyering-Vos, M. RNA interference with the allatoregulating neuropeptide genes from the fall armyworm Spodoptera frugiperda and its effects on the JH titer in the hemolymph. J. Insect Physiol. 54 (6), 997-1007 (2008).
- Scott, J. G., et al. Towards the elements of successful insect RNAi. J. Insect Physiol. 59 (12), 1212-1221 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados