Method Article
에 RNAi의 트리거 배달
요약
RNA interference (RNAi) is an extremely valuable tool for uncovering gene function. However, the ability to target genes using RNAi during pre-adult stages is limited in the major human malaria vector Anopheles gambiae. We describe an RNAi protocol to reduce gene function via direct injection during pupal development.
초록
RNA interference (RNAi), a naturally occurring phenomenon in eukaryotic organisms, is an extremely valuable tool that can be utilized in the laboratory for functional genomic studies. The ability to knockdown individual genes selectively via this reverse genetic technique has allowed many researchers to rapidly uncover the biological roles of numerous genes within many organisms, by evaluation of loss-of-function phenotypes. In the major human malaria vector Anopheles gambiae, the predominant method used to reduce the function of targeted genes involves injection of double-stranded (dsRNA) into the hemocoel of the adult mosquito. While this method has been successful, gene knockdown in adults excludes the functional assessment of genes that are expressed and potentially play roles during pre-adult stages, as well as genes that are expressed in limited numbers of cells in adult mosquitoes. We describe a method for the injection of Serine Protease Inhibitor 2 (SRPN2) dsRNA during the early pupal stage and validate SRPN2 protein knockdown by observing decreased target protein levels and the formation of melanotic pseudo-tumors in SRPN2 knockdown adult mosquitoes. This evident phenotype has been described previously for adult stage knockdown of SRPN2 function, and we have recapitulated this adult phenotype by SRPN2 knockdown initiated during pupal development. When used in conjunction with a dye-labeled dsRNA solution, this technique enables easy visualization by simple light microscopy of injection quality and distribution of dsRNA in the hemocoel.
서문
말라리아는 매년 개인의 수백만에 영향을 미치는 모기 매개 전염병이다. 세계 보건기구 (WHO)는 2013 년 오년 1 세 미만의 소아에서 발생한 78 퍼센트의 어느 인해 말라리아 약 584,000 죽음이 있었다는 것을보고합니다. 인간의 말라리아의 원인 병원체는 속 변형체 내에서 정단 복합체 충류 기생충과 여성 아노 펠 레스 모기에 의해 자신의 인간의 호스트 사이에 전송된다. 모기가 후속 혈액 식사에 감염되지 않은 개인에 다음 예금 감염 기생충에 감염된 개인으로부터 혈액 식사를한다, 때 변속기가 발생합니다. 속 아노 펠 레스 내 아노 펠 레스 gambiae는 최대의 vectorial 용량 종이며, 사하라 사막 이남의 아프리카 1-3에서 가장 눈에 띄는 말라리아 벡터이다.
현재, 살충제의 배치에 의해 모기 벡터 제어는 b에 계속인간 말라리아의 부담을 경감하기 위해 사용될 주요 방법으로 전자. 1960 년대 이후 살충제의 사용은 매우 성공적인 것으로 입증되었지만, 살충제 저항 상승은 신규 살충제 및 다른 벡터 제어 전략 4-7의 개발에 대한 필요성을 주도하고있다. 2010 년, WHO에보고 49 (63) 국가의 총 말라리아 벡터 1 살충제 저항성의 발생을 지적했다. 또한, Afrotropical 지역에서 저항 데이터를 평가하는 피어 리뷰 문학을 활용 IR 매퍼 도구는 2001 년과 2012 년 사이에 각각 7 피레스 로이드와 dichlorodiphenyltrichloroethane (DDT)에 대한 내성 46 %와 27 % 증가, 거기보고합니다.
RNA 간섭 (RNAi의)는 페튜니아 식물 8,9 및 곰팡이 뉴로 crassa의 9,10- 유전자를 불 활성화하기 위해 사용될 수있는 기술로서 1990에서 확인되었다. 잠시 후,1998 년 RNAi를 먼저 주입 또는 공급 방법 9,11 통해 안티센스 또는 이중 가닥 RNA (dsRNA에)의 도입에 의해 동물 모델에서 유전자 발현을 감소시키는 수단으로서, 예쁜 꼬마 선충에 설명 하였다. 그 발견 이후, RNAi의 연구자들은 빠른 속도로 매우 선택적 전사 후 유전자 침묵 메커니즘을 통해 관심의 유전자의 기능적 역할을 조사하기 위해 역 유전학을 이용 할 수 있도록하여 기능 유전체학의 추구를 혁명을 일으켰다. 노랑 초파리와 같은 일부 생물에서, 간섭 RNA 구조를 표현하는 유전자 변형 생물체의 사용은 유전자 녹다운 (KD) 널리 성공했다. 에서 유전자의 사용 있지만. RNAi에 대한 gambiae이 이용되고있다 대규모 스크린을위한 유용 할 수있다, 유전자 변형 모기 균주의 발생은 노동 및 시간 집약적, 일반적으로 generati 관심의 유전자의 식별에서 이동 2-3 개월 복용 둘 다적절한 형질 전환 재고 (12)에. 현재 유전자 KD의 기본 방법. gambiae는 dsRNA에의, 성인 단계에서, 체액에 주입하여 특정 유전자 12, 13에 대한 구체적인이다. 이 과정은 일반적으로 훨씬 더 빠른 형질 전환 방법 (12)보다 증명, 유전자 KD의 평가에 관심있는 유전자의 식별에서 이동 약 1 개월 소요됩니다. 애벌레 단계의 RNAi하는 방법은 최근에 설립되었다. 14-17 먹이 나노 입자를 통해 또는 구두 전달로 gambiae Aedes aegypti 및 미세 조류 기반의 dsRNA를 개발의 초기 단계에서 기능 유전체학 분석을 수행 할 수있는 기회를 제공하고, 18 분자. 직접 분사, 공급, 및 나노 입자 전달 방법에서, dsRNA를은 "짧은 RNA를 간섭"21 ~ 25 염기 길이 (siRNA를) (19, 20)에 효소 Dicer에 의해 표적 세포에 의해 자율적으로 흡수하고 분해된다. 이러한 siRNA를 다음 있습니다 incorpor로 ated RNA 유도 복합체 (RISC)를 침묵, 한 가닥은 RNA 바인딩 RISC 복합체에 결합 대상의 mRNA를 절단하여 그 수준을 감소시키고 그것의 번역 (19, 20)를 억제 할 수 있도록, 폐기 될로부터.
기본 모기 생물학의 많은 본질적인 기능은 호스트 환경 설정 (예를 들어, 후각, 맛보기), 짝짓기, 재생 및 면역 포함의 vectorial 용량을 조절한다. 이러한 생물학적 과정의 중요성을 감안할 때, 유전 또는 약리학 적 수준에서 자신의 변조 살충제 저항의 우회를 포함하는 벡터 제어를위한 새로운 기회를 제공하고, 벡터 관리에보다 광범위하게 통합 된 접근 방식에 대한 새로운 도구를 제공 할 가능성이 높습니다. 이러한 고유의 생물학적 기능을 기본 유전자의 역할을 평가하는 기능 유전체학의 사용은 새로운 목표의 식별을 가능하게하고 우리가 효과적으로 새로운,보다 효과적인 제어 전략에서을 만드는 방법에 대한 새로운 통찰력을 제공 할 것입니다이거 야. 우리의 번데기 단계에서의 RNAi를 개시하기위한 신속한 주입 방법의 개발과 사용에 대해 설명합니다. gambiae. 우리는 RNAi의 트리거의 번데기 주입 빨리 넉다운 유전자가 포스트 출현 성인에서 시작 된 경우 관찰되는 것보다 출현 이후, 즉, 초기 단계의 성인에서 생성 된 표현형의 관찰을 가능하게 관찰. 이 방법은 유전자 번데기 발달 구간에서 시작하여 성숙한 단계 등 번데기 개발 중에 개시 유전자 녹다운이 지속하고 영향을 줄 수 있다는 초기 성인 체액 액세스 유형의 세포,뿐만 아니라 세포 유형으로 연장 넉다운 수 있다는 변태 중에 더 체액 - 접근 이러한 출현 다음 성인 부속에있는 감각 신경 세포와 성인에서보다.
프로토콜
1. 합성 및 준비 dsRNA를
- 더 식별 오프 대상 영향이없는 것으로 예측되고 관심의 유전자 내에서 (해당 dsRNA를 생성하는) 200-800 bp의 넉다운 영역을 식별합니다 (예를 들어, 다른 유전자 내에서 어떤 서열 상 동성 ≥18 BP) 및 음성 대조군 (예 : 이러한 대장균의 lacZ 유전자로 (GenBank 등록 유전자 ID : 945006) 대상 곤충 게놈 내에 존재하지 않는 이종성 서열. 대안 적으로, SRPN2 21,22로서 쉽게 관찰 된 표현형을 수득 예 양성 대조군 (사용 ,의 GenBank 유전자 ID :. 1,270,169)는 dsRNA를 대상으로 SRPN2의 순서는 미셸 등으로 정의된다 (2005) 21..
주 : E-RNAi의 이러한 영역의 식별 및 올리고 뉴클레오타이드 프라이머 (23)를 설계하는 과정에 유용 오픈 소스 생물 정보학 자원이다. - 의를 수행tandard PCR 증폭 (즉,의 Taq DNA 중합 효소는 30-35 사이클을 사용하여 수행) T7 프로모터 서열에 의해 측면 dsRNA를 합성 템플릿을 획득하기 위해 게놈 DNA 또는 cDNA의 템플릿을 이용하여 (5'-TAATACGACTCACTATAGGG-3 ') 및 dsRNA를 준비 진행하고 청소 제조업체의 지침에 따라 상용 시험 관내 전사 키트를 사용하여. 사용 SRPN2 PCR 증폭 조건 등에 제시된 프라이머 정보를 제공합니다. (2011) 22.
- 260 nm의 파장에서의 자외선 흡수 분광법에 의해 정제 된 앰플 리콘 RNA 수율을 정량화의 RNase가없는 물에 소정의 농도 (예를 들면, 3 μg의 / μL)로 조정한다.
- 낮은 RNA 농도 문제 해결을 위해, 아래로 실온에서 진공 원심 분리기에서 샘플을 회전하거나 샘플을 동결 건조 및 물을 작은 볼륨을 재구성하여 액체 부피를 줄일 수 있습니다. 샘플을 동결 건조에 필요한 시간을 따라 달라질초기 샘플 볼륨과 dsRNA를 농도에.
- TAE 1X TBE 또는 준비 2 % 아가로 오스 겔상에서의 dsRNA의 품질 및 길이를 확인 버퍼 전사 반응에 사용되는 주형 DNA와 함께, 에티 디움 브로마이드 (EtBr이)으로 염색. dsRNA를 템플릿의 DNA보다 더 느리게 마이그레이션합니다. 품질 및 길이가 더 비특이적 dsRNA에 제품이 없을 보장함으로써 각각의 표준 DNA 마커 제품을 비교하여 평가할 수있다.
참고 : EtBr이이 강력한 돌연변이에 따라 적절하게 처리해야한다.
주 : 3 μg의 / μL의 농도에서 dsRNA를 샘플 0.5 μL은 EtBr이 유리화 아가 로스 젤에서 가시화하기에 충분한 것보다 더 많은 것이다. - 필요할 때까지 -20 ° C에서 dsRNA를 저장합니다. 분취이 dsRNA를 대량 준비를해야하므로 여러 동결 / 해동 사이클은 저하의 원인이 될 수 있습니다.
2. 빠른 그린 FCF 염료 (FGD) 튜브를 준비합니다
- 빠른 그린 FCF 염료를 희석의 RNase없는 물에 0.1 % (v / v)의 (작업 용액)에 원액 (≥85 % 염료 함량)에서.
- 피펫 1.5 ml의 마이크로 원심 튜브의 바닥에 염색 1 μL.
- 약 3 시간 동안 65 ° C 열 블록에 넣어 튜브를 사용하기 전에 냉각, 적어도 30 분 동안 실온에서 액체, 다음 장소 튜브 증발합니다. 이 건조 고체 염료를 dsRNA 부유 용액에서 재구성한다.
3. 풀 주입 바늘
- 10 ~ 30 ㎛의 팁 직경에 가열 된 바늘 풀러를 사용하여 붕규산 유리 바늘을 빼냅니다. 더 히터의 조정 : 차 설정에 해당합니다. = 100 (1), 히터 조절 없음. 2 = 70.
- 바늘의 미세 팁의 손상을 방지하려면 퍼티의 성형 스트립에 페트리 접시에 수평으로 모두 뽑아 바늘을 배치합니다.
참고 : 방법을 당기는 모세관 바늘에 대한 추가 정보는 말라리아 연구 및 참조 시약 리소스 센터 M에서 더 자세히 볼 수 있습니다R4 설명서 24.
4. 사출 역을 준비
- 필요한 자료를 수집 : 유리 마이크로 캐 필러 바늘이 미세 팁, 마이크로 인젝터, 얇은 필터 종이와 두꺼운 종이 필터, 페트리 접시, 전송 피펫, 페인트 브러시 및 해부 광학 현미경으로 당겼다.
- 마이크로 인젝터 설명서의 지침에 따라 마이크로 인젝터를 준비하고, 펄스 당 원하는 볼륨 (예를 들어, 펄스 당 69 NL의 최대)에 주입 볼륨을 설정합니다.
- 현미경 다루기 쉬운 플랫폼 (예, 스티로폼 튜브 랙의 평탄한 측면) 위에 얇은 여과지 개의 필터 종이 시트를 적층하고, 가장자리 테이프로 고정.
- 얼음의 각 dsRNA를 별도의 색 염료 튜브 용액 및 장소 10 μl를 재현 탁.
5. 주입을위한 번데기를 수집
- 탈 물 10ml 및 수집 ~ 50 창백한 번데기 (두리 채우기 작은 60mm는 X 15mm 페트리 접시일회용 플라스틱 전송 피펫을 사용하여 insectary 트레이에서 번데기 후 첫 24 시간)를 ng를.
- 어두운 표피 선탠 중간을 가지고있는 번데기를 제거합니다.
참고 : 표피가 황갈색 시작하면, 그것은 훨씬 더 높은 치사율의 표피, 사출 결과를 침투하는 것이 더 어려워진다.
6. dsRNA를 주입
- 해부 현미경 하에서 미세 포셉 쌍 주사 바늘의 말단 팁을 끊는.
- (3 인치, 30 게이지 바늘과 주사기를 사용) 미네랄 오일 바늘을 메우기 및 마이크로 인젝터와 과잉 오일을 추방함으로써 주사 바늘을 준비한다.
- 전면 dsRNA를 최대 양의 주사 바늘을 작성하고 액체의 분배를 보장하기 위해 현미경으로 하나의 펄스를 꺼냅니다. 어떤 액체가 취해지지 및 / 또는 배출되는 경우에, 임의의 차단을 위해 바늘의 말단 팁을 확인 바늘 단단히 microinjecto 확보되도록아르 자형.
- 1-3 번데기를 선택하고, 여과지에 배치합니다.
- 붓을 사용하여, 지느러미 표피 접근과 필터 종이에 번데기를 놓고 필터 종이에 밀어 초과 물을 흡수하기 위해 붓을 사용합니다.
- 붓의 끝 번데기를 안정화하고, 번데기의 등의 표면에 대하여 약 30 °의 각도로 흉부와 복부 사이의 지느러미 표피에 바늘을 삽입합니다. 사출가 번데기와 바늘의 후방 끝으로 이동해야는 전방 - 투 - 후방 방향으로 이동해야한다.
- 체액에 3 μg의 / μL dsRNA를 솔루션의 두 펄스 (펄스 당 69 NL)를 주입하고, 몸 전체 색의 분포를 확인합니다. 어떤 색상이 확인되지 않은 경우, 장애물에서 팁을 취소 약간 주사 바늘의 위치를 이동 및 액체 전달을 반복합니다.
- 부드럽게 배양 물에 바늘에서 번데기를 이동 젖은 붓을 사용합니다. 티그는 가벼운 접촉시 붓에 충실해야 번데기.
7. 후 주입 조건
- 적절한 공기 흐름 (예를 들어, 메쉬 케이지 또는 메쉬 뚜껑이있는 용기)와 모기 케이지에 주입 번데기와 페트리 접시를 놓습니다. 번데기 사육 조건은 27 ± 3 ° C의 온도에서 지속적으로 유지 75 ± 5 %의 습도와 일 빛 아래해야 : 8 시간 : 16 어두운주기.
- 성인 공급을위한 메쉬 포도당 용액 (V / w)의 10 %를 준비하고, 모기 케이지에 솔루션 포화 목화 공을 놓습니다.
8 최저 평가
- 원하는 시간 점 (들)에서, 컨트롤에 비해 실험 dsRNA를 주입 곤충의 표현형을 평가.
- -20 ℃에서 2-3 분 동안 성인을 놀 2 ° C에서 콜드 플레이트로 옮기고 15 배에 해부 현미경을 이용하여 임의의 의사 - 종양 형성을 확인함으로써 매일 dsSRPN2 및 dsLacZ 곤충 평가브라이트 조명 확대. 평가 후, insectary 조건 (27 ± 3 ° C, 75 ± 5 % 습도)에 성인을 반환합니다.
참고 :이 프로토콜에서 사용되는 실험 및 제어 dsRNA에 각각 dsSRPN2 및 dsLacZ 있습니다. 컨트롤에 적합한 많은 옵션이 있습니다; 그러나, 제안되는 표현형 및 / 또는 발현이 용이하고 /하거나 정량 [예를 들어, 정량적 실시간 PCR (QRT-PCR), 웨스턴 블롯]를 사용한다 (예를 들어, 현미경 해부) 가시화되는 양성 대조군 웨스턴 블롯 및 QRT-PCR을 통해이 기술. SRPN2 단백질 및 성적 증명서 정량을 배울 때, 각각 외. (2005) (21) 미셸에 설명되어 있습니다.
- -20 ℃에서 2-3 분 동안 성인을 놀 2 ° C에서 콜드 플레이트로 옮기고 15 배에 해부 현미경을 이용하여 임의의 의사 - 종양 형성을 확인함으로써 매일 dsSRPN2 및 dsLacZ 곤충 평가브라이트 조명 확대. 평가 후, insectary 조건 (27 ± 3 ° C, 75 ± 5 % 습도)에 성인을 반환합니다.
결과
유전자 KD 수익률 주입 초기 번데기 단계에서 수행되는 최적의 결과, 표피 선탠 수준이 낮은 경우 (그림 1A가, 왼쪽 및 1B)에 대한 번데기 주입. 일반적으로 24 시간 주입 다음 증가 번데기 죽음의 결과 (그림 1A, 중앙 및 오른쪽) 후, 선탠과 표피의 경화를 증가. 번데기 개발 속도는 insectary 조건과 동물의 밀도 (24, 25)에 따라 달라질 수 있습니다; 따라서, 그것은 시각적으로 색소 침착을 평가하는 것이 가장 좋습니다.
주입 과정 모세관 바늘은 후방 방향 (도 2A)에 앞쪽에서 대략 30 °의 각도로 지느러미 표피에 삽입된다. 니들이 삽입 된 dsRNA + 0.01 %되면 (V / W) FGD가 분배되는 색소의 분포 (체액 걸쳐 Figu 분명) 2B 다시.
번데기에 대한 성인 출현의 평가 FGD 비 주사 컨트롤 (그림 3A)의 96.7 %의 출현에 비해 70 % 출현의 평균 속도를 보여 (V / w) 0.01 % 주입. 참고로, 번데기 경우와 부분 출현 비 생존 모기 (도 3b)의 다수 관찰되었다. 주입 동물 출현 시간에 더 지연 (그림 4A) 또는 중 성별 (그림 4B)에 바이어스 영향을 전시하지 않습니다. 성인 생존의 추가 평가는 10 포스트 출현은 이후 출현 성인 생존 (그림 4C)에는 분명 영향을 알 수없는 일까지 실시했다.
KD 품질 및 유효성은 최저 대한 양성 대조군으로 21,22 넉다운 SRPN2와 연관된 melanotic 의사 종양 (어둡게 착색 조직 클러스터) 표현형에 의하여 평가 하였다 음성 대조군으로 dsLacZ 주입과 관련된 표현형의 부재. 등장 성인 모기는 8 일 후 분사 (하루 6 ~ 7 후 출현)에서 득점했다. Melanotic 의사 종양 (도 5a 및도 5b) dsSRPN2 대 93.5 %의 표피를 통해 관찰 dsLacZ 성인 모기 (도 6A)의 0 %. 음울 흑화 조직의 클러스터는 색소 패치 (그림 5C)의 해부에 확인되었다. 의사 종양이 빠르면 3 일 후 출현으로 성인 표피에 볼 수 있었고, 또한 dsSRPN2의 체액과 장 조직의 하위 집합에 존재 (데이터가 표시되지 않음). 5 포스트 분사 (초기 성인 단계)에서 크게 dsSRPN2에 SRPN2 수준을 감소하지만, dsLacZ 또는 비 주입 체액 단백질 분리하지 (그림 6B)를 관찰 하였다.
ftp_upload / 53738 / 53738fig1.jpg "/>
그림 1 : 번데기 dsRNA를 주입하기위한 발달 준비 성인 무대에 최적의 생존과 진행에 dsRNA를 결과의 조기 번데기 주입.. 표피 색소의 낮은 수준 (A, 왼쪽 및 B)는 제 0-24 시간 내에 다음 번데기 관찰 할 수있다. 가난한 생존에 적당한에서 번데기 표피 앞의 분사 (A, 센터 및 오른쪽) 결과 태닝.
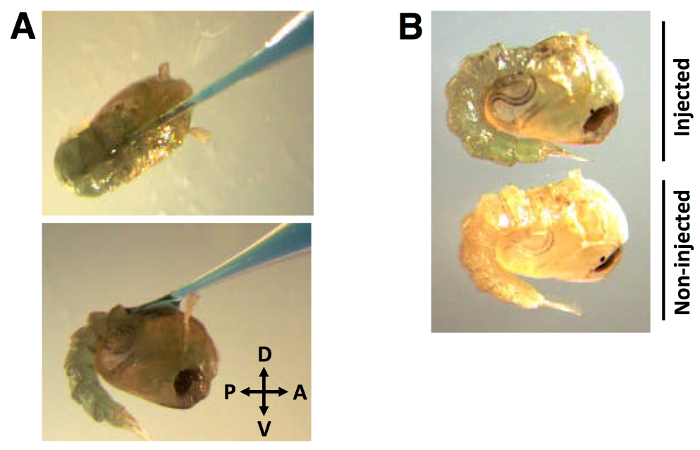
그림 2 :. 전방에서 약 30 °의 각도로 주입 위치와 지느러미 표피에 색소 표지 dsRNA를의 염료 표지 된 dsRNA를 (A) 모세관 바늘 주입 분포, 방향을 후부합니다. (B) 염료가 눈에 띄게 번데기 체액에 분포한다. 0.01 % F (138)로 표지 된 dsRNA (NL)의 주입량,GD (W / V).

도 3. 사후 주입 성인 등장 (A) 번데기의 70 %는 비 분사 제어 (N = 60)의 96.7 %에 비해, (N = 60) (V는 / W)를 성공적으로 등장 0.01 %의 FGD 주입. 세 가지 생물학적 복제가 수행되었다. 번데기 경우와 (B) 부분 출현은 비 생존 모기 다수 관찰되었다. 오차 막대는 평균 (SEM)의 표준 오차를 나타낸다.
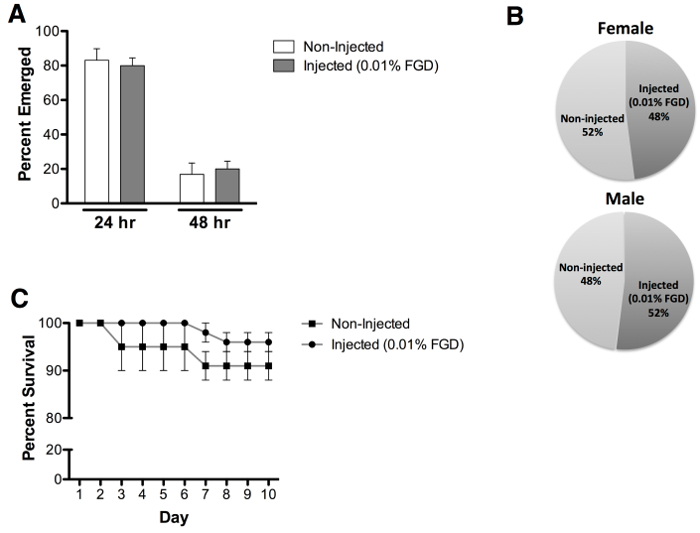
그림 4 : 출현 비율, 성 평가 및 성인 생존 (A) 비 주입 번데기에 비해 필적 출현 시간은, 0.01 %의 FGD (24 시간 = 80 %와 48 시간 = 20 %)와 번데기 주입 다음 관찰되었다 (24. 시간 = 83 %와 48 시간 = 17 %). (B ) 약 동일한 남성과 여성의 성인 출현은 0.01 %의 FGD 주입 번데기 (여성 = 48 %와 남성 = 52 %)과 비 주입 번데기 (여성 = 52 %와 남성 = 48 %) 관찰되었다. (C) 생존 분석은 0.01 % FGD와 주사 10 일 후 출현까지 평가, 성인 생존에 영향을주지 않음을 알 수있다. 결과는 3 개의 독립적 인 주입 0.01 %의 FGD 실험 (N = 60) 및 비 주사 (N = 60) 번데기 (남성과 여성의 동등한 숫자) 데이터를 나타냅니다. 오차 막대는 평균 (SEM)의 표준 오차를 나타낸다.

그림 5 : 의사 종양 양성 대조군 표현형이 성공적으로 최저를 반영하는 의사 종양 (A) 복부 및 주사 하였을 dsSRPN2의 (B) 흉부 표피에서 관찰하지만, 하루 8 포스트 분사에 주사 하였을 성인 모기를 dsLacZ되지 않았다..(C) 높은 배율 (400X) 및 표피 색소 패치 해부 이미지 (a)는 (b) 어둡고 흑화 셀 클러스터를 보여준다.
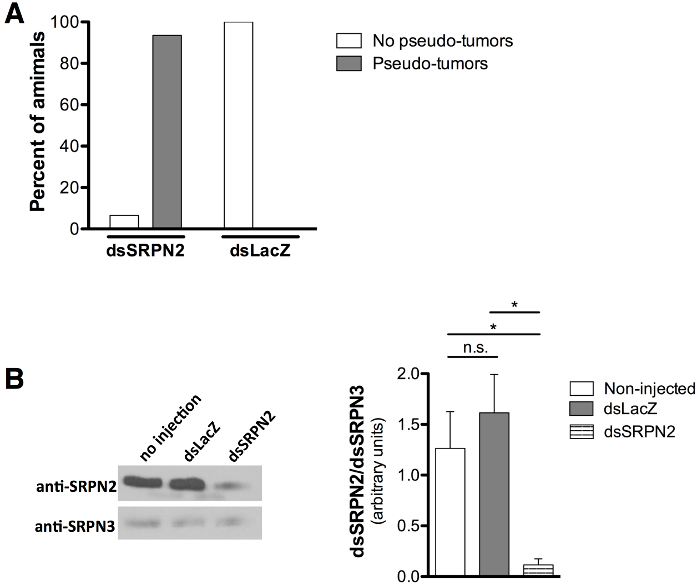
도 6 : 의사 - 종양 형성의 정량은 SRPN2 단백질 수치 감소 (A) 번데기 주사 0 dsLacZ 컨트롤 % (N = 19)와 비교하여 (N = 21) dsSRPN2 성인의 93.5 %에서 의사 - 종양 형성을 초래한다. . 결과는 8 일 후 분사를 획득했습니다. (B) 웨스턴 블롯 (왼쪽)에 도시 한 dsSRPN2에 SRPN2 수준을 감소하지만 dsLacZ 또는 비 - 주입 된 체액 단백질 분리 물 (5 일 후 분사). 결과 3 개의 독립적 인 실험을 기반으로. 1,000 : 1 : 2,000, 각각 사용 방지 SRPN2 21 항 SRPN3 (26) 항체 희석은 1이었다. 염소 항 - RA5000 : BBIT의 IgG-HRP (제품 SC-2004, 산타 크루즈 생명 공학, 달라스 TX는) 1을 사용 하였다. 모든 단백질 수준이 짝 t 시험으로 비교하여 통계적으로 SRPN3에 밴드 강도 (ImageJ에 소프트웨어, NIH, 베데스다, MD), 정규화에 의해 (오른쪽) 정량화 하였다. P <0.05 : *, P ≥0.05 : NS (중요하지 않음). 오차 막대는 평균 (SEM)의 표준 오차를 나타낸다.
토론
모기에 비 형질 전환의 RNAi를 유도하는 현재의 방법은 성인 hemocoel 12, 13 또는 RNAi의 트리거 코팅 된 나노 입자 14 ~ 17 또는 미세 조류 기반의 dsRNA를 18 분자의 애벌레 먹이로 dsRNA를 직접 주입을 포함한다. 성인 모기 타겟팅, 매우 가치있는 동안, 이전의 개발 기간 동안 작동 유전자의 큰 숫자를 제외 할 수 있습니다. 유충의 공급에 의해 초기화가 최저 번데기 통해 가변 단백질 지속성 전위에 부분적으로 인해 성인 단계에서 일치 표현형을 생성 할 수있다. 따라서,보다 완전 성인 단계에서 유전자 기능을 평가하기 위해 유전자 전 성인 발달 단계 중 기능뿐만 아니라 향상된 능력을 평가하는 수단을 제공한다 번데기 개발시 RNAi의 개시에서 특히 목적으로 추가 도입 방법. dsRNA를 주입 또는 발현 유전자 녹다운의 지속성에 기초하여 유전자 녹다운 방식과 마찬가지로예측 될 수 없다. 따라서, 성적 증명서 또는 단백질 수준은 관심의 개발 기간 동안 관심의 유전자를 평가해야한다. SRPN2 dsRNA를 주입 동물 SRPN2에 대한 5 일 후 분사에서 단백질 수준을 감소의 우리가 계속 관찰하지만, 단백질 회전율 및 반감기 등의 요소는 서로 다른 대상에 대해 다를 수 있습니다. 잘 농축 dsRNA를 사출에 사용되는 것이 아니라 보장하는 것이 중요하고, 아가 로스 겔에 그대로 나타난다. 우리는 최저 결과가 충분하지 않은 경우 실험자 이러한 요인을 재평가 추천 및 dsRNA를 각각의 농도는 특정 유전자의 대상에 대해 경험적으로 테스트 할 필요가있다.
우리의 번데기 단계에서 RNA 간섭을 개시하기위한 방법을 설명한다. gambiae 개발. 이 방법은 직접 초기 번데기의 hemocoel에 dsRNA를 미세 주입을 통해 도입에 의존하여 사출 품질의 평가를 할 수 있습니다염료 표지 된 dsRNA를 사용합니다. 주입 품질을 시각화 할 수있는 능력은 성공적인 최저 보장하는 중요한 향상을 구성하고 성인 단계에 초점을 이전에보고 된 대부분의 dsRNA를 기반 프로토콜에서 고려되지 않은 사출 기반 유전자 녹다운의 양상을 구성한다. 이 개발 기간이 중요한 발달 구간에서 역할을 할 수 유전자의 발현에 번데기를 표적으로하거나, 성인의 초기 단계에서 기능적으로 평가 될 수있다. 또한,이 방법은 변형시 액세스 셀 dsRNA를 세포에 전달하고, RNA 간섭의 확립을 가능하게 할 수 있지만 완전히 형성 성인 모기 덜 접근.
하커 등의 최근 마이크로 어레이 분석. (2012) (560)를 확인했다. 업 규제 또는 배아에서 성인에 이르기까지 서로 다른 발달 단계에서 최소 4 배에서 하향 조정했다 gambiae 성적 증명서. (56)의0 성적 증명서는 식별 (309)의 세트는 번데기 개발 (27) 중에 조절 하였다. 이러한 연구 결과는 번데기 단계에서 발생하는 것과, 유기체가 변태를 겪는 동안 간격을 포함하여 모기의 개발을 통해 차동 유전자 발현에 대한 많은 요구 사항이 있다는 것을 시사한다. 등 많은 곤충 종에서. gambiae, 이러한 개발 (즉, 번데기 cuticular 및 키틴 결합 단백질) 등의 과정에 관여하는 유전자 27-31과 면역 반응 (즉, 수신자 수용체 같은 단백질) 27,32-34 매우 번데기 단계에서 표현된다. 완전히 형성 성인 등장하면, 환경 생리 35 변화에 따라 유전자 발현이 계속된다. 특히, 초기 성인 개발 과정, 발달 유전자 (즉, 성인 cuticular 및 근질 단백질) (36)의 발현 증가뿐만 아니라 다른 주요 유전자가 (즉, , 정자 특정 단백질과 사이토 크롬 P450 대사 효소) 27,36.
이 프로토콜 SRPN2의 개발에 사용하는 포지티브 제어 수단이다. gambiae 세린 프로테아제 억제제 (세르 핀). SRPN2 곤충 melanization 곤충 (21, 22)의 폭 넓은 선천성 면역 반응의 네가티브 조절에 중요한 역할을한다. 의사 - 종양 형성 (21, 22)를 쉽게 광학 현미경을 이용하여 관찰 표현형 성인 모기 결과 SRPN2의 최저. 이 별개의 표현형 쉽게 라이브 곤충 득점 할 수 있음을 감안할 때, 우리는 초기 번데기 단계의 RNAi 주사에 대한 SRPN2을 사용했다. 또한, SRPN2하여 초기 성인에서 번데기 RNAi의 주입 및 기능 평가를위한 좋은 목표를 제공, 모든 발달 단계 (37) 동안 표현된다. 우리는 우리가 개발 한 방법은 유도 유사한 성인 melanotic pseud 할 수 있음을 입증 개발 번데기 기간 동안 수행 dsRNA를 주사의 결과로서 오 - 종양 형성. 이 프로토콜을 개발, 우리는 (즉, 애벌레 - 번데기의 탈피 후 첫 24 시간)이 최적의 성인 출현을 얻기위한 중요한 초기 번데기 개발하는 동안 그 주사를 관찰했다. 불량한 출현 후 분사 획득되는 경우, 우리는 이하 광범위한 표피 경화와 번데기를 구하여 초기 번데기 주입이 달성 보장하기 위해 더 정확하게 유충 스테이징 바랍니다. 또한, 주입시 최적의 출현 비율의 표피 결과에 손상이 증가 배율을 최소화하는 것은 동물의 의도 영역이 천공되어 있는지 확인 할 수 있습니다. 바늘 복부 표피 뚫할지, 염료 표지 된 액체의 풀링 번데기의 외관에 명백 할 것이다 또는 여과지를 포화한다. 매우 개 이상의 표피 구멍이있는 모든 번데기를 폐기하는 것이 좋습니다.
성인 모기 주사의 성능에 많은 실험실의 폭 넓은 경험과 함께 jove_content은 "> 이전에 확인 된 미세 주입 방식은 번데기의 RNAi 실험에 사용하기위한 간단한 프로토콜 수정하여 적용 할 수 있습니다. 전반적으로,이 방법의 목표는 연구자에게 능력을 제공하는 것입니다 유전 분석은 상기 신규 한 벡터 제어 전략의 개발을 지원하는 연구를 가능하게 수행 될 수 역방향 동안 기간을 확대. 흥미롭게도, 이러한 Rhodnius의 prolixus 및 스포 도프 테라 프 루기 페르 다른 종에서 실험, 침묵 효과를 크게하는 경향이 유전자를 밝혀 사전 성인 중 시작 할 때 더 큰 개발의 모든 단계 동안. 38, 39 스테이지, 넉다운 RNAi를 매개 유전자는 신속성과 유전자 침묵의 지속성 및 대상 유전자에 의해 코딩되는 단백질의 안정성에 대한 고려 될 수 있습니다. 이상적인 RNAi의 대상 유전자 PROTEI를 인코딩 자들을 경향n 또는 RNA 짧은 반감기와 높은 이직률 11,40을 갖는다.유전자의 RNAi 전략은 또한 사전 성인 단계 동안 신속성 및 RNAi의 지속성에 대한 고려 사항을 해결하기 위해 채용 될 수 있지만, 형질 전환 기법은 많은 결점 (모기 교배 곤충을 생성하기위한 예를 들면, 트랜스 제닉 라인의 생성에 필요한 시간, 실험 시간 프레임을 규제 dsRNA를 발현, 및 형질 전환 주식의 유지 보수)와 함께. 대조적으로, 우리의 프로토콜은 번데기 개발 과정 및 유래 및 변형 동안 액세스 할 수 있지만, 성인 덜 액세스 할 수있는 세포 유형에 유전자 최저를 시작하기위한 쉽고 빠른 방법을 제공한다. 염료 표지 된 dsRNA를 현탁액의 사용은 쉽게 주입 성공의 평가와 번데기에서 도입 된 물질이 분산이 가능합니다. 성인 주입 된 동물에 비해 번데기 주입 성인에서 종양 형성의 개시에 대한 우리의 데이타는 초기화와 일치의 iation 번데기 단계에서 최저의 RNAi는 매개. 우리의 G3 모기 라인을 사용하고 insectary 조건에서, 우리는 성인의 포스트 분사가 3~5일에게 포스트 출현을 주입 이르면 10 일 성인 melanotic 의사 종양 형성을 관찰합니다. 초기 번데기 단계의 주입을 수행함으로써, 우리는 초기 오일 주입 후 (즉, 3~4일가 등장 게시)으로 볼 수 melanotic 의사 종양 형성을 관찰합니다. 이러한 데이터는이 방법은 이전에 아래 - 연구 개발 기간 (즉, 번데기 개발) 동안 유전자 최저의 개시를 할 수 있음을 의미한다. 우리의 염료 라벨링 방법은 때문에 모든 애벌레 령충 동안 표피의 반투명 특성으로 새로운 애벌레 주입 프로토콜의 개발에 유용 할 수 있습니다. 본 연구에 사용 된 컨트롤이 최저 표현형을 표시하는 성인 단계로 진행을해야하지만, 미래의 실험을 제공합니다 초기 번데기의 주입 다음 번데기 특정 표현형을 평가하기늦은 번데기 개발 등의 추가 개발 기간에이 방법의 확장에 대한 귀중한 통찰력. 요약하면,이 방법은 RNAi를 매개 유전자 최저의 번데기 개시를위한 가치있는 RNAi의 프로토콜을 제공하고 벡터 곤충 연구 커뮤니티 내에서 사용할 수있는 기능 유전체학 도구를 확장합니다.
공개
이 비디오 기사에 대한 오픈 액세스는 바이오젠에 의해 지급됩니다.
감사의 말
We would like to thank Dr. Flaminia Catteruccia and her research group (Harvard School of Public Health, Boston, MA) for providing our laboratory with the G3 colony used in this research and for the LacZ template DNA. We thank Adam Jenkins (Boston College, Chestnut Hill, MA) for his assistance in maintaining the insectary. The Biology Department of Boston College generously funded the research associated with the development of this technique.
자료
| Name | Company | Catalog Number | Comments |
| MEGAscript RNAi kit | Ambion | AM1626 | |
| Nanoject II injector | Drummond | 3-000-204 | |
| Nanoject II foot switch | Drummond | 3-000-026 | |
| Borosilicate glass capillaries | Drummond | 3-000-203-G/X | |
| Glass micropipette puller | Narishigne | PB-7 | |
| Fast Green FCF dye | Sigma | F7258 | Can substitute with a non-toxic food dye. |
| Plastic transfer pipettes | Thermo Scientific | 1371150 | ¼ inch cut from tip to create a wider opening. |
| Whatman “thin” filter paper | GE Healthcare | 1001-090 | This is 9 cm diameter Grade 1, but can be altered depending on size of injection pad. |
| Western blot “thick” filter paper | BioRad | 107-3931 | This is the filter paper generally used for Western blots. |
| Petri dishes (60 mm x 15 mm) | Fisher Scientific | FB0875713A | |
| Paint brush (size 0) | Michael’s Art | 10474940 | Brush size and brand can vary based on availability and user preference. |
| Dissecting light microscope | ---- | ----- | This can vary based on availability and user preference. |
참고문헌
- Kelly-Hope, L. A., McKenzie, F. E. The multiplicity of malaria transmission: a review of entomological inoculation rate measurements and methods across sub-Saharan Africa. Malar. J. 8 (1), 1-16 (2009).
- The malERA Consultative Group on Vector Control. A Research Agenda for Malaria Eradication: Vector Control. PLoS Med. 8 (1), e1000401 (2011).
- Enyati, A., Hemmingway, J. Malaria Management: Past, Present, and Future. Annu. Rev. of Entomol. 55 (1), 569-591 (2010).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genet. 10 (3), 1004236 (2014).
- Mitchell, S. N., et al. Metabolic and Target-Site Mechanisms Combine to Confer Strong DDT Resistance in Anopheles gambiae. PLoS ONE. 9 (3), e92662 (2014).
- Knox, T. B., et al. An online tool for mapping insecticide resistance in major Anopheles vectors of human malaria parasites and review of resistance status for the Afrotropical region. Parasite Vector. 7 (76), 1-14 (2014).
- Napoli, C., Lemieux, C., Jorgensen, R. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes. Plant Cell. 2, 279-289 (2002).
- Sen, G. L., Blau, H. M. A brief history of RNAi: the silence of the genes. FASEB J. 20 (9), 1293-1299 (2006).
- Romano, N., Macino, G. Quelling: transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences. Mol. Microbiol. 6 (22), 3343-3353 (1992).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Catteruccia, F., Levashina, E. A. RNAi in the Malaria Vector, Anopheles gambiae: Therapeutic Applications of RNAi: Methods and Protocols. Methods Mol. Biol. 555, 63-75 (2009).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A). gambiae). J. Vis. Exp. (5), e230 (2007).
- Mysore, K., Andrews, E., Li, P., Duman-Scheel, M. Chitosan/siRNA nanoparticle targeting demonstrates a requirement for single-minded during larval and pupal olfactory system development of the vector mosquito Aedes aegypti. BMC Dev. Biol. 14 (9), 1-16 (2014).
- Mysore, K., Flannery, E. M., Tomchaney, M., Severson, D. W., Duman-Scheel, M. Disruption of Aedes aegypti Olfactory System Development through Chitosan/siRNA Nanoparticle Targeting of semaphorin-1a. PLoS Negl. Trop. Dis. 7 (5), (2013).
- Zhang, X., Zhang, J., Zhu, K. Y. Chitosan/double-stranded RNA nanoparticle-mediated RNA interference to silence chitin synthase genes through larval feeding in the African malaria mosquito (Anopheles gambiae). Insect Mol. Biol. 19 (5), 683-693 (2010).
- Zhang, X., et al. Chitosan/Interfering RNA Nanoparticle Mediated Gene Silencing in Disease Vector Mosquito Larvae. J. Vis. Exp. (97), e52523 (2015).
- Kumar, A., Wang, S., Ou, R., Samrakandi, M., Beerntsen, B. T., Sayre, R. T. Development of an RNAi based microalgal larvicide to control mosquitoes. Malaria World J. 4 (6), 1-7 (2013).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: A review. J. Insect Physiol. 56 (3), 227-235 (2010).
- Burand, J. P., Hunter, W. B. RNAi: Future in insect management. J. Invertebr. Pathol. 112, S68-S74 (2013).
- Michel, K., Budd, A., Pinto, S., Gibson, T. J., Kafatos, F. C. Anopheles gambiae SRPN2 facilitates midgut invasion by the malaria parasite Plasmodium berghei. EMBO Rep. 6 (9), 891-897 (2005).
- An, C., Budd, A., Kanost, M. R., Michel, K. Characterization of a regulatory unit that controls melanization and affects longevity of mosquitoes. Cell Mol. Life Sci. 68 (11), 1929-1939 (2011).
- Horn, T., Boutros, M. E-RNAi: a web application for the multi-species design of RNAi reagents--2010 update. Nucleic Acids Res. 38, W332-W339 (2010).
- Benedict, M. Q. . Methods in Anopheles Research. , (2014).
- Lyimo, E. O., Takken, W., Koella, J. C. Effect of rearing temperature and larval density on larval survival, age at pupation and adult size of Anopheles gambiae. Entomol. Exp. Appl. 63, 265-271 (1992).
- Michel, K., et al. Increased melanizing activity in Anopheles gambiae does not affect development of Plasmodium falciparum. Proc. Natl. Acad. Sci. 103 (45), 16858-16863 (2006).
- Harker, B. W., et al. Transcription Profiling Associated With Life Cycle of Anopheles gambiae. J Med Entomol. 49 (2), 316-325 (2012).
- Dotson, E. M., Cornel, A. J., Willis, J. H., Collins, F. H. A family of pupal-specific cuticular protein genes in the mosquito Anopheles gambiae. Insect Biochem. Molec. Biol. 28, 459-472 (1998).
- Hopkins, T. L., Krchma, L. J., Ahmad, S. A., Kramer, K. J. Pupal cuticle proteins of Manduca sexta: characterization and profiles during sclerotization. Insect Biochem. Molec. Biol. 30, 19-27 (1999).
- Liang, J., Zhang, L., Xiang, Z., He, N. Expression profile of cuticular genes of silkworm, Bombyx mori. BMC Genomics. 11 (173), 1-13 (2010).
- Zhou, X., Riddiford, L. M. Broad specifies pupal development and mediates the "status quo" action of juvenile hormone on the pupal-adult transformation in Drosophila and Manduca. Development. 129, 2259-2269 (2002).
- Luna, C., Wang, X., Huang, Y., Zhang, J., Zheng, L. Characterization of four Toll related genes during development and immune responses in Anopheles gambiae. Insect Biochem. Molec. Biol. 32, 1171-1179 (2002).
- Tauszig, S., Jouanguy, E., Hoffmann, J. A., Imler, J. -. L. Toll-related receptors and the control of antimicrobial peptide expression in Drosophila. Proc. Natl. Acad. Sci. 97 (19), 10520-10525 (2000).
- Tryselius, Y., Samakovlis, C., Kimbrell, D. A., Hultmark, D. CecC, a cecropin gene expressed during metamorphosis in Drosophila pupae. Eur. J. Biochem. 204, 1-5 (1992).
- Goodisman, M. A. D., Isoe, J., Wheeler, D. E., Wells, M. A. Evolution of Insect Metamorphosis: a Microarray-Based Study of Larval and Adult Gene Expression in the Ant Camponotus Festinatus. Evolution. 59 (4), 858-870 (2005).
- Cook, P. E., Sinkins, S. P. Transcriptional profiling of Anopheles gambiae mosquitoes for adult age estimation. Insect Mol. Bio. 19 (6), 745-751 (2010).
- Suwanchaichinda, C., Kanost, M. R. The serpin gene family in Anopheles gambiae. Gene. 442 (1-2), 47-54 (2009).
- Araujo, R. N., et al. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug Rhodnius prolixus (Hemiptera: Reduviidae) by dsRNA ingestion or injection. Insect Biochem. Molec. Biol. 36 (9), 683-693 (2006).
- Griebler, M., Westerlund, S. A., Hoffmann, K. H., Meyering-Vos, M. RNA interference with the allatoregulating neuropeptide genes from the fall armyworm Spodoptera frugiperda and its effects on the JH titer in the hemolymph. J. Insect Physiol. 54 (6), 997-1007 (2008).
- Scott, J. G., et al. Towards the elements of successful insect RNAi. J. Insect Physiol. 59 (12), 1212-1221 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유