Method Article
RNAi trigger consegna in
In questo articolo
Riepilogo
RNA interference (RNAi) is an extremely valuable tool for uncovering gene function. However, the ability to target genes using RNAi during pre-adult stages is limited in the major human malaria vector Anopheles gambiae. We describe an RNAi protocol to reduce gene function via direct injection during pupal development.
Abstract
RNA interference (RNAi), a naturally occurring phenomenon in eukaryotic organisms, is an extremely valuable tool that can be utilized in the laboratory for functional genomic studies. The ability to knockdown individual genes selectively via this reverse genetic technique has allowed many researchers to rapidly uncover the biological roles of numerous genes within many organisms, by evaluation of loss-of-function phenotypes. In the major human malaria vector Anopheles gambiae, the predominant method used to reduce the function of targeted genes involves injection of double-stranded (dsRNA) into the hemocoel of the adult mosquito. While this method has been successful, gene knockdown in adults excludes the functional assessment of genes that are expressed and potentially play roles during pre-adult stages, as well as genes that are expressed in limited numbers of cells in adult mosquitoes. We describe a method for the injection of Serine Protease Inhibitor 2 (SRPN2) dsRNA during the early pupal stage and validate SRPN2 protein knockdown by observing decreased target protein levels and the formation of melanotic pseudo-tumors in SRPN2 knockdown adult mosquitoes. This evident phenotype has been described previously for adult stage knockdown of SRPN2 function, and we have recapitulated this adult phenotype by SRPN2 knockdown initiated during pupal development. When used in conjunction with a dye-labeled dsRNA solution, this technique enables easy visualization by simple light microscopy of injection quality and distribution of dsRNA in the hemocoel.
Introduzione
La malaria è una malattia infettiva trasmessa dalle zanzare che colpisce molti milioni di persone ogni anno. L'Organizzazione Mondiale della Sanità (OMS) riferisce che nel 2013 ci sono stati circa 584.000 i decessi dovuti alla malaria, il 78 per cento dei quali si sono verificati nei bambini sotto l'età di cinque anni 1. Gli agenti patogeni che causano la malaria umana sono parassiti Apicomplexa all'interno del Plasmodium genere e sono trasmessi tra i loro ospiti umani dalle zanzare femmina Anopheles. La trasmissione si verifica quando la zanzara prende un pasto di sangue da un individuo che è stato infettato, e quindi i depositi parassiti infettivi in un individuo infetto in un successivo pasto di sangue. All'interno del genere Anopheles, Anopheles gambiae è la specie con la maggiore capacità vettoriale ed è il vettore della malaria più importante in Africa sub-sahariana 1-3.
Attualmente, le zanzare controllo vettoriale per la distribuzione di insetticidi continua a bvia e il metodo principale utilizzato per ridurre l'impatto della malaria umana. Sebbene l'uso di insetticidi dal 1960 ha dimostrato di essere estremamente efficace, l'aumento della resistenza agli insetticidi ha spinto la necessità di sviluppare nuovi insetticidi e strategie di controllo alternative vettore 4-7. Nel corso del 2010, per un totale di 49 di 63 paesi dichiaranti per l'OMS ha indicato la presenza di resistenza agli insetticidi in vettori della malaria 1. Inoltre, lo strumento IR Mapper, che utilizza la letteratura peer-reviewed per valutare i dati di resistenza nelle regioni afrotropicali, riporta che tra il 2001 e il 2012 ci sono stati 46% e il 27% un aumento della resistenza ai piretroidi e diclorodifeniltricloroetano (DDT), rispettivamente 7.
Interferenza RNA (RNAi) è stato identificato nei primi anni 1990 come una tecnica che potrebbe essere impiegato per inattivare geni nella pianta Petunia 8,9 e del fungo Neurospora crassa 9,10. Poco dopo,nel 1998, RNAi è stata la prima volta nel Caenorhabditis elegans come un mezzo per ridurre l'espressione genica in un modello animale per l'introduzione di antisenso o di RNA a doppio filamento (dsRNA) tramite iniezione o di alimentazione metodi di 9,11. Fin dalla sua scoperta, RNAi ha rivoluzionato la ricerca della genomica funzionale, consentendo ai ricercatori di utilizzare genetica inversa per indagare rapidamente i ruoli funzionali di geni di interesse tramite un meccanismo di silenziamento genico post-trascrizionale altamente selettivo. In alcuni organismi, come Drosophila melanogaster, l'uso di organismi transgenici che esprimono interferenti costrutti RNA è stato ampiamente successo per knockdown gene (KD). Sebbene l'uso di transgeni in An. gambiae per RNAi è stato utilizzato e può rivelarsi utile per gli schermi di grandi dimensioni, la generazione di ceppi di zanzare transgeniche è allo stesso tempo del lavoro e tempo intenso, generalmente prendendo due o tre mesi per andare dalla identificazione di un gene di interesse per i Generatisu di uno stock adeguato transgenici 12. Attualmente, il principale metodo di gene KD in An. gambiae è mediante iniezione nel emolinfa, durante la fase adulta, di dsRNA specifico per un dato gene 12,13. Questo processo richiede in genere circa un mese per andare da identificazione di un gene di interesse per la valutazione di gene KD, dimostrando di essere molto più rapidi rispetto ai metodi transgenici 12. I metodi per larvale stadi RNAi sono stati istituiti di recente in An. a base di microalghe gambiae e Aedes aegypti tramite nanoparticelle alimentazione 14-17 o mediante consegna orale di dsRNA molecole 18, offrendo la possibilità di eseguire analisi genomica funzionale durante le prime fasi di sviluppo. In iniezione diretta, l'alimentazione, e metodi di consegna di nanoparticelle, dsRNA è ripreso in maniera autonoma dalla cellula bersaglio e scisso dall'enzima Dicer in 21-25 nucleotidi a lungo "short interfering RNA" (siRNA) 19,20. Questi siRNA sono poi Incorporated nel RNA-induced silencing complex (RISC), da cui verrà scartato un filo, che consente il complesso RISC RNA-bound di legarsi al fender e l'mRNA target e quindi ridurre il suo livello e inibisce la sua traduzione 19,20.
Molte caratteristiche intrinseche della biologia di base delle zanzare modulano la capacità vettoriale, tra cui la preferenza host (ad esempio, l'olfatto, gustation), l'accoppiamento, la riproduzione e l'immunità. Data l'importanza di questi processi biologici, è probabile che la loro modulazione a livello genetico o farmacologica offrirà nuove opportunità per il controllo vettoriale, tra cui l'elusione di resistenza agli insetticidi, e di fornire nuovi strumenti per gli approcci più in generale integrato alla gestione vettoriale. L'uso della genomica funzionale per valutare il ruolo dei geni alla base di tali caratteristiche biologiche intrinseche consentirà identificazione di nuovi bersagli e fornire nuove informazioni su come possiamo creare in modo efficace nuova, più efficace di controllo strategi. Descriviamo lo sviluppo e l'utilizzo di un metodo di iniezione rapida per l'avvio RNAi durante la fase di pupa di An. gambiae. Osserviamo che fase di iniezione di pupa di un trigger RNAi permette l'osservazione dei fenotipi risultanti negli adulti fase iniziale, vale a dire, prima dopo la nascita di quella che sarebbe rispettato se silenziamento genico sono stati avviati negli adulti post-emergenza. Questo metodo consente silenziamento genico che inizia durante l'intervallo dello sviluppo pupa e si estende in stadi adulti, tali che silenziamento genico iniziata durante lo sviluppo pupa può persistere e influenzare l'adulto emolinfa accessibili tipi di cellule, così come i tipi di cellule che sono più emolinfa-accessibile durante la metamorfosi che nell'adulto, come ad esempio i neuroni sensoriali si trovano in appendici adulti seguenti emergere.
Protocollo
1. Sintesi e Preparazione dsRNA
- Identificare una regione atterramento 200-800 bp (per generare corrispondente dsRNA) all'interno del gene di interesse che è previsto per avere effetti fuori bersaglio identificabili (per esempio, nessuna sequenza omologia ≥18 bp all'interno di un altro gene) e un controllo negativo (ad esempio , una sequenza eterologa non è presente all'interno del genoma bersaglio insetto, come il gene lacZ Escherichia coli (GenBank gene ID: 945.006). in alternativa, utilizzare un controllo positivo (ad esempio, che produce un fenotipo facilmente osservato, come SRPN2 21,22 , GenBank Gene ID:. 1270169) la sequenza del target SRPN2 dsRNA è definita Michel et al (2005) 21..
Nota: E-RNAi è una risorsa bioinformatica open-source che è utile per l'identificazione di tali regioni e per il processo di progettazione primer oligonucleotidi 23. - eseguire standard amplificazione PCR (vale a dire, eseguita con Taq DNA polimerasi utilizzando 30-35 cicli) utilizzando un DNA genomico o un modello di cDNA per ottenere dsRNA modello di sintesi affiancato da una sequenza promotore T7 (5'-TAATACGACTCACTATAGGG-3 ') e procedere con la preparazione e dsRNA pulire-up utilizzando un kit di trascrizione in vitro commerciale secondo le istruzioni del produttore. Usa SRPN2 PCR condizioni di amplificazione e informazioni di fondo, come presentato in An et al. (2011) 22.
- Quantificare purificati rendimenti RNA ampliconi mediante spettroscopia di assorbimento UV a lunghezza d'onda di 260 nm e regolare alla concentrazione desiderata (ad esempio, 3 mg / mL) in acqua RNase-free.
- Per la risoluzione basse concentrazioni di RNA, ridurre il volume di liquido da spinning campioni giù in una centrifuga sotto vuoto a temperatura ambiente o dalla liofilizzazione di campioni e ricostituzione in piccoli volumi di acqua. Il tempo richiesto per liofilizzazione campione varia a secondasui volumi iniziali del campione e delle concentrazioni dsRNA.
- Controllare la qualità e la lunghezza del dsRNA su un gel di agarosio al 2% preparato con 1x TBE o TAE buffer e colorati con bromuro di etidio (EtBr), insieme con il DNA stampo utilizzato per la reazione di trascrizione. Il dsRNA migrerà più lentamente del DNA stampo. Qualità e durata possono essere valutate assicurando non ci sono prodotti non specifici dsRNA e confrontando i prodotti con un marcatore del DNA di serie, rispettivamente.
Nota: EtBr è un agente mutageno potente e deve essere maneggiato di conseguenza.
Nota: Ad una concentrazione dsRNA di 3 mg / mL, 0,5 ml di campione è più che sufficiente per la visualizzazione sul gel di agarosio EtBr-tinto. - Conservare dsRNA a -20 ° C fino al momento dell'uso. Più cicli di congelamento / scongelamento possono causare il degrado, in modo aliquote dovrebbero essere preparati per grandi volumi di dsRNA.
2. Preparare veloce verde FCF Dye Tubes (FGD)
- Diluire veloce colorante verde FCFda soluzione madre (≥85% contenuto di colorante) al 0,1% (v / v) (soluzione di lavoro) in acqua RNase-free.
- Pipettare 1 ml di colorante nel fondo di una provetta da 1,5 ml microcentrifuga.
- Porre le provette in un blocco di calore a 65 ° C per circa 3 ore per evaporare, quindi posizionare i tubi di liquido a temperatura ambiente per almeno 30 minuti, raffreddare prima dell'uso. Questo colorante solido secco sarà ricostituire in soluzione risospensione dsRNA.
3. Aghi Pull iniezione
- Tirare aghi di vetro borosilicato con un estrattore ago riscaldato ad un diametro punta di 10-30 micron. Pull impostazioni corrispondono a: regolazione riscaldamento n. 1 = 100, regolazione riscaldamento n. 2 = 70.
- Per evitare di danneggiare la multa punta dell'ago, inserire tutti gli aghi tirati orizzontalmente in una capsula di Petri su una striscia di stampaggio stucco.
Nota: Informazioni aggiuntive per capillare che tira ago metodi può essere trovato in dettaglio nel malaria ricerca e reagente di riferimento Resource Center MManuale R4 24.
4. Preparare stazione di iniezione
- Raccogliere materiali necessari: aghi di vetro microcapillari tirato a punta fine, microinjector, carta da filtro sottile e carta da filtro di spessore, capsule di Petri, pipette di trasferimento, pennello e dissezione microscopio ottico.
- Preparare la microinjector come indicato nel manuale microinjector, e impostare il volume di iniezione al volume desiderato per impulso (ad esempio, massimo di 69 nl per impulso).
- Su una piattaforma che è facile da manovrare al microscopio (ad esempio, parte piatta di un portaprovette polistirolo), impilare i due fogli di carta filtro con la carta da filtro sottile sulla parte superiore, e fissarlo con nastro intorno ai bordi.
- Risospendere 10 ml di ciascuna soluzione dsRNA in tubi di tintura di colore separati, e posto sul ghiaccio.
5. Raccogliere Pupe per iniezione
- Riempire un piccolo 60 millimetri x 15 mm piastra Petri con 10 ml di acqua deionizzata, e raccogliere ~ 50 pupe pallido (During le prime 24 ore dopo impupamento) da un cassetto insectary utilizzando una pipetta di trasferimento di plastica usa e getta.
- Rimuovere eventuali pupe che hanno medio cuticola concia scuro.
Nota: Una volta che la cuticola comincia ad abbronzarsi, diventa più difficile da penetrare la cuticola, ed i risultati di iniezione in molto più alta letalità.
6. dsRNA iniezione
- Sotto il microscopio da dissezione, rompere la punta distale dell'ago iniezione con un paio di pinze sottili.
- Preparare l'ago di iniezione riempimento l'ago con olio minerale (utilizzando una siringa con un 3 pollici, ago 30 gauge) ed espellere l'olio in eccesso con il microinjector.
- Davanti riempire ago per iniezione con massima quantità di dsRNA, ed espellere un impulso al microscopio per garantire l'erogazione di liquido. Nel caso in cui nessun liquido viene ripreso e / o espulso, controllare la punta distale dell'ago per qualsiasi blocco e assicurarsi che l'ago sia saldamente fissato nella microinjector.
- Raccogliere 1-3 pupe, e metterli sulla carta da filtro.
- Utilizzando il pennello, posizionare il pupe sulla carta da filtro con dorsali cuticola accessibili, e utilizzare il pennello per spingere su carta da filtro e assorbire di acqua in eccesso.
- Stabilizzare la pupa con la punta del pennello, e inserire l'ago nella cuticola dorsale fra il torace e dell'addome con un angolo di circa 30 ° rispetto alla superficie dorsale della pupa. L'iniezione deve essere diretto verso l'estremità posteriore della pupa e l'ago deve essere spostato in senso antero-a-posteriore.
- Iniettare due impulsi (69 nl per impulso) di 3 mg soluzione / ml dsRNA nel emolinfa, e controllare la distribuzione del colore in tutto il corpo. Se nessun colore è identificato, spostare la posizione dell'ago iniezione leggermente per eliminare la punta da ostruzione e ripetere la consegna del liquido.
- Usare il pennello bagnato per spostare delicatamente pupa dall'ago in acqua per la coltura. Tegli pupa dovrebbe attenersi al pennello al contatto della luce.
7. Condizioni post-iniezione
- Mettere capsula di Petri con pupe iniettato in una gabbia di zanzara con il flusso d'aria adeguato (per esempio, gabbia di rete o in un contenitore con coperchio mesh). condizioni di allevamento pupa devono rimanere costantemente a 27 ± 3 ° C di temperatura, 75 ± 5% di umidità e di essere sotto una luce: buio ciclo di 16: 8 ore.
- Preparare un 10% (w / v) di glucosio, e posizionare un batuffolo di cotone soluzione satura sulla gabbia zanzara mesh per l'alimentazione degli adulti.
8. Valutare Knockdown
- Al time-point (s) desiderata, valutare fenotipi in sperimentali insetti dsRNA-iniettati, rispetto ai controlli.
- Valutare dsSRPN2 e dsLacZ insetti al giorno da raffreddamento giù adulti per circa 2-3 minuti a -20 ° C, il conferimento ad un piatto freddo a 2 ° C e identificare ogni formazione pseudo-tumorale per l'utilizzo di un microscopio da dissezione a 15Xingrandimento con illuminazione campo chiaro. Dopo la valutazione, tornare gli adulti a condizioni insectary (27 ± 3 ° C, 75 ± 5% di umidità).
Nota: I dsRNAs sperimentali e di controllo utilizzati in questo protocollo sono dsSRPN2 e dsLacZ, rispettivamente. Ci sono molte opzioni adatte per i controlli; tuttavia, si suggerisce che un controllo positivo per cui fenotipo e / o l'espressione è facilmente visualizzate (per esempio, mediante dissezione microscopio) e / o quantificare [ad esempio, quantitativa real-time PCR (qRT-PCR), Western blot] deve essere usato quando l'apprendimento di questa tecnica. proteina SRPN2 e la trascrizione quantificazione tramite Western blot e qRT-PCR, rispettivamente, sono descritti in Michel et al. (2005) 21.
- Valutare dsSRPN2 e dsLacZ insetti al giorno da raffreddamento giù adulti per circa 2-3 minuti a -20 ° C, il conferimento ad un piatto freddo a 2 ° C e identificare ogni formazione pseudo-tumorale per l'utilizzo di un microscopio da dissezione a 15Xingrandimento con illuminazione campo chiaro. Dopo la valutazione, tornare gli adulti a condizioni insectary (27 ± 3 ° C, 75 ± 5% di umidità).
Risultati
Iniezione di pupa per i rendimenti gene KD risultati ottimali quando l'iniezione viene eseguita durante la fase iniziale di pupa, quando i livelli di abbronzatura cuticola sono bassi (Figura 1A, a sinistra, e 1B). Concia e indurimento della cuticola Maggiore, in genere dopo 24 ore, ad un aumento della morte di pupa dopo l'iniezione (figura 1A, al centro ea destra). Il tasso di sviluppo pupa può variare a seconda delle condizioni insectary e la densità degli animali 24,25; Pertanto, è meglio valutare la pigmentazione visivamente.
Durante il processo di iniezione, l'ago capillare viene inserito nella cuticola dorsali ad un angolo di circa 30 ° nella direzione anteriore a posteriore (Figura 2A). Una volta che l'ago è inserito e il dsRNA + 0,01% (w / v) FGD viene erogata, la distribuzione del colorante è evidente in tutta la emolinfa (Figure 2B).
Valutazione della comparsa adulta per pupe iniettato con 0,01% (w / v) FGD rivelato un tasso medio del 70% emergere, rispetto al 96,7% emergere di controlli non iniettati (Figura 3A). Di nota, emersione parziale dal bozzolo è stato osservato per un gran numero di zanzare non sopravvivendo (Figura 3B). Animali iniettati mostrano ritardi nel tempo emergere (Figura 4A) o di impatto di parte su entrambi i sessi (Figura 4B). Ulteriori valutazione della sopravvivenza degli adulti effettuata fino al giorno 10 post-emergenza rivela alcun impatto evidente sul post-emergenza di sopravvivenza degli adulti (Figura 4C).
Validazione di qualità KD è stata valutata dal melanotico pseudo-tumorale (gruppo tessuto scuro pigmentato) fenotipo associato con SRPN2 atterramento 21,22 come controllo positivo per atterramento e la assenza di fenotipi associati con iniezione dsLacZ come controllo negativo. zanzare adulte che sono emersi sono stati segnati al giorno 8 dopo l'iniezione (giorno 6-7 post-emergenza). Melanotic pseudo-tumori (Figura 5A e 5B) sono stati osservati attraverso la cuticola del 93,5% del dsSRPN2 vs. 0% delle zanzare dsLacZ adulti (Figura 6A). Grappoli di tessuto scuro melanized sono stati identificati sulla dissezione di patch pigmentate (Figura 5C). Pseudo-tumori erano visibili sulla cuticola adulti fin dal giorno 3 post-emergenza ed erano presenti in un sottogruppo di dsSRPN2 emolinfa e tessuti intestinali anche (dati non mostrati). A 5 post-iniezione (fase adulta precoce), è diminuito in modo significativo i livelli di SRPN2 in dsSRPN2, ma non è stata osservata dsLacZ o isolati proteici non-iniettati emolinfa (Figura 6B).
ftp_upload / 53738 / 53738fig1.jpg "/>
Figura 1: messa in scena dello sviluppo per l'iniezione di pupa dsRNA iniezione pupa precoce di dsRNA risultati in termini di sopravvivenza e la progressione ottimale in fase adulta.. Bassi livelli di cuticola pigmentazione (A, a sinistra, e B) possono essere osservati nel primo 0-24 ore dopo impupamento. Concia delle pupa cuticola precedente iniezione (A, al centro ea destra) risulta in moderata a scarsa sopravvivenza.
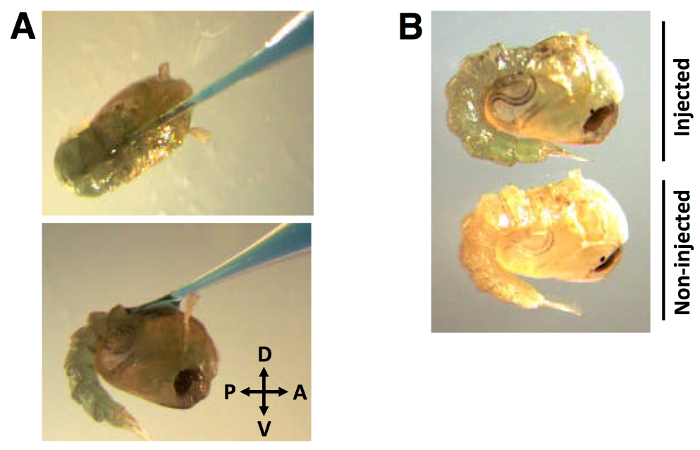
Figura 2:. Posizione iniezione e distribuzione di dsRNA (A) capillare ago per iniezione colorante-marcato di colorante marcato dsRNA nella cuticola dorsali ad un angolo di circa 30 °, in direzione antero-posteriore. (B) Il colorante è visibilmente distribuito nella emolinfa pupa. dsRNA volume di iniezione di 138 nl, etichettato con il 0,01% FGD (w / v).

Figura 3:. Post-iniezione adulto emergenza (A) 70% di pupe iniettato con 0,01% FGD (w / v) emerso successo (n = 60), rispetto al 96,7% dei controlli non iniettati (n = 60). sono stati eseguiti tre repliche biologiche. (B) emergere parziale dal bozzolo è stato osservato per un gran numero di zanzare non sopravvivere. Le barre di errore rappresentano l'errore standard della media (SEM).
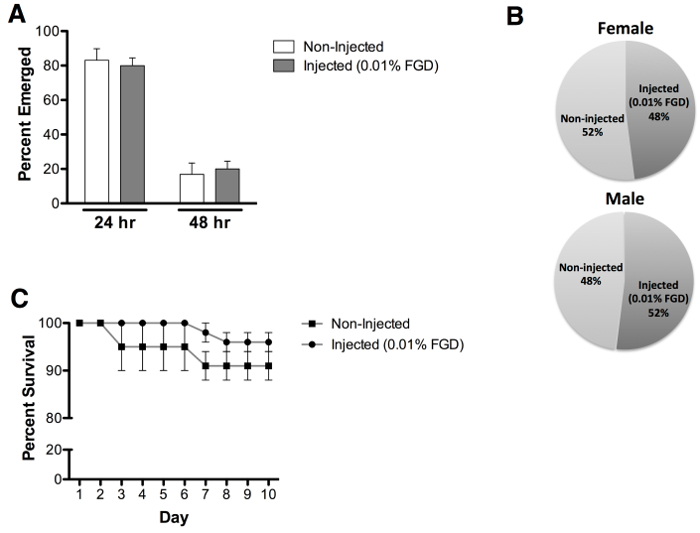
Figura 4: tasso Emersione, la valutazione del sesso e degli adulti di sopravvivenza (A) sono stati osservati volte emergenza comparabili in seguito ad iniezione di pupa con 0,01% FGD (24 ore = 80% e 48 hr = 20%), rispetto ai pupe non per iniezione (24. hr = 83% e 48 hr = 17%). (B ) Approssimativamente uguale maschio e femmina adulta nascita è stata osservata per il 0,01% FGD pupe iniettato (femmina = 48% e di sesso maschile = 52%) e pupe non per iniezione (femmina = 52% e di sesso maschile = 48%). Analisi (C) di sopravvivenza rivela che l'iniezione con il 0,01% FGD non influisce la sopravvivenza degli adulti, valutata fino a 10 giorni post-emergenza. I risultati rappresentano i dati da tre esperimenti indipendenti con lo 0,01% FGD iniettati (n = 60) e pupe non per iniezione (n = 60) (un numero uguale di maschi e femmine). Le barre di errore rappresentano l'errore standard della media (SEM).

Figura 5: Pseudo-tumore fenotipo controllo positivo riflette atterramento di successo sono stati osservati pseudo-tumori sul (A) addominale e (B) cuticola toracica di dsSRPN2 -injected, ma non dsLacZ zanzare adulte -injected al giorno 8 post-iniezione..(C) un ingrandimento superiore (400X) per immagini (a), della cuticola e la dissezione di patch pigmentate (b) rivela ammassi di cellule cupamente melanized.
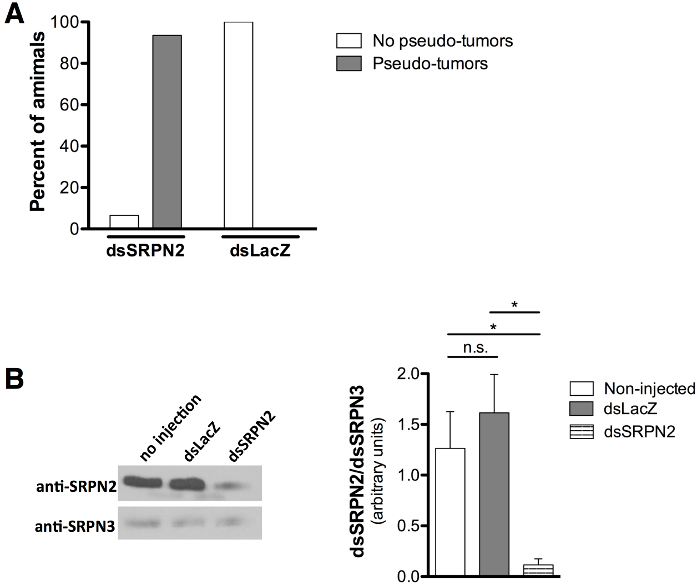
Figura 6: Quantificazione di formazione pseudo-tumorale e diminuzione dei livelli della proteina SRPN2 (A) iniezioni stadio di pupa provocano la formazione di pseudo-tumore nel 93,5% dei dsSRPN2 adulti (n = 21) rispetto allo 0% dei controlli dsLacZ (n = 19). . I risultati ottenuti giorno 8 post-iniezione. (B) Western Blot (a sinistra) mostra diminuito SRPN2 livelli in dsSRPN2, ma non dsLacZ o isolati non-iniettato proteine emolinfa (giorno 5 post-iniezione). I risultati in base a tre esperimenti indipendenti. Anti-SRPN2 21 e anti-SRPN3 diluizioni 26 anticorpi utilizzati sono stati 1: rispettivamente di 2.000,: 1.000 e 1. Capra anti-rabbit IgG-HRP (prodotto SC-2004 Santa Cruz Biotechnology, Dallas, TX) è stato utilizzato a 1: 5.000. Tutti i livelli della proteina sono stati quantificati (a destra) per intensità di banda (ImageJ Software, NIH, Bethesda, MD), normalizzato a SRPN3, e statisticamente rispetto con il test t spaiato. P <0.05: *, P ≥0.05: ns (non significativo). Le barre di errore rappresentano l'errore standard della media (SEM).
Discussione
Gli attuali metodi per indurre non transgenico RNAi in zanzare implicano l'iniezione diretta di dsRNA in hemocoel adulti 12,13 o larvale alimentazione di RNAi nanoparticelle rivestite di trigger 14-17 o microalghe a base di dsRNA molecole 18. Targeting la zanzara adulta, mentre estremamente prezioso, in grado di escludere un gran numero di geni che funzionano durante precedenti periodi di sviluppo. Knockdown avviato dal alimentazione larvale può produrre fenotipi incoerenti durante la fase adulta a causa, in parte, al potenziale di persistenza proteine variabile attraverso la fase di pupa. Pertanto, l'introduzione di un ulteriore metodo che si rivolge specificamente ad avviare RNAi durante lo sviluppo pupa fornirà un mezzo per valutare più a fondo le funzioni del gene durante la pre-adulti fasi di sviluppo, così come le capacità avanzate per valutare la funzione del gene durante le fasi di adulti. Come con silenziamento genico approccio basato sulla iniezione dsRNA o l'espressione, la persistenza di silenziamento geniconon può essere previsto. Pertanto, i livelli di trascrizione o di proteine dovrebbero essere valutati per gene di interesse durante i periodi di sviluppo di interesse. Anche se si osserva una continuazione della diminuzione dei livelli di proteine a giorno 5 post-iniezione per SRPN2 negli animali SRPN2 dsRNA-iniettati, fattori come il turnover proteico e l'emivita possono differire per target diversi. È fondamentale garantire, così, che il dsRNA da utilizzare per l'iniezione è ben concentrato e appare intatta su un gel di agarosio. Si consiglia di sperimentatori rivalutare questi fattori se i risultati atterramento non sono sufficienti, e aver bisogno di essere testati empiricamente per target specifici geni rispettive concentrazioni di dsRNA.
Noi descriviamo un metodo per l'apertura di RNA interferenza durante la fase di pupa di An. sviluppo gambiae. Questo metodo si basa sull'introduzione tramite microiniezione di dsRNA direttamente nel hemocoel di pupe precoce e consente di valutazione della qualità di iniezione da parte deluso di tinture marcato dsRNA. La possibilità di visualizzare qualità iniezione costituisce un miglioramento fondamentale per garantire knockdown successo e costituisce un aspetto di knockdown gene iniezione-based che non è stata considerata nella maggior precedentemente riportati protocolli dsRNA basati concentrandosi sul stadio adulto. Targeting la pupa all'insorgenza di questo periodo di sviluppo, geni che potrebbero svolgere un ruolo durante questo intervallo di sviluppo critica, o durante le prime fasi di adulta possono essere valutati funzionalmente. Inoltre, questo metodo può consentire la consegna dsRNA alle cellule, e la creazione di interferenze RNA nelle cellule che sono accessibili durante la metamorfosi, ma meno accessibile in zanzare adulte completamente formati.
Una recente analisi di microarray per Harker et al. (2012) ha identificato 560 An. trascrizioni gambiae che sono stati up-regolati o down-regolato da almeno 4 volte durante le fasi di sviluppo distinte, che vanno dall'embrione all'adulto. Del 560 trascrizioni identificato, una serie di 309 è stato up-regolati durante lo sviluppo pupa 27. Questi risultati suggeriscono che ci sono molte richieste per l'espressione genica differenziale in tutto lo sviluppo della zanzara, inclusi quelli che si verificano durante la fase di pupa, un intervallo durante il quale l'organismo subisce metamorfosi. In molte specie di insetti, tra cui An. gambiae, i geni coinvolti nei processi quali lo sviluppo (vale a dire, cuticolare pupa e proteine chitina-binding) 27-31 e immune risposta (cioè, Toll proteine recettori-like) 27,32-34 sono altamente espressi durante la fase di pupa. Una volta che un adulto completamente formato è emersa, non vi è proseguita l'espressione genica in risposta alle ambientale e fisiologico cambia 35. In particolare, durante il primo sviluppo adulto, vi è un aumento dell'espressione di geni dello sviluppo (cioè, cuticolare adulti e proteine sarcoplasmatico) 36, così come altri geni chiave (ossia , Lo sperma proteina specifica e citocromo P450 enzimi del metabolismo) 27,36.
Il controllo positivo utilizzata per lo sviluppo di questo protocollo, SRPN2, è un An. inibitore della serina proteasi gambiae (serpin). SRPN2 svolge un ruolo importante nella regolazione negativa di melanizzazione insetto, un ampio spettro innata risposta immunitaria negli insetti 21,22. Knockdown di SRPN2 in zanzare adulte risultati nella formazione pseudo-tumorale 21,22, un fenotipo che può essere facilmente osservata mediante l'uso di microscopia ottica. Dato che questo fenotipo distinto può essere facilmente segnato in insetti vivi, abbiamo usato SRPN2 per preparazioni iniettabili fase RNAi pupa iniziali. Inoltre, SRPN2 si esprime in tutte le fasi di sviluppo 37, fornendo in tal modo un buon obiettivo per la fase di pupa RNAi iniezione e valutazione della funzione agli inizi degli adulti. Abbiamo dimostrato che il metodo che abbiamo sviluppato è in grado di indurre simili adulti pseud melanotic formazione o-tumorale a seguito di iniezioni dsRNA eseguite durante la fase di pupa dello sviluppo. Nello sviluppo di questo protocollo, abbiamo osservato che l'iniezione durante le prime fasi di sviluppo pupa (vale a dire, il primo 24 ore dopo la muta larvale-pupa) è fondamentale per l'ottenimento di emergenza ottimale per adulti. Nel caso in cui poveri emergenza si ottiene dopo l'iniezione, si consiglia di mettere in scena le larve con maggiore precisione, per ottenere pupe con meno ampia indurimento cuticola e assicurare l'iniezione stadio di pupa precoce è raggiunto. Inoltre, riducendo al minimo i danni ai risultati della cuticola dei tassi di emergenza ottimali e aumentare l'ingrandimento durante l'iniezione può contribuire a garantire che solo la regione destinata dell'animale è forata. Se l'ago deve forare attraverso la cuticola ventrale pool di liquido colorante marcato sarà evidente sulla parte esterna della pupa o satura il filtro di carta. Si consiglia vivamente di scartare qualsiasi pupe che hanno più di una puntura cuticola.
jove_content "> Con le ampie esperienze di molti laboratori con le prestazioni di iniezioni di zanzare adulte, approcci microiniezione precedentemente identificati può essere adattato con semplici modifiche del protocollo per l'uso in esperimenti di RNAi pupa. Nel complesso, l'obiettivo di questo metodo è quello di fornire ai ricercatori la possibilità di ampliare il periodo di tempo durante il quale invertire analisi genetiche possono essere eseguite, consentendo ulteriori ricerche che supporterà lo sviluppo di nuove strategie di controllo vettoriale. è interessante notare che gli esperimenti in altre specie, come Rhodnius prolixus e Spodoptera frugiperda, rivelano che gene effetti silenziamento tendono ad essere molto maggiore quando avviato durante la pre-adulta stadi 38,39. durante tutte le fasi di sviluppo, gene RNAi mediata atterramento è soggetto a considerazioni riguardanti la rapidità e la persistenza di silenziamento genico, e la stabilità delle proteine codificate dai geni mirati. il target ideale RNAi geni tendono ad essere quelli che codificano un Protein o RNA che ha una breve emivita e alto tasso di turnover 11,40.Mentre strategie RNAi transgenici possono anche essere impiegati per affrontare considerazioni rapidità e persistenza RNAi durante le fasi di pre-adulti, tecniche transgeniche hanno molti inconvenienti (ad esempio, il tempo richiesto per la generazione di linee transgeniche, sperimentali tempi per accoppiamenti zanzara per generare insetti con l'espressione dsRNA regolamentato, e la manutenzione delle scorte transgenici). Al contrario, il nostro protocollo offre un metodo semplice e veloce per l'avvio di silenziamento genico durante lo sviluppo pupa e in tipi di cellule che hanno origine e sono accessibili durante la metamorfosi, ma sono meno accessibili negli adulti. L'uso di sospensioni dsRNA colorante marcato consente una facile valutazione del successo di iniezione e la dispersione di materiale introdotto all'interno di pupe. I nostri dati sulla comparsa di formazione di tumori negli adulti pupe a iniezione, rispetto agli animali iniettati da adulti, è coerente con initiation di atterramento RNAi-mediata durante la fase di pupa. Usando la nostra linea G3 zanzare e nelle nostre condizioni insectary, osserviamo l'adulto melanotico formazione pseudo-tumorale già 10 giorni dopo l'iniezione di adulti iniettato tre a cinque giorni post-emergenza. Eseguendo iniezione precoce pupa stadio, si osserva la formazione melanotic pseudo-tumore visibile fin da cinque giorni dopo l'iniezione (per esempio, tre o quattro giorni dopo l'emergenza). Questi dati implicano che questo metodo consente l'inizio di silenziamento genico nel corso di un periodo di sviluppo in precedenza sotto-studiato (per esempio, lo sviluppo di pupa). Il nostro metodo di etichettatura colorante può rivelarsi utile anche per lo sviluppo di nuovi protocolli di iniezione larvali, a causa della natura traslucida della cuticola durante tutte le età larvali. Mentre il controllo utilizzato in questo studio richiede progressione nella fase adulta per visualizzare un fenotipo atterramento, futuri esperimenti per valutare fenotipi specifici pupe stadio dopo l'iniezione di pupe presto forniràinformazioni preziose per quanto riguarda l'espansione di questo metodo in altri periodi di sviluppo, come lo sviluppo in ritardo pupa. In sintesi, questo metodo fornisce un valido protocollo RNAi per la fase di pupa inizio della knockdown gene RNAi-mediata ed espande gli strumenti di genomica funzionale disponibili per l'uso all'interno della comunità di ricerca insetto vettore.
Divulgazioni
Open Access per questo video-articolo è pagato da Biogen.
Riconoscimenti
We would like to thank Dr. Flaminia Catteruccia and her research group (Harvard School of Public Health, Boston, MA) for providing our laboratory with the G3 colony used in this research and for the LacZ template DNA. We thank Adam Jenkins (Boston College, Chestnut Hill, MA) for his assistance in maintaining the insectary. The Biology Department of Boston College generously funded the research associated with the development of this technique.
Materiali
| Name | Company | Catalog Number | Comments |
| MEGAscript RNAi kit | Ambion | AM1626 | |
| Nanoject II injector | Drummond | 3-000-204 | |
| Nanoject II foot switch | Drummond | 3-000-026 | |
| Borosilicate glass capillaries | Drummond | 3-000-203-G/X | |
| Glass micropipette puller | Narishigne | PB-7 | |
| Fast Green FCF dye | Sigma | F7258 | Can substitute with a non-toxic food dye. |
| Plastic transfer pipettes | Thermo Scientific | 1371150 | ¼ inch cut from tip to create a wider opening. |
| Whatman “thin” filter paper | GE Healthcare | 1001-090 | This is 9 cm diameter Grade 1, but can be altered depending on size of injection pad. |
| Western blot “thick” filter paper | BioRad | 107-3931 | This is the filter paper generally used for Western blots. |
| Petri dishes (60 mm x 15 mm) | Fisher Scientific | FB0875713A | |
| Paint brush (size 0) | Michael’s Art | 10474940 | Brush size and brand can vary based on availability and user preference. |
| Dissecting light microscope | ---- | ----- | This can vary based on availability and user preference. |
Riferimenti
- Kelly-Hope, L. A., McKenzie, F. E. The multiplicity of malaria transmission: a review of entomological inoculation rate measurements and methods across sub-Saharan Africa. Malar. J. 8 (1), 1-16 (2009).
- The malERA Consultative Group on Vector Control. A Research Agenda for Malaria Eradication: Vector Control. PLoS Med. 8 (1), e1000401 (2011).
- Enyati, A., Hemmingway, J. Malaria Management: Past, Present, and Future. Annu. Rev. of Entomol. 55 (1), 569-591 (2010).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genet. 10 (3), 1004236 (2014).
- Mitchell, S. N., et al. Metabolic and Target-Site Mechanisms Combine to Confer Strong DDT Resistance in Anopheles gambiae. PLoS ONE. 9 (3), e92662 (2014).
- Knox, T. B., et al. An online tool for mapping insecticide resistance in major Anopheles vectors of human malaria parasites and review of resistance status for the Afrotropical region. Parasite Vector. 7 (76), 1-14 (2014).
- Napoli, C., Lemieux, C., Jorgensen, R. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes. Plant Cell. 2, 279-289 (2002).
- Sen, G. L., Blau, H. M. A brief history of RNAi: the silence of the genes. FASEB J. 20 (9), 1293-1299 (2006).
- Romano, N., Macino, G. Quelling: transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences. Mol. Microbiol. 6 (22), 3343-3353 (1992).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Catteruccia, F., Levashina, E. A. RNAi in the Malaria Vector, Anopheles gambiae: Therapeutic Applications of RNAi: Methods and Protocols. Methods Mol. Biol. 555, 63-75 (2009).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A). gambiae). J. Vis. Exp. (5), e230 (2007).
- Mysore, K., Andrews, E., Li, P., Duman-Scheel, M. Chitosan/siRNA nanoparticle targeting demonstrates a requirement for single-minded during larval and pupal olfactory system development of the vector mosquito Aedes aegypti. BMC Dev. Biol. 14 (9), 1-16 (2014).
- Mysore, K., Flannery, E. M., Tomchaney, M., Severson, D. W., Duman-Scheel, M. Disruption of Aedes aegypti Olfactory System Development through Chitosan/siRNA Nanoparticle Targeting of semaphorin-1a. PLoS Negl. Trop. Dis. 7 (5), (2013).
- Zhang, X., Zhang, J., Zhu, K. Y. Chitosan/double-stranded RNA nanoparticle-mediated RNA interference to silence chitin synthase genes through larval feeding in the African malaria mosquito (Anopheles gambiae). Insect Mol. Biol. 19 (5), 683-693 (2010).
- Zhang, X., et al. Chitosan/Interfering RNA Nanoparticle Mediated Gene Silencing in Disease Vector Mosquito Larvae. J. Vis. Exp. (97), e52523 (2015).
- Kumar, A., Wang, S., Ou, R., Samrakandi, M., Beerntsen, B. T., Sayre, R. T. Development of an RNAi based microalgal larvicide to control mosquitoes. Malaria World J. 4 (6), 1-7 (2013).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: A review. J. Insect Physiol. 56 (3), 227-235 (2010).
- Burand, J. P., Hunter, W. B. RNAi: Future in insect management. J. Invertebr. Pathol. 112, S68-S74 (2013).
- Michel, K., Budd, A., Pinto, S., Gibson, T. J., Kafatos, F. C. Anopheles gambiae SRPN2 facilitates midgut invasion by the malaria parasite Plasmodium berghei. EMBO Rep. 6 (9), 891-897 (2005).
- An, C., Budd, A., Kanost, M. R., Michel, K. Characterization of a regulatory unit that controls melanization and affects longevity of mosquitoes. Cell Mol. Life Sci. 68 (11), 1929-1939 (2011).
- Horn, T., Boutros, M. E-RNAi: a web application for the multi-species design of RNAi reagents--2010 update. Nucleic Acids Res. 38, W332-W339 (2010).
- Benedict, M. Q. . Methods in Anopheles Research. , (2014).
- Lyimo, E. O., Takken, W., Koella, J. C. Effect of rearing temperature and larval density on larval survival, age at pupation and adult size of Anopheles gambiae. Entomol. Exp. Appl. 63, 265-271 (1992).
- Michel, K., et al. Increased melanizing activity in Anopheles gambiae does not affect development of Plasmodium falciparum. Proc. Natl. Acad. Sci. 103 (45), 16858-16863 (2006).
- Harker, B. W., et al. Transcription Profiling Associated With Life Cycle of Anopheles gambiae. J Med Entomol. 49 (2), 316-325 (2012).
- Dotson, E. M., Cornel, A. J., Willis, J. H., Collins, F. H. A family of pupal-specific cuticular protein genes in the mosquito Anopheles gambiae. Insect Biochem. Molec. Biol. 28, 459-472 (1998).
- Hopkins, T. L., Krchma, L. J., Ahmad, S. A., Kramer, K. J. Pupal cuticle proteins of Manduca sexta: characterization and profiles during sclerotization. Insect Biochem. Molec. Biol. 30, 19-27 (1999).
- Liang, J., Zhang, L., Xiang, Z., He, N. Expression profile of cuticular genes of silkworm, Bombyx mori. BMC Genomics. 11 (173), 1-13 (2010).
- Zhou, X., Riddiford, L. M. Broad specifies pupal development and mediates the "status quo" action of juvenile hormone on the pupal-adult transformation in Drosophila and Manduca. Development. 129, 2259-2269 (2002).
- Luna, C., Wang, X., Huang, Y., Zhang, J., Zheng, L. Characterization of four Toll related genes during development and immune responses in Anopheles gambiae. Insect Biochem. Molec. Biol. 32, 1171-1179 (2002).
- Tauszig, S., Jouanguy, E., Hoffmann, J. A., Imler, J. -. L. Toll-related receptors and the control of antimicrobial peptide expression in Drosophila. Proc. Natl. Acad. Sci. 97 (19), 10520-10525 (2000).
- Tryselius, Y., Samakovlis, C., Kimbrell, D. A., Hultmark, D. CecC, a cecropin gene expressed during metamorphosis in Drosophila pupae. Eur. J. Biochem. 204, 1-5 (1992).
- Goodisman, M. A. D., Isoe, J., Wheeler, D. E., Wells, M. A. Evolution of Insect Metamorphosis: a Microarray-Based Study of Larval and Adult Gene Expression in the Ant Camponotus Festinatus. Evolution. 59 (4), 858-870 (2005).
- Cook, P. E., Sinkins, S. P. Transcriptional profiling of Anopheles gambiae mosquitoes for adult age estimation. Insect Mol. Bio. 19 (6), 745-751 (2010).
- Suwanchaichinda, C., Kanost, M. R. The serpin gene family in Anopheles gambiae. Gene. 442 (1-2), 47-54 (2009).
- Araujo, R. N., et al. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug Rhodnius prolixus (Hemiptera: Reduviidae) by dsRNA ingestion or injection. Insect Biochem. Molec. Biol. 36 (9), 683-693 (2006).
- Griebler, M., Westerlund, S. A., Hoffmann, K. H., Meyering-Vos, M. RNA interference with the allatoregulating neuropeptide genes from the fall armyworm Spodoptera frugiperda and its effects on the JH titer in the hemolymph. J. Insect Physiol. 54 (6), 997-1007 (2008).
- Scott, J. G., et al. Towards the elements of successful insect RNAi. J. Insect Physiol. 59 (12), 1212-1221 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon