Method Article
Retroviral תמרה של Helper T תאים כגישה גנטית לחקר מנגנוני בקרת הבידול והתפקוד שלהם
In This Article
Summary
מערכות ניסיוניות רבות כבר נוצלו כדי להבין את המנגנונים המסדירים פיתוח תאי T ולתפקד תגובה חיסונית. הנה גישה גנטית באמצעות תמרת retroviral מתוארת, אשר היא כלכלי, זמן יעיל, והכי חשוב, מאוד אינפורמטיבי בזיהוי מסלולים רגולטוריים.
Abstract
Helper T cell development and function must be tightly regulated to induce an appropriate immune response that eliminates specific pathogens yet prevents autoimmunity. Many approaches involving different model organisms have been utilized to understand the mechanisms controlling helper T cell development and function. However, studies using mouse models have proven to be highly informative due to the availability of genetic, cellular, and biochemical systems. One genetic approach in mice used by many labs involves retroviral transduction of primary helper T cells. This is a powerful approach due to its relative ease, making it accessible to almost any laboratory with basic skills in molecular biology and immunology. Therefore, multiple genes in wild type or mutant forms can readily be tested for function in helper T cells to understand their importance and mechanisms of action. We have optimized this approach and describe here the protocols for production of high titer retroviruses, isolation of primary murine helper T cells, and their transduction by retroviruses and differentiation toward the different helper subsets. Finally, the use of this approach is described in uncovering mechanisms utilized by microRNAs (miRNAs) to regulate pathways controlling helper T cell development and function.
Introduction
The immune response must be highly regulated to eliminate infections but prevent attacks on self-tissue that lead to autoimmunity. Helper T cells play an essential role in regulating the immune response, and a great deal of effort has been undertaken to understand their development and function (illustrated in several recent reviews 1-3). However, many questions remain, and many approaches have been utilized to study the mechanisms controlling helper T cell development and function. These have ranged from the use of in vitro cell culture systems to whole animals. Cell culture systems, especially those using cell lines, offer the benefit of ease of use and the ability to generate large amount of material to do sophisticated biochemical analyses. However, they suffer from their limited ability to reproduce the actual conditions occurring in an immune response. In contrast, whole animal experiments offer the benefit of relevance, but they can suffer from difficulties in manipulation and the ability to perform precise controls in addition to their large costs and ethical implications. Nevertheless, the vast majority of helper T cells studies today still require the use of whole animal experiments involving primary T cells because of the inability of cell lines to duplicate the exact steps occurring in the whole animal. Therefore, it is essential to utilize cost effective approaches that are highly informative.
Genetics is one powerful tool to study helper T cell development and function, yet traditional methods involving gene knockouts or transgenes are time consuming and expensive so they are often out of reach of small labs. However, retroviral transduction offers a powerful, rapid and, cost effective genetic approach to study the mechanisms of specific gene products. Therefore, it is commonly used in papers studying helper T cell development and function.
We have optimized a procedure for retroviral transduction of helper T cells. It utilizes the pMIG (Murine stem cell virus-Internal ribosomal entry site-Green fluorescent protein) retroviral expression vector, in which the gene of interest can be cloned and thereby expressed from the retrovirus long terminal repeat (LTR) 4. In addition, downstream of the inserted gene of interest is an internal ribosome entry sequence (IRES) followed by the green fluorescent protein (GFP) gene so transduced cells can easily be followed by their expression of GFP. The vector was originally derived from the Murine Stem Cell Virus (MSCV) vectors, which contain mutations in repressor binding sites in the LTRs making them resistant to silencing and thus, giving high expression in many cell types including helper T cells 5,6. Production of high titer retrovirus requires a simple transient transfection protocol of human embryonic kidney (HEK) 293T cells with the MIG vector and a helper virus vector that expresses the retroviral GAG, Pol, and Env genes. For this the pCL-Eco helper virus vector 7 works well in producing high titer replication incompetent retroviruses.
Here these protocols for retroviral production and transduction of primary murine T cells are described in addition to some of our results using this approach to study miRNA regulation of gene expression controlling helper T cell differentiation. miRNAs are small RNAs of approximately 22 nucleotides in length that post-transcriptionally regulate gene expression by targeting homologous sequences in protein encoding messenger RNAs and suppressing translation and inducing message instability 8,9. miRNAs play critical roles in developmental gene regulation. They are essential in the earliest stages of development, as embryos that cannot produce miRNAs die at a very early stage 10. In addition miRNAs are important later on in the development of many tissues. They are thought to function by fine-tuning the expression of genes required for developmental programs 1. In helper T cells miRNAs play multiple roles and are required for regulatory T cell (Treg) development 11-14. We used retroviral transduction as a means to dissect the mechanisms of miRNA regulation of Treg differentiation 15. Through such studies important individual miRNAs were determined by retroviral-mediated overexpression. Subsequently, relevant genes regulated by these miRNAs were identified in order to understand the molecular pathways regulated by miRNAs in helper T cell differentiation.
Protocol
כל עבודת העכבר שבוצעה הפרוטוקולים הללו התבצעה על פי ההליכים המדעיים בעלי חי החוק, בריטניה תחת רישיון פרויקט חית 70/6965.
1. ייצור retroviral
לפני הליך קבלת כל האישורים הנדרשים להפקת אורגניזמים מהונדסים גנטית והשימוש רטרווירוסים בתאי יונקים.
- צמיחה של תאי 293T HEK
- לגדל תאים 293T HEK על מנות בתרבית רקמה 10 ס"מ במדיום HEK 293T (השתנה בינוני של הנשר של Dulbecco (DMEM) עם בסרום שור עוברית 10% (FBS), 100 יחידות / מ"ל פניצילין 0.1 מ"ג / מ"ל סטרפטומיצין, ו -2 מ"מ L- גלוטמין) . למעבר תא כללי, פיצול תאים 1:10 כשהם מגיעים למפגש ידי הסרה בינונית pipetting תאי מצלחת עם מדיום HEK 293T טרי.
הערה: תאים צריכים להגיע למפגש ב 2-3 ימים. 293T HEK תאים לצרף רופף לצלחת כך trypsinization אינה נדרשת. - 24 שעות לפני transfection, לפצל conflueצלחת של תאים NT 01:10 לצלחת 10 ס"מ (צלחת אחת לכל transfection) כך למחרת התאים ~ 50% ומחוברות.
- לגדל תאים 293T HEK על מנות בתרבית רקמה 10 ס"מ במדיום HEK 293T (השתנה בינוני של הנשר של Dulbecco (DMEM) עם בסרום שור עוברית 10% (FBS), 100 יחידות / מ"ל פניצילין 0.1 מ"ג / מ"ל סטרפטומיצין, ו -2 מ"מ L- גלוטמין) . למעבר תא כללי, פיצול תאים 1:10 כשהם מגיעים למפגש ידי הסרה בינונית pipetting תאי מצלחת עם מדיום HEK 293T טרי.
- Transfection ידי משקעי סידן פוספט
- כ 1 שעה לפני transfection, להסיר בינוני מתאי ובזהירות להוסיף 9 מ"ל של מדיום HEK 293T טריים כדי למנוע מתאי ניתוק מן הצלחת.
- הכן 2x Hepes בופר (2x HBS) וכן 2.5 טריים פתרון M CaCl 2 כמתואר בטבלה 1. ההפשרה מניות DNA. עבור transfections היעילה ביותר להשתמש DNA באיכות הכנה פלסמיד.
- בשנת תחתית 6 מ"ל עגול או 15 מ"ל צינור חרוטי להוסיף 5 מיקרוגרם של ה- DNA retroviral (pMIG) 4, 5 מיקרוגרם של ה- DNA וירוס עוזר (PCL-Eco) 7, ו- H 2 O ל 420 μl. הוסף 80 μl של 2.5 M CaCl 2 מביא את הנפח הסופי 500 μl.
הערה: זה יחד עם השלב הבא (תוספת של 2x HBS) יכול להיעשות על ספסל קבוע כל עוד ster הכלליטכניקת Ile משמשת. - לאט לאט להוסיף 500 μl של ירידה 2x HBS אחר טיפה לתערובת DNA לעיל, תוך vortexing בעדינות כך שהפתרון הוא מעורב באופן רציף ואת קאפו 4 משקעים בגבישים אפילו בגודל.
- העבר כדי ברדס בתרבית רקמה ולאט לאט מוסיפים את תערובת DNA 4 קאפו (1 מ"ל) dropwise אל 9 מ"ל של מדיום מכסה את התאים בעוד כל הזמן בעדינות מתערבל את הצלחת. שוב להיזהר שלא לנתק תאים מהצלחת. מניחים את התאים בחזרה לתוך החממה.
הערה: בשלב זה המשקע Capo 4 יהיה גלוי בקלות תחת מיקרוסקופ כמו גבישים קטנים בערך בגודל של חיידקים. אלה נתפסים בקלות לאחר 30-60 דקות כאשר היו הגבישים הזדמנות ליישב לתחתית של הצלחת.
- אוסף של וירוס בתרבות Supernatants.
- למחרת (בכל מקום בין 12-24 שעות לאחר transfection) להסיר את המדיום ולהאכיל את התאים עם 10 מ"לשל המדיום HEK 293T טרי שוב נזהר שלא לעקור את התאים מן הצלחת.
הערה: זה מדלל את חומרים מעכבים הלימפוציטים שתאי HEK 293T מפרישים לתוך המדיום במהלך transfection. - בערב של היום השני (~ 24 transfection שעות שלאחר) להאכיל תאים עם 3.5 מ"ל של מדיום 293T HEK טריים. היזהר כי המשטח מונח ברמה בדיוק בחממה כך שצד אחד לא נשאר יבש.
- אסוף בינוני ~ 12 שעות לאחר מכן (חנות ב 4 ° C) ולהאכיל עם 3.5 מ"ל של מדיום 293T HEK טריים. אוסף חזור פי 2 בערך 12 מרווחי hr כך שכ -10 מ"ל של מדיום נאסף. זהו מניות הווירוס.
- ספין החוצה את כל התאים שיורית HEK 293T ופסולת הסלולר על ידי צנטריפוגה ב 600 XG במשך 5 דקות. לחלופין, לסנן באמצעות מסנן 0.45 מיקרומטר, נמוך חלבון מחייב, מזרק. וירוס החנות ב 4 מעלות צלזיוס, ועל טיטר הטוב ביותר, משתמש בתוך יום או ימים, כמו כייל יפחת לאט ב 4 ° C.. אל freeze, כמו זה מקטין באופן משמעותי את כייל.
- למחרת (בכל מקום בין 12-24 שעות לאחר transfection) להסיר את המדיום ולהאכיל את התאים עם 10 מ"לשל המדיום HEK 293T טרי שוב נזהר שלא לעקור את התאים מן הצלחת.
בידוד 2. הנאיבי הראשי CD4 + T תאים
- בידוד של תאים ליקוציט
- להרדים עכברים על ידי נקע בצוואר רחם, מחנק 2 CO, או פרוטוקול אנושי אחר מתאים לכללי הטיפול בבעלי החיים של המוסד.
- לנתח טרי עכברים מורדמים ולהסיר טחול והלימפה הרצוי צומת 15. מניחים את האיברים בבארות של צלחת בתרבית רקמה 6 היטב המכיל בינוני R10 (בינוני RPMI עם 10% חום מומת FBS, 100 יחידות / מ"ל פניצילין, 0.1 מ"ג / מ"ל סטרפטומיצין, 2 מ"מ L- גלוטמין, ו -0.1% β-mercaptoethanol) . השתמש מכסה מנוע תרבית תאים לנתיחה של עכברים וכל המניפולציות לאחר למזער סיכוי הזיהום בתרבויות.
הערה: שמור את המדיום R10 קר ולבצע את כל השלבים לטיהור במורד הזרם על 4 מעלות צלזיוס. - מניחים מסננת תרבית תאים 70 מיקרומטר לתוך 50 מ"ל צינור חרוטי המכיל כ 5 מ"ל של מדיום R10. השתמש מסננת אחד הצמתים הטחול הלימפה של עד שלושה עכברים.
- להוסיף צומת טחול הלימפה אל מסננת התא מרוכך בעזרת הקצה של בוכנת מזרק 5 מיליליטר. לשטוף עם 1-2 מ"ל של מדיום R10.
- עבר תאים לצינור 15 מיליליטר חרוטים ולהביא את הנפח עד 14 מיליליטר עם R10. צנטריפוגה ב 600 XG במשך 5 דקות ב 4 ° C.. בטל supernatant ידי שפיכת אותו ובתנועה אחת ונקי כדי למנוע להפריע גלולה התא.
- הוסף 2 מ"ל של קר (4 ° C) חיץ אדום תא תמוגה (טבלה 1) על צינור אחד. לערבב בעדינות על 3.5 דקות, תוך שמירה על הצינור על קרח.
הערה: התזמון של תמוגה תא האדומה הוא קריטי כדי למנוע מוות של לימפוציטים. לכן, את העיתוי המדויק של כל אצווה של חיץ תמוגה התא האדום יהיה צריך להיות מותאם. - להוסיף ≈12-13 מ"ל של מדיום R10. מיד צנטריפוגות וזורקים supernatant כמו בשלב 2.1.5. בצע את השלבים כביסה 2x שנינות יותרh R10 בינוני כדי להסיר כל חיץ תא תמוגה אדום שיורית מן התאים למנוע מוות של לימפוציטים.
- ספירת תאים בתוך hemocytometer דילול 1:20 ב trypan הכחול כדי לקבוע את התשואה של תאי קיימא. צפו כ 8-10 x 10 7 תאים לכל עכבר.
- בידוד של תאים מסוג CD4 + T באמצעות מגנטי חרוזים מקיט הסר CD8 +, CD11b +, CD16 / 32 +, הנוגדן CD45R +, בכיתה MHC II + ו- Ter-119 + תאים.
- Aliquot 8-10 x 10 7 תאים משלב 2.1.8 לכל 15 מ"ל צינור צנטריפוגות חרוטי ב 600 XG במשך 5 דקות ב 4 ° C. יוצק את supernatant עם תנועה חלקה יחיד כדי למנוע להפריע גלולת התא. Resuspend התאים בצינור אחד ב 100 μl של חום מומת FBS מכן להוסיף 100 μl של תערובת נוגדנים מתוך הערכה. דגירה במשך 30 דקות ב 4 ° C עם ערבוב עדין על מכבש.
- בעוד התאים הנ"ל דוגרים, להכין את החרוזים.
- חרוזים Resuspend הבקבוקון ידי vortexing עבור> 30 שניות ולאחר מכן להעביר 1 מ"ל של חרוזים לכל 8-10 x 10 7 תאים מוכנים צינור חרוטי 15 מ"ל. הוסף 2 מ"ל של מדיום R10 לכל מ"ל של חרוזים ומערבבים בעדינות.
- מניחים את הצינורית מגנט דקות 1 ואז להשליך את supernatant. הסר צינור מן החרוזים מגנט ו resuspend ב 4 מ"ל של מדיום R10. סכום של חרוזים זה מספיק בשני סבבים של דגירה.
- שוטפים את התאים בסוף הדגירה נוגדן (שלב 2.2.1) על ידי הוספת 10 מ"ל של מדיום R10 לכל צינור. בעדינות מערבבת היטב עם מתערבל של תאי צינור צנטריפוגות ב 600 XG במשך 5 דקות ב 4 ° C. יוצק את supernatant עם תנועה חלקה יחיד כדי למנוע להפריע גלולת התא. תאים Resuspend ב 1 מ"ל של מדיום R10.
- הוסף 2 מ"ל של חרוזים שטף משלב 2.2.2.2 (½ בסך מוכן לכל צינור) על צינור אחד של תאים שטופלו נוגדן דגירה במשך 30 דקות ב 4 ° C עם ערבוב עדין על roller.
- Resuspend את התערובת חרוז התא על ידי פעמים pipetting 5 בעדינות עם pipet המכיל פתיחת קצה צר. למנוע הקצפה. מניחים את הצינורית מגנט חרוזים למשך 2 דקות ולאחר מכן להעביר את supernatant המכיל את התאים שנבחרו באופן שלילי צינור חדש. שמור את התאים הללו, כפי שהם האוכלוסייה CD4 +.
- חזור על סלקציה שלילית עוד פעם אחת. ספין התאים משלב 2.2.5 ב 600 XG במשך 5 דקות ב 4 ° C.. יוצקים את supernatant כמו בשלב 2.2.3 ו resuspend ב 1 מ"ל של מדיום R10. בצע את שלבי 2.2.4 ו 2.2.5 שוב. לאחר הבחירה החרוזה מגנטי הסופי, לספור את התאים כדי לקבוע אם תחלים (תשואות טיפוסיות הן 15-20 x 10 6 תאים לכל 10 8 לויקוציטים).
- בידוד של תאים הנאיביים CD4 + T (CD25 - ו CD62L גבוה) באמצעות עמודות הפרדה ניידת
- צנטריפוגה CD4 + T תאים ב 600 XG במשך 5 דקות ב 4 ° C ו resuspend ב 150-200 μl שלבינוני R10 לכל 10 8 תאים. הוסף 2 μl של נוגדנים חד שבטיים CD25 biotinylated המניות (שיבוט 7D4). דגירה במשך 30 דקות ב 4 ° C עם ערבוב עדין על מכבש.
- שטפו תאים על ידי הוספת 10 מ"ל של חיץ טור הפרדה תא (טבלה 1). צנטריפוגה ב 600 XG במשך 5 דקות ב 4 ° C.. להסיר כמה שיותר supernatant ככל האפשר לאמוד את היקף חיץ / התאים הנותרים. Resuspend לנפח סופי של כ 90 μl לכל 10 7 תאים.
- הוסף 20 μl של חרוזים streptavidin לכל 10 7 תאים ומערבבים עם תנועות עדינות. דגירה במשך 15 דקות ב 4 ° C..
- בעוד תאים הם דוגרים, להכין את הפרדת תא הבינונית (MS) עמודות עבור הגישה הידנית. כל עמודת MS שומרת 10 7 תאים, ומאז CD25 + תאים בדרך כלל מייצגים כ -10% CD4 + תאים כוללים, משתמש 1 עמודה לכל 10 8 תאים מסוג CD4 + T. הוסף 500 μl של חיץ טור הפרדה תא לעמודהולתת לזרום. חזור על 2 יותר פעמים.
- בסוף דגירת תא / חרוז, לשטוף תאים על ידי הוספת 10 מיליליטר של חיץ טור הפרדת תא צנטריפוגה ב 600 XG במשך 5 דקות ב 4 ° C. Resuspend התאים 500 μl של חיץ טור הפרדה תא לכל 10 8 תאים, אבל עדיין משתמשים 500 μl אם יש פחות תאים.
- החל 500 μl של השעית תא / חרוז לעמודה ולאסוף את הזרימה דרך. תעביר את זה לאורך זמן 1 העמודה יותר לאסוף את הזרימה דרך שוב. יש לשטוף את העמודה 3 פעמים עם 500 μl של חיץ טור ההפרדה התא, הוספת כל לזרום מן שטיפות אלה אל התאים שנאספו. אלו הם CD25 - תאים. ספירת תאים כדי לקבוע תשואה.
- אם Tregs (CD25 + תאים) הוא רצויים, לבודד כדלקמן.
- הסר את העמודה מפריד והחזק אותו מעל בלטפל צינור אוניברסלי פתוח לשמור על סטריליות. פיפטה במהירות 500 μl של חיץ הפרדת תא על colטור ה ו לרוקן את השבר החיובי בחוזקה, באמצעות הבוכנה מסופקת עם הטור.
- חזור על הליך השטיפה 2 פעמים יותר. לעבור את החלק יחסי החיובי על טור פרדה טרי תא MS וזורק זרימת דרך זו. בתוקף לשטוף את התאים חיובית שלוש פעמים, כמו תאים לפני צנטריפוגות ב 600 XG במשך 5 דקות ב 4 ° C. תאים Resuspend ב 1 מ"ל של מדיום R10 ולספור לקבוע את התשואה.
- כדי להשיג CD25 - תאים גבוהה T CD62L, צנטריפוגה CD25 - תאי T מבודד למעלה בשלב 2.3.6 ב 600 XG במשך 5 דקות ב 4 ° ו resuspend ב 150-200 μl של המדיום R10 לכל 10 7 תאים. הוסף 5 μl של נוגדנים חד שבטיים המניות biotinylated CD62L (שיבוט MEL-14) ו דגירה של 30 דקות ב 4 ° C עם ערבוב עדין על מכבש כמו קודם.
- בצע לשטוף, streptavidin חרוז מחייב, והכנת טור הפרדה תא כמתואר עבור פרוטוקול בידוד Treg (2.3.7). שימוש הפעםטור הפרדת תאים גדולים (LS), אשר בעל קיבולת של 10 8 תאים.
- מאחר ותאי T הגבוה CD62L בדרך כלל מייצגים כ 60-70% של CD25 - תאים, השתמש בעמודת הפרדת תא 1 LS לכל 10 8 תאים. מוסיף את תערובת תא / חרוז לעמודת הפרדת תא LS כמתואר בשלב 2.3.6 - פעם שלכת זרימת הסופיות עד וכולל ועמודת שטיפות. אוספים את התאים גבוהה T CD62L כמתואר בשלב 2.3.7 לאיסוף תאי CD25 +.
- תאים צנטריפוגה ב 600 XG במשך 5 דקות ב 4 ° C. תאים Resuspend ב 1 מ"ל של R10 ולספור לקבוע תשואה. לדלל את 0.75-1 X10 6 תאים לכל מ"ל במדיום R10.
- לנתח טוהר של תאים על ידי מיון התא פלורסנט המופעל (FACS).
- אסטרטגיה מכתימה FACS
- עבור תאים לפני ואחרי כל שלבי בידוד, כתם עם CD4-FITC, CD8a-PerCP-Cy5.5 (עוזר ותאי T ציטוטוקסיים), ו MHCII-PE (כיתת MHC II תאי מבטאים).
- עבור תאים לפני ואחרי בידוד CD25, כתם עם CD4-FITC ו CD25-PE (Tregs לעומת תאי T מסייעים אחרים).
- עבור תאים לפני ואחרי CD62L כתם בידוד עם CD4-FITC, CD62L-PE ו CD44-APC (נאיבי לעומת תאי T מסייעים זיכרון מפעיל).
- לכל מקום לניתוח 10 5 תאים בתוך באר של 96 גם צלחת U-תחתונה. צנטריפוגה ב 600 XG במשך 5 דקות ב 4 ° C.. יוצקים את בינוני לשטוף את התאים פעם עם 200 DPBS μl. צנטריפוגה כנ"ל ויוצקים מעל DPBS.
- הוסף 50 μl של DPBS לכל היטב 0.5 μl של כל נוגדן (כמצוין 2.4.1) ו לדגור על RT במשך 30 דקות בחושך כדי למנוע הלבנת של תווית ניאון.
- לשטוף את התאים 2X עם DPBS כמו 2.4.2 ומיד לנתח על cytometer זרימה באמצעות פרוטוקולים והנחיות ספציפיות המכשיר בהישג יד.
הערה: לאחר שלב בידודו הסופי של הכנה טובה, 90-95% של תא יהיולהיות CD4 + CD25 - תאים גבוהה T CD62L.
- אסטרטגיה מכתימה FACS
3. retroviral תמרה של תאים הופעלו CD4 + T ו הבידול שלהם לתוך קבוצות משנת Helper T ספציפיות
- retroviral התמרה
הערה: שילוב retroviral וביטוי גנים דורש חלוקת התא. לכן, תאי T חייבים להיות מופעלים O / N.- בעוד לבודד את תאי ה- T נאיבי, מעיל צלחת בתרבית רקמה 24 גם עם אנטי CD3 ונוגדנים אנטי CD28 מדולל DPBS. הוסף 250 μl לכל טוב. השתמש אנטי CD3 אנטי ב 1μg / מ"ל. השתמש-CD28 אנטי בבית מ"ל 2 מיקרוגרם / אם התאים בסופו של דבר להיות מובחן תחת Th0, Th1, תנאים Th2 ו iTregs. השתמש-CD28 אנטי ב 10 מיקרוגרם / מיליליטר תנאי Th9 ו TH17. דגירה ~ שעה 2 ב 37 מעלות צלזיוס חממה בתרבית רקמה.
- זמן קצר לפני culturing התאים, להסיר את פתרון הנוגדן ולשטוף את הצלחת עם ~ 250 μl של DPBS לכל טוב להסיר unbound נוגדן. תיזהר לא לתת את הצלחת להתייבש כך לעבד מקסימום של 6 בארות בכל פעם. הסר DPBS לשטוף ולהוסיף 1 מ"ל של תאי CD4 + T נאיבי במדיום R10 ב 0.75-1 x 10 6 תאים לכל מיליליטר. הפעל תאים O / N (14-16 שעות).
- למחרת, תאים צנטריפוגות בצלחת ב 900 XG במשך 5 דקות ב 30 מעלות צלזיוס לצרף תאים בתחתית הבארות.
- לאסוף ולשמור את המדיום נזהרים שלא לעקור את התאים, ולהחליף עם supernatant התרבות הנגיף 1 מ"ל מוכן מן הפרוטוקול ייצור וירוס. אל תתנו התאים להתייבש כך לעבד למקסימום של 4 בארות בכל פעם.
- זה טוב להוסיף 1 μl של 8 מ"ג / מ"ל polybrene ו -10 μl של 1M HEPES pH 7.5 כדי לסייע ספיגת וירוס ולמנוע alkalization משמעותית CO הסביבה 2 במהלך צנטריפוגה הבאה. צנטריפוגה תאים בצלחת ב 900 XG במשך 90 דקות ב 30 ° C.
- התמיינות של תאים לתוך SPECIקבוצות משנה FIC
- מוציאים בזהירות את supernatant התרבות הנגיף ולהחליף עם 1 מ"ל של המדיום שנאספו למעלה בשלב 3.1.4, מכיוון שהיא מכילה IL-2 ו גורמי גדילה של תאי T אחרים. הוספת ריאגנטים מצוין תאי טבלה 2 והתרבות במשך 3-4 ימים כדי לבדל את התאים לתוך תת-מערכות ספציפיות.
- ניתוח של תאים
- עבור מכתים תאיים של ציטוקינים, לטפל בתאים עם 1 מיקרוגרם / מ"ל כל אחד phorbol 12-myristate 13-אצטט (PMA) ו ionomycin במשך 4 שעות. במהלך 2 שעות של גירוי האחרון, להוסיף 1 מיקרוגרם / מ"ל של brefeldin א
- תאי Resuspend מהתחתיים כל היטב על ידי pipetting מעלה ומטה מספר פעמים. העבר כ 10 5 תאים לצלחת 96 באר U התחתונה (בדרך כלל 100 μl מן 1 מ"ל של התרבות של תאים Th) עבור קיבעון מכתים.
- עבור מכתים GFP, לתקן תאים עם 100 μl של paraformaldehyde 2% ב RT במשך בדיוק 5 דקות, כתקופת דגירה כבר יהיה להלבין א GFPnd להפריע מכתים Foxp3. שטפו תאים על ידי הוספת 100 μl של DPBS זה היטב צנטריפוגות ב 600 XG ב 22 מעלות צלזיוס למשך 5 דקות. יוצקים את supernatant.
זהירות: Paraformaldehyde רעיל. טפל בו במנדף עם עור ומשקפי מגן. - תקן את התאים שוב באמצעות 100 μl חיץ 1x קיבוע עשוי ערכת מכתים Foxp3 (1 נפח של קיבוע חיץ 3 כרכים של diluent). דגירת התאים במשך 45 דקות ב RT או לחלופין דגירה על 4 מעלות צלזיוס למשך 16 שעות.
- לאחר קיבוע, permeabilize התאים על ידי הוספת 100 μl של חיץ permeabilization מאותה הערכה. לדגור על RT במשך 30-45 דקות ולאחר מכן צנטריפוגות ב 600 XG ב 22 מעלות צלזיוס למשך 5 דקות.
- עבור מכתים נוגדן, להסיר חיץ קיבעון / permeabilization ולהוסיף 50 μl של חיץ permeabilization הטרי. מוסיפים את הנוגדן נדרש מדולל במאגר permeabilization ב 0.5 μl לכל 50 חיץ μl לדגימה. דגירה של 30-45 דקות ב RT בחושך כדי למנוע הלבנה של שפעתתווית orescent.
- להוסיף 150 μl permeabilization חיץ צנטריפוגות ב 600 XG ב 22 מעלות צלזיוס למשך 5 דקות. מחק את חיץ permeabilization ולהוסיף 200 DPBS μl. לנתח על cytometer זרימה באמצעות פרוטוקולים והנחיות ספציפיות המכשיר בהישג יד.
הערה: הקפד לכלול בקרות נאותות עבור מכתים ציטוקינים כגון צביעה עם נוגדנים לשלוט אלוטיפ, ניתוח שאינו מופעל או Th0 תאים מופעל, וכו '
תוצאות
ההצלחה של מערכת ניסיונית זו דורשת אוכלוסיות טהורות מאוד של תאי T והכנות רטרו-וירוס כייל גבוה. תוצאות נציג מוצגים כאן כדוגמאות ניסויים מוצלחים. איור 1 מציג את טוהר טיפוסי של אוכלוסיות טרום שנבחרו פוסט בכל שלב של פרוטוקול בידוד T מסייעים התא נאיבי. איור 2 ו -3 להמחיש את ניתוח הייצור רטרו-וירוס דרך ביטוי של GFP בתאי HEK 293T טרנספקציה (איור 2) ותאי T transduced (איור 3). יעילות transfection של תאי 293T HEK יכולה להשתנות באופן משמעותי עם בונת retroviral שונה, אבל זה בדרך כלל לא תואם את רמת ייצור רטרו-וירוס ציין עם מספר תאי GFP + T. כמו כן, את מספר התאים GFP + T יכול להשתנות בהתאם לתנאי הקיטוב. יתר על כן, מ 'רמת ביטוי EAN של GFP ואת הגן המוכנס יכול להשתנות בהתאם למספר עותקי וירוס המשולב, ההשפעה של אתר האינטגרציה על שעתוק, ועל מנגנוני ויסות שלאחר תעתיק המשפיעים על תמליל ויראלי.
לבסוף, איור 4 מראה כמה תוצאות טיפוסיות שראינו עם התמיינות תאי T מסייע כאשר miRNAs miR-15b / 16 הם ביטוי יתר. תוצאות אלו מראות כמה השתנות שיכולים להתרחש בתוך ניסוי פרט כך השפעות אמיתיות חייבות להיות תימוכי ניתוח סטטיסטי של ניסויים חוזרים מרובים באמצעות תכשירים שונים של תאי T מסייע. בניסויים אלו התגובות Th2 יכול להיות קשה להבחין בקו C57BL / 6 משמש כאן משום שהם נוטים לתגובות Th1. כמו כן, IL-9 מכתים יכול להיות קשה לזהות מעל הרקע. לכן, קיים הכרח לעשות שולטת אלוטיפ ולהקים פיצוי הולם על מנת להבטיח ga הנכוןטינג ביטוי ציטוקינים. בתוצאות שלנו מצאנו כי miR-15b / 16 משפר אינדוקציה iTreg ידי עיכוב mTOR במסלול איתות באמצעות דיכוי הביטוי של Rictor רכיבים mTOR 15. miR-15b / 16 לפעמים יכול להשפיע Th0, Th1, והבחנת TH17 בניסויים בודדים, אך אין השפעה משמעותית כאשר בוחנים ניסויים חוזרים מרובים. בניגוד miR-15b / 16 ביטוי יתר עושה באופן משמעותי לדכא בידול Th9 (ראה התייחסות 18).
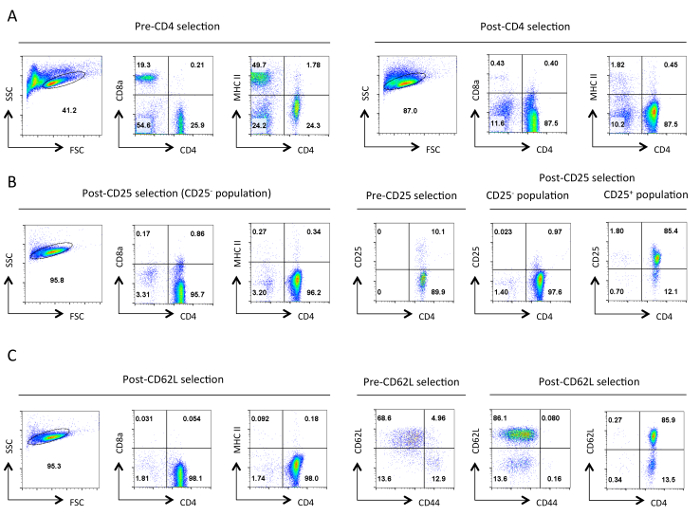
איור 1. טוהר אופייני של תאי T מסייע בכל שלב של בידוד. תזרים נציג cytometry תוצאות של אנטיגנים הצביעו מוצג מהשער של תאי חיים שיועדו לכך הפיזור קדימה (FSC) ואת צד פיזור (SSC) מגרשים. (א) לפני ואחרי CD4 סלקציה שלילית. פרופילי ביטוי של CD4,CD8a, ו MHCII מוצגים. אלו ממחישות את העשרת תאי T מסייעים אובדן תאי T ציטוטוקסיים ו MHC class II תאים המבטאים. היטהרות טובה צריכה לגרום תאים ~ 90% CD4 + T בשלב זה. (ב) בחירת CD25. מהשמאל הם פרופילי הביטוי של CD4, CD8a, ו MHCII, והמימין הוא CD4 וביטוי CD25 פרופילי בחירה לפני ואחרי. בשלב זה> 95% של תאי CD25 שליליים שנבחרו צריך להיות CD4 + CD25 -. הבחירה (C) CD62L. פרופילי הביטוי CD4, CD8a, ו MHCII מוצגים בצד שמאל. מימין פרופילי ביטוי CD62L ו CD44 מוצגים עבור תאים טרום ופוסט CD62L שנבחרו יחד עם פרופיל ביטוי CD4 ו CD62L של תאים שנבחרו פוסט. לאחר בחירת CD62L כמעט כל תאי זיכרון (CD44 +) יוסרו השארת אוכלוסייה מועשרת בתאי T מסייע נאיביים המכילים 10-15 תאי מפעיל% (CD62L נמוך). לכולםפרופילי FACS, גדרות מקבילות וקשקשת עבור פרמטר ספציפי נשמרו לאורך כל דרך. המספרים מייצגים את אחוז התאים בתוך אוכלוסיה מגודרת. ירידת הקלת גודל התאים לאחר המיון הראשוני היא ככל הנראה בשל לחץ מכאני במהלך הפרוטוקול. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
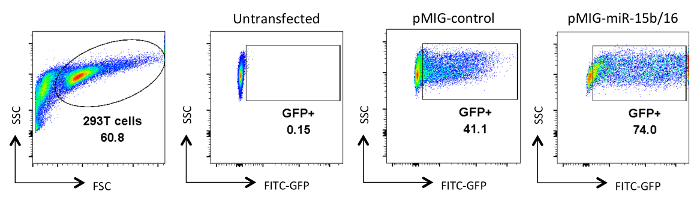
איור 2. ניתוח של תאים HEK 293T-טרנספקציה רטרו-וירוס. הביטוי GFP מוצג תאים HEK 293T שהיו או untransfected או transfected ונותחו לאחר איסוף supernatants תרבות ויראלי. ניתוח GFP נעשה על תאים חיים מהשער על המגרש FSC ו SSC בלוח הראשון. מספרים מייצגים את אחוז GFP + התאים בתוך האזור המגודר. t האופיינית יעילות ransfection נעה בין 30-90%. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
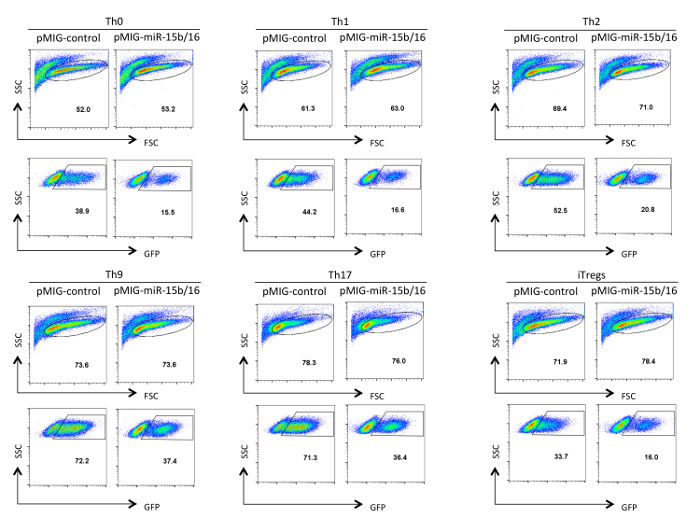
איור 3. ניתוח של תאי T מסייעים transduced רטרו-וירוס. הביטוי GFP מוצג בתאי T מסייעים retroviral-transduced לאחר בידול Th0, Th1, Th2, Th9, TH17, ו Treg תנאי הקיטוב במשך שלושה ימים. ניתוח היה מגודר על תאי חיים והופעלו מצוינים בלוח FSC / SSC. יעילות התמרה יכול להשתנות בין 10-75% תלוי מבנה ותנאי הקיטוב. כמו כן, עוצמת הניאון מתכוונת ביטוי GFP יכול להשתנות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
ילדה = "jove_content" FO: keep-together.within-page = "1"> 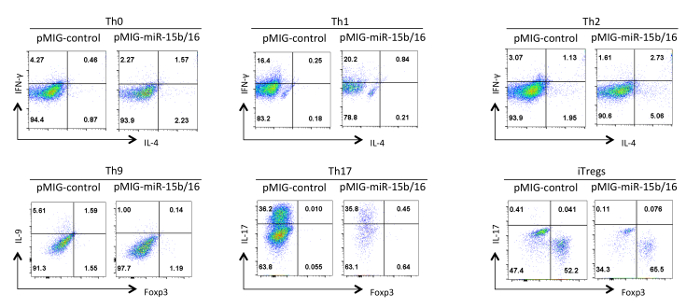
איור 4. השפעת miR-15b / 16 ביטוי יתר על התמיינות תאי T מסייע בתנאי קיטוב שונים. פרופילים ציטוקינים נציג מוצגים על GFP + אוכלוסיית תאי האיור 3. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

טבלה 1:. חוצצי המשמשים הפרוטוקולים הללו אנא לחץ כאן כדי להוריד את הטבלה כמו גיליון אלקטרוני של Excel.
| עוֹזֵרתנאי קיטוב תא T | ||
| Th0 | אנטי-IL-4 | 5 מיקרוגרם / מ"ל |
| אנטי IFN-γ | 5 מיקרוגרם / מ"ל | |
| Th1 | רקומביננטי-IL-12 | 20 ng / ml |
| אנטי-IL-4 | 5 מיקרוגרם / מ"ל | |
| Th2 | IL-4 רקומביננטי | 40 ng / ml |
| אנטי IFN-γ | 5 מיקרוגרם / מ"ל | |
| Th9 | TGF-β רקומביננטי | 2.5 ng / ml |
| IL-4 רקומביננטי | 40 ng / ml | |
| אנטי IFN-γ | 10 מיקרוגרם / מ"ל | |
| TH17 | TGF-β רקומביננטי | 2.5 ng / ml |
| IL-6 רקומביננטי | 50 ng / ml | |
| אנטי IFN-γ | 5 מיקרוגרם / מ"ל | |
| אנטי-IL-4 | 5 מיקרוגרם / מ"ל | |
| אנטי-IL-2 | 5 מיקרוגרם / מ"ל | |
| Tregs | TGF-β רקומביננטי | 2.5 ng / ml |
| IL-2 רקומביננטי | 5 ng / ml | |
טבלה 2: תנאי קיטוב משנה תא T מסייע.
Discussion
ביטוי יתר של גנים בתיווך retroviral היא דרך רבת עוצמה כדי לנתח פונקציה בתאי T מסייעים, כמו התפתחות ותפקוד שלהם נקבעת בדרך כלל על ידי רמת הביטוי של רגולטורים מרכזיים. עם זאת, פרשנות זהירה של התוצאות נדרשת כי רמות ביטוי משמעותי מעל אלה של גן אנדוגני יכולות להציג ממצאים רבים. לכן, טכניקה זו צריכה להיות משולבת עם אחרים כדי לאמת את הרלוונטיות של פונקציה. לדוגמא, ביטוי יתר צריך להיות כהשלמת ביטוי מופחת באמצעות siRNAs או נוקאאוט גנטי אם זמין. עם miRNAs, בהחלט השלמנו ניסויי ביטוי יתר עם אלה של חסימה באמצעות וירוסים כי ביטוי יתר מירנה מלאכותית מיקוד אתרים שפעלו מעכבים תחרותיים כתעריף מירנה 15. תאי retroviral transduced יכולים להיות מנוצלים גם מבחני ביוכימיים המעורבים RNA וניתוח חלבון. עם זאת, מגבלה עיקרית של ניסויים אלה היא יעילות של מיל התמרulting באוכלוסייה מעורבת של תאים transduced ו untransduced. לכן, מבחנים אלה יהיו רוב דורשים סבירים מיון של GFP + אוכלוסייה. לבסוף, מבחני בידול במבחנה צריכים להיות משולבים עם ניסויי in vivo, ואחת דרכים זו יכולה להיות מושגת על ידי הוא adoptively העברה תאי T transduced לעכברים ובעקבות הבידול שלהם והשפיעו על התגובה החיסונית.
אחת המגבלות המפתח מערכת זו הוא בגודל של הגנום רנ"א שיכולים להיות ארוז לתוך קפסיד retroviral. מניסיוננו, בגודל הכנס המרבי עבור מערכת retroviral MIG שנותן ייצור וירוס טוב הוא 3-3.5 קילו. לכן, גנים גדולים לא ניתן לנתח עם מערכת זו, כפי שהם נותנים titers וירוס העני. עם זאת, רוב הגנים הם קטנים יותר מאשר גודל זה כל כך מערכת זו שימושית עבור מגוון רחב של מחקרי גן.
עם התמרה retroviral, מספר חלופות בתוך protoco אלהls שמש. חוקרים רבים נצלו שורות תאי אריזה המבטאות את גני retroviral ביציבות (למשל אסמכתא 16). עם זאת, השגנו את טיטר הגבוהה ביותר באמצעות תאים 293T HEK רגיל עם שיתוף transfection של וקטור PCL-אקו עוזר וירוס. בידוד של תאי T מסייע נאיבי יכול גם להיות מושג באמצעות מיון תא ולא פרדת חרוז תא מגנט פרוטוקול הטור, אבל זה דורש גישת סדרן תא, ואת עלויות זמן מסוג הם בדרך כלל גבוהות יותר מאשר ריאגנטים החרוז. לבסוף, יש וריאציות על תנאי הפעלה בשימוש להבדיל תאי T מסייע לתוך תת השונה. לדוגמה, גירוי TCR של תאים במשך זמן רב מדי לפני חשיפה לתנאי התרמה Treg יכול לעכב גיוסם 16. זו יכולה להיות בעיה, כי הביטוי retroviral דורש חלוקת התא הנגרמת על ידי גירוי של תאים. אף על פי כן, מצאנו אינדוקציה יעילה Treg באמצעות פרוטוקול זה עם O / Activ Nation לפני התמרה retroviral.
בתוך הפרוטוקולים הללו, יישום מוצלח דורש מספר גורמים. הכנות רטרו-וירוס כייל גבוה צריכים transfection היעיל של תאי 293T HEK כך DNA באיכות גבוהה HBS 2x המוכנה בדיוק חשובות. בנוסף, את צפיפות התאים של תאי HEK 293T צריך להיות בערך 50% בשלב של transfection כי ביטוי טוב של ה- DNA transfected דורש כי התא ומתרחב, וזה יהיה עכבות אם התאים הם גם דלילים או צפופים. תאים בצפיפות האופטימלית במהלך transfection צריכים להגיע למפגש בשלב כלשהו במהלך השלבים האוספים וירוס, אבל הם ימשיכו לייצר מניות וירוס כייל גבוה לאורך כל הדרך אל האוסף האחרון. בידול יעיל של תאי T מסייע דורש איכות תא טובה כדי להבטיח כי תאים בודדים הם לטוהר באיור 1. כמו כן, את איכות התאים תלויה fr העכבריםאום אשר הם בודדו. עבור מחקרים אלה, השתמשנו C57BL בן 6-8 בשבוע / 6 עכברים. עכברים מבוגרים יכולים להיות פחות תאים תמימים, זנים אחרים, יכולים להיות שונים הבידול שלהם. לדוגמה, עכברים BALB / ג נוטים יותר לתגובות Th2 מ C57BL / 6 עכברים 17 כך כאמור לעיל, C57BL / 6 T תאים יכול להיות קשה כדי לעורר תגובה Th2. בנוסף, אחד מתנאי הבידול עשויים להשתנות מעט ממעבדה למעבדה, ואת ההשפעה של ביטוי יתר גן עשויה רק להתברר בתנאים תת-אופטימלית כך ריכוזים ציטוקינים בתנאי הקיטוב השונים ייתכן שיהיו צורך טיטרציה. לבסוף, תופעות של גן ביטוי היתר או תנאי הקיטוב על התפשטות תאים יכולות להשפיע על היעילות התמר כך תופעות מדידה של הגן של עניין עשויות לדרוש אופטימיזציה של התזמון וריכוז ריאגנטים מקטב. אופטימיזציה כל הגורמים הללו צריכות להוביל לתוצאות אינפורמטיבי עם מערכת זו.
Disclosures
The authors have no conflicting interest in the publication of this work.
Acknowledgements
This work was supported by a Biotechnology and Biological Sciences Research Council (BBSRC) grant (BB/H018573/1) and a BD Biosciences grant.
Materials
| Name | Company | Catalog Number | Comments |
| RPMI | Sigma | R8758 | |
| DMEM | Sigma | D5671 | |
| Penicillin Streptomycin solution | Sigma | P4333 | |
| L-Glutamine | Sigma | G7513 | |
| β-mercaptoethanol | Sigma | M3148 | |
| DPBS | Sigma | D8537 | |
| MIG vector | Addgene | Plasmid 9094 | |
| pCL-Eco vector | Addgene | Plasmid 12371 | |
| Cell strainer | BD Falcon | 352350 | |
| Magnetic beads mouse CD4 cell kit | Invitrogen (Dynabeads) | 11415D | |
| Streptavidin Beads | Miltenyi Biotech | 130-048-102 | |
| MS cell separation columns | Miltenyi Biotech | 130-042-201 | |
| LS cell separation columns | Miltenyi Biotech | 130-042-401 | |
| CD25 Biotenylated MAb | BD Biosciences | 85059 | clone 7D4 |
| CD62L Biotenylated MAb | BD Biosciences | 553149 | clone MEL-14 |
| Polybrene (Hexadimethrine Bromide) | Sigma | 107689 | |
| Anti-CD3 | eBiosciences | 16-0031-85 | clone 145-2C11 |
| Anti-CD28 | eBiosciences | 16-0281-85 | clone 37.51 |
| Anti-IL-4 | BD Biosciences | 559062 | clone 11B11 |
| Anti-IFN-gamma | BD Biosciences | 559065 | clone XMG1.2 |
| Anti-IL-2 | BD Biosciences | 554425 | cloneJES6-5H4 |
| Recombinant IL-12 p70 | eBiosciences | 14-8121 | |
| Recombinant IL-4 | BD Biosciences | 550067 | |
| Recombinant TGF-beta | eBiosciences | 14-8342-62 | |
| Recombinant IL-6 | eBiosciences | 14-8061 | |
| Recombinant IL-2 | eBiosciences | 14-8021 | |
| PMA | Sigma | P8139 | |
| Ionomycin | Sigma | I0634 | |
| Brefeldin A | eBiosciences | 00-4506 | |
| Paraformaldehyde | Sigma | 16005 | Paraformaldehyde is toxic so use appropriate caution when handling |
| Foxp3 staining buffer set | eBiosciences | 00-5523 | |
| Anti-CD4 FITC | eBiosciences | 11-0041 | clone GK1.5 |
| Anti-CD8a perCP-cy5.5 | eBiosciences | 45-0081-80 | clone 53-6.7 |
| Anti-MHCII PE | eBiosciences | 12-0920 | clone HIS19 |
| Anti-CD25 PE | eBiosciences | 12-0251-82 | clone PC61.5 |
| Anti-CD62L PE | eBiosciences | 12-0621-82 | clone MEL-14 |
| Anti-CD44 APC | eBiosciences | 17-0441 | clone IM7 |
| Anti-IFN-gamma FITC | eBiosciences | 11-7311-81 | clone XMG1.2 |
| Anti-IL-4 PE | BD Biosciences | 554435 | clone 11B11 |
| Anti-IL-9 PE or APC | eBiosciences/Biolegend | 50-8091-82/514104 | clone RM9A4 |
| Anti-IL-17a PE | BD Biosciences | 559502 | clone TC11-18H10 |
| Anti-Foxp3 APC or PE | eBiosciences | 17-5773-82/12-5773-80 | clone FJK-16s |
| NaCl | Sigma | S7653 | |
| KCl | Sigma | P9333 | |
| Na2HPO4-2H2O | Sigma | 71643 | |
| Dextrose/Glucose | Sigma | G7021 | |
| HEPES, free acid | Sigma | H3375 | |
| NH4Cl | Sigma | A9434 | |
| Disodium EDTA | Sigma | D2900000 | |
| KHCO3 | Sigma | 237205 | |
| CaCl2 | Sigma | C5670 |
References
- Baumjohann, D., Ansel, K. M. MicroRNA-mediated regulation of T helper cell differentiation and plasticity. Nat Rev Immunol. 13 (9), 666-678 (2013).
- Wilson, C. B., Rowell, E., Sekimata, M. Epigenetic control of T-helper-cell differentiation. Nat Rev Immunol. 9 (2), 91-105 (2009).
- Pearce, E. L., Poffenberger, M. C., Chang, C. H., Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science. 342 (6155), 1242454 (2013).
- Cherry, S. R., Biniszkiewicz, D., Van Parijs, L., Baltimore, D., Jaenisch, R. Retroviral Expression in Embryonic Stem Cells and Hematopoietic Stem Cells. Mol and Cell Biol. 20 (20), 7419-7426 (2000).
- Miller, A. D., Rosman, G. J. Improved retroviral vectors for gene transfer and expression. BioTechniques. 7 (9), 980-990 (1989).
- Grez, M., Akgün, E., Hilberg, F., Ostertag, W. Embryonic stem cell virus, a recombinant murine retrovirus with expression in embryonic stem cells. Proc Nat Acad Sci USA. 87 (23), 9202-9206 (1990).
- Naviaux, R. K., Costanzi, E., Haas, M., Verma, I. M. The pCL vector system: rapid production of helper-free, high-titer, recombinant retroviruses. J Virol. 70 (8), 5701-5705 (1996).
- Filipowicz, W., Bhattacharyya, S. N., Sonenberg, N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?. Nat Rev Genetics. 9 (2), 102-114 (2008).
- He, L., Hannon, G. J. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genetics. 5 (7), 522-531 (2004).
- Bernstein, E., Kim, S. Y., et al. Dicer is essential for mouse development. Nat Genetics. 35 (3), 215-217 (2003).
- Cobb, B. S., Hertweck, A., et al. A role for Dicer in immune regulation. J Exp Med. 203 (11), 2519-2527 (2006).
- Chong, M. M. W., Rasmussen, J. P., Rudensky, A. Y., Rundensky, A. Y., Littman, D. R. The RNAseIII enzyme Drosha is critical in T cells for preventing lethal inflammatory disease. J Exp Med. 205 (9), 2005-2017 (2008).
- Liston, A., Lu, L. F., O'Carroll, D., Tarakhovsky, A., Rudensky, A. Y. Dicer-dependent microRNA pathway safeguards regulatory T cell function. J Exp Med. 205 (9), 1993-2004 (2008).
- Zhou, X., Jeker, L. T., et al. Selective miRNA disruption in T reg cells leads to uncontrolled autoimmunity. J Exp Med. 205 (9), 1983-1991 (2008).
- Singh, Y., Garden, O. A., Lang, F., Cobb, B. S. MicroRNA-15b/16 Enhances the Induction of Regulatory T Cells by Regulating the Expression of Rictor and mTOR. J Immunol. 195 (12), 5667-5677 (2015).
- Sauer, S., Bruno, L., et al. T cell receptor signaling controls Foxp3 expression via PI3K, Akt, and mTOR. Proc Nat Acad Sci USA. 105 (22), 7797-7802 (2008).
- Yagi, J., Arimura, Y., Takatori, H., Nakajima, H., Iwamoto, I., Uchiyama, T. Genetic background influences Th cell differentiation by controlling the capacity for IL-2-induced IL-4 production by naive CD4+ T cells. Int Immunol. 18 (12), 1681-1690 (2006).
- Singh, Y., Garden, O. A., Lang, F., Cobb, B. S. MicroRNAs regulate T-cell production of interleukin-9 and identify hypoxia-inducible factor-2a as an important regulator of T helper 9 and regulatory T-cell differentiation. Immunology. 149, 74-86 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved