Method Article
Retrovirale Transduktion von T-Helferzellen als genetischer Ansatz zur Untersuchung Mechanismen der Kontrolle ihrer Differenzierung und Funktion
In diesem Artikel
Zusammenfassung
Viele experimentelle Systeme wurden die Mechanismen regulieren T-Zell-Entwicklung und Funktion in einer Immunantwort zu verstehen, verwendet. Hier ist ein genetischer Ansatz retrovirale Transduktion unter Verwendung beschrieben, die wirtschaftlich ist, Zeit effizient, und vor allem sehr informativ bei der Identifizierung von Regulationswege.
Zusammenfassung
Helper T cell development and function must be tightly regulated to induce an appropriate immune response that eliminates specific pathogens yet prevents autoimmunity. Many approaches involving different model organisms have been utilized to understand the mechanisms controlling helper T cell development and function. However, studies using mouse models have proven to be highly informative due to the availability of genetic, cellular, and biochemical systems. One genetic approach in mice used by many labs involves retroviral transduction of primary helper T cells. This is a powerful approach due to its relative ease, making it accessible to almost any laboratory with basic skills in molecular biology and immunology. Therefore, multiple genes in wild type or mutant forms can readily be tested for function in helper T cells to understand their importance and mechanisms of action. We have optimized this approach and describe here the protocols for production of high titer retroviruses, isolation of primary murine helper T cells, and their transduction by retroviruses and differentiation toward the different helper subsets. Finally, the use of this approach is described in uncovering mechanisms utilized by microRNAs (miRNAs) to regulate pathways controlling helper T cell development and function.
Einleitung
The immune response must be highly regulated to eliminate infections but prevent attacks on self-tissue that lead to autoimmunity. Helper T cells play an essential role in regulating the immune response, and a great deal of effort has been undertaken to understand their development and function (illustrated in several recent reviews 1-3). However, many questions remain, and many approaches have been utilized to study the mechanisms controlling helper T cell development and function. These have ranged from the use of in vitro cell culture systems to whole animals. Cell culture systems, especially those using cell lines, offer the benefit of ease of use and the ability to generate large amount of material to do sophisticated biochemical analyses. However, they suffer from their limited ability to reproduce the actual conditions occurring in an immune response. In contrast, whole animal experiments offer the benefit of relevance, but they can suffer from difficulties in manipulation and the ability to perform precise controls in addition to their large costs and ethical implications. Nevertheless, the vast majority of helper T cells studies today still require the use of whole animal experiments involving primary T cells because of the inability of cell lines to duplicate the exact steps occurring in the whole animal. Therefore, it is essential to utilize cost effective approaches that are highly informative.
Genetics is one powerful tool to study helper T cell development and function, yet traditional methods involving gene knockouts or transgenes are time consuming and expensive so they are often out of reach of small labs. However, retroviral transduction offers a powerful, rapid and, cost effective genetic approach to study the mechanisms of specific gene products. Therefore, it is commonly used in papers studying helper T cell development and function.
We have optimized a procedure for retroviral transduction of helper T cells. It utilizes the pMIG (Murine stem cell virus-Internal ribosomal entry site-Green fluorescent protein) retroviral expression vector, in which the gene of interest can be cloned and thereby expressed from the retrovirus long terminal repeat (LTR) 4. In addition, downstream of the inserted gene of interest is an internal ribosome entry sequence (IRES) followed by the green fluorescent protein (GFP) gene so transduced cells can easily be followed by their expression of GFP. The vector was originally derived from the Murine Stem Cell Virus (MSCV) vectors, which contain mutations in repressor binding sites in the LTRs making them resistant to silencing and thus, giving high expression in many cell types including helper T cells 5,6. Production of high titer retrovirus requires a simple transient transfection protocol of human embryonic kidney (HEK) 293T cells with the MIG vector and a helper virus vector that expresses the retroviral GAG, Pol, and Env genes. For this the pCL-Eco helper virus vector 7 works well in producing high titer replication incompetent retroviruses.
Here these protocols for retroviral production and transduction of primary murine T cells are described in addition to some of our results using this approach to study miRNA regulation of gene expression controlling helper T cell differentiation. miRNAs are small RNAs of approximately 22 nucleotides in length that post-transcriptionally regulate gene expression by targeting homologous sequences in protein encoding messenger RNAs and suppressing translation and inducing message instability 8,9. miRNAs play critical roles in developmental gene regulation. They are essential in the earliest stages of development, as embryos that cannot produce miRNAs die at a very early stage 10. In addition miRNAs are important later on in the development of many tissues. They are thought to function by fine-tuning the expression of genes required for developmental programs 1. In helper T cells miRNAs play multiple roles and are required for regulatory T cell (Treg) development 11-14. We used retroviral transduction as a means to dissect the mechanisms of miRNA regulation of Treg differentiation 15. Through such studies important individual miRNAs were determined by retroviral-mediated overexpression. Subsequently, relevant genes regulated by these miRNAs were identified in order to understand the molecular pathways regulated by miRNAs in helper T cell differentiation.
Protokoll
Alle Maus Arbeit in diesen Protokollen durchgeführt wurde gemäß der Tiere Scientific Verfahrensgesetz, UK unter dem Tier Projektlizenz vorgenommen 70/6965.
1. Retrovirale Produktion
Vor dem Verfahren erhalten alle erforderlichen Zulassungen für gentechnisch veränderte Organismen produzieren und die Verwendung von Retroviren in Säugerzellen.
- Wachstum von HEK 293T - Zellen
- Wachsen HEK 293T Zellen auf 10 cm-Gewebekulturschalen in HEK 293T-Medium (Dulbecco-modifiziertes Eagle-Medium (DMEM) mit 10% fötalem Rinderserum (FBS), 100 Einheiten / ml Penicillin 0,1 mg / ml Streptomycin und 2 mM L-Glutamin) . Für allgemeine Zellpassage, 01.10 Split-Zellen, wenn sie erreichen Zusammenfluß von Medium zu entfernen und Pipettieren der Zellen von der Platte mit frischen HEK 293T Medium.
HINWEIS: Die Zellen sollten Einmündung in 2-3 Tagen erreichen. 293T HEK-Zellen befestigen lose auf der Platte so ist Trypsinierung nicht erforderlich. - 24 Stunden vor der Transfektion, Split ein confluent Platte von Zellen 1:10 bis 10 cm-Platte (eine Platte pro Transfektion), so dass die nächsten Tag wurden die Zellen sind ~ 50% konfluent.
- Wachsen HEK 293T Zellen auf 10 cm-Gewebekulturschalen in HEK 293T-Medium (Dulbecco-modifiziertes Eagle-Medium (DMEM) mit 10% fötalem Rinderserum (FBS), 100 Einheiten / ml Penicillin 0,1 mg / ml Streptomycin und 2 mM L-Glutamin) . Für allgemeine Zellpassage, 01.10 Split-Zellen, wenn sie erreichen Zusammenfluß von Medium zu entfernen und Pipettieren der Zellen von der Platte mit frischen HEK 293T Medium.
- Die Transfektion von Calciumphosphat - Fällungs
- Etwa 1 h vor der Transfektion entfernen Medium aus Zellen und vorsichtig 9 ml frischer HEK 293T-Medium zu den Zellen zu verhindern von der Platte löst.
- Bereiten 2x HEPES - gepufferte Saline (2x HBS) und ein frisches 2,5 M CaCl 2 -Lösung , wie in Tabelle 1 beschrieben. Auftauen DNA Aktien. Für den effizientesten Transfektionen verwenden Plasmid Prep Qualität DNA.
- In einer 6 - ml - Rundboden oder 15 ml konischen Röhrchen 5 ug retroviraler DNA (pMIG) 4, 5 ug Helfervirus DNA (pCL-Eco) 7 und H 2 O auf 420 & mgr; l hinzuzufügen. Hinzuzufügen 80 ul 2,5 M CaCl 2 um das Endvolumen auf 500 ul zu bringen.
Anmerkung: Dies zusammen mit dem nächsten Schritt (Zugabe von 2x HBS) auf einer regelmäßigen bench solange allgemeinen ster geschehenile Technik wird verwendet. - Langsam 500 ul 2x HBS Tropfen für Tropfen zu der Mischung über DNA während sanft verwirbelt , so dass die Lösung kontinuierlich gemischt und die CaPO 4 fällt in sogar großen Kristallen.
- Transfer zu einem Kultur Kapuze Gewebe und fügen Sie langsam die CaPO 4 DNA - Gemisch (1 ml) tropfenweise zu den 9 ml Medium Abdeckung der Zellen , während ständig und vorsichtig auf die Platte wirbeln. Erneut vorsichtig sein, nicht Zellen von der Platte zu lösen. Legen Sie die Zellen wieder in den Inkubator.
HINWEIS: An diesem Punkt der CaPO 4 Niederschlag wird unter dem Mikroskop wie kleine Kristalle über die Größe der Bakterien leicht sichtbar sein. Diese sind leicht zu sehen, nach 30-60 Minuten, wenn die Kristalle eine Chance gehabt haben, an der Unterseite der Platte zu begleichen.
- Sammlung von Virus in Kulturüberständen.
- Am folgenden Tag (überall von 12 bis 24 Stunden nach der Transfektion) entfernen Sie das Medium und füttern die Zellen mit 10 mleinmal von frischem 293T Medium HEK wieder darauf achten, daß die Zellen von der Platte zu entfernen.
HINWEIS: Dies schwächt aus Lymphozyten-hemmende Substanzen, die die HEK 293T-Zellen in das Medium während der Transfektion absondern. - Am Abend des zweiten Tages (~ 24 Stunden nach der Transfektion) feed-Zellen mit 3,5 ml frischem HEK 293T Medium. Achten Sie darauf, dass die Platte genau Niveau in den Inkubator gelegt wird, so dass eine Seite nicht trocken bleibt.
- Sammeln Medium ~ 12 Stunden später (bei 4 ° C) und Futtermittel mit 3,5 ml frischem HEK 293T Medium. Wiederholen collection 2 weitere Male in etwa 12 Stunden Intervallen, so dass etwa 10 ml Medium wird gesammelt. Dies ist das Virus Lager.
- Spinnen alle restlichen HEK 293T-Zellen und Zelltrümmer durch bei 600 g für 5 min zentrifugiert. Alternativ filtern, um ein 0,45 & mgr; m, niedrige Proteinbindung, Spritzenfilter. Shop-Virus bei 4 ° C und für die besten Titer, verwenden Sie innerhalb eines Tages oder zwei, wie der Titer langsam bei 4 ° C abnehmen wird. Nicht frEeze, da dies erheblich den Titer nimmt ab.
- Am folgenden Tag (überall von 12 bis 24 Stunden nach der Transfektion) entfernen Sie das Medium und füttern die Zellen mit 10 mleinmal von frischem 293T Medium HEK wieder darauf achten, daß die Zellen von der Platte zu entfernen.
2. Isolierung von primären Naïve CD4 + T - Zellen
- Isolierung von Leukozytenzellen
- Euthanize Mäuse durch Genickbruch, CO 2 Ersticken oder andere humane Protokoll angemessen auf die Behandlung der Tiere Regeln der Institution.
- Präparieren frisch getöteten Mäuse und entfernen Milz und Lymphknoten gewünschten 15. Platzieren Sie die Organe in Vertiefungen einer 6-Well-Gewebekulturplatte enthält, R10-Medium (RPMI-Medium mit 10% hitzeinaktiviertem FBS, 100 Einheiten / ml Penicillin, 0,1 mg / ml Streptomycin, 2 mM L-Glutamin und 0,1% β-Mercaptoethanol) . Verwenden Sie eine Zellkultur Haube für die Präparation von Mäusen und alle nachfolgenden Manipulationen Wahrscheinlichkeit einer Kontamination in den Kulturen zu minimieren.
HINWEIS: Halten Sie das R10 Medium kalt und führen Sie alle nachgelagerten Reinigungsschritte bei 4 ° C. - Legen Sie eine 70 um Zellkultur Sieb in einen 50 ml konischen Röhrchen ca. 5 ml R10-Medium enthält. Verwenden Sie ein Sieb für die Milz und Lymphknoten von bis zu drei Mäusen.
- mit dem Ende eines 5 ml Spritzenkolben hinzufügen Milz und Lymphknoten zur Zellsieb und mazerieren. Spülen Sie mit 1-2 ml R10-Medium.
- Übertragen Zellen auf eine 15 ml konischen Röhrchen und bringen das Volumen von bis zu 14 ml mit R10. Zentrifuge bei 600 × g für 5 min bei 4 ° C. Überstand verwerfen, indem Sie sie mit einem sauberen Bewegung Gießen zu verhindern, dass das Zellpellet zu stören.
- 2 ml kaltem (4 ° C) Lysepuffer für rote Blutkörperchen (Tabelle 1) zu jedem Röhrchen. Sanft für 3,5 min mischen, auf Eis, um die Röhre zu halten.
HINWEIS: Der Zeitpunkt der Auflösung der roten Blutkörperchen kritisch ist der Tod von Lymphozyten zu verhindern. Daher müssen die genaue Timing jeder Charge von Red Zelllysepuffer optimiert werden. - In ≈12-13 ml R10-Medium. Unmittelbar Zentrifuge und Überstand verwerfen, wie in Schritt 2.1.5. Führen Sie die Waschschritte 2x mehr Witzh R10 mittlerer restliche Erythrozyten-Lyse-Puffer von den Zellen zu entfernen und den Tod von Lymphozyten vermeiden.
- Zählen von Zellen in einem Hämocytometer 01.20 in Trypanblau Verdünnen der Ausbeute an lebenden Zellen zu bestimmen. Erwarten Sie etwa 8-10 x 10 7 Zellen pro Maus.
- Isolierung von CD4 + T - Zellen Magnetic Beads Kit CD8 +, CD11b +, CD16 / 32 +, CD45R +, MHC - Klasse - II + und Ter-119 + Zellen zu entfernen.
- Aliquot 8-10 x 10 7 Zellen aus Schritt 2.1.8 pro 15 ml konischen Röhrchen und Zentrifugieren bei 600 xg für 5 min bei 4 ° C. Gießen Sie den Überstand mit einer sauberen Bewegung weg zu verhindern, dass das Zellpellet zu stören. Resuspendieren der Zellen in jedem Röhrchen in 100 ul hitzeinaktiviertem FBS dann aus dem Satz 100 ul der Antikörpermischung hinzuzufügen. Inkubieren für 30 min bei 4 ° C unter vorsichtigem Mischen auf einer Walze.
- Während die oben genannten Zellen werden inkubiert, bereiten die Perlen.
- Resuspendieren Perlen in dem Fläschchen durch Vortexen für> 30 sec übertragen dann 1 ml der Perlen pro 8-10 x 10 7 hergestellten Zellen einem 15 ml konischen Röhrchen. 2 ml R10-Medium pro ml Perlen und vorsichtig mischen.
- Das Röhrchen wird in den Magneten für 1 min dann den Überstand verwerfen. Entfernen Rohr von den Magneten und resuspendieren Kügelchen in 4 ml R10-Medium. Diese Menge an Perlen ist für zwei Runden der Inkubation ausreichend.
- Waschen der Zellen am Ende der Antikörper-Inkubation (Schritt 2.2.1) durch Zugabe von 10 ml R10-Medium pro Röhrchen. gut mischen Sie vorsichtig mit Verwirbelung der Röhre und Zentrifuge Zellen bei 600 xg für 5 min bei 4 ° C. Gießen Sie den Überstand mit einer sauberen Bewegung weg zu verhindern, dass das Zellpellet zu stören. Die Zellen in 1 ml R10-Medium.
- 2 ml der gewaschenen Kügelchen aus Schritt 2.2.2.2 (½ der Menge für jedes Rohr hergestellt) zu jedem Röhrchen von Zellen Antikörper behandelt und Inkubation für 30 min bei 4 ° C unter vorsichtigem Mischen auf einem roller.
- Resuspendieren Zell-Kügelchen-Mischung durch vorsichtiges Pipettieren 5-mal mit einer Pipette einen schmalen Spitzenöffnung enthält. Schaumbildung vermeiden. Das Röhrchen wird in den Perlen Magnet für 2 min dann den Überstand die negativ selektierten Zellen in ein neues Röhrchen enthält. Bewahren Sie diese Zellen, wie sie die CD4 + Bevölkerung.
- Wiederholen Sie die negative Selektion noch einmal. Spin-Zellen aus Schritt 2.2.5 bei 600 xg für 5 min bei 4 ° C. Gießen Sie den Überstand, wie in Schritt 2.2.3 und Resuspendieren in 1 ml R10-Medium ab. Führen Sie die Schritte 2.2.4 und 2.2.5 wieder. Nach der endgültigen Auswahl magnetischen Kügelchen, die Zellen zählen Ausbeute zu bestimmen (typische Ausbeuten sind 15-20 x 10 6 Zellen pro 10 8 Leukozyten).
- Isolierung von naiven CD4 + T - Zellen (CD25 - und CD62L hoch) Zelltrennsäulen Verwendung
- Zentrifuge CD4 + T - Zellen bei 600 xg für 5 min bei 4 ° C und resuspendieren in 150-200 ulR10 Medium pro 10 8 Zellen. In 2 ul Lager biotinyliertem CD25 monoklonalen Antikörper (Klon 7D4). Inkubieren für 30 min bei 4 ° C unter vorsichtigem Mischen auf einer Walze.
- Waschen Sie die Zellen durch 10 ml der Zellseparationssäule Puffer Addieren (Tabelle 1). Zentrifuge bei 600 × g für 5 min bei 4 ° C. Entfernen Sie so viel Überstand wie möglich und schätzen das Volumen des Puffers / Zellen verbleiben. Resuspendieren auf ein Endvolumen von etwa 90 & mgr; l pro 10 7 Zellen.
- In 20 ul Streptavidinkügelchen pro 10 7 Zellen und mischen sich mit sanften Flicks. Inkubieren für 15 min bei 4 ° C.
- Während Zellen werden inkubiert, bereiten Sie die mittlere Zelltrennung (MS) Spalten für die manuelle Ansatz. Jede MS Spalte behält 10 7 Zellen, und da CD25 + Zellen typischerweise etwa 10% der gesamten CD4 + Zellen darstellen, verwenden Sie 1 Spalte pro 10 8 CD4 + T - Zellen. Hinzufügen 500 ul Zelltrennsäulenpuffer auf die Säuleund lassen Sie durchfließen. Wiederholen Sie 2 weitere Male.
- Am Ende der Zellen / Perlen-Inkubation, wasche die Zellen durch Zugabe von 10 ml Zelltrennsäulenpuffer und Zentrifugieren bei 600 xg für 5 min bei 4 ° C. Die Zellen in 500 & mgr; l Zellseparationssäule Puffer pro 10 8 Zellen, aber immer noch 500 & mgr; l verwendet werden, wenn es weniger Zellen sind.
- Bewerben 500 ul Zellen / Perlen-Suspension in die Kolonne und sammeln die Strömung durch. Führen Sie diese über die Säule 1 mehr Zeit und sammeln die Strömung durch erneut. Spülen der Säule 3-mal mit 500 ul Zelltrennsäulenpuffer, die jeweils von diesen Spülungen zu den gesammelten Zellen durch Zugabe fließen. Dies sind die CD25 - -Zellen. Zählen von Zellen zu bestimmen Ausbeute.
- Wenn Tregs (CD25 + Zellen) gewünscht sind, zu isolieren wie folgt.
- Entfernen Sie die Säule aus dem Separator und halten Sie ihn über einem offenen Universal-Schlauch kümmert Sterilität aufrecht zu erhalten. Schnell Pipette 500 ul Zelltrennpuffer auf den colUMN und spülen fest die positive Fraktion, den Kolben mit der Säule geliefert werden.
- Wiederholen Sie den Spülvorgang 2 weitere Male. Übergeben Sie die positive Fraktion über eine neue MS Zelltrennsäule und entsorgen Sie diesen Durchfluss. auszuspülen Fest der positiven Zellen dreimal nach wie vor und Zentrifuge Zellen bei 600 xg für 5 min bei 4 ° C Die Zellen in 1 ml R10-Medium und zählen die Ausbeute zu bestimmen.
- CD62L hoch T - Zellen, die CD25 Zentrifuge - - T - Zellen isoliert oben in Schritt 2.3.6 bei 600 xg für 5 min bei 4 ° und resuspendieren in 150-200 ul R10 Medium pro 10 7 Zellen CD25 zu erhalten. In 5 ul Lager biotinyliert CD62L monoklonalen Antikörper (Klon MEL-14) und Inkubation für 30 min bei 4 ° C unter leichtem Rühren auf einer Rolle wie zuvor.
- Führen Sie waschen, Streptavidin Auffädeln Bindung und Zelltrennsäule Vorbereitung für Treg Isolierungsprotokoll beschrieben (2.3.7). Dieses Mal Gebrauchdie große Zelltrennung (LS) Säule, die eine Kapazität von 10 8 Zellen hat.
- Da CD62L hoch T Zellen typischerweise etwa 60-70% der CD25 darstellen - Zellen, verwenden Sie 1 LS Zellseparationssäule pro 10 8 Zellen. In Zellen / Perlen-Mischung zu LS Zelltrennsäule als 2.3.6 in Schritt beschrieben - diesmal die endgültige Strömungs Verwerfen durch und Spalte Spülungen. Sammeln Sie die CD62L hoch T - Zellen , wie in Schritt 2.3.7 für die CD25 + Zellsammlung beschrieben.
- Zentrifugen Zellen bei 600 xg für 5 min bei 4 ° C. Die Zellen in 1 ml R10 und zählen Ausbeute zu bestimmen. Die Lösung wird bis 0.75-1 X10 6 Zellen pro ml in R10 Medium.
- Analysieren Reinheit von Zellen durch fluoreszenzaktivierte Zellsortierung (FACS).
- FACS-Färbung Strategie
- Für Zellen vor und nach alle Stufen der Isolierung, Fleck mit CD4-FITC, CD8a-PerCP-Cy5.5 (Helfer und zytotoxische T-Zellen) und MHCII-PE (MHC-Klasse-II-exprimierenden Zellen).
- Für Zellen vor und nach der CD25 Isolation, Fleck mit CD4-FITC und CD25-PE (Tregs im Vergleich zu anderen Helfer-T-Zellen).
- Für Zellen vor und nach dem CD62L Isolation Fleck mit CD4-FITC, CD62L-PE und CD44-APC (naiv gegenüber Speicher und Effektor-Helfer-T-Zellen).
- Für jede Analyse Platz 10 5 Zellen in einer Vertiefung einer 96 - Well - U-Bodenplatte. Zentrifuge bei 600 × g für 5 min bei 4 ° C. Gießen Sie das Medium ab und waschen Sie die Zellen einmal mit 200 ul DPBS. Zentrifuge nach oben und abgießen DPBS.
- Je 50 ul DPBS pro Vertiefung und 0,5 ul jeder Antikörper (wie in 2.4.1 angegeben) und Inkubation bei RT für 30 min im Dunkeln Bleichen von fluoreszierenden Markierung zu vermeiden.
- Waschen Sie die Zellen 2x mit DPBS wie in 2.4.2 und sofort auf einer Fluss analysieren Protokolle und Richtlinien speziell für das Instrument zur Hand cytometer verwenden.
HINWEIS: Nach dem letzten Isolierungsschritt von einer guten Vorbereitung, 90-95% der Zellensein CD4 + CD25 - CD62L hoch T - Zellen.
- FACS-Färbung Strategie
3. retroviraler Transduktion von aktivierten CD4 + T - Zellen und ihre Differenzierung in spezifische T Helper Subsets
- Retrovirale Transduktion
HINWEIS: Retrovirale Integration und Expression von Genen erfordert Zellteilung. Daher müssen T-Zellen aktiviert O / N sein.- Während der Isolierung der naiven T-Zellen, Mantel eine 24-Well-Gewebekulturplatte mit Anti-CD3 und anti-CD28 in DPBS verdünnt Antikörper. In 250 ul pro Vertiefung. Verwenden anti anti-CD3 bei 1 ug / ml. Verwenden anti-CD28 bei 2 & mgr; g / ml, wenn die Zellen schließlich unter Th0, Th1, Th2 und iTregs Bedingungen unterschieden werden. Verwenden Sie Anti-CD28 bei 10 ug / ml für Th9 und Th17 Bedingungen. Inkubiere ~ 2 h bei 37 ° C in einem Gewebekultur-Inkubator.
- Unmittelbar vor der Kultivierung der Zellen, entfernen Sie die Antikörperlösung und waschen Sie die Platte mit ~ 250 ul DPBS pro Vertiefung unbou entfernennd Antikörper. Seien Sie nicht vorsichtig die Platte so austrocknen zu lassen, maximal 6 Vertiefungen zu einer Zeit verarbeiten. Entfernen DPBS waschen und 1 ml naiven CD4 + T - Zellen in R10 - Medium bei 0,75-1 x 10 6 Zellen pro ml. Zellen aktivieren O / N (14-16 h).
- Am folgenden Tag Zentrifugen Zellen in der Platte bei 900 xg für 5 min bei 30 ° C-Zellen auf den Boden der Vertiefungen zu befestigen.
- Sammeln und das Medium speichern darauf achten, daß die Zellen zu verdrängen und ersetzen mit 1 ml Virus Kulturüberstand aus der Virusproduktion Protokoll vorbereitet. nicht austrocknen die Zellen lassen so ein Maximum von 4 Vertiefungen zu einer Zeit verarbeiten.
- Zu jeder Vertiefung für 1 & mgr; l von 8 mg / ml Polybren und 10 ul 1 M HEPES , pH 7,5 , auf Virusaufnahme und verhindern signifikante Alkalisierung in der Umgebungs CO 2 während der nachfolgenden Zentrifugation unterstützen. Centrifuge Zellen in der Platte bei 900 × g für 90 min bei 30 ° C
- Differenzierung von Zellen in SpeziFic Subsets
- Entfernen Sie vorsichtig mit 1 ml des Mediums gesammelt oben in Schritt 3.1.4, das Virus Kulturüberstand und ersetzen, da sie IL-2 und andere T-Zell-Wachstumsfaktoren enthält. Fügen angegebenen Reagenzien in Tabelle 2 und Kulturzellen für 3-4 Tage Zellen in bestimmte Untergruppen zu unterscheiden.
- Analyse von Zellen
- Für die intrazelluläre Färbung von Zytokinen, behandeln Zellen mit 1 & mgr; g / ml jeweils von Phorbol-12-Myristat-13-acetat (PMA) und Ionomycin für 4 Stunden. Während der letzten 2 Stunden der Stimulation, fügen Sie 1 & mgr; g / ml Brefeldin A.
- Die Zellen aus dem Boden jeder Vertiefung durch Auf- und Abpipettieren mehrmals. Übertragen etwa 10 5 Zellen auf einer 96 - Well U Bodenplatte ( in der Regel 100 & mgr; l aus der 1 ml der Kultur von Th - Zellen) zur Fixierung und Färbung.
- Für GFP-Färbung fixieren Zellen mit 100 & mgr; l von 2% Paraformaldehyd bei RT für genau 5 min, als eine längere Inkubationszeit wird das GFP ein Bleichmittelnd stören Foxp3 Färbung. Waschen Sie die Zellen durch Zugabe von 100 ul DPBS in jede Vertiefung und Zentrifuge bei 600 × g bei 22 ° C für 5 min. Gießen Sie den Überstand ab.
Achtung: Paraformaldehyd ist giftig. Behandeln Sie ihn in einem Abzug mit der Haut und Augenschutz. - Fix die Zellen wieder mit 100 ul 1x Fixation Puffer aus der Foxp3 Färbekit gemacht (1 Volumen Fixation Puffer zu 3 Volumina Verdünnungsmittel). Inkubieren der Zellen für 45 min bei RT oder bei 4 ° C für 16 Stunden inkubieren.
- Nach der Fixierung Permeabilisierung Zellen durch aus dem gleichen Kit 100 ul Permeabilisierung Puffer hinzuzufügen. für 30-45 Minuten bei RT inkubieren, dann für 5 min bei 600 × g bei 22 ° C zentrifugieren.
- Für Antikörper-Färbung, Fixierung / Permeabilisierung Puffer und 50 ml frisches Permeabilisierung Puffer zu entfernen. Fügen Sie den erforderlichen Antikörper verdünnt in Permeabilisierung Puffer bei 0,5 & mgr; l pro 50 & mgr; l Puffer pro Probe. Inkubieren für 30-45 min bei RT in Dunkelheit Bleichen von Grippe zu vermeidenorescent Label.
- Zugabe von 150 & mgr; l Puffer und Permeabilisierung Zentrifuge bei 600 × g bei 22 ° C für 5 min. Entsorgen Sie die Permeabilisierung Puffer und 200 ul DPBS. Analysieren Sie mit einem Durchflusszytometer Protokolle und Richtlinien speziell für das Instrument an der Hand.
HINWEIS: Stellen Sie sicher , dass geeignete Kontrollen für Zytokinfärbung wie Färben mit Isotypenkontrolle Antikörper enthalten, nicht aktivierten oder Th0 aktivierten Zellen zu analysieren, usw.
Ergebnisse
Der Erfolg dieses experimentelle System erfordert sehr reine Populationen von T-Zellen und hoher Titer-Retrovirus-Präparate. Repräsentative Ergebnisse sind als Beispiele für erfolgreiche Experimente hier gezeigt. Abbildung 1 zeigt die typische Reinheit von prä- und post ausgewählten Populationen in jeder Phase der naiven T - Helferzellisolierungsprotokoll, Fig . 2 und 3 veranschaulichen die Analyse von Retrovirus - Produktion durch die GFP - Expression in den transfizierten HEK 293T - Zellen (Abbildung 2) und transduzierten T - Zellen (Abbildung 3). Transfektionseffizienzen der HEK 293T - Zellen können erheblich variieren mit verschiedenen retroviralen Konstrukten, aber dies häufig korreliert nicht mit der Ebene der Produktion Retrovirus mit der Anzahl der GFP + T - Zellen beobachtet. Auch kann die Anzahl der GFP + T - Zellen hängt von der Polarisationsbedingungen variieren. Weiterhin ist die mean Expression von GFP und das insertierte Gen kann in Abhängigkeit von der Anzahl der Kopien Virus integriert, die Wirkung der Integrationsstelle auf die Transkription und post-transkriptionalen Regulationsmechanismen variieren, um die viralen Transkripts zu beeinflussen.
Schließlich Abbildung 4 zeigt einige typische Ergebnisse , die wir mit Helfer - T - Zell - Differenzierung beobachtet , wenn die miRNAs miR-15b / 16 überexprimiert werden. Diese Ergebnisse zeigen einige der Variabilität, die innerhalb eines einzelnen Experiments so wahr Effekte begründet werden muss durch eine statistische Analyse von mehreren Wiederholungsversuchen mit verschiedenen Präparaten von T-Helferzellen auftreten kann. In diesen Experimenten können Th2-Antworten schwierig sein, in der C57BL / 6-Linie hier verwendet, um zu beobachten, weil sie zu Th1-Reaktionen neigen. Ebenso kann IL-9-Färbung schwierig sein, über dem Hintergrund zu erfassen. Daher ist es zwingend notwendig, Isotypkontrollen zu tun und einen angemessenen Ausgleich einzurichten, um eine korrekte ga gewährleistenting der Zytokin-Expression. In unseren Ergebnissen haben wir , dass miR-15b / 16 verbessert iTreg Induktions 15 durch Hemmung des mTOR - Signalweg durch Unterdrückung der Expression der Komponenten Rictor und mTOR gefunden. miR-15b / 16 kann manchmal beeinflussen Th0, Th1 und Th17 Differenzierung in einzelnen Experimenten, aber es gibt keine signifikante Wirkung, wenn in mehreren Wiederholungsversuchen untersucht. Im Gegensatz miR-15b / 16 Überexpression nicht unterdrückt deutlich Th9 Differenzierung (siehe Referenz 18).
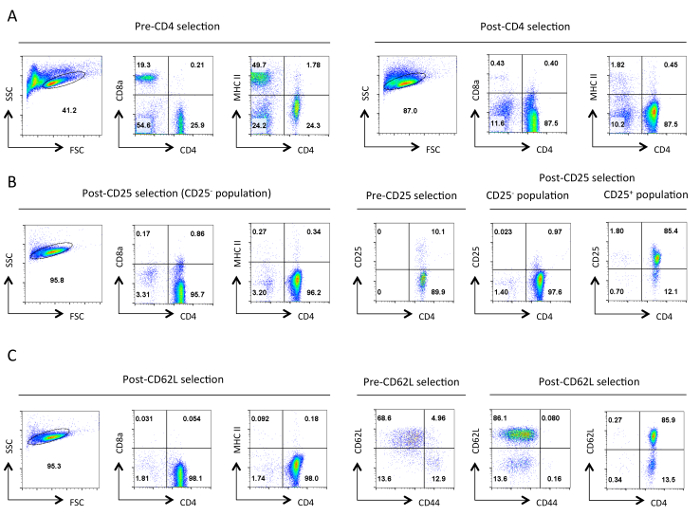
Abbildung 1. Typische Reinheit von Helfer - T - Zellen in jeder Phase der Isolation. Repräsentative Durchflusszytometrie Ergebnisse der angegebenen Antigene werden von dem Gate von lebenden Zellen in der Vorwärtsstreuung (FSC) und Side Scatter (SSC) Plots bezeichnet gezeigt. (A) vor und nach der CD4 - negative Selektion. Expressionsprofile von CD4,CD8a und MHCII gezeigt. Diese veranschaulichen die Anreicherung von Helfer-T-Zellen und den Verlust der zytotoxischen T-Zellen und MHC-Klasse II exprimierende Zellen. Eine gute Reinigung sollte in ~ 90% CD4 + T - Zellen in diesem Stadium führen. (B) CD25 Auswahl. Auf der linken Seite sind die Expressionsprofile von CD4, CD8a und MHCII, und auf der rechten Seite sind die CD4 und CD25-Expressionsprofile vor und nach der Auswahl. An dieser Stelle> 95% der CD25 negativ selektierten Zellen sollten CD4 + CD25 sein -. (C) CD62L Auswahl. CD4, CD8a und MHCII Expressionsprofile sind auf der linken Seite gezeigt. Auf der rechten Seite werden die Expressionsprofile für CD62L und CD44 für Pre- und Post-CD62L ausgewählten Zellen zusammen mit CD4 und CD62L Expressionsprofil von Post ausgewählten Zellen gezeigt. Nach CD62L Auswahl praktisch alle Speicherzellen (CD44 +) entfernt , um eine hoch angereicherte Population von naiven T - Helferzellen zu verlassen , die 10-15% Effektor - Zellen (CD62L low) enthält. Für alleFACS-Profile, Einstellungen und äquivalente Skalen für einen bestimmten Parameter wurden während gehalten. Die Zahlen stellen den Prozentsatz an Zellen in einer Gated Bevölkerung. Der leichte Rückgang der Größe der Zellen nach der ersten Wahl ist vermutlich durch mechanische Beanspruchung während des Protokolls. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
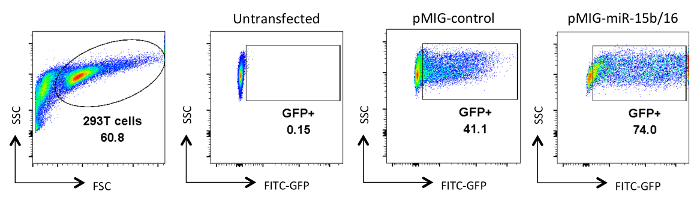
Abbildung 2. Analyse von Retrovirus-transfizierten HEK 293T - Zellen. Die GFP - Expression in HEK 293T - Zellen gezeigt , die entweder untransfizierten waren oder transfiziert und nach der Entnahme von viralen Kulturüberständen analysiert. GFP-Analyse wurde an lebenden Zellen aus dem Tor auf der FSC und SSC Plot in der ersten Platte erfolgen. Die Zahlen stellen den Prozentsatz der GFP + Zellen innerhalb der Gated Region. Typische transfection Effizienzen liegen zwischen 30-90%. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
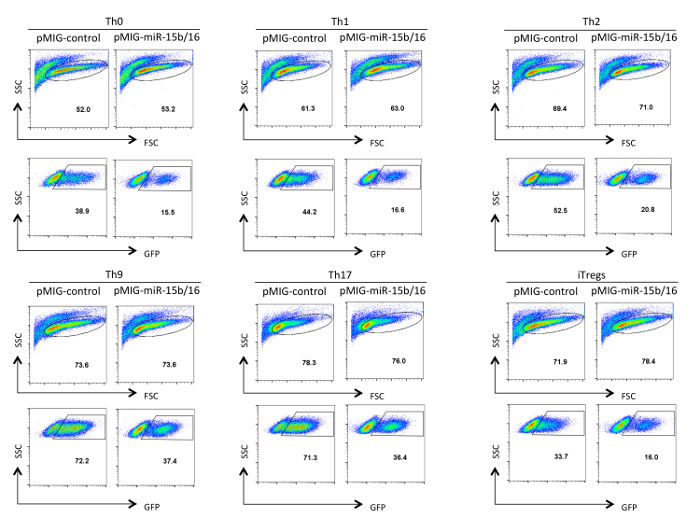
Abbildung 3. Analyse von Retrovirus transduzierten T - Helferzellen. GFP - Expression wird für drei Tage in retroviral transduzierten Helfer - T - Zellen nach Differenzierung in Th0, Th1, Th2, Th9, Th17 und Treg Polarisationsbedingungen gezeigt. Die Analyse wurde gated auf Live- und aktivierten Zellen in der FSC / SSC-Panel angezeigt. Transduktionseffizienzen kann zwischen 10-75% in Abhängigkeit von dem Konstrukt und den Polarisationsbedingungen variieren. Ebenso kann die mittlere Fluoreszenzintensität der GFP - Expression variieren. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
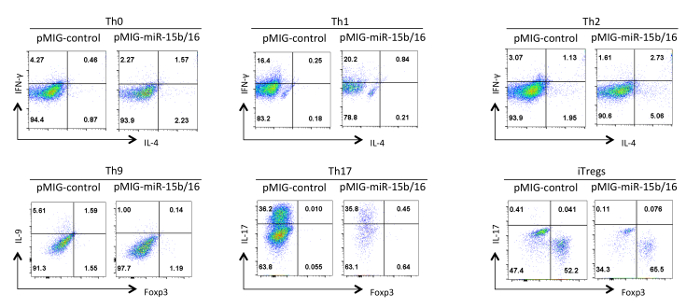
Abbildung 4. Wirkung von miR-15b / 16 Überexpression auf T - Zell - Differenzierung Helfer in verschiedenen Polarisationszustände. Repräsentative Zytokinprofile sind auf der GFP + Population von Zellen aus Abbildung 3 dargestellt. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Tabelle 1:. Puffer in diesen Protokollen verwendet Bitte hier klicken , um diese Tabelle als Excel - Tabelle zum Download bereit .
| HelferT-Zell-Polarisationszustände | ||
| Th0 | anti-IL-4 | 5 & mgr; g / ml |
| Anti-IFN-γ | 5 & mgr; g / ml | |
| Th1 | rekombinante IL-12 | 20 ng / ml |
| anti-IL-4 | 5 & mgr; g / ml | |
| Th2 | rekombinantes IL-4 | 40 ng / ml |
| Anti-IFN-γ | 5 & mgr; g / ml | |
| Th9 | rekombinantes TGF-β | 2,5 ng / ml |
| rekombinantes IL-4 | 40 ng / ml | |
| Anti-IFN-γ | 10 & mgr; g / ml | |
| Th17 | rekombinantes TGF-β | 2,5 ng / ml |
| rekombinantes IL-6 | 50 ng / ml | |
| Anti-IFN-γ | 5 & mgr; g / ml | |
| anti-IL-4 | 5 & mgr; g / ml | |
| anti-IL-2 | 5 & mgr; g / ml | |
| Tregs | rekombinantes TGF-β | 2,5 ng / ml |
| rekombinantes IL-2 | 5 ng / ml | |
Tabelle 2: Helper T - Zell - Untergruppe Polarisationszustände.
Diskussion
Retrovirale vermittelte Überexpression von Genen ist eine leistungsfähige Methode, Funktion in T-Helferzellen zu analysieren, wie ihre Entwicklung und Funktion oft durch die Expression von Schlüsselregulatoren bestimmt wird. Allerdings ist vorsichtige Interpretation der Ergebnisse erforderlich, da die Expressionsniveaus deutlich über denen des endogenen Gens viele Artefakte einführen können. Daher sollte diese Technik mit anderen kombiniert werden, um die Relevanz der Funktion zu überprüfen. Zum Beispiel Überexpression sollte durch eine reduzierte Expression unter Verwendung von siRNAs oder Gen-Knockout falls vorhanden, ergänzt werden. Mit miRNAs, ergänzt wir die Überexpression Experimente mit denen der Blockierung von Viren verwendet , die künstliche miRNA Targeting Websites überexprimiert , die als kompetitive Inhibitoren für eine miRNA 15 gehandelt hat. Retrovirale transduzierten Zellen können auch in biochemischen Assays denen RNA und Protein-Analyse verwendet werden. Jedoch ist eine große Einschränkung dieser Experimente Effizienz der Transduktion resulting in einer gemischten Population von transduzierten und untransduzierten Zellen. Daher werden diese Assays wahrscheinlich erfordern der GFP + -Population Sortieren. Schließlich wird in vitro Differenzierungsassays sollten mit in vivo Experimenten kombiniert werden, und ein Weg , dies erreicht werden kann , ist durch die adoptiv transduzierten T - Zellen in Mäuse übertragen und nach ihrer Differenzierung und ihre Wirkung auf die Immunantwort.
Eine der wichtigsten Beschränkungen dieses Systems ist die Größe des RNA-Genoms, die in das retrovirale Kapsid verpackt werden kann. Nach unserer Erfahrung ist die maximale Einsatzgröße für MIG retroviralen System, das gute Virusproduktion gibt, ist 3-3,5 kb. Daher können größere Gene mit diesem System nicht analysiert werden, da sie schlechte Virustiter geben. Jedoch sind die meisten Gene kleiner als diese Größe so dass dieses System für eine große Vielzahl von Gen-Studien nützlich ist.
Mit retrovirale Transduktion, mehrere Alternativen, die in dieser Protocols verwendet. Viele Forscher haben Verpackungszelllinien verwendet, die die retroviralen Gene stabil exprimieren (zum Beispiel 16 Referenz). Allerdings haben wir die höchsten Titer unter Verwendung von Standard-HEK 293T-Zellen mit Co-Transfektion des PCL- Eco Helfervirus-Vektor erhalten. Isolation von naiven T-Helferzellen können auch durch die Zelle erreicht werden Sortier anstelle der magnetischen Kügelchen und Zellseparationssäule Protokoll, aber dies erfordert Zugang zu einem Zellsortierer, und die Kosten für die Sortierzeit sind in der Regel höher als die Wulst Reagenzien. Schließlich gibt es Variationen Aktivierungsbedingungen verwendet, um Helfer-T-Zellen in den verschiedenen Untergruppen zu unterscheiden. Zum Beispiel TCR Stimulation der Zellen zu lange vor der Einwirkung von Treg induzierenden Bedingungen können ihre Induktion 16 hemmen. Dies kann ein Problem sein, weil retroviralen Expressions erfordert durch Stimulation von Zellen induzierten Zellteilung. Trotzdem haben wir eine effiziente Treg Induktion dieses Protokoll mit O / N activ gefundenation vor der retrovirale Transduktion.
Innerhalb dieser Protokolle, erfordert eine erfolgreiche Anwendung mehrere Faktoren zurückzuführen. Hohe Titer-Retrovirus Präparate benötigen effiziente Transfektion der HEK 293T-Zellen so qualitativ hochwertige DNA und präzise vorbereitet 2x HBS sind wichtig. Darüber hinaus muss die Zelldichte der HEK 293T-Zellen etwa 50% am Punkt der Transfektion zu sein, weil eine gute Expression der transfizierten DNA erfordert, dass die Zellen aktiv wachsen, und dies verhindert werden, wenn die Zellen zu spärlich oder dicht sind. Zellen, die bei der optimalen Dichte während der Transfektion sollten Einmündung an einem gewissen Punkt während der Virussammlung Schritte erreichen, aber sie werden auch weiterhin mit hohem Titer Virusstämme den ganzen Weg bis zum letzten Kollektion produziert. Effiziente Differenzierung der T - Helferzellen erfordert eine gute Zellqualität gewährleisten , so dass isolierte Zellen auf die Reinheit sind in 1 dargestellt ist . In ähnlicher Weise ist die Qualität der Zellen hängt von der Mäuse from, die sie isoliert wurden. Für diese Studien haben wir 6-8 Wochen alte C57BL / 6-Mäusen verwendet. Ältere Mäuse haben weniger naive Zellen und andere Stämme in ihrer Differenzierung unterscheiden. Beispielsweise BALB / c - Mäuse sind anfälliger für Th2 - Antworten als C57BL / 6 - Mäusen 17 so wie oben erwähnt, C57BL / 6 - T - Zellen kann schwierig sein , eine Th2 - Antwort zu induzieren. Zusätzlich kann jeder der Differenzierungsbedingungen können leicht von Labor zu Labor variieren und die Wirkung von Gen-Überexpression kann in nur suboptimale Bedingungen offensichtlich werden so Cytokin-Konzentrationen in den verschiedenen Polarisationszustände müssen titriert werden. Schließlich Wirkungen des überexprimierten Gens oder die Polarisationsbedingungen auf die Zellproliferation können die Transduktionseffizienz beeinflussen so Meßeffekte des Gens von Interesse erfordern kann das Timing und die Konzentration der polarisierenden Reagenzien zu optimieren. Die Optimierung all dieser Faktoren sollten mit diesem System zu informativen Ergebnissen führen.
Offenlegungen
The authors have no conflicting interest in the publication of this work.
Danksagungen
This work was supported by a Biotechnology and Biological Sciences Research Council (BBSRC) grant (BB/H018573/1) and a BD Biosciences grant.
Materialien
| Name | Company | Catalog Number | Comments |
| RPMI | Sigma | R8758 | |
| DMEM | Sigma | D5671 | |
| Penicillin Streptomycin solution | Sigma | P4333 | |
| L-Glutamine | Sigma | G7513 | |
| β-mercaptoethanol | Sigma | M3148 | |
| DPBS | Sigma | D8537 | |
| MIG vector | Addgene | Plasmid 9094 | |
| pCL-Eco vector | Addgene | Plasmid 12371 | |
| Cell strainer | BD Falcon | 352350 | |
| Magnetic beads mouse CD4 cell kit | Invitrogen (Dynabeads) | 11415D | |
| Streptavidin Beads | Miltenyi Biotech | 130-048-102 | |
| MS cell separation columns | Miltenyi Biotech | 130-042-201 | |
| LS cell separation columns | Miltenyi Biotech | 130-042-401 | |
| CD25 Biotenylated MAb | BD Biosciences | 85059 | clone 7D4 |
| CD62L Biotenylated MAb | BD Biosciences | 553149 | clone MEL-14 |
| Polybrene (Hexadimethrine Bromide) | Sigma | 107689 | |
| Anti-CD3 | eBiosciences | 16-0031-85 | clone 145-2C11 |
| Anti-CD28 | eBiosciences | 16-0281-85 | clone 37.51 |
| Anti-IL-4 | BD Biosciences | 559062 | clone 11B11 |
| Anti-IFN-gamma | BD Biosciences | 559065 | clone XMG1.2 |
| Anti-IL-2 | BD Biosciences | 554425 | cloneJES6-5H4 |
| Recombinant IL-12 p70 | eBiosciences | 14-8121 | |
| Recombinant IL-4 | BD Biosciences | 550067 | |
| Recombinant TGF-beta | eBiosciences | 14-8342-62 | |
| Recombinant IL-6 | eBiosciences | 14-8061 | |
| Recombinant IL-2 | eBiosciences | 14-8021 | |
| PMA | Sigma | P8139 | |
| Ionomycin | Sigma | I0634 | |
| Brefeldin A | eBiosciences | 00-4506 | |
| Paraformaldehyde | Sigma | 16005 | Paraformaldehyde is toxic so use appropriate caution when handling |
| Foxp3 staining buffer set | eBiosciences | 00-5523 | |
| Anti-CD4 FITC | eBiosciences | 11-0041 | clone GK1.5 |
| Anti-CD8a perCP-cy5.5 | eBiosciences | 45-0081-80 | clone 53-6.7 |
| Anti-MHCII PE | eBiosciences | 12-0920 | clone HIS19 |
| Anti-CD25 PE | eBiosciences | 12-0251-82 | clone PC61.5 |
| Anti-CD62L PE | eBiosciences | 12-0621-82 | clone MEL-14 |
| Anti-CD44 APC | eBiosciences | 17-0441 | clone IM7 |
| Anti-IFN-gamma FITC | eBiosciences | 11-7311-81 | clone XMG1.2 |
| Anti-IL-4 PE | BD Biosciences | 554435 | clone 11B11 |
| Anti-IL-9 PE or APC | eBiosciences/Biolegend | 50-8091-82/514104 | clone RM9A4 |
| Anti-IL-17a PE | BD Biosciences | 559502 | clone TC11-18H10 |
| Anti-Foxp3 APC or PE | eBiosciences | 17-5773-82/12-5773-80 | clone FJK-16s |
| NaCl | Sigma | S7653 | |
| KCl | Sigma | P9333 | |
| Na2HPO4-2H2O | Sigma | 71643 | |
| Dextrose/Glucose | Sigma | G7021 | |
| HEPES, free acid | Sigma | H3375 | |
| NH4Cl | Sigma | A9434 | |
| Disodium EDTA | Sigma | D2900000 | |
| KHCO3 | Sigma | 237205 | |
| CaCl2 | Sigma | C5670 |
Referenzen
- Baumjohann, D., Ansel, K. M. MicroRNA-mediated regulation of T helper cell differentiation and plasticity. Nat Rev Immunol. 13 (9), 666-678 (2013).
- Wilson, C. B., Rowell, E., Sekimata, M. Epigenetic control of T-helper-cell differentiation. Nat Rev Immunol. 9 (2), 91-105 (2009).
- Pearce, E. L., Poffenberger, M. C., Chang, C. H., Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science. 342 (6155), 1242454 (2013).
- Cherry, S. R., Biniszkiewicz, D., Van Parijs, L., Baltimore, D., Jaenisch, R. Retroviral Expression in Embryonic Stem Cells and Hematopoietic Stem Cells. Mol and Cell Biol. 20 (20), 7419-7426 (2000).
- Miller, A. D., Rosman, G. J. Improved retroviral vectors for gene transfer and expression. BioTechniques. 7 (9), 980-990 (1989).
- Grez, M., Akgün, E., Hilberg, F., Ostertag, W. Embryonic stem cell virus, a recombinant murine retrovirus with expression in embryonic stem cells. Proc Nat Acad Sci USA. 87 (23), 9202-9206 (1990).
- Naviaux, R. K., Costanzi, E., Haas, M., Verma, I. M. The pCL vector system: rapid production of helper-free, high-titer, recombinant retroviruses. J Virol. 70 (8), 5701-5705 (1996).
- Filipowicz, W., Bhattacharyya, S. N., Sonenberg, N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?. Nat Rev Genetics. 9 (2), 102-114 (2008).
- He, L., Hannon, G. J. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genetics. 5 (7), 522-531 (2004).
- Bernstein, E., Kim, S. Y., et al. Dicer is essential for mouse development. Nat Genetics. 35 (3), 215-217 (2003).
- Cobb, B. S., Hertweck, A., et al. A role for Dicer in immune regulation. J Exp Med. 203 (11), 2519-2527 (2006).
- Chong, M. M. W., Rasmussen, J. P., Rudensky, A. Y., Rundensky, A. Y., Littman, D. R. The RNAseIII enzyme Drosha is critical in T cells for preventing lethal inflammatory disease. J Exp Med. 205 (9), 2005-2017 (2008).
- Liston, A., Lu, L. F., O'Carroll, D., Tarakhovsky, A., Rudensky, A. Y. Dicer-dependent microRNA pathway safeguards regulatory T cell function. J Exp Med. 205 (9), 1993-2004 (2008).
- Zhou, X., Jeker, L. T., et al. Selective miRNA disruption in T reg cells leads to uncontrolled autoimmunity. J Exp Med. 205 (9), 1983-1991 (2008).
- Singh, Y., Garden, O. A., Lang, F., Cobb, B. S. MicroRNA-15b/16 Enhances the Induction of Regulatory T Cells by Regulating the Expression of Rictor and mTOR. J Immunol. 195 (12), 5667-5677 (2015).
- Sauer, S., Bruno, L., et al. T cell receptor signaling controls Foxp3 expression via PI3K, Akt, and mTOR. Proc Nat Acad Sci USA. 105 (22), 7797-7802 (2008).
- Yagi, J., Arimura, Y., Takatori, H., Nakajima, H., Iwamoto, I., Uchiyama, T. Genetic background influences Th cell differentiation by controlling the capacity for IL-2-induced IL-4 production by naive CD4+ T cells. Int Immunol. 18 (12), 1681-1690 (2006).
- Singh, Y., Garden, O. A., Lang, F., Cobb, B. S. MicroRNAs regulate T-cell production of interleukin-9 and identify hypoxia-inducible factor-2a as an important regulator of T helper 9 and regulatory T-cell differentiation. Immunology. 149, 74-86 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten