Method Article
Rétrovirale transduction des cellules T auxiliaires comme une approche génétique pour étudier les mécanismes contrôlant leur différenciation et la fonction
Dans cet article
Résumé
De nombreux systèmes expérimentaux ont été utilisés pour comprendre les mécanismes qui régulent la croissance et la fonction des lymphocytes T dans une réponse immunitaire. Ici, une approche génétique en utilisant la transduction rétrovirale est décrite, qui est économique, efficace du temps, et surtout, très instructif pour identifier les voies de régulation.
Résumé
Helper T cell development and function must be tightly regulated to induce an appropriate immune response that eliminates specific pathogens yet prevents autoimmunity. Many approaches involving different model organisms have been utilized to understand the mechanisms controlling helper T cell development and function. However, studies using mouse models have proven to be highly informative due to the availability of genetic, cellular, and biochemical systems. One genetic approach in mice used by many labs involves retroviral transduction of primary helper T cells. This is a powerful approach due to its relative ease, making it accessible to almost any laboratory with basic skills in molecular biology and immunology. Therefore, multiple genes in wild type or mutant forms can readily be tested for function in helper T cells to understand their importance and mechanisms of action. We have optimized this approach and describe here the protocols for production of high titer retroviruses, isolation of primary murine helper T cells, and their transduction by retroviruses and differentiation toward the different helper subsets. Finally, the use of this approach is described in uncovering mechanisms utilized by microRNAs (miRNAs) to regulate pathways controlling helper T cell development and function.
Introduction
The immune response must be highly regulated to eliminate infections but prevent attacks on self-tissue that lead to autoimmunity. Helper T cells play an essential role in regulating the immune response, and a great deal of effort has been undertaken to understand their development and function (illustrated in several recent reviews 1-3). However, many questions remain, and many approaches have been utilized to study the mechanisms controlling helper T cell development and function. These have ranged from the use of in vitro cell culture systems to whole animals. Cell culture systems, especially those using cell lines, offer the benefit of ease of use and the ability to generate large amount of material to do sophisticated biochemical analyses. However, they suffer from their limited ability to reproduce the actual conditions occurring in an immune response. In contrast, whole animal experiments offer the benefit of relevance, but they can suffer from difficulties in manipulation and the ability to perform precise controls in addition to their large costs and ethical implications. Nevertheless, the vast majority of helper T cells studies today still require the use of whole animal experiments involving primary T cells because of the inability of cell lines to duplicate the exact steps occurring in the whole animal. Therefore, it is essential to utilize cost effective approaches that are highly informative.
Genetics is one powerful tool to study helper T cell development and function, yet traditional methods involving gene knockouts or transgenes are time consuming and expensive so they are often out of reach of small labs. However, retroviral transduction offers a powerful, rapid and, cost effective genetic approach to study the mechanisms of specific gene products. Therefore, it is commonly used in papers studying helper T cell development and function.
We have optimized a procedure for retroviral transduction of helper T cells. It utilizes the pMIG (Murine stem cell virus-Internal ribosomal entry site-Green fluorescent protein) retroviral expression vector, in which the gene of interest can be cloned and thereby expressed from the retrovirus long terminal repeat (LTR) 4. In addition, downstream of the inserted gene of interest is an internal ribosome entry sequence (IRES) followed by the green fluorescent protein (GFP) gene so transduced cells can easily be followed by their expression of GFP. The vector was originally derived from the Murine Stem Cell Virus (MSCV) vectors, which contain mutations in repressor binding sites in the LTRs making them resistant to silencing and thus, giving high expression in many cell types including helper T cells 5,6. Production of high titer retrovirus requires a simple transient transfection protocol of human embryonic kidney (HEK) 293T cells with the MIG vector and a helper virus vector that expresses the retroviral GAG, Pol, and Env genes. For this the pCL-Eco helper virus vector 7 works well in producing high titer replication incompetent retroviruses.
Here these protocols for retroviral production and transduction of primary murine T cells are described in addition to some of our results using this approach to study miRNA regulation of gene expression controlling helper T cell differentiation. miRNAs are small RNAs of approximately 22 nucleotides in length that post-transcriptionally regulate gene expression by targeting homologous sequences in protein encoding messenger RNAs and suppressing translation and inducing message instability 8,9. miRNAs play critical roles in developmental gene regulation. They are essential in the earliest stages of development, as embryos that cannot produce miRNAs die at a very early stage 10. In addition miRNAs are important later on in the development of many tissues. They are thought to function by fine-tuning the expression of genes required for developmental programs 1. In helper T cells miRNAs play multiple roles and are required for regulatory T cell (Treg) development 11-14. We used retroviral transduction as a means to dissect the mechanisms of miRNA regulation of Treg differentiation 15. Through such studies important individual miRNAs were determined by retroviral-mediated overexpression. Subsequently, relevant genes regulated by these miRNAs were identified in order to understand the molecular pathways regulated by miRNAs in helper T cell differentiation.
Protocole
Tous les travaux de la souris effectués dans ces protocoles a été réalisée selon les procédures scientifiques Animaux Loi, Royaume-Uni en vertu de l'animal Licence du projet 70/6965.
1. rétrovirale production
Avant de continuer d'obtenir toutes les approbations nécessaires à la production d'organismes génétiquement modifiés et l'utilisation de retrovirus dans les cellules de mammifères.
- La croissance des cellules HEK 293T
- Cultiver les cellules HEK 293T sur 10 cm des boîtes de culture tissulaire en milieu HEK 293T (Modified Eagle Medium (DMEM de Dulbecco) avec 10% de sérum de veau fœtal (FBS), 100 unités / ml Pénicilline 0,1 mg / ml de streptomycine et 2 mM de L-glutamine) . Pour passage cellulaire général, les cellules fractionnées 1:10 quand ils atteignent la confluence en enlevant moyen et pipetage des cellules de la plaque avec un milieu HEK 293T frais.
NOTE: Les cellules doivent atteindre la confluence dans 2-3 jours. cellules 293T HEK attachent vaguement à la plaque de sorte trypsinisation est pas nécessaire. - 24 heures avant la transfection, diviser un confluePlaque de cellules nt 1:10 à une plaque de 10 cm (une plaque par transfection) de sorte que le lendemain, les cellules sont confluentes à environ 50%.
- Cultiver les cellules HEK 293T sur 10 cm des boîtes de culture tissulaire en milieu HEK 293T (Modified Eagle Medium (DMEM de Dulbecco) avec 10% de sérum de veau fœtal (FBS), 100 unités / ml Pénicilline 0,1 mg / ml de streptomycine et 2 mM de L-glutamine) . Pour passage cellulaire général, les cellules fractionnées 1:10 quand ils atteignent la confluence en enlevant moyen et pipetage des cellules de la plaque avec un milieu HEK 293T frais.
- Transfection par Calcium Phosphate Précipitations
- Environ 1 h avant la transfection, éliminer le milieu des cellules et ajouter soigneusement 9 ml de milieu HEK 293T fraîches pour empêcher les cellules de désolidarisation de la plaque.
- Préparer 2x Hepes Buffered Saline (2x HBS) et une nouvelle M CaCl2 solution à 2,5 , comme décrit dans le tableau 1. Décongeler les stocks d'ADN. Pour les transfections les plus efficaces d'utiliser l'ADN plasmidique de la qualité de préparation.
- Dans un 6 ml à fond rond de 15 ml ou tube conique ajoute 5 pg d'ADN rétroviral (pMIG) 4, 5 pg d'ADN de virus Helper (PCL-Eco) 7 et H 2 O à 420 ul. Ajouter 80 ul de 2,5 M de CaCl2 en portant le volume final à 500 ul.
Note: Ceci avec l'étape suivante (ajout de 2x HBS) peut être fait sur un banc régulier aussi longtemps que ster généraletechnique ile est utilisé. - Ajouter lentement 500 pi de goutte 2x HBS à goutte au mélange d'ADN ci - dessus tout en tourbillonner doucement pour que la solution est mélangée en continu et le capo 4 précipite dans les cristaux même taille.
- Transférer vers une hotte de culture tissulaire et ajouter lentement le mélange CaPO 4 de l' ADN (1 ml) goutte à goutte à 9 ml de milieu recouvrant les cellules tout en agitant continuellement et doucement la plaque. Encore une fois, veillez à ne pas détacher les cellules de la plaque. Placez les cellules de nouveau dans l'incubateur.
NOTE: A ce stade , le capo 4 précipité sera facilement visible sous un microscope sous forme de petits cristaux de la taille des bactéries. Ceux-ci sont facilement visibles après 30-60 min lorsque les cristaux ont eu la chance de se déposer au fond de la plaque.
- Collection de virus dans les surnageants de culture.
- Le lendemain (partout 12-24 h après la transfection) éliminer le milieu et nourrir les cellules avec 10 mlde milieu HEK 293T frais une fois de plus en faisant attention à ne pas déloger les cellules de la plaque.
NOTE: Cela dilue les substances inhibitrices lymphocytaires que les cellules HEK 293T sécrètent dans le milieu au cours de la transfection. - Le soir de la deuxième journée (~ 24 heures après transfection) cellules avec 3,5 ml de milieu HEK 293T frais nourrir. Veillez à ce que la plaque est placée exactement au même niveau dans l'incubateur de sorte qu'un côté ne reste pas sec.
- Collecter moyen ~ 12 heures plus tard (conserver à 4 ° C) et d'alimentation avec 3,5 ml de milieu HEK 293T frais. Répétez collection 2 plusieurs fois à environ 12 intervalles de h de telle sorte que 10 ml de milieu est recueilli. Ceci est le stock de virus.
- Spin sur toutes les cellules HEK 293T résiduelles et les débris cellulaires par centrifugation à 600 xg pendant 5 min. Vous pouvez également filtrer en utilisant un filtre à seringue de 0,45 um à faible liaison aux protéines,. virus de magasin à 4 ° C, et pour les meilleurs titres, utiliser dans un jour ou deux, comme le titre diminuera lentement à 4 ° C. Ne frEeze, car cela diminue significativement le titre.
- Le lendemain (partout 12-24 h après la transfection) éliminer le milieu et nourrir les cellules avec 10 mlde milieu HEK 293T frais une fois de plus en faisant attention à ne pas déloger les cellules de la plaque.
2. Isolement du primaire Naïf cellules T CD4 +
- Isolement des cellules leucocytaires
- Euthanasier souris par dislocation cervicale, CO 2 asphyxie, ou un autre protocole humanitaire appropriée aux règles de manipulation des animaux de l'institution.
- Disséquer souris fraîchement euthanasiés et enlever la rate et de la lymphe souhaitée nœuds 15. Placer les organes dans les puits d'un tissu plaque de culture à 6 puits contenant le milieu R10 (milieu RPMI avec 10% inactivé par la chaleur de FBS, 100 unités / ml de pénicilline, 0,1 mg / ml de streptomycine, 2 mM de L-glutamine et 0,1% de β-mercaptoéthanol) . Utiliser une hotte de culture cellulaire pour la dissection des souris et toutes les manipulations ultérieures pour réduire au minimum risque de contamination dans les cultures.
REMARQUE: Conservez le moyen R10 froid et effectuer toutes les étapes de purification en aval à 4 ° C. - Placer un 70 um culture cellulaire crépine dans un 50 ml de tube conique contenant environ 5 ml de milieu R10. Utilisez un filtre pour la rate et les ganglions lymphatiques de jusqu'à trois souris.
- Ajouter les ganglions lymphatiques et la rate au tamis cellulaire et macérer avec l'extrémité d'un piston de la seringue de 5 ml. Rincer avec 1-2 ml de milieu R10.
- Transfert des cellules dans un tube conique de 15 ml et porter le volume à 14 ml avec R10. Centrifuger à 600 g pendant 5 min à 4 ° C. Rejeter le surnageant en le versant hors d'un mouvement propre pour éviter de perturber le culot cellulaire.
- Ajouter 2 ml de froid (4 ° C) , la lyse des globules rouges du tampon (tableau 1) à chaque tube. Mélanger doucement pendant 3,5 min, en gardant le tube sur la glace.
NOTE: Le moment de la lyse des globules rouges est essentielle pour prévenir la mort des lymphocytes. Par conséquent, le moment exact de chaque lot de tampon de lyse des globules rouges doit être optimisée. - Ajouter ≈12-13 ml de milieu R10. Immédiatement centrifugeuse et éliminer le surnageant comme à l'étape 2.1.5. Effectuez les étapes de lavage 2x plus d'esprith R10 moyen pour éliminer tout résidu de tampon de lyse des globules rouges à partir des cellules et d'éviter la mort des lymphocytes.
- Compter les cellules dans un hémocytomètre dilution 1:20 en bleu trypan pour déterminer le rendement des cellules viables. Attendez environ 8-10 x 10 7 cellules par souris.
- Isolement des cellules T CD4 + en utilisant des billes magnétiques Kit pour supprimer CD8 +, CD11b +, CD16 / 32 +, CD45R +, CMH de classe II + et Ter-119 + cellules.
- Aliquoter 8-10 x 10 7 cellules de l' étape 2.1.8 par 15 ml de tube et centrifuger à 600 xg pendant 5 min à 4 ° C conique. Verser le surnageant avec un mouvement propre pour éviter de perturber le culot cellulaire. Resuspendre les cellules dans chaque tube dans 100 pi de chaleur FBS inactivé puis ajouter 100 ul d'anticorps mélange du kit. Incuber pendant 30 min à 4 ° C avec agitation douce sur un rouleau.
- Alors que les cellules ci-dessus sont en incubation, préparer les perles.
- Remettre les billes dans le flacon par tourbillonnement pendant> 30 sec transfèrent ensuite 1 ml de billes par 8-10 x 10 7 cellules préparées à un tube conique de 15 ml. Ajouter 2 ml de milieu R10 par ml de perles et mélanger délicatement.
- Placer le tube dans l'aimant pendant 1 min, puis jeter le surnageant. Retirer le tube des billes magnétiques et remettre en suspension dans 4 ml de milieu R10. Cette quantité de billes est suffisante pour deux cycles d'incubation.
- Laver les cellules à la fin de l'incubation de l'anticorps (étape 2.2.1) en ajoutant 10 ml de milieu R10 par tube. Doucement bien mélanger avec tourbillonnant des cellules du tube et centrifuger à 600 xg pendant 5 min à 4 ° C. Verser le surnageant avec un mouvement propre pour éviter de perturber le culot cellulaire. Resuspendre les cellules dans 1 ml de milieu R10.
- Ajouter 2 ml des perles lavées de l'étape 2.2.2.2 (la moitié de la quantité préparée pour chaque tube) pour chaque tube de cellules traitées avec l'anticorps et on incube pendant 30 min à 4 ° C avec agitation douce sur un transbordeurller.
- Remettre en suspension le mélange de cellules perles par pipetage 5 fois avec une pipette contenant une ouverture de pointe étroite. Éviter de faire mousser. Placer le tube dans l'aimant de perles pendant 2 min, puis transférer le surnageant contenant les cellules sélectionnées négativement à un nouveau tube. Gardez ces cellules, car ils sont la population CD4 +.
- Répétez la sélection négative une fois de plus. Spin cellules de l'étape 2.2.5 à 600 xg pendant 5 min à 4 ° C. Décanter le surnageant comme à l'étape 2.2.3 et remettre en suspension dans 1 ml de milieu R10. Suivez les étapes 2.2.4 et 2.2.5 à nouveau. Après la sélection finale de billes magnétiques, compter les cellules pour déterminer la récupération (rendements typiques sont de 15-20 x 10 6 cellules par 10 8 leucocytes).
- Isolement des cellules T CD4 + Naïf (CD25 - et CD62L haute) l' utilisation des colonnes de séparation de cellules
- Centrifugeuse cellules T CD4 + à 600 g pendant 5 min à 4 ° C et remettre en suspension dans 150-200 pi deMoyen R10 par 10 8 cellules. Ajouter 2 ul d'actions biotinylé CD25 anticorps monoclonal (clone 7D4). Incuber pendant 30 min à 4 ° C avec agitation douce sur un rouleau.
- Laver les cellules en ajoutant 10 ml de tampon de colonne de séparation de cellules (tableau 1). Centrifuger à 600 g pendant 5 min à 4 ° C. Retirez autant surnageant que possible et estimer le volume de tampon / cellules restantes. Remettre en suspension jusqu'à un volume final d'environ 90 ul pour 10 7 cellules.
- Ajouter 20 ul de billes de streptavidine par 10 7 cellules et mélanger avec flicks douces. Incuber pendant 15 min à 4 ° C.
- Alors que les cellules sont en incubation, préparer les colonnes de séparation de milieu cellulaire (MS) pour l'approche manuelle. Chaque colonne MS conserve 10 7 cellules, et depuis les cellules CD25 + représentent généralement environ 10% de CD4 + cellules totale, utilisez 1 colonne par 10 8 cellules T CD4 +. Ajouter 500 pi de tampon de la colonne de séparation de cellules dans la colonneet laisser couler à travers. Répétez 2 fois plus.
- A la fin de cellule / perle incubation, laver les cellules en ajoutant 10 ml de tampon de la colonne de séparation des cellules et centrifugation à 600 g pendant 5 min à 4 ° C. Resuspendre les cellules dans 500 pi de séparation cellulaire tampon de la colonne par 10 8 cellules, mais toujours utiliser 500 pi s'il y a moins de cellules.
- Appliquer 500 ul de cellules / billes en suspension dans la colonne et de recueillir le débit à travers. Passez ce sur la colonne 1 plus de temps et de recueillir l'écoulement à travers une fois de plus. Rincer la colonne 3 fois avec 500 pi de tampon de la colonne de séparation des cellules, en ajoutant chaque flux au travers de ces rinçages aux cellules recueillies. Ce sont les CD25 - cellules. Compter les cellules pour déterminer le rendement.
- Si Tregs (cellules CD25 +) sont souhaitées, isoler de la manière suivante.
- Retirer la colonne du séparateur et la maintenir au-dessus d'une ouverture universelle tubulaire en prenant soin de maintenir la stérilité. pipette rapidement 500 pi de tampon de séparation des cellules sur le collonne et rincer fermement la fraction positive, en utilisant le piston fourni avec la colonne.
- Répétez la procédure de rinçage 2 fois plus. Passez la fraction positive sur une colonne de séparation de cellules fraîches MS et jeter ce flux continu. rincer fermement les cellules positives à trois reprises, comme avant et centrifuger les cellules à 600 xg pendant 5 min à 4 ° C les cellules Resuspendre dans 1 ml de milieu R10 et compter pour déterminer le rendement.
- Pour obtenir CD25 - CD62L cellules haute T, centrifugeuse CD25 - lymphocytes T isolés ci - dessus à l' étape 2.3.6 à 600 xg pendant 5 min à 4 ° et remettre en suspension dans 150-200 ul de milieu R10 par 10 7 cellules. Ajouter 5 pl d'actions biotinylé anticorps monoclonal CD62L (clone MEL-14) et incuber pendant 30 min à 4 ° C en mélangeant doucement sur un rouleau comme avant.
- Effectuer lavage, Streptavidin perle de liaison, et la préparation de la colonne de séparation des cellules comme décrit pour Treg protocole d'isolement (2.3.7). Cet emploi du tempsla grande colonne de séparation de cellules (LS), qui a une capacité de 10 8 cellules.
- Puisque les cellules CD62L haute T représentent généralement environ 60-70% de CD25 - cellules, utilisez 1 LS colonne de séparation de cellules par 10 8 cellules. Ajouter le mélange de cellules / bourrelet à LS colonne de séparation cellulaire comme décrit dans l'étape 2.3.6 - cette fois jeter le flux final par le biais et la colonne rinçages. Recueillir les cellules CD62L haute T comme décrit à l' étape 2.3.7 pour la collecte de cellules CD25 +.
- Centrifuger les cellules à 600 xg pendant 5 min à 4 ° C. Resuspendre cellules dans 1 ml de R10 et comptent pour déterminer le rendement. Diluer à 0,75-1 X10 6 cellules par ml dans un milieu R10.
- Analyser la pureté des cellules par tri cellulaire activé par fluorescence (FACS).
- Stratégie de coloration FACS
- Pour les cellules pré et post toutes les étapes d'isolement, tache avec CD4-FITC, CD8a-PerCP-Cy5.5 (helper et T cytotoxiques cellules), et MHCII-PE (CMH de classe II de cellules exprimant).
- Pour les cellules pré et post isolement de CD25, tache avec CD4-FITC et CD25-PE (Tregs par rapport aux autres cellules T auxiliaires).
- Pour les cellules pré et post CD62L tache d'isolement avec CD4-FITC, CD62L-PE et CD44-APC (naïve par rapport aux cellules mémoire et effecteur T auxiliaires).
- Pour chaque lieu d'analyse 10 5 cellules dans un puits d'une plaque à fond en U 96. Centrifuger à 600 g pendant 5 min à 4 ° C. Verser le milieu et laver les cellules une fois avec 200 DPBS ul. Centrifugeuse comme ci-dessus et versez hors DPBS.
- Ajouter 50 ul de DPBS par puits et 0,5 ul de chaque anticorps (comme indiqué dans 2.4.1) et incuber à température ambiante pendant 30 min dans l'obscurité pour éviter le blanchiment du marqueur fluorescent.
- Laver les cellules 2x avec DPBS comme dans 2.4.2 et analyser immédiatement un cytomètre de flux en utilisant des protocoles et des directives spécifiques à l'instrument à portée de main.
NOTE: Après l'étape d'isolement final d'une bonne préparation, 90-95% des cellules serontêtre CD4 + CD25 - CD62L cellules haute T.
- Stratégie de coloration FACS
3. rétrovirale transduction des cellules activées T CD4 + et leur différenciation en spécifiques T Helper sous - ensembles
- rétrovirale transduction
NOTE: l'intégration rétrovirale et l'expression des gènes nécessite la division cellulaire. Par conséquent, les cellules T doivent être activées O / N.- Bien que l'isolement des cellules T naïves, manteau 24 et le tissu plaque de culture avec des anti-CD28 anticorps dilué dans du DPBS anti-CD3 et. Ajouter 250 ul par puits. Utilisez lutte anti-CD3 à 1 pg / ml. Utilisez anti-CD28 à 2 pg / ml si les cellules seront finalement différenciées sous Th0, Th1, Th2 et iTregs conditions. Utilisez anti-CD28 à 10 pg / ml pour les conditions th9 et Th17. Incuber pendant ~ 2 h à 37 ° C dans un incubateur de culture tissulaire.
- Juste avant la culture des cellules, enlever la solution d'anticorps et laver la plaque avec ~ 250 pi de DPBS par puits pour éliminer unbound anticorps. Veillez à ne pas laisser la plaque sécher afin de traiter un maximum de 6 puits à la fois. Retirer DPBS laver et ajouter 1 ml de cellules CD4 + T naïfs en milieu R10 à 0,75-1 x 10 6 cellules par ml. Activer les cellules O / N (14-16 h).
- Le jour, le centrifuger les cellules suivantes dans la plaque à 900 g pendant 5 min à -30 ° C à attacher les cellules au fond des puits.
- Collecter et enregistrer le milieu en faisant attention de ne pas déplacer les cellules, et le remplacer par le surnageant 1 ml de culture de virus préparé à partir du protocole de production de virus. Ne laissez pas les cellules sécher afin de traiter un maximum de 4 puits à la fois.
- A chaque puits , ajouter 1 pl de 8 mg / ml de polybrène et 10 pi de 1 M de HEPES à pH 7,5 à l' aide de l' absorption du virus et empêcher alcalinisation significatif dans le milieu ambiant du CO 2 lors de la centrifugation suivante. Centrifuger les cellules dans la plaque à 900 g pendant 90 min à 30 ° C
- Différenciation des cellules dans Specifiques sous-ensembles
- Retirez délicatement le virus surnageant de culture et le remplacer par 1 ml du milieu recueillies précédemment à l'étape 3.1.4, car il contient de l'IL-2 et d'autres facteurs T de croissance cellulaire. Ajouter les réactifs indiqués dans le tableau 2 et la culture des cellules pendant 3-4 jours pour différencier les cellules en sous-ensembles spécifiques.
- L' analyse des cellules
- Pour la coloration intracellulaire des cytokines, traiter les cellules avec 1 pg / ml chacun phorbol 12-myristate 13-acétate (PMA) et l'ionomycine pendant 4 heures. Au cours des 2 dernières heures de stimulation, ajouter 1 pg / ml de brefeldine A.
- Resuspendre les cellules du fond de chaque puits par pipetage de haut en bas plusieurs fois. Transférer environ 10 5 cellules à une plaque de 96 puits U inférieure (habituellement 100 pi du 1 ml de culture de cellules Th) pour la fixation et la coloration.
- Pour GFP coloration, fixer les cellules avec 100 pi de paraformaldehyde à 2% à la température ambiante pendant exactement 5 minutes, comme un temps d'incubation plus longue va blanchir la GFP and interférer avec Foxp3 coloration. Laver les cellules en ajoutant 100 ul de DPBS à chaque puits et on centrifuge à 600 g à 22 ° C pendant 5 min. Verser le surnageant.
Attention: paraformaldéhyde est toxique. Manipuler dans une hotte avec la peau et une protection oculaire. - Fixer les cellules à nouveau à l'aide de 100 pi de tampon 1x fixation fabriqué à partir du kit de coloration Foxp3 (1 volume de tampon de fixation à 3 volumes de diluant). Incuber les cellules pendant 45 min à température ambiante ou encore incuber à 4 ° C pendant 16 heures.
- Après fixation, les cellules perméabiliser par addition de 100 ul de tampon de perméabilisation de la même kit. Incuber à température ambiante pendant 30-45 min puis centrifuger à 600 g à 22 ° C pendant 5 min.
- Pour la coloration des anticorps, éliminer le tampon de fixation / perméabilisation et ajouter 50 pi de tampon de perméabilisation frais. Ajouter l'anticorps nécessaire dilué dans du tampon de perméabilisation à 0,5 pi par 50 ul de tampon par échantillon. Incuber pendant 30-45 min à température ambiante dans l'obscurité pour éviter le blanchiment de la grippeétiquette orescent.
- Ajouter 150 pi de tampon de perméabilisation et centrifuger à 600 g à 22 ° C pendant 5 min. Jeter le tampon de perméabilisation et ajouter 200 DPBS ul. Analyser un cytomètre de flux en utilisant des protocoles et des directives spécifiques à l'instrument à portée de main.
REMARQUE: Assurez - vous d'inclure des contrôles appropriés pour cytokine coloration tels que la coloration avec des anticorps de contrôle d'isotype, l' analyse de cellules non activées ou Th0 activées, etc.
Résultats
Le succès de ce système expérimental nécessite des populations très pures de cellules T et préparations de retrovirus à titre élevé. Les résultats représentatifs sont présentés ici à titre d' exemples d'expériences réussies. La figure 1 montre la pureté typique des populations pré- et post-sélectionnés à chaque étape du protocole d'isolement des cellules T auxiliaires naïves. La figure 2 et 3 illustrent l'analyse de la production de retrovirus par l' expression de la GFP dans les cellules HEK 293T transfectées (figure 2) et les cellules T transduites (figure 3). L' efficacité de la transfection des cellules HEK 293T peuvent varier considérablement avec les différentes constructions rétrovirales, mais souvent ne correspond pas avec le niveau de production de retrovirus observée avec le nombre de cellules GFP + T. En outre, le nombre de cellules GFP + T peut varier en fonction des conditions de polarisation. En outre, le mean niveau d'expression de la GFP et le gène inséré peut varier en fonction du nombre de copies de virus intégré, l'effet du site d'intégration sur la transcription, et des mécanismes de régulation post-transcriptionnel qui affectent la transcription virale.
Enfin, la figure 4 montre des résultats typiques que nous avons observés avec la différenciation des cellules T auxiliaires lorsque les miRNAs miR-15b / 16 sont surexprimés. Ces résultats montrent une partie de la variabilité qui peut se produire au sein d'une expérience individuelle des effets tellement vrais doivent être étayées par une analyse statistique de plusieurs expériences répétées en utilisant différentes préparations de cellules T auxiliaires. Dans ces expériences, les réponses Th2 peuvent être difficiles à observer dans la / 6 ligne C57BL utilisé ici parce qu'ils sont sujets à des réponses Th1. De même, l'IL-9 coloration peut être difficile à détecter dessus du fond. Par conséquent, il est impératif d'effectuer des contrôles d'isotype et mettre en place une compensation adéquate pour garantir un bon gating de l'expression des cytokines. Dans nos résultats , nous avons découvert que miR-15b / 16 améliore iTreg l' induction par inhibition de la voie de signalisation par suppression de l'expression des composants et Rictor mTOR 15 mTOR. miR-15b / 16 peut parfois influencer Th0, Th1, et la différenciation Th17 dans des expériences individuelles, mais il n'y a pas d'effet significatif lorsqu'il a examiné dans plusieurs expériences répétées. En revanche miR-15b / 16 surexpression ne supprime de manière significative la différenciation Th9 (voir référence 18).
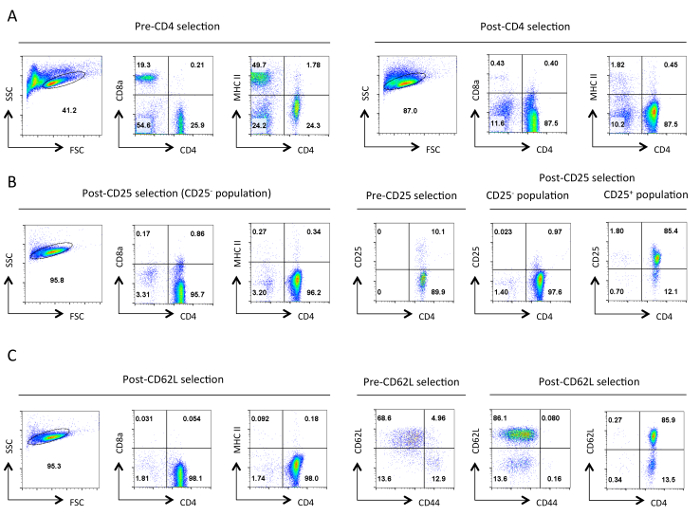
Figure 1. pureté typique de cellules T auxiliaires à chaque étape de l' isolement. D'écoulement représentant cytométrie résultats des antigènes indiqués sont présentés à partir de la porte de cellules vivantes désignées dans le Scatter Forward (FSC) et Side Scatter (SSC) parcelles. Sélection négative (A) avant et après-CD4. Les profils d'expression de CD4,CD8a et MHCII sont présentés. Ces exemples illustrent l'enrichissement des cellules T auxiliaires et de la perte de lymphocytes T cytotoxiques et du CMH de classe II des cellules exprimant. Une bonne purification devrait aboutir à ~ 90% de cellules T CD4 + à ce stade. (B) sélection de CD25. Sur la gauche sont les profils d'expression de CD4, CD8a et MHCII, et à droite sont les CD4 et l'expression de CD25 profils pré et post-sélection. À ce stade , > 95% des cellules CD25 sélectionnées négativement devrait être CD4 + CD25 -. (C) CD62L sélection. les profils d'expression de CD4, CD8A et CMHII sont indiqués sur la gauche. Sur la droite, les profils d'expression pour CD62L et CD44 sont présentés pour les cellules sélectionnées pré et post-CD62L ainsi que CD4 et CD62L profil d'expression des cellules de poste sélectionné. Après la sélection CD62L pratiquement toutes les cellules de mémoire (CD44 +) sont éliminés en laissant une population fortement enrichie de cellules T auxiliaires naïves , qui contient 10-15% des cellules effectrices (CD62L faible). Pour tousprofils FACS, paramètres équivalents et des échelles pour un paramètre spécifique ont été maintenues tout au long. Les nombres représentent le pourcentage de cellules dans une population fermée. La légère diminution de la taille des cellules après la sélection initiale est probablement due à une contrainte mécanique pendant le protocole. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
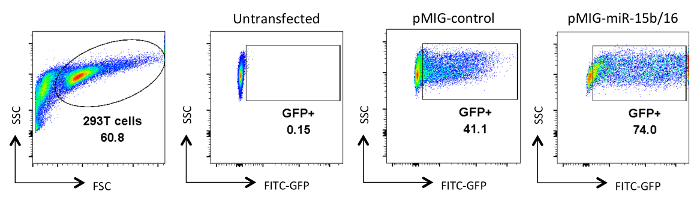
Figure 2. Analyse des cellules HEK 293T transfectées avec un retrovirus. L' expression de GFP dans les cellules est représenté HEK 293T qui étaient soit non transfectées ou transfectées et analysé après la collecte de surnageant de culture virale. l'analyse de la GFP a été effectuée sur des cellules vivantes de la porte sur le FSC et l'intrigue SSC dans le premier panneau. Les nombres représentent le pourcentage de cellules GFP + dans la région fermée. Typique tl' efficacité de ransfection varient entre 30-90%. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
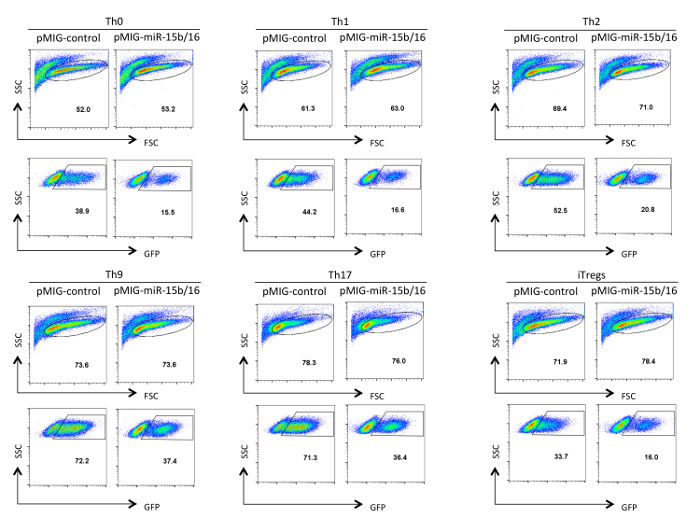
Expression de la GFP Figure 3. L' analyse des cellules T auxiliaires de type retrovirus transduites. Est représenté dans les cellules T auxiliaires rétroviraux transduites après différenciation dans Th0, Th1, Th2, Th9, Th17 et Treg conditions de polarisation pendant trois jours. L'analyse a été fermée sur des cellules vivantes et activées indiquées dans le panneau FSC / SSC. Les efficacités de transduction peuvent varier entre 10 à 75% en fonction de la construction et des conditions de polarisation. De même, l'intensité de fluorescence moyenne d'expression de la GFP peut varier. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
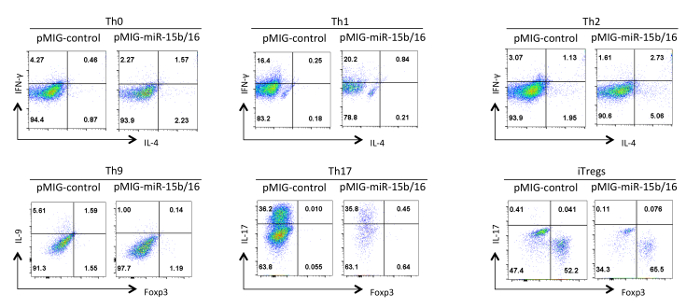
Figure 4. Effet de miR-15b / 16 surexpression sur la différenciation des cellules T helper dans différentes conditions de polarisation. Les profils de cytokine représentatifs sont présentés sur la GFP + population de cellules à partir de la figure 3. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Tableau 1:. Les tampons utilisés dans ces protocoles S'il vous plaît cliquer ici pour télécharger ce tableau comme une feuille de calcul Excel.
| Auxiliaireconditions de polarisation des lymphocytes T | ||
| Th0 | anti-IL-4 | 5 ug / ml |
| anti-IFN-γ | 5 ug / ml | |
| Th1 | recombinant-IL-12 | 20 ng / ml |
| anti-IL-4 | 5 ug / ml | |
| Th2 | IL-4 recombinante | 40 ng / ml |
| anti-IFN-γ | 5 ug / ml | |
| Th9 | Le TGF-β recombiné | 2,5 ng / ml |
| IL-4 recombinante | 40 ng / ml | |
| anti-IFN-γ | 10 pg / ml | |
| Th17 | Le TGF-β recombiné | 2,5 ng / ml |
| IL-6 recombinante | 50 ng / ml | |
| anti-IFN-γ | 5 ug / ml | |
| anti-IL-4 | 5 ug / ml | |
| anti-IL-2 | 5 ug / ml | |
| Tregs | Le TGF-β recombiné | 2,5 ng / ml |
| IL-2 recombinante | 5 ng / ml | |
Tableau 2: sous - ensemble de cellules conditions de polarisation T auxiliaires.
Discussion
Rétrovirale surexpression de gènes à médiation est un moyen puissant pour analyser la fonction des cellules T auxiliaires, comme le développement et la fonction est souvent déterminée par le niveau des régulateurs clés de l'expression. Cependant, une interprétation prudente des résultats est nécessaire parce que les niveaux d'expression significativement supérieurs à ceux du gène endogène peuvent introduire de nombreux artefacts. Par conséquent, cette technique devrait être combinée avec d'autres pour vérifier la pertinence de la fonction. Par exemple, la surexpression devrait être complété par une expression réduite en utilisant des ARNsi ou KOs géniques si disponible. Avec miARN, nous complétions expériences de surexpression avec ceux de blocage en utilisant des virus qui surexprimés miARN artificiel ciblant les sites qui ont agi comme des inhibiteurs compétitifs pour un miRNA 15. les cellules transduites rétroviraux peuvent également être utilisés dans des dosages biochimiques impliquant l'ARN et l'analyse des protéines. Toutefois, une limitation majeure de ces expériences est l'efficacité de la résolution de transductionUlting dans une population mixte de cellules transduites et non transduites. Par conséquent, ces essais seront très probablement besoin de tri de la GFP + population. Enfin, tests in vitro de différenciation doivent être combinées avec des expériences in vivo, et une façon d'y parvenir est par le transfert adoptif des cellules T transduites à des souris et à la suite de leur différenciation et leur effet sur la réponse immunitaire.
L'une des principales limitations de ce système est la taille du génome de l'ARN qui peut être encapsidé dans la capside rétrovirale. Dans notre expérience, la taille de l'insert maximum pour MIG système rétroviral qui donne une bonne production de virus est de 3-3,5 kb. Par conséquent, les gènes plus grands ne peuvent pas être analysés avec ce système, car ils donnent des titres viraux pauvres. Cependant, la plupart des gènes sont plus petites que cette dimension si ce système est utile pour une grande variété d'études génétiques.
Avec une transduction rétrovirale, plusieurs variantes dans le cadre de ces protocols ont été utilisés. De nombreux chercheurs ont utilisé des lignées cellulaires d'encapsidation qui expriment de manière stable les gènes rétroviraux (par exemple , référence 16). Cependant, nous avons obtenu les titres les plus élevés en utilisant des cellules HEK 293T standard par co-transfection du vecteur de virus auxiliaire pCL-Eco. L'isolement des cellules auxiliaires T naïfs peut également être réalisée par le tri, plutôt que le bourrelet et la séparation des cellules protocole de colonne magnétique de cellules, mais cela nécessite un accès à un trieur de cellules, et les coûts pour le temps de tri sont généralement plus élevées que les réactifs de perles. Enfin, il existe des variations sur les conditions d'activation utilisées pour différencier les cellules T auxiliaires dans les différents sous-ensembles. Par exemple, la stimulation du TCR des cellules trop longtemps avant l' exposition Treg conditions induisant peut inhiber leur induction 16. Cela peut être un problème parce que l'expression rétrovirale nécessite la division cellulaire induite par la stimulation des cellules. Néanmoins, nous avons trouvé efficace induction Treg utilisant ce protocole avec O / N activation avant la transduction rétrovirale.
Au sein de ces protocoles, l'application réussie nécessite plusieurs facteurs. préparations de retrovirus à titre élevé ont besoin transfection efficace des cellules HEK 293T d'ADN afin de haute qualité et précisément préparé 2x HBS sont importants. En outre, la densité cellulaire des cellules HEK 293T doit être d'environ 50% au point de transfection parce que la bonne expression de l'ADN transfectées exige que les cellules sont en pleine croissance, et cela va être inhibée si les cellules sont trop rares ou dense. Les cellules à la densité optimale pendant la transfection devraient atteindre la confluence à un moment donné au cours des étapes de collecte de virus, mais ils vont continuer à produire des stocks de virus à titre élevé tout au long de la dernière collection. Une différenciation efficace des cellules T auxiliaires nécessite une bonne qualité de la cellule afin d' assurer que les cellules sont isolées à la pureté illustrée sur la figure 1. De même, la qualité des cellules est dépendante de la souris from laquelle ils ont été isolés. Pour ces études, nous avons utilisé 6-8 semaines C57BL / 6 de souris. souris âgées peuvent avoir des cellules moins naïfs, et d'autres souches peuvent différer dans leur différenciation. Par exemple, des souris BALB / c sont plus sujettes à Th2 que C57BL / 6 17 manière indiquée ci - dessus, C57BL / 6 cellules T peuvent être difficiles à induire une réponse Th2. En outre, l'une des conditions de différenciation peut varier légèrement d'un laboratoire à, et l'effet de la surexpression du gène ne peuvent apparaître dans des conditions sous-optimales afin concentrations de cytokine dans les différentes conditions de polarisation peuvent avoir besoin d'être titrée. Enfin, les effets du gène surexprimé ou les conditions de polarisation sur la prolifération cellulaire peuvent influencer l'efficacité de transduction de sorte que les effets de mesure du gène d'intérêt peuvent nécessiter d'optimiser le temps et la concentration des réactifs de polarisation. Optimisation de tous ces facteurs devrait conduire à des résultats d'information avec ce système.
Déclarations de divulgation
The authors have no conflicting interest in the publication of this work.
Remerciements
This work was supported by a Biotechnology and Biological Sciences Research Council (BBSRC) grant (BB/H018573/1) and a BD Biosciences grant.
matériels
| Name | Company | Catalog Number | Comments |
| RPMI | Sigma | R8758 | |
| DMEM | Sigma | D5671 | |
| Penicillin Streptomycin solution | Sigma | P4333 | |
| L-Glutamine | Sigma | G7513 | |
| β-mercaptoethanol | Sigma | M3148 | |
| DPBS | Sigma | D8537 | |
| MIG vector | Addgene | Plasmid 9094 | |
| pCL-Eco vector | Addgene | Plasmid 12371 | |
| Cell strainer | BD Falcon | 352350 | |
| Magnetic beads mouse CD4 cell kit | Invitrogen (Dynabeads) | 11415D | |
| Streptavidin Beads | Miltenyi Biotech | 130-048-102 | |
| MS cell separation columns | Miltenyi Biotech | 130-042-201 | |
| LS cell separation columns | Miltenyi Biotech | 130-042-401 | |
| CD25 Biotenylated MAb | BD Biosciences | 85059 | clone 7D4 |
| CD62L Biotenylated MAb | BD Biosciences | 553149 | clone MEL-14 |
| Polybrene (Hexadimethrine Bromide) | Sigma | 107689 | |
| Anti-CD3 | eBiosciences | 16-0031-85 | clone 145-2C11 |
| Anti-CD28 | eBiosciences | 16-0281-85 | clone 37.51 |
| Anti-IL-4 | BD Biosciences | 559062 | clone 11B11 |
| Anti-IFN-gamma | BD Biosciences | 559065 | clone XMG1.2 |
| Anti-IL-2 | BD Biosciences | 554425 | cloneJES6-5H4 |
| Recombinant IL-12 p70 | eBiosciences | 14-8121 | |
| Recombinant IL-4 | BD Biosciences | 550067 | |
| Recombinant TGF-beta | eBiosciences | 14-8342-62 | |
| Recombinant IL-6 | eBiosciences | 14-8061 | |
| Recombinant IL-2 | eBiosciences | 14-8021 | |
| PMA | Sigma | P8139 | |
| Ionomycin | Sigma | I0634 | |
| Brefeldin A | eBiosciences | 00-4506 | |
| Paraformaldehyde | Sigma | 16005 | Paraformaldehyde is toxic so use appropriate caution when handling |
| Foxp3 staining buffer set | eBiosciences | 00-5523 | |
| Anti-CD4 FITC | eBiosciences | 11-0041 | clone GK1.5 |
| Anti-CD8a perCP-cy5.5 | eBiosciences | 45-0081-80 | clone 53-6.7 |
| Anti-MHCII PE | eBiosciences | 12-0920 | clone HIS19 |
| Anti-CD25 PE | eBiosciences | 12-0251-82 | clone PC61.5 |
| Anti-CD62L PE | eBiosciences | 12-0621-82 | clone MEL-14 |
| Anti-CD44 APC | eBiosciences | 17-0441 | clone IM7 |
| Anti-IFN-gamma FITC | eBiosciences | 11-7311-81 | clone XMG1.2 |
| Anti-IL-4 PE | BD Biosciences | 554435 | clone 11B11 |
| Anti-IL-9 PE or APC | eBiosciences/Biolegend | 50-8091-82/514104 | clone RM9A4 |
| Anti-IL-17a PE | BD Biosciences | 559502 | clone TC11-18H10 |
| Anti-Foxp3 APC or PE | eBiosciences | 17-5773-82/12-5773-80 | clone FJK-16s |
| NaCl | Sigma | S7653 | |
| KCl | Sigma | P9333 | |
| Na2HPO4-2H2O | Sigma | 71643 | |
| Dextrose/Glucose | Sigma | G7021 | |
| HEPES, free acid | Sigma | H3375 | |
| NH4Cl | Sigma | A9434 | |
| Disodium EDTA | Sigma | D2900000 | |
| KHCO3 | Sigma | 237205 | |
| CaCl2 | Sigma | C5670 |
Références
- Baumjohann, D., Ansel, K. M. MicroRNA-mediated regulation of T helper cell differentiation and plasticity. Nat Rev Immunol. 13 (9), 666-678 (2013).
- Wilson, C. B., Rowell, E., Sekimata, M. Epigenetic control of T-helper-cell differentiation. Nat Rev Immunol. 9 (2), 91-105 (2009).
- Pearce, E. L., Poffenberger, M. C., Chang, C. H., Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science. 342 (6155), 1242454 (2013).
- Cherry, S. R., Biniszkiewicz, D., Van Parijs, L., Baltimore, D., Jaenisch, R. Retroviral Expression in Embryonic Stem Cells and Hematopoietic Stem Cells. Mol and Cell Biol. 20 (20), 7419-7426 (2000).
- Miller, A. D., Rosman, G. J. Improved retroviral vectors for gene transfer and expression. BioTechniques. 7 (9), 980-990 (1989).
- Grez, M., Akgün, E., Hilberg, F., Ostertag, W. Embryonic stem cell virus, a recombinant murine retrovirus with expression in embryonic stem cells. Proc Nat Acad Sci USA. 87 (23), 9202-9206 (1990).
- Naviaux, R. K., Costanzi, E., Haas, M., Verma, I. M. The pCL vector system: rapid production of helper-free, high-titer, recombinant retroviruses. J Virol. 70 (8), 5701-5705 (1996).
- Filipowicz, W., Bhattacharyya, S. N., Sonenberg, N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?. Nat Rev Genetics. 9 (2), 102-114 (2008).
- He, L., Hannon, G. J. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genetics. 5 (7), 522-531 (2004).
- Bernstein, E., Kim, S. Y., et al. Dicer is essential for mouse development. Nat Genetics. 35 (3), 215-217 (2003).
- Cobb, B. S., Hertweck, A., et al. A role for Dicer in immune regulation. J Exp Med. 203 (11), 2519-2527 (2006).
- Chong, M. M. W., Rasmussen, J. P., Rudensky, A. Y., Rundensky, A. Y., Littman, D. R. The RNAseIII enzyme Drosha is critical in T cells for preventing lethal inflammatory disease. J Exp Med. 205 (9), 2005-2017 (2008).
- Liston, A., Lu, L. F., O'Carroll, D., Tarakhovsky, A., Rudensky, A. Y. Dicer-dependent microRNA pathway safeguards regulatory T cell function. J Exp Med. 205 (9), 1993-2004 (2008).
- Zhou, X., Jeker, L. T., et al. Selective miRNA disruption in T reg cells leads to uncontrolled autoimmunity. J Exp Med. 205 (9), 1983-1991 (2008).
- Singh, Y., Garden, O. A., Lang, F., Cobb, B. S. MicroRNA-15b/16 Enhances the Induction of Regulatory T Cells by Regulating the Expression of Rictor and mTOR. J Immunol. 195 (12), 5667-5677 (2015).
- Sauer, S., Bruno, L., et al. T cell receptor signaling controls Foxp3 expression via PI3K, Akt, and mTOR. Proc Nat Acad Sci USA. 105 (22), 7797-7802 (2008).
- Yagi, J., Arimura, Y., Takatori, H., Nakajima, H., Iwamoto, I., Uchiyama, T. Genetic background influences Th cell differentiation by controlling the capacity for IL-2-induced IL-4 production by naive CD4+ T cells. Int Immunol. 18 (12), 1681-1690 (2006).
- Singh, Y., Garden, O. A., Lang, F., Cobb, B. S. MicroRNAs regulate T-cell production of interleukin-9 and identify hypoxia-inducible factor-2a as an important regulator of T helper 9 and regulatory T-cell differentiation. Immunology. 149, 74-86 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon