Method Article
Eğitim için bir genetik Yaklaşım olarak yardımcı T hücrelerinin retroviral İletimi Mekanizmaları kendi Farklılaşma ve Kontrol Fonksiyonunun
Bu Makalede
Özet
Bir çok deney sistemleri, bir immün yanıt olarak T hücresi gelişimini ve fonksiyonunu düzenlemek mekanizmaları anlamak için kullanılmıştır. İşte retroviral transdüksiyon kullanarak genetik yaklaşım düzenleyici yolları belirlenmesinde, ekonomik zaman verimli ve en önemlisi, son derece bilgilendirici olan tarif edilmektedir.
Özet
Helper T cell development and function must be tightly regulated to induce an appropriate immune response that eliminates specific pathogens yet prevents autoimmunity. Many approaches involving different model organisms have been utilized to understand the mechanisms controlling helper T cell development and function. However, studies using mouse models have proven to be highly informative due to the availability of genetic, cellular, and biochemical systems. One genetic approach in mice used by many labs involves retroviral transduction of primary helper T cells. This is a powerful approach due to its relative ease, making it accessible to almost any laboratory with basic skills in molecular biology and immunology. Therefore, multiple genes in wild type or mutant forms can readily be tested for function in helper T cells to understand their importance and mechanisms of action. We have optimized this approach and describe here the protocols for production of high titer retroviruses, isolation of primary murine helper T cells, and their transduction by retroviruses and differentiation toward the different helper subsets. Finally, the use of this approach is described in uncovering mechanisms utilized by microRNAs (miRNAs) to regulate pathways controlling helper T cell development and function.
Giriş
The immune response must be highly regulated to eliminate infections but prevent attacks on self-tissue that lead to autoimmunity. Helper T cells play an essential role in regulating the immune response, and a great deal of effort has been undertaken to understand their development and function (illustrated in several recent reviews 1-3). However, many questions remain, and many approaches have been utilized to study the mechanisms controlling helper T cell development and function. These have ranged from the use of in vitro cell culture systems to whole animals. Cell culture systems, especially those using cell lines, offer the benefit of ease of use and the ability to generate large amount of material to do sophisticated biochemical analyses. However, they suffer from their limited ability to reproduce the actual conditions occurring in an immune response. In contrast, whole animal experiments offer the benefit of relevance, but they can suffer from difficulties in manipulation and the ability to perform precise controls in addition to their large costs and ethical implications. Nevertheless, the vast majority of helper T cells studies today still require the use of whole animal experiments involving primary T cells because of the inability of cell lines to duplicate the exact steps occurring in the whole animal. Therefore, it is essential to utilize cost effective approaches that are highly informative.
Genetics is one powerful tool to study helper T cell development and function, yet traditional methods involving gene knockouts or transgenes are time consuming and expensive so they are often out of reach of small labs. However, retroviral transduction offers a powerful, rapid and, cost effective genetic approach to study the mechanisms of specific gene products. Therefore, it is commonly used in papers studying helper T cell development and function.
We have optimized a procedure for retroviral transduction of helper T cells. It utilizes the pMIG (Murine stem cell virus-Internal ribosomal entry site-Green fluorescent protein) retroviral expression vector, in which the gene of interest can be cloned and thereby expressed from the retrovirus long terminal repeat (LTR) 4. In addition, downstream of the inserted gene of interest is an internal ribosome entry sequence (IRES) followed by the green fluorescent protein (GFP) gene so transduced cells can easily be followed by their expression of GFP. The vector was originally derived from the Murine Stem Cell Virus (MSCV) vectors, which contain mutations in repressor binding sites in the LTRs making them resistant to silencing and thus, giving high expression in many cell types including helper T cells 5,6. Production of high titer retrovirus requires a simple transient transfection protocol of human embryonic kidney (HEK) 293T cells with the MIG vector and a helper virus vector that expresses the retroviral GAG, Pol, and Env genes. For this the pCL-Eco helper virus vector 7 works well in producing high titer replication incompetent retroviruses.
Here these protocols for retroviral production and transduction of primary murine T cells are described in addition to some of our results using this approach to study miRNA regulation of gene expression controlling helper T cell differentiation. miRNAs are small RNAs of approximately 22 nucleotides in length that post-transcriptionally regulate gene expression by targeting homologous sequences in protein encoding messenger RNAs and suppressing translation and inducing message instability 8,9. miRNAs play critical roles in developmental gene regulation. They are essential in the earliest stages of development, as embryos that cannot produce miRNAs die at a very early stage 10. In addition miRNAs are important later on in the development of many tissues. They are thought to function by fine-tuning the expression of genes required for developmental programs 1. In helper T cells miRNAs play multiple roles and are required for regulatory T cell (Treg) development 11-14. We used retroviral transduction as a means to dissect the mechanisms of miRNA regulation of Treg differentiation 15. Through such studies important individual miRNAs were determined by retroviral-mediated overexpression. Subsequently, relevant genes regulated by these miRNAs were identified in order to understand the molecular pathways regulated by miRNAs in helper T cell differentiation.
Protokol
Bu protokollerin yapılan tüm fare çalışma hayvan Proje Lisansı 70/6965 altında Hayvanlar Bilimsel Prosedürleri Yasası, UK göre yapılmıştır.
1. Retroviral Üretim
Önce takibata genetiği değiştirilmiş organizmalar ve memeli hücrelerinde retrovirüslerin kullanımını üretmek için gerekli tüm onayların alınması.
- HEK 293T hücrelerinin büyüme
- 10 cm doku kültürü HEK 293T ortamında yemekler HEK 293T hücreleri büyütün (% 10 fetal bovin serumu ile Dulbecco Modifiye Eagle Ortamı (DMEM) (FBS), 100 birim / ml penisilin, 0.1 mg / ml streptomisin, ve 2 mM L-glutamin) . Genel hücre geçişi için, bölünmüş hücreler 01:10 onlar orta kaldırarak ve taze HEK 293T orta plaka kapalı hücreleri pipetleme izdiham ulaştığınızda.
NOT: Hücreler 2-3 gün içinde izdiham ulaşmak gerekir. 293T HEK hücreleri yani trypsinization gerekli değildir plakaya gevşek takın. - 24 saatlik bir transfeksiyon önce, bir conflue bölünmüşErtesi gün hücreler,% 50 konfluent böylece 10 cm plaka (transfeksiyon için bir plaka) hücre 1:10 nt plaka.
- 10 cm doku kültürü HEK 293T ortamında yemekler HEK 293T hücreleri büyütün (% 10 fetal bovin serumu ile Dulbecco Modifiye Eagle Ortamı (DMEM) (FBS), 100 birim / ml penisilin, 0.1 mg / ml streptomisin, ve 2 mM L-glutamin) . Genel hücre geçişi için, bölünmüş hücreler 01:10 onlar orta kaldırarak ve taze HEK 293T orta plaka kapalı hücreleri pipetleme izdiham ulaştığınızda.
- Kalsiyum fosfat çökeltme yöntemiyle transfeksiyonu
- Yaklaşık 1 saat önce transfeksiyondan, hücrelerden orta kaldırmak ve dikkatle plaka koparma hücreleri önlemek için taze HEK 293T orta 9 ml ekleyin.
- 2x Hepes tamponlu tuz çözeltisi (2x HBA) ve Tablo 1 'de tarif edildiği gibi yeni bir 2.5 M CaCl2 çözeltisi hazırlayın., DNA stok çözülme. En verimli nakiller için plazmid hazırlık kalite DNA kullanın.
- 6 ml'lik yuvarlak tabanlı bir ya da 15 ml konik bir tüp içinde 5 retroviral DNA (pMIG) 4 ug, yardımcı virüs DNA (PCL-Eco) 7 5 ug, ve H2O 420 ul ilave edin. 500 ul son hacim getiren 2.5 M CaCl 2 80 ul ekleyin.
Not: Bu, bir sonraki aşama (2x HBS ilavesi) ile birlikte, genel ster sürece normal bir tezgah üzerinde yapılabilirile tekniği kullanılmaktadır. - Çözümü sürekli karıştırılır ve CaPO4 hatta boyutlu kristalleri çökeltileri şekilde hafifçe karıştırın yavas yukarıdaki DNA karışımına damla 2x HBS damla 500 ul ekleyin.
- Sürekli ve yavaşça plaka karıştırılırken hücreleri kapsayan ortamın 9 ml CaPO4 DNA karışımı (1 mi) damla damla ilave yavaş bir doku kültürü kaputu aktarın ve. Bir kez daha plaka hücreleri ayırmak için dikkatli olun. geri kuvöz içine hücreleri yerleştirin.
NOT: Bu noktada CaPO4 çökelti bakterilerin boyutu hakkında küçük kristaller halinde mikroskop altında kolayca görülebilir. Kristaller plakanın altına yerleşmek için bir şans oldu zaman bu kolayca 30-60 dakika sonra görülür.
- Kültür Süpernatantları Virüs toplanması.
- (Her yerde transfeksiyondan sonra 12-24 saat itibaren) Ertesi gün orta kaldırmak ve 10 ml hücreleri beslemekTaze HEK 293T orta bir kez daha plaka hücreleri çıkarmak için dikkatli olmak.
NOT: Bu HEK 293T hücreleri transfeksiyon sırasında ortama salgılar lenfosit inhibitör maddeleri dışarı sulandırır. - İkinci gün (~ 24 saat sonrası transfeksiyon) akşamı taze HEK 293T orta 3,5 ml hücreleri besler. bir tarafı kuru kalmaması, böylece plaka inkübatör tam seviyesine yerleştirilir dikkat edin.
- ~ 12 saat sonra (4 ° C'de mağaza) ve taze HEK 293T orta 3,5 ml yem orta toplayın. Tekrarlayın koleksiyon 2 kez daha kabaca orta yaklaşık 10 ml toplanan böylece 12 saat aralıkları. Bu virüs stok.
- 5 dakika boyunca 600 x g'de santrifüj kalıntı HEK 293T hücrelerin ve hücre artıklarının uzatmak. Seçenek olarak ise, bir 0.45 um, düşük protein bağlama, şırınga filtresi kullanılarak filtre. titre yavaşça 4 ° C'de azalacak olarak saklayın 4 ° C'de virüs ve en iyi titreleri için, bir veya iki gün içinde kullanın. fr etmeyinbu anlamlı titresi azaldıkça, eeze.
- (Her yerde transfeksiyondan sonra 12-24 saat itibaren) Ertesi gün orta kaldırmak ve 10 ml hücreleri beslemekTaze HEK 293T orta bir kez daha plaka hücreleri çıkarmak için dikkatli olmak.
Birincil naif CD4 + T hücrelerinin 2. İzolasyon
- Lökosit Hücrelerinin İzolasyonu
- Servikal dislokasyon CO 2 boğulma ya da kurumun hayvan taşıma kurallarına uygun diğer insani protokolü ile fareler Euthanize.
- Taze ötenazi fareler incelemek ve dalak kaldırmak ve arzu edilen lenf düğümleri 15. R10 ortamında (% 10 FBS, ısı, 100 birim / ml penisilin, 0,1 mg / ml streptomisin, 2 mM L-glutamin, ve% 0.1 β-merkaptoetanol ile RPMI ortamı) ihtiva eden bir 6 yuvalı doku kültür plakasının yuvaları içinde organları yerleştirin . kültürlerde kontaminasyon riskini en aza indirmek için fareler ve daha sonraki tüm manipülasyonlara diseksiyonu için bir hücre kültürü kaputu kullanın.
NOT: Soğuk R10 orta tutun ve 4 ° C'de tüm aşağı arıtma adımları uygulayın. - 5 içine 70 mikron hücre kültürü süzgeç yerleştirin0 mi R10 ortamının yaklaşık 5 ml ihtiva eden konik tüp. üçe kadar farelerin dalak ve lenf düğümleri, bir süzgeç kullanın.
- hücre süzgecinden dalak ve lenf düğümleri ekleyin ve 5 ml şırınga pistonu ucunu kullanarak macerate. R10 orta 1-2 ml ile durulayın.
- 15 ml konik tüp hücreleri aktarın ve R10 ile 14 ml hacim getirmek. 4 ° C'de 5 dakika boyunca 600 x g'de santrifüjleyin. Hücre pelet rahatsız önlemek için bir temiz hareketi ile kapalı dökerek süpernatant atın.
- Her tüpe, soğuk (4 ° C), kırmızı hücre lisis tampon maddesi (Tablo 1) 2 ml ilave edilir. Yavaşça buz tüpü tutarak, 3.5 dakika boyunca karıştırın.
NOT: kırmızı hücre lisis zamanlaması lömfositlerin ölümünü önlemek için önemlidir. Bu nedenle, kırmızı hücre parçalama tamponu her parti tam zamanlama optimize edilmesi gerekecektir. - R10 ortamının ≈12-13 ml ekleyin. Hemen santrifüj ve adım 2.1.5 deki gibi süpernatant atın. Daha fazla zekâ 2x yıkama adımları uygulayınH R10 ortamı hücrelerden herhangi bir kalıntı kırmızı hücre parçalama tamponunu çıkarın ve lenfositlerin ölümüne önlemek için.
- canlı hücre verimi belirlemek için tripan mavi 1:20 seyreltilmesiyle bir hemositometrede hücreleri sayın. Fare başına yaklaşık 8-10 x 10 7 hücre bekliyoruz.
- Manyetik boncuk Kit kullanarak CD4 + T hücreleri İzolasyonu CD8 +, CD11b +, CD16 / 32 +, CD45R +, MHC sınıf II + ve Ter-119 + Hücreler çıkarmak.
- Kısım adım 8-10 x 10 7 hücre 2.1.8 başına 15 ml konik tüp, 4 ° C'de 5 dakika boyunca 600 x g'de santrifüjleyin. Hücre pelet rahatsız önlemek için bir temiz hareketi ile Süpernatantı dökün. FBS, söz konusu takım antikor karışımı, 100 ul durdurulmuş ısı 100 ul her bir tüp içinde tekrar süspansiyon hücreleri. bir silindir nazik karıştırma ile 4 ° C'de 30 dakika süreyle inkübe edilir.
- Yukarıda sözü edilen hücreler inkübe olmasına rağmen, taneler hazırlamak.
- > 30 saniye boyunca girdaplanarak şişe içinde süspanse boncuklar daha sonra, 15 ml konik tüp 8-10 x 10 7 hazırlanan hücre başına boncuk 1 ml aktarın. boncuk ml başına R10 orta 2 ml ekleyin ve hafifçe karıştırın.
- Sonra süpernatantı atmak 1 dakika boyunca mıknatıs tüp yerleştirin. R10 orta 4 ml mıknatıs ve tekrar süspansiyon boncuk borusunu sökün. boncuk Bu miktar inkübasyon iki tur için yeterlidir.
- tüp başına R10 ortamı 10 ml ekleyerek antikor inkübasyon (Aşama 2.2.1) sonunda hücreler yıkanır. Yavaşça 4 ° C'de 5 dakika boyunca 600 x g'de santrifüj tüpü ve hücre döndürme ile iyice karıştırın. Hücre pelet rahatsız önlemek için bir temiz hareketi ile Süpernatantı dökün. R10 orta 1 ml yeniden süspanse hücreleri.
- antikor ile tedavi edilen hücrelerin her tüpe (her bir tüp için hazırlanan miktarda ½) aşama 2.2.2.2 yıkanır boncuk 2 ml ilave edilir ve bir ro nazik karıştırma ile 4 ° C'de 30 dakika inkübeller.
- nazikçe dar ucu açıklığı içeren bir pipet ile 5 kez pipetleme hücre boncuk karışımı tekrar süspansiyon. Köpürtmeyiniz. Daha sonra yeni bir tüpe olumsuz seçilen hücreleri ihtiva eden üst sıvıyı transferi 2 dakika boyunca boncuk mıknatıs tüp yerleştirin. Onlar CD4 + nüfus olarak, bu hücreleri tutun.
- Negatif Seçimi bir kez daha tekrarlayın. 4 ° C'de 5 dakika boyunca 600 x g'de aşama 2.2.5 hücreleri dönerler. R10 orta 1 ml adım 2.2.3 ve tekrar süspansiyon gibi Süpernatantı dökün. Takip yine 2.2.4 ve 2.2.5 adımları. Nihai manyetik boncuk seçiminden sonra, (tipik verimleri 10 8 lökositler başına 15-20 x 10 6 hücre vardır) kurtarma belirlemek için hücreleri saymak.
- Celi ayırma kolonu kullanılarak - Naif CD4 + T hücreleri (ve CD62L yüksek CD25) İzolasyonu
- 150-200 ul Santrifüj, CD4 + T 4 ° C'de 5 dakika boyunca 600 x g'de hücreleri ve tekrar süspansiyon10 8 hücre başına R10 araç. Hisse senedi biyotinile CD25 monoklonal antikor (klon 7D4) 2 ul ekleyin. bir silindir nazik karıştırma ile 4 ° C'de 30 dakika süreyle inkübe edilir.
- Hücre ayırma kolon tamponu (Tablo 1) 10 ml ilave edilerek hücreler yıkanır. 4 ° C'de 5 dakika boyunca 600 x g'de santrifüjleyin. mümkün olduğu kadar Süpernatantı ve kalan tampon / hücre hacmini tahmin ediyoruz. 10 7 hücre başına yaklaşık 90 | il son hacim olması için yeniden süspanse edin.
- 10 7 hücre başına Streptavidin boncuk 20 ul ekleyin ve hafif hareketleri ile karıştırın. 4 ° C'de 15 dakika boyunca inkübe edin.
- Hücreler kuluçka iken, manuel yaklaşım orta hücre ayırma (MS) sütunları hazırlamak. Her bir MS kolon 10 7 hücre korur ve CD25 + hücreleri, tipik olarak toplam CD4 + hücreleri, yaklaşık% 10 temsil ettiği, 10 8, CD4 + T hücreleri için 1 sütun kullanır. kolonuna hücre ayırma kolonu tampon 500 ul ekleve akmasına izin verin. 2 kez daha tekrarlayın.
- Hücre / boncuk İnkübasyonun sonunda hücre ayırma kolonu 10 ml tampon eklenmesi ve 4 ° C'de 5 dakika boyunca 600 x g'de santrifüj hücreleri yıkayın. 10 8 hücre başına hücre ayırma kolon tamponu 500 ul hücrelerin tekrar, ancak daha az hücre varsa yine 500 ul kullanın.
- kolona hücre / boncuk süspansiyonu 500 ul uygulayın ve akışı toplamak. Sütun 1 daha zamanla bu geçmek ve bir kez daha akışı toplamak. Her Toplanan hücrelere bu durulama akışı ekleyerek, sütun hücre ayırma kolon tamponu 500 ul ile 3 kez durulayın. Bunlar CD25 vardır - hücrelerdir. verimi belirlemek için hücreleri saymak.
- Treg'ler (CD25 + hücreler) istenirse, aşağıdaki şekilde izole.
- ayırıcıdan sütunu kaldırmak ve sterilite korumak için açık bir evrensel tüp alarak bakım yukarıda tutun. Hızla col üzerine hücre ayırma tampon 500 ul pipetUMN ve sıkıca sütuna ile birlikte piston kullanarak, pozitif fraksiyonu dışarı floş.
- yıkama prosedürünü 2 kez daha tekrarlayın. taze MS hücre ayırma kolonu üzerinde olumlu kısmını Pass ve bu flow-through atın. Sıkıca R10 ortamı, 1 ml 4 ° C'de tekrar süspansiyon hücreleri, 5 dakika boyunca 600 x g'de santrifüj öncesi hücreleri gibi pozitif hücreler üç kez yıkanması ve verimi belirlemek için sayısı.
- CD62L yüksek Tm hücreleri, santrifüj CD25 - - 10 7 hücre başına R10 ortamının 150-200 ul 4 ° ve tekrar süspansiyon, 5 dakika boyunca 600 x g'de aşama 2.3.6 yukarıda izole edilen T hücrelerinin CD25 elde edildi. Hazır biyotinile CD62L monoklonal antikor 5 ul (klon MEL-14) ilave edilir ve daha önce olduğu gibi, bir silindir üzerine nazik karıştırma 4 ° C'de 30 dakika inkübe edilir.
- Regülatör T izolasyon protokolü (2.3.7) için tarif edildiği gibi yıkama yapın Streptavidin bağlayıcı boncuk ve hücre ayırma kolonu hazırlanması. Bu kez kullanımı10 8 hücre kapasitesi geniş bir hücre ayırma (LS) sütunu.
- CD62L yüksek T hücreleri tipik olarak CD25 yaklaşık% 60-70 temsil ettiğinden - hücreler, 10 8 hücre başına 1 LS hücre ayırma sütunu kullanın. Adım 2.3.6 de açıklandığı gibi LS hücre ayırma kolonuna hücre / boncuk karışımı ekleyin - kolon durulama yoluyla ve bu kez nihai akışını atarak. CD25 + hücre toplanması için adım 2.3.7 açıklandığı gibi CD62L yüksek T hücrelerini toplayın.
- R10, 1 ml 4 ° C'de tekrar süspansiyon hücreleri, 5 dakika boyunca 600 x g'de santrifüj hücreleri ve verimi belirlemek için sayısı. R10 ortamında 0.75-1 X10 ml başına 6 hücreleri sulandırmak.
- Floresan aktive edilen hücre sınıflandırma (FACS) ile hücrelerin saflığı analiz edin.
- FACS boyama stratejisi
- Hücreler öncesi ve izolasyon tüm aşamaları, CD4-FITC, CD8a-PerCP-Cy5.5 ile leke (yardımcı ve sitotoksik T hücreleri) sonrası ve MHCI içinI-PE (MHC sınıf II ifade eden hücreler).
- ve hücreler öncesi CD25 izolasyonu, CD4-FITC ve CD25-PE (diğer yardımcı T hücreleri karşı Tregs) ile lekeyi sonrası.
- CD4-FITC, CD62L-PE ve (bellek ve efektör yardımcı T hücreleri karşı naif) CD44-APC ile ön hücreleri ve sonrası CD62L izolasyon leke.
- Her analiz yer için 96 oyuklu U tabanlı plaka iyi 10. 5 hücreleri. 4 ° C'de 5 dakika boyunca 600 x g'de santrifüjleyin. orta dökün ve 200 ul DPBS ile bir kez hücreleri yıkayın. Santrifüj yukarıdaki gibi ve DPBS dökünüz.
- floresan etiket beyazlatma önlemek için karanlıkta 30 dakika süre ile oda sıcaklığında göz başına DPBS 50 ul ve (2.4.1 gösterildiği gibi) her bir antikorun, 0.5 ul ekleyin ve inkübe edilir.
- Yıkama hücreleri 2.4.2 gibi DPBS ile 2x ve hemen eldeki cihaza özgü protokoller ve yönergeleri kullanarak bir akış sitometresinde analiz edin.
NOT: iyi bir hazırlık son izolasyonu adımından sonra, hücreler% 90-95 olacaktırCD62L yüksek T hücrelerini - CD4 + CD25 olacak.
- FACS boyama stratejisi
3. retroviral aktif CD4 + T hücrelerinin transdüksiyonu ve spesifik T yardımcı alt-grup halinde farklılaşmalarını
- Retroviral transdüksiyonun
NOT: Retroviral entegrasyon ve genlerin ifade hücre bölünmesini gerektirir. Bu nedenle, T-hücreleri O / N aktive edilmelidir.- naif T hücreleri izole ederken, kat anti-CD3 ve DPBS içinde seyreltilmiş anti-CD28 antikorları ile 24 gözlü bir doku kültür levhası. Oyuk başına 250 ul ekle. 1 ug / ml anti-CD3, anti kullanın. Hücreler sonuçta Th0 Th1, Th2 ve iTregs koşullar altında farklı olacaktır, eğer 2 ug / ml'de anti-CD28 kullanın. Th9 ve Th17 koşulları 10 ug / ml'de anti-CD28 kullanın. bir doku kültürü kuluçka makinesi içinde 37 ° C 'de yaklaşık 2 saat inkübe edin.
- Hemen önce hücrelerin kültürlenmesi için, antikor çözüm kaldırıp unbou çıkarmak için kuyu başına DPBS ~ 250 ul plakayı yıkayınND antikoru. Plaka böylece bir seferde 6 kuyu maksimum işlemek kurumasına izin vermemek için dikkatli olun. DPBS yıkama çıkarın ve ml başına 0.75-1 x 10 6 hücre R10 ortamı içinde saf CD4 + T hücrelerinin 1 ml. Hücreleri O / N (14-16 saat) etkinleştirin.
- 30 ° C'de 5 dakika boyunca 900 x g'de plaka Ertesi gün, hücreler, santrifüj kuyu altına hücreleri takmak için.
- Toplayın ve hücreleri yerinden dikkatli olmak orta kaydetmek ve virüs üretim protokolü hazırlanan 1 ml virüs yüzer kültürü ile değiştirin. Hücreler bu nedenle bir seferde 4 kuyuların maksimum işlemek kurumasına izin vermeyin.
- Her birine de bir virüs alımını yardımcı olmak ve ardından santrifüj içinde oda CO2 önemli alkalizasyon önlemek için 8 mg / ml polibren 1 ul ve 1 M HEPES pH 7.5, 10 ul ekle. 30 ° C 'de 90 dakika boyunca 900 x g'de plaka Santrifüj hücreleri
- Speci içine hücrelerin farklılaşmasıfic alt kümeleri
- Dikkatle virüs kültürü üst katmanını çıkarın ve IL-2 ve diğer T hücresi büyüme faktörleri içerdiği, Aşama 3.1.4 üzerinde toplanır, 1 ml aracı ile değiştirin. Belirli alt kümeleri hücreleri ayırt etmek için 3-4 gün Tablo 2 ve Kültür hücrelerinde, belirtilen reaktifler ekleyin.
- Hücrelerin analizi
- sitokinlerinin hücre içi boyanması için, / forbol 12-miristat 13-asetat (PMA), her ml 1 ug hücre tedavisi ve 4 saat iyonomisin. stimülasyon Son 2 saat boyunca brefeldin A 1 ug / ml ilave
- yukarı pipetleme ve birkaç kez aşağı her bir kuyunun dibinden tekrar süspansiyon hücreleri. Tespit ve boyama için (Th hücreleri kültürünün 1 ml, genellikle 100 ul), 96 oyuklu U tabanlı bir plaka yaklaşık olarak 10 5 hücre transfer edin.
- GFP boyanması için, GFP, bir ağartıcı Daha uzun bir enkübasyon süresi olarak, tam olarak 5 dakika boyunca oda sıcaklığında% 2 paraformaldehit, 100 ul hücreleri gidermeknd Foxp3 boyama ile müdahale. 5 dakika boyunca 22 ° C'de 600 x g'de de santrifüj her DPBS 100 ul ilave edilerek hücreler yıkanır. Süpernatantı dökün.
Dikkat: Paraformaldehyde toksiktir. cilt ve göz koruması ile bir davlumbaz idare. - Yine Foxp3 boyama kiti (seyreltici 3 hacimleri Fixation tampon 1 hacim) yapılan 100 ul 1x Fixation tampon kullanarak hücrelerin sabitleyin. Oda sıcaklığında, 45 dakika süre ile inkübe hücreleri ya da seçenek olarak 16 saat 4 ° C'de inkübe edin.
- Tespit edildikten sonra, aynı kiti permeabilization tampon 100 ul ekleyerek hücreleri permeabilize. daha sonra 5 dakika boyunca 22 ° C'de 600 x g'de santrifüj 30-45 dakika boyunca oda sıcaklığında inkübe edin.
- antikor boyama için, sabitleme / permeabilization tampon kaldırmak ve taze permeabilization tampon 50 ul ekleyin. Numune başına 0.5 ul 50 her ul tampona permeabilizasyon tampon maddesi içinde seyreltildi gerekli antikor ekleyin. grip ağartma önlemek için karanlıkta, oda sıcaklığında 30-45 dakika inkübeFlüoresan etiketi.
- 5 dakika boyunca 22 ° C'de 600 x g'de 150 ul permeabilizasyon tamponu ve santrifüj ekleyin. Permeabilization tampon atın ve 200 ul DPBS ekleyin. eldeki cihaza özgü protokoller ve yönergeleri kullanarak bir akış sitometresinde analiz edin.
NOT: vb, aktif olmayan veya Th0 aktif hücreleri analiz, izotop kontrol antikorları ile boyanarak sitokin boyama için uygun kontroller dahil emin olun
Sonuçlar
Bu deneysel sistemin başarısı T hücreleri ve yüksek titre retrovirüs hazırlıkları oldukça saf popülasyonları gerektirir. Temsilcisi sonuçları başarılı deneylerin örnekleri olarak burada gösterilmiştir. Şekil 1 Şekil 2. Naif yardımcı T hücre izolasyon protokolü her aşamasında öncesi ve sonrası seçilen nüfus tipik saflık gösterir ve 3 GFP ile retrovirüs üretiminin analizini göstermektedir transfekte edilmiş HEK 293T hücrelerinde (Şekil 2) ve kalıt aktarımlı T hücreleri (Şekil 3). HEK 293T hücrelerinin transfeksiyonu verimleri çeşitli retroviral yapıları ile önemli ölçüde değişebilir, ama bu genellikle, GFP + T hücrelerinin sayısı ile gözlenen retrovirüs üretimi düzeyi ile ilişkili değildir. Ayrıca, GFP + T hücrelerin sayısı, bir polarizasyon koşullarına bağlı olarak değişebilir. Bundan başka, mGFP EAN ifade seviyesi ve entegre virüs kopya sayısına bağlı olarak değişebilir eklenen gen, transkripsiyon entegrasyon sitenin etkisi ve viral transkript etkileyen transkripsiyon sonrası düzenleyici mekanizmalar.
Son olarak, Şekil 4 miRNA'lar miR-15b / 16 aşın zaman biz yardımcı T hücre farklılaşması ile gözlenen bazı tipik sonuçlarını gösterir. Bu sonuçlar çok doğru etkiler yardımcı T hücrelerinin farklı hazırlıklarını kullanarak birden fazla tekrar deneyleri istatistiksel analizi ile kanıtlanmalıdır bireysel deney içinde oluşabilecek değişkenlik bazı göstermektedir. Bu deneylerde, Th2 yanıtları da Th1 yanıtları eğilimli olduğu için burada kullanılan, C57BL / 6 doğrultusunda gözlemlemek zor olabilir. Aynı şekilde, IL-9 boyama arka plan üzerinde tespit etmek zor olabilir. Nedenle, izotip kontrolleri yapmak ve doğru ga sağlamak için uygun tazminat kurmak için zorunludursitokin ifade ting. Bu sonuçlar biz miR-15b / 16 bileşenleri Rictor ve mTOR 15 ekspresyonunu bastırmak yoluyla sinyal yolu mTOR engelleyerek iTreg indüksiyonunu geliştiğini tespit etmiş bulunuyoruz. miR-15b / 16, bazen bireysel deneylerde Th0, Th1 ve Th17 farklılaşma etkileyebilir, ancak birden çok tekrar deneylerinde incelenen önemli bir etkisi yoktur. Buna karşılık miR-15b / 16 ekspresyonu anlamlı Th9 farklılaşmasını (referans 18) bastırmak yok.
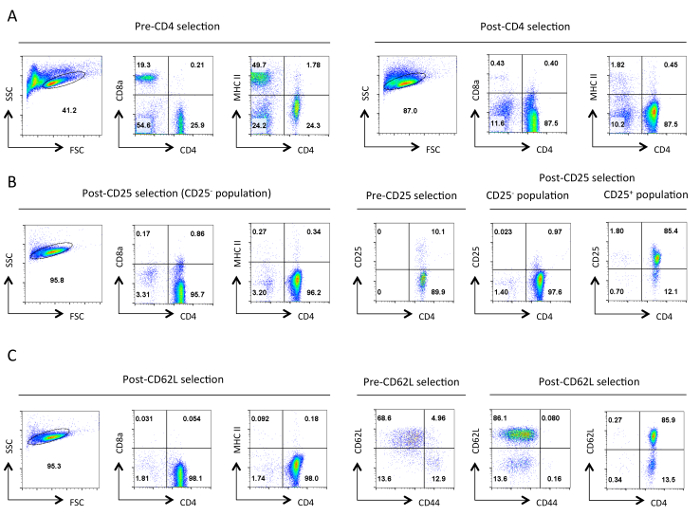
Şekil izolasyon her aşamasında yardımcı T hücrelerinin 1. Tipik saflık. Belirtilen antijenlerin sitometri sonuçları Temsilcisi akış İleri Yayılıma (FSC) ve Side Scatter (SSC) araziler belirlenen canlı hücrelerin kapıdan gösterilmiştir. (A) öncesi ve sonrası CD4 negatif seçim. CD4 ekspresyon profilleri,CD8a ve MHC II gösterilmektedir. Bu yardımcı T hücrelerinin çoğalmasını, ve sitotoksik T hücrelerinin kaybı ve MHC sınıf II sentezleyen hücre göstermektedir. İyi bir saflaştırma bu aşamada% 90 CD4 + T hücreleri ~ sonuçlanmalıdır. (B) CD25 seçimi. Solda CD4, CD8a ve MHC II ekspresyon profilleri vardır ve sağda CD4 ve CD25 ifade öncesi ve sonrası seçimi profilleri. CD25 negatif seçilen hücrelerin bu nokta>% 95 CD4 + CD25 olmalıdır -. (C) CD62L seçimi. CD4, CD8a ve MHC II ifade profilleri solda gösterilmektedir. Sağda CD62L ve CD44 için ekspresyon profilleri sonrası seçili hücrelerin CD4 ve CD62L ifadesi profili ile birlikte öncesi ve sonrası CD62L seçili hücreler için gösterilmiştir. CD62L seçiminden sonra hemen hemen tüm bellek hücreleri (CD44 +)% 10-15, efektör hücreler (CD62L düşük) içeren saf yardımcı T hücrelerinin zenginleştirilmiş nüfus bırakıldığı halde ayrılır. Hepsi içinBelirli bir parametre için FACS profilleri, eşdeğer ayarları ve ölçekler boyunca korundu. Sayılar bir kapı nüfus içindeki hücrelerin yüzdesini temsil eder. İlk seçimden sonra hücrelerin büyüklüğünde hafif azalma protokol sırasında mekanik stres muhtemelen kaynaklanmaktadır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
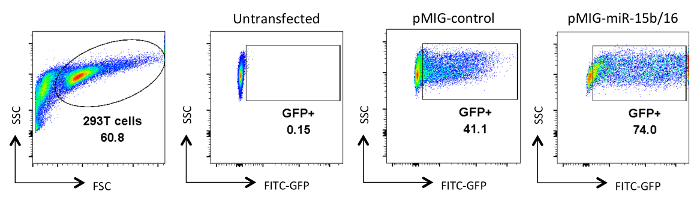
Şekil retrovirüs ile transfekte HEK 293T hücrelerinin 2. Analiz. GFP ifade edilmemiş veya transfekte edilmiş ve viral kültür yüzer maddelerinin toplanması sonra analiz ya da vardı HEK 293T hücrelerinde gösterilir. GFP analizi ilk panelde FSC üzerinde kapısı ve SSC arsa canlı hücreler üzerinde yapıldı. Sayılar kapılı bölgede GFP + hücrelerinin yüzdesini temsil eder. tipik transfection verimlilikleri% 30-90 arasında değişmektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
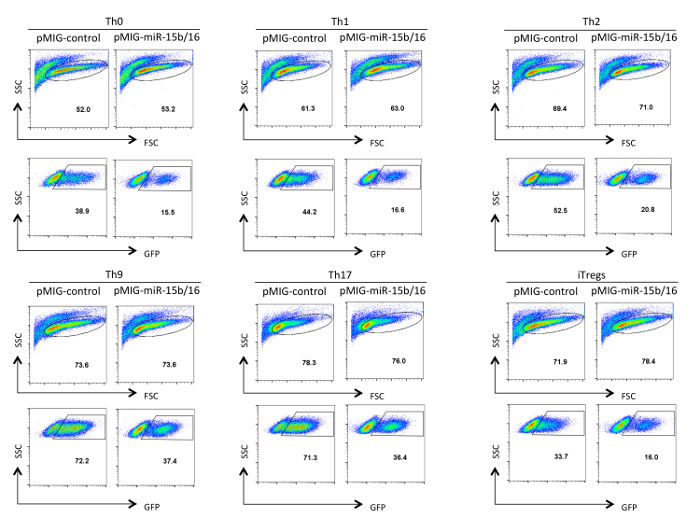
Şekil retrovirüs transduse yardımcı T hücrelerinin 3. Analiz. GFP tanımı Th0, Th1, Th2, Th9, Th17 içinde farklılaşmadan sonra retroviral-transdüksiyonlu yardımcı T hücreleri gösterilmektedir ve üç gün boyunca regülatör polarizasyon koşullarıdır. Analiz FSC / SSC panelinde belirtilen canlı ve aktif hücreleri üzerinde Geçitli. Transdüksiyon etkisinde bir yapı ve polarizasyon koşullarına bağlı olarak% 10-75 arasında değişebilir. Aynı şekilde, GFP ifade ortalama floresan yoğunluğu değişebilir. Edebilirsiniz bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
: fo lass = "jove_content" 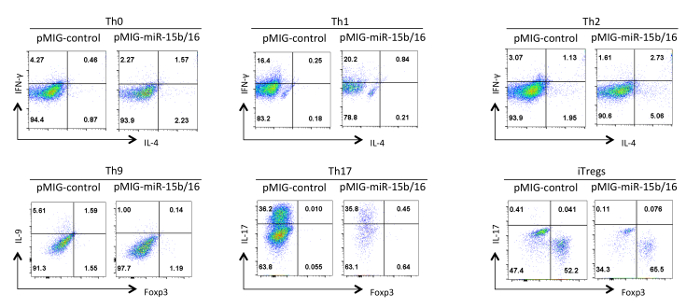
Şekil miR-15b 4. Efekt / farklı polarizasyon koşullarında yardımcı T hücre farklılaşması üzerine 16 ekspresyonu. Temsili sitokin profilleri GFP + Şekil 3 hücrelerin nüfus gösterilmektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Tablo 1:. Bu protokollerde kullanılan tamponlar bir Excel elektronik tablosu olarak bu tabloyu indirmek için tıklayınız.
| YardımcıT hücresi kutuplaşması koşulları | ||
| Th0 | anti-IL-4 | 5 ug / ml |
| Anti-IFN-γ | 5 ug / ml | |
| Th1 | Rekombinant IL-12 | 20 ng / ml |
| anti-IL-4 | 5 ug / ml | |
| Th2 | Rekombinant IL-4 | 40 ng / ml |
| Anti-IFN-γ | 5 ug / ml | |
| Th9 | Rekombinant TGF-β | 2.5 ng / ml |
| Rekombinant IL-4 | 40 ng / ml | |
| Anti-IFN-γ | 10 ug / ml | |
| Th17 | Rekombinant TGF-β | 2.5 ng / ml |
| Rekombinant IL-6 | 50 ng / ml | |
| Anti-IFN-γ | 5 ug / ml | |
| anti-IL-4 | 5 ug / ml | |
| anti-IL-2 | 5 ug / ml | |
| Treg'ler | Rekombinant TGF-β | 2.5 ng / ml |
| Rekombinant IL-2 | 5 ng / ml | |
Tablo 2: Yardımcı T hücresi alt kümesi polarizasyon koşulları.
Tartışmalar
onların gelişim ve fonksiyon genellikle anahtar düzenleyicilerin ifade düzeyine göre belirlenir olarak genlerin retroviral aracılı aşırı ekspresyonu, yardımcı T hücrelerinin işlevi analiz etmek için güçlü bir yoldur. önemli ölçüde endojen genin yukarıda ifade seviyeleri çok eserleri tanıtmak çünkü Ancak, sonuçların dikkatli yorumlanması gerekmektedir. Bu nedenle, bu teknik fonksiyon ilişkisini kontrol etmek için başka levhalarla birleştirilebilir olmalıdır. Örneğin, overekspresyonu varsa siRNA'lar veya gen dolguyu kullanarak azaltılmış ifade ile tamamlanmalıdır. MiRNA'lar, biz bir miRNA 15 gibi rekabetçi inhibitörleri hareket sitelerini hedefleyen yapay miRNA aşırı virüsleri kullanarak engelleme olanlar ile aşırı ekspresyonu deneyler tamamlanmaktadır. Retroviral kalıt hücreleri, RNA ve protein analizi dahil, biyokimyasal deneylerde kullanılabilir. Bununla birlikte, bu deneyler önemli bir sınırlama transdüksiyon Res verimliliğiTransdüksiyona ve untransduced hücrelerin karışık bir popülasyonda ulting. Bu nedenle, bu analizler büyük ihtimalle GFP + nüfusun sıralama gerektirecektir. Son olarak, in vitro tahliller, farklılaşma, in vivo deneyler ile bir araya getirilmiş ve bu sağlanabilir bir şekilde adoptif farelere kalıt aktarımlı T hücreleri aktarılması ve farklılaşma ve immün yanıt üzerindeki etkisini takip ederek olduğu vurgulanmalıdır.
Bu sistem anahtarı sınırlamaların bir retroviral kapsid içine paketlenebilir RNA genomunun boyutudur. Bizim tecrübelerimize göre, iyi bir virüs üretimini sağlayan MIG retroviral sistemi için maksimum uç boyutu 3-3.5 kb. fakir virüs titreleri vermek nedenle, büyük genler, bu sistem ile analiz edilemez. Bu sistem, gen çalışmaları çeşitli için yararlıdır ancak, çok sayıda genin bu boyutta daha küçüktür.
Retroviral transdüksiyon, bu Protoco içinde çeşitli alternatifleri ileLS kullanılmıştır. Birçok araştırmacı stabil retroviral genler (örneğin 16 referans) ifade eden paketleme hücre hatları kullanmışlardır. Bununla birlikte, PCL-Çevre yardımcı virüs vektörünün eş transfeksiyonu standart HEK 293T hücreleri kullanılarak, en yüksek titrelerini elde edilmiştir. saf yardımcı T hücrelerinin izole edilmesi, aynı zamanda manyetik boncuk hücre ayırma kolonu protokolü yerine hücre sıralama ile elde edilebilir, ancak bu hücre sıralayıcı erişim gerektirir, ve sıralama kez maliyetleri tipik haliyle kordon reaktifler daha yüksektir. Son olarak, farklı alt-grup halinde, yardımcı T hücreleri ayırt etmek için kullanılan aktivasyon koşulları farklılıklar vardır. Örneğin, çok uzun süre hücrelerin TCR stimülasyonu regülatör uyaran koşullara maruz önce indüksiyon 16 önleyebilir. retroviral ifade hücrelerinin uyarımı ile uyarılan hücre bölünmesini gerektirir, bu bir sorun olabilir. Yine de, biz O / N activ ile bu protokolü kullanarak verimli Treg indüksiyon buldukretroviral transdüksiyon öncesinde tirme.
Bu protokoller kapsamında, başarılı uygulama çeşitli faktörleri gerektirir. Yüksek titre retrovirüs hazırlıkları önemli HEK 293T hücrelerinde çok yüksek kalitede DNA ve hassas hazırlanan 2x HBS verimli transfeksiyon gerekir. Transfekte edilen DNA iyi sentezleme hücreleri çok seyrek veya yoğun ise hücreler aktif olarak büyümekte ve bu inhibe olacak gerektirir Buna ek olarak, HEK 293T hücrelerinin hücre yoğunluğu transfeksiyon noktasında yaklaşık% 50 olması gerekmektedir. transfeksiyon sırasında optimum yoğunlukta Hücreler virüs toplama adımları sırasında bir noktada izdiham ulaşmak gerekir, ama hepsi yolu son koleksiyonu ile yüksek titre virüs stokları üretmeye devam edecektir. Yardımcı T hücrelerinin etkili farklılaşma iyi bir hücre kalitesi böylece yalıtılmış hücreler, Şekil 1 'de gösterilen saflığına sağlamak gerekir. Benzer bir şekilde, hücrelerin kalitesi farenin fr bağlıdırbunlar izole edildi OM. Bu çalışmalar için, 6-8 haftalık C57BL / 6 fareleri kullanılmıştır. Yaşlı farelerde daha az naif hücreleri olabilir ve diğer suşları kendi farklılaşma farklı olabilir. T hücreleri, bir Th2 yanıtını uyarmak için zor olabilir, yukarıda belirtilen C57BL / 6 belirtildiği gibi örneğin, BALB / c fareleri, böylece C57BL / 6 fareleri 17 den Th2 tepkilerinin daha yatkındır. Buna ek olarak, farklılaşma koşullardan herhangi laboratuardan laboratuara biraz farklı olabilir ve çeşitli polarizasyon koşullarında Sitokin konsantrasyonları titre edilmesi gereklidir, bu nedenle gen aşırı ifadesinin etkisi sadece alt uygun koşullarda ortaya çıkabilir. Son olarak, hücre çoğalması ile ilgili aşırı eksprese edilen gen etkisi veya polarizasyon koşulları, ilgi konusu genin, böylece ölçüm etkileri polarize reaktifler zamanlama ve yoğunluklarının ayarlanması gerekebilir transdüksiyon verimliliği etkileyebilir. Tüm bu faktörleri optimize bu sistem ile bilgilendirici sonuçlara yol açacaktır.
Açıklamalar
The authors have no conflicting interest in the publication of this work.
Teşekkürler
This work was supported by a Biotechnology and Biological Sciences Research Council (BBSRC) grant (BB/H018573/1) and a BD Biosciences grant.
Malzemeler
| Name | Company | Catalog Number | Comments |
| RPMI | Sigma | R8758 | |
| DMEM | Sigma | D5671 | |
| Penicillin Streptomycin solution | Sigma | P4333 | |
| L-Glutamine | Sigma | G7513 | |
| β-mercaptoethanol | Sigma | M3148 | |
| DPBS | Sigma | D8537 | |
| MIG vector | Addgene | Plasmid 9094 | |
| pCL-Eco vector | Addgene | Plasmid 12371 | |
| Cell strainer | BD Falcon | 352350 | |
| Magnetic beads mouse CD4 cell kit | Invitrogen (Dynabeads) | 11415D | |
| Streptavidin Beads | Miltenyi Biotech | 130-048-102 | |
| MS cell separation columns | Miltenyi Biotech | 130-042-201 | |
| LS cell separation columns | Miltenyi Biotech | 130-042-401 | |
| CD25 Biotenylated MAb | BD Biosciences | 85059 | clone 7D4 |
| CD62L Biotenylated MAb | BD Biosciences | 553149 | clone MEL-14 |
| Polybrene (Hexadimethrine Bromide) | Sigma | 107689 | |
| Anti-CD3 | eBiosciences | 16-0031-85 | clone 145-2C11 |
| Anti-CD28 | eBiosciences | 16-0281-85 | clone 37.51 |
| Anti-IL-4 | BD Biosciences | 559062 | clone 11B11 |
| Anti-IFN-gamma | BD Biosciences | 559065 | clone XMG1.2 |
| Anti-IL-2 | BD Biosciences | 554425 | cloneJES6-5H4 |
| Recombinant IL-12 p70 | eBiosciences | 14-8121 | |
| Recombinant IL-4 | BD Biosciences | 550067 | |
| Recombinant TGF-beta | eBiosciences | 14-8342-62 | |
| Recombinant IL-6 | eBiosciences | 14-8061 | |
| Recombinant IL-2 | eBiosciences | 14-8021 | |
| PMA | Sigma | P8139 | |
| Ionomycin | Sigma | I0634 | |
| Brefeldin A | eBiosciences | 00-4506 | |
| Paraformaldehyde | Sigma | 16005 | Paraformaldehyde is toxic so use appropriate caution when handling |
| Foxp3 staining buffer set | eBiosciences | 00-5523 | |
| Anti-CD4 FITC | eBiosciences | 11-0041 | clone GK1.5 |
| Anti-CD8a perCP-cy5.5 | eBiosciences | 45-0081-80 | clone 53-6.7 |
| Anti-MHCII PE | eBiosciences | 12-0920 | clone HIS19 |
| Anti-CD25 PE | eBiosciences | 12-0251-82 | clone PC61.5 |
| Anti-CD62L PE | eBiosciences | 12-0621-82 | clone MEL-14 |
| Anti-CD44 APC | eBiosciences | 17-0441 | clone IM7 |
| Anti-IFN-gamma FITC | eBiosciences | 11-7311-81 | clone XMG1.2 |
| Anti-IL-4 PE | BD Biosciences | 554435 | clone 11B11 |
| Anti-IL-9 PE or APC | eBiosciences/Biolegend | 50-8091-82/514104 | clone RM9A4 |
| Anti-IL-17a PE | BD Biosciences | 559502 | clone TC11-18H10 |
| Anti-Foxp3 APC or PE | eBiosciences | 17-5773-82/12-5773-80 | clone FJK-16s |
| NaCl | Sigma | S7653 | |
| KCl | Sigma | P9333 | |
| Na2HPO4-2H2O | Sigma | 71643 | |
| Dextrose/Glucose | Sigma | G7021 | |
| HEPES, free acid | Sigma | H3375 | |
| NH4Cl | Sigma | A9434 | |
| Disodium EDTA | Sigma | D2900000 | |
| KHCO3 | Sigma | 237205 | |
| CaCl2 | Sigma | C5670 |
Referanslar
- Baumjohann, D., Ansel, K. M. MicroRNA-mediated regulation of T helper cell differentiation and plasticity. Nat Rev Immunol. 13 (9), 666-678 (2013).
- Wilson, C. B., Rowell, E., Sekimata, M. Epigenetic control of T-helper-cell differentiation. Nat Rev Immunol. 9 (2), 91-105 (2009).
- Pearce, E. L., Poffenberger, M. C., Chang, C. H., Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science. 342 (6155), 1242454 (2013).
- Cherry, S. R., Biniszkiewicz, D., Van Parijs, L., Baltimore, D., Jaenisch, R. Retroviral Expression in Embryonic Stem Cells and Hematopoietic Stem Cells. Mol and Cell Biol. 20 (20), 7419-7426 (2000).
- Miller, A. D., Rosman, G. J. Improved retroviral vectors for gene transfer and expression. BioTechniques. 7 (9), 980-990 (1989).
- Grez, M., Akgün, E., Hilberg, F., Ostertag, W. Embryonic stem cell virus, a recombinant murine retrovirus with expression in embryonic stem cells. Proc Nat Acad Sci USA. 87 (23), 9202-9206 (1990).
- Naviaux, R. K., Costanzi, E., Haas, M., Verma, I. M. The pCL vector system: rapid production of helper-free, high-titer, recombinant retroviruses. J Virol. 70 (8), 5701-5705 (1996).
- Filipowicz, W., Bhattacharyya, S. N., Sonenberg, N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?. Nat Rev Genetics. 9 (2), 102-114 (2008).
- He, L., Hannon, G. J. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genetics. 5 (7), 522-531 (2004).
- Bernstein, E., Kim, S. Y., et al. Dicer is essential for mouse development. Nat Genetics. 35 (3), 215-217 (2003).
- Cobb, B. S., Hertweck, A., et al. A role for Dicer in immune regulation. J Exp Med. 203 (11), 2519-2527 (2006).
- Chong, M. M. W., Rasmussen, J. P., Rudensky, A. Y., Rundensky, A. Y., Littman, D. R. The RNAseIII enzyme Drosha is critical in T cells for preventing lethal inflammatory disease. J Exp Med. 205 (9), 2005-2017 (2008).
- Liston, A., Lu, L. F., O'Carroll, D., Tarakhovsky, A., Rudensky, A. Y. Dicer-dependent microRNA pathway safeguards regulatory T cell function. J Exp Med. 205 (9), 1993-2004 (2008).
- Zhou, X., Jeker, L. T., et al. Selective miRNA disruption in T reg cells leads to uncontrolled autoimmunity. J Exp Med. 205 (9), 1983-1991 (2008).
- Singh, Y., Garden, O. A., Lang, F., Cobb, B. S. MicroRNA-15b/16 Enhances the Induction of Regulatory T Cells by Regulating the Expression of Rictor and mTOR. J Immunol. 195 (12), 5667-5677 (2015).
- Sauer, S., Bruno, L., et al. T cell receptor signaling controls Foxp3 expression via PI3K, Akt, and mTOR. Proc Nat Acad Sci USA. 105 (22), 7797-7802 (2008).
- Yagi, J., Arimura, Y., Takatori, H., Nakajima, H., Iwamoto, I., Uchiyama, T. Genetic background influences Th cell differentiation by controlling the capacity for IL-2-induced IL-4 production by naive CD4+ T cells. Int Immunol. 18 (12), 1681-1690 (2006).
- Singh, Y., Garden, O. A., Lang, F., Cobb, B. S. MicroRNAs regulate T-cell production of interleukin-9 and identify hypoxia-inducible factor-2a as an important regulator of T helper 9 and regulatory T-cell differentiation. Immunology. 149, 74-86 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır