Method Article
공부하는 유전 적 접근으로 헬퍼 T 세포의 레트로 바이러스 형질 도입은 메커니즘 자신의 차별화 및 기능 제어
요약
많은 실험 시스템은 면역 반응의 T 세포의 발달 및 기능을 조절하는 메카니즘을 이해하는 데에 이용되고있다. 여기 레트로 바이러스 형질 도입을 이용하여 유전 적 접근 경로를 규정하는 식별 경제적 시간 효율적이고, 무엇보다도 매우 유익하다 설명한다.
초록
Helper T cell development and function must be tightly regulated to induce an appropriate immune response that eliminates specific pathogens yet prevents autoimmunity. Many approaches involving different model organisms have been utilized to understand the mechanisms controlling helper T cell development and function. However, studies using mouse models have proven to be highly informative due to the availability of genetic, cellular, and biochemical systems. One genetic approach in mice used by many labs involves retroviral transduction of primary helper T cells. This is a powerful approach due to its relative ease, making it accessible to almost any laboratory with basic skills in molecular biology and immunology. Therefore, multiple genes in wild type or mutant forms can readily be tested for function in helper T cells to understand their importance and mechanisms of action. We have optimized this approach and describe here the protocols for production of high titer retroviruses, isolation of primary murine helper T cells, and their transduction by retroviruses and differentiation toward the different helper subsets. Finally, the use of this approach is described in uncovering mechanisms utilized by microRNAs (miRNAs) to regulate pathways controlling helper T cell development and function.
서문
The immune response must be highly regulated to eliminate infections but prevent attacks on self-tissue that lead to autoimmunity. Helper T cells play an essential role in regulating the immune response, and a great deal of effort has been undertaken to understand their development and function (illustrated in several recent reviews 1-3). However, many questions remain, and many approaches have been utilized to study the mechanisms controlling helper T cell development and function. These have ranged from the use of in vitro cell culture systems to whole animals. Cell culture systems, especially those using cell lines, offer the benefit of ease of use and the ability to generate large amount of material to do sophisticated biochemical analyses. However, they suffer from their limited ability to reproduce the actual conditions occurring in an immune response. In contrast, whole animal experiments offer the benefit of relevance, but they can suffer from difficulties in manipulation and the ability to perform precise controls in addition to their large costs and ethical implications. Nevertheless, the vast majority of helper T cells studies today still require the use of whole animal experiments involving primary T cells because of the inability of cell lines to duplicate the exact steps occurring in the whole animal. Therefore, it is essential to utilize cost effective approaches that are highly informative.
Genetics is one powerful tool to study helper T cell development and function, yet traditional methods involving gene knockouts or transgenes are time consuming and expensive so they are often out of reach of small labs. However, retroviral transduction offers a powerful, rapid and, cost effective genetic approach to study the mechanisms of specific gene products. Therefore, it is commonly used in papers studying helper T cell development and function.
We have optimized a procedure for retroviral transduction of helper T cells. It utilizes the pMIG (Murine stem cell virus-Internal ribosomal entry site-Green fluorescent protein) retroviral expression vector, in which the gene of interest can be cloned and thereby expressed from the retrovirus long terminal repeat (LTR) 4. In addition, downstream of the inserted gene of interest is an internal ribosome entry sequence (IRES) followed by the green fluorescent protein (GFP) gene so transduced cells can easily be followed by their expression of GFP. The vector was originally derived from the Murine Stem Cell Virus (MSCV) vectors, which contain mutations in repressor binding sites in the LTRs making them resistant to silencing and thus, giving high expression in many cell types including helper T cells 5,6. Production of high titer retrovirus requires a simple transient transfection protocol of human embryonic kidney (HEK) 293T cells with the MIG vector and a helper virus vector that expresses the retroviral GAG, Pol, and Env genes. For this the pCL-Eco helper virus vector 7 works well in producing high titer replication incompetent retroviruses.
Here these protocols for retroviral production and transduction of primary murine T cells are described in addition to some of our results using this approach to study miRNA regulation of gene expression controlling helper T cell differentiation. miRNAs are small RNAs of approximately 22 nucleotides in length that post-transcriptionally regulate gene expression by targeting homologous sequences in protein encoding messenger RNAs and suppressing translation and inducing message instability 8,9. miRNAs play critical roles in developmental gene regulation. They are essential in the earliest stages of development, as embryos that cannot produce miRNAs die at a very early stage 10. In addition miRNAs are important later on in the development of many tissues. They are thought to function by fine-tuning the expression of genes required for developmental programs 1. In helper T cells miRNAs play multiple roles and are required for regulatory T cell (Treg) development 11-14. We used retroviral transduction as a means to dissect the mechanisms of miRNA regulation of Treg differentiation 15. Through such studies important individual miRNAs were determined by retroviral-mediated overexpression. Subsequently, relevant genes regulated by these miRNAs were identified in order to understand the molecular pathways regulated by miRNAs in helper T cell differentiation.
프로토콜
이러한 프로토콜에서 수행되는 모든 마우스 작업은 동물 프로젝트 라이센스 6천9백65분의 70에서 동물 과학적인 절차 법, 영국에 따라 수행 하였다.
1. 레트로 바이러스 생산
이전 절차와 유전자 변형 유기체 포유 동물 세포의 레트로 바이러스의 사용을 제조하기위한 모든 필요한 승인을 얻었다.
- HEK 293T 세포의 성장
- 10cm 조직 배양 HEK 293T 배지에서 요리를하는 HEK 293T 세포 성장 (10 % 소 태아 혈청을 가진 둘 베코 변형 이글 배지 (DMEM) (FBS), 100 단위 / ml의 페니실린, 0.1 ㎎ / ㎖ 스트렙토 마이신, 2 mM의 글루타민) . 일반적으로 세포 통로를 들어, 분할 세포 1:10 그들은 매체를 제거하고 신선한 HEK 293T 매체와 함께 접시 떨어져 세포를 피펫 팅으로 합류에 도달했을 때.
참고 : 세포 2-3 일 합류에 도달해야한다. 293T HEK 세포는 그렇게 트립신이 필요하지 않은 판에 느슨하게 연결합니다. - 24 시간은 형질 전환 이전하는 conflue을 분할다음날 세포가 ~ 50 %의 합류 연결되도록 10cm 플레이트 (형질 전환 당 하나의 판)에 세포 1:10 NT 판.
- 10cm 조직 배양 HEK 293T 배지에서 요리를하는 HEK 293T 세포 성장 (10 % 소 태아 혈청을 가진 둘 베코 변형 이글 배지 (DMEM) (FBS), 100 단위 / ml의 페니실린, 0.1 ㎎ / ㎖ 스트렙토 마이신, 2 mM의 글루타민) . 일반적으로 세포 통로를 들어, 분할 세포 1:10 그들은 매체를 제거하고 신선한 HEK 293T 매체와 함께 접시 떨어져 세포를 피펫 팅으로 합류에 도달했을 때.
- 인산 칼슘의 침전에 의해 형질
- 약 1 시간 전에 형질로, 세포에서 매체를 제거하고 조심스럽게 접시에서 분리 세포를 방지하기 위해 신선한 HEK의 293T 매체의 9를 가하여.
- 배 헤 페스 완충 식염수 (배 HBS) 표 1에 설명 된대로 신선한 2.5 M CaCl2를 솔루션을 준비합니다. DNA의 주식을 녹여. 가장 효율적인 형질에 대한 플라스미드 준비 품질 DNA를 사용합니다.
- 6 ml의 둥근 바닥 또는 15 ml의 원뿔 튜브 5 레트로 바이러스 DNA (pMIG) 4 μg의, 도우미 바이러스 DNA (PCL-에코) (7)의 5 μg의, 그리고 H 2 O 420 μl를 추가합니다. 500 μL에 최종 볼륨을 가져 오는 2.5 M CaCl2를 80 μl를 추가합니다.
참고 :이를 다음 단계 (2 배 HBS의 추가)와 함께 일반적인 아이돌만큼 정기적 벤치에 수행 할 수 있습니다ILE 기술이 사용된다. - 이 솔루션은 지속적으로 혼합하고 카포 4도 크기의 결정에 침전되도록 부드럽게 텍싱하면서 천천히 위의 DNA 혼합물에 드롭으로 2 배 HBS 드롭의 500 μl를 추가합니다.
- 지속적으로 부드럽게 판을 소용돌이 치는 동안 세포를 포함하는 매체의 9 ml의에 카포 4 DNA 혼합물 (1 ml)을 적가을 추가 서서히 조직 문화 후드로 이동합니다. 다시 한번 판에서 세포를 분리하지 않도록주의하십시오. 다시 인큐베이터로 세포를 놓습니다.
참고 :이 시점에서 카포 4 침전물 박테리아의 크기에 대한 작은 결정으로 현미경 쉽게 볼 수 있습니다. 결정이 판의 바닥에 정착 할 수있는 기회가있을 때이 쉽게 30 ~ 60 분 후에 볼 수 있습니다.
- 문화 상층 액에서 바이러스의 컬렉션입니다.
- (어디 형질 전환 후 12 ~ 24 시간에서) 다음 날은 매체를 제거하고 10 ml의 세포를 공급신선한 HEK의 293T 매체의 다시 한 번 판에서 셀을 제거하지 않도록주의.
주 : 이것은 HEK 293T 세포의 형질 감염이 동안 배지에 분비 림프구 저해 물질을 희석시킨다. - 둘째 날 (~ 24 시간 후 형질)의 저녁 신선한 HEK의 293T 매체의 3.5 ml의와 세포를 공급. 한 쪽이 건조 왼쪽되지 않도록 판은 인큐베이터에서 정확히 수준을 배치되도록주의해야합니다.
- ~ 12 시간 이상 (4 ℃에서 저장) 및 신선한 HEK의 293T 매체의 3.5 ml의 먹이 매체를 수집합니다. 반복 회수 2 회 이상 대략 중간의 약 10 ㎖가 수집되도록 12 시간 간격. 이 바이러스 재고입니다.
- 5 분 동안 600 XG에 원심 분리하여 잔류 HEK의 293T 세포와 세포 파편을 스핀. 대안 적으로, 0.45 μm의 바인딩 낮은 단백질 주사기 필터를 사용하여 필터링. 역가 천천히 4 ° C에서 감소하므로 저장 4 ° C에서 바이러스, 최고의 역가에 대해는 하루 이틀 내에 사용합니다. 호텔 fr하지 마십시오이 크게 감소 역가로서 eeze.
- (어디 형질 전환 후 12 ~ 24 시간에서) 다음 날은 매체를 제거하고 10 ml의 세포를 공급신선한 HEK의 293T 매체의 다시 한 번 판에서 셀을 제거하지 않도록주의.
차 나이브 CD4 + T 세포의 2. 분리
- 백혈구 세포의 분리
- 자궁 경부 전위, CO 2 질식 또는 기관의 동물 취급 규칙에 적합한 다른 인간 프로토콜에 의해 쥐를 안락사.
- 갓 안락사 쥐를 해부하고 비장을 제거하고 원하는 림프는 15 노드. R10 배지 (10 % FBS 비활성화 열, 100 유닛 / ㎖의 페니실린, 0.1 ㎎ / ㎖ 스트렙토 마이신, 2 mM의 글루타민, 및 0.1 % β 메르 캅토 에탄올로 RPMI 배지)을 포함하는 6 웰 조직 배양 플레이트의 웰에 장기 배치 . 문화 오염의 가능성을 최소화하기 위해 마우스와 이후의 모든 조작의 해부에 대한 세포 배양 후드를 사용합니다.
참고 : 감기 R10 매체를 유지하고 4 ℃에서 모든 다운 스트림 정화 단계를 수행합니다. - 5에 70 μm의 세포 배양 여과기를 배치0 ml의 R10 매체의 약 5 mL를 포함하는 원뿔 튜브를. 최대 세 생쥐의 비장과 림프절에 대해 하나의 여과기를 사용합니다.
- 셀 스트레이너에 비장과 림프절을 추가하고 5 ML의 주사기 플런저의 끝 부분을 사용하여 담가서 부드럽게. R10 매체의 1-2 ㎖로 씻어.
- 15 ML 원뿔 튜브에 세포를 전송하고 R10 14 ml의 최대 볼륨을 가지고. 4 ℃에서 5 분 동안 600 XG에 원심 분리기. 세포 펠렛을 방해하지 않도록 한 깨끗한 이동로를 부어 상층 액을 버린다.
- 각 튜브에 감기 (4 ° C) 붉은 세포 용해 버퍼 (표 1) 2 ㎖를 추가합니다. 조심스럽게 얼음에 튜브를 유지, 3.5 분 동안 혼합한다.
주 : 붉은 세포 용해의 타이밍이 림프구의 죽음을 방지하는 것이 중요하다. 따라서, 적혈구 용해 완충액의 각 배치의 정확한 타이밍을 최적화 할 필요가있다. - R10 매체의 ≈12-13 ML을 추가합니다. 즉시 원심 분리 단계 2.1.5에서와 같이 상층 액을 버린다. 더 위트 배 세척 단계를 수행H R10 매체는 셀로부터 임의의 잔류 적혈구 용해 완충액을 제거하고 림프구의 사멸을 방지한다.
- 생존 세포의 수율을 결정 트리 판 블루로 1:20 희석 혈구 세포 카운트. 마우스 당 약 8 ~ 10 × 10 7 세포를 기대합니다.
- 자석 구슬에게 키트를 사용하여 CD4 + T 세포의 분리는 CD8 +, CD11b를 +, CD16 / 32 +, CD45R +, MHC 클래스 II +와 테르-119 + 세포를 제거하는 방법.
- 나누어지는 단계 8-10 × 10 7 세포 2.1.8 (15) 당 ML 원뿔 튜브와 4 ° C에서 5 분 600 XG에 원심 분리기. 세포 펠렛을 방해하지 않도록 한 깨끗한 운동 상층 액을 붓는다. FBS는 다음 키트에서 항체 믹스 100 ㎕를 추가 열 불활 100 ㎕의 각 튜브에 세포를 재현 탁. 롤러에 부드러운 혼합으로 4 ° C에서 30 분 동안 품어.
- 상기 세포를 배양하는 동안 비드 준비.
- > 30 초 동안 볼 텍싱하여 유리 병에 재현 탁 비즈는 15 ML 원뿔 관에 8 ~ 10 × 10 (7) 제조 셀 당 구슬 1 ㎖를 전송합니다. 구슬 ml의 당 R10 매체의 2 ML을 추가하고 부드럽게 섞는다.
- 다음 상층 액을 버린다 1 분 자석에 튜브를 놓습니다. R10 매체의 4 ㎖에 자석과에 resuspend 구슬에서 튜브를 제거합니다. 구슬이 금액은 부화 두 차례에 충분하다.
- 튜브 당 R10 배지 10 ㎖를 첨가하여 항체 인큐베이션 (단계 2.2.1)의 마지막에 세포를 세척 하였다. 부드럽게 4 ° C에서 5 분 동안 600 XG에 튜브와 원심 분리기 세포의 소용돌이와 잘 섞는다. 세포 펠렛을 방해하지 않도록 한 깨끗한 운동 상층 액을 붓는다. R10 배지 1 ㎖에 재현 탁 된 세포.
- 항체를 처리 한 세포의 각 튜브 (각 튜브를 준비 양 ½) 단계 2.2.2.2에서 세척 구슬 2 ㎖를 추가하고 소유주에 부드러운 혼합으로 4 ° C에서 30 분 동안 배양크 로스.
- 부드럽게 좁은 선단 개구를 포함하는 피펫으로 5 회 피펫 팅하여 세포 - 비드를 재현 탁 혼합물. 발포하지 마십시오. 다음 새 튜브에 부정적인 선택 세포를 포함 뜨는을 전송 2 분의 구슬 자석에 튜브를 놓습니다. 그들은 CD4 + 인구만큼,이 세포를 보관하십시오.
- 부정적인 선택을 한 번 더 반복합니다. 4 ℃에서 5 분 동안 600 XG에 단계 2.2.5에서 세포를 스핀. R10 배지 1 ㎖의 단계 2.2.3과에 resuspend과 상등액을 따르십시오. 팔로우 다시 2.2.4와 2.2.5 단계를 반복합니다. 최종 자기 비드 선택 후, (일반 수율 10 8 백혈구 당 15 ~ 20 × 10 6 세포 인) 복구를 결정하기 위해 세포를 계산합니다.
- 세포 분리 열을 사용하여 - 나이브 CD4 + T 세포 (CD62L 및 높은 CD25)의 분리
- 의 150-200 μL에서 원심 분리기 CD4 + T는 4 ° C에서 5 분 600 XG에 세포에 resuspend10 8 셀 당 R10 매체. 재고 비오틴 CD25 단클론 항체 (클론 7D4)의 2 μl를 추가합니다. 롤러에 부드러운 혼합으로 4 ° C에서 30 분 동안 품어.
- 세포 분리 컬럼 완충액 (표 1) 10 ㎖를 첨가하여 세포를 세척 하였다. 4 ℃에서 5 분 동안 600 XG에 원심 분리기. 최대한 상등액을 제거하고 남은 버퍼 / 세포의 양을 추정한다. 107 세포 당 90 ㎕의 최종 부피로 재현 탁.
- 10 7 세포 당 스트렙 타비 딘 구슬의 20 μl를 추가하고 부드러운 제스처와 함께 섞는다. 4 ℃에서 15 분 동안 품어.
- 세포 배양 동안 수동 접근 매체 세포 분리 (MS) 컬럼을 준비한다. 각 MS 열은 10 7 세포를 유지하고, CD25 + 세포는 일반적으로 총 CD4 + 세포의 약 10 %를 차지하기 때문에, 10 8 CD4 + T 세포 당 1 열을 사용합니다. 열에 세포 분리 컬럼 완충액 500 μL를 추가과를 통해 흐를 수 있습니다. 2 번 더 반복합니다.
- 셀 / 비드 인큐베이션 마지막에 세포 분리 컬럼 완충액 10 ㎖를 첨가하고, 4 ℃에서 5 분 동안 600 × g으로 원심 분리하여 세포를 세척 하였다. 10 8 셀 당 세포 분리 컬럼 버퍼의 500 μl의 세포를 재현 탁하지만, 적은 수의 세포가있는 경우 여전히 500 μl를 사용합니다.
- 컬럼에 셀 / 비드 서스펜션의 500 μl를 적용하고를 통해 흐름을 수집합니다. 열 1 시간 이상이 합격을 다시 한번를 통해 흐름을 수집합니다. 각 수집 된 셀이 린스로부터 흐를 추가 열을 세포 분리 컬럼 완충액 500 μL로 3 회 헹군다. 다음은 CD25 있습니다 - 세포. 수율을 결정하기 위해 세포를 계산합니다.
- Tregs (CD25 + 세포)를 원하는 경우 다음과 같이 분리.
- 분리기에서 열을 제거하고 불임을 유지하기 위해 열려있는 보편적 인 튜브 돌보는 위를 유지. 신속 COL에 세포 분리 완충액 500 μL 피펫UMN 단단히 열와 함께 제공되는 플런저를 사용하여 긍정적 인 부분을 세척하십시오.
- 플러싱 절차를 2 회 이상 반복합니다. 신선한 MS 세포 분리 컬럼을 통해 긍정적 인 부분을 전달하고이 흐름을 통해 폐기하십시오. 단단히 R10 매체의 1 ㎖에 4 ° C.를 Resuspend 세포에서 5 분 동안 600 XG에 이전과 원심 분리기 세포로 양성 세포를 세 번, 물로 씻어 수율을 결정하기 위해 계산합니다.
- CD62L 높은 T 세포, 원심 분리기 CD25 - - 10 7 세포 당 R10 매체 150-200 μl를 4 °와에 resuspend에서 5 분 동안 600 XG에 단계 2.3.6에서 위에 고립 된 T 세포 CD25을 구하십시오. 재고 비오틴 CD62L 모노클로 날 항체의 5 μl를 (복제 MEL-14)를 추가하고 이전과 같이 롤러에 부드러운 혼합 4 ° C에서 30 분 동안 품어.
- TREG 분리 프로토콜 (2.3.7)에 기재 한 바와 같이 세척을 수행, 스트렙 타비 딘 바인딩 구슬, 세포 분리 컬럼 준비. 이 시간 사용10 8 셀의 용량이 큰 세포 분리 (LS) 칼럼.
- CD62L 높은 T 세포는 일반적으로 CD25의 약 60-70% 표현하기 때문에 - 세포를, 10 8 셀 당 1 LS 세포 분리 컬럼을 사용합니다. 단계 2.3.6에서 설명 된 바와 같이 LS 세포 분리 컬럼 셀 / 비드 혼합물을 추가 - 칼럼 린스 통해서 이번에는 최종 흐름을 폐기. CD25 + 세포 수집 공정 2.3.7에 설명 된 CD62L 높은 T 세포를 수집한다.
- R10의 1 ml를 4 ℃에서 재현 탁 세포에서 5 분 600 XG에 원심 분리기 세포 수율을 결정하기 위해 계산합니다. R10 매체에 0.75-1 X10에 ml의 당 6 세포를 희석.
- 형광 활성화 셀 정렬 (FACS)에 의해 세포의 순도를 분석 할 수 있습니다.
- FACS 염색 전략
- 세포 사전 및 분리의 모든 단계, CD4-FITC, CD8a-를 PerCP-Cy5.5와 얼룩 (도우미 및 세포 독성 T 세포)를 게시하고 MHCI에 대한I-PE (MHC 클래스 II 발현하는 세포).
- 세포 사전에 들어하는 CD25 분리, CD4-FITC와 CD25-PE (다른 헬퍼 T 세포 대 Tregs)와 얼룩을 게시 할 수 있습니다.
- CD4-FITC, CD62L-PE와 (메모리 및 이펙터 헬퍼 T 세포에 비해 순진) CD44-APC와 사전 세포 및 사후 CD62L 분리 얼룩하십시오.
- 각 분석 장소에 대한 96 웰 U 바닥 판의 잘 10 5 세포. 4 ℃에서 5 분 동안 600 XG에 원심 분리기. 매체를 붓고 200 μL의 DPBS 한 번 세포를 씻으십시오. 원심 분리기는 위 DPBS을 붓는다.
- 형광 라벨의 탈색을 방지하기 위해 어두운 곳에서 30 분간 실온에서 웰 당 50 μL DPBS 및 (2.4.1로 나타낸 바와 같이) 각각의 항체 0.5 μl를 첨가하고 배양한다.
- 세척 세포는 2.4.2에서와 같이 DPBS로 2 배 즉시 손에서 악기로 특정 프로토콜과 가이드 라인을 사용하여 사이토 흐름을 분석 할 수 있습니다.
주 : 좋은 준비의 최종 분리 단계 후, 세포의 90-95%이됩니다CD62L 높은 T 세포 - CD4 + CD25 될.
- FACS 염색 전략
3. 레트로 바이러스 활성화 CD4 + T 세포의 형질 도입 및 특정 T 도우미 하위 집합으로 자신의 차별화
- 레트로 바이러스 형질 도입
참고 : 레트로 바이러스 통합 및 유전자의 발현은 세포 분열을 필요로한다. 따라서, T 세포는 O / N를 활성화해야합니다.- 순진한 T 세포를 분리하는 동안, 코트 항 CD3과 DPBS에 희석 항 CD28 항체를 가진 24 잘 조직 배양 플레이트. 물론 당 250 μl를 추가합니다. 1μg / ㎖에서 안티 항 CD3을 사용합니다. 세포가 궁극적으로 TH0,받은 Th1, TH2 및 iTregs 조건에서 차별화 될 경우 2 μg의 / ㎖에서 안티 CD28 사용합니다. TH9과 Th17 조건 10 μg의 / ㎖에서 안티 CD28 사용합니다. 조직 문화 인큐베이터에서 37 ° C에서 ~ 2 시간을 품어.
- 직전에 세포를 배양하기 위해, 항체 용액을 제거하고 unbou을 제거 웰당 DPBS ~ 250 μL의 접시를 씻어차 항체. 판 그렇게 한 번에 6 우물의 최대 처리를 건조하게하지 않도록주의하십시오. DPBS 세척 제거하고 ㎖의 당 0.75-1 × 10 6 세포에서 R10 매체에서 순진한 CD4 + T 세포를 1 ㎖를 추가합니다. 세포 O / N (14 ~ 16 시간)을 활성화합니다.
- 30 ° C에서 5 분 900 XG에 접시에 다음 날, 원심 분리기 세포는 우물의 바닥에 전지를 연결합니다.
- 수집하고 세포를 대체하지 않도록주의 매체를 저장하고 바이러스 생산 프로토콜로부터 제조 된 1 ml의 바이러스 배양 상층 액으로 대체합니다. 세포가 그렇게 한 번에 네 우물의 최대 처리를 건조하게하지 마십시오.
- 각각의 잘 바이러스의 흡수를 돕고 다음 원심 분리 동안 주위 CO 2에 상당한 알카리 화를 방지하기 위해 8 ㎎ / ㎖의 폴리 브렌의 1 μL와 1M HEPES 산도 7.5의 10 μl를 추가합니다. 30 ℃에서 90 분 동안 900 XG에 접시에 원심 분리기 세포
- 정시로 세포의 분화FIC 하위 집합
- 조심 바이러스 배양 상청을 제거하고 IL-2 및 다른 T 세포 성장 인자가 포함 같이, 단계 3.1.4에서 상기 수집 된 배지 1 ㎖로 교체한다. 특정 하위 집합으로 세포를 분화 3-4 일 동안 표 2와 문화를 세포에 표시된 시약을 추가합니다.
- 세포의 분석
- 세포 내 사이토 카인 염색법 / 포르 볼 12- 미리 스테이트 13- 아세테이트 (PMA)의 각각을 1 μg의 용액으로 세포들을 처리하고 4 시간 동안 이오 노마 이신. 자극의 마지막 2 시간 동안 brefeldin A의 1 μg의 / ㎖를 추가
- 최대 피펫 팅에 의해 여러 번 아래로 각 웰의 바닥에서 재현 탁 세포. 고정 및 염색에 대한 (목 세포의 문화의 1 ml의에서 일반적으로 100 μL) 96 웰 U 바닥 판에 약 10 5 세포를 전송합니다.
- GFP의 염색을 위해, GFP A를 표백하는 긴 인큐베이션 시간으로 정확히 5 분 동안 실온에서 2 % 파라 포름 알데하이드 100 ㎕와 세포를 해결차 Foxp3의 염색을 방해. 5 분 동안 22 ° C에서 600 XG에 잘 원심 분리기 각 DPBS 100 μl를 추가하여 세포를 씻으십시오. 상층 액을 붓는다.
주의 : 파라 포름 알데히드는 독성이있다. 피부와 눈 보호 흄 후드를 처리합니다. - 다시 Foxp3의 염색 키트 (희석제의 3 볼륨에 고정 버퍼의 1 볼륨) 만든 100 ㎕의 1 배 고정 버퍼를 사용하여 세포를 고정합니다. 실온에서 45 분 동안 세포를 품어 또는 대안으로 16 시간 동안 4 ° C에서 품어.
- 정착 후, 동일한 세트로부터 permeabilization 완충액 100 ㎕를 첨가하여 세포를 Permeabilize 하시려면. 다음 5 분 동안 22 ° C에서 600 XG에 원심 분리기 30 ~ 45 분 동안 실온에서 품어.
- 항체 염색의 경우, 고정 / permeabilization 버퍼를 제거하고 신선한 permeabilization 버퍼의 50 μl를 추가합니다. 샘플 당 0.5 ㎕의 50 당 μL 버퍼에 permeabilization 버퍼에 희석 필요한 항체를 추가합니다. 독감의 표백을 피하기 위해 어둠 속에서 실온에서 30 ~ 45 분 동안 품어orescent 레이블입니다.
- 5 분 동안 22 ° C에서 600 XG에 150 μL의 permeabilization 버퍼와 원심 분리기를 추가합니다. permeabilization 버퍼를 취소하고 200 μL의 DPBS를 추가합니다. 손에서 악기로 특정 프로토콜과 가이드 라인을 사용하여 사이토 흐름을 분석 할 수 있습니다.
참고 : 등, 비 활성화 또는 TH0 활성화 된 세포를 분석, 이소 제어 항체로 염색 같은 사이토 카인 염색에 대한 적절한 컨트롤을 포함해야합니다
결과
이 실험 시스템의 성공은 T 세포와 고역가 레트로 바이러스 제제의 고순도 집단을 필요로한다. 대표적인 결과가 성공적인 실험 예로서 여기에 도시되어있다.도 1은도 2. 순진한 헬퍼 T 세포 격리 프로토콜의 각 단계에서 전후 선택된 집단의 전형적인 순도를 보여주고도 3은 GFP 발현을 레트로 바이러스 생산의 분석을 도시 형질 감염된 HEK의 293T 세포 (그림 2)와 형질 도입 T 세포 (그림 3). HEK 293T 세포의 형질 전환 효율은 다른 레트로 바이러스 작 제물에 따라 크게 변할 수 있지만, 이것은 종종 GFP + T 세포의 수를 관찰 레트로 바이러스 생산의 수준과 상관 없다. 또한, GFP + T 세포의 숫자는 편광 상태에 따라 달라질 수있다. 또한, mGFP의 발현 수준 EAN 일체화 바이러스 매수에 따라 달라질 수있는 삽입 유전자의 전사에 통합 사이트 효과 및 바이러스 전 사체에 영향을주는 전사 후 조절 기전.
마지막으로, 그림 4의 miRNAs은 miR-15B는 / (16)가 과발현 때 우리는 헬퍼 T 세포 분화 관찰 한 전형적인 결과를 보여줍니다. 이러한 결과 때문에 진정한 효과 헬퍼 T 세포의 다양한 제제를 사용하여 여러 반복 실험의 통계적 분석에 의해 입증되어야 개별 실험에서 발생할 수있는 변화들을 보여준다. 이 실험에서, TH2 반응은 한 Th1 반응하는 경향이 있기 때문에 여기에 사용 된 C57BL / 6 라인 관찰하기가 어려울 수있다. 유사하게, IL-9 염색 배경 위에서 검출하기 어려울 수있다. 따라서, 아이소 타입 컨트롤을하고 올바른 조지아을 보장하기 위해 적절한 보상을 설정하는 데 필수적이다사이토 카인의 발현 팅. 우리의 결과에서 우리는은 miR-15B / 16 구성 요소 Rictor과 mTOR의 15의 발현을 억제을 통해 신호 전달 경로에서 mTOR를 억제함으로써 iTreg 유도을 향상 것으로 나타났습니다. 미르 15B / 16 때때로 개별 실험 TH0,받은 Th1 및 Th17 분화에 영향을 미칠 수 있지만, 다수의 반복 실험에서 시험 큰 영향은 없다. 반면은 miR-15B / 16 과발현이 크게 TH9 차별화를 (참조 18 참조) 억제 않습니다.
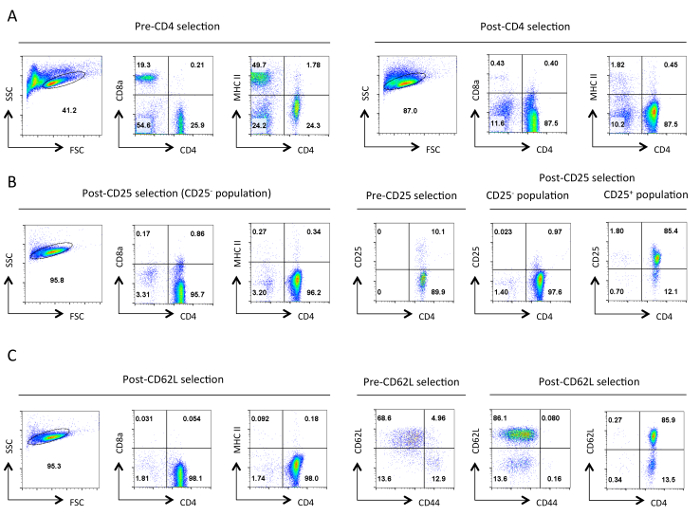
그림 분리의 각 단계에서 헬퍼 T 세포의 1. 일반적인 순도. 표시된 항원의 결과 세포 계측법 대표 흐름은 앞으로 분산 형 (FSC)와 사이드 분산 형 (SSC) 플롯에서 지정한 살아있는 세포의 게이트에서 표시됩니다. (A) 사전 및 사후 CD4 음의 선택. CD4의 발현 프로파일,CD8a 및 MHCII이 표시됩니다. 이러한 헬퍼 T 세포의 보충 및 세포 독성 T 세포의 손실 및 MHC 클래스 II 발현 세포를 나타낸다. 좋은 정화는이 단계에서 90 % CD4 + T 세포 ~ 초래한다. (B) CD25를 선택합니다. 왼쪽에서 CD4, CD8a 및 MHCII의 발현 프로파일, 그리고 오른쪽에있는 CD4이며 CD25 발현 사전 및 사후 선택을 프로필. CD25 부정적인 선택한 셀이 점> 95 %에서 CD4 + CD25해야한다 -. (C) CD62L보세요. CD4, CD8a 및 MHCII 발현 프로파일은 왼쪽에 표시됩니다. 오른쪽에 CD62L과 CD44의 발현 양상은 포스트 선택된 셀의 CD4와 CD62L 식 프로필과 함께 사전 및 사후 CD62L 선택된 셀에 표시됩니다. CD62L 선택되면 거의 모든 메모리 셀 (CD44 +)를 10~15% 이펙터 세포 (CD62L 저)를 함유 나이브 헬퍼 T 세포의 고농축 인구 이탈 제거된다. 모든특정 매개 변수에 대한 FACS 프로필, 동등한 설정 및 저울에 걸쳐 유지 하였다. 숫자는 게이트 집단 내 세포의 비율을 나타낸다. 초기 선택 후 세포의 크기에 약간의 감소는 프로토콜 동안 기계적 스트레스에 아마도 때문이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
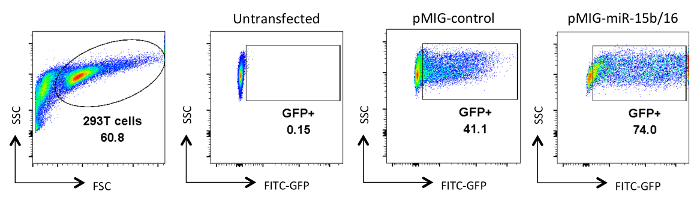
도 레트로 바이러스 형질 감염된 HEK 293T 세포에 2. 분석. GFP 발현은 형질 감염되지 않은 또는 형질 감염 및 바이러스 배양 상청액 수집 한 후 분석 하였다 하나의 HEK 293T 세포에 나타낸다. GFP 분석은 첫 번째 패널에서 금융위원회에 게이트와 SSC 플롯에서 살아있는 세포에서 수행되었다. 숫자는 게이트 영역 내의 GFP + 세포의 비율을 나타낸다. 일반적인 transfection 효율이 30~90% 사이의 범위. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
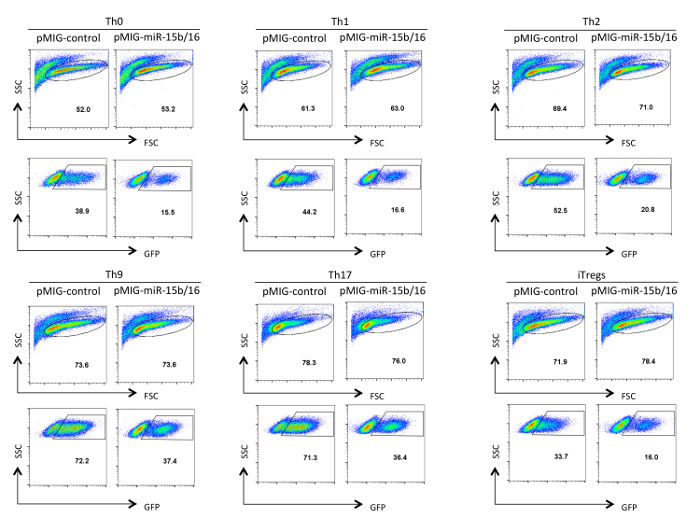
도 레트로 바이러스 형질 헬퍼 T 세포 3. 분석. GFP 발현 TH0,받은 Th1, TH2, TH9, Th17에서 분화 후 레트로 바이러스 형질 도입 헬퍼 T 세포에 도시 한 3 일간 TREG 편광 상태이다. 분석은 FSC / SSC 패널에 표시된 라이브 및 활성화 세포에 문이되었다. 전달 효율은 구조 및 편광 상태에 따라 10~75%에 따라 다를 수 있습니다. 마찬가지로, GFP 발현의 평균 형광 강도는 다릅니다. 수있는 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
: FO 아가씨 = "jove_content" 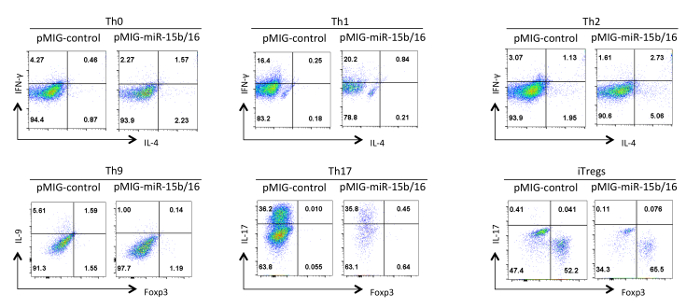
그림은 miR-(15b)의 4 효과 / 다른 편광 상태에서 헬퍼 T 세포 분화에 16 과발현. 대표적인 사이토 카인 프로필이 GFP + 그림 3에서 세포의 인구에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

표 1 :.이 프로토콜에 사용되는 버퍼 Excel 스프레드 시트로이 표를 다운로드하려면 여기를 클릭하십시오.
| 돕는 사람T 세포 편광 상태 | ||
| TH0 | 항 IL-4 | 5 μg의 / ㎖ |
| 안티 IFN-γ | 5 μg의 / ㎖ | |
| TH1 | 재조합 IL-12 | 20 ng를 / ㎖ |
| 항 IL-4 | 5 μg의 / ㎖ | |
| TH2 | 재조합 IL-4 | 각 40ng / ㎖ |
| 안티 IFN-γ | 5 μg의 / ㎖ | |
| TH9 | 재조합 TGF-β | 2.5 ng를 / ㎖ |
| 재조합 IL-4 | 각 40ng / ㎖ | |
| 안티 IFN-γ | 10 μg의 / ㎖ | |
| Th17 | 재조합 TGF-β | 2.5 ng를 / ㎖ |
| 재조합 IL-6 | 50 ng를 / ㎖ | |
| 안티 IFN-γ | 5 μg의 / ㎖ | |
| 항 IL-4 | 5 μg의 / ㎖ | |
| 항 IL-2 | 5 μg의 / ㎖ | |
| Tregs | 재조합 TGF-β | 2.5 ng를 / ㎖ |
| 재조합 IL-2 | 5 NG / ㎖ | |
표 2 : 헬퍼 T 세포 서브 세트의 편광 상태.
토론
이들 발전과 기능은 종종 키 조정기의 발현에 의해 결정되는 바와 같이 레트로 바이러스 매개 된 유전자의 과발현은 헬퍼 T 세포의 기능을 분석하기위한 강력한 방법이다. 크게 내인성 유전자들 위에서 발현 여러 이슈를 도입 할 수 있기 때문에, 결과의 해석에주의가 필요하다. 따라서,이 기술은 함수의 관련성을 확인하기 위해 다른 조합한다. 예를 들어, 과발현이 가능한 경우 siRNA를 또는 유전자 녹아웃을 사용하여 단축 된 표현에 의해 보완되어야한다. 의 miRNAs, 우리는 miRNA의 15 경쟁력 억제제 행동 사이트를 대상으로 인공 miRNA의를 과발현 바이러스를 사용하여 차단하는 것과 과발현 실험을 보완. 레트로 바이러스 형질 도입 된 세포는 RNA 및 단백질 분석을 포함하는 생화학 적 분석에 이용 될 수있다. 그러나,이 실험의 주요 제한은 입술 전달 효율은형질 도입 및 untransduced 세포의 혼합 인구 ulting. 따라서 이러한 분석은 가능성이 가장 높은 GFP + 인구의 정렬이 필요합니다. 마지막으로, 체외 분화 분석은 생체 내 실험과 결합하고, 이것이 달성 될 수있는 한 가지 방법은 적응 적 마우스로 형질 도입 된 T 세포의 전사 및 분화 및 면역 반응에 미치는 영향에 따라이다한다.
이 시스템의 주요 한계들 중 하나는 레트로 바이러스 캡시드 내로 패키징 될 수있는 RNA 게놈의 크기이다. 우리의 경험에서, 좋은 바이러스 생산을 제공 MIG의 레트로 바이러스 시스템의 최대 삽입 크기는 3-3.5 KB입니다. 이들은 불량 바이러스 역가를 제공 따라서 큰 유전자는이 시스템을 해석 할 수 없다. 이 시스템의 유전자 연구의 다양한 유용하므로 그러나, 대부분의 유전자가이 크기보다 작다.
레트로 바이러스 전달이 protoco 내에서 여러 가지 대안으로LS가 사용되어왔다. 많은 연구자 안정적 레트로 바이러스 유전자 (예 16 참조) 발현 패키징 세포주를 이용했다. 그러나, 우리는 PCL 에코 헬퍼 바이러스 벡터의 공동 형질 표준의 HEK 293T 세포를 사용하여 최고 역가를 얻었다. 나이브 헬퍼 T 세포의 분리는 자성 비드와 세포 분리 컬럼 프로토콜 대신 정렬 셀을 통해 달성 될 수 있지만, 이는 셀 소터에 대한 액세스를 요구하고, 일종의 시간에 대한 비용은 일반적으로 비드 시약보다 더 높다. 마지막으로, 서로 다른 서브 세트에 헬퍼 T 세포를 구별하는 데 사용되는 작동 조건에 변동이있다. 예를 들어, 너무 오래 세포의 TCR 자극은 TREG 유도 조건에 노출하기 전에 유도 (16)을 억제 할 수 있습니다. 레트로 바이러스 발현 세포의 자극에 의해 유도되는 세포의 분열을 필요로하기 때문에 문제가 될 수있다. 그럼에도 불구하고, 우리는 O / N의 액티브이 프로토콜을 사용하여 효율적인 TREG 유도를 발견레트로 바이러스 전달하기 전에 ATION.
이러한 프로토콜 내에서 성공적인 응용 프로그램은 몇 가지 요소가 필요합니다. 높은 역가 레트로 바이러스 제제는 중요하다 HEK의 293T 세포 때문에 높은 품질의 DNA와 정확하게 준비 배 HBS의 효율적인 형질 전환이 필요합니다. 형질 감염된 DNA를 잘 발현은 세포가 너무 희박한 또는 조밀 한 경우 세포가 활발히 성장하고,이 억제되도록 요구하기 때문에 또한 HEK 293T 세포의 세포 밀도는 형질의 시점에서 약 50 %가 될 필요가있다. 형질 전환시 최적의 농도에서 세포는 바이러스 수집 단계 동안 어떤 시점에서 합류에 도달해야하지만, 그들은 모든 방법 마지막 컬렉션을 통해 높은 역가의 바이러스 주식을 생산하는 것입니다. 헬퍼 T 세포의 효율적인 분화 세포 좋은 품질이되도록 분리 된 세포는도 1에 도시 된 순도되도록 요구한다. 마찬가지로, 셀의 품질은 쥐 FR에 의존그들은 고립 된 엄마. 이러한 연구를 위해, 우리 6-8 주령 C57BL / 6 마우스를 사용하고 있습니다. 이전 마우스는 덜 순진 세포를 가질 수 있고, 다른 균주는 차별화 다를 수 있습니다. T 세포는 TH2 반응을 유도하기 어려울 수 있으며, 상기 C57BL / 6 바와 같이 예를 들어, BALB / c 마우스 그래서 C57BL / 6 마우스 17보다 TH2 반응에 더 쉽다. 또한, 분화 조건들은 실험실 실험실에서 약간 다를 수 있고, 다양한 편광 상태의 사이토 카인 농도는 적정 될 필요가있을 수 있으므로 유전자 과발현의 효과는 서브 - 최적의 조건에서 명백해질 수있다. 마지막으로, 세포 증식의 과발현 유전자의 영향이나 편광 상태는 관심의 유전자의 측정 이렇게 효과 편광 시약의 타이밍 및 농도를 최적화 필요할 수 전달 효율에 영향을 미칠 수있다. 이러한 모든 요소를 최적화하는 것은이 시스템에 유익한 결과를 가져올 것이다.
공개
The authors have no conflicting interest in the publication of this work.
감사의 말
This work was supported by a Biotechnology and Biological Sciences Research Council (BBSRC) grant (BB/H018573/1) and a BD Biosciences grant.
자료
| Name | Company | Catalog Number | Comments |
| RPMI | Sigma | R8758 | |
| DMEM | Sigma | D5671 | |
| Penicillin Streptomycin solution | Sigma | P4333 | |
| L-Glutamine | Sigma | G7513 | |
| β-mercaptoethanol | Sigma | M3148 | |
| DPBS | Sigma | D8537 | |
| MIG vector | Addgene | Plasmid 9094 | |
| pCL-Eco vector | Addgene | Plasmid 12371 | |
| Cell strainer | BD Falcon | 352350 | |
| Magnetic beads mouse CD4 cell kit | Invitrogen (Dynabeads) | 11415D | |
| Streptavidin Beads | Miltenyi Biotech | 130-048-102 | |
| MS cell separation columns | Miltenyi Biotech | 130-042-201 | |
| LS cell separation columns | Miltenyi Biotech | 130-042-401 | |
| CD25 Biotenylated MAb | BD Biosciences | 85059 | clone 7D4 |
| CD62L Biotenylated MAb | BD Biosciences | 553149 | clone MEL-14 |
| Polybrene (Hexadimethrine Bromide) | Sigma | 107689 | |
| Anti-CD3 | eBiosciences | 16-0031-85 | clone 145-2C11 |
| Anti-CD28 | eBiosciences | 16-0281-85 | clone 37.51 |
| Anti-IL-4 | BD Biosciences | 559062 | clone 11B11 |
| Anti-IFN-gamma | BD Biosciences | 559065 | clone XMG1.2 |
| Anti-IL-2 | BD Biosciences | 554425 | cloneJES6-5H4 |
| Recombinant IL-12 p70 | eBiosciences | 14-8121 | |
| Recombinant IL-4 | BD Biosciences | 550067 | |
| Recombinant TGF-beta | eBiosciences | 14-8342-62 | |
| Recombinant IL-6 | eBiosciences | 14-8061 | |
| Recombinant IL-2 | eBiosciences | 14-8021 | |
| PMA | Sigma | P8139 | |
| Ionomycin | Sigma | I0634 | |
| Brefeldin A | eBiosciences | 00-4506 | |
| Paraformaldehyde | Sigma | 16005 | Paraformaldehyde is toxic so use appropriate caution when handling |
| Foxp3 staining buffer set | eBiosciences | 00-5523 | |
| Anti-CD4 FITC | eBiosciences | 11-0041 | clone GK1.5 |
| Anti-CD8a perCP-cy5.5 | eBiosciences | 45-0081-80 | clone 53-6.7 |
| Anti-MHCII PE | eBiosciences | 12-0920 | clone HIS19 |
| Anti-CD25 PE | eBiosciences | 12-0251-82 | clone PC61.5 |
| Anti-CD62L PE | eBiosciences | 12-0621-82 | clone MEL-14 |
| Anti-CD44 APC | eBiosciences | 17-0441 | clone IM7 |
| Anti-IFN-gamma FITC | eBiosciences | 11-7311-81 | clone XMG1.2 |
| Anti-IL-4 PE | BD Biosciences | 554435 | clone 11B11 |
| Anti-IL-9 PE or APC | eBiosciences/Biolegend | 50-8091-82/514104 | clone RM9A4 |
| Anti-IL-17a PE | BD Biosciences | 559502 | clone TC11-18H10 |
| Anti-Foxp3 APC or PE | eBiosciences | 17-5773-82/12-5773-80 | clone FJK-16s |
| NaCl | Sigma | S7653 | |
| KCl | Sigma | P9333 | |
| Na2HPO4-2H2O | Sigma | 71643 | |
| Dextrose/Glucose | Sigma | G7021 | |
| HEPES, free acid | Sigma | H3375 | |
| NH4Cl | Sigma | A9434 | |
| Disodium EDTA | Sigma | D2900000 | |
| KHCO3 | Sigma | 237205 | |
| CaCl2 | Sigma | C5670 |
참고문헌
- Baumjohann, D., Ansel, K. M. MicroRNA-mediated regulation of T helper cell differentiation and plasticity. Nat Rev Immunol. 13 (9), 666-678 (2013).
- Wilson, C. B., Rowell, E., Sekimata, M. Epigenetic control of T-helper-cell differentiation. Nat Rev Immunol. 9 (2), 91-105 (2009).
- Pearce, E. L., Poffenberger, M. C., Chang, C. H., Jones, R. G. Fueling immunity: insights into metabolism and lymphocyte function. Science. 342 (6155), 1242454 (2013).
- Cherry, S. R., Biniszkiewicz, D., Van Parijs, L., Baltimore, D., Jaenisch, R. Retroviral Expression in Embryonic Stem Cells and Hematopoietic Stem Cells. Mol and Cell Biol. 20 (20), 7419-7426 (2000).
- Miller, A. D., Rosman, G. J. Improved retroviral vectors for gene transfer and expression. BioTechniques. 7 (9), 980-990 (1989).
- Grez, M., Akgün, E., Hilberg, F., Ostertag, W. Embryonic stem cell virus, a recombinant murine retrovirus with expression in embryonic stem cells. Proc Nat Acad Sci USA. 87 (23), 9202-9206 (1990).
- Naviaux, R. K., Costanzi, E., Haas, M., Verma, I. M. The pCL vector system: rapid production of helper-free, high-titer, recombinant retroviruses. J Virol. 70 (8), 5701-5705 (1996).
- Filipowicz, W., Bhattacharyya, S. N., Sonenberg, N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?. Nat Rev Genetics. 9 (2), 102-114 (2008).
- He, L., Hannon, G. J. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genetics. 5 (7), 522-531 (2004).
- Bernstein, E., Kim, S. Y., et al. Dicer is essential for mouse development. Nat Genetics. 35 (3), 215-217 (2003).
- Cobb, B. S., Hertweck, A., et al. A role for Dicer in immune regulation. J Exp Med. 203 (11), 2519-2527 (2006).
- Chong, M. M. W., Rasmussen, J. P., Rudensky, A. Y., Rundensky, A. Y., Littman, D. R. The RNAseIII enzyme Drosha is critical in T cells for preventing lethal inflammatory disease. J Exp Med. 205 (9), 2005-2017 (2008).
- Liston, A., Lu, L. F., O'Carroll, D., Tarakhovsky, A., Rudensky, A. Y. Dicer-dependent microRNA pathway safeguards regulatory T cell function. J Exp Med. 205 (9), 1993-2004 (2008).
- Zhou, X., Jeker, L. T., et al. Selective miRNA disruption in T reg cells leads to uncontrolled autoimmunity. J Exp Med. 205 (9), 1983-1991 (2008).
- Singh, Y., Garden, O. A., Lang, F., Cobb, B. S. MicroRNA-15b/16 Enhances the Induction of Regulatory T Cells by Regulating the Expression of Rictor and mTOR. J Immunol. 195 (12), 5667-5677 (2015).
- Sauer, S., Bruno, L., et al. T cell receptor signaling controls Foxp3 expression via PI3K, Akt, and mTOR. Proc Nat Acad Sci USA. 105 (22), 7797-7802 (2008).
- Yagi, J., Arimura, Y., Takatori, H., Nakajima, H., Iwamoto, I., Uchiyama, T. Genetic background influences Th cell differentiation by controlling the capacity for IL-2-induced IL-4 production by naive CD4+ T cells. Int Immunol. 18 (12), 1681-1690 (2006).
- Singh, Y., Garden, O. A., Lang, F., Cobb, B. S. MicroRNAs regulate T-cell production of interleukin-9 and identify hypoxia-inducible factor-2a as an important regulator of T helper 9 and regulatory T-cell differentiation. Immunology. 149, 74-86 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유