A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ב חוץ גופית Assay פעילות עבור ppGpp (p) המעביר מ Clostridium difficile וטיהור
In This Article
Summary
כאן, אנו מתארים שיטה לטיהור מתויג היסטידין pyrophosphokinase אנזימים וניצול כרומטוגרפיה שכבה דקה של סובסטרטים radiolabelled ומוצרים כדי assay עבור פעילות אנזימטי בתוך חוץ גופית. וזמינותו פעילות האנזים ישימה בהרחבה על כל קינאז, נוקלאוטיד cyclase או התגובה פוספור-העברת מנגנון אשר כולל נוקלאוטיד טריפוספט הידרוליזה.
Abstract
אנזימים קינאז, pyrophosphokinase העברה של פוספט גמא או את moiety רב-תכליתי בטא-גמא של נוקלאוטיד טריפוספט מבשרי סובסטרטים ליצירת מוצרים phosphorylated. השימוש של γ -32- P שכותרתו NTP מבשרי מאפשר פיקוח סימולטני של ניצול המצע היווצרות המוצר על-ידי רדיוגרפיה. שכבה דקה כרומטוגרפיה (TLC) על צלחות תאית מאפשרת כימות רגיש של המצע והמוצר והגליונות מהירה. אנו מציגים שיטה ניצול של כרומטוגרפיה דק-שכבה כדי assay לפעילות pyrophosphokinase המעביר ppGpp מטוהרים (p). שיטה זו כבר בעבר בשימוש כדי לאפיין את פעילות מחזורית synthetases נוקלאוטיד, dinucleotide ומתאים בהרחבה אפיון הפעילות של כל אנזים הידרוליזה ערבות טריפוספט נוקלאוטיד או מעביר מסוף פוספט מתורם פוספט כדי מולקולה נוספת.
Introduction
אנזימים קינאז, pyrophosphokinase (או diphospho-קינאז) להעביר פוספטים מבשרי טריפוספט (NTP) נוקלאוטיד המצע מולקולות. מצעים באפשרותך לכלול אחרים נוקלאוטידים, חומצות אמינו או חלבונים, פחמימות, שומנים1. ניתוחים Bioinformatic יכול לפעמים לחזות המצע cognate של אנזים או מצעים על סמך הדמיון כדי אנזימים מאופיין, אך אימות ניסיוני עדיין נחוץ. באופן דומה, בזיקה של אנזים substrate(s) שלו ואת הקצב שבו זה מזרז את התגובה פוספור-העברה, ואת ההשפעות של גורמים שותפים, מעכבי, או effectors אנזימים אחרים. להיקבע השפעול. כדי למנוע דלדול של מבשר ATP על ידי אחרים הצורכים ATP אנזימים המצויים הציטופלסמה חיידקי, פעילות כמותיים מבחני דורשים חלבון מטוהרים.
חלבון טיהור באמצעות כרומטוגרפיית זיקה מתכת כבר מכוסה באופן יסודי של ספרות2,3. תגיות היסטידין בהיקף של שישה שאריות היסטידין רצופים מצורף ל N - או C-הסופית של חלבון רקומביננטי מאפשרות טיהור מהירה זיקה מתכת כרומטוגרפיה4,5,6. רצפים אלה הם קטנים לעומת החלבונים הם לשנות, בדרך כלל יש השפעה מינימלית על פונקציה של חלבונים, למרות שהם יכולים לפעמים לשנות יציבות החלבון ו/או אנזים קינטיקה7,8. היסטידין תגים ב- N -, C-טרמיני של החלבון אותו יכול לקבל אפקטים שונים, אשר קשה לחזות מבלי להכיר את המבנה של החלבון המדובר. תגיות היסטידין משולבים בדרך כלל במהלך שכפול של חלבון רקומביננטי על-ידי עיצוב תחל זה לקודד את שאריות היסטידין 6, גם מיד 3' כדי codon התחלה ATG או מיידית 5' ל stop codon של מסגרת קריאה פתוחה. לאחר הגברה, הגן המכיל hexahistidine מאתרים לתוך וקטור תחת השליטה של יזם inducible, ביטוי, בדרך כלל זן מעבדה של e. coli. אז יכול להיות מבודדת החלבון רקומבינציה על שרף זיקה המכיל קיבוע קטיונים דו ערכיים (בדרך כלל ניקל או קובלט)9. ניתן להסיר מזהמות יליד המתכת מחייב חלבונים על ידי טיטור עם imidazole, אשר והשמה מזיחה חלבון מאוגד2. בסופו של דבר, חלבון המטרה הוא eluted מן העמודה עם ריכוז גבוה של imidazole. ישנם כמה מקורות מסחריים עבור קיבוע הקטיון מתכת שרפים, היצרנים לספק המלצות כדי להפוך את מאגר תנאים imidazole ריכוזים. לאחר • תנאי, חלבון יכול להיות נותחו על ידי נתרן dodecyl סולפט-לזיהוי בג'ל (מרחביות-עמוד), דיאליזה או מיד בשימוש מבחני פונקציונלי.
ישנן מספר שיטות לפיקוח פעילות קינאז בעקיפין על ידי צימוד הידרוליזה בונד פוספט ATP ריאקציה השנייה משחררת או מרגש fluorophore או יוצרת chemiluminescence, אבל תגובות אלו חלקים מרובים, ניתן יהיה לוגיסטית מאתגר10. הדרך הברור ביותר למדוד באופן ספציפי פוספור-העברת פעילות היא לפקח באופן ישיר ההעברה של קבוצת פוספט radiolabeled וγ זמינים מסחרית -32-P NTP קודמן המצע radiolabeled11 , 12 , 13. תערובות של סובסטרטים radiolabeled ומוצרים יכולים להיות מופרדים ו לכמת על ידי שכבה דקה כרומטוגרפיה (TLC). TLC מנצל את הניידות דיפרנציאלית של מומסים בגבול הממס נתון על-ידי מתן הממס (שלב נוזלי) להעביר על ידי נימיות על פני משטח (מעבדתי) שעליו היה תערובת של מומסים בגבול הספוחה14. מומסים בגבול קטנים ו/או חוסר אינטראקציה חיובית עם השלב מוצק נודדים למרחקים ארוכים ממיקומם הראשוני יותר מומסים בגבול עם משקל מולקולרי גבוה יותר או הזיקות נהדר עבור המוצק. בחינת פוספור-העברה, פוספט moieties להגדיל את המשקל המולקולרי של מולקולות הם מתווספים ולהוסיף מטען יוניים שלילי ב- pH נייטרלי או חומצי11,12,14. זה מקטין את הניידות שלהם על משטח בסיסיים כגון פיי-תאית. כשאתה פותח חומצי אשלגן פוספט מאגר, תערובות של מונו-, די-, tri-, טטרה- ו pentaphosphate מינים ניתן להפריד בקלות על פיי-תאית, המאפשר כימות של כל מין (איור 2, איור 3). מבחני כזה יכול להתבצע באמצעות lysates תאים המכילים את האנזים עניין, אבל זה כולל את פוטנציאל הפעילות של kinases אחרים, phosphatases ATPases כללי כדי לרוקן את המצע ו/או המוצר. עבור כמותיים במבחנה הערכה של פעילות אנזים, יש צורך לטהר את האנזים עניין.
Guanosine tetraphosphate (ppGpp) guanosine pentaphosphate (pppGpp) הם ribonucleotide איתות מולקולות נוצר על ידי העברת רב-תכליתי קבוצה של קודמן אדנוזין טריפוספט (ATP), בהתאמה, של diphosphate guanosine (תמ ג) או guanosine tetraphosphate (GTP) המצע15. אותות אלה ribonucleotide יחיד, המכונה באופן קולקטיבי (p) ppGpp, מתווכים ברמת התא בתגובה עקה המכונה תגובת מחמירים ב15,מגוונת מיני החיידקים16. שתי מחלקות ההכפלה של אנזימים לעודד היווצרות של15,ppGpp (p)17 Rel/Spo אנזימים homolog (RSH) הם 'זמן' bifunctional (p) ppGpp המעביר/hydrolases בשם שלהם דמיון רלה, ספוט (p) ppGpp מטבולית אנזימים של Escherichia coli אשר מכילים המעביר ההידרולז, תחומי הרגולציה, בעוד alarmone קטן המעביר (SAS) אנזימים synthetases monofunctional קצר נמצאו אך ורק גראם חיידקים חיוביים15, 17 , 18. יוצרי נבג גראם חיוביים החיידק Clostridium difficile מקודד בשם RSH ו- SAS הגנים19. כאן, אנו מציגים פעילות ראשונית מבחני לאשר כי האנזים RSH difficile ג הוא המעביר ppGpp catalytically פעיל (p).
Access restricted. Please log in or start a trial to view this content.
Protocol
1. inducible ביטוי של חלבון מתויג היסטידין
- להגביר rsh מ ג difficile הדנ א R20291.
- השתמש פולימראז אמינות גבוהה ופעל לפי הוראות היצרן.
- להגביר difficile ג rsh באמצעות תחל
rsh_F (CAGGTACCGGTTATATGCATGATAAAGAATTACAAG),
rsh_R (CCCTGCAGCTAATGGTGATGGTGATGGTGATTTGTCATTCTATAAATAC), אשר מציגה תג hexahistidine C-טרמינל.
הערה: KpnI ואת PstI לחתוך אתרי ברצף פריימר הם מודגשים. - לעכל את הווקטור pMMBneo וחותכים המוצר PCR rsh-his6 עם הגבלת Pstl ו- KpnI אתרים ב 37 מעלות צלזיוס למשך 45 דקות.
- לטהר הווקטור ליניארית, שברי PCR ויה agarose בג'ל וטיהור הבאים עם ערכת חילוץ ג'ל הדנ א.
- למדוד את ספיגת nm 280 (280) של וקטור ואת המוצר PCR מוגבר. להשתמש את המשוואה
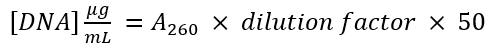 כדי לקבוע את ריכוז הדנ א של כל שבר ה-DNA.
כדי לקבוע את ריכוז הדנ א של כל שבר ה-DNA.
- מאתרים ומפסיקים rsh לתוך pMMBneo לביטוי.
- לשלב 25 ng של וקטור PMMBneo מעוכל, 125 ng של המוצר ג'ין rsh-his6 , 2 μL של 10 x מאגר ליגאז 1 μL של ה-DNA ליגאז. השתמשו המים חינם נוקלאז להתאמת אמצעי האחסון הכולל 20 μL. דגירה ב 16 ° C עבור 16 h.
הערה: היעילות של מצדו תלוי בגודל פרגמנט, שתישמר בהתבסס על יצרן פרוטוקולים. - להפוך את המוצר וקטור מחוברים e. coli DH5-α או אחר רקה - פלסמיד תחזוקה זן. בחר בתאים טרנספורמציה על צלחות ליברות עם kanamycin μg/mL 100 ולאחר תקופת דגירה של 16-24 h ב- 37 מעלות צלזיוס.
- לבחור ארבע המושבות מהצלחת טרנספורמציה (s), פסים אחד על צלחת טריים המכילים 100 kanamycin μg/mL עבור בידוד של דנ א. דגירה הלוחות חדש ב 37 מעלות צלזיוס במשך 16-24 h, בחר אחד בודד עבור הביטוי חלבון עוקבות.
- כדי לאשר את מצדו מוצלחת של החלבון ללא פגע rsh קידוד האזור, פיק מושבה של הנבחרת לבודד לתוך 20 μL של מים, חום ב 95 מעלות צלזיוס למשך 10 דקות ולאחר כתבנית לשימוש PCR מאשרות באמצעות הראשיים אותו. להשתמש כדי להגביר את הגן.
- לשלב 25 ng של וקטור PMMBneo מעוכל, 125 ng של המוצר ג'ין rsh-his6 , 2 μL של 10 x מאגר ליגאז 1 μL של ה-DNA ליגאז. השתמשו המים חינם נוקלאז להתאמת אמצעי האחסון הכולל 20 μL. דגירה ב 16 ° C עבור 16 h.
- להפוך את פלסמיד מאומת על פי פרוטוקולים סטנדרטיים טרנספורמציה לשינוי פלסמיד חיידקי e. coli למערכת BL21 e. coli לייצור חלבון תשואה גבוהה.
- אקספרס RSH-His6 ב e. coli.
- בחר מושבה בודדת של e. coli BL21 הפך עם pMMBneo::rsh , לחסן 2 מ ל LB בינוני עם 50 kanamycin μg/mL. דגירה ב 37 ° C h 12-16 תוך טלטול-250 סל"ד.
- לחסן 500 מ"ל של מדיום LB המכיל 50 kanamycin μg/mL 0.5 מ של התרבות לילה צמיחת תאים וביטוי חלבונים.
- דגירה התרבות ביטוי ב 37 ° C ו 250 סל"ד ב שייקר אינקובטור עד צפיפות התא מגיע עם יתר600 0.167 ב 37 º C.
- לצמצם את הטמפרטורה חממה של 30 מעלות צלזיוס ולא לחכות 30 דקות על הטמפרטורה תרבות לרדת.
- כדי ריכוז סופי של 0.5 מ מ, להשפיע RSH הביטוי על-ידי הוספת איזופרופיל β-D-thiogalactoside (IPTG). לאפשר את תנאי הגיוס יתקיים בין לילה (עבור h 16 – 18) ב 30 מעלות צלזיוס, רועדת-250 סל"ד.
- גלולה על ידי צנטריפוגה ב g x 3,080 למשך 30 דקות ב 4 º C.
הערה: בגדר ניתן לאחסן במשך הלילה ב-20 ° C לטיהור חלבון המטרה למחרת ללא הפסד מורגש של חלבון תשואה או פעילות אנזימטיות.
2. חלבון טיהור באמצעות כרומטוגרפיית זיקה ניקל
הערה: להמשיך ישירות עם חלבון טיהור הפעולות המפורטות להלן לאחר הבהרת את התא lysate. אחסון הבהיר lysate ב 4 ° C בלילה עבור טיהור חלבון הבאים מפחית את התשואה חלבון.
- לטהר חלבון באמצעות 1 מ"ל של ניקל-Nitriloacetic חומצה (Ni-נ) שרף על עמודה הכבידה.
- יום לפני השימוש, equilibrate את העמודה בן לילה ב 4 ° C עם 2 מ של מאגר equilibration (10 מ מ טריס-HCl pH 7.79, 300 מ"מ NaCl, 50 מ מ2PO NaH4ליזוזים 0.5 מ"ג/מ"ל, 5 מ מ MgCl2, imidazole 10 מ מ, 0.25 mM DTT, 5 מ מ phenylmethane sulfonyl פלואוריד (PMSF), 10% גליצרול).
- למחרת היום להביא את העמודה של 4 ° C עד RT לפני טעינת את שקופה lysate ותן מסמלת ~ 2-3 h.
הערה: להביא את העמודה שיווי משקל תרמי הוא חיוני כדי למנוע בועות אוויר ויוצרים בתוך העמודה. - Resuspend בגדר שהושג בשלב 1.3.6 במאגר של פירוק (10 מ מ טריס-HCl pH 7.8, 300 מ"מ NaCl, 5 מ מ MgCl2, 50 מ מ2PO NaH4, 10% גליצרול, ליזוזים 0.5 מ"ג/מ"ל, imidazole 10 מ מ, 0.25 מ"מ DTT ו 5 מ מ PMSF).
- Sonicate תאים על קרח עבור 8 x 10 s מרווחים, השהיית 30 s בין פולסים.
- להבהיר את lysate על ידי צנטריפוגה ב g x 3,080 למשך 30 דקות ב 4 ° C באמצעות של microcentrifuge.
- להכין lysate עם נפחים שווים של פירוק מאגר והחילו הבהיר lysate לעמודה ומזומן לאסוף את הזרימה דרך.
- החל מובהר lysate זרימה דרך לעמודה ולאסוף את הזרימה-דרך משנית.
- לשטוף את העמודה עם שטיפת מאגר 1 (10 מ"מ טריס-HCl (pH 7.79), 300 מ"מ NaCl, 5 מ מ MgCl2, 50 מ מ2PO NaH4, imidazole 30 מ מ, 10% גליצרול). לאסוף את הזרימה דרך.
הערה: הכללה של 5 מ מ MgCl2 במאגרי רוחצים את • תנאי חשוב לפעילות אנזימטי של חלבון מטוהרים. - לשטוף את העמודה עם שטיפת מאגר 2 (10 מ מ טריס-HCl (pH 7.79), 300 מ"מ NaCl, 5 מ מ MgCl2, 50 מ מ NaH2PO4 ו- 50 מ מ imidazole). לאסוף את הזרימה דרך.
- החל מ ל 2 • תנאי מאגר (10 מ מ טריס-HCl (pH 7.79), 300 מ"מ NaCl, 50 מ מ2PO NaH4, 10% גליצרול ו- 75 מ מ imidazole). לאסוף זרימה דרך שני שברים של 1 מ ל כל אחד.
הערה: העמודה לאחר שלב זה ניתן לאחסן במאגר equilibration ב 4 ° C אם החלבון אותו יטוהר ב וזמינותו טיהור הבא. העמודה יכולה לשמש עד 3 פעמים אם מאוחסנים כראוי.
- להעריך את העמודה שברים טוהר על ידי עמודים מרחביות.
- להעריך איכותית חלבון טיהור, להפעיל aliquots 20 μL של כל עמודה שברים על ג'ל 4% / 10% לזיהוי עבור 60 דקות ב-170 V.
- כתם הג'ל עם 0.1% Coomassie כחול בטמפרטורת החדר במשך 5 שעות, נדנדה בעדינות על כיסא נדנדה benchtop.
- Destain את הג'ל ב- 40% מתנול, 10% חומצה אצטית קרחונית ללילה בטמפרטורת החדר, נדנדה על כיסא נדנדה benchtop.
הערה: ג'ל נציג מתואר באיור1.
- Dialyze elute שבר 2 בן לילה ב 4 º C.
- Dialyze נגד המאגר דיאליזה (15.7 מ מ טריס-HCl (pH 7.6), 471.9 מ מ NaCl, 15.69 מ"מ MgCl2, גליצרול DTT, 1.5 מ מ PMSF ו- 15.7% מ מ 1.57) ביחס של 200: 1 באמצעות מכשיר דיאליזה 1 מ"ל עם ניתוק משקל מולקולרי kDa 20 (MWCO).
- לקבוע את הריכוז של חלבון דיאליזה לדוגמה על ידי מדידת ספיגת ב 280 ננומטר ושימוש הכחדה טוחנת מחושב מקדם 82085 M-1ס מ-1 20.
- אחסן aliquots μL 5 המדגם דיאליזה חלבון aliquots ב-80 מעלות צלזיוס עד השימוש.
3. חלבון Assay פעילות על ידי שכבה דקה כרומטוגרפיה
- הכינו את הצלחת כרומטוגרפיה שכבה דקה.
- לפני שתבצע את התגובה, להכין polyethyleneimine (פיי)-צלחות תאית על ידי שטיפה במים יונים. מקם את לוחיות הרישוי בתוך תא זכוכית עם מים מזוקקים זוגי עד לעומק של ~0.5 ס מ.
- אפשר מים להעביר אל החלק העליון של הלוח.
הערה: לשטוף את לוחיות הרישוי אינו הכרחי לחלוטין, כמו צלחות עשוי לשמש בלעדיו, אבל הכביסה להגדיל את הבהירות של התמונות המתקבלות. לשטוף את הצלחות בשני כיוונים בניצב נוספת מבטיחה כי כל מזהמים נוכח השרף מבודדים בפינה אחת של הצלחת (איור 2). - להוציא את הצלחות תא זכוכית ולהשאיר מתלה benchtop כדי לילה יבש (12-18 h).
- סמן את הצלחות יבש 2.0 ס מ מקצה אחד עם עיפרון רך כדי לציין היכן הדגימות שיוחל עבור TLC. לקבלת דוגמאות μL 2, להחיל דוגמיות לא פחות מ 1.0 ס מ אחד מהשני (איור 2).
הערה: פעולה זו מאפשרת הפרדה ברורה בין ספוט סמוכים, אשר חיוני על האות כימות. ככל שרף תאית אינה שרוט, קטן לסימני על פני השטח לא יתערב ההעברה הממס. - תכנון ניסויים, תמיד להשאיר מקום אחד שהלוח בשימוש.
הערה: פעולה זו תספק נתיב ריק על כימות מדגם (איור 2). צלחת 20 ס מ TLC יהיה מקום 19 נקודות.
- Assay פעילות האנזים
- להכין תערובת מאגר 5 x המכיל 50 מ"מ טריס-HCl (pH 7.5), אצטט אמוניום 25 מ מ, 10 מ מ אשלגן כלורי, 1 מ"מ DTT ו- 0.6 מ"מ ATP.
הערה: בשילוב זה עשוי להיות מוכן בכמויות גדולות, קפוא aliquots 10 μL לשימוש מאוחר יותר. נושא לא לערבב מספר מחזורים ההקפאה-הפשרה. - להכין תגובות בודדות המכיל 3 μM RSH, 1 x מאגר מיקס, 0.6 מ"מ התמ"ג, 1.2 מ מ MgCl2. הוסף μCi 1.0 של γ -32P-ATP לכל 10 μL של תגובה והשתמש מים חינם נוקלאז להביא את התגובה עד נפח הרצוי. הוסף את RSH לאחר יש מספר רכיבים אחרים, כמו התוספת של RSH לתערובת נוקלאוטיד המכיל יוזם את assay אנזימטי פעילות.
הערה: נפח התגובה הסופי יהיה תלוי מספר timepoints שנדגמו. כדי לבצע דגימה μL 2/timepoint, להרכיב μL 10 תערובת התגובה עבור כל timepoints 4. - כדי לשלוט על הידרוליזה של ATP מפעילות נוקלאז מזהמים, להרכיב לתגובה μL 10 המכיל חלבון לא, דגירה זה במקביל. ספוט 2 דוגמאות μL-t = 0, בסוף הניסוי כדי להבטיח כי ATP לא היה הידרוליזה בהיעדר חלבון.
- מיד עם תוספת של RSH, להסיר את 2 μL, ספוט אותו לצלחת פיי-תאית שכותרתו כמו ה-t = 0 דקות לדוגמה.
- דגירה התגובה ב 37 מעלות צלזיוס, הסרת aliquots μL 2-timepoints הרצוי.
הערה: פעילות אנזימטי ייפסק ברגע הספוחה הוא הדוגמה לצלחת תאית. המתן 10-30 דקות אחרי הנקודה האחרונה מתווסף צלחת לפני פיתוח כדי להבטיח ספיחה מלאה וייבוש הדגימה.
- להכין תערובת מאגר 5 x המכיל 50 מ"מ טריס-HCl (pH 7.5), אצטט אמוניום 25 מ מ, 10 מ מ אשלגן כלורי, 1 מ"מ DTT ו- 0.6 מ"מ ATP.
- שכבה דקה כרומטוגרפיה
- למלא את התא כרומטוגרפיה 1.5 M 1.5 מ' ח'2PO4 (pH 3.64) לעומק של 0.5 ס מ.
הערה: אמצעי האחסון הדרושים תלוי הממדים של הטנקים כרומטוגרפיה. כל מיכל הזכוכית עם תחתון רמה כי הוא רחב מספיק כדי לאפשר הכנסה של צלחת חום ואהבה בלי כיפוף יכולה לשמש בפיתוח טנק עם התוספת של כיסוי. הצלחת TLC ניתן לחתוך לרצועות צר עם סכין גילוח נקי כדי לאפשר פיתוח בתוך זכוכית מכוסה הסרט פלסטיק. - לטבול את הקצה התחתון של הלוח של הממס. לאפשר הממס להעביר אל החלק העליון של הלוח (~ 90 דקות).
הערה: בזמן ההעברה הממס ייעצר בחלק העליון של הצלחת, דגימות לא יאבדו או לרוץ יחד במהלך טבילה יותר, צלחות לא אמורים להישאר בתוך הממס בן לילה. Immersions יותר מ 4 שעות יכול לגרום השרף לנתק מהצלחת גיבוי, לאובדן של האות. - הסר את הלוחית של הטנק כרומטוגרפיה ומניחים אותו על benchtop מקלב.
- לאפשר את הצלחת לאוויר יבש למשך הלילה.
הערה: ייבוש עשויים להיות מואץ על ידי שימוש מיבש שיער. יובש יכול להיות מוערך על ידי הצבע של השרף, אשר יהיה להכהות כאשר הוא רטוב ולחזור לצבע של צלחת שאינם בשימוש כאשר יבש לחלוטין. - לאחר הצלחת יבש, עוטף את הצלחת הסרט פלסטיק למנוע העברה של חומר רדיואקטיבי בקלטת הדמיה וניתוח מאת autoradiography (איור 3).
- למלא את התא כרומטוגרפיה 1.5 M 1.5 מ' ח'2PO4 (pH 3.64) לעומק של 0.5 ס מ.
- ניתוח נתונים
- לחשוף את הצלחת פיי-תאית המכיל מופרדים התגובות קלטת phosphorimager במשך 4 שעות בטמפרטורת החדר.
הערה: זהו חשיפה מספקת תשואה תמונה מאוד ברורה באמצעות ריכוז המצוין טריים γ -32P-ATP. אם כמויות נמוכות של המצע radiolabelled משמשים, זמן החשיפה יכול להיות מוגברת ש 12-16. - תמונת בקלטת על phosphorimager.
- באמצעות תוכנת הדמיה עם ממשק משתמש גרפי, לצייר אזורים של הריבית (ROIs) על-ידי בחירת לצייר מלבן באמצעות העכבר כדי לצייר ROIs מלבני סביב כל כתמים ליין ואת ATP ppGpp הנכלל הזה ליין (איור 3 ).
- השתמש בפקודות בחר, להעתיק, להדביק (או המקביל פקודות בהתבסס על תוכנת הדמיה בשימוש) כדי לצייר ROIs זהה בתוך המסלולים אחרות כדי להבטיח כי ROIs מדידת אות בתוך חלקים זהים לכל ליין. כוללים ROIs של נתיב שאינו בשימוש, כדי לשמש ריקים.
- שימוש את נתח | כלים | רועי מנהל | להוסיף פקודות של תוכנת הדמיה, בחר את כל ROIs מצויר בצלחת תאית פיי.
- שימוש את נתח | לקבוע מידות | מדד פקודות, לכמת את עוצמת האות בתוך כל רועי ולייצא את המדידות כגיליון (איור 3). חיסור ערכים ריקים רועי מהמודיעין ניסיוני.
- לחשב איזה אחוז של האות blanked בתוך כל ליין הוא לייחס ATP ו- ppGpp באמצעות הנוסחאות

הערה: ROIs ניתן למשוך, quantitated באמצעות תוכנה מסחרית תואם phosphorimager או ImageJ זמינה בחופשיות תוכנה (המכון הלאומי לבריאות).
- לחשוף את הצלחת פיי-תאית המכיל מופרדים התגובות קלטת phosphorimager במשך 4 שעות בטמפרטורת החדר.
Access restricted. Please log in or start a trial to view this content.
תוצאות
אנו מציגים שיטה ולטיהור זיקה המעביר ppGpp (p) Clostridium difficile , את ההערכה של פעילותה אנזימטיות. איור 1 מדגים את טיהור חלבון מושגת על ידי כרומטוגרפיית זיקה מתכת. השבר השני • תנאי (E2) מטיהור זה היה דיאליזה, המשמש את assay אנזימטי פעילות. איור 2 מפרט א...
Access restricted. Please log in or start a trial to view this content.
Discussion
כאן אנחנו מדווחים הטיהור של שלו מתויג RSH מ ג difficile ולהציג שיטה על כימות פעילות באמצעות כרומטוגרפיה radiolabeled שכבה דקה. בעבר נעשה שימוש בשיטה זו כדי להעריך את הפעילות של אנזימים cyclase diguanylate ג difficile, כמו גם המעביר ppGpp (p), נוקלאוטיד cyclase, קינאז ואנזימים phosphodiesterase של האורגניזמים האחרים
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים אין מתחרים אינטרסים כלכליים או אחרים ניגודי עניינים.
Acknowledgements
עבודה זו מומן על ידי NIAID 1K22AI118929-01. EBP נתמך על ידי מענק תוכנית הקיץ מלגת מחקר של משרד של המחקר באוניברסיטת דומיניון הישן, נורפולק, וירג'יניה, ארה ב.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Inducible overexpression of a histidine-tagged protein | |||
| Phusion polymerase | New England Biolabs (NEB) | M0530L | |
| QIAEX II DNA Gel Extraction Kit | Qiagen | 20021 | |
| KpnI restriction enzyme | NEB | R0142S | |
| PstI restriction enzyme | NEB | R0140S | |
| T4 DNA ligase | NEB | M0202 | |
| NEB® 5-alpha Competent E. coli (High Efficiency) | NEB | C2987I | |
| BL21 (DE3) Competent E. coli | NEB | C2527I | |
| IPTG | Sigma-Aldrich | 10724815001 | |
| JXN-26 centrifuge with JLA 10.500 rotor | Beckman Coulter Avanti | - | |
| Microcentrifuge with D3024/D3024R rotor | Scilogex | - | |
| MaxQ SHKE6000 Incubator | Thermo Scientific | - | |
| Ultrasonic processor | Sonics | VC-750 | |
| Protein purification by nickel affinity chromatography | |||
| Ni-NTA resin | G Biosciences | 786-940/941 | |
| Pierce Disposable Gravity columns, 10 mL | Thermo Scientific | 29924 | |
| 1 mL Spectra/ Por float-A-lyzer G2 dialysis device (MWCO: 20-kD) | Spectrum | G235033 | |
| Mini-Protean Electrophoresis Cell | BioRad | 1658004 | |
| Protein activity assay by thin layer chromatography | |||
| Thin layer chromatograph (TLC) development tank | General Glass Blowing Company | 80-3 | |
| Polyethylenimine (PEI)-cellulose plates (20 cm x 20 cm, 100 μm thickness) with polyester support | Sigma-Aldrich | Z122882-25EA | |
| ATP, [γ-32P]- 3000 Ci/mmol 10mCi/ml lead, 100 μCi | Perkin Elmer | NEG002A | |
| Adenosine 5’-triphosphate (ATP) 100 mM | Bio Basic Canada | AB0311 | |
| Guanosine-5’-diphosphate disodium salt (GDP) | Alfa Aesar | AAJ61646MC/E | |
| Storage phosphor screen | GE Healthcare Life Sciences | BAS-IP TR 2040 E Tritium Screen | |
| Storm 860 phosphorimager | GE Healthcare Life Sciences | - |
References
- Cheek, S., Ginalski, K., Zhang, H., Grishin, N. V. A comprehensive update of the sequence and structure classification of kinases. BMC Structural Biology. 5 (1), 6(2005).
- Porath, J. Immobilized metal ion affinity chromatography. Protein Expression and Purification. 3 (4), 263-281 (1992).
- Arnau, J., Lauritzen, C., Pedersen, J. Cloning strategy, production and purification of proteins with exopeptidase-cleavable His-tags. Nature Protocols. 1 (5), 2326-2333 (2006).
- Porath, J., Carlsson, J., Olsson, I., Belfrage, G. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258 (5536), 598-599 (1975).
- Smith, M. C., Furman, T. C., Ingolia, T. D., Pidgeon, C. Chelating peptide-immobilized metal ion affinity chromatography. A new concept in affinity chromatography for recombinant proteins. Journal of Biological Chemistry. 263 (15), 7211-7215 (1988).
- Graslund, S., et al. Protein production and purification. Nature Methods. 5 (2), 135-146 (2008).
- Booth, W. T., et al. Impact of an N-terminal Polyhistidine Tag on Protein Thermal Stability. ACS Omega. 3 (1), 760-768 (2018).
- Thielges, M. C., Chung, J. K., Axup, J. Y., Fayer, M. D. Influence of histidine tag attachment on picosecond protein dynamics. Biochemistry. 50 (25), 5799-5805 (2011).
- Chaga, G. S. Twenty-five years of immobilized metal ion affinity chromatography: past, present and future. Journal of Biochemical and Biophysical Methods. 49 (1-3), 313-334 (2001).
- Ma, H., Deacon, S., Horiuchi, K. The challenge of selecting protein kinase assays for lead discovery optimization. Expert opinion on drug discovery. 3 (6), 607-621 (2008).
- Tamayo, R., Tischler, A. D., Camilli, A. The EAL domain protein VieA is a cyclic diguanylate phosphodiesterase. Journal of Biological Chemistry. 280 (39), 33324-33330 (2005).
- Purcell, E. B., McKee, R. W., McBride, S. M., Waters, C. M., Tamayo, R. Cyclic Diguanylate Inversely Regulates Motility and Aggregation in Clostridium difficile. Journal of Bacteriology. 194 (13), 3307-3316 (2012).
- Purcell, E. B., Tamayo, R. Identification and characterization of cyclic nucleotide phosphodiesterases. Methods in Molecular Biology. 1016, 235-243 (2013).
- Ross, P., et al. Control of cellulose synthesis Acetobacter xylinum. A unique guanyl oligonucleotide is the immediate activator of the cellulose synthase. Carbohydrate Research. 149 (1), 101-117 (1986).
- Potrykus, K., Cashel, M. (p)ppGpp: still magical? Annual Review of Microbiology. 62, 35-51 (2008).
- Boutte, C. C., Crosson, S. Bacterial lifestyle shapes stringent response activation. Trends in Microbiology. 21 (4), 174-180 (2013).
- Nanamiya, H., et al. Identification and functional analysis of novel (p)ppGpp synthetase genes in Bacillus subtilis. Molecular Microbiology. 67 (2), 291-304 (2008).
- Gaca, A. O., et al. Basal Levels of (p)ppGpp in Enterococcus faecalis: the Magic beyond the Stringent Response. mBio. 4 (5), (2013).
- Sebaihia, M., et al. The multidrug-resistant human pathogen Clostridium difficile has a highly mobile, mosaic genome. Nature Genetics. 38 (7), 779-786 (2006).
- Gasteiger, E., et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis. Nucleic Acids Research. 31 (13), 3784-3788 (2003).
- Purcell, E. B., et al. A nutrient-regulated cyclic diguanylate phosphodiesterase controls Clostridium difficile biofilm and toxin production during stationary phase. Infection and Immunity. , (2017).
- Mechold, U., Murphy, H., Brown, L., Cashel, M. Intramolecular Regulation of the Opposing (p)ppGpp Catalytic Activities of RelSeq, the Rel/Spo Enzyme from Streptococcus equisimilis. Journal of Bacteriology. 184 (11), 2878-2888 (2002).
- Dalebroux, Z. D., Svensson, S. L., Gaynor, E. C., Swanson, M. S. ppGpp Conjures Bacterial Virulence. Microbiology and Molecular Biology Reviews. 74 (2), 171-199 (2010).
- Bartlett, J. G. Clostridium difficile: progress and challenges. Annals of the New York Academy of Sciences. 1213, 62-69 (2010).
- US Department of Health and Human Services. , Centers for Disease Control and Prevention, US Department of Health and Human Services. Atlanta, GA. (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved