Method Article
כימות סימולטני של CD8 וקטור נגד ו- Anti-transgene-ספציפי+ T תאים דרך MHC אני Tetramer מכתים לאחר החיסון עם וקטור ויראלי
In This Article
Summary
כאן, אנו מציגים פרוטוקול לשם זיהוי איכותי vivo של אנטיגן ספציפי CD8+ T תאים. ניתוח אפשרי עם המתלים תא בודד איברים או כמויות קטנות של דם. מגוון רחב של מחקרים דורשות הניתוח של תגובות תא T ציטוטוקסי (חיסון, מחקרים חיסוני סרטן).
Abstract
על זיהום ויראלי, אנטיגן ספציפי CD8+ T ציטוטוקסיים (Ctl) עולות ותורמות לחיסול תאים נגועים כדי למנוע ההתפשטות של פתוגנים. לכן, התדירות של אנטיגן ספציפי Ctl הוא מעיד על עוצמת התגובה תא T כנגד אנטיגן ספציפי. ניתוח כזה חשוב אימונולוגיה בסיסי, פיתוח החיסון, סרטן immunobiology, את אימונולוגיה מסתגלת. בתחום החיסונים, התגובה CTL נגד מרכיבי וקטור ויראלי משותפת קובע עד כמה יעיל הדור של תאים אנטיגן ספציפי נגד אנטיגן של הריבית (כלומר, transgene, ). Ctl אנטיגן ספציפי יכול גם יזוהו על-ידי גירוי עם פפטידים ספציפי ולאחריו ציטוקין תאיים מכתים או על ידי צביעה ישירה של קולטני התא T אנטיגן ספציפי (TCRs) וניתוח cytometry זרימה. השיטה הראשונה היא במקום זמן רב מאחר שהיא דורשת הקרבת בעלי חיים כדי לבודד תאים מן האיברים. כמו כן, זה דורש בידוד של דם של חיות קטנות, שזה קשה לביצוע. השיטה השנייה היא די מהירה, יכול להיעשות בקלות עם כמויות קטנות של דם, אינה תלויה פונקציות אפקטור ספציפיים, כגון פעילות cytolytic. MHC tetramers הם כלי אידיאלי כדי לזהות TCRs אנטיגן ספציפי.
כאן, אנו מתארים את פרוטוקול בו זמנית לזהות אנטיגן ספציפי Ctl עבור פפטידים immunodominant של וקטור ויראלי VSV-GP (LCMV-GP, VSV-NP) ו transgenes (ביצית, HPV 16 E7, eGFP) על ידי MHC אני cytometry tetramer מכתים וזרימה. צביעת אפשרי ישירות מדם או של תא בודד המתלים של איברים, כמו הטחול. דם או תא בודד המתלים של איברים מודגרת עם tetramers. לאחר צביעת עם נוגדנים נגד CD3 ו CD8, Ctl אנטיגן ספציפי הם לכמת על ידי cytometry זרימה. באופן אופציונלי, נוגדנים נגד CD43, CD44, CD62L או אחרים ניתן לכלול כדי לקבוע את מצב ההפעלה של אנטיגן ספציפי CD8+T תאים, בין תמים ותאי אפקטור.
Introduction
המטרה של שיטה זו הוא להעריך את התדירות של לימפוציטים-T ציטוטוקסיות (CTL) התגובות אנטיגנים (מספר) העכבר על ידי ניתוח תזרים cytometric ללא צורך גירוי פפטיד גוזלת זמן. שיטה זו מנתח יחודיות פנוטיפ של אנטיגן של קבוצות משנה של רשימת אישורים אמינים, ב מכתים יחיד. אנחנו ממוטב המתחם Histocompatibility רס ן אני (MHC אני) tetramer מכתים בפרוטוקול כדי לנתח את היעילות של החיסון גישות חדשות, כגון VSV-GP, גרסה חדשה של הנגיף vesicular stomatitis (VSV), איפה גליקופרוטאין G של VSV הוחלפה על-ידי גליקופרוטאין GP של1,choriomeningitis לימפוציטית וירוס (LCMV)2. בנוסף התגובה ההורמונאלית, read-out חשוב של ולייעל של חיסון היא אינדוקציה של תגובה CTL נגד אנטיגנים אחד או כמה. העקביות והעבודה העמידות של התגובה התאית חשובים בהקשר הזה, זה רייטינג לעקוב אחר קינטיקה של CTL תגובות של אותה חיה. זה יוביל גם ירידה של מספרים בעלי חיים, היבט חשוב בנוגע לעקרונות של "3Rs"3. לפיכך, ניתוח מ קטנה כמו 20 µL של דם הוא אופטימלי למטרה זו.
Tetramers פותחו בשנות התשעים המאוחרות4 הפך כלי חשוב בתחום של תא T אימונולוגיה. Tetramers הם fluorescently-ידי קומפלקסים של MHC ארבע אני / מולקולות פפטיד, אשר לאגד TCRs, ספציפיות עבור פפטיד יחיד. כיום, הם ניתן גם לקנות מוכנות מראש5, הוראה מותאמת אישית ללא תשלום במתקן ליבה Tetramer של NIH על אוניברסיטת אמורי6 או מיוצר המעבדה7. MHC II tetramers ואני הינם זמינים, קרי עבור CD8+ ו CD4+ T תאים, בהתאמה. עוצמת tetramer מכתים טמון חיסכון של זמן, אלא פשוט וקל לתקנן8 פרוטוקולים, רגישות9. בנוסף, אם עובד עם דם, חיות לא צריך להיות קורבן, כמויות מינימליות של מדגם נדרשים. מדידה אחת אינה מוגבלת אנטיגן יחיד, אך ניתן לנתח מספר אנטיגנים בתוך אחד מכתים בעת שילוב tetramers מצומדת עם fluorophores שונים. אנטיגנים שהתגלו לאחרונה, לדוגמה, מתוך מסכי פפטיד, יכול להיות בקלות שולבו tetramers, המשמש עבור כימות של המשנה תא T.
Tetramer מכתים לא ייתן מידע על פונקציונליות CTL (כלומר., ייצור ציטוקינים, פונקציות אפקטור), אבל רק ירידה לפרטים. כדי לקבל מידע על הפונקציונליות של תא T, תאיים ציטוקין מכתים (ICS) או Assay אנזים מקושרים חיסונית ספוט (ELISpot) צריך להיות מבוצע8,10. Tetramer מכתים ו ICS/ELISpot, לעומת זאת, אינם מיותר אבל מעדיף משלימים אחד את השני. גירוי במבחנה כדי לעודד ייצור ציטוקינים עבור ICS/ELISpot תשנה את פנוטיפ תא T המקורית. Tetramer מכתים, לעומת זאת, משאיר את תא T נגעה; פנוטיפ המקורי נשמר, ניתן לנתח. גם, יתרון גדול נוסף של tetramers הוא כי צביעת יכול להיות משולב עם מיון מגנטי של העשרה של תאים אנטיגן ספציפי11. פעולה זו מאפשרת הניתוח של אוכלוסיות נדירים, כמו גם culturing של תאים ממוינים עם אנטיגן מוגדר-specificities — תכונה זו אינו אפשרי עם שיטות אחרות.
באמצעות את הפרוטוקול המתואר כאן, tetramer מכתים, וכן ICS/ELISpot ניתן לבצע את איבר אחד, כי רק מעט מאוד חומר (דם: 20 µL; הטחול: עונה 1 פרק 106 תאים) דרוש עבור tetramer מכתים. עם זאת, בהתאם התדירות של תאים אנטיגן ספציפי של הריבית, הכוח של TCR בהתאמה את ואת ההקשר ניסיוני, כמות התאים הדרושים ייתכן שתצטרך להיות יורה או העשרה מגנטי אולי צריך להיות מיושם.
Tetramers נמצאים בשימוש נרחב, לדוגמה להעריך ולייעל של חיסונים (antitumor)12,13,14,15 או חיסוני16,17, ניתוח פנוטיפי ו מרחבית לוקליזציה של תא T אנטיגן ספציפי קבוצות משנה18,19,20,21,22,23. השיטה המתוארת כאן מתאים ללימודים, אשר שואפים לכלול את כימות וניתוח פנוטיפי של CD8 אנטיגן ספציפי מאתר+ T תאים בניתוח שלהם בצורה נוחה ומהירה.
Protocol
כל השיטות המתוארות בוצעו בהתאם האוסטרית הלאומית חוק הניסויים ("Tierversuchsgesetz"), בעלי חיים הרשות למשפט ניתנה על ידי הרשויות הלאומיות אוסטרי.
1. מאגר הכנה מדגם אוסף
הערה: המתח העכבר להשתמש תלוי epitope ניתח. לבחור את tetramer המתאים המאגד MHC מסוג הביע בעכברים, למשל, H - 2Kb עבור עכברים C57BL/6. מין וגיל החיות תהיה תלויה השאלה המדעית. רוב הניסויים שתוארו כאן, לשימוש עכברים הנשי רוב בגיל 6-8 שבועות בתחילת הניסוי, כלומר חיסון הראשון, .
- הכנת מאגר FACS (באגירה פוספט תמיסת מלח (PBS) + סרום עגל עוברי 1% (FCS) + אזיד הנתרן 0.1% + 2 מ מ Ethylenediaminetetraacetic חומצה (EDTA) ומאגר FACS תיקון (1.5% (v/v) פורמלדהיד ב- PBS).
הערה: מומלץ כי שני מאגרים מוכנים מראש. מאוחסן ב 4 ° C עד השימוש. - דם: לאסוף 20 µL של דם לכל העכבר וריד הזנב של העכבר צינורות מצופים EDTA, כפי שתואר לעיל24.
הערה: דם עשוי גם להיות שנאספו על ידי נתיבים אחרים, למשל, vena facialis או רטרו-מסלולית סינוס. עם זאת, השיטה של איסוף דם חייב להיות תואם חוק הניסויים הלאומית והיישומים משפט בעלי חיים. אוסף של דם מן הווריד של הזנב הוא אידיאלי עבור מחקרים שבהם נדרשים שוב ושוב קטן כמויות של דם. חומר נוסף נדרש פיצוי פקדים והפקד שאינו מוכתם. - טחול: לבודד את האיבר ולחץ, עם העזרה של הבוכנה של מזרק, דרך nm 70 40 µm תא מסננת. לבצע פירוק של אריתרוציטים, כמתואר בשלב 6 וספירה. התאם את ריכוז עונה 1 פרק 107 תאים/מ ב- PBS. לפי המדגם, עונה 1 פרק 106 תאים נדרשים.
הערה: תמיד נמנים כמה תלעג לחסן או לשלוט בבעלי חיים וקטור לחסן כפקד שלילי. עבור אובלבומין (פשוט)-tetramer, מדגם עכברים OT-1, יכול לשמש בקרה חיובית. אל תשכח מוכתם ופקדים פיצוי בחישוב. במידת הצורך, ייתכן איחדו דגימות בעלי חיים שונים הניסוי בשביל זה. - לאחר איסוף הדגימה, ישירות להמשיך ההכתמה.
2. הגדרת מכתים
- מכינים שפופרת FACS אחת עבור כל דגימה. תווית צינורות כראוי, להעביר μL 100 של איברים השעיה (1 x 106 תאים) או 20 μL של דם לתוך כל שפופרת.
- טחול: צנטריפוגה למשך 5 דקות ב x 600 גרם ב 4 – 8 ° C וזורקים את תגובת שיקוע. המערבולת resuspend בגדר התא.
הערה: התוצאה תהיה נפח הנותרים של-20 µL, דומה בתור אמצעי האחסון עבור דגימות הדם. - לכל ערוץ לשמש גם להכין שפופרת FACS אחת מדגם פיצוי. מכינים דוגמא נוספת אחת בתור פקד וללא רבב.
3. tetramer מכתים
-
עבור כל דגימה, להשתמש μL 50 של דילול tetramer. Tetramers הציע, אופטימיזציה דילולים, עיין טבלה 1.
הערה: בעת עבודה עם tetramers או נוגדנים, כבה את האור בטיחות ארון ולהגן דגימות מן האור.- הכן צינור עם FACS מאגר (נפח = 50 μL × מספר הדגימות פלוס נוספים 10% מהנפח הכולל כדי לפצות על שגיאות pipetting).
- להוסיף tetramer(s) דילול אופטימלית, כפי שמפורט בטבלה1. מערבולת הפתרון.
הערה: בשעת שימוש בלוח כל נוגדן (CD3, CD8, CD43, CD44, CD62L) fluorophores המפורטים, tetramers שני (ב PE ו APC) יכול להיות כלול. ניתן לשלב שני tetramers מכתים יחיד, דהיינו, מכתים של תאים עם שני tetramers יכול להתבצע בו זמנית.
| Tetramer | רצף פפטיד | אלל | Fluorophore | דילול |
| MHC אני / ביצית | SIINFEKL | H - 2Kb | APC | 1:25 |
| MHC אני/VSV-NP | RGYVYQGL | H - 2Kb | PE | 1:25 |
| MHC אני / EGFP | HYLSTQSAL | H-2Kd | PE | 1:25 |
| MHC אני/LCMV-GP | KAVYNFATC | H-2Db | APC | 1:25 |
| MHC אני / HPV 16 E7 | RAHYNIVTF | H-2Db | APC | 1:10 |
טבלה 1: הציע tetramers של האופטימלית דילולים. Tetramers המומלצת עבור כמה פפטידים immunodominant של מודל אנטיגנים (אובלבומין (פשוט), חלבון פלואורסצנטי ירוק (eGFP) משופרת) או רכיבי פתוגן (Vesicular stomatitis וירוס (VSV) נוקלאופרוטאין (NP), וירוס Choriomeningitis לימפוציטית (LCMV... גליקופרוטאין) (GP) ו- E7 וירוס הפפילומה האנושי (HPV) oncoprotein (E7)). עבור כל אחד, רצף פפטיד אלל המתאימים, רשום fluorophore באותה מידה כמו המומלצת, דילול ממוטבת.
- להוסיף 50 μL של דילול tetramer כל דגימה של מערבולת בעדינות. להוסיף מאגר FACS בלבד (ללא tetramer) לפקדים פיצויים לדוגמה וללא רבב.
- דגירה בדגימות כעשרים דקות ב 37 מעלות צלזיוס, מוגן מפני אור. כדי להבטיח מעבר חלק מ tetramer כדי נוגדן מכתים, להכין את תערובת נוגדן כפי שמתואר בשלב 4 במהלך זמן הדגירה.
הערה: עבור כל tetramer בודדים, תנאים אופטימליים (דילול, זמן הדגירה וטמפרטורה) צריכים להיות מותאמים.
4. הכנת נוגדנים
-
עבור כל דגימה, להכין µL 50 של נוגדן מיקס.
- הכן צינור עם FACS מאגר (נפח = 50 μL × מספר הדגימות פלוס נוספים 10% מהנפח הכולל לפיצוי שגיאות pipetting).
- מוסיפים נוגדנים דילולים כמפורט בטבלה מס ' 2.
הערה: השאלה המדעית, בצירופים סמן מלבד המתואר כאן עשוי לשמש בהתאם. הקפד לכלול תמיד נוגדנים נגד CD3 ו CD8 בחלונית ' '. - מערבולת הפתרון.
| נוגדן | Fluorophore | דילול | µg/מדגם | סמן |
| CD3 | PE-Cy7 | 1:200 | 0.05 | Ctl (CD3+CD8+) |
| CD8 | פסיפיק בלו | 1:750 | 0.013 | |
| V450 | בטחונות | 0.1 | ||
| CD43 | FITC | בטחונות | 0.25 | הפעלה (CD43+) |
| CD44 | PE-Cy5 | 1:250 | 0.04 | סגנון נאיבי (CD44–CD62L+) & אפקטור (CD44+CD62L–) |
| CD62L | APC-Cy7 | שבערך | 0.02 |
בטבלה 2: נוגדנים המשמשים את הפרוטוקול ואת דילולים אופטימלית. סמני פני השטח המומלץ (CD3, CD8, CD43, CD44 ו CD62L) מפורטים בעמודה הראשונה. עבור כל אחד, fluorophore מומלצים, דילול ממוטב ואת כמות נוגדנים/מדגם מפורטים. בעמודה האחרונה, סוג התא מזוהה עם כל סמן צוין.
-
להכין נוגדנים עבור פקדים פיצוי. עבור כל פקד פיצוי, השתמש נוגדן נגד CD8 בצבע המתאים.
- בכל אחד מהערוצים, הכן צינור עם μL 200 FACS המאגר ולהוסיף 1 μL של נוגדן דילול 1:200 נגד CD8 בצבע המתאים.
- מערבולת הצינורות.
- מיד להמשיך עם כתמים.
5. צביעה של דגימות
- לשטוף דגימות פעם אחת על-ידי הוספת ~ 1 מ"ל של מאגר FACS, צנטריפוגה עבור 5 דקות ב x 600 גרם ב 4 – 8 ° c לאחר צנטריפוגה, למחוק את תגובת שיקוע, לנקז את הנוזל הנותר על ערימת מגבות נייר.
הערה: בעת עבודה עם דם, להיות זהיר בעת מנקזת הנוזל הנותר. לפני פירוק של אריתרוציטים, הדם לא ידבק לתחתית הצינור FACS. לחלופין, וארוקן את תגובת שיקוע. - להוסיף בעדינות μL 50 של המיקס נוגדנים כדי תא צניפה כל המערבולת.
- להוסיף 50 μL של כל תערובת פיצוי בגדר תא של שליטה פיצוי התואם ו מערבולת בעדינות.
- להוסיף μL 50 FACS מאגר בגדר תא של שליטה וללא רבב, מערבולת בעדינות.
- דגירה כל דוגמאות למשך 30 דקות ב 4 ° C, מוגן מפני אור.
- כאשר עובדים עם איברים: לדלג על שלב 6. תשטוף פעם אחת על-ידי הוספת ~ 1-2 מ של מאגר FACS, צנטריפוגה למשך 5 דקות ב x 600 גרם ב 4 – 8 ° C לאחר צנטריפוגה, למחוק את תגובת שיקוע, לנקז את הנוזל הנותר על ערימת מגבות נייר.
- בעת עבודה עם דם: המשך לשלב 6 (פירוק של אריתרוציטים).
6. פירוק של אריתרוציטים
- להוסיף 500 μL של ג'ק (אמוניום כלוריד-אשלגן) מאגר25 מדגם כל ובעדינות מערבולת.
הערה: מאגר ACK יוביל נפיחות osmotic והמסה, במיוחד של אריתרוציטים. - תקופת דגירה של 5 דקות בטמפרטורת החדר בחושך.
- להוסיף 1 מ"ל של מאגר FACS, צנטריפוגה עבור 5 דקות ב x 600 גרם ב 4 – 8 ° c לאחר צנטריפוגה, למחוק את תגובת שיקוע, לנקז את הנוזל הנותר על ערימת מגבות נייר.
הערה: כאשר בגדר הוא מעדיף אדום, לחזור על פירוק של אריתרוציטים. - תשטוף פעם אחת על-ידי הוספת ~ 1-2 מ ל FACS מאגר, צנטריפוגה למשך 5 דקות ב x 600 גרם ב 4 – 8 ° C לאחר צנטריפוגה, למחוק את תגובת שיקוע, לנקז את הנוזל הנותר על ערימת מגבות נייר.
7. לזרום Cytometric מדידה וניתוח
- להוסיף 150-300 μL מאגר תיקון FACS כל שפופרת ומערבבים על ידי vortexing. עבור 20 µL של דם, µL 150 מאגר מספיקה.
הערה: לפני קיבוע, ודא כי התאים הם. ובכן מחדש על תנאי על מנת למנוע היווצרות גושים. להמשיך עם מדידת cytometric מהר ככל האפשר. - למדוד את הפקדים פיצוי ולתקן כל חפיפות ספקטרלי.
-
הגדרת שערים רציפים, כפי שהיא מתוארת באיור 1 לבחירה CD3+/CD8+ תאים.
- שער על לימפוציטים באמצעות פיזור קדמי ו- sideward (אזור) (הלא-לוגריתמי).
- בתוך האוכלוסייה לימפוציט, שער על תאים בודדים באמצעות פיזור הקדמיים רוחב לעומת אזור (הלא-לוגריתמי).
- מגרש לימפוציטים תא בודד באמצעות ערוצי CD3 ו CD8 (לוגריתמי). לזהות CD8+ T תאים על-ידי gating-CD3+/CD8+ תאים.
- מגרש CD8+ לעומת Tetramer+ תאים ושער -CD8 תאים+ Tetramer+ , כפי שהיא מתוארת באיור 2.
- במידת האפשר, להקליט 20,000 תאים (לפחות 5,000 תאים מדם) CD3+/CD8+ של שער עבור כל דגימה ולשמור בתור קובץ FCS.
הערה: כמות התאים כדי להקליט ייתכן שתצטרך להיות מותאם על פי התדירות של תאים אנטיגן ספציפי של ריבית. - לנתח את FCS קבצים עם תוכנת ניתוח המתאים. השתמש באסטרטגיה המגביל, כפי שתואר לעיל (סעיף 7.3) ולכמת CD8+ Tetramer+ תאים.
תוצאות
איור 1 מדגים כיצד שער כראוי על תאי המטרה של פרוטוקול זה, כלומר CD3+/CD8+ תאים. זה לציין כי הופעל תאים לעתים קרובות downregulate תא T קולטן26,27 , לכן, התאיםנמוך CD3 צריך להיכלל גם gating. לאחר gating של CD3+/CD8+ תאים, tetramer חיובי תאים יכול להיות מזוהה (איור 2). נציג לחומה עכבר שליטה שלילי (תמים), כמו גם בעלי חיים שחוסנו גם גם אדנו ביצית מפריש 5 (Adeno-פשוט) או ביצית-המבטאת VSV-GP (VSV-GP-פשוט) מוצגים. כפי שניתן לראות את שהכלים התחתונה שניים שונים tetramers יכול להיות משולב בצינור זהה עבור מכתים. זה מאפשר כימות בו זמנית של שתי specificities CTL שונים: וירוסים ספציפיים (VSV N) ו- Ctl transgene ספציפיים (פשוט). וידאנו כי ליחיד tetramer stainings לתת אחוזים דומים של תאים חיוביים עבור כל tetramer... באמצעות פרוטוקול זה, אחרים וירוס ספציפיים (למשל., LCMV GP, HPV 16 E7) או transgene מסוימים (למשל., GFP) תא T אוכלוסיות יכול להיות מנותח (משלימה איור 1). משלימה טבלה 1, מוצגים תוצאות עבור חמישה בעלי חיים לאחר חיסון VSV-GP-ביצית — המציינת את החוסן של tetramer מכתים.
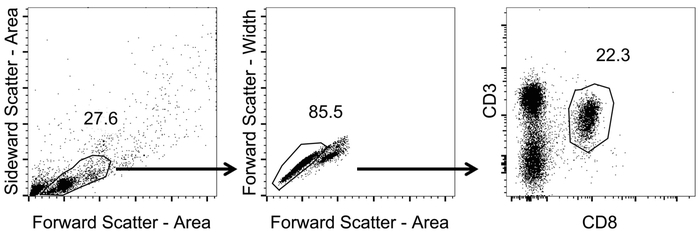
איור 1: נציג gating אסטרטגיה כדי לנתח CD8+ T תאים בדם. ייצוג סכמטי של האסטרטגיה המגביל המשמש לניתוח cytometric זרימה. לאחר tetramer מכתים וזרימה cytometric מדידה, ניתחנו את הנתונים. לימפוציטים זוהו עם פיזור קדמי ו- sideward (אזור) (הלא-לוגריתמי). מאלה, תאים בודדים זוהו על-ידי החלת פיזור הקדמיים רוחב לעומת אזור (הלא-לוגריתמי). CD8+ T תאים זוהו על ידי gating-CD3+/CD8+ תאים (לוגריתמי). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
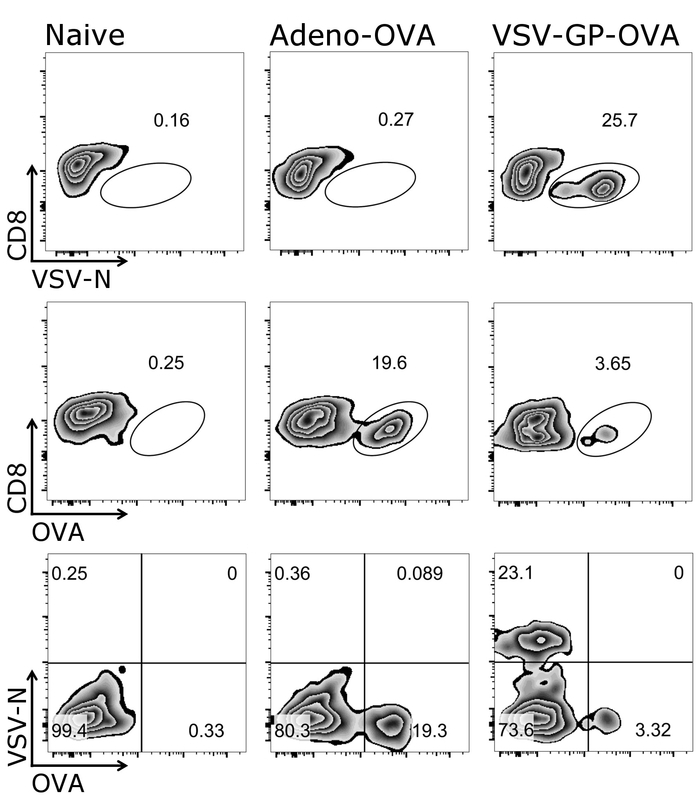
איור 2: נציג gating אסטרטגיה לכמת CD8 ספציפיים ביצית או N+ T תאים בדם. ייצוג סכמטי של האסטרטגיה המגביל המשמש עבור זרימת כימות cytometric של תאים tetramer+ . CD3+/CD8+ תאים שימשו לצורך ניתוח tetramer. החלונית העליונה והאמצעית: דה מרקר CD8 סומן נגד בהתאמה tetramer (לוגריתמי). לוח נמוכה: בשתי tetramers שורטטו אחד נגד השני (לוגריתמי). שמאל: העכבר שליטה (תמים); האמצעי: העכבר היה חיסון עם אדנו ביצית מפריש 5 (Adeno-פשוט); נכון: העכבר היה חיסון עם אובלבומין (פשוט)-המבטאת VSV-GP (VSV-GP-פשוט). דם נאסף מן וריד הזנב ביום 7 לאחר חיסון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
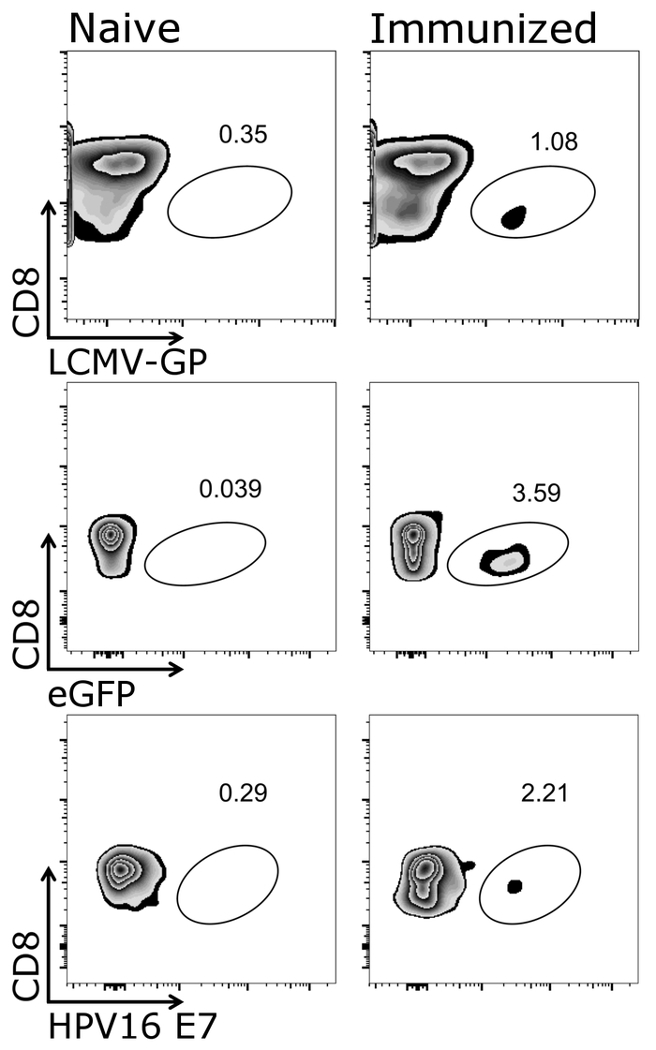
משלימה איור 1: תוצאת CD3 נציג+/CD8+ tetramer+ תאים לאחר החיסון. ייצוג סכמטי של זרימה כימות cytometric של תאים tetramer+ . CD3+/CD8+ תאים שימשו לצורך ניתוח tetramer, דה מרקר CD8 סומן נגד בהתאמה tetramer (לוגריתמי). שמאל: עכברים היו תמימים, נכון: עכברים היו חיסון עם VSV-GP (החלונית העליונה), משופרת חלבון פלואורסצנטי ירוק (eGFP)-המבטאת VSV-GP (לוח האמצעי) או VSV-GP לבטא וירוס הפפילומה האנושי (HPV) E7 oncoprotein (E7) (החלונית התחתונה). הדם שנאספו וריד הזנב ביום 7 לאחר חיסון, מוכתם tetramers (LCMV-GP, eGFP ו- HPV E7). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
יתרון אחד חשוב של הפרוטוקול המתואר כאן הוא כי תא T תגובות מהעכבר אותו ניתן בעקבות לאורך זמן כמו כמויות קטנות בלבד של דם יש צורך בכל מדידה. איור 3 מראה תוצאות למופת תא T תגובות לאורך זמן. בנוסף, כמויות של אנטיגן ספציפי Ctl פנוטיפ שלהם יכול גם להיות מנותח באמצעות פרוטוקול זה (איור 4).
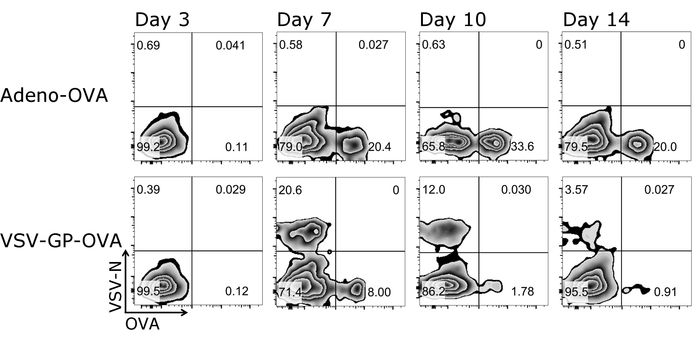
איור 3: תוצאה נציג של CD8+ תא T קינטי בדם לאחר החיסון. ייצוג סכמטי של האסטרטגיה המגביל המשמש עבור זרימת כימות cytometric של תאים tetramer+ . CD3+/CD8+ תאים שימשו לצורך ניתוח tetramer, שני tetramers שורטטו אחד נגד השני (לוגריתמי). לוחות העליון: העכבר היה חיסון עם אדנו ביצית מפריש 5 (Adeno-פשוט); להוריד לוחות: העכבר היה חיסון עם אובלבומין (פשוט)-המבטאת VSV-GP (VSV-GP-פשוט). דם נאסף מן וריד הזנב ביום 3, 7, 10 ו- 14 לאחר חיסון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
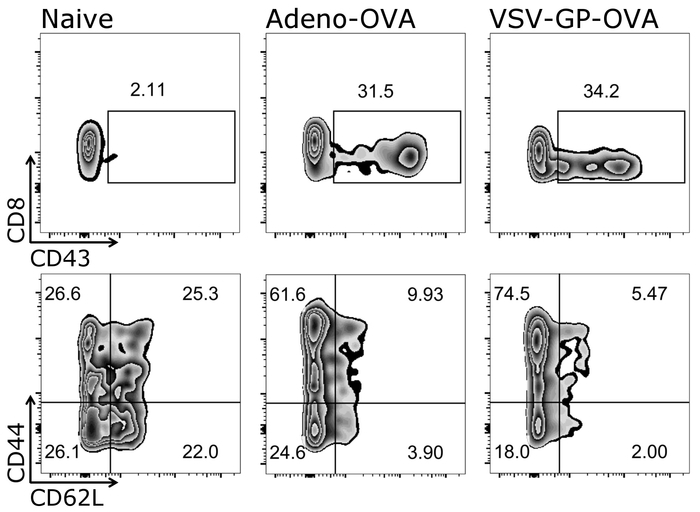
איור 4: תוצאה נציג של CD8+ T לתא ההפעלה ובידול לתוך תאים נאיביים ולא אפקטור לאחר החיסון. ייצוג סכמטי של האסטרטגיה המגביל המשמש עבור זרימת cytometric כימות מופעל (CD43+), תמים (CD44–/CD62L+) ואת אפקטור (CD44+/CD62L–) CD3+/CD8+ תאים ( סרגל לוגריתמי). שמאל: העכבר שליטה (תמים); האמצעי: העכבר היה חיסון עם אדנו ביצית מפריש 5 (Adeno-פשוט); נכון: העכבר היה חיסון עם אובלבומין (פשוט)-המבטאת VSV-GP (VSV-GP-פשוט). דם נאסף מן וריד הזנב ביום 7 לאחר חיסון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| עכבר # | % CD43+ | % VSV-N Tetramer+ | % ביצית Tetramer+ | |
| ללעוג | 1 | 1.7 | 0.45 | 0.41 |
| 2 | 0.77 | 0.69 | 0.15 | |
| 3 | 1.34 | 0.35 | 0.31 | |
| 4 | 1.68 | 0.83 | 0.26 | |
| 5 | 0.84 | 0.47 | 0.23 | |
| VSV-GP-ביצית | 1 | 23 | 13.2 | 3.69 |
| 2 | 32.6 | 15.9 | 3.54 | |
| 3 | 22.1 | 11.7 | 2.43 | |
| 4 | 15.1 | 8.89 | 1.79 | |
| 5 | 29.1 | 14.7 | 5.64 |
משלימה טבלה 1: אחוזי CD3 מופעל, אנטיגן ספציפי+/CD8+ תאים לאחר החיסון. עכברים או תמים או חיסון עם אובלבומין (פשוט)-המבטאת VSV-GP (VSV-GP-פשוט) (n = 5). הדם שנאספו וריד הזנב ביום 7 לאחר חיסון, מוכתם tetramers (VSV-N וביצית). מופעל (CD43+) ו- CD3 אנטיגן ספציפי (tetramer+)+/CD8+ התאים היו לכמת על ידי cytometry זרימה.
Discussion
Tetramer מכתים הוא פרוטוקול פשוט למדי ולא מסובך כדי לנתח יחודיות פנוטיפ ופפטיד של לימפוציטים-T. השימוש של דם לניתוח, כפי שמתואר כאן, פולשנית ומאפשרת ניטור רציף, כך למשל במחקרים חיסון. בשטח של החיסון, כימות של תגובות ספציפיים וקטוריים או אנטיגן הוא עניין, כמו תגובות ספציפיות וקטור עלול לעכב תגובה חיסונית יעיל נגד אנטיגן חיסון28. הערה היא כי עם פרוטוקול המתוארים כאן, שתי האוכלוסיות ניתן לכמת בעת ובעונה אחת ב צביעת tetramer יחיד, ובכך מקצר את השתנות מכתימים וכמויות הדגימה. עם זאת, כמה צעדים צריך להיעשות בזהירות כדי להבטיח מדידה נכונה ונתונים אמינים. אם משתמש דם הווריד הזנב לניתוח, אחד להקפיד לחמם את החיות לזירוז vasodilation24. ובכך, דם מספקת ניתן לאסוף תוך זמן קצר, לחץ על החיות תקטן, הניתוח היא הרבה יותר, בהשוואה אם הדם נאסף אט-אט. בנוסף, לאחר איסוף הדגימה (דם או איברים), צביעת ישירה מומלץ כדי למנוע תוצאות שליליות שווא עקב TCR downregulation. אותו הדבר חל על כל השלבים הבאים: ההליך צריך ואין כל הכביסה השלבים מצומצמת למספר מינימלי (כאמור בפרוטוקול). כדי להבטיח מכתים נכונה, להקפיד על מערבולת כל פתרונות ודוגמאות לפני ואחרי הדגירה. הדבר חשוב במיוחד לפני תיקון הדגימות כדי להימנע הצליעה של תאים.
מבחינת שינוי בפרוטוקול, סמני פני ו tetramers אחרים ניתן להשתמש, בהתאם מטרת הניתוח. עם זאת, כל ריאגנטים אז צריך להיות טיטרציה, בצורה אופטימלית בשילוב עם כל מכתימה את החלונית. עבור חלק tetramers כמפורט להלן, אופטימיזציה חשף כי אנו יכולים להגדיל את הדילול המומלץ על ידי היצרן (1:10 מומלץ, אופטימיזציה 1:25) (טבלה 1). כדי לפצות חפיפה ספקטרלי, חרוזים הפיצוי יכול לשמש במקום תאים מוכתם. לגבי הבחירה של fluorochrome מצמידים tetramer, אחד צריך הסתברותיות להשתמש fluorochromes בהיר, כמו זה מקלה על האיתור - במיוחד כאשר האות הוא נמוך. כמו Dolton ועמיתיו29, אנחנו מעדיפים להשתמש PE או APC-מצמידים tetramers, אשר יכול להיות משולב בצורה מושלמת מכתים יחיד ו CD8+ T תאים עם ירידה לפרטים אנטיגן יחיד יכול להיות יפה זוהה (איור 2). לגבי טמפרטורה, דגירה פעמים, קיים מגוון רחב של tetramer מכתים תנאים. בתהליך קידום אתרים שלנו, אנחנו התייחס בעיה זו והופיע tetramer מכתים-תנאים שונים (למשל 4 ° C, בטמפרטורת החדר או 37 ° C). מן התוצאות המתקבלות, אנו ממליצים על כתם כעשרים דקות ב 37 מעלות צלזיוס, אשר קונקורדנציה עם ספרות30,31. דגירה ממושכת יש להימנע, ככל זה יכול להוביל הפנמה של tetramer30 ו- false והתוצאות השליליות.
הבחירה של הנוגדן נכון גילוי של CD8+ תאים הוא נושא חשוב נוסף, אשר חייב לשקול בזהירות (ומותאמות באופן פוטנציאלי). זה נובע מהעובדה מסוימים נוגדן anti-CD8 שיבוטים בלוק קשירה של tetramers כדי TCR, אנושי32 , כמו גם דגימות33 העכבר. עבור שלנו tetramer מכתים פרוטוקול, בחרנו שיבוט 53 – 6.7 כתם של CD8 מאתר+ תאים – שיבוט אשר אינו חוסם, אבל מעדיף מגבירה את tetramer מכתים.
Tetramer מכתים הוא די מסובך בעת ניתוח תגובות חיסוניות בולטים בשיאו של התגובה תא T, לדוגמה. עם זאת, ייתכן שיש אוכלוסיות שהן קצת יותר "בעייתי". דוגמאות כאלה כוללים תאים ספציפיים עבור אנטיגנים זיקה נמוכה (גידול, עצמי), הופעל לאחרונה תאים אשר לאחר מכן למטה מוסדר רצפטורים או קבוצות משנה תא נדיר (למשל. תמים קודמן או זיכרון תא אוכלוסיות) שלהם. במקרים אלה, tetramer הקלאסית מכתים פרוטוקול ייתכן שתצטרך להיות שיפור או בשילוב עם שיטות אחרות. לדוגמה, dasatinib מעכב (PKI) חלבון קינאז מעכב TCR הפנמה, כלל לפני tetramer מכתים. Tetramers יכול גם להיות התייצב על-ידי הכללת Abs הראשי unconjugated אנטי-fluorochrome לאחר tetramer מכתים. בנוסף לכך, עוצמת קרינה פלואורסצנטית יכול להיות מוגברת על ידי תוספת של שני Ab אנטי fluorochrome מצומדת Ab29,34,35,36. אופטימיזציה את התנאים באופן סלקטיבי tetramers שצוין בפרוטוקול זה ואנו לא כללו PKI או Abs נוספים. עם זאת, עבור כל tetramer אחרים, התנאים אופטימליים יש יותאם באופן אינדיבידואלי. לגבי אוכלוסיות נדיר, tetramer מכתים ייתכן שתצטרך להיות משולב עם העשרה מגנטי11.
כדי לפשט ולאמת FACS ניתוח של tetramer מכתים, פקדים ואתאיזם צריך להיות כלול. כפקד שלילי, אנחנו תמיד מכתים תאים של עכבר תמימה של המתח אותו עם שלנו tetramer של עניין. לחלופין, דגימות יכול להיות מוכתם tetramers עם פפטידים לא רלוונטי, אבל עם fluorochrome אותו כמו tetramer של עניין. פקדים אלה חיוניים כדי לא לכלול אותות חיובי כוזב, למשל., שמקורם תאים גוסס. בנוסף לכך, מומלץ לכלול כתם חי/מת, כגון propidium יודיד (PI). זה חשיבות מיוחדת אם תאים לא מוכתמים ישירות לאחר בידוד. אסטרטגיה נוספת כדי להסיר את הרקע autofluorescence עשויה להיות לכלול מספר סמנים תא T ערוץ אחד. על ידי למעט תאים חיוביים בערוץ הזה, אוכלוסיות תא T יכול ייכללו. כפקד חיובית, מדגם העכבר OT-1, יכול לשמש tetramer ביצית, לדוגמה. עבור אחרים tetramers, זה חייב להיבחר בנפרד (למשל., דוגמה של עכבר, היה לחסן מספר פעמים). דומים אחרים37, אנחנו גם להתבונן מטה-התקנות של קולטן CD8 במהלך ההפעלה CTL ביום 7 של אפקטור תא T בתגובה. לכן, כדי למנוע אובדן שהופעל tetramer+ אפקטור T תאים, מומלץ לכלול את התאיםנמוך של CD8 בניתוח (לפחות אם מודדים בשלב אפקטור).
האיכות ואת כמות המידע אחד יכול לאחזר פרוטוקול זה תלויה את הידע בנושא אנטיגן להילמד, זמינות וספציפיות של tetramer והאיכות של המכונה FACS (מספר לייזרים וגלאים זמין). אם עובדים עם דוגמאות חיות, וריאציה של התגובה החיסונית הוא טבעי ובלתי נמנע. לכן, כדי לקבל תוצאות משמעותיות tetramer מכתים, לפחות 3-5 חיות צריך להיות מנותח. אם עשית זאת, פרוטוקול המתוארים כאן ייתן תוצאות אמין לשחזור (למופת כתוצאה מן הניסוי אחד ניתן למצוא טבלה משלימה 1). כפי שהוזכר קודם לכן, שיטה זו מתאימה באופן מושלם כדי לכמת את פנוטיפ וספציפיות אנטיגן-של CD8+ T תאים (איור 3, 4; משלימה איור 1), לא רק בתוך העכבר אלא גם בבני אדם. עם זאת, כדי לנתח CD8+ תא T אפקטור פונקציות, כגון מוות של תאים granzyme-induced, ICS ו/או ELISpot צריך להתבצע. עם זאת, אחד יש לזכור כי תא T פונקציות, כפי שהיא נמדדת על ידי גירוי במבחנה שאולי לא מייצג המצב בפועל ויוו. אין ויוו, סביבה מדכא עשוי למנוע פונקציות תא T אשר נמדדים במבחנה.
על tetramer משלו, צביעת אינו מספק כל מידע, אבל זה התפתח להיות שיטה חיונית כדי לאפיין את תא T תגובות ולכמת תא T קבוצות משנה במבחנה באופן רגיש מאוד38. Tetramers לא יכול לשמש רק לכמת קבוצות משנה מסוימים, אלא גם כדי לבודד אותם39, להתאים אותם לשפה היברידיזציה19,20 וללמוד אנטיגנים נמוך-זיקה, כגון סרטניים הקשורים40, 41. מאז הגילוי של טכנולוגיית tetramer4, tetramer מכתים הפך כלי חיוני ב- T-cell ניתוח וטווח התנועה של יישומים.
Disclosures
Dorothee פון הרובד הוא ממציא של VSV-GP ומחזיק מניות המיעוט בחברה ביוטק ViraTherapeutics GmbH, המחזיקה את זכויות הקניין עבור VSV-GP. למחברים אחרים, אין אינטרסים כלכליים מתחרים קיימים.
Acknowledgements
הפרויקט מומן על ידי FWF האוסטרי המדע הקרן (פרויקט מספר P 25499-B13) ולהעניק של האיחוד האירופי אופק 2020 המחקר, חדשנות תוכנית תחת הסכם מס 681032. הכימית הבאה הושג באמצעות מתקן ליבה Tetramer NIH: Class I MHC Tetramer עבור vesicular stomatitis וירוס נוקלאופרוטאין (RGYVYQGL).
Materials
| Name | Company | Catalog Number | Comments |
| Safety cabinet class 2 | VWR | LBCP302411030 | |
| Flow cytometer (e.g. FACSCanto II) | BD | 338962 | |
| Analysis platform for flow cytometry analysis (e.g. FlowJo) | Fisher Scientific Co. L.L.C. | NC0887833 | |
| Binocular microscopes, VisiScope 100 | VWR | 630-1553 | |
| Vortex mixer | Phoenix Instrument | RS-VA 10 | |
| Centrifuge suitable for FACS tubes (e.g. Rotanta 460R) | Hettich | 5660 | |
| Sterile Scalpel Blades Nr. 10 | Braun | BB510 | |
| Cell strainer 40 µm | Sigma | CLS431750 | |
| Cell strainer 70 µm | Sigma | CLS431751 | |
| Neubauer counting chamber | VWR | 630-1506 | |
| Pipettes (20 μL, 200 µL and 1000 μL) | Eppendorf | 4924000037, 4924000061, 4924000088 | |
| Pipette tips, sterile (20 µL, 200 µL, 1,000 µL) | Biozym | 770050, 770200, 770400 | |
| Pipet Boy | Integra | 155 000 | |
| Sterile pipettes (5 mL, 10 mL, 25 mL) | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Multistep Pipette, HandyStep S | BRAND | 705110 | |
| 12.5 mL Combitips for Multistep Pipette | BrandTech Scientific | 702378 | |
| Microvette CB 300 K2E | Sarstedt | 16.444 | |
| Sterile reaction tubes (1.5 mL, 50 mL) | Sarstedt | 72.692.005, 62.547.254 | |
| FACS tubes (non-sterile) | Szabo Scandic | BDL352008 | |
| PBS | Lonza | LONBE17-516F | |
| Heat-inactivated FCS | ThermoFisher Scientific | 10500064 | |
| Formaldehyde | Roth | 4979.1 | |
| Sodium azide | Roth | K305.1 | |
| PE-Cy7 Rat Anti-Mouse CD3 Molecular Complex | BD | 560591 | Clone 17A2; Lot # 7235504 |
| Pacific Blu Rat Anti-Mouse CD8a | BD | 558106 | Clone 53-6.7; Lot # 5058904 |
| V450 Rat anti-Mouse CD8a | BD | 560469 | Clone 53-6.7; Lot # 5205945 |
| FITC anti-mouse CD43 | BioLegend | 121206 | Clone 1B11; Lot # B233778 |
| PE-Cy5 Rat Anti-Mouse CD44 | BD | 553135 | Clone IM7; Lot # 85660 |
| APC-Cy7 Rat Anti-Mouse CD62L | BD | 560514 | Clone MEL-14; Lot # 7215801 |
| OVA-tetramer/APC | MBL | TB-5001-2 | SIINFEKL, H-2Kb; Lot # T1702008 |
| VSV NP-tetramer/PE | MBL | TS-M529-1 | RGYVYQGL, H-2Kb; Lot # 007 |
| EGFP-tetramer/PE | MBL | TS-M525-1 | HYLSTQSAL, H-2Kd; Lot # 004 |
| LCMV-GP-tetramer/APC | MBL | TB-5002-2 | KAVYNFATC, H-2Db; Lot # T1412006 |
| HPV 16 E7-tetramer/APC | MBL | TB-5008-2 | RAHYNIVTF, H-2Db; Lot # T1804003 |
References
- Tober, R., et al. VSV-GP: a potent viral vaccine vector that boosts the immune response upon repeated applications. Journal of virology. 88 (9), 4897-4907 (2014).
- Muik, A., et al. Re-engineering vesicular stomatitis virus to abrogate neurotoxicity, circumvent humoral immunity, and enhance oncolytic potency. Cancer Reseaerch. 74 (13), 3567-3578 (2014).
- Eales, L. J., Farrant, J., Helbert, M., Pinching, A. J. Peripheral blood dendritic cells in persons with AIDS and AIDS related complex: loss of high intensity class II antigen expression and function. Clinical and Experimental Immunology. 71, 423-427 (1988).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- . Tetramers and Monomers Available from: https://www.mblintl.com/products/research/monomer-tetramers/filter/product_type/monomer (2016)
- Wolfl, M., et al. Quantitation of MHC tetramer-positive cells from whole blood: evaluation of a single-platform, six-parameter flow cytometric method. Cytometry A. 57 (2), 120-130 (2004).
- Burrows, S. R., et al. Peptide-MHC class I tetrameric complexes display exquisite ligand specificity. The Journal of Immunology. 165 (11), 6229-6234 (2000).
- Sims, S., Willberg, C., Klenerman, P. MHC-peptide tetramers for the analysis of antigen-specific T cells. Expert Review of Vaccines. 9 (7), 765-774 (2010).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. The Journal of Visualized Experiments. (68), (2012).
- Xie, Y., et al. A novel T cell-based vaccine capable of stimulating long-term functional CTL memory against B16 melanoma via CD40L signaling. Cellular & Molecular Immunology. 10 (1), 72-77 (2013).
- Nanjundappa, R. H., Wang, R., Xie, Y., Umeshappa, C. S., Xiang, J. Novel CD8+ T cell-based vaccine stimulates Gp120-specific CTL responses leading to therapeutic and long-term immunity in transgenic HLA-A2 mice. Vaccine. 30 (24), 3519-3525 (2012).
- Bowers, E. V., Horvath, J. J., Bond, J. E., Cianciolo, G. J., Pizzo, S. V. Antigen delivery by alpha(2)-macroglobulin enhances the cytotoxic T lymphocyte response. Journal of Leukocyte Biology. 86 (2), 1259-1268 (2009).
- Guo, H., Baker, S. F., Martinez-Sobrido, L., Topham, D. J. Induction of CD8 T cell heterologous protection by a single dose of single-cycle infectious influenza virus. The Journal of Immunology. 88 (20), 12006-12016 (2014).
- Sakai, K., et al. Dendritic cell-based immunotherapy targeting Wilms' tumor 1 in patients with recurrent malignant glioma. Journal of Neurosurgery. 123 (4), 989-997 (2015).
- Rosaely, C. G., et al. Immune responses to WT1 in patients with AML or MDS after chemotherapy and allogeneic stem cell transplantation. International Journal of Cancer. 138 (7), 1792-1801 (2016).
- Shane, H. L., Reagin, K. L., Klonowski, K. D. The Respiratory Environment Diverts the Development of Antiviral Memory CD8 T Cells. The Journal of Immunology. , (2018).
- Li, S., Mwakalundwa, G., Skinner, P. J. In Situ MHC-tetramer Staining and Quantitative Analysis to Determine the Location, Abundance, and Phenotype of Antigen-specific CD8 T Cells in Tissues. The Journal of Visualized Experiments. (127), e56130 (2017).
- De Vries, I. J. M., et al. In situ detection of antigen-specific T cells in cryo-sections using MHC class I tetramers after dendritic cell vaccination of melanoma patients. Cancer Immunology Immunotherapy. 56 (10), 1667-1676 (2007).
- Tan, H. X., et al. Induction of vaginal-resident HIV-specific CD8 T cells with mucosal prime-boost immunization. Mucosal Immunology. , (2017).
- Huang, H., et al. CD8(+) T Cell Immune Response in Immunocompetent Mice during Zika Virus Infection. Journal of Virology. 91 (22), (2017).
- Hensel, M. T., et al. Selective Expression of CCR10 and CXCR3 by Circulating Human Herpes Simplex Virus-Specific CD8 T Cells. Journal of Virology. 91 (19), (2017).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21 (1), 15-23 (2001).
- San Jose, E., Borroto, A., Niedergang, F., Alcover, A., Alarcon, B. Triggering the TCR complex causes the downregulation of nonengaged receptors by a signal transduction-dependent mechanism. Immunity. 12 (2), 161-170 (2000).
- Dietrich, J., Hou, X., Wegener, A. M., Geisler, C. CD3 gamma contains a phosphoserine-dependent di-leucine motif involved in down-regulation of the T cell receptor. EMBO Journal. 13 (9), 2156-2166 (1994).
- Schone, D., et al. Immunodominance of Adenovirus-Derived CD8(+) T Cell Epitopes Interferes with the Induction of Transgene-Specific Immunity in Adenovirus-Based Immunization. Journal of Virology. 91 (20), (2017).
- Dolton, G., et al. More tricks with tetramers: a practical guide to staining T cells with peptide–MHC multimers. Immunology. 146 (1), 11-22 (2015).
- Whelan, J. A., et al. Specificity of CTL Interactions with Peptide-MHC Class I Tetrameric Complexes Is Temperature Dependent. The Journal of Immunology. 163 (8), 4342-4348 (1999).
- Wooldridge, L., et al. Tricks with tetramers: how to get the most from multimeric peptide–MHC. Immunology. 126 (2), 147-164 (2009).
- Denkberg, G., Cohen, C. J., Reiter, Y. Critical role for CD8 in binding of MHC tetramers to TCR: CD8 antibodies block specific binding of human tumor-specific MHC-peptide tetramers to TCR. The Journal of Immunology. 167 (1), 270-276 (2001).
- Daniels, M. A., Jameson, S. C. Critical role for CD8 in T cell receptor binding and activation by peptide/major histocompatibility complex multimers. The Journal of Experimental Medicine. 191 (2), 335-346 (2000).
- Tungatt, K., et al. Antibody stabilization of peptide-MHC multimers reveals functional T cells bearing extremely low-affinity TCRs. The Journal of Immunology. 194 (1), 463-474 (2015).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. Journal of Immunological Methods. 340 (1), 11-24 (2009).
- Rius, C., et al. Peptide-MHC Class I Tetramers Can Fail To Detect Relevant Functional T Cell Clonotypes and Underestimate Antigen-Reactive T Cell Populations. The Journal of Immunology. 200 (7), 2263-2279 (2018).
- Xiao, Z., Mescher, M. F., Jameson, S. C. Detuning CD8 T cells: down-regulation of CD8 expression, tetramer binding, and response during CTL activation. The Journal of Experimental Medicine. 204 (11), 2667-2677 (2007).
- McMichael, A. J., O'Callaghan, C. A. A New Look at T Cells. The Journal of Experimental Medicine. 187 (9), 1367-1371 (1998).
- Hunsucker, S. A., et al. Peptide/MHC tetramer-based sorting of CD8(+) T cells to a leukemia antigen yields clonotypes drawn nonspecifically from an underlying restricted repertoire. Cancer Immunology Research. 3 (3), 228-235 (2015).
- Pittet, M. J., et al. Ex vivo analysis of tumor antigen specific CD8+ T cell responses using MHC/peptide tetramers in cancer patients. International Immunopharmacology. 1 (7), 1235-1247 (2001).
- Cohen, C. J., et al. Isolation of neoantigen-specific T cells from tumor and peripheral lymphocytes. The Journal of Clinical Investigation. 125 (10), 3981-3991 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved