Method Article
Determinazione quantitativa simultanea delle anti-vettore e Anti-transgene-Specific CD8+ T cellule tramite MHC I tetramero colorazione dopo la vaccinazione con un vettore virale
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per l'ex vivo determinazione qualitativa dell'antigene-specifiche CD8+ T cellule. L'analisi è possibile con sospensioni di cellule singole da organi o da piccole quantità di sangue. Una vasta gamma di studi richiedono l'analisi delle risposte a cellula T citotossica (vaccinazione e studi di immunoterapia del cancro).
Abstract
Dopo l'infezione virale, antigene-specifiche CD8+ cellule di T citotossiche (CTL) derivano e contribuire all'eliminazione delle cellule infettate per impedire la diffusione di agenti patogeni. Di conseguenza, la frequenza di antigene-specific CTLs è indicativa della forza della risposta delle cellule T contro un antigene specifico. Tale analisi è importante in immunologia di base, lo sviluppo di vaccini, cancro immunobiologia e l'immunologia adattivo. Nel campo vaccino, la risposta CTL diretta contro componenti di un vettore virale co-determina quanto efficace è la generazione di cellule antigene-specifiche contro l'antigene di interesse (cioè, transgene). Antigene-specifici CTL può essere rilevato sia dalla stimolazione con peptidi specifici seguite da intracellulari di cytokine colorazione o dalla macchiatura diretta dei recettori di cellule T antigene-specifiche (TCR) e analisi di citometria a flusso. Il primo metodo è piuttosto che richiede tempo, poiché è necessario sacrificare degli animali per isolare le cellule da organi. Inoltre, esso richiede l'isolamento del sangue da animali di piccole taglia che è difficile da eseguire. Il secondo metodo è piuttosto veloce, può essere fatto facilmente con piccole quantità di sangue e non è dipenda su funzioni effettrici specifiche, ad esempio attività citolitica. I tetrameri MHC sono uno strumento ideale per rilevare l'antigene-specifici TCR.
Qui, descriviamo un protocollo per rilevare contemporaneamente antigene-specifici CTL per i peptidi immunodominanti del vettore virale VSV-GP (LCMV-GP, VSV-NP) e transgeni (OVA, E7 di HPV 16, eGFP) di MHC I tetramero macchiatura e flusso cytometry. La colorazione è possibile direttamente da sangue o da sospensioni di singola cellula degli organi, quali la milza. Sangue o sospensioni di singole cellule di organi vengono incubate con tetrameri. Dopo colorazione con anticorpi contro CD3 e CD8, antigene-specifici CTL sono quantificati tramite flusso cytometry. Facoltativamente, gli anticorpi contro CD43, CD44, CD62L o altri possono essere inclusi per determinare lo stato di attivazione di CD8 antigene-specifiche+T cellule e di discriminare tra cellule effettrici ed ingenuo.
Introduzione
Lo scopo di questo metodo è quello di valutare la frequenza delle risposte dei linfociti T citotossici (CTL) agli antigeni (più) nel topo da analisi cytometric di flusso senza la necessità di stimolazione del peptide che richiede tempo. Questo metodo analizza la specificità di fenotipo e dell'antigene di sottoinsiemi CTL, in un singolo ciclo di colorazione. Abbiamo ottimizzato il complesso maggiore di istocompatibilità ho (MHC I) tetramero che macchia protocollo per analizzare l'efficacia di nuovi approcci di vaccino, come VSV-GP, una nuova variante del virus stomatite vescicolare (VSV), dove la glicoproteina G del VSV è stata sostituita dalla glicoproteina GP della Coriomeningite linfocitaria virus (LCMV)1,2. Oltre alla risposta umorale, una lettura importante dell'effettività di un vaccino è l'induzione di una risposta CTL contro uno o più antigeni. Come la consistenza e la durata della risposta cellulare sono importanti in questo contesto, è favorevole per monitorare la cinetica delle risposte CTL dall'animale stesso. Questo porterà anche ad una riduzione del numero di animali, un aspetto importante per quanto riguarda i principi delle "3R"3. Quindi, l'analisi da appena 20 µ l di sangue è ottima per questo scopo.
Tetrameri sono stati sviluppati negli anni ' 90 tardi4 ed è diventato uno strumento importante nel campo della immunologia delle cellule T. Sono tetrameri fluorescente etichettati complessi di quattro MHC I / molecole del peptide, che si legano alla TCR, specifico per un singolo peptide. Al giorno d'oggi, possono essere acquistati sia già pronti5, custom-ordinato gratuitamente presso l'impianto di Core NIH tetramero Emory University6 o prodotte in laboratorio7. MHC I e II tetrameri sono disponibili, cioè per CD8+ e CD4 cellule+ T, rispettivamente. La potenza del tetramero macchiatura sta nel risparmio di tempo, piuttosto semplice e facile da standardizzare i protocolli8 e sensibilità9. Inoltre, se si lavora con il sangue, gli animali non è necessario essere sacrificato e quantità minime di campione sono necessari. Una sola misurazione non è limitata a un singolo antigene, ma parecchi antigeni possono essere analizzati in una colorazione quando combinando tetrameri coniugati con diversi fluorofori. Antigeni recentemente scoperti, per esempio dagli schermi del peptide, possono essere facilmente incorporati in tetrameri e utilizzati per la quantificazione del sottoinsieme delle cellule T.
Tetramero di colorazione non darà informazioni sulle funzionalità CTL (cioè., produzione di citochina, funzioni effettrici), ma solo specificità. Per ottenere informazioni sulla funzionalità delle cellule T, intracellulare cytokine colorazione (ICS) o analisi enzima Linked Immuno Spot (ELISpot) dovrà essere eseguita8,10. Tetramero macchiatura e ICS/ELISpot, tuttavia, non sono ridondanti, ma piuttosto completano a vicenda. Stimolazione in vitro per indurre la produzione di citochina per ICS/ELISpot altererà il fenotipo a cellula T originale. Tetramero di colorazione, al contrario, lascia la cellula T intatta; il fenotipo originale è conservato e può essere analizzato. Inoltre, un altro grande vantaggio di tetrameri è che la colorazione possono essere combinati con l'ordinamento magnetico e l'arricchimento di cellule antigene-specifiche11. Questo permette l'analisi delle popolazioni rari, così come coltura delle cellule ordinate con antigene-specificità definita — una caratteristica che non è possibile con altri metodi.
Utilizzando il protocollo descritto qui, tetramero colorazione, nonché ICS/ELISpot può essere eseguita da un organo, perché solo pochissimo materiale (sangue: 20 µ l; milza: 1 x 106 cellule) è richiesto per la colorazione del tetramero. Tuttavia, a seconda della frequenza delle cellule antigene-specifiche di interesse, la forza delle rispettive TCR e il contesto sperimentale, la quantità di cellule necessarie potrebbe essere necessario essere scalato o arricchimento magnetico potrebbe essere necessario essere applicato.
Tetrameri sono ampiamente utilizzati, ad esempio per valutare l'efficacia di vaccini (antitumorale)12,13,14,15 o immunoterapia16,17, analisi fenotipica e spaziale localizzazione di cellule T antigene-specifiche sottoinsiemi18,19,20,21,22,23. Il metodo qui descritto è adatto per gli studi, che intendono includere la quantificazione e l'analisi fenotipica di murino antigene-specifiche CD8+ T cellule nella loro analisi in modo rapido e conveniente.
Protocollo
Tutti i metodi descritti sono state eseguite in conformità con la legge austriaca del sperimentazione animale nazionale ("Tierversuchsgesetz"), e prova animale permesso fu concesso dalle autorità nazionali austriaci.
1. tampone preparazione e raccolta dei campioni
Nota: Il ceppo del mouse utilizzato dipende l'epitopo analizzato. Scegliere un tetramero appropriato che viene associato a un MHC tipo espresso nei topi, per esempio., H - 2Kb per topi C57BL/6. Il sesso e l'età degli animali dipenderà la domanda scientifica. Per la maggior parte degli esperimenti descritti qui, utilizzare topi femmina a 6 – 8 settimane di età all'inizio dell'esperimento, cioè, prima immunizzazione.
- Preparare FACS Buffer (tampone fosfato salino (PBS) + 1% siero fetale del vitello (FCS) + 0,1% sodio azide + acido etilendiamminotetracetico 2mm (ed) e buffer di fissaggio FACS (1,5% (v/v) di formaldeide in PBS).
Nota: Si raccomanda che entrambi i buffer vengono preparati in anticipo. Conservato a 4 ° C fino all'utilizzo. - Sangue: Raccogliere 20 µ l di sangue per topo da vena caudale del mouse in provette sensibilizzate con EDTA, come descritto in precedenza24.
Nota: Sangue possono essere raccolti anche attraverso altre vie, ad esempio, della vena facialis o retro-orbitale seno. Tuttavia, il metodo di raccolta del sangue deve essere in conformità con la legge nazionale sperimentazione animale e animale prova applicazioni. Raccolta di sangue dalla vena caudale è ideale per gli studi dove sono necessari ripetutamente piccole quantità di sangue. Materiale aggiuntivo è richiesto per i controlli di compensazione e il controllo non tinto. - Milza: Isolare l'organo e, con l'aiuto dello stantuffo di una siringa, premere attraverso un 70 nm e 40 µm cella filtro. Eseguire la lisi degli eritrociti, come descritto nel passaggio 6 e conteggio. Regolare la concentrazione di 1 x 107 cellule/mL in PBS. Per esempio, 1 x 106 celle sono necessari.
Nota: Sempre includere alcuni mock immunizzati o vettoriale immunizzati animali di controllo come controllo negativo. Per ovoalbumina (uova)-tetramero, un campione dai topi di OT-1 potrebbe essere utilizzato come controllo positivo. Non dimenticate non macchiate e controlli di compensazione nel calcolo. Se necessario, campioni da diversi animali nell'esperimento potrebbero essere riuniti per questo. - Dopo la raccolta dei campioni, procedere direttamente con la colorazione.
2. set-up di colorazione
- Preparare una provetta di FACS per ciascun campione. Etichettare correttamente provette e trasferire 100 µ l della sospensione di organo (1 x 106 cellule) o 20 μL di sangue in ogni provetta.
- Milza: Centrifugare per 5 min a 600 x g a 4 – 8 ° C e scartare il surnatante. Vortice per risospendere il pellet cellulare.
Nota: Questo si tradurrà in un volume residuo di circa 20 µ l, simile come il volume per i campioni di sangue. - Per ogni canale utilizzabile anche preparare una provetta di FACS per un esempio di compensazione. Preparare un campione aggiuntivo come un controllo non colorato.
3. tetramero macchiatura
-
Per ogni campione, utilizzare 50 μL di diluizione del tetramero. Suggerito tetrameri e diluizioni ottimizzati, fare riferimento alla tabella 1.
Nota: Quando si lavora con tetrameri o anticorpi, spegnere la luce della sicurezza mobile e proteggere i campioni dalla luce.- Preparare una provetta con il tampone di FACS (volume = 50 μL × numero di campioni più ulteriore 10% del volume totale per compensare errori di pipettaggio).
- Aggiungere tetramer(s) a una diluizione ottimale, come elencato nella tabella 1. Vortice la soluzione.
Nota: Quando si utilizza il pannello intero anticorpo (CD3, CD8, CD43, CD44, CD62L) con fluorofori elencati, due tetrameri (in PE e APC) possono essere inclusi. Entrambi i tetrameri possono essere combinati in una sola colorazione, cioè, colorazione di cellule con entrambi i tetrameri possono essere eseguite contemporaneamente.
| Tetramero | Sequenza del peptide | Allele | Fluoroforo | Diluizione |
| MHC I / OVA | SIINFEKL | H - 2Kb | APC | 01:25 |
| MHC I/VSV-NP | RGYVYQGL | H - 2Kb | PE | 01:25 |
| MHC I / EGFP | HYLSTQSAL | H-2Kd | PE | 01:25 |
| MHC I/LCMV-GP | KAVYNFATC | H-2Db | APC | 01:25 |
| MHC I / HPV 16 E7 | RAHYNIVTF | H-2Db | APC | 01:10 |
Tabella 1: suggerito tetrameri e diluizioni ottimali. Tetrameri consigliati per alcuni peptidi immunodominanti di antigeni di modello (ovoalbumina (OAV) e migliorata della proteina fluorescente verde (eGFP)) o componenti di agente patogeno (nucleoproteina (VSV) virus stomatite vescicolare (NP), Coriomeningite linfocitaria Virus (LCMV ) Della glicoproteina (GP) e papillomavirus umano (HPV) oncoproteina E7 (E7)). Per ciascuno, la sequenza del peptide e allele corrispondente, è elencato anche come raccomandato fluoroforo e diluizione ottimizzato.
- Aggiungere 50 μL di diluizione tetramero a ciascun campione e vortice delicatamente. Aggiungere FACS buffer solo (senza tetramero) ai controlli di compensazione e per il campione senza macchia.
- Incubare i campioni per 20 min a 37 ° C, al riparo dalla luce. Per garantire una transizione senza soluzione di continuità da tetramero di anticorpo che macchia, è necessario preparare la miscela di anticorpo come descritto nel passaggio 4 durante il periodo di incubazione.
Nota: Per ogni singolo tetramero, condizioni ottimali (temperatura, tempo di incubazione e diluizione) devono essere regolato.
4. preparazione di anticorpi
-
Per ogni campione, preparare 50 µ l di miscela di anticorpo.
- Preparare una provetta con il tampone di FACS (volume = 50 μL × numero di campioni più ulteriore 10% del volume totale di compensare errori di pipettaggio).
- Aggiungere gli anticorpi nelle diluizioni come elencato nella tabella 2.
Nota: A seconda la domanda scientifica, potrebbero essere utilizzate altre combinazioni di marcatore a parte quella qui descritta. Assicurarsi di includere sempre gli anticorpi contro CD3 e CD8 nel pannello. - Vortice la soluzione.
| Anticorpo | Fluoroforo | Diluizione | µ g/campione | Marcatore |
| CD3 | PE-Cy7 | 1: 200 | 0.05 | CTL (CD3+CD8+) |
| CD8 | Pacific Blue | s 1: 750 | 0,013 | |
| V450 | 1: 100 | 0.1 | ||
| CD43 | FITC | 1: 100 | 0.25 | Attivazione (CD43+) |
| CD44 | PE-Cy5 | 1: 250 | 0,04 | Naive (CD44–CD62L+) & effettrici (CD44+CD62L–) |
| CD62L | APC-Cy7 | 1: 500 | 0,02 |
Tabella 2: gli anticorpi usati in questo protocollo e diluizioni ottimali. Consigliati gli indicatori di superficie (CD3, CD8, CD43, CD44 e CD62L) sono elencati nella prima colonna. Per ciascuna, sono elencati il fluoroforo consigliato, diluizione ottimizzata e quantità di anticorpo/campione. Nell'ultima colonna, il tipo di cella identificato con ogni indicatore viene specificato.
-
Preparare gli anticorpi per i controlli di compensazione. Per ogni controllo di compensazione, usare un anticorpo contro CD8 nel rispettivo colore.
- Per ogni canale, preparare una provetta con 200 μL di tampone di FACS e aggiungere 1 μL di un anticorpo di diluizione di 1: 200 contro CD8 nel rispettivo colore.
- Vortice i tubi.
- Procedere immediatamente con la macchiatura.
5. colorazione dei campioni
- Lavare una volta campioni aggiungendo ~ 1 mL di tampone di FACS e centrifugare per 5 min a 600 x g a 4 – 8 ° C. Dopo la centrifugazione, scartare il surnatante e sgocciolare il liquido restante su una pila di tovaglioli di carta.
Nota: Quando si lavora con il sangue, essere cauti quando lo scarico liquido restante. Prima la lisi degli eritrociti, sangue non si attacchi al fondo del tubo FACS. In alternativa, aspirare il supernatante. - Aggiungere 50 µ l della miscela dell'anticorpo in ciascun pellet cellulare e vortice delicatamente.
- Aggiungere 50 μL di ogni mix di compensazione per il pellet cellulare del controllo corrispondente compensazione e vortice delicatamente.
- Aggiungere 50 μL di tampone di FACS per il pellet cellulare del controllo non macchia e vortice delicatamente.
- Incubare tutti i campioni per 30 min a 4 ° C, al riparo dalla luce.
- Quando si lavora con gli organi: ignorare il passaggio 6. Lavare una volta aggiungendo ~ 1 – 2 mL di tampone di FACS e centrifugare per 5 min 600 x g a 4 – 8 ° C. Dopo la centrifugazione, scartare il surnatante e sgocciolare il liquido restante su una pila di tovaglioli di carta.
- Quando si lavora con il sangue: procedere al passaggio 6 (lisi degli eritrociti).
6. lisi degli eritrociti
- Aggiungere 500 μL di tampone ACK (ammonio-cloruro-potassio)25 per ogni campione e delicatamente vortice.
Nota: Buffer di ACK porterà a rigonfiamento osmotico e Lisi, in particolare degli eritrociti. - Incubare per 5 min a temperatura ambiente al buio.
- Aggiungere 1 mL di buffer di FACS e centrifugare per 5 min a 600 x g a 4 – 8 ° C. Dopo la centrifugazione, scartare il surnatante e far sgocciolare il liquido restante su una pila di tovaglioli di carta.
Nota: Quando la pallina è piuttosto rossa, ripetere la lisi degli eritrociti. - Lavare una volta aggiungendo ~ 1 – 2 mL FACS buffer e centrifugare per 5 min 600 x g a 4 – 8 ° C. Dopo la centrifugazione, scartare il surnatante e sgocciolare il liquido restante su una pila di tovaglioli di carta.
7. analisi e misurazione Cytometric di flusso
- Aggiungere 150 – 300 μL di tampone fissaggio FACS in ogni provetta e mescolare nel Vortex. 20 µ l di sangue, 150 µ l di tampone è sufficiente.
Nota: Prima della fissazione, assicurarsi che le cellule siano ben ri-sospensione al fine di prevenire la formazione di grumi. Procedere con la misurazione del flusso cytometric più rapidamente possibile. - I controlli di compensazione di misurare e correggere eventuali sovrapposizioni spettrale.
-
Impostare porte sequenziale, come illustrato nella Figura 1 per selezionare per CD3+/CD8+ cellule.
- Cancello sui linfociti mediante dispersione in avanti e lateralmente (Area) (non-logaritmica).
- All'interno della popolazione dei linfociti, cancello su singole cellule usando forward scatter larghezza vs area (scala non logaritmica).
- Tracciare i linfociti singola cella usando canali CD3 e CD8 (scala logaritmica). Identificare CD8+ T cellule di gating su CD3+/CD8+ cellule.
- Trama CD8+ vs tetramero+ cellule e cancello il CD8+ + tetramero cellule, come raffigurato in Figura 2.
- Se possibile, registrare 20.000 (almeno 5.000 cellule dal sangue) nel CD3+/CD8+ gate per ogni campione e salvare come file FCS.
Nota: La quantità di cellule per registrare potrebbe essere necessario essere regolata in base alla frequenza delle cellule antigene-specifiche di interesse. - Analizzare i file FCS con software di analisi appropriato. Utilizzare la strategia di gating, come descritto in precedenza (sezione 7.3) e quantificare CD8+ + tetramero cellule.
Risultati
Nella figura 1 viene illustrato come cancello correttamente sulle cellule bersaglio del presente protocollo, vale a dire CD3+/CD8+ cellule. È da notare che ha attivato cellule spesso downregulate il T cell receptor26,27 e, pertanto, CD3 cellulebasso dovrebbero essere incluse nel gating. Dopo il CD3 di gating+/CD8+ cellule, tetramero positivo cellule possono essere identificato (Figura 2). Rappresentante macchie per un mouse di controllo negativo (ingenuo), come bene come animali o vaccinati con entrambi OVA-secrezione dell'Adenovirus 5 (Adeno-OVA) o OVA-esprimendo VSV-GP (VSV-GP-OVA) vengono visualizzati. Come visto nelle macchie inferiore due diversi tetrameri possono essere combinati nello stesso tubo per la colorazione. Questo consente la quantificazione simultanea di due diverse specificità CTL: virus-specifici (VSV N) e CTL specifici transgene (OAV). Abbiamo confermato che gli stainings tetramero singole e doppie dare percentuali simili di cellule positive per ogni tetramero. Usando questo protocollo, altri virus-specifici (es.., LCMV GP, E7 di HPV 16) o specifiche del transgene (ad es.., GFP) delle cellule di T popolazioni possono essere analizzato (Supplemental figura 1). In supplementare nella tabella 1, vengono visualizzati risultati per cinque animali dopo immunizzazione con VSV-GP-OVA — indicante robustezza del tetramero macchiatura.
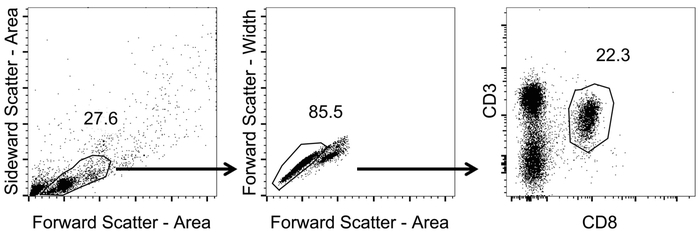
Figura 1: Rappresentante gating strategia per analizzare CD8+ T cellule nel sangue. Rappresentazione schematica della gating strategia utilizzata per l'analisi cytometric di flusso. Dopo misurazione tetramero macchiatura e flusso cytometric dati sono stati analizzati. I linfociti sono stati identificati con dispersione in avanti e lateralmente (Area) (non-logaritmica). Da quelli, singole cellule sono state identificate mediante l'applicazione di zona di forward scatter larghezza vs (scala non logaritmica). CD8+ T cellule sono state identificate di gating su CD3+/CD8+ cellule (scala logaritmica). Clicca qui per visualizzare una versione più grande di questa figura.
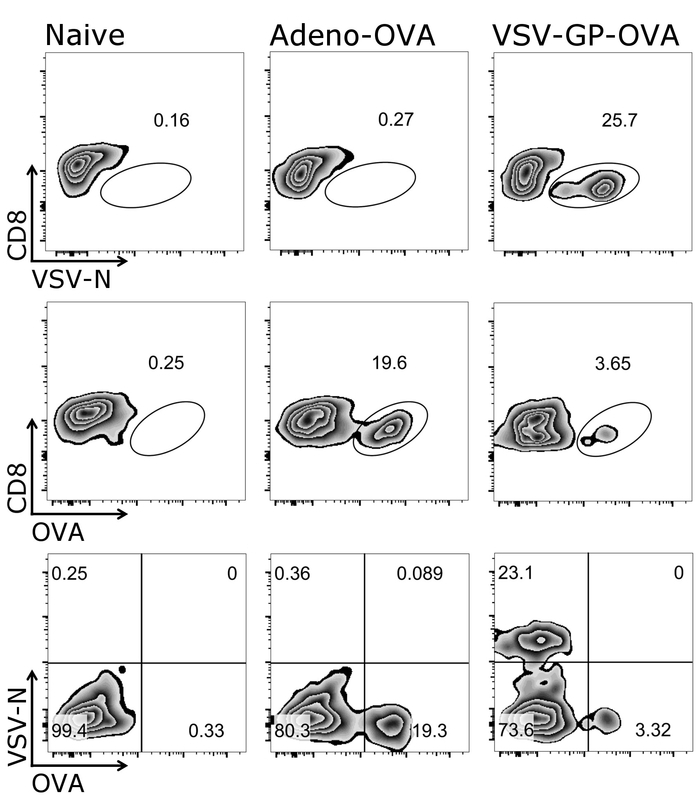
Figura 2: Rappresentante gating strategia per quantificare OVA - e N-specific CD8+ T cellule nel sangue. Rappresentazione schematica della gating strategia utilizzata per Quantificazione cytometric di flusso delle cellule tetramero+ . CD3+/CD8+ cellule sono state usate per l'analisi del tetramero. Pannello superiore e centrale: il marcatore di CD8 era tramato contro rispettivo tetramero (scala logaritmica). Pannello inferiore: entrambi i tetrameri sono stati tracciati contro l'altro (scala logaritmica). Sinistra: controllo (ingenuo) del mouse; centrale: mouse è stato immunizzato con ovuli-secernenti Adenovirus 5 (Adeno-ovuli); destra: mouse è stato immunizzato con ovoalbumina (uova)-esprimendo VSV-GP (VSV-GP-OVA). Sangue è stato raccolto dalla vena caudale al giorno 7 dopo immunizzazione. Clicca qui per visualizzare una versione più grande di questa figura.
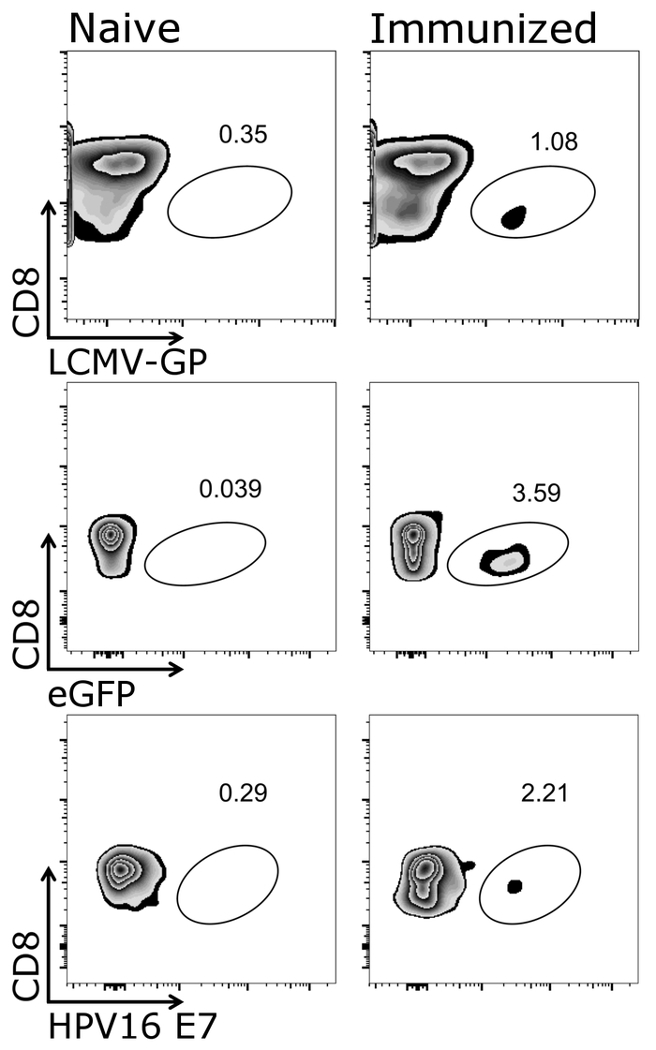
Supplemental figura 1: Risultato rappresentativo di CD3+/CD8+ cellule tetramero+ dopo la vaccinazione. Rappresentazione schematica della quantificazione cytometric di flusso delle cellule tetramero+ . CD3+/CD8+ cellule sono state usate per l'analisi del tetramero e il marcatore di CD8 era tramato contro rispettivo tetramero (scala logaritmica). Sinistra: topi erano ingenui, destra: topi sono stati immunizzati con VSV-GP (pannello superiore), migliorata della proteina fluorescente verde (eGFP)-esprimendo VSV-GP (pannello centrale) o VSV-GP esprimendo la oncoproteina E7 di papillomavirus umano (HPV) (E7) (pannello inferiore). Il sangue è stato raccolto da vena caudale al giorno 7 dopo immunizzazione e macchiato con tetrameri (LCMV-GP, eGFP ed E7 di HPV). Clicca qui per visualizzare una versione più grande di questa figura.
Un grande vantaggio del protocollo descritto qui è che le risposte delle cellule T dal mouse stesso possono essere seguite nel tempo come solo piccole quantità di sangue sono necessari per ogni misurazione. La figura 3 Mostra risultati esemplare per le risposte delle cellule T nel corso del tempo. Oltre alla quantità di antigene-specific CTLs, il loro fenotipo può essere analizzato anche usando questo protocollo (Figura 4).
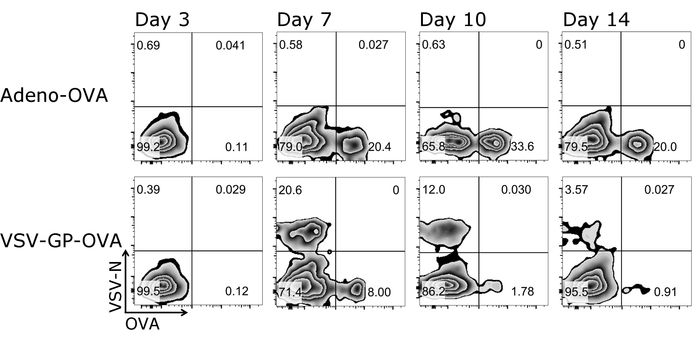
Figura 3: Risultato rappresentativo di CD8+ T cell cinetica nel sangue dopo la vaccinazione. Rappresentazione schematica della gating strategia utilizzata per Quantificazione cytometric di flusso delle cellule tetramero+ . CD3+/CD8+ cellule sono state usate per l'analisi del tetramero ed entrambi tetrameri sono stati tracciati contro l'altro (scala logaritmica). Pannelli superiori: mouse è stato immunizzato con ovuli-secernenti Adenovirus 5 (Adeno-ovuli); abbassare i pannelli: mouse è stato immunizzato con ovoalbumina (uova)-esprimendo VSV-GP (VSV-GP-OVA). Sangue è stato raccolto dalla vena caudale al giorno 3, 7, 10 e 14 dopo immunizzazione. Clicca qui per visualizzare una versione più grande di questa figura.
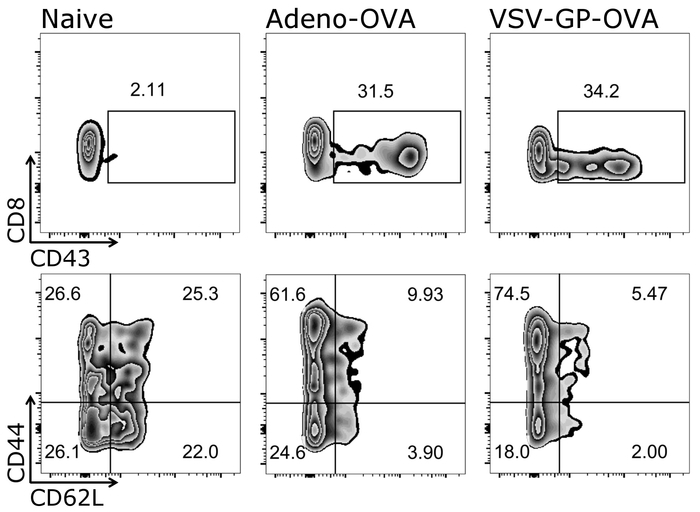
Figura 4: Risultato rappresentativo di CD8+ T cellulare attivazione e differenziazione in cellule effettrici ed ingenuo dopo la vaccinazione. Rappresentazione schematica della gating strategia utilizzata per Quantificazione cytometric di flusso di attivato (CD43+), ingenuo (CD44–/CD62L+) ed effettrici (CD44+/CD62L–) CD3+/CD8+ cellule ( scala logaritmica). Sinistra: controllo (ingenuo) del mouse; centrale: mouse è stato immunizzato con ovuli-secernenti Adenovirus 5 (Adeno-ovuli); destra: mouse è stato immunizzato con ovoalbumina (uova)-esprimendo VSV-GP (VSV-GP-OVA). Sangue è stato raccolto dalla vena caudale al giorno 7 dopo immunizzazione. Clicca qui per visualizzare una versione più grande di questa figura.
| # Il mouse | CD43%+ | Tetramero di VSV-N %+ | Tetramero di ovuli %+ | |
| Mock | 1 | 1.7 | 0.45 | 0.41 |
| 2 | 0,77 | 0,69 | 0.15 | |
| 3 | 1.34 | 0.35 | 0,31 | |
| 4 | 1.68 | 0,83 | 0,26 | |
| 5 | 0.84 | 0,47 | 0.23 | |
| VSV-GP-OVA | 1 | 23 | 13.2 | 3,69 |
| 2 | 32,6 | 15,9 | 3,54 | |
| 3 | 22,1 | 11,7 | 2.43 | |
| 4 | 15.1 | 8.89 | 1.79 | |
| 5 | 29.1 | 14,7 | 5,64 |
Supplementare tabella 1: Percentuali di CD3 attivato e antigene-specifica+/CD8+ cellule dopo la vaccinazione. I topi sono stati entrambi ingenuo o immunizzati con ovoalbumina (uova)-esprimendo VSV-GP (VSV-GP-OVA) (n = 5). Il sangue è stato raccolto da vena caudale al giorno 7 dopo immunizzazione e macchiato con tetrameri (VSV-N e ovuli). Attivato (CD43+) e CD3 antigene-specifiche (tetramero+)+/CD8+ cellule sono state quantificate tramite flusso cytometry.
Discussione
Macchiatura del tetramero è un protocollo piuttosto semplice e senza complicazioni per analizzare il fenotipo e peptide specificità di un linfocita T. L'utilizzo di sangue per l'analisi, come descritto qui, è come minimo dilagante e consente il monitoraggio continuo, ad esempio negli studi di vaccinazione. Nel campo della vaccinazione, la quantificazione delle risposte antigene-specifiche e di vettore è di interesse, come le risposte specifiche del vettore potrebbero ostacolare un'efficace risposta immunitaria contro il vaccino antigene28. Di nota è che con il protocollo descritto qui, entrambe le popolazioni possono essere quantificate simultaneamente in un singolo tetramero di macchiatura, riducendo la variabilità di colorazione e quantità di campione. Tuttavia, a pochi passi devono essere fatte con cura per garantire la corretta misurazione e dati affidabili. Se si utilizza sangue dalla vena caudale per analisi, uno dovrebbe assicurarsi che preriscaldare gli animali per indurre vasodilatazione24. Quindi, sufficiente sangue può essere raccolto in breve tempo, lo stress sugli animali è ridotto e l'analisi è molto meglio, rispetto a se il sangue viene raccolto lentamente. Inoltre, dopo la raccolta dei campioni (sangue o organi), macchiatura diretta è consigliabile per evitare risultati falsi negativi a causa di TCR downregulation. Lo stesso vale per tutti i passaggi successivi: la procedura non deve essere interrotta e tutti i passaggi del lavaggio ridotto al minimo numero (come indicato nel protocollo). Per garantire la corretta colorazione, dovrebbe prestare attenzione a vortice tutte le soluzioni e i campioni prima e dopo incubazione. Ciò è particolarmente importante prima di fissare i campioni per evitare grumi di cellule.
In termini di modifica del protocollo, possono essere utilizzati altri marcatori di superficie e tetrameri, a seconda l'obiettivo dell'analisi. Tuttavia, tutti i reagenti quindi necessario dosare in modo ottimale in combinazione con l'intero pannello di colorazione. Per alcuni i tetrameri specificati qui, ottimizzazione ha rivelato che possiamo aumentare la diluizione consigliata dal produttore (01:10 consigliato, ottimizzato 01:25) (tabella 1). Per compensare la sovrapposizione spettrale, perline di compensazione può essere utilizzato invece di cellule marcate. Per quanto riguarda la scelta del fluorocromo tetramero-accoppiati, si dovrebbe prevedere di utilizzare fluorocromi brillanti, che facilita la rilevazione - soprattutto quando il segnale è basso. Come Dolton e colleghi29, preferiamo usare tetrameri PE - o APC-accoppiati, che possono essere perfettamente combinati in un'unica colorazione e CD8+ T cellule con una specificità del singolo antigene possono essere ben rilevato (Figura 2). Per quanto riguarda la temperatura e l'incubazione volte, esiste una varietà di tetramero condizioni di colorazione. Nel nostro processo di ottimizzazione, abbiamo affrontato questo problema ed abbiamo effettuato tetramero che macchia a condizioni diverse (ad esempio 4 ° C, temperatura ambiente o 37 ° C). Dai risultati ottenuti, si consiglia a macchiare per 20 min a 37 ° C, che è in concordanza con letteratura30,31. Incubazione prolungata dovrebbe essere evitato, come questo può portare a interiorizzazione dei risultati negativi del tetramero30 e false.
La scelta dell'anticorpo giusto per il rilevamento di CD8+ cellule è un'altra questione importante, che ha attentamente considerati (e potenzialmente adattato). Ciò deriva dal fatto che alcuni cloni dell'anticorpo anti-CD8 blocco associazione di tetrameri di TCR, in umano32 così come mouse33 campioni. Per il nostro tetramero protocollo di colorazione, abbiamo selezionato clone 53 – 6.7 a macchiare per CD8 murino+ cellule — un clone che non blocca, ma piuttosto migliora tetramero macchiatura.
Macchiatura del tetramero è piuttosto semplice quando si analizzano le risposte immunitarie prominente al picco della risposta delle cellule T, ad esempio. Tuttavia, potrebbero esistere delle popolazioni che sono un po' più "problematiche". Questi esempi includono cellule specifiche per antigeni di bassa affinità (tumore, self), recentemente attivato cellule che successivamente giù-regolato loro recettori o sottoinsiemi di cellule rare (ad es.. ingenuo precursore o memoria popolazioni di cellule). In questi casi, il tetramero classico protocollo di colorazione potrebbe essere necessario essere migliorato o combinato con altri metodi. Ad esempio, il proteina chinasi inibitore (PKI) dasatinib inibisce l'interiorizzazione di TCR e potrebbe essere inserito prima della colorazione tetramero. Tetrameri possono essere stabilizzati anche includendo anti-fluorocromo non coniugata Abs primario dopo la macchiatura tetramero. Inoltre, l'intensità di fluorescenza può essere aumentata tramite l'aggiunta di un secondo anti-Ab fluorocromo-coniugate Ab29,34,35,36. Abbiamo ottimizzato le condizioni in modo selettivo per i tetrameri specificati nel presente protocollo e non include PKI o Abs ulteriori. Tuttavia, per qualsiasi altro tetramero, le condizioni ottimali devono essere regolata singolarmente. Per quanto riguarda le popolazioni rare, tetramero colorazione potrebbe essere necessario essere combinati con arricchimento magnetico11.
Per facilitare e convalidare analisi Citofluorimetrica del tetramero macchiatura, controlli positivi e negativi devono essere inclusi. Come controllo negativo, abbiamo sempre macchia le cellule del mouse ingenui dello stesso ceppo con nostro tetramero di interesse. In alternativa, i campioni possono essere macchiati con tetrameri con peptidi irrilevanti, ma con il fluorocromo stesso come il tetramero di interesse. Tali controlli sono essenziali per escludere falsi segnali positivi, ad esempio., che proviene dalle cellule morenti. Oltre a questo, si consiglia di includere una macchia vive/morte, ad esempio ioduro di propidio (PI). Questo è di particolare importanza se le cellule non sono macchiate direttamente dopo l'isolamento. Un'altra strategia per rimuovere autofluorescence sfondo potrebbe essere di includere diversi marcatori di cellule non-T in un canale. Escludendo le cellule positive in questo canale, popolazioni di cellule non-T possono essere escluso. Come controllo positivo, un campione da un mouse di OT-1 può essere utilizzato per tetramero OVA, ad esempio. Per altri tetrameri, questo deve essere scelto individualmente (ad es.., campione da un mouse, che è stato immunizzato più volte). Allo stesso modo gli altri37, osserviamo anche una down-regulation del recettore CD8 durante l'attivazione di CTL al 7 ° giorno della risposta delle cellule T effettrici. Pertanto, per evitare la perdita di cellule T effettrici attivato tetramero+ , si consiglia di includere le cellule CD8basso nell'analisi (almeno se la misurazione nella fase effettrice).
La qualità e la quantità di informazioni che si possono recuperare da questo protocollo dipende dalla conoscenza circa l'antigene da studiare, la disponibilità e la specificità del tetramero e la qualità della macchina FACS (numero di rivelatori disponibili e laser). Se si lavora con campioni animali, variazione nella risposta immunitaria è naturale e inevitabile. Pertanto, per ottenere risultati significativi da tetramero macchiatura, almeno 3-5 animali dovrebbero essere analizzati. Se fatto, il protocollo descritto qui darà risultati affidabili e riproducibili (esemplare risultato da un esperimento può essere trovato nella Tabella supplementare 1). Come accennato prima, questo metodo è perfettamente adatto per quantificare il fenotipo e la specificità dell'antigene di CD8+ T cellule (Figura 3, 4; Supplemental Figura 1), non solo nel topo ma anche negli esseri umani. Tuttavia, per analizzare CD8+ delle cellule T effettrici le funzioni, come la morte delle cellule indotta da granzyme, ICS e/o ELISpot devono essere eseguite. Tuttavia, si dovrebbe tenere a mente che funzioni a cellula T, come misurato dalla stimolazione in vitro potrebbero non rappresentare la reale situazione in vivo. In vivo, un ambiente soppressivo potrebbe impedire le funzioni delle cellule T che vengono misurate in vitro.
Il relativi propri, tetramero macchiatura non fornisce tutte le informazioni, ma si è evoluto per diventare un metodo essenziale per caratterizzare le risposte delle cellule T e quantificare i sottoinsiemi a cellula T in vitro in un modo molto sensibile38. Tetrameri non possono essere utilizzati solo per quantificare determinati sottoinsiemi, ma anche per isolare quelli39, li localizzare l'ibridazione in situ19,20 e studiare gli antigeni di bassa affinità, come tumore-collegati40, 41. dalla scoperta del tetramero tecnologia4, tetramero macchiatura è diventato uno strumento essenziale in analisi a cellula T e la gamma di applicazioni.
Divulgazioni
Dorothee von Laer è un inventore di VSV-GP e detiene quote di minoranza in società biotech ViraTherapeutics GmbH, che detiene i diritti di proprietà intellettuale per VSV-GP. Per gli altri autori, concorrenti interessi finanziari non esistano.
Riconoscimenti
Questo progetto è stato finanziato dal fondo scienza austriaco FWF (numero di progetto P 25499-B13) e concede la ricerca Orizzonte 2020 dell'Unione europea e il programma di innovazione sotto contratto n. 681032. Il reagente seguente è stato ottenuto attraverso la struttura di nucleo del tetramero NIH: classe I MHC tetramero per nucleoproteina del virus di stomatite vescicolare (RGYVYQGL).
Materiali
| Name | Company | Catalog Number | Comments |
| Safety cabinet class 2 | VWR | LBCP302411030 | |
| Flow cytometer (e.g. FACSCanto II) | BD | 338962 | |
| Analysis platform for flow cytometry analysis (e.g. FlowJo) | Fisher Scientific Co. L.L.C. | NC0887833 | |
| Binocular microscopes, VisiScope 100 | VWR | 630-1553 | |
| Vortex mixer | Phoenix Instrument | RS-VA 10 | |
| Centrifuge suitable for FACS tubes (e.g. Rotanta 460R) | Hettich | 5660 | |
| Sterile Scalpel Blades Nr. 10 | Braun | BB510 | |
| Cell strainer 40 µm | Sigma | CLS431750 | |
| Cell strainer 70 µm | Sigma | CLS431751 | |
| Neubauer counting chamber | VWR | 630-1506 | |
| Pipettes (20 μL, 200 µL and 1000 μL) | Eppendorf | 4924000037, 4924000061, 4924000088 | |
| Pipette tips, sterile (20 µL, 200 µL, 1,000 µL) | Biozym | 770050, 770200, 770400 | |
| Pipet Boy | Integra | 155 000 | |
| Sterile pipettes (5 mL, 10 mL, 25 mL) | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Multistep Pipette, HandyStep S | BRAND | 705110 | |
| 12.5 mL Combitips for Multistep Pipette | BrandTech Scientific | 702378 | |
| Microvette CB 300 K2E | Sarstedt | 16.444 | |
| Sterile reaction tubes (1.5 mL, 50 mL) | Sarstedt | 72.692.005, 62.547.254 | |
| FACS tubes (non-sterile) | Szabo Scandic | BDL352008 | |
| PBS | Lonza | LONBE17-516F | |
| Heat-inactivated FCS | ThermoFisher Scientific | 10500064 | |
| Formaldehyde | Roth | 4979.1 | |
| Sodium azide | Roth | K305.1 | |
| PE-Cy7 Rat Anti-Mouse CD3 Molecular Complex | BD | 560591 | Clone 17A2; Lot # 7235504 |
| Pacific Blu Rat Anti-Mouse CD8a | BD | 558106 | Clone 53-6.7; Lot # 5058904 |
| V450 Rat anti-Mouse CD8a | BD | 560469 | Clone 53-6.7; Lot # 5205945 |
| FITC anti-mouse CD43 | BioLegend | 121206 | Clone 1B11; Lot # B233778 |
| PE-Cy5 Rat Anti-Mouse CD44 | BD | 553135 | Clone IM7; Lot # 85660 |
| APC-Cy7 Rat Anti-Mouse CD62L | BD | 560514 | Clone MEL-14; Lot # 7215801 |
| OVA-tetramer/APC | MBL | TB-5001-2 | SIINFEKL, H-2Kb; Lot # T1702008 |
| VSV NP-tetramer/PE | MBL | TS-M529-1 | RGYVYQGL, H-2Kb; Lot # 007 |
| EGFP-tetramer/PE | MBL | TS-M525-1 | HYLSTQSAL, H-2Kd; Lot # 004 |
| LCMV-GP-tetramer/APC | MBL | TB-5002-2 | KAVYNFATC, H-2Db; Lot # T1412006 |
| HPV 16 E7-tetramer/APC | MBL | TB-5008-2 | RAHYNIVTF, H-2Db; Lot # T1804003 |
Riferimenti
- Tober, R., et al. VSV-GP: a potent viral vaccine vector that boosts the immune response upon repeated applications. Journal of virology. 88 (9), 4897-4907 (2014).
- Muik, A., et al. Re-engineering vesicular stomatitis virus to abrogate neurotoxicity, circumvent humoral immunity, and enhance oncolytic potency. Cancer Reseaerch. 74 (13), 3567-3578 (2014).
- Eales, L. J., Farrant, J., Helbert, M., Pinching, A. J. Peripheral blood dendritic cells in persons with AIDS and AIDS related complex: loss of high intensity class II antigen expression and function. Clinical and Experimental Immunology. 71, 423-427 (1988).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- . Tetramers and Monomers Available from: https://www.mblintl.com/products/research/monomer-tetramers/filter/product_type/monomer (2016)
- Wolfl, M., et al. Quantitation of MHC tetramer-positive cells from whole blood: evaluation of a single-platform, six-parameter flow cytometric method. Cytometry A. 57 (2), 120-130 (2004).
- Burrows, S. R., et al. Peptide-MHC class I tetrameric complexes display exquisite ligand specificity. The Journal of Immunology. 165 (11), 6229-6234 (2000).
- Sims, S., Willberg, C., Klenerman, P. MHC-peptide tetramers for the analysis of antigen-specific T cells. Expert Review of Vaccines. 9 (7), 765-774 (2010).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. The Journal of Visualized Experiments. (68), (2012).
- Xie, Y., et al. A novel T cell-based vaccine capable of stimulating long-term functional CTL memory against B16 melanoma via CD40L signaling. Cellular & Molecular Immunology. 10 (1), 72-77 (2013).
- Nanjundappa, R. H., Wang, R., Xie, Y., Umeshappa, C. S., Xiang, J. Novel CD8+ T cell-based vaccine stimulates Gp120-specific CTL responses leading to therapeutic and long-term immunity in transgenic HLA-A2 mice. Vaccine. 30 (24), 3519-3525 (2012).
- Bowers, E. V., Horvath, J. J., Bond, J. E., Cianciolo, G. J., Pizzo, S. V. Antigen delivery by alpha(2)-macroglobulin enhances the cytotoxic T lymphocyte response. Journal of Leukocyte Biology. 86 (2), 1259-1268 (2009).
- Guo, H., Baker, S. F., Martinez-Sobrido, L., Topham, D. J. Induction of CD8 T cell heterologous protection by a single dose of single-cycle infectious influenza virus. The Journal of Immunology. 88 (20), 12006-12016 (2014).
- Sakai, K., et al. Dendritic cell-based immunotherapy targeting Wilms' tumor 1 in patients with recurrent malignant glioma. Journal of Neurosurgery. 123 (4), 989-997 (2015).
- Rosaely, C. G., et al. Immune responses to WT1 in patients with AML or MDS after chemotherapy and allogeneic stem cell transplantation. International Journal of Cancer. 138 (7), 1792-1801 (2016).
- Shane, H. L., Reagin, K. L., Klonowski, K. D. The Respiratory Environment Diverts the Development of Antiviral Memory CD8 T Cells. The Journal of Immunology. , (2018).
- Li, S., Mwakalundwa, G., Skinner, P. J. In Situ MHC-tetramer Staining and Quantitative Analysis to Determine the Location, Abundance, and Phenotype of Antigen-specific CD8 T Cells in Tissues. The Journal of Visualized Experiments. (127), e56130 (2017).
- De Vries, I. J. M., et al. In situ detection of antigen-specific T cells in cryo-sections using MHC class I tetramers after dendritic cell vaccination of melanoma patients. Cancer Immunology Immunotherapy. 56 (10), 1667-1676 (2007).
- Tan, H. X., et al. Induction of vaginal-resident HIV-specific CD8 T cells with mucosal prime-boost immunization. Mucosal Immunology. , (2017).
- Huang, H., et al. CD8(+) T Cell Immune Response in Immunocompetent Mice during Zika Virus Infection. Journal of Virology. 91 (22), (2017).
- Hensel, M. T., et al. Selective Expression of CCR10 and CXCR3 by Circulating Human Herpes Simplex Virus-Specific CD8 T Cells. Journal of Virology. 91 (19), (2017).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21 (1), 15-23 (2001).
- San Jose, E., Borroto, A., Niedergang, F., Alcover, A., Alarcon, B. Triggering the TCR complex causes the downregulation of nonengaged receptors by a signal transduction-dependent mechanism. Immunity. 12 (2), 161-170 (2000).
- Dietrich, J., Hou, X., Wegener, A. M., Geisler, C. CD3 gamma contains a phosphoserine-dependent di-leucine motif involved in down-regulation of the T cell receptor. EMBO Journal. 13 (9), 2156-2166 (1994).
- Schone, D., et al. Immunodominance of Adenovirus-Derived CD8(+) T Cell Epitopes Interferes with the Induction of Transgene-Specific Immunity in Adenovirus-Based Immunization. Journal of Virology. 91 (20), (2017).
- Dolton, G., et al. More tricks with tetramers: a practical guide to staining T cells with peptide–MHC multimers. Immunology. 146 (1), 11-22 (2015).
- Whelan, J. A., et al. Specificity of CTL Interactions with Peptide-MHC Class I Tetrameric Complexes Is Temperature Dependent. The Journal of Immunology. 163 (8), 4342-4348 (1999).
- Wooldridge, L., et al. Tricks with tetramers: how to get the most from multimeric peptide–MHC. Immunology. 126 (2), 147-164 (2009).
- Denkberg, G., Cohen, C. J., Reiter, Y. Critical role for CD8 in binding of MHC tetramers to TCR: CD8 antibodies block specific binding of human tumor-specific MHC-peptide tetramers to TCR. The Journal of Immunology. 167 (1), 270-276 (2001).
- Daniels, M. A., Jameson, S. C. Critical role for CD8 in T cell receptor binding and activation by peptide/major histocompatibility complex multimers. The Journal of Experimental Medicine. 191 (2), 335-346 (2000).
- Tungatt, K., et al. Antibody stabilization of peptide-MHC multimers reveals functional T cells bearing extremely low-affinity TCRs. The Journal of Immunology. 194 (1), 463-474 (2015).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. Journal of Immunological Methods. 340 (1), 11-24 (2009).
- Rius, C., et al. Peptide-MHC Class I Tetramers Can Fail To Detect Relevant Functional T Cell Clonotypes and Underestimate Antigen-Reactive T Cell Populations. The Journal of Immunology. 200 (7), 2263-2279 (2018).
- Xiao, Z., Mescher, M. F., Jameson, S. C. Detuning CD8 T cells: down-regulation of CD8 expression, tetramer binding, and response during CTL activation. The Journal of Experimental Medicine. 204 (11), 2667-2677 (2007).
- McMichael, A. J., O'Callaghan, C. A. A New Look at T Cells. The Journal of Experimental Medicine. 187 (9), 1367-1371 (1998).
- Hunsucker, S. A., et al. Peptide/MHC tetramer-based sorting of CD8(+) T cells to a leukemia antigen yields clonotypes drawn nonspecifically from an underlying restricted repertoire. Cancer Immunology Research. 3 (3), 228-235 (2015).
- Pittet, M. J., et al. Ex vivo analysis of tumor antigen specific CD8+ T cell responses using MHC/peptide tetramers in cancer patients. International Immunopharmacology. 1 (7), 1235-1247 (2001).
- Cohen, C. J., et al. Isolation of neoantigen-specific T cells from tumor and peripheral lymphocytes. The Journal of Clinical Investigation. 125 (10), 3981-3991 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon