Method Article
La Quantification simultanée des anti-vecteur et Anti-transgene-Specific CD8+ T Cells Via MHC I tétramère coloration après une Vaccination avec un vecteur Viral
Dans cet article
Résumé
Nous présentons ici un protocole pour l’ex vivo détection qualitative de l’antigène-spécifiques CD8+ T des cellules. L’analyse est possible grâce à des suspensions de cellules simples d’organes ou de petites quantités de sang. Un large éventail d’études exigent l’analyse des réponses des cellules T cytotoxiques (vaccination et études d’immunothérapie du cancer).
Résumé
Après une infection virale, spécifiques de l’antigène CD8+ les cellules T cytotoxiques (CTL) apparaissent et contribuent à l’élimination des cellules infectées pour prévenir la propagation des agents pathogènes. Par conséquent, la fréquence des CTL spécifiques de l’antigène est révélateur de la force de la réponse des lymphocytes T contre un antigène spécifique. Une telle analyse est importante en immunologie fondamentale, le développement de vaccins, immunobiologie de cancer et l’immunologie adaptative. Dans le domaine du vaccin, la réponse CTL dirigée contre les composantes d’un vecteur viral détermine conjointement est quelle est l’efficacité de la génération de cellules antigène-spécifiques contre l’antigène d’intérêt (p. ex. transgène de, ). CTL spécifiques de l’antigène peuvent soit être détectées par stimulation avec des peptides spécifiques suivies des cytokines intracellulaires coloration soit la coloration directe des récepteurs spécifiques de l’antigène des lymphocytes T (TCR) et l’analyse par cytométrie en flux. La première méthode est plutôt fastidieux car il faut sacrifier des animaux à isoler les cellules des organes. Elle exige aussi, isolement du sang de petits animaux qui est difficile à réaliser. Cette dernière méthode est assez rapide, peut être facilement faite avec de petites quantités de sang et ne dépend pas des fonctions effectrices spécifiques, tels que l’activité cytolytique. Les tétramères MHC sont un outil idéal pour détecter l’antigène-spécifiques TCRs.
Nous décrivons ici un protocole visant à détecter simultanément CTL pour les peptides immunodominante du vecteur viral VSV-GP (CML-GP, VSV-NP) spécifiques de l’antigène et les transgènes (ovules, HPV 16 E7, eGFP) par MHC I tétramère souillure et écoulement cytometry. La coloration est possible directement à partir de sang ou de suspensions cellulaires unique d’organes comme la rate. Sang ou des suspensions de cellules simples des organes sont incubées avec tétramères. Après le marquage avec l’anticorps anti-CD3 et CD8, CTL spécifiques de l’antigène sont quantifiés par cytométrie en flux. Éventuellement, anticorps contre CD43, CD44, CD62L ou d’autres peuvent être inclus afin de déterminer l’état d’activation d’antigène-spécifiques CD8+T les cellules et d’établir une distinction entre les cellules naïves et effectrices.
Introduction
Le but de cette méthode consiste à évaluer la fréquence des réponses des lymphocytes T cytotoxiques (CTL) aux antigènes (multiples) chez la souris par cytométrie sans besoin de stimulation du peptide chronophage. Cette méthode analyse la spécificité phénotype et antigène de sous-ensembles CTL, une coloration unique. Nous avons optimisé le complexe majeur d’histocompatibilité j’ai (MHC I) tétramère souillant le protocole afin d’analyser l’efficacité de nouvelles approches de vaccins, tels que VSV-GP, une nouvelle variante du virus de la stomatite vésiculaire (VSV), où la glycoprotéine G de VSV a été remplacée par la glycoprotéine GP de la chorioméningite lymphocytaire virus (CML)1,2. En plus de la réponse humorale, une lecture importante de l’efficacité d’un vaccin est l’induction d’une réponse CTL contre un ou plusieurs antigènes. La cohérence et la durabilité de la réponse cellulaire sont importantes dans ce contexte, il est favorable pour suivre la cinétique des réponses CTL du même animal. Cela conduira aussi à une réduction du nombre d’animaux, un aspect important concernant les principes des « 3R »3. Analyse à partir d’aussi peu que 20 µL de sang est donc optimale à cet effet.
Tétramères ont été développés dans les dernières années 904 et est devenu un outil important dans le domaine de l’immunologie des lymphocytes T. Tétramères sont complexes fluorescent marqué du CMH quatre j’ai / molécules peptidiques, qui se lient à TCRs, spécifiques pour un seul peptide. De nos jours, ils peuvent être soit achetés prêts à l’emploi5, commandé gratuitement l’installation de base de tétramère NIH à Emory University6 ou produits dans le laboratoire7. MHC I et tétramères II sont disponibles, , c'est-à-dire pour CD8+ et CD4+ T cellules, respectivement. La puissance de coloration tétramère réside dans économie de temps, plutôt simple et facile standardiser les protocoles8 et9de la sensibilité. Aussi, si vous travaillez avec du sang, les animaux n’avez pas besoin d’être sacrifié, et des quantités minimes d’échantillon sont nécessaires. Une mesure n’est pas limitée à un seul antigène, mais plusieurs antigènes peuvent être analysées en une coloration en combinant des tétramères conjugué avec des fluorophores différents. Les antigènes nouvellement découverts, par exemple des écrans de peptide, facilement peuvent être incorporés dans les tétramères et utilisés pour la quantification du sous-ensemble des lymphocytes T.
Tétramère coloration ne donnera pas les informations sur les fonctionnalités CTL (i.e., la production de cytokines, fonctions effectrices), mais seulement de spécificité. Pour obtenir des informations sur les fonctionnalités de cellules T, cytokine intracellulaire (ICS) de coloration ou Enzyme Linked Immuno Spot (ELISpot) dosage il faut accompli8,10. Tétramère coloration et ICS/ELISpot, cependant, ne sont pas redondants mais plutôt complètent mutuellement. La stimulation in vitro pour induire la production de cytokines pour ICS/ELISpot modifiera le phénotype de cellules T original. Tétramère de coloration, en revanche, ne modifie en rien les lymphocytes T ; le phénotype d’origine est conservé et peut être analysé. En outre, un autre grand avantage des tétramères est que la coloration peut être combinée avec Tri magnétique et l’enrichissement des cellules spécifiques de l’antigène11. Cela permet l’analyse des populations rares, ainsi que mise en culture des cellules triées avec antigène-spécificités définies — une fonctionnalité qui est impossible avec d’autres méthodes.
En utilisant le protocole décrit ici, tétramère coloration, ainsi que ICS/ELISpot peut être effectuée d’un organe, parce que seulement très peu de matériel (sang : 20 µL ; rate : 1 x 106 cellules) est requis pour la coloration du tétramère. Toutefois, selon la fréquence des cellules antigène-spécifiques d’intérêt, la force de la TCR respectif et le contexte expérimental, la quantité de cellules nécessaires devrez peut-être être transposés ou enrichissement magnétique peut doivent être appliquées.
Tétramères sont largement utilisés, par exemple pour évaluer l’effectivité des vaccins (antitumorale)12,13,14,15 ou immunothérapie16,17, analyse phénotypique et spatiale localisation des lymphocytes T spécifiques de l’antigène sous-ensembles18,19,20,21,22,23. La méthode décrite ici est adaptée pour des études qui visent à inclure la quantification et l’analyse phénotypique des murins spécifiques de l’antigène CD8+ T cells dans leur analyse de façon rapide et pratique.
Protocole
Toutes les méthodes décrites ont été réalisées dans le respect de la loi autrichienne de Animal d’expérimentation nationale (« Tierversuchsgesetz »), et animaux du procès permission a été accordée par les autorités nationales autrichiennes.
1. tampon préparation et collecte de l’échantillon
Remarque : La souche de souris utilisée dépend de l’épitope analysé. Choisissez un tétramère approprié qui se lie à un type de MHC exprimé chez les souris, par exemple, H - 2Kb chez les souris C57BL/6. Le sexe et l’âge des animaux dépendra de la question scientifique. Pour la plupart des expériences décrites ici, utiliser les souris femelles à l’âge de 6 à 8 semaines au début de l’expérience, c'est-à-dire, première vaccination.
- Préparer un tampon FACS (solution saline tamponnée au Phosphate (PBS) + sérum de veau foetal de 1 % (FCS) + 0,1 % d’azide de sodium + l’acide éthylènediaminetétraacétique (EDTA) de 2 mM et tampon de fixation FACS (formaldéhyde de 1,5 % (v/v) dans du PBS).
Remarque : Il est recommandé que les deux tampons sont préparés à l’avance. Conservées à 4 ° C jusqu'à l’utilisation. - Sang : Collecter 20 µL de sang par la souris de la veine de la queue de la souris dans les tubes revêtus d’EDTA, comme décrit plus haut24.
Remarque : Le sang peut également être recueilli par d’autres voies, par exemple,, vena facial ou sinus rétro-orbitaire. Toutefois, la méthode de prélèvement de sang doit être en conformité avec le droit national de l’expérimentation animale et les demandes d’essais animaux. Collecte de sang de la veine caudale est idéal pour les études où à plusieurs reprises de petites quantités de sang sont nécessaires. Matériel supplémentaire est requis pour les commandes de compensation et le contrôle non teinté. - Rate : Isoler l’orgue et, avec l’aide du piston d’une seringue, appuyez sur à un 70 nm et crépine de cellule de 40 µm. Effectuer la lyse des érythrocytes, tel que décrit à l’étape 6 et comte. Ajuster la concentration à 1 x 107 cellules/mL dans du PBS. Par exemple, 1 x 106 cellules sont nécessaires.
Remarque : Toujours inclure certains faux immunisés ou vecteur immunisé animaux de témoins comme contrôle négatif. Pour l’ovalbumine (OVA)-tétramère, un échantillon provenant d’OT-1 souris peut être utilisée comme témoin positif. N’oubliez pas non colorés et des commandes de compensation dans le calcul. Si nécessaire, échantillons de différents animaux dans l’expérience pourraient être regroupés pour cela. - Après prélèvement, directement procéder à la coloration.
2. mise en place de coloration
- Préparer un tube de FACS pour chaque échantillon. Identifier correctement les tubes et transférer 100 μl de la suspension de l’orgue (1 x 106 cellules) ou 20 μL de sang dans chaque tube.
- Spleen : Centrifuger pendant 5 min à 600 g à 4 – 8 ° C et éliminer le surnageant. Vortex pour remettre en suspension le culot cellulaire.
Remarque : Cela se traduira par un volume de près de 20 µL, similaires en volume pour les échantillons de sang. - Pour chaque canal à utiliser également préparer un tube de FACS pour un échantillon de compensation. Préparer un échantillon supplémentaire un témoin non souillé.
3. tétramère coloration
-
Pour chaque échantillon, utilisez 50 μL de dilution tétramère. Pour tétramères suggérés et optimisée des dilutions, reportez-vous au tableau 1.
Remarque : Lorsque vous travaillez avec des anticorps ou des tétramères, éteindre la lumière de la sécurité du cabinet et protéger les échantillons de la lumière.- Préparer un tube avec du tampon de FACS (volume = 50 μL × nombre d’échantillons plus la majoration de 10 % du volume total pour compenser les erreurs de pipetage).
- Ajouter tetramer(s) à une dilution optimale, comme indiqué au tableau 1. Vortex la solution.
Remarque : Lorsque vous utilisez le panneau entier anticorps (CD3, CD8, CD43, CD44, CD62L) avec des fluorophores énumérées, deux tétramères (en PE et APC) peuvent être inclus. Les deux tétramères peuvent être combinés dans une coloration unique, c'est-à-dire, , coloration des cellules avec les deux tétramères peut être effectuée simultanément.
| Tétramère | Séquence peptidique | Allèle | Fluorophore | Dilution |
| MHC I / OVULES | SIINFEKL | H - 2Kb | APC | 01:25 |
| MHC I/VSV-NP | RGYVYQGL | H - 2Kb | PE | 01:25 |
| MHC I / EGFP | HYLSTQSAL | H-2Kd | PE | 01:25 |
| MHC I/CML-GP | KAVYNFATC | H-2Db | APC | 01:25 |
| MHC I / HPV 16 E7 | RAHYNIVTF | H-2Db | APC | 01:10 |
Tableau 1 : a suggéré des tétramères et dilutions optimales. Tétramères recommandées pour certains peptides immunodominante du modèle antigènes (ovalbumine (OVA) et la protéine fluorescente verte améliorée (eGFP)) ou des composants de l’agent pathogène (stomatite vésiculaire (VSV) de virus nucléoprotéine (NP), Virus de chorioméningite lymphocytaire (CML Glycoprotéine) (GP) et l’oncoprotéine E7 de virus du papillome humain (VPH) (E7)). Pour chaque séquence peptidique et l’allèle correspondant, ainsi comme l’a recommandé un fluorophore et dilution optimisée est répertorié.
- Ajouter 50 μL de dilution tétramère de chaque échantillon et vortex doucement. Ajouter FACS tampon uniquement (sans le tétramère) aux contrôles de l’indemnisation et à l’échantillon non coloré.
- Incuber les échantillons pendant 20 min à 37 ° C, abri de la lumière. Afin d’assurer une transition en douceur à anticorps coloration du tétramère, préparer le mélange d’anticorps comme décrit à l’étape 4 au cours de la période d’incubation.
Remarque : Pour chaque tétramère individuel, des conditions optimales (dilution, temps d’incubation et température) doivent être ajustés.
4. préparation des anticorps
-
Pour chaque échantillon, préparer 50 µL du mélange de l’anticorps.
- Préparer un tube avec du tampon de FACS (volume = 50 μL × nombre d’échantillons plus la majoration de 10 % du volume total de compenser des erreurs de pipetage).
- Ajouter les anticorps dans les dilutions figurant au tableau 2.
Remarque : Selon la question scientifique, d’autres combinaisons de marqueur en dehors de celle décrite ici peuvent être utilisés. Assurez-vous de toujours inclure des anticorps anti-CD3 et CD8 dans le panneau. - Vortex la solution.
| Anticorps | Fluorophore | Dilution | µg/échantillon | Marqueur |
| CD3 | PE-Cy7 | 1 : 200 | 0.05 | CTL (CD3+CD8+) |
| CD8 | Bleu Pacifique | 1:750 | 0,013 | |
| V450 | 1/100 | 0,1 | ||
| CD43 | FITC | 1/100 | 0.25 | Activation (CD43+) |
| CD44 | PE-Cy5 | 1/250 | 0,04 | Naive (CD44–CD62L+) & effecteur (CD44+CD62L–) |
| CD62L | APC-Cy7 | 1/500 | 0,02 |
Tableau 2 : anticorps utilisés dans le présent protocole et les dilutions optimales. Marqueurs de surface recommandées (CD3, CD8, CD43, CD44 et CD62L) figurent dans la première colonne. Pour chacun, le fluorophore recommandé, la dilution optimisée et la quantité d’anticorps/échantillon sont répertoriés. Dans la dernière colonne, le type de cellule identifié avec chaque marqueur est spécifié.
-
Préparer des anticorps pour les contrôles de l’indemnisation. Pour chaque commande de compensation, utilisez un anticorps contre CD8 dans la couleur respective.
- Pour chaque canal, préparer un tube avec 200 μL de tampon de FACS et ajouter 1 μL d’un anticorps de dilution de 1 : 200 contre CD8 dans la couleur respective.
- Vortex les tubes.
- Procéder immédiatement à la coloration.
5. coloration des échantillons
- Laver une fois les échantillons en ajoutant environ 1 mL de tampon de FACS et centrifuger pendant 5 min à 600 x g 4 – 8 ° c. Après centrifugation, éliminer le surnageant et égoutter restants sur une pile de serviettes en papier.
Remarque : Lorsque vous travaillez avec du sang, faire preuve de prudence lors de la vidange liquide restant. Avant la lyse des érythrocytes, sang ne collera pas au fond du tube FACS. Vous pouvez également aspirer le surnageant. - Ajouter 50 μL de la combinaison de l’anticorps à chaque culot cellulaire et vortex doucement.
- Ajouter 50 μL de chaque mélange de compensation pour le culot de la commande de compensation correspondante et vortex doucement.
- Ajouter 50 μL de tampon de FACS au culot cellulaire du contrôle non coloré et vortex doucement.
- Incuber les échantillons pendant 30 min à 4 ° C, abri de la lumière.
- Lorsque vous travaillez avec des organes : Sautez l’étape 6. Laver une fois en ajoutant environ 1 à 2 mL de tampon de FACS et centrifuger pendant 5 min à 600 x g 4 – 8 ° c. Après centrifugation, éliminer le surnageant et égoutter restants sur une pile de serviettes en papier.
- Lorsque vous travaillez avec du sang : passez à l’étape 6 (lyse des érythrocytes).
6. la lyse des érythrocytes
- Ajouter 500 μl de tampon ACK (chlorure d’Ammonium-Potassium)25 pour chaque échantillon et doucement le vortex.
Remarque : Tampon ACK entraînera un gonflement osmotique et lyse, plus précisément des érythrocytes. - Incuber 5 min à température ambiante dans l’obscurité.
- Ajouter 1 mL de tampon de FACS et centrifuger pendant 5 min à 600 x g 4 – 8 ° c. Après centrifugation, éliminer le surnageant et évacuer le liquide restant sur une pile de serviettes en papier.
Remarque : Lorsque le culot est plutôt rouge, répétez la lyse des érythrocytes. - Laver une fois en ajoutant environ 1 à 2 mL FACS de tampon et centrifuger pendant 5 min à 600 x g 4 – 8 ° c. Après centrifugation, éliminer le surnageant et égoutter restants sur une pile de serviettes en papier.
7. flux analyse et mesure de la cytométrie en flux
- Ajouter 150 – 300 μL de tampon de fixation FACS dans chaque tube et mélanger au vortex. Pour 20 µL de sang, 150 µL de tampon est suffisante.
Remarque : Avant la fixation, assurez-vous que les cellules sont bien remises en suspension afin d’éviter la formation de touffes. Procéder à la mesure de débit par cytométrie en flux aussi rapidement que possible. - Mesurer les commandes de compensation et de corriger tout chevauchement spectrale.
-
Mis en place des portes séquentielles, comme illustré à la Figure 1 pour sélectionner pour CD3+/CD8+ cellules.
- Porte sur les lymphocytes à l’aide de nuages de points avant et latéralement (région) (échelle non logarithmique).
- Au sein de la population lymphocytaire, porte sur des cellules individuelles à l’aide des nuages de points avant largeur vs zone (échelle non logarithmique).
- Tracer les lymphocytes cellule unique à l’aide de chaînes CD3 et CD8 (échelle logarithmique). Identifier les CD8+ T cells de blocage sur le CD3+/CD8+ cellules.
- Tracer des CD8+ vs tétramère+ cellules et porte sur CD8+ + de tétramère de cellules, comme illustré à la Figure 2.
- Si possible, enregistrer 20 000 cellules (au moins 5 000 cellules de sang) dans le CD3+/CD8+ porte pour chaque échantillon et enregistrer dans un fichier de FCS.
Remarque : La quantité de cellules pour enregistrer peut devoir être ajustée selon la fréquence des cellules spécifiques de l’antigène d’intérêt. - Analyser les fichiers FCS avec logiciel d’analyse appropriée. Utilisez la stratégie de blocage, comme décrit ci-dessus (section 7.3) et de quantifier les CD8+ + de tétramère cellules.
Résultats
La figure 1 montre comment la porte correctement sur les cellules cibles du présent protocole, à savoir CD3+/CD8+ cellules. Il est à noter qu’activé cellules souvent régulent la T cell receptor26,27 et, par conséquent, lesfaibles cellules CD3 devraient également figurer dans le processus de blocage. Après déclenchement le CD3+/CD8+ cellules, tétramère positive de cellules peuvent être identifiés (Figure 2). Représentant efface pour une souris de contrôle négatif (naïve), ainsi que les animaux soit vacciné avec un adénovirus sécrétant des ovules 5 (adéno-OVA) ou exprimant l’OVA VSV-GP (VSV-GP-OVA) sont indiquées. Comme on le voit dans les taches plus bas deux différentes tétramères peuvent être combinés dans le même tube pour la coloration. Cela permet la quantification simultanée de deux différentes spécificités CTL : spécifiques du virus (VSV N) et CTL spécifiques transgène (OVA). Nous avons confirmé que simples et doubles tétramère salissures donnent des pourcentages semblables des cellules positives pour chaque tétramère. Utilisant ce protocole, autres virus spécifiques (par exemple., LCMV GP, HPV 16 E7) ou transgène spécifiques (par ex.., GFP) T cell populations peuvent être analysés (la Figure 1). Dans la Table 1, figurent les résultats pour cinq animaux après la vaccination avec VSV-GP-OVA — indiquant la robustesse du tétramère de coloration.
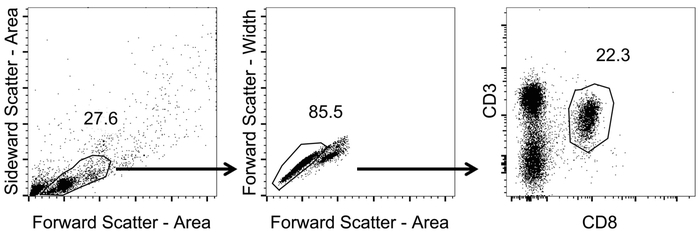
Figure 1 : Représentant gating stratégie afin d’analyser les CD8+ T des cellules dans le sang. Représentation schématique de la stratégie de blocage utilisée pour l’analyse en cytométrie en flux. Après mesure de tétramère de coloration et de débit par cytométrie en flux, les données ont été analysées. Les lymphocytes ont été identifiés avec les nuages de points avant et latéralement (région) (échelle non logarithmique). De celles, cellules individuelles ont été identifiés en appliquant la zone de dispersion avant largeur vs (échelle non logarithmique). CD8+ T les cellules ont été identifiés par le blocage sur le CD3+/CD8+ cellules (échelle logarithmique). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
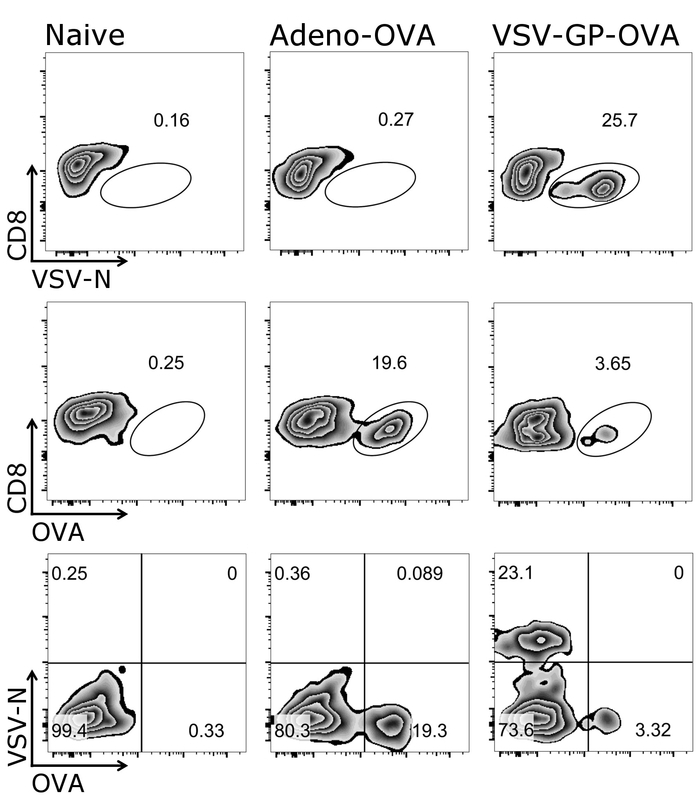
Figure 2 : Représentant gating stratégie pour quantifier les ovules - et N-specific CD8+ T des cellules dans le sang. Représentation schématique de la stratégie de blocage utilisée pour la quantification de cytométrie en flux des cellules tétramère+ . CD3+/CD8+ des cellules sont utilisées pour l’analyse de tétramère. Panneau supérieur et moyen : le marqueur CD8 a comploté contre tétramère respectif (échelle logarithmique). Panneau inférieur : les deux tétramères ont été tracées contre l’autre (échelle logarithmique). Gauche : souris de contrôle (naïve) ; milieu : souris a été immunisée avec l’adénovirus sécrétant des ovules 5 (adéno-OVA) ; droite : souris a été immunisée avec l’ovalbumine (OVA)-exprimant la VSV-GP (VSV-GP-OVA). Sang a été prélevé d’une veine caudale au 7e jour après la vaccination. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
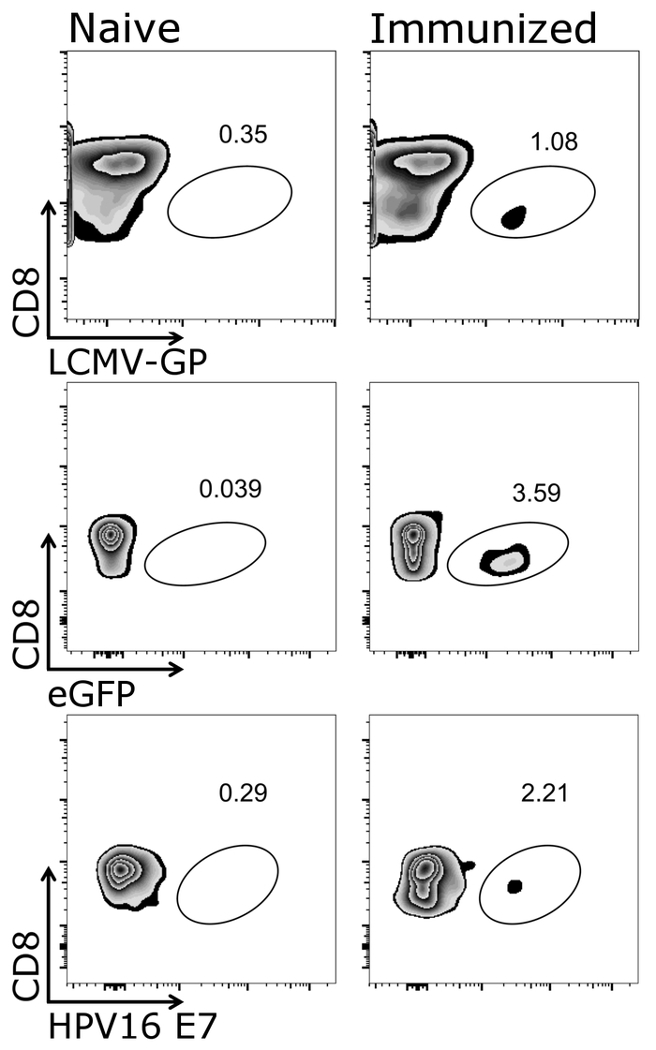
Supplemental Figure 1 : Résultat représentatif du CD3+/CD8+ cellules tétramère+ après la vaccination. Représentation schématique de la quantification de cytométrie en flux des cellules tétramère+ . CD3+/CD8+ des cellules sont utilisées pour l’analyse des tétramères et le marqueur CD8 a comploté contre tétramère respectif (échelle logarithmique). Gauche : souris étaient naïfs, droite : souris ont été immunisés avec VSV-GP (du haut), enhanced Green Fluorescent Protein (eGFP)-exprimant la VSV-GP (panneau central) ou VSV-GP exprimant l’oncoprotéine E7 de virus du papillome humain (VPH) (E7) (panneau inférieur). Le sang a été prélevé de la veine caudale au 7e jour après la vaccination et tachée de tétramères (CML-GP, eGFP et VPH E7). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Un gros avantage du protocole décrit ici est que les lymphocytes T de la souris même peuvent être suivis au fil du temps que seules de petites quantités de sang sont nécessaires pour chaque mesure. La figure 3 illustre les résultats exemplaires pour les lymphocytes T au fil du temps. En plus de la quantité d’antigène-spécifiques CTL, leur phénotype peut également être analysé utilisant ce protocole (Figure 4).
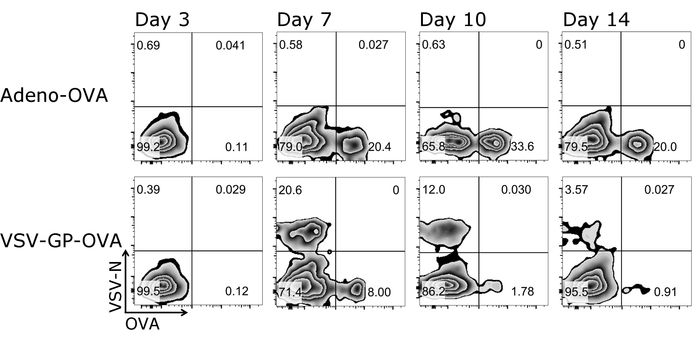
Figure 3 : Résultat représentatif de CD8+ T cell cinétique dans le sang après la vaccination. Représentation schématique de la stratégie de blocage utilisée pour la quantification de cytométrie en flux des cellules tétramère+ . CD3+/CD8+ des cellules sont utilisées pour l’analyse des tétramères et deux tétramères ont été tracées contre l’autre (échelle logarithmique). Panneaux supérieurs : souris a été immunisée avec l’adénovirus sécrétant des ovules 5 (adéno-OVA) ; abaisser les panneaux : la souris a été immunisée avec l’ovalbumine (OVA)-exprimant la VSV-GP (VSV-GP-OVA). Sang a été prélevé d’une veine caudale au jour 3, 7, 10 et 14 après la vaccination. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
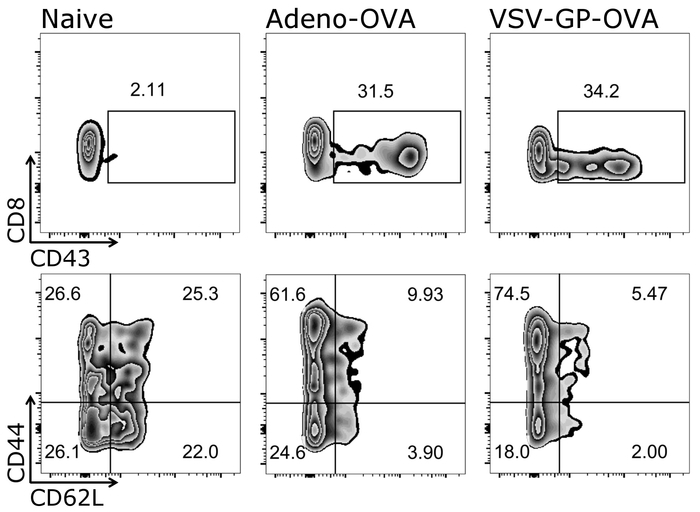
Figure 4 : Résultat représentatif de CD8+ T cell activation et différenciation en cellules naïves et effectrices après la vaccination. Représentation schématique de la stratégie de blocage utilisée pour quantifier les flux par cytométrie en flux activé (CD43+), naïf (CD44–/CD62L+) et effectrices (CD44+/CD62L–) CD3+/CD8+ cellules () échelle logarithmique). Gauche : souris de contrôle (naïve) ; milieu : souris a été immunisée avec l’adénovirus sécrétant des ovules 5 (adéno-OVA) ; droite : souris a été immunisée avec l’ovalbumine (OVA)-exprimant la VSV-GP (VSV-GP-OVA). Sang a été prélevé d’une veine caudale au 7e jour après la vaccination. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| # La souris | CD43 %+ | Tétramère de VSV-N %+ | Tétramère d’ovules %+ | |
| Mock | 1 | 1.7 | 0,45 | 0,41 |
| 2 | 0,77 | 0,69 | 0,15 | |
| 3 | 1.34 | 0,35 | 0,31 | |
| 4 | 1,68 | 0,83 | 0,26 | |
| 5 | 0,84 | 0,47 | 0,23 | |
| VSV-GP-OVA | 1 | 23 | 13.2 | 3.69 |
| 2 | 32,6 | 15,9 | 3.54 | |
| 3 | 22.1 | 11,7 | 2.43 | |
| 4 | 15.1 | 8.89 | 1,79 | |
| 5 | 29.1 | 14,7 | 5.64 |
Supplémentaire tableau 1 : Pourcentages d’activés et spécifique de l’antigène CD3+/CD8+ cellules après la vaccination. Souris ont été soit naïf ou immunisées avec l’ovalbumine (OVA)-exprimant la VSV-GP (VSV-GP-OVA) (n = 5). Le sang a été prélevé de la veine caudale au 7e jour après la vaccination et tachée de tétramères (VSV-N et ovules). Activé (CD43+) et (tétramère+) spécifiques de l’antigène CD3+/CD8+ cellules ont été quantifiés par cytométrie en flux.
Discussion
Tétramère de coloration est un protocole assez simple et peu compliqué à analyser la spécificité de phénotype et peptide d’un lymphocyte T. L’utilisation du sang pour l’analyse, comme décrit ici, est peu invasive et permet une surveillance continue, par exemple dans les études de la vaccination. Dans le domaine de la vaccination, la quantification des réponses de vecteur et antigène-spécifique est d’intérêt, comme vecteur des réponses risquent d’entraver une réponse immunitaire efficace contre le vaccin antigène28. Il est à noter qu’avec le protocole décrit ici, les deux populations peuvent être quantifiées en même temps une coloration unique tétramère, réduisant ainsi la coloration de la variabilité et les montants de l’échantillon. Cependant, quelques étapes doivent s’effectuer avec précaution afin d’assurer des données fiables et mesure correcte. Si en utilisant le sang de la veine caudale pour l’analyse, on doit Assurez-vous qu’afin de préchauffer les animaux pour provoquer une vasodilatation24. Ainsi, suffisamment de sang peut être collecté en peu de temps, réduire le stress sur les animaux et l’analyse est beaucoup mieux, par rapport à si le sang est prélevé lentement. En outre, après le prélèvement de l’échantillon (sanguin ou organes), coloration directe est recommandée afin d’éviter les résultats faussement négatifs en raison de la diminution TCR. Il en va de même pour toutes les étapes suivantes : la procédure ne doit pas être interrompue et toutes les étapes de lavage réduit au nombre minimal (comme indiqué dans le protocole). Afin d’assurer la bonne coloration, il faut à vortex toutes les solutions et les échantillons avant et après incubation. Ceci est particulièrement important avant de fixer les échantillons afin d’éviter l’agglutination des cellules.
En ce qui concerne la modification du protocole, autres marqueurs de surface et des tétramères peuvent être utilisés, selon l’objectif de l’analyse. Cependant, tous les réactifs doivent ensuite être titré, optimale en combinaison avec l’ensemble panneau de coloration. Pour certains les tétramères spécifiés à cet emplacement, optimisation révèle que nous pouvons augmenter la dilution recommandée par le fabricant (01:10 recommandé, optimisé à 01:25) (tableau 1). Pour compenser le recouvrement spectral, perles de compensation peuvent être utilisés au lieu de cellules colorées. Quant au choix du fluorochrome tétramère couplés, on devrait envisager pour utiliser des fluorochromes lumineux, car cela facilite la détection - surtout quand le signal est faible. 29Dolton et collègues, nous préférons utiliser des tétramères PE ou APC-couplés, qui peuvent être parfaitement combinés dans une coloration unique et CD8+ T cellules avec une spécificité de l’antigène unique peuvent être très bien détecté (Figure 2). Au sujet des délais d’incubation et de température, il existe une variété de tétramère coloration des conditions. Dans notre processus d’optimisation, nous avons abordé cette question et jouée tétramère à des conditions différentes (4 ° C, température ambiante ou 37 ° C). Partir des résultats obtenus, nous vous recommandons de colorer pendant 20 min à 37 ° C, ce qui est en concordance avec la littérature30,31. Incubation prolongée doit être évitée car cela peut conduire à l’internalisation du tétramère30 et faux résultats négatifs.
Le choix de l’anticorps de droite pour la détection des CD8+ cellules est une autre question importante, qui doit mûrement réfléchi (et potentiellement adapté). Cela procède du fait que certain anticorps anti-CD8 clones liaison bloc de tétramères pour le RCT, en homme32 ainsi que des souris33 échantillons. Pour notre tétramère souillant le protocole, nous avons choisi clone 53 – 6,7 sur la tache pour murine CD8+ cellules — un clone qui ne bloque pas, mais plutôt améliore la coloration tétramère.
Tétramère de coloration est plutôt simple, lors de l’analyse des réponses immunitaires à l’apogée de la réponse des lymphocytes T, par exemple. Toutefois, il pourrait y avoir des populations qui sont un peu plus « problématiques ». Ces exemples incluent des cellules spécifiques d’antigènes de faible affinité (tumeur, self), récemment activé cellules qui diminuées par la suite leurs récepteurs ou les sous-ensembles de cellules rares (naïve par exemple. précurseur ou mémoire populations de cellules). Dans ces cas, le tétramère classique souillant le protocole devrez peut-être être améliorés ou combiné avec d’autres méthodes. Par exemple, la protéine kinase inhibiteur (ICP) dasatinib inhibe l’internalisation de TCR et peut-être être introduite avant la coloration du tétramère. Tétramères peuvent également être stabilisées en incluant Abs primaire non-conjugué anti-fluorochrome après coloration tétramère. En outre, intensité de la fluorescence peut être augmentée par l’addition d’un deuxième anti-Ab fluorochrome-conjuguées Ab29,34,35,36. Nous avons optimisé les conditions sélectivement les tétramères précisés dans le présent protocole et ne comportait pas de PKI ou Abs supplémentaires. Cependant, pour n’importe quel autre tétramère, les conditions optimales doivent être ajustés individuellement. En ce qui concerne les populations rares, tétramère coloration devrez peut-être être combiné avec enrichissement magnétique11.
Pour faciliter et valider FACS analyse du tétramère coloration, témoins négatifs et positifs devraient être inclus. Comme témoin négatif, nous toujours tacher les cellules de souris naïves de la même souche avec notre tétramère d’intérêt. Par ailleurs, des échantillons peuvent être colorés avec tétramères peptides non pertinentes, mais avec le même fluorochrome comme le tétramère d’intérêt. Ces contrôles sont essentiels afin d’exclure des signaux positifs fausses, par exemple., provenant de cellules mourantes. En outre, il est recommandé d’inclure une tache de vivre/morts, comme l’iodure de propidium (PI). Ceci est particulièrement important si les cellules ne sont pas souillées directement après l’isolement. Une autre stratégie pour supprimer autofluorescence fond pourrait consister à inclure plusieurs marqueurs de cellules non T dans un canal. En excluant les cellules positives dans ce canal, les populations non cellules T peuvent être exclues. Comme témoin positif, un échantillon d’une souris d’OT-1 peut être utilisé pour tétramère d’ovules, par exemple. Pour autres tétramères, cela doit être choisie individuellement (par exemple., l’échantillon d’une souris, ce qui a été vaccinée plusieurs fois). Comme d’autres37, nous observons également une régulation négative des récepteurs CD8 durant l’activation de CTL au 7e jour de l’effecteur réponse des lymphocytes T. Par conséquent, pour éviter la perte de cellules effectrices T activés tétramère+ , nous vous recommandons d’inclure les cellulesfaibles CD8 dans l’analyse (du moins si la mesure dans la phase effectrice).
La qualité et la quantité d’informations on peut récupérer de ce protocole est tributaire de la connaissance au sujet de l’antigène à étudier, la disponibilité et la spécificité du tétramère et la qualité de la machine de FACS (nombre de lasers et détecteurs disponibles). Si vous travaillez avec des échantillons de l’animales, la variation de la réponse immunitaire est naturelle et inévitable. Par conséquent, pour obtenir des résultats significatifs du tétramère coloration, au moins 3 à 5 animaux devrait être analysés. Si fait, le protocole décrit ici donnera des résultats fiables et reproductibles (exemplaire résultent d’une expérience se trouvent dans le Tableau complémentaire 1). Comme mentionné précédemment, cette méthode est parfaitement adaptée pour quantifier le phénotype et la spécificité de l’antigène de CD8+ T cells (Figure 3, 4 ; La Figure 1), non seulement chez la souris mais aussi chez les humains. Toutefois, afin d’analyser les CD8+ des lymphocytes T effecteurs les fonctions telles que la mort cellulaire induite par le granzyme, ICS et/ou ELISpot doivent être exécutées. Toutefois, il convient de garder à l’esprit que les fonctions des cellules de T, tel que mesuré par stimulation in vitro pourraient constituer pas la situation in vivo. In vivo, un environnement suppressif pourrait empêcher les fonctions des lymphocytes T qui sont mesurées in vitro.
Sur ses propres, tétramère coloration ne fournit pas toutes les informations, mais il a évolué pour devenir une méthode essentielle pour caractériser des lymphocytes T et quantifier des sous-ensembles de cellules T in vitro d’une manière très sensible38. Tétramères ne peuvent seulement être utilisés pour quantifier certains sous-ensembles, mais aussi pour isoler ces39, de les localiser en hybridation in situ19,20 et d’étudier des antigènes de faible affinité, comme associé aux tumeurs40, 41. depuis la découverte du tétramère technologie4, tétramère de coloration est devenu un outil essentiel dans l’analyse de cellules T et la gamme d’applications.
Déclarations de divulgation
Dorothee von Laer est un inventeur de VSV-GP et minorité parts dans la société de biotechnologie ViraTherapeutics GmbH, qui détient les droits de propriété intellectuelle de VSV-GP. Pour les autres auteurs, sans intérêts financiers concurrents existent.
Remerciements
Ce projet a été financé par le Fonds de Science autrichienne FWF (numéro de projet P 25499-B13) et de l’Union européenne Horizon 2020 programme de recherche et l’innovation sous accordent le contrat no 681032. Le réactif suivant a été obtenu par le biais de la NIH tétramère Core Facility : classe I MHC tétramère de nucléoprotéine de virus de la stomatite vésiculeuse (RGYVYQGL).
matériels
| Name | Company | Catalog Number | Comments |
| Safety cabinet class 2 | VWR | LBCP302411030 | |
| Flow cytometer (e.g. FACSCanto II) | BD | 338962 | |
| Analysis platform for flow cytometry analysis (e.g. FlowJo) | Fisher Scientific Co. L.L.C. | NC0887833 | |
| Binocular microscopes, VisiScope 100 | VWR | 630-1553 | |
| Vortex mixer | Phoenix Instrument | RS-VA 10 | |
| Centrifuge suitable for FACS tubes (e.g. Rotanta 460R) | Hettich | 5660 | |
| Sterile Scalpel Blades Nr. 10 | Braun | BB510 | |
| Cell strainer 40 µm | Sigma | CLS431750 | |
| Cell strainer 70 µm | Sigma | CLS431751 | |
| Neubauer counting chamber | VWR | 630-1506 | |
| Pipettes (20 μL, 200 µL and 1000 μL) | Eppendorf | 4924000037, 4924000061, 4924000088 | |
| Pipette tips, sterile (20 µL, 200 µL, 1,000 µL) | Biozym | 770050, 770200, 770400 | |
| Pipet Boy | Integra | 155 000 | |
| Sterile pipettes (5 mL, 10 mL, 25 mL) | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Multistep Pipette, HandyStep S | BRAND | 705110 | |
| 12.5 mL Combitips for Multistep Pipette | BrandTech Scientific | 702378 | |
| Microvette CB 300 K2E | Sarstedt | 16.444 | |
| Sterile reaction tubes (1.5 mL, 50 mL) | Sarstedt | 72.692.005, 62.547.254 | |
| FACS tubes (non-sterile) | Szabo Scandic | BDL352008 | |
| PBS | Lonza | LONBE17-516F | |
| Heat-inactivated FCS | ThermoFisher Scientific | 10500064 | |
| Formaldehyde | Roth | 4979.1 | |
| Sodium azide | Roth | K305.1 | |
| PE-Cy7 Rat Anti-Mouse CD3 Molecular Complex | BD | 560591 | Clone 17A2; Lot # 7235504 |
| Pacific Blu Rat Anti-Mouse CD8a | BD | 558106 | Clone 53-6.7; Lot # 5058904 |
| V450 Rat anti-Mouse CD8a | BD | 560469 | Clone 53-6.7; Lot # 5205945 |
| FITC anti-mouse CD43 | BioLegend | 121206 | Clone 1B11; Lot # B233778 |
| PE-Cy5 Rat Anti-Mouse CD44 | BD | 553135 | Clone IM7; Lot # 85660 |
| APC-Cy7 Rat Anti-Mouse CD62L | BD | 560514 | Clone MEL-14; Lot # 7215801 |
| OVA-tetramer/APC | MBL | TB-5001-2 | SIINFEKL, H-2Kb; Lot # T1702008 |
| VSV NP-tetramer/PE | MBL | TS-M529-1 | RGYVYQGL, H-2Kb; Lot # 007 |
| EGFP-tetramer/PE | MBL | TS-M525-1 | HYLSTQSAL, H-2Kd; Lot # 004 |
| LCMV-GP-tetramer/APC | MBL | TB-5002-2 | KAVYNFATC, H-2Db; Lot # T1412006 |
| HPV 16 E7-tetramer/APC | MBL | TB-5008-2 | RAHYNIVTF, H-2Db; Lot # T1804003 |
Références
- Tober, R., et al. VSV-GP: a potent viral vaccine vector that boosts the immune response upon repeated applications. Journal of virology. 88 (9), 4897-4907 (2014).
- Muik, A., et al. Re-engineering vesicular stomatitis virus to abrogate neurotoxicity, circumvent humoral immunity, and enhance oncolytic potency. Cancer Reseaerch. 74 (13), 3567-3578 (2014).
- Eales, L. J., Farrant, J., Helbert, M., Pinching, A. J. Peripheral blood dendritic cells in persons with AIDS and AIDS related complex: loss of high intensity class II antigen expression and function. Clinical and Experimental Immunology. 71, 423-427 (1988).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- . Tetramers and Monomers Available from: https://www.mblintl.com/products/research/monomer-tetramers/filter/product_type/monomer (2016)
- Wolfl, M., et al. Quantitation of MHC tetramer-positive cells from whole blood: evaluation of a single-platform, six-parameter flow cytometric method. Cytometry A. 57 (2), 120-130 (2004).
- Burrows, S. R., et al. Peptide-MHC class I tetrameric complexes display exquisite ligand specificity. The Journal of Immunology. 165 (11), 6229-6234 (2000).
- Sims, S., Willberg, C., Klenerman, P. MHC-peptide tetramers for the analysis of antigen-specific T cells. Expert Review of Vaccines. 9 (7), 765-774 (2010).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. The Journal of Visualized Experiments. (68), (2012).
- Xie, Y., et al. A novel T cell-based vaccine capable of stimulating long-term functional CTL memory against B16 melanoma via CD40L signaling. Cellular & Molecular Immunology. 10 (1), 72-77 (2013).
- Nanjundappa, R. H., Wang, R., Xie, Y., Umeshappa, C. S., Xiang, J. Novel CD8+ T cell-based vaccine stimulates Gp120-specific CTL responses leading to therapeutic and long-term immunity in transgenic HLA-A2 mice. Vaccine. 30 (24), 3519-3525 (2012).
- Bowers, E. V., Horvath, J. J., Bond, J. E., Cianciolo, G. J., Pizzo, S. V. Antigen delivery by alpha(2)-macroglobulin enhances the cytotoxic T lymphocyte response. Journal of Leukocyte Biology. 86 (2), 1259-1268 (2009).
- Guo, H., Baker, S. F., Martinez-Sobrido, L., Topham, D. J. Induction of CD8 T cell heterologous protection by a single dose of single-cycle infectious influenza virus. The Journal of Immunology. 88 (20), 12006-12016 (2014).
- Sakai, K., et al. Dendritic cell-based immunotherapy targeting Wilms' tumor 1 in patients with recurrent malignant glioma. Journal of Neurosurgery. 123 (4), 989-997 (2015).
- Rosaely, C. G., et al. Immune responses to WT1 in patients with AML or MDS after chemotherapy and allogeneic stem cell transplantation. International Journal of Cancer. 138 (7), 1792-1801 (2016).
- Shane, H. L., Reagin, K. L., Klonowski, K. D. The Respiratory Environment Diverts the Development of Antiviral Memory CD8 T Cells. The Journal of Immunology. , (2018).
- Li, S., Mwakalundwa, G., Skinner, P. J. In Situ MHC-tetramer Staining and Quantitative Analysis to Determine the Location, Abundance, and Phenotype of Antigen-specific CD8 T Cells in Tissues. The Journal of Visualized Experiments. (127), e56130 (2017).
- De Vries, I. J. M., et al. In situ detection of antigen-specific T cells in cryo-sections using MHC class I tetramers after dendritic cell vaccination of melanoma patients. Cancer Immunology Immunotherapy. 56 (10), 1667-1676 (2007).
- Tan, H. X., et al. Induction of vaginal-resident HIV-specific CD8 T cells with mucosal prime-boost immunization. Mucosal Immunology. , (2017).
- Huang, H., et al. CD8(+) T Cell Immune Response in Immunocompetent Mice during Zika Virus Infection. Journal of Virology. 91 (22), (2017).
- Hensel, M. T., et al. Selective Expression of CCR10 and CXCR3 by Circulating Human Herpes Simplex Virus-Specific CD8 T Cells. Journal of Virology. 91 (19), (2017).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21 (1), 15-23 (2001).
- San Jose, E., Borroto, A., Niedergang, F., Alcover, A., Alarcon, B. Triggering the TCR complex causes the downregulation of nonengaged receptors by a signal transduction-dependent mechanism. Immunity. 12 (2), 161-170 (2000).
- Dietrich, J., Hou, X., Wegener, A. M., Geisler, C. CD3 gamma contains a phosphoserine-dependent di-leucine motif involved in down-regulation of the T cell receptor. EMBO Journal. 13 (9), 2156-2166 (1994).
- Schone, D., et al. Immunodominance of Adenovirus-Derived CD8(+) T Cell Epitopes Interferes with the Induction of Transgene-Specific Immunity in Adenovirus-Based Immunization. Journal of Virology. 91 (20), (2017).
- Dolton, G., et al. More tricks with tetramers: a practical guide to staining T cells with peptide–MHC multimers. Immunology. 146 (1), 11-22 (2015).
- Whelan, J. A., et al. Specificity of CTL Interactions with Peptide-MHC Class I Tetrameric Complexes Is Temperature Dependent. The Journal of Immunology. 163 (8), 4342-4348 (1999).
- Wooldridge, L., et al. Tricks with tetramers: how to get the most from multimeric peptide–MHC. Immunology. 126 (2), 147-164 (2009).
- Denkberg, G., Cohen, C. J., Reiter, Y. Critical role for CD8 in binding of MHC tetramers to TCR: CD8 antibodies block specific binding of human tumor-specific MHC-peptide tetramers to TCR. The Journal of Immunology. 167 (1), 270-276 (2001).
- Daniels, M. A., Jameson, S. C. Critical role for CD8 in T cell receptor binding and activation by peptide/major histocompatibility complex multimers. The Journal of Experimental Medicine. 191 (2), 335-346 (2000).
- Tungatt, K., et al. Antibody stabilization of peptide-MHC multimers reveals functional T cells bearing extremely low-affinity TCRs. The Journal of Immunology. 194 (1), 463-474 (2015).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. Journal of Immunological Methods. 340 (1), 11-24 (2009).
- Rius, C., et al. Peptide-MHC Class I Tetramers Can Fail To Detect Relevant Functional T Cell Clonotypes and Underestimate Antigen-Reactive T Cell Populations. The Journal of Immunology. 200 (7), 2263-2279 (2018).
- Xiao, Z., Mescher, M. F., Jameson, S. C. Detuning CD8 T cells: down-regulation of CD8 expression, tetramer binding, and response during CTL activation. The Journal of Experimental Medicine. 204 (11), 2667-2677 (2007).
- McMichael, A. J., O'Callaghan, C. A. A New Look at T Cells. The Journal of Experimental Medicine. 187 (9), 1367-1371 (1998).
- Hunsucker, S. A., et al. Peptide/MHC tetramer-based sorting of CD8(+) T cells to a leukemia antigen yields clonotypes drawn nonspecifically from an underlying restricted repertoire. Cancer Immunology Research. 3 (3), 228-235 (2015).
- Pittet, M. J., et al. Ex vivo analysis of tumor antigen specific CD8+ T cell responses using MHC/peptide tetramers in cancer patients. International Immunopharmacology. 1 (7), 1235-1247 (2001).
- Cohen, C. J., et al. Isolation of neoantigen-specific T cells from tumor and peripheral lymphocytes. The Journal of Clinical Investigation. 125 (10), 3981-3991 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon