Method Article
反ベクトルと反遺伝子特定 CD8 の同時定量+ T はマイク ウイルスベクターを用いたワクチン後染色テトラマー MHC を介して細胞
要約
ここでは、元のプロトコルを提案生体内抗原特異的 CD8 の定性的検出+ T 細胞。分析は、単一細胞懸濁液の臓器や血液量が少ないからで可能です。広範な研究には、細胞傷害性 T 細胞の反応 (予防接種・癌免疫療法研究) の分析が必要。
要約
ウイルス感染、抗原特異的 CD8 に+細胞傷害性 T 細胞 (Ctl) が発生し、病原体の拡散を防ぐために感染した細胞の除去に貢献します。したがって、抗原特異的 Ctl の頻度は特定の抗原に対して T 細胞応答の強さを表しています。このような分析は、基礎免疫学、ワクチン開発、癌免疫生物学、適応免疫において重要です。ウイルスのベクトルのコンポーネントに対して指示される CTL 応答はワクチン分野で、どのように効果的な興味 (すなわち,遺伝子) の抗原に対する抗原特異的細胞の生成は、共同を判断します。抗原特異的 Ctl は、フローサイトメトリーによる細胞内サイトカイン染色、抗原特異的 T 細胞受容体 (Tcr) と解析の直接染色を続いて特定のペプチド刺激によってどちらか検出できます。最初のメソッドは、臓器から細胞を分離するための動物の犠牲が必要なのでかなり時間がかかる。また、それを実行することは困難である小動物からの血液の分離が必要です。後者の方法はかなり速いです、少量の血液で簡単に行うことが、細胞障害活性などの特定の機能には依存しません。MHC テトラマーは、抗原特異的に Tcr を検出する理想的なツールです。
ここでは、抗原特異的 Ctl VSV GP のウイルスのベクトルの主要抗原ペプチド (脈絡 GP、VSV NP) および MHC の遺伝子 (OVA、HPV 16 E7 eGFP) を同時に検出するプロトコルについて述べる私四量体染色とフローサイトメトリー。染色は、血液から直接、または脾臓などの臓器の単一細胞懸濁液から可能です。血液や臓器の単一細胞懸濁液はテトラマーと孵化させます。CD3 および CD8 抗体で染色、フローサイトメトリーによる抗原特異的 Ctl の量を示します。必要に応じて、CD43、CD44、CD62L に対する抗体が抗原特異的 CD8 の活発化の状態を決定するために含めることができる+T 細胞と世間知らずとエフェクター細胞の間で区別します。
概要
このメソッドの目的は、時間のかかるペプチド刺激を必要とせずフローサイトメトリー解析によるマウスの (複数の) 抗原に対する細胞傷害性 T リンパ球 (CTL) の反応の頻度を評価するためにです。このメソッドは、単一の染色で、CTL のサブセットの表現型と抗原特異性を分析します。主要組織適合性複合体を最適化私 (MHC 私) 四量体糖蛋白質 G の VSV が置き換えられて水胞性口炎ウイルス (VSV) の変種、VSV GP などの新しいワクチン アプローチの有効性を分析するためのプロトコルを汚す、リンパ球性脈絡髄膜炎ウイルス (脈絡)1,2の GP 糖タンパク質。体液性応答に加えて、ワクチンの有効性の重要な読み出しは 1 つまたは複数の抗原に対して CTL 応答の誘導です。一貫性と細胞応答の耐久性は、このコンテキストでは重要な同じ動物から CTL 応答の動態をモニターに有利です。これはまた動物数、「3 r」3原則に関する重要な側面削減に 。したがって、血液のわずか 20 μ L からの分析は、この目的のため最適です。
90 年代後半に開発されたテトラマー4 T 細胞免疫学の分野で重要なツールとなった。テトラマー 4 MHC の複合体の蛍光標識は、私/単一ペプチドの特定の Tcr に結合するペプチド分子。最近では、どちらか購入できます既製5、特注エモリー大学6 NIH テトラマー中核施設が無料またはラボ7で作り出されました。MHC I と II テトラマー CD8 のすなわち使用可能な、は、+と CD4+ T 細胞、それぞれ。四量体染色の効力は、時間の節約、むしろシンプルで使いやすい8プロトコル、および感度9を標準化であります。また、動物が犠牲になる必要はありません血を使用する場合、サンプルの最小量が必要。1 つの測定は単一の抗原に限られないが、1 つ汚すとき異なった fluorophores が付いている共役テトラマーを組み合わせることで複数の抗原を分析できます。ペプチドの画面から例えば、新たに発見された抗原をテトラマーに組み込まれて簡単にして T 細胞サブセットの定量化に使用できます。
四量体染色与えない CTL 機能 (すなわち.、サイトカイン産生、エフェクター機能) についてのみ特異性が。T 細胞機能、細胞内サイトカイン染色 (ICS) または酵素リンク免疫スポット (しなさい) 試金する必要がある情報を得るために8,10を実行します。四量体を染色し、ICS/しなさい、しかし、冗長ではありませんが、お互いを補完します。ICS/しなさいのサイトカイン産生を誘導するために生体外の刺激は、元の T 細胞の表現型を変更します。四量体染色、対照的に、T 細胞そのまま残し。元の表現型が保持され、分析することができます。また、テトラマーのもう一つの大きな利点は、磁気の並べ替えと抗原特異的細胞11の濃縮と染色を組み合わせることができますです。これにより、定義された抗原特異性を持つ細胞の培養し同様、特殊な集団の分析-は機能できないことその他の方法で。
使用して、ここで説明されているプロトコル四量体を汚すと同様、IC/しなさい実行できる 1 つの器官からためだけほとんどの材料 (血: 20 μ L; 脾臓: 1 x 10 の6セル) 四量体の汚損のため必要です。ただし、興味の抗原特異的細胞の頻度、に応じてそれぞれの TCR と実験的コンテキストの強さ、必要な細胞の量はスケール アップする必要があります。 または磁気濃縮を適用する必要があります。
(抗) ワクチン12,13,14,15または免疫療法16,17, 表現型解析の有効性を評価するためにたとえば、テトラマーが広く使用されますと空間抗原特異的 T 細胞サブセット18,19,20,21,22,23のローカリゼーション。ここで説明する方法は、研究は、定量化と抗原特異的 CD8 のマウスの表現型解析を取り入れることを目標に適しています+ T 細胞の迅速かつ便利な方法で彼らの分析。
プロトコル
オーストリア国立動物実験法 (「Tierversuchsgesetz」) に準拠して記載されているすべてメソッド行ったし、オーストリア国家当局によって動物の試用権限が与えられています。
1. 緩衝液調製検体の採取と
注:使用マウスの緊張は、エピトープ解析に依存します。型にバインドされ、MHC マウスで、例えば表される, H-2 Kb c57bl/6 マウスの適切な四量体を選択します。性別と年齢の動物の科学的な質問によって異なります。説明実験のほとんどはここで、実験、すなわち,最初の予防接種の開始時は 6-8 週齢雌マウスを使用します。
- 準備 FACS バッファー (リン酸緩衝生理食塩水 (PBS) + 1% ウシ胎仔血清 (FCS) + 0.1% アジ化ナトリウム + 2 mM エチレンジアミン四酢酸 (EDTA)、FACS 固定バッファー (PBS で 1.5% (v/v) ホルムアルデヒド)。
注:両方のバッファーが事前に準備されていることをお勧めします。使用するまで 4 ° C で保存します。 - 血液: EDTA 被覆管にマウスの尾静脈からマウスあたりの血液の 20 μ L を収集24を前述のよう。
注:血液は、,下大静脈クマゼミやレトロな軌道洞など他のルートでも収集できます。ただし、採血法、国立動物実験法と動物の試用版アプリケーションに準拠します。尾静脈からの血のコレクションは、繰り返し少量の血液が必要な研究に最適です。付加的な材料は、補正コントロールと非染め色コントロールに必要です。 - 脾臓: は、器官を分離し、注射器のプランジャーの助けを借りて、70 nm、40 μ m の細胞のストレーナーを押します。前述の手順 6 の数、赤血球の溶解を実行します。PBS で 1 × 107細胞/ml の濃度を調整します。1 サンプルあたりの 1 x 10 の6セルが必要です。
注:常にいくつか模擬接種を含めるまたはネガティブ コントロールとしてベクター免疫動物を制御します。卵白アルブミン (OVA) の-肯定的な制御として四量体、OT 1 マウスからのサンプルが使用されます。無染色を忘れないでくださいと計算で補正コントロール。必要に応じて、実験でさまざまな動物からのサンプルはこのプールがあります。 - サンプル コレクションの後直接染色に進みます。
2. 染色セットアップ
- 各サンプルを 1 つの FACS チューブを準備します。チューブを正しくラベル付けし、各チューブにオルガン懸濁液 (1 x 10 の6セル) の 100 μ L または血の 20 μ L を転送します。
- 脾臓: 4 ~ 8 ° C で 600 x gで 5 分間遠心分離し、上澄みを廃棄します。渦巻きを細胞ペレットを再懸濁します。
注:これは約 20 μ L、血液サンプルのボリュームとして同様の残りのボリュームになります。 - 各チャネルはまた使用するため補正のサンプルの 1 つの FACS 管を準備します。無染色のコントロールと 1 つの追加のサンプルを準備します。
3. 四量体染色
-
各サンプルの四量体希釈の 50 μ L を使用します。推奨されるテトラマーおよび最適化された希薄、表 1 を参照してください。
注:テトラマーまたは抗体を使用する場合、キャビネット安全性のライトをオフし、光からサンプルを保護します。- FACS バッファー管を準備 (ボリューム = × サンプル数 50 μ L 加え、ピペッティング エラーを補正する総量の 10% の追加)。
- 表 1に記載されている最適な希釈に tetramer(s) を追加します。渦ソリューション。
注:上場 fluorophores が付いている全体の抗体パネル (CD3、CD8、CD43、CD44、CD62L) を使用して、PE と (APC) で 2 つのテトラマーが指定できます。単一染色で両方テトラマーを組み合わせることができますすなわち,は、両方のテトラマーと細胞の染色を同時に実行することができます。
| 四量体 | ペプチッド シーケンス | 対立遺伝子 | 蛍光体 | 希釈 |
| MHC 私/OVA | SIINFEKL | H-2 Kb | APC | 1:25 |
| MHC 私/VSV NP | RGYVYQGL | H-2 Kb | PE | 1:25 |
| MHC 私/EGFP | HYLSTQSAL | H, マウス | PE | 1:25 |
| MHC 私/脈絡 GP | KAVYNFATC | H 2 db | APC | 1:25 |
| MHC 私/HPV 16 E7 | RAHYNIVTF | H 2 db | APC | 1:10 |
表 1: テトラマーと最適な希釈を提案します。(卵白アルブミン (OVA) および強化された緑の蛍光蛋白質 (eGFP)) モデル抗原や病原体コンポーネント (水疱性口内炎ウイルス (VSV) np)、リンパ球性脈絡髄膜炎ウイルス (脈絡のいくつかの主要抗原ペプチドの推奨されるテトラマー) 糖タンパク質 (GP) とヒトパピ ローマ ウイルス (HPV) E7 腫瘍 (E7))。それぞれ、ペプチド配列と対応する対立遺伝子、同様に推奨される蛍光体および最適化された希釈が表示されます。
- 各サンプルと渦に優しくテトラマー希釈の 50 μ L を追加します。補正コントロールおよび無染色のサンプルのみ (4 量体) なし FACS バッファーを追加します。
- 光から保護、37 ° C で 20 分間サンプルをインキュベートします。四量体から抗体染色へのシームレスな移行を確保するため、培養時間の間に手順 4 で説明した抗体ミックスを準備します。
注:それぞれの個々 の量 (希釈、インキュベーション時間と温度) の最適の条件を調整する必要があります。
4. 抗体の調製
-
各サンプルの抗体ミックスの 50 μ L を準備します。
- FACS バッファー管を準備 (ボリューム × サンプル数 50 μ L 加えピペッティングのエラーを補償するために容量の追加の 10% を =)。
- 表 2に記載されている希釈に抗体を追加します。
注:科学的な質問によってここに記載されているものから離れて他のマーカーの組み合わせをされる可能性があります。常にパネルに CD3 および CD8 抗体を含めることを確認します。 - 渦ソリューション。
| 抗体 | 蛍光体 | 希釈 | μ g/サンプル | マーカー |
| CD3 | PE Cy7 | 1: 200 | 0.05 | Ctl (CD3+CD8+) |
| CD8 | パシフィック ブルー | 1:750 | 0.013 | |
| V450 | 1: 100 | 0.1 | ||
| CD43 | FITC | 1: 100 | 0.25 | 活性化 (CD43+) |
| CD44 | PE Cy5 | 1: 250 | 0.04 | ナイーブ (CD44-CD62L+) & エフェクター (CD44+CD62L-) |
| CD62L | APC Cy7 | 1: 500 | 0.02 |
表 2: このプロトコルと最適な希釈で使用される抗体です。推奨表面マーカー (CD3、CD8、CD43、CD44、CD62L) は、最初の列に表示されます。ごとに、推奨される蛍光体、最適化された希釈と抗体/サンプルの量が表示されます。最後の列に各マーカーで識別されるセル型が指定されます。
-
補正コントロール抗体を準備します。各補償制御それぞれのカラーに CD8 抗体を使用します。
- 各チャンネルを FACS バッファー 200 μ l チューブを準備し、それぞれのカラーに CD8 抗体希釈 1: 200 の 1 μ L を追加します。
- 渦管。
- すぐに染色に進みます。
5. サンプルの染色
- 4-8 ° C で 600 x gで FACS バッファーと 5 分間遠心する 〜 1 mL を追加してサンプルを一度洗う遠心分離の後上澄みを廃棄し、ペーパー タオルのスタックの残りの液を切る。
注:血で処理する場合は、残りの液体を排水するとき注意が必要。赤血球の溶解前に血は FACS 管の下部に固執しません。また、上清を吸引します。 - 各細胞ペレットと渦に優しく抗体ミックスの 50 μ L を追加します。
- 優しく対応する補償制御と渦の細胞ペレットに 50 μ L の各補償のミックスを追加します。
- 優しく無染色制御と渦の細胞ペレットに FACS バッファーの 50 μ L を追加します。
- 光から保護、4 ° C で 30 分間すべてのサンプルをインキュベートします。
- 器官を使用する場合: 手順 6 をスキップします。〜 1-2 を追加することで一度洗って FACS バッファーおよび 4-8 ° C で 600 x gで 5 分間遠心分離機の mL遠心分離の後上澄みを廃棄し、ペーパー タオルのスタックの残りの液を切る。
- 血液を使用する場合: 6 (赤血球の溶解) の手順に進みます。
6. 赤血球の溶解
- 各サンプルと優しく渦に ACK (アンモニウム塩化カリウム) バッファー25 500 μ L を追加します。
注:ACK バッファーは、浸透圧の腫れと具体的には赤血球の溶解に します。 - 暗闇の中で部屋の温度で 5 分間インキュベートします。
- 4-8 ° C で 600 x gで FACS バッファーと 5 分間遠心の 1 mL を追加します。遠心分離の後上澄みを廃棄し、ペーパー タオルのスタックの残りの液を切る。
メモ: ペレットが赤ではなく、赤血球の溶解を繰り返します。 - 〜 1-2 を追加することで一度洗って mL FACS バッファーと 4-8 ° C で 600 x gで 5 分間遠心遠心分離の後上澄みを廃棄し、ペーパー タオルのスタックの残りの液を切る。
7. フローサイト メーターによる測定と解析を流れ
- 各管に FACS 固定バッファーの 150-300 μ L を加え、ボルテックスで混ぜます。血 20 μ、150 μ L のバッファーで十分です。
注:固定の前に細胞が塊の形成を防止するためにも再度中断されたことを確認します。できるだけ早く流れフローサイト メーターによる測定を続行します。 - 補正コントロールを測定し、任意のスペクトルの重複を修正します。
-
CD3 の選択を図 1に示すように、シーケンシャル ゲートを設定+/CD8+細胞。
- 前後脇の散布 (エリア) (非対数スケール) を使用してリンパ球にゲート。
- リンパ球の集団内で前方散乱幅対エリア (非対数スケール) を使用して単一セルのゲートします。
- CD3 および CD8 チャネル (対数目盛) を使用して 1 つのセルのリンパ球をプロットします。CD8 を識別する+ T 細胞の CD3 ゲート+/CD8+細胞。
- CD8 をプロット+対+四量体細胞と CD8 のゲート+テトラマー+セル、図 2に示すように。
- 可能であれば、CD3 に 20,000 (血から少なくとも 5,000 細胞) を記録+/CD8+の各サンプルのゲートし、FCS ファイルとして保存します。
注:記録する細胞の量は興味の抗原特異的細胞の頻度に応じて調整する必要があります。 - 適切な分析ソフトウェアで FCS ファイルを分析します。(セクション 7.3) 上記のようにゲートの戦略を使用し、CD8 を定量化+テトラマー+細胞。
結果
図 1は、このプロトコル、すなわち CD3 の標的細胞に正しくゲートする方法を示します+/CD8+細胞。活性化して細胞レセプター T 細胞受容体26,27頻繁と、したがって、この CD3低細胞はゲートの開閉に含まれます必要がありますです。CD3 をゲーティング後+/CD8+セル、テトラマー陽性細胞がすることができます (図 2) を確認します。代表のネガティブ コントロール (純真な) マウスのしみかどちらか [OVA 分泌アデノ ウイルス (アデノ OVA) 5 と予防接種を動物としてよくまたは OVA 表現 VSV GP (VSV-GP-OVA) が表示されます。2 つの異なる低しみに見られるように、テトラマーは汚損のため同じ管で結合できます。これにより、2 つの異なる CTL 特異性の同時定量: ウイルス固有 (VSV N) と遺伝子特定 (OVA) Ctl。シングルとダブルの四量体染色が各四量体の陽性細胞の同じようなパーセントを与えることを確認しました。このプロトコルは、他のウイルスに固有 (HPV 16 E7 脈絡 GP.、(例えば) を使用または特定の遺伝子 (例えば.、 GFP) T 細胞集団がすることができます分析 (補足図 1)。補足表 1、VSV GP OVA 接種後 5 つの動物のための結果を示す — 四量体染色の堅牢性を示します。
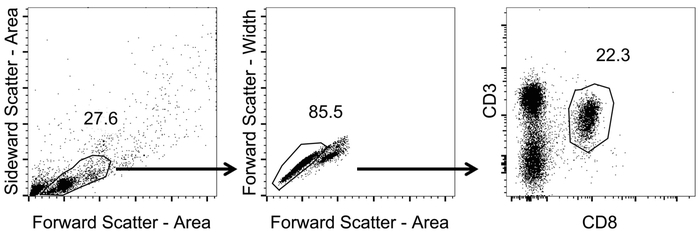
図 1: CD8 を分析する戦略をゲート代表+ T 細胞血液中です。フローサイトメトリーによる解析に使用されるゲートの戦略の模式図。四量体染色と流れフローサイト メーターによる計測後、データを分析しました。リンパ球は、前方と脇の散乱 (領域) (非対数目盛) 識別されました。単一のセルは前方散乱幅対エリア (非対数目盛) を適用することによって識別されました。CD8+ T 細胞は CD3 にゲートによって識別された+/CD8+細胞 (対数目盛)。この図の拡大版を表示するのにはここをクリックしてください。
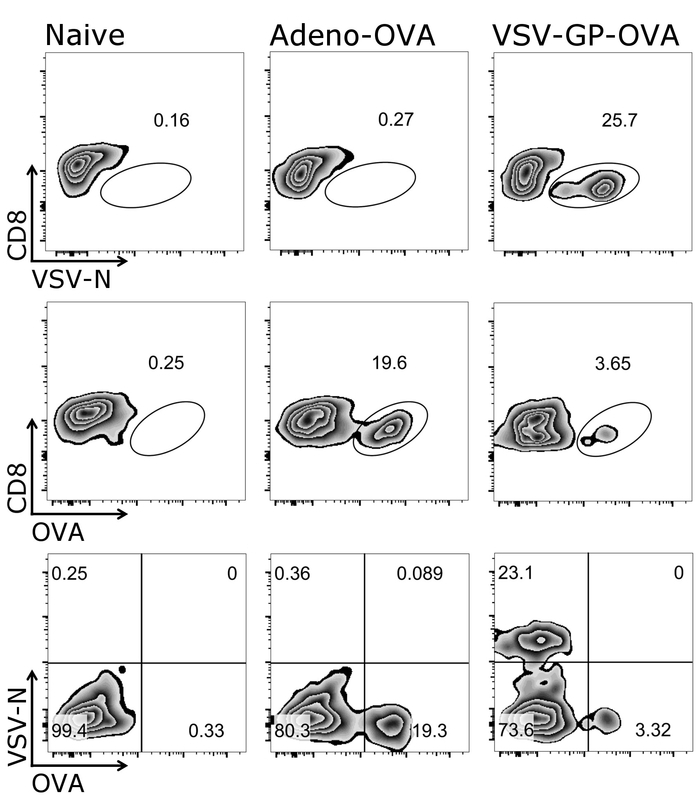
図 2: OVA および N 固有 CD8 を定量化する戦略をゲート代表+ T 細胞血液中です。四量体+細胞の流れフローサイトメトリー法による定量に使用されるゲートの戦略の模式図。CD3+/CD8+セルはテトラマー解析に使用されました。上・中流のパネル: CD8 マーカーはそれぞれ四量体 (対数目盛) に対してプロットしました。下部のパネル: 両方のテトラマーをお互い (対数目盛) に対してプロットしました。左:コントロール (純真な) マウス;中間:マウス卵子分泌アデノ ウイルス (アデノ OVA); 5 で予防接種を受けて右:マウスが卵白アルブミン (OVA) 予防接種を受けて-VSV GP (VSV-GP-OVA) を表現します。予防接種後 7 日目で尾静脈から採血。この図の拡大版を表示するのにはここをクリックしてください。
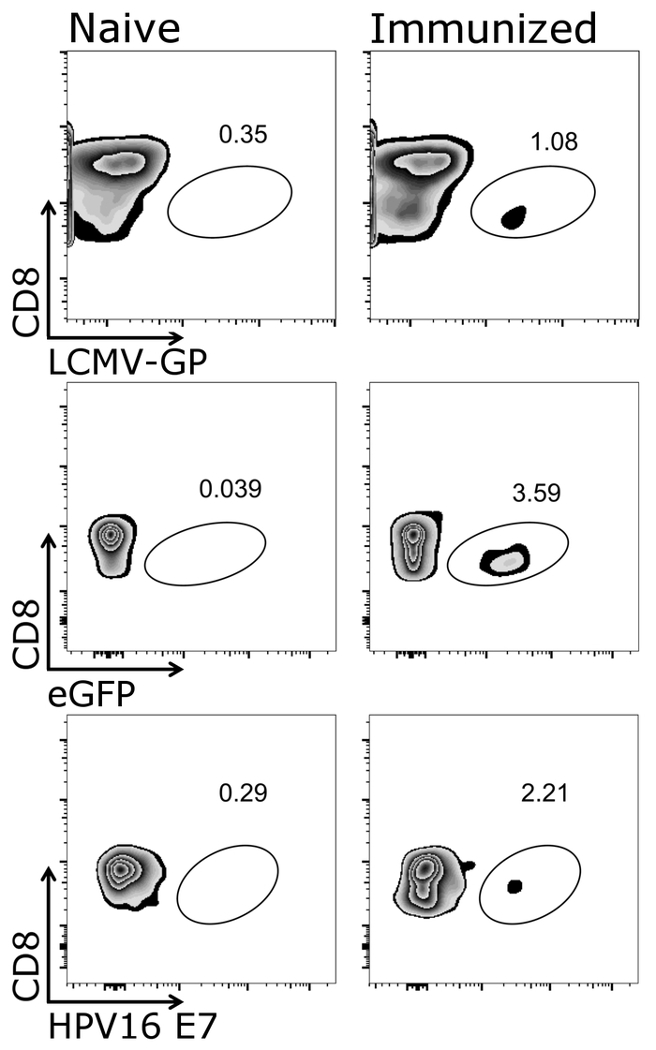
CD3 の補足図 1: 代表的な結果+/CD8+ワクチン接種後の四量体+細胞。四量体+細胞の流れフローサイトメトリー法による定量の模式図。CD3+/CD8+テトラマー解析に使用された細胞と CD8 マーカーはそれぞれ四量体 (対数目盛) に対してプロットしました。左:マウスは甘かった、右:マウス VSV GP (上部パネル) で免疫した、緑色蛍光タンパク質 (eGFP) を強化-VSV GP (中央のパネル) または VSV GP ヒトパピ ローマ ウイルス (HPV) E7 腫瘍 (E7) を表現する表現 (下段)。血液免疫後 7 日目で尾静脈から収集された、テトラマー (脈絡 GP、eGFP と HPV E7) で染色します。この図の拡大版を表示するのにはここをクリックしてください。
ここで説明されているプロトコルの 1 つの大きな利点は、のみ少量の血液の各測定のために必要な時間をかけて同じマウスからの T 細胞の応答を続くことができることです。図 3は、時間の経過と共に T 細胞応答のための模範的な結果を示しています。抗原特異的 Ctl の量だけでなくその表現型も分析できます (図 4) プロトコルを使用しています。
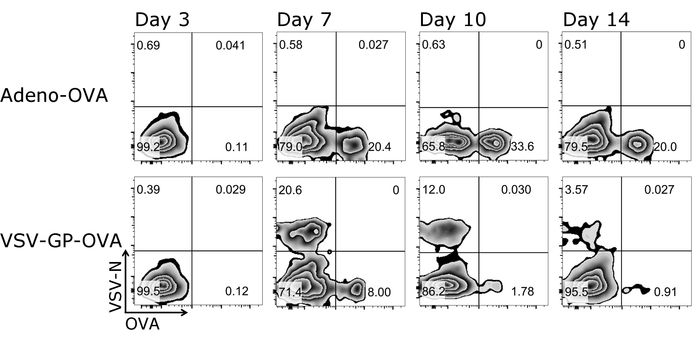
図 3: 代表的な結果 CD8 の+ T 細胞ワクチン接種後血液の運動。四量体+細胞の流れフローサイトメトリー法による定量に使用されるゲートの戦略の概略図。CD3+/CD8+テトラマー解析に使用された細胞と互いに (対数目盛) 両方のテトラマーをプロットしました。上部パネル: マウス卵子分泌アデノ ウイルス (アデノ OVA); 5 で予防接種を受けてパネルを下げる: マウスが卵白アルブミン (OVA) 予防接種を受けて-VSV GP (VSV-GP-OVA) を表現します。予防接種後の 3、7、10、14 日に尾静脈から採血。この図の拡大版を表示するのにはここをクリックしてください。
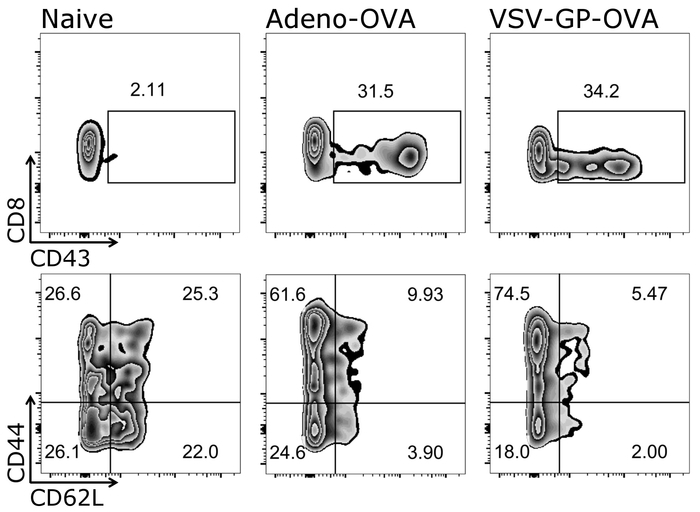
図 4: 代表的な結果 CD8 の+ T 細胞活性化とワクチン接種後世間知らずとエフェクター細胞への分化。の流れフローサイトメトリー法による定量化に使用されるゲート戦略の概略をアクティブ (CD43+)、ナイーブ (CD44-/CD62L+) とエフェクター (CD44+/CD62L-) CD3+/CD8+細胞 (対数スケール)。左:コントロール (純真な) マウス;中間:マウス卵子分泌アデノ ウイルス (アデノ OVA); 5 で予防接種を受けて右:マウスが卵白アルブミン (OVA) 予防接種を受けて-VSV GP (VSV-GP-OVA) を表現します。予防接種後 7 日目で尾静脈から採血。この図の拡大版を表示するのにはここをクリックしてください。
| # をマウスします。 | %Cd43+ | % VSV N 四量体+ | %Ova 四量体+ | |
| モック | 1 | 1.7 | 0.45 | 0.41 |
| 2 | 0.77 | 0.69 | 0.15 | |
| 3 | 1.34 | 0.35 | 0.31 | |
| 4 | 1.68 | 0.83 | 0.26 | |
| 5 | 0.84 | 0.47 | 0.23 | |
| VSV GP OVA | 1 | 23 | 13.2 | 3.69 |
| 2 | 32.6 | 15.9 | 3.54 | |
| 3 | 22.1 | 11.7 | 2.43 | |
| 4 | 15.1 | 8.89 | 1.79 | |
| 5 | 29.1 | 14.7 | 5.64 |
補足表 1:活性および抗原特異的 CD3 の割合+/CD8+細胞ワクチン接種後です。世間知らずであるかまたは卵白アルブミン (OVA) で免疫したマウス-VSV gp (VSV-GP-OVA) (n = 5)。血液免疫後 7 日目で尾静脈から収集された、テトラマー (VSV N と OVA) で染色します。アクティブ (CD43+) と抗原特異的 (四量体+) CD3+/CD8+細胞のフローサイトメトリーによる定量を行った。
ディスカッション
四量体染色 T リンパ球の表現型とペプチド特異性を分析するのではなく簡単で単純なプロトコルです。血液分析のための前述のように、低侵襲し、により、継続的な監視、たとえば予防接種の研究。予防接種においては、ベクトルと抗原特定の反応の定量化は、関心のベクトル固有の応答はワクチン抗原28に対して効果的な免疫応答を妨げる可能性があります。メモは、ここで説明したプロトコルと両方の人口示すことができる同時に単一四量体染色で染色可変性とサンプル量を減らします。ただし、いくつかの手順は、適切な測定と信頼性の高いデータを確保するため慎重に行う必要があります。尾静脈からの血液を使用すると、分析のため、あらかじめ血管拡張24を誘導するために動物を暖かい確認 1 つ必要があります。これにより、十分な血を短時間で集めることができる、動物へのストレスを削減、分析がはるかに良いと比較するとして、血がゆっくりと収集された場合。また、サンプルのコレクション (血液や臓器) の後を推奨して、TCR ダウンレギュレーションにより偽陰性を避けるために直接染色です。同様に、すべての以降の手順: プロシージャは中断されるべきではない、すべての洗濯手順 (プロトコルに記載) として最低限の数に減少します。適切な染色するには、すべてのソリューションや前にサンプルを培養後渦に注意をすべき。細胞の凝集を避けるためにサンプルを修正する前に、これは特に重要です。
プロトコルを変更するには、面で他の表面マーカーとテトラマー分析の目的に応じてを使用することがことができます。ただし、すべての試薬、染色パネル全体との組み合わせで最適な滴を必要があります。ここで指定したテトラマーのいくつかは、最適化が明らかに我々 は、製造元の推奨希釈を増やすことができます (1:10 推奨、1:25 の最適化) (表 1)。スペクトルの重複を補正するために補償ビーズは陽性細胞の代わりに使用できます。については四量体結合螢光の選択 1 つを想定する必要があります明るい螢光色素を使用する信号が低いとき特に検出 - 容易。長砂ら29日として単一染色および CD8 で完全に組み合わせることができます PE または APC 結合テトラマーを使うことが望ましい+ T 単一の抗原特異性を持つ細胞をきれいにすることができます (図 2) を検出します。温度、培養時間に関するさまざまな四量体染色条件が存在します。我々 の最適化プロセスでは、この問題に対処して、四量体 (4 ° C、室温または 37 ° C) の異なる条件下で染色を行った。得られた結果から文献30,31である 37 ° C で 20 分間染色する勧めします。四量体30と偽否定的な結果の内面化につながるよう、長期培養は避けてください。
CD8 の検出のための右の抗体の選択+細胞は慎重に考慮された (および潜在的適応) は、別の重要な問題。これは実際には、特定の抗 CD8 抗体クローン マウス33サンプルと同様に、人間の32で、TCR にテトラマーの結合をブロックから発生します。プロトコルを汚す量私たち私たちは選択クローン マウス CD8 のために 53-6.7+セル — ブロックしませんが、四量体の染色はむしろ向上するクローン。
たとえば T 細胞応答のピーク時に顕著な免疫応答を解析するとき、四量体の染色はむしろ複雑ではないです。しかし、もう少し '問題' である集団がある可能性があります。このような例は、低親和性抗原の特定の細胞 (腫瘍、自己)、最近アクティブ化されたその後ダウン規制を細胞の受容体や希少細胞サブセット (例えば.素朴な前駆体またはメモリ セルの人口)。これらのケースでのプロトコルを汚す古典的な四量体は改善またはその他の方法と組み合わせる必要があります。たとえば、タンパク質キナーゼ阻害剤 (PKI) ダサチニブは TCR の内面化を阻害する、四量体が汚れる前に含まれているでしょう。テトラマーは、四量体染色後反螢光色素非プライマリ Abs を含むでも安定することができます。さらに、第 2 反 Ab 蛍光色素標識された Ab29,34,35,36の添加による蛍光強度を増加できます。テトラマーをこのプロトコルで指定された選択条件を最適化し、PKI または追加の Abs を含みませんでした。ただし、他の量のための最適の条件は個別に調整が必要。特殊な集団について四量体の染色は磁気濃縮11と組み合わせること必要があります。
容易にする、四量体染色の FACS 解析を検証する正と負のコントロールが含まれているはずです。ネガティブ コントロールとして常に関心の四量体で私たちと同じ系統の素朴なマウスの細胞を染色します。また、サンプルは、テトラマー無関係なペプチドが関心の四量体として同じ螢光色素に汚すことができます。このようなコントロールは偽の肯定的な信号を除外する不可欠です例えば.、死細胞に由来します。これに加えて、propidium ヨウ化 (PI) などのライブ/デッド汚れを含むようにそれをお勧めします。これは特別な重要性の細胞は分離後直接汚れていない場合です。蛍光背景を削除する別の戦略は、1 つのチャネルで複数の T 細胞マーカーを含めることがあります。このチャネルの細胞陽性を除外することによって T 細胞集団を除外できます。肯定的な制御として、OVA 四量体のたとえば OT 1 マウスからのサンプルを使用できます。個別に選択するのにはその他のテトラマー (例えば.、数回を免疫したマウスからサンプル)。同様他37、また遵守 CD8 受容体のダウンレギュレーション エフェクター T 細胞応答の 7 日目で CTL 活性化中。したがって、アクティブ化された四量体+エフェクター T 細胞の損失を避けるためには、CD8低細胞を解析に含める我々 お勧めします (少なくともエフェクター段階で測定する場合)。
品質と 1 つは、このプロトコルから取得できる情報量は調査される抗原についての知識、可用性および四量体と FACS 機 (レーザーや検出器の使用可能な数) の質の特異性に依存しています。動物試料を使用して、免疫応答の変化が自然と避けられないです。したがって、四量体染色から意味のある結果を得るためには、少なくとも 3-5 動物を分析する必要があります。そうして、ここで説明されているプロトコルは信頼性が高く、再現性のある結果 (補足表1 に 1 つの実験から模範的な結果を見つけることができます) を与えます。前に述べたように、このメソッドは、表現型および cd8 陽性の抗原特異性の定量化に最適+ T 細胞 (図 3, 4;補足図 1) だけでなく人間にもマウスで。ただし、CD8 を分析する+ T 細胞のエフェクター機能をグランザイムによる細胞死、しなさいおよび/または ICS を実行する必要があります。ただし、1 つ留意すべき体外刺激による T 細胞機能の生体内での実態を表さないことがあります。抑制環境生体内で生体外で測定される T 細胞機能にできません。
独自の四量体の染色を提供しません、すべての情報が T 細胞の反応を特徴付けるし、in vitro での非常に敏感な方法38T 細胞サブセットを定量化する本質的な方法となってへと進化。特定のサブセットを定量化するが、またそれらの39を分離 in situ ハイブリダイゼーション19,20それらをローカライズし、腫瘍関連40,などの低親和性抗原を調べるするテトラマーを使用だけことはできません41. テトラマー技術4の発見、以来四量体染色 T 細胞の解析とアプリケーションの範囲に不可欠なツールとなっています。
開示事項
ドロテー ・ フォン ・ Laer VSV GP の発明者少数の VSV GP のための知的財産権を保持している ViraTherapeutics 社のバイオ テクノロジー企業の株式を保持しています。他の著者のため競っている金銭的な利益はありません。
謝辞
FWF オーストリア科学基金 (プロジェクト番号 P 25499 B13) によって資金が供給されたこのプロジェクト、欧州連合のホライゾン 2020年研究とイノベーション プログラムの下で付与契約号 681032。次の試薬は NIH テトラマー中核施設から得た: 水疱性口内炎ウイルス核タンパク質 (RGYVYQGL) のクラス I MHC テトラマー。
資料
| Name | Company | Catalog Number | Comments |
| Safety cabinet class 2 | VWR | LBCP302411030 | |
| Flow cytometer (e.g. FACSCanto II) | BD | 338962 | |
| Analysis platform for flow cytometry analysis (e.g. FlowJo) | Fisher Scientific Co. L.L.C. | NC0887833 | |
| Binocular microscopes, VisiScope 100 | VWR | 630-1553 | |
| Vortex mixer | Phoenix Instrument | RS-VA 10 | |
| Centrifuge suitable for FACS tubes (e.g. Rotanta 460R) | Hettich | 5660 | |
| Sterile Scalpel Blades Nr. 10 | Braun | BB510 | |
| Cell strainer 40 µm | Sigma | CLS431750 | |
| Cell strainer 70 µm | Sigma | CLS431751 | |
| Neubauer counting chamber | VWR | 630-1506 | |
| Pipettes (20 μL, 200 µL and 1000 μL) | Eppendorf | 4924000037, 4924000061, 4924000088 | |
| Pipette tips, sterile (20 µL, 200 µL, 1,000 µL) | Biozym | 770050, 770200, 770400 | |
| Pipet Boy | Integra | 155 000 | |
| Sterile pipettes (5 mL, 10 mL, 25 mL) | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Multistep Pipette, HandyStep S | BRAND | 705110 | |
| 12.5 mL Combitips for Multistep Pipette | BrandTech Scientific | 702378 | |
| Microvette CB 300 K2E | Sarstedt | 16.444 | |
| Sterile reaction tubes (1.5 mL, 50 mL) | Sarstedt | 72.692.005, 62.547.254 | |
| FACS tubes (non-sterile) | Szabo Scandic | BDL352008 | |
| PBS | Lonza | LONBE17-516F | |
| Heat-inactivated FCS | ThermoFisher Scientific | 10500064 | |
| Formaldehyde | Roth | 4979.1 | |
| Sodium azide | Roth | K305.1 | |
| PE-Cy7 Rat Anti-Mouse CD3 Molecular Complex | BD | 560591 | Clone 17A2; Lot # 7235504 |
| Pacific Blu Rat Anti-Mouse CD8a | BD | 558106 | Clone 53-6.7; Lot # 5058904 |
| V450 Rat anti-Mouse CD8a | BD | 560469 | Clone 53-6.7; Lot # 5205945 |
| FITC anti-mouse CD43 | BioLegend | 121206 | Clone 1B11; Lot # B233778 |
| PE-Cy5 Rat Anti-Mouse CD44 | BD | 553135 | Clone IM7; Lot # 85660 |
| APC-Cy7 Rat Anti-Mouse CD62L | BD | 560514 | Clone MEL-14; Lot # 7215801 |
| OVA-tetramer/APC | MBL | TB-5001-2 | SIINFEKL, H-2Kb; Lot # T1702008 |
| VSV NP-tetramer/PE | MBL | TS-M529-1 | RGYVYQGL, H-2Kb; Lot # 007 |
| EGFP-tetramer/PE | MBL | TS-M525-1 | HYLSTQSAL, H-2Kd; Lot # 004 |
| LCMV-GP-tetramer/APC | MBL | TB-5002-2 | KAVYNFATC, H-2Db; Lot # T1412006 |
| HPV 16 E7-tetramer/APC | MBL | TB-5008-2 | RAHYNIVTF, H-2Db; Lot # T1804003 |
参考文献
- Tober, R., et al. VSV-GP: a potent viral vaccine vector that boosts the immune response upon repeated applications. Journal of virology. 88 (9), 4897-4907 (2014).
- Muik, A., et al. Re-engineering vesicular stomatitis virus to abrogate neurotoxicity, circumvent humoral immunity, and enhance oncolytic potency. Cancer Reseaerch. 74 (13), 3567-3578 (2014).
- Eales, L. J., Farrant, J., Helbert, M., Pinching, A. J. Peripheral blood dendritic cells in persons with AIDS and AIDS related complex: loss of high intensity class II antigen expression and function. Clinical and Experimental Immunology. 71, 423-427 (1988).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- . Tetramers and Monomers Available from: https://www.mblintl.com/products/research/monomer-tetramers/filter/product_type/monomer (2016)
- Wolfl, M., et al. Quantitation of MHC tetramer-positive cells from whole blood: evaluation of a single-platform, six-parameter flow cytometric method. Cytometry A. 57 (2), 120-130 (2004).
- Burrows, S. R., et al. Peptide-MHC class I tetrameric complexes display exquisite ligand specificity. The Journal of Immunology. 165 (11), 6229-6234 (2000).
- Sims, S., Willberg, C., Klenerman, P. MHC-peptide tetramers for the analysis of antigen-specific T cells. Expert Review of Vaccines. 9 (7), 765-774 (2010).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. The Journal of Visualized Experiments. (68), (2012).
- Xie, Y., et al. A novel T cell-based vaccine capable of stimulating long-term functional CTL memory against B16 melanoma via CD40L signaling. Cellular & Molecular Immunology. 10 (1), 72-77 (2013).
- Nanjundappa, R. H., Wang, R., Xie, Y., Umeshappa, C. S., Xiang, J. Novel CD8+ T cell-based vaccine stimulates Gp120-specific CTL responses leading to therapeutic and long-term immunity in transgenic HLA-A2 mice. Vaccine. 30 (24), 3519-3525 (2012).
- Bowers, E. V., Horvath, J. J., Bond, J. E., Cianciolo, G. J., Pizzo, S. V. Antigen delivery by alpha(2)-macroglobulin enhances the cytotoxic T lymphocyte response. Journal of Leukocyte Biology. 86 (2), 1259-1268 (2009).
- Guo, H., Baker, S. F., Martinez-Sobrido, L., Topham, D. J. Induction of CD8 T cell heterologous protection by a single dose of single-cycle infectious influenza virus. The Journal of Immunology. 88 (20), 12006-12016 (2014).
- Sakai, K., et al. Dendritic cell-based immunotherapy targeting Wilms' tumor 1 in patients with recurrent malignant glioma. Journal of Neurosurgery. 123 (4), 989-997 (2015).
- Rosaely, C. G., et al. Immune responses to WT1 in patients with AML or MDS after chemotherapy and allogeneic stem cell transplantation. International Journal of Cancer. 138 (7), 1792-1801 (2016).
- Shane, H. L., Reagin, K. L., Klonowski, K. D. The Respiratory Environment Diverts the Development of Antiviral Memory CD8 T Cells. The Journal of Immunology. , (2018).
- Li, S., Mwakalundwa, G., Skinner, P. J. In Situ MHC-tetramer Staining and Quantitative Analysis to Determine the Location, Abundance, and Phenotype of Antigen-specific CD8 T Cells in Tissues. The Journal of Visualized Experiments. (127), e56130 (2017).
- De Vries, I. J. M., et al. In situ detection of antigen-specific T cells in cryo-sections using MHC class I tetramers after dendritic cell vaccination of melanoma patients. Cancer Immunology Immunotherapy. 56 (10), 1667-1676 (2007).
- Tan, H. X., et al. Induction of vaginal-resident HIV-specific CD8 T cells with mucosal prime-boost immunization. Mucosal Immunology. , (2017).
- Huang, H., et al. CD8(+) T Cell Immune Response in Immunocompetent Mice during Zika Virus Infection. Journal of Virology. 91 (22), (2017).
- Hensel, M. T., et al. Selective Expression of CCR10 and CXCR3 by Circulating Human Herpes Simplex Virus-Specific CD8 T Cells. Journal of Virology. 91 (19), (2017).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21 (1), 15-23 (2001).
- San Jose, E., Borroto, A., Niedergang, F., Alcover, A., Alarcon, B. Triggering the TCR complex causes the downregulation of nonengaged receptors by a signal transduction-dependent mechanism. Immunity. 12 (2), 161-170 (2000).
- Dietrich, J., Hou, X., Wegener, A. M., Geisler, C. CD3 gamma contains a phosphoserine-dependent di-leucine motif involved in down-regulation of the T cell receptor. EMBO Journal. 13 (9), 2156-2166 (1994).
- Schone, D., et al. Immunodominance of Adenovirus-Derived CD8(+) T Cell Epitopes Interferes with the Induction of Transgene-Specific Immunity in Adenovirus-Based Immunization. Journal of Virology. 91 (20), (2017).
- Dolton, G., et al. More tricks with tetramers: a practical guide to staining T cells with peptide–MHC multimers. Immunology. 146 (1), 11-22 (2015).
- Whelan, J. A., et al. Specificity of CTL Interactions with Peptide-MHC Class I Tetrameric Complexes Is Temperature Dependent. The Journal of Immunology. 163 (8), 4342-4348 (1999).
- Wooldridge, L., et al. Tricks with tetramers: how to get the most from multimeric peptide–MHC. Immunology. 126 (2), 147-164 (2009).
- Denkberg, G., Cohen, C. J., Reiter, Y. Critical role for CD8 in binding of MHC tetramers to TCR: CD8 antibodies block specific binding of human tumor-specific MHC-peptide tetramers to TCR. The Journal of Immunology. 167 (1), 270-276 (2001).
- Daniels, M. A., Jameson, S. C. Critical role for CD8 in T cell receptor binding and activation by peptide/major histocompatibility complex multimers. The Journal of Experimental Medicine. 191 (2), 335-346 (2000).
- Tungatt, K., et al. Antibody stabilization of peptide-MHC multimers reveals functional T cells bearing extremely low-affinity TCRs. The Journal of Immunology. 194 (1), 463-474 (2015).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. Journal of Immunological Methods. 340 (1), 11-24 (2009).
- Rius, C., et al. Peptide-MHC Class I Tetramers Can Fail To Detect Relevant Functional T Cell Clonotypes and Underestimate Antigen-Reactive T Cell Populations. The Journal of Immunology. 200 (7), 2263-2279 (2018).
- Xiao, Z., Mescher, M. F., Jameson, S. C. Detuning CD8 T cells: down-regulation of CD8 expression, tetramer binding, and response during CTL activation. The Journal of Experimental Medicine. 204 (11), 2667-2677 (2007).
- McMichael, A. J., O'Callaghan, C. A. A New Look at T Cells. The Journal of Experimental Medicine. 187 (9), 1367-1371 (1998).
- Hunsucker, S. A., et al. Peptide/MHC tetramer-based sorting of CD8(+) T cells to a leukemia antigen yields clonotypes drawn nonspecifically from an underlying restricted repertoire. Cancer Immunology Research. 3 (3), 228-235 (2015).
- Pittet, M. J., et al. Ex vivo analysis of tumor antigen specific CD8+ T cell responses using MHC/peptide tetramers in cancer patients. International Immunopharmacology. 1 (7), 1235-1247 (2001).
- Cohen, C. J., et al. Isolation of neoantigen-specific T cells from tumor and peripheral lymphocytes. The Journal of Clinical Investigation. 125 (10), 3981-3991 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved