Method Article
Одновременная количественная оценка анти вектор и анти трансген конкретных CD8+ T клетки через MHC Тетрамер пятная после вакцинации с вирусный вектор
В этой статье
Резюме
Здесь, мы представляем протокол для ex vivo качественного обнаружения антиген специфические CD8+ T клетки. Анализ возможна с одной клеточных суспензий от органов или небольшое количество крови. Широкий спектр исследований требуют анализа ответов цитотоксических Т-клеток (вакцинации и Рак иммунотерапия исследований).
Аннотация
После вирусной инфекции, антиген специфические CD8+ цитотоксических Т-клеток (CTL) возникают и вносить вклад в ликвидацию инфицированных клеток, чтобы предотвратить распространение патогенов. Таким образом частота антиген специфические ЦТЛ свидетельствует о прочности клеток T ответ против специфического антигена. Такой анализ имеет важное значение в основных иммунологии, разработки вакцин, рак иммунобиологии и адаптивной иммунологии. В области вакцин CTL реакции, направленной против компоненты вектора вирусный совместно определяет, насколько эффективна поколения антиген специфические клетки против антигена интереса (то есть, трансген). Антиген специфические ЦТЛ либо могут быть обнаружены путем стимуляции с последующим внутриклеточных цитокинов пятнать или прямого окрашивания клеток T антиген специфические рецепторы (TCRs) и анализ подачей cytometry специфических пептидов. Первый метод является довольно трудоемким, так как он требует принесения в жертву животных, чтобы изолировать клетки от органов. Кроме того он требует изоляции крови от мелких животных, которые трудно выполнить. Последний метод является довольно быстро, можно легко сделать с небольшим количеством крови и не зависит от конкретных эффекторных функций, таких как цитолитических активности. MHC-тетрамера являются идеальным инструментом для выявления TCRs антиген специфические.
Здесь мы описываем Протокол одновременно обнаруживать антиген специфические списки для immunodominant пептидов вирусный вектор VSV-GP (LCMV-GP, VSV-NP) и трансгенов (OVA, Е7 ВПЧ 16, eGFP), MHC я Тетрамер окрашивания и потока цитометрии. Окрашивание можно непосредственно из крови или из одного клеточных суспензий таких органов, как селезенке. Крови или одну ячейку суспензий органов инкубируют с тетрамера. После окрашивания с антителами против CD8 и CD3, антиген специфические ЦТЛ количественно подачей cytometry. При необходимости, антитела против CD43, CD44, CD62L или другие могут быть включены определить состояние активации антиген специфические CD8+T клетки и различать наивными и эффекторных клеток.
Введение
Цель этого метода является для оценки частоты ответов цитотоксических Т-лимфоцитов (CTL) (несколько) антигены в мыши гранулярных анализа потоков без необходимости времени пептид стимуляции. Этот метод анализирует фенотипа и антиген специфика подмножеств CTL, в одного окрашивания. Мы оптимизировали комплекс гистосовместимости майор я (MHC I) Тетрамер пятнать протокол для анализа эффективности новых подходов вакцины, например VSV-GP, новый вариант вируса везикулярного стоматита (ВСВ), где была заменена гликопротеина G от VSV гликопротеин GP лимфоцитарный хориоменингит вирус (LCMV)1,2. В дополнение к гуморальный ответ важным считывания эффективность вакцины является индукции CTL ответ против одного или нескольких антигенов. Как последовательность и долговечность клеточного ответа имеют важное значение в этом контексте, это благоприятный для мониторинга кинетики CTL ответов от же животное. Это также приведет к сокращению поголовья, важным аспектом относительно принципов «3Rs»3. Следовательно анализ от всего лишь 20 мкл крови является оптимальным для этой цели.
В конце 90-х годов были разработаны тетрамера4 и стал важным инструментом в области иммунологии Т-клеток. Тетрамера являются дневно меченых комплексы четырех MHC I / пептид молекулы, которые привязку к TCRs, специфических для одного пептид. В настоящее время, они могут быть либо куплены готовые5, обычай приказал бесплатно на объекте Core Тетрамер NIH в Университете Эмори6 или производимых в лаборатории7. MHC, I и II тетрамера, доступных, , т.е. для CD8+ и CD4 клеток+ T, соответственно. Потенция Тетрамер окрашивания заключается в экономии времени, довольно просто и легко стандартизировать8 протоколов и чувствительность9. Кроме того при работе с кровью, животных не нужно приносить в жертву и минимальное количество образца не требуется. Одно измерение не ограничивается одной антигена, но несколько антигены могут быть проанализированы в одной окрашивание, когда объединения тетрамера проспряганное с различными флуорофоров. Недавно обнаруженные антигены, например от экранов пептид, легко могут быть включены в тетрамера и используется для количественного определения подмножества Т-клеток.
Тетрамер окрашивания не даст информацию о функциональности CTL (т.е.., производство цитокинов, эффекторные функции), но только специфичности. Для получения сведений о Т-клеток функциональность, внутриклеточных цитокинов, окрашивание (ICS) или Assay фермента, связанных Immuno пятно (ELISpot) должны быть выполнены8,10. Тетрамер окрашивание и ICS/ELISpot, однако, не являются избыточными, но скорее дополняют друг друга. В пробирке стимуляции заставить цитокиновой продукции для ICS/ELISpot будет изменять оригинальный фенотип Т-клеток. Тетрамер окрашивание, напротив, оставляет Т-клеток нетронутыми; оригинальные фенотип сохраняются и могут быть проанализированы. Кроме того еще одним большим преимуществом тетрамера является, что окрашивание может сочетаться с магнитной сортировки и обогащение антиген специфические клетки11. Это позволяет для анализа редких населения, а также культивирования сортировки клеток с определенный антиген-специфические особенности — это функция, которая является не представляется возможным с другими методами.
Используя протокол, описанные здесь, Тетрамер окрашивания, а также ICS/ELISpot может быть выполнена из одного органа, потому что только очень мало материала (кровь: 20 мкл; селезенка: 1 x 106 клеток) необходим для окрашивания Тетрамер. Однако в зависимости от частоты антиген специфические клетки интереса, сила соответствующих TCR и экспериментальной контекста, количество необходимых клеток может потребоваться масштабировать или магнитного обогащения может потребоваться применить.
Тетрамера широко используются, например оценить эффективность вакцин (противоопухолевое)12,13,,1415 или иммунотерапии16,17, анализ фенотипических и пространственных Локализация антиген специфические Т-клеток подмножеств18,19,20,21,22,23. Метод, описанный здесь подходит для исследований, которые призваны включать количественную оценку и фенотипического анализа мышиных антиген специфические CD8+ T-клеток в их анализе в быстрый и удобный способ.
протокол
Все методы, описанные были исполнены по законодательству австрийской национальной животных экспериментов («Tierversuchsgesetz»), и животных судебного разрешения национальными властями Австрии.
1. буфер подготовка и образцы коллекции
Примечание: Штамм мыши используется зависит epitope проанализированы. Выберите соответствующий Тетрамер, который связывает с MHC тип выражена в мышей, например, H - 2 КБ для мышей C57BL/6. Пол и возраст животных будет зависеть научный вопрос. Для большинства экспериментов, описанных здесь, используйте самок мышей в возрасте 6 – 8 недель в начале эксперимента, то есть, первый иммунизации.
- Подготовка буфера СУИМ (фосфат амортизированное saline (PBS) + 1% плода телячьей сыворотки (FCS) + азид натрия 0,1% + 2 мм Этилендиаминтетрауксусная кислота (ЭДТА) и СУИМ фиксации буфера (1,5% (v/v) формальдегида в PBS).
Примечание: Рекомендуется, что оба буферы готовятся заранее. Хранить при 4 ° C до использования. - Кровь: Собирать 20 мкл крови на мыши из Вены хвост мыши в покрытием ЭДТА трубы, как описано ранее,24.
Примечание: Кровь также может собираться по другим маршрутам, например,, Вена лицевого или ретро орбиталь синуса. Однако метод сбора крови должен быть соблюдать права национальных экспериментов на животных и животных пробную приложений. Забор крови из Вены хвост идеально подходит для исследования, где необходимы неоднократно небольшое количество крови. Для компенсации элементов управления и контроля-окрашенных требуется дополнительный материал. - Селезенка: Изолировать орган и с помощью поршень шприца, нажмите через 70 нм и 40 мкм фильтром клеток. Выполняют Лизис эритроцитов, как описано в шаге 6 и count. Отрегулируйте концентрацию до 1 x 107 кл/мл в PBS. За образец 1 x 106 клеток являются обязательными.
Примечание: Всегда включать некоторые макет прививки или управлять векторного прививки животных как отрицательный контроль. Для овальбумина (OVA)-Тетрамер, образец от мышей OT-1 может использоваться как позитивный элемент управления. Не забывайте, безупречный и компенсации управления в расчет. При необходимости, образцы из различных животных в эксперименте могут быть объединены для этого. - После проб непосредственно приступить к пятнать.
2. Окрашивание Set-up
- Подготовка одного СУИМ трубки для каждого образца. Правильно этикетке трубки и передачи 100 мкл суспензии орган (1 х 106 клеток) или 20 мкл крови в каждую пробирку.
- Селезенка: Центрифуги для 5 мин при 600 x g на 4 – 8 ° C и удалить супернатант. Вихрь Ресуспензируйте Пелле ячейки.
Примечание: Это приведет к оставшийся объем около 20 мкл, аналогичные как объем для образцов крови. - Для каждого канала, которые будут использоваться также подготовьте один СУИМ трубки для компенсации образца. Подготовьте один дополнительный образец как элемент неокрашенных.
3. Тетрамер пятнать
-
Для каждого образца используйте 50 мкл Тетрамер разрежения. Для предлагаемых тетрамера и оптимизированный разведений обратитесь к таблице 1.
Примечание: При работе с тетрамера или антител, выключите свет безопасности кабинета и защищать образцы от света.- Подготовка трубки с СУИМ буфера (объем = 50 мкл × количество образцов плюс дополнительные 10% от общего объема, чтобы компенсировать дозирования ошибки).
- Добавьте tetramer(s) в оптимальной разрежения, как указано в таблице 1. Вихрь решение.
Примечание: При использовании панели все антитела (CD3, CD8, CD43, CD44, CD62L) с перечисленных флуорофоров, два тетрамера (в PE и APC) могут быть включены. Оба тетрамера могут быть объединены в один окрашивание, т.е., окрашивание клеток с обеих тетрамера могут быть выполнены одновременно.
| Тетрамер | Пептид последовательность | Аллель | Флюорофор | Разбавление |
| MHC I / OVA | SIINFEKL | H - 2 КБ | APC | 1:25 |
| MHC I/VSV-NP | RGYVYQGL | H - 2 КБ | PE | 1:25 |
| MHC I / EGFP | HYLSTQSAL | H-2Kd | PE | 1:25 |
| MHC I/LCMV-GP | KAVYNFATC | H-2 дБ | APC | 1:25 |
| MHC I / ВПЧ 16 E7 | RAHYNIVTF | H-2 дБ | APC | 1:10 |
Таблица 1: предложил тетрамера и оптимальной разведениях. Рекомендуемая тетрамера для некоторых immunodominant пептидов модель антигены (овальбумина (OVA) и расширенной зеленого флуоресцентного белка (eGFP)) или патогена компонентов (везикулярного стоматита вирус (ВСВ) Нуклеопротеиды (NP), лимфоцитарный хориоменингит вирус (LCMV Гликопротеин) (GP) и вирус папилломы человека (ВПЧ) E7 онкопротеин (E7)). Для каждого, пептид последовательность и соответствующего аллеля перечислены также рекомендуется Флюорофор и оптимизированный разрежения.
- Добавьте 50 мкл Тетрамер разбавления каждого образца и вихревой мягко. Добавьте буфер СУИМ (без Тетрамер) для компенсации управления и безупречный пример.
- Проинкубируйте образцы для 20 минут при 37 ° C, защищать от света. Чтобы обеспечить плавный переход от Тетрамер к Пятнать антитела, Подготовьте смесь антител, как описано в шаге 4 во время инкубации.
Примечание: Для каждого индивидуального Тетрамер оптимальные условия (разрежения, время инкубации и температуры) должны быть скорректированы.
4. Подготовка антител
-
Для каждого образца Подготовьте 50 мкл антител смеси.
- Подготовка трубки с СУИМ буфера (объем = 50 мкл × количество образцов плюс дополнительные 10% от общего объема, чтобы компенсировать дозирования ошибки).
- Добавление антител в разведениях, перечисленные в таблице 2.
Примечание: В зависимости от научного вопроса могут использоваться другие комбинации маркер Помимо описанной здесь. Убедитесь в том, чтобы всегда включать антител против CD3 и CD8 в панели. - Вихрь решение.
| Антитела | Флюорофор | Разбавление | мкг/образец | Маркер |
| CD3 | PE-Cy7 | 1: 200 | 0.05 | Списки доверия сертификатов (CD3+CD8+) |
| CD8 | Тихоокеанский синий | жилой | 0.013 | |
| V450 | 1: 100 | 0.1 | ||
| CD43 | FITC | 1: 100 | 0.25 | Активация (CD43+) |
| CD44 | PE-Cy5 | 1: 250 | 0,04 | Наивный (CD44–CD62L+) & эффектор (CD44+CD62L–) |
| CD62L | БТР Cy7 | 1: 500 | 0.02 |
Таблица 2: антитела, которые используются в этот протокол и оптимального разведениях. В первом столбце перечислены рекомендованные поверхностных маркеров (CD3, CD8, CD43, CD44 и CD62L). Для каждого перечислены рекомендованные Флюорофор, оптимизированный разрежения и количество антител/образца. В последней колонке указан тип ячейки с каждым маркером.
-
Подготовка антител для компенсации элементов управления. Для каждого элемента управления компенсации используйте антитело против CD8 в соответствующие цвета.
- Для каждого канала подготовить трубка с 200 мкл буфера СУИМ и добавить 1 мкл 1: 200 разбавления антитела против CD8 в соответствующие цвета.
- Вихревой трубы.
- Немедленно приступайте к пятнать.
5. Окрашивание образцов
- Стирать образцы раз, добавив ~ 1 мл буфера СУИМ и центрифуги для 5 мин на 600 x g на 4 – 8 ° C. После центрифугирования удалить супернатант и слить оставшуюся жидкость в стеке бумажных полотенец.
Примечание: При работе с кровью, будьте осторожны, когда слива оставшейся жидкости. До Лизис эритроцитов крови не будет придерживаться нижней части трубки СУИМ. Кроме того аспирационная супернатант. - Добавьте 50 мкл антител смеси каждой ячейки гранул и вихревой мягко.
- Добавьте 50 мкл каждого компенсации смеси Пелле ячейка соответствующей компенсации управления и вихревой мягко.
- Добавьте 50 мкл буфера СУИМ клетки Пелле неокрашенных контроля и вихревой мягко.
- Инкубируйте все образцы для 30 мин при 4 ° C, защищать от света.
- При работе с органами: пропустите шаг 6. Мыть раз, добавив ~ 1 – 2 мл буфера СУИМ и центрифуги для 5 мин при 600 x g на 4 – 8 ° C. После центрифугирования удалить супернатант и слить оставшуюся жидкость в стеке бумажных полотенец.
- При работе с кровью: перейдите к шагу 6 (Лизис эритроцитов).
6. Лизис эритроцитов
- Добавьте 500 мкл буфера ACK (аммония хлорид калия)25 для каждого образца и аккуратно вихря.
Примечание: ACK буфера приведет к осмотической отек и lysis, специально эритроцитов. - Инкубируйте 5 мин при комнатной температуре в темноте.
- Добавьте 1 mL буфер СУИМ и центрифуги для 5 мин на 600 x g на 4 – 8 ° C. После центрифугирования удалить супернатант и слить оставшуюся жидкость в стеке бумажных полотенец.
Примечание: Когда гранулы довольно красный, повторите Лизис эритроцитов. - Мыть раз, добавив ~ 1 – 2 мл СУИМ буфера и центрифуги для 5 мин при 600 x g на 4 – 8 ° C. После центрифугирования удалить супернатант и слить оставшуюся жидкость в стеке бумажных полотенец.
7. поток гранулярных измерения и анализа
- Добавить 150 – 300 мкл СУИМ фиксации буфера к каждой пробке и смешайте vortexing. Для 20 мкл крови 150 мкл буфера является достаточным.
Примечание: До фиксации убедитесь, что клетки также вновь приостановлено, для того, чтобы предотвратить образование сгустков. Как можно скорее приступайте гранулярных измерения потока. - Мера контроля компенсации и исправить любые спектральных дублирования.
-
Настройка последовательных ворот, как показано на рисунке 1 выбрать для CD3+/CD8+ клеток.
- Ворота на лимфоцитов с помощью прямых и сбоку точечной (область) (не логарифмическая шкала).
- В рамках населения лимфоцитов ворота на отдельные ячейки, используя вперед разброс ширина против области (не логарифмическая шкала).
- Участок одноклеточного лимфоциты CD8 и CD3 каналам (логарифмическая шкала). Определить CD8 клетки+ T, стробирования на CD3+/CD8+ клеток.
- Участок CD8+ против Тетрамер+ клеток и ворота на CD8 клетки Тетрамер+ + , как показано на рисунке 2.
- Если возможно, запись 20 000 (по крайней мере 5000 клетки из крови) в CD3+/CD8+ ворота для каждого образца и сохранить как файл FCS.
Примечание: Количество клеток для записи может потребоваться отрегулировать согласно частоте антиген специфические клетки интереса. - Анализировать ФТС файлы с программным обеспечением надлежащего анализа. Использование стробирования стратегии, как описано выше (раздел 7.3) и количественно CD8 Тетрамер+ + клеток.
Результаты
На рисунке 1 показано, как правильно ворот на клетки цели настоящего Протокола, а именно CD3+/CD8+ клеток. Это отметить, что активированы клетки часто помощью26,рецепторов Т-клеток27 и, таким образом, CD3низкой клетки должны также включаться в стробирования. После стробирования CD3+/CD8+ клетки, Тетрамер позитивные клетки могут быть определены (рис. 2). Представитель помарок для мыши отрицательный контроль (наивно), а также животных либо вакцинированная либо OVA-секретирующих аденовирус 5 (адено-OVA) или OVA-выражая VSV-GP (VSV-GP-OVA) отображаются. Как видно из ниже помарки, два разных тетрамера могут быть объединены в же трубки для окрашивания. Это позволяет одновременно количественной оценки двух различных особенностей CTL: вирус специфических (VSV N) и ЦТЛ трансген специфичные (OVA). Мы подтвердили, что stainings одно- и двухместные Тетрамер дают аналогичный процент положительных клеток для каждого Тетрамер. Используя этот протокол, другие вирус специфических (например,., LCMV GP, Е7 ВПЧ 16) или трансген конкретных (например., GFP) Т-клеток, население может быть проанализированы (Дополнительные рис. 1). В дополнительной таблице 1, отображаются результаты для пяти животных после иммунизации с VSV-GP-OVA — о надежности Тетрамер окрашивания.
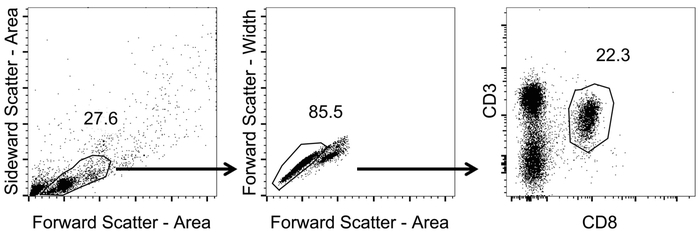
Рисунок 1: Представитель стробирования стратегии для анализа CD8+ T-клеток в крови. Схематическое представление стробирования стратегии, используемые для анализа гранулярных потока. После измерения гранулярных Тетрамер окрашивание и потока были проанализированы данные. Лимфоцитов были определены с вперед и сбоку точечной (область) (не логарифмическая шкала). От тех были определены отдельные клетки, применяя вперед разброс ширина против области (не логарифмическая шкала). CD8+ T клетки были определены стробирования на CD3+/CD8+ клеток (логарифмическая шкала). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
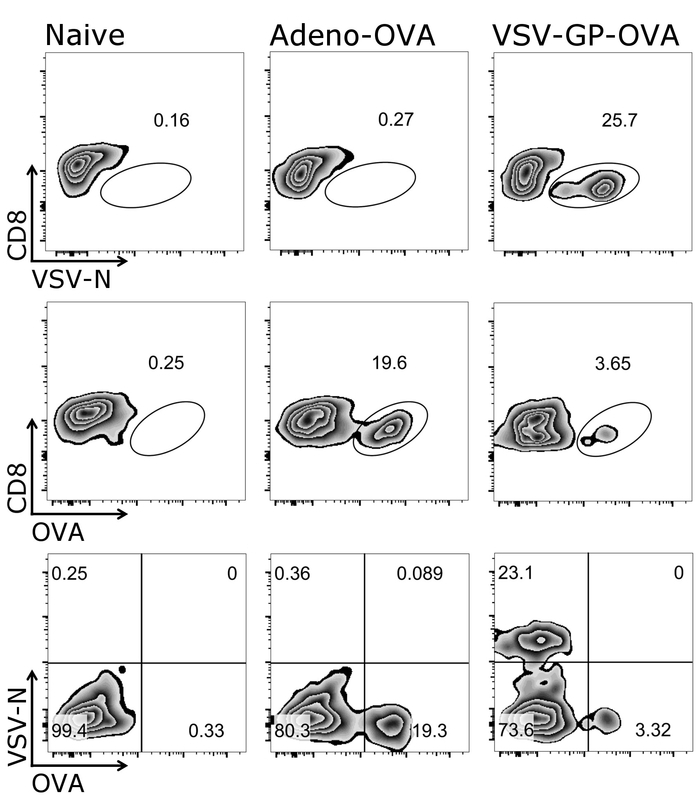
Рисунок 2: Представитель стробирования стратегия поддается OVA - и N-определенной CD8+ T клеток в крови. Схематическое представление стробирования стратегия, используемая для количественного определения потока гранулярных клеток Тетрамер+ . CD3+/CD8+ клетки были использованы для анализа Тетрамер. Верхняя и средняя группа: CD8 маркер был заговор против соответствующих Тетрамер (логарифмическая шкала). Нижняя панель: оба тетрамера были нанесены друг против друга (логарифмическая шкала). Слева: мышь управления (наивно); среднего: мыши было иммунизировано с OVA-секретирующих аденовирус 5 (адено-OVA); право: мыши было иммунизировано с овальбумина (OVA)-выражая VSV-GP (VSV-GP-РАВНИНА). Кровь была собрана из Вены хвост на 7 день после иммунизации. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
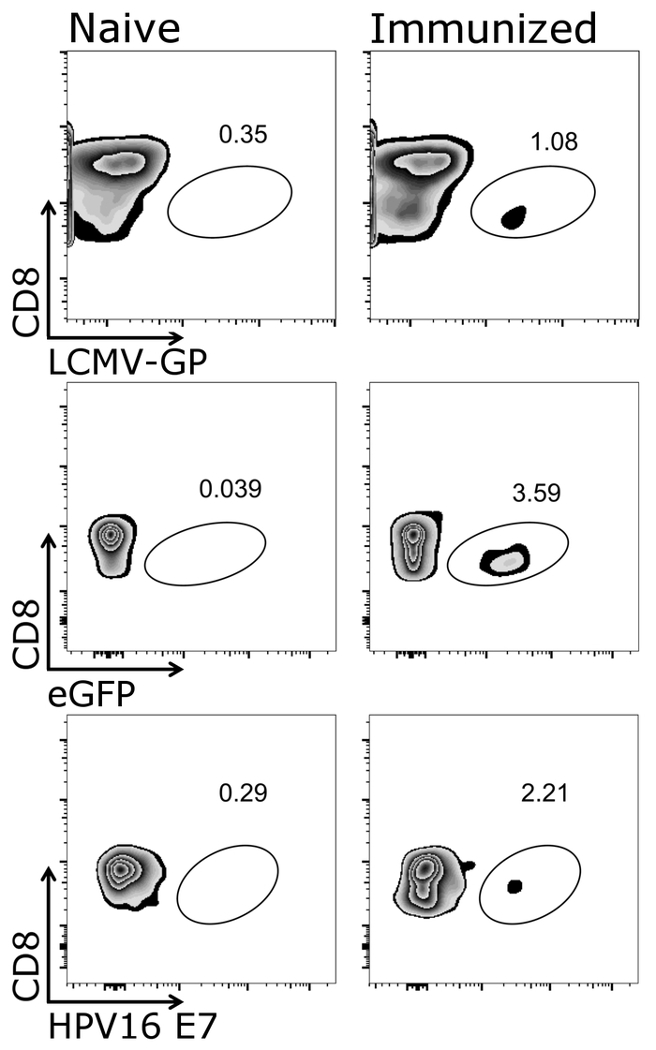
Дополнительные рисунок 1: Представитель результат CD3+/CD8+ + Тетрамер клетки после вакцинации. Схематическое представление потока квантификации гранулярных клеток Тетрамер+ . CD3+/CD8+ клетки были использованы для анализа Тетрамер и CD8 маркер был заговор против соответствующих Тетрамер (логарифмическая шкала). Слева: мышей были наивными, право: мышей были иммунизированы с VSV-GP (Верхняя панель), усиленной Зеленый флуоресцентный белок (eGFP)-выражая VSV-GP (средняя группа) или VSV-GP, выражая вируса папилломы человека (ВПЧ) E7 онкопротеин (E7) (Нижняя панель). Крови было собрано из Вены хвост на 7 день после иммунизации и витражи с тетрамера (LCMV-GP, eGFP и Е7 ВПЧ). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Одним большим преимуществом протокола, описанные здесь является, что Т-клеток ответов от же мыши могут следовать с течением времени, как только небольшое количество крови необходимы для каждого измерения. Рисунок 3 показывает образцовые результаты для Т-клеток ответов с течением времени. Помимо количества антиген специфические ЦТЛ их фенотип можно проанализировать с помощью этого протокола (рис. 4).
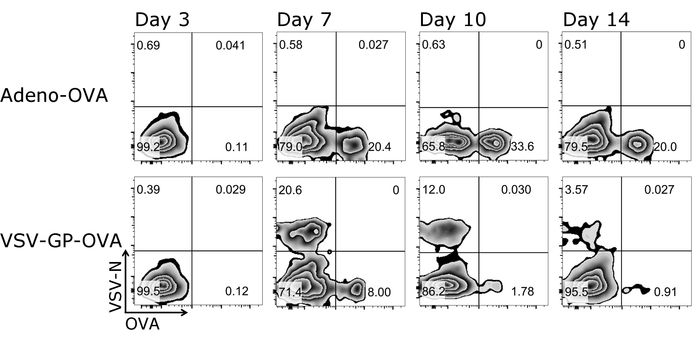
Рисунок 3: Представитель результат CD8+ Т-клеток, кинетическая в крови после вакцинации. Схематическое представление стробирования стратегия, используемая для количественного определения потока гранулярных клеток Тетрамер+ . CD3+/CD8+ клетки были использованы для анализа Тетрамер и оба тетрамера были нанесены друг против друга (логарифмическая шкала). Верхней панели: мышь была иммунизацию с OVA-секретирующих аденовирус 5 (адено-OVA); ниже панели: мышь была иммунизацию с овальбумина (OVA)-выражая VSV-GP (VSV-GP-РАВНИНА). Кровь была собрана из Вены хвост в день 3, 7, 10 и 14 после иммунизации. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
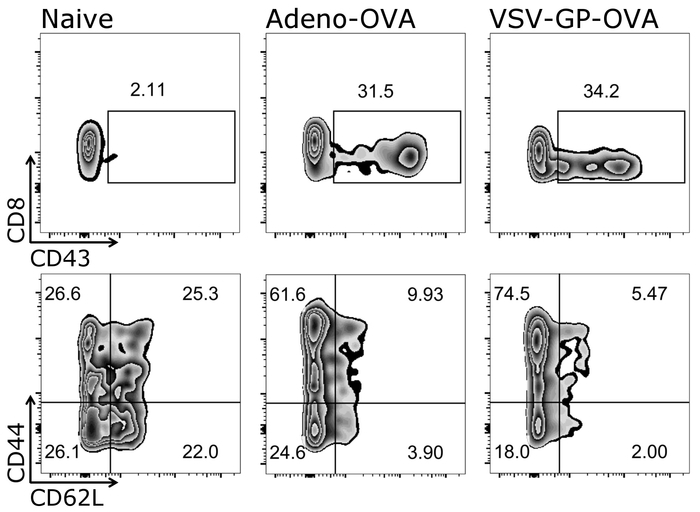
Рисунок 4: Представитель результат CD8+ T Сотовый активации и дифференциация в наивной и эффекторные клетки после вакцинации. Схематическое представление стробирования стратегия, используемая для количественного определения потока гранулярных активирована (CD43+), наивно (CD44–/CD62L+) и эффекторных (CD44+/CD62L–) CD3+/CD8+ клеток () Логарифмическая шкала). Слева: мышь управления (наивно); среднего: мыши было иммунизировано с OVA-секретирующих аденовирус 5 (адено-OVA); право: мыши было иммунизировано с овальбумина (OVA)-выражая VSV-GP (VSV-GP-РАВНИНА). Кровь была собрана из Вены хвост на 7 день после иммунизации. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Мышь # | % CD43+ | Тетрамер VSV-N %+ | % ЯЙЦЕКЛЕТОК Тетрамер+ | |
| макет | 1 | 1.7 | 0,45 | 0,41 |
| 2 | 0,77 | 0,69 | 0,15 | |
| 3 | 1.34 | 0,35 | 0.31 | |
| 4 | 1,68 | 0,83 | 0.26 | |
| 5 | 0.84 | 0.47 | 0,23 | |
| VSV-GP-OVA | 1 | 23 | 13.2 | 3.69 |
| 2 | 32.6 | 15,9 | 3.54 | |
| 3 | 22,1 | 11.7 | 2.43 | |
| 4 | 15.1 | 8,89 | 1.79 | |
| 5 | 29.1 | 14.7 | 5.64 |
Справочная таблица 1: Процент активированных и антиген специфические CD3+/CD8+ клетки после вакцинации. Мышей были либо наивные или иммунизацию с овальбумина (OVA)-выражая VSV-GP (VSV-GP-OVA) (n = 5). Крови было собрано из Вены хвост на 7 день после иммунизации и витражи с тетрамера (N-виллах и OVA). Активирован (CD43+) и CD3 антиген специфические (Тетрамер+)+/CD8+ клетки были количественно подачей cytometry.
Обсуждение
Тетрамер окрашивание является довольно простой и несложный протокол для анализа фенотипа и пептида специфика Т-лимфоцитов. Использование крови для анализа, как описано здесь, минимально инвазивных и обеспечивает непрерывный мониторинг, например в исследованиях вакцинации. В области вакцинации количественная оценка вектор - и антиген специфические реакции представляет интерес, как вектор конкретных ответов может помешать эффективной иммунный ответ против антигенов вакцины28. Следует отметить, что с протоколом, описанные здесь, обе популяции могут быть количественно одновременно в одном Тетрамер окрашивание, снижая изменчивость окраски и образец сумм. Однако несколько шагов необходимо тщательно сделать для обеспечения надлежащего измерения и надежных данных. При использовании крови из вен хвост для анализа, один следует обязательно предварительно теплой животных, чтобы вызвать вазодилатацию24. Таким образом достаточно крови могут быть собраны в течение короткого времени, снижение стресса на животных и анализ гораздо лучше, по сравнению с, если кровь собирается медленно. Кроме того после проб (крови и органов), прямого окрашивания рекомендуется избегать ложных отрицательных результатов благодаря TCR даунрегуляция. То же самое для всех последующих шагов: процедура не должна быть прервана и все этапы стирки уменьшен до минимального числа (как указано в протоколе). Чтобы обеспечить правильное окрашивание, следует позаботиться вихря все решения и образцов до и после инкубации. Это особенно важно до фиксации образцов во избежание слипания клеток.
С точки зрения изменения протокола, других поверхностных маркеров и тетрамера могут использоваться, в зависимости от цели анализа. Однако все реагенты затем нужно титруют, оптимально в сочетании с весь пятнать панели. Для некоторых из тетрамера, указанный здесь, оптимизации показал, что мы можем увеличить разрежения, рекомендованный производителем (1:10 рекомендуется, оптимизированный 1:25) (Таблица 1). Чтобы компенсировать спектрального наложения, бусины компенсации может использоваться вместо окрашенных клеток. Что касается выбор Тетрамер в сочетании флюрохром, один следует предусмотреть использовать яркие флуорохромов, как это облегчает обнаружение - особенно при низком уровне сигнала. 29Долтоне и коллег, мы предпочитаем использовать PE - или APC-в сочетании тетрамера, которые могут быть вполне объединены в единый окрашивание и CD8+ T клетки с точностью один антиген может быть красиво обнаружено (рис. 2). Что касается температуры и инкубации раз существует целый ряд Тетрамер пятнать условия. В нашей оптимизации процесса мы рассмотрели этот вопрос и Тетрамер пятнать в разных условиях (например, 4 ° C, комнатной температуры или 37 ° C). Из полученных результатов мы рекомендуем пятно для 20 минут при 37 ° C, который в соответствии с литературы30,31. Следует избегать длительного инкубации, как это может привести к интернализации Тетрамер30 и false отрицательные результаты.
Выбор правой антитела для обнаружения CD8+ клетки является еще одним важным вопросом, который должен тщательно рассмотреть (и потенциально адаптированы). Это вытекает из того факта, что некоторые антитела анти CD8 клоны блок связывание тетрамера с TCR, в человека32 , а также мыши33 образцы. Для наших Тетрамер пятнать протокол, мы выбрали клон 53 – 6.7 пятно для мышиных CD8+ клетки — клон, который не блокировать, но скорее укрепляет Тетрамер пятнать.
Тетрамер пятнать довольно несложный, при анализе известных иммунные реакции на пике реакции клеток T, например. Однако возможно, населения, которые являются немного более «проблемных». Такие примеры включают в себя клетки, специфичных для низкого сродства антигены (опухоли, самоуправления), недавно активированных клеток, который впоследствии вниз регулирует их рецепторов или подмножества редких ячейки (например,. наивно прекурсоров или памяти клеточных популяций). В этих случаях классическая Тетрамер пятнать протокол может потребоваться быть улучшены или в сочетании с другими методами. К примеру протеин киназы ингибитора (PKI) dasatinib препятствует TCR интернализации и могут быть включены до Тетрамер пятнать. Тетрамера также могут быть стабилизированы, включая анти флюрохром неконъюгированной первичной Abs после Тетрамер пятнать. Кроме того интенсивность флуоресценции может быть увеличена добавлением второй анти Ab конъюгированных флюрохром Ab29,34,35,36. Мы оптимизированные условия выборочно для тетрамера, указанных в настоящем Протоколе и не включают PKI или дополнительных Abs. Однако для любых других Тетрамер, оптимальные условия должны корректироваться индивидуально. Что касается редких населения Тетрамер пятнать может потребоваться сочетаться с магнитного обогащения11.
Для облегчения и проверить анализ СУИМ Тетрамер окрашивание, негативные и позитивные элементы должны быть включены. Как отрицательный контроль мы всегда пятно клетки мыши наивный же штамма с нашими Тетрамер интерес. Кроме того образцы могут быть окрашены с тетрамера с нерелевантных пептиды, но с же флюрохром как Тетрамер интерес. Такие элементы управления имеют важное значение для исключения ложных положительных сигналов, например., из умирающих клеток. Помимо этого рекомендуется включать жить/мертвые пятна, например пропидий йодидом (PI). Это имеет особое значение, если ячейки не окрашенные непосредственно после изоляции. Еще одна стратегия для удаления фона аутофлюоресценция бы включить несколько маркеров Т клеток в одном канале. Исключая инфицированных клеток в этот канал, могут быть исключены T клеточных популяций. Как позитивный элемент образец из мыши OT-1 может использоваться для Тетрамер OVA, например. Для других тетрамера, это должен быть выбран индивидуально (например., образец от мыши, который было иммунизировано несколько раз). Так другие37, мы также наблюдаем вниз регулирование рецептора CD8 во время активации CTL на 7 день эффекторных клеток T ответ. Таким образом, чтобы избежать потери клеток-эффекторов Т активированного Тетрамер+ , мы рекомендуем включитьнизкой CD8 клетки в анализ (по крайней мере если измерения в фазе эффекторных).
Качество и количество информации, которую один можно получить из этого протокола зависит от знания о антигена изучаться, доступность и специфики Тетрамер и качество машины СУИМ (количество доступных детекторов и лазеры). При работе с животных образцы, изменения в иммунном ответе является естественным и неизбежным. Таким образом чтобы получить значимые результаты от Тетрамер окрашивание, по крайней мере 3-5 животных должны быть проанализированы. Если это сделано, протокол, описанные здесь даст надежных и воспроизводимых результатов (образцовый результат от одного эксперимента можно найти в Дополнительной таблице 1). Как упоминалось ранее, этот метод идеально подходит для количественного определения фенотипа и антиген специфика CD8+ Т-клеток (рис. 3, 4; Дополнительные рис. 1), не только в мышь, но и в организме человека. Однако для анализа CD8+ Т-клеток-эффекторов функции, такие как Гранзим индуцированной клеточной гибели, ICS или ELISpot должны быть выполнены. Однако следует иметь в виду, что функции клеток T, как измеряется в пробирке стимуляции может не представляют фактическое положение в естественных условиях. В естественных условиях, подавляющих окружающей среды могли бы предотвратить функции Т-клеток, которые измеряются в лабораторных условиях.
На свой собственный, Тетрамер окрашивания не предоставляет всю информацию, но она эволюционировала, чтобы стать важным методом для характеристики Т-клеток ответов и количественного определения подмножества Т-клеток in vitro в очень чувствительных образом38. Тетрамера не может использоваться только для количественно определенных подмножеств, но и для изолировать те39, локализовать их путем гибридизации in situ19,20 и изучения антигены низкого сродства, например опухольассоциированных40, 41. с момента открытия Тетрамер технологии4, окрашивание Тетрамер стал важным инструментом анализа Т-клеток и спектр применения.
Раскрытие информации
Доротея фон Laer изобретатель VSV-GP и держит что меньшинством акций в биотехнологической компании ViraTherapeutics GmbH, которая держит прав интеллектуальной собственности для VSV-GP. Для других авторов существует без финансовых интересов.
Благодарности
Этот проект финансировался Фондом Австрии науки FWF (номер P 25499-B13 проекта) и Европейского союза Horizon 2020 исследований и инновационной программы под предоставить соглашение № 681032. Следующие реагент был получен через низ Тетрамер Core: класс I MHC Тетрамер для Нуклеопротеиды вирус везикулярного стоматита (RGYVYQGL).
Материалы
| Name | Company | Catalog Number | Comments |
| Safety cabinet class 2 | VWR | LBCP302411030 | |
| Flow cytometer (e.g. FACSCanto II) | BD | 338962 | |
| Analysis platform for flow cytometry analysis (e.g. FlowJo) | Fisher Scientific Co. L.L.C. | NC0887833 | |
| Binocular microscopes, VisiScope 100 | VWR | 630-1553 | |
| Vortex mixer | Phoenix Instrument | RS-VA 10 | |
| Centrifuge suitable for FACS tubes (e.g. Rotanta 460R) | Hettich | 5660 | |
| Sterile Scalpel Blades Nr. 10 | Braun | BB510 | |
| Cell strainer 40 µm | Sigma | CLS431750 | |
| Cell strainer 70 µm | Sigma | CLS431751 | |
| Neubauer counting chamber | VWR | 630-1506 | |
| Pipettes (20 μL, 200 µL and 1000 μL) | Eppendorf | 4924000037, 4924000061, 4924000088 | |
| Pipette tips, sterile (20 µL, 200 µL, 1,000 µL) | Biozym | 770050, 770200, 770400 | |
| Pipet Boy | Integra | 155 000 | |
| Sterile pipettes (5 mL, 10 mL, 25 mL) | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Multistep Pipette, HandyStep S | BRAND | 705110 | |
| 12.5 mL Combitips for Multistep Pipette | BrandTech Scientific | 702378 | |
| Microvette CB 300 K2E | Sarstedt | 16.444 | |
| Sterile reaction tubes (1.5 mL, 50 mL) | Sarstedt | 72.692.005, 62.547.254 | |
| FACS tubes (non-sterile) | Szabo Scandic | BDL352008 | |
| PBS | Lonza | LONBE17-516F | |
| Heat-inactivated FCS | ThermoFisher Scientific | 10500064 | |
| Formaldehyde | Roth | 4979.1 | |
| Sodium azide | Roth | K305.1 | |
| PE-Cy7 Rat Anti-Mouse CD3 Molecular Complex | BD | 560591 | Clone 17A2; Lot # 7235504 |
| Pacific Blu Rat Anti-Mouse CD8a | BD | 558106 | Clone 53-6.7; Lot # 5058904 |
| V450 Rat anti-Mouse CD8a | BD | 560469 | Clone 53-6.7; Lot # 5205945 |
| FITC anti-mouse CD43 | BioLegend | 121206 | Clone 1B11; Lot # B233778 |
| PE-Cy5 Rat Anti-Mouse CD44 | BD | 553135 | Clone IM7; Lot # 85660 |
| APC-Cy7 Rat Anti-Mouse CD62L | BD | 560514 | Clone MEL-14; Lot # 7215801 |
| OVA-tetramer/APC | MBL | TB-5001-2 | SIINFEKL, H-2Kb; Lot # T1702008 |
| VSV NP-tetramer/PE | MBL | TS-M529-1 | RGYVYQGL, H-2Kb; Lot # 007 |
| EGFP-tetramer/PE | MBL | TS-M525-1 | HYLSTQSAL, H-2Kd; Lot # 004 |
| LCMV-GP-tetramer/APC | MBL | TB-5002-2 | KAVYNFATC, H-2Db; Lot # T1412006 |
| HPV 16 E7-tetramer/APC | MBL | TB-5008-2 | RAHYNIVTF, H-2Db; Lot # T1804003 |
Ссылки
- Tober, R., et al. VSV-GP: a potent viral vaccine vector that boosts the immune response upon repeated applications. Journal of virology. 88 (9), 4897-4907 (2014).
- Muik, A., et al. Re-engineering vesicular stomatitis virus to abrogate neurotoxicity, circumvent humoral immunity, and enhance oncolytic potency. Cancer Reseaerch. 74 (13), 3567-3578 (2014).
- Eales, L. J., Farrant, J., Helbert, M., Pinching, A. J. Peripheral blood dendritic cells in persons with AIDS and AIDS related complex: loss of high intensity class II antigen expression and function. Clinical and Experimental Immunology. 71, 423-427 (1988).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- . Tetramers and Monomers Available from: https://www.mblintl.com/products/research/monomer-tetramers/filter/product_type/monomer (2016)
- Wolfl, M., et al. Quantitation of MHC tetramer-positive cells from whole blood: evaluation of a single-platform, six-parameter flow cytometric method. Cytometry A. 57 (2), 120-130 (2004).
- Burrows, S. R., et al. Peptide-MHC class I tetrameric complexes display exquisite ligand specificity. The Journal of Immunology. 165 (11), 6229-6234 (2000).
- Sims, S., Willberg, C., Klenerman, P. MHC-peptide tetramers for the analysis of antigen-specific T cells. Expert Review of Vaccines. 9 (7), 765-774 (2010).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. The Journal of Visualized Experiments. (68), (2012).
- Xie, Y., et al. A novel T cell-based vaccine capable of stimulating long-term functional CTL memory against B16 melanoma via CD40L signaling. Cellular & Molecular Immunology. 10 (1), 72-77 (2013).
- Nanjundappa, R. H., Wang, R., Xie, Y., Umeshappa, C. S., Xiang, J. Novel CD8+ T cell-based vaccine stimulates Gp120-specific CTL responses leading to therapeutic and long-term immunity in transgenic HLA-A2 mice. Vaccine. 30 (24), 3519-3525 (2012).
- Bowers, E. V., Horvath, J. J., Bond, J. E., Cianciolo, G. J., Pizzo, S. V. Antigen delivery by alpha(2)-macroglobulin enhances the cytotoxic T lymphocyte response. Journal of Leukocyte Biology. 86 (2), 1259-1268 (2009).
- Guo, H., Baker, S. F., Martinez-Sobrido, L., Topham, D. J. Induction of CD8 T cell heterologous protection by a single dose of single-cycle infectious influenza virus. The Journal of Immunology. 88 (20), 12006-12016 (2014).
- Sakai, K., et al. Dendritic cell-based immunotherapy targeting Wilms' tumor 1 in patients with recurrent malignant glioma. Journal of Neurosurgery. 123 (4), 989-997 (2015).
- Rosaely, C. G., et al. Immune responses to WT1 in patients with AML or MDS after chemotherapy and allogeneic stem cell transplantation. International Journal of Cancer. 138 (7), 1792-1801 (2016).
- Shane, H. L., Reagin, K. L., Klonowski, K. D. The Respiratory Environment Diverts the Development of Antiviral Memory CD8 T Cells. The Journal of Immunology. , (2018).
- Li, S., Mwakalundwa, G., Skinner, P. J. In Situ MHC-tetramer Staining and Quantitative Analysis to Determine the Location, Abundance, and Phenotype of Antigen-specific CD8 T Cells in Tissues. The Journal of Visualized Experiments. (127), e56130 (2017).
- De Vries, I. J. M., et al. In situ detection of antigen-specific T cells in cryo-sections using MHC class I tetramers after dendritic cell vaccination of melanoma patients. Cancer Immunology Immunotherapy. 56 (10), 1667-1676 (2007).
- Tan, H. X., et al. Induction of vaginal-resident HIV-specific CD8 T cells with mucosal prime-boost immunization. Mucosal Immunology. , (2017).
- Huang, H., et al. CD8(+) T Cell Immune Response in Immunocompetent Mice during Zika Virus Infection. Journal of Virology. 91 (22), (2017).
- Hensel, M. T., et al. Selective Expression of CCR10 and CXCR3 by Circulating Human Herpes Simplex Virus-Specific CD8 T Cells. Journal of Virology. 91 (19), (2017).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21 (1), 15-23 (2001).
- San Jose, E., Borroto, A., Niedergang, F., Alcover, A., Alarcon, B. Triggering the TCR complex causes the downregulation of nonengaged receptors by a signal transduction-dependent mechanism. Immunity. 12 (2), 161-170 (2000).
- Dietrich, J., Hou, X., Wegener, A. M., Geisler, C. CD3 gamma contains a phosphoserine-dependent di-leucine motif involved in down-regulation of the T cell receptor. EMBO Journal. 13 (9), 2156-2166 (1994).
- Schone, D., et al. Immunodominance of Adenovirus-Derived CD8(+) T Cell Epitopes Interferes with the Induction of Transgene-Specific Immunity in Adenovirus-Based Immunization. Journal of Virology. 91 (20), (2017).
- Dolton, G., et al. More tricks with tetramers: a practical guide to staining T cells with peptide–MHC multimers. Immunology. 146 (1), 11-22 (2015).
- Whelan, J. A., et al. Specificity of CTL Interactions with Peptide-MHC Class I Tetrameric Complexes Is Temperature Dependent. The Journal of Immunology. 163 (8), 4342-4348 (1999).
- Wooldridge, L., et al. Tricks with tetramers: how to get the most from multimeric peptide–MHC. Immunology. 126 (2), 147-164 (2009).
- Denkberg, G., Cohen, C. J., Reiter, Y. Critical role for CD8 in binding of MHC tetramers to TCR: CD8 antibodies block specific binding of human tumor-specific MHC-peptide tetramers to TCR. The Journal of Immunology. 167 (1), 270-276 (2001).
- Daniels, M. A., Jameson, S. C. Critical role for CD8 in T cell receptor binding and activation by peptide/major histocompatibility complex multimers. The Journal of Experimental Medicine. 191 (2), 335-346 (2000).
- Tungatt, K., et al. Antibody stabilization of peptide-MHC multimers reveals functional T cells bearing extremely low-affinity TCRs. The Journal of Immunology. 194 (1), 463-474 (2015).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. Journal of Immunological Methods. 340 (1), 11-24 (2009).
- Rius, C., et al. Peptide-MHC Class I Tetramers Can Fail To Detect Relevant Functional T Cell Clonotypes and Underestimate Antigen-Reactive T Cell Populations. The Journal of Immunology. 200 (7), 2263-2279 (2018).
- Xiao, Z., Mescher, M. F., Jameson, S. C. Detuning CD8 T cells: down-regulation of CD8 expression, tetramer binding, and response during CTL activation. The Journal of Experimental Medicine. 204 (11), 2667-2677 (2007).
- McMichael, A. J., O'Callaghan, C. A. A New Look at T Cells. The Journal of Experimental Medicine. 187 (9), 1367-1371 (1998).
- Hunsucker, S. A., et al. Peptide/MHC tetramer-based sorting of CD8(+) T cells to a leukemia antigen yields clonotypes drawn nonspecifically from an underlying restricted repertoire. Cancer Immunology Research. 3 (3), 228-235 (2015).
- Pittet, M. J., et al. Ex vivo analysis of tumor antigen specific CD8+ T cell responses using MHC/peptide tetramers in cancer patients. International Immunopharmacology. 1 (7), 1235-1247 (2001).
- Cohen, C. J., et al. Isolation of neoantigen-specific T cells from tumor and peripheral lymphocytes. The Journal of Clinical Investigation. 125 (10), 3981-3991 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены