Method Article
Anti-vektör ve Anti transgene özel CD8 eşzamanlı miktar+ T hücreleri MHC ile ben Tetramer sonrasi hipererjik bir Viral vektör ile boyama
Bu Makalede
Özet
Burada, eski için bir iletişim kuralı mevcut antijen spesifik CD8 vivo nitel tespiti+ T hücreleri. Analiz tek hücre süspansiyonlar organları veya küçük miktarda kan ile mümkündür. Çok çeşitli çalışmalar sitotoksik T hücre yanıt (aşı ve kanser immünoterapi çalışmaları) analizini gerektirir.
Özet
Viral enfeksiyon, antijen spesifik CD8 üzerine+ sitotoksik T hücreleri (CTL) ortaya çıkan ve patojenler yayılmasını önlemek için enfekte hücreleri ortadan kaldırılması için katkıda bulunmak. Bu nedenle, antijen spesifik CTL'ler sıklığını T hücre yanıtı spesifik antijen karşı güç göstergesidir. Bu tip çözümlemeler temel İmmünoloji, aşı geliştirme, kanser immunobiology ve adaptif İmmünoloji önemlidir. Aşı alanında bir viral vektör bileşenleri karşı yönetmen CTL yanıt ne kadar etkili faiz (yani, transgene) antijen karşı antijen spesifik hücreleri nesil birlikte belirler. Antijen spesifik CTL'ler ya stimülasyon tarafından belirli peptidler ardından akış sitometresi tarafından hücre içi sitokin boyama veya antijen spesifik T hücre reseptör (TCRs) doğrudan boyama analizi ile tespit edilebilir. Organ hücreleri izole hayvanların ödün gerektirdiğinden ilk yöntem oldukça zaman alır. Ayrıca, yalıtım yapmak zor olan küçük hayvan kanı gerektirir. İkinci yöntemi oldukça hızlı, küçük miktarda kan ile kolayca yapılabilir ve cytolytic etkinliği gibi belirli efektör fonksiyonları bağımlı değildir. MHC tetramers antijen spesifik TCRs algılamak için ideal bir araç vardır.
Burada, biz aynı anda antijen spesifik viral vektör VSV-GP immunodominant peptidler için CTL (LCMV-GP, VSV-NP) ve transgenes (OVA, HPV 16 E7, eGFP) tarafından MHC algılamak için bir protokol tarif ben tetramer boyama ve akış sitometresi. Boyama, doğrudan kan veya tek hücre süspansiyonlar dalak gibi organların mümkündür. Kan ya da tek hücre süspansiyonlar organların tetramers ile inkübe. CD3 ve CD8 karşı antikorlar ile boyama sonra antijen spesifik CTL'ler akış sitometresi tarafından sayısal. İsteğe bağlı olarak, antikorlar CD43, CD44, CD62L veya başkalarına karşı antijen spesifik CD8 etkinleştirme durumunu belirlemek için eklenebilir+T hücreleri ve naif ve efektör hücreler arasında ayırımcılık için.
Giriş
Bu yöntem, akış sitometrik çözümlemesi ezelî belgili tanımlık lüzum için zaman alıcı peptid dürtme tarafından fare (birden fazla) antijenleri sitotoksik T lenfosit (CTL) yanıt sıklığını değerlendirmek için amaçtır. Bu yöntem CTL alt kümeleri içinde bir tek boyama, fenotip ve antijen özgüllük inceliyor. Biz en iyi duruma getirilmiş Binbaşı MHC kompleksi ben (MHC ben) protokolü VSV-GP, nereye G VSV glikoprotein yerini almış tarafından vesicular Stomatit virüsünün (VSV), yeni bir türevi gibi yeni aşı yaklaşımların etkinliğini çözümlemek için boyama tetramer glikoprotein GP lenfositik choriomeningitis virüs (LCMV)1,2. Humoral yanıt yanı sıra, indüksiyon bir CTL yanıt bir veya daha fazla antijenlere karşı bir aşı etkinliğini önemli bir okuma var. Tutarlılık ve hücresel yanıt dayanıklılığını bu bağlamda önemli olduğundan, aynı hayvan CTL tepkilerin kinetik izlemek için olumlu. Bu da hayvan sayıları, "3Rs"3prensipleri ile ilgili önemli bir yönü bir azalma yol açacaktır. Bu nedenle, az 20 µL Kan analizinden bu amaç için en uygunudur.
Tetramers geç 90 lı yıllarda geliştirilmiş4 ve T hücre İmmünoloji alanında önemli bir araç haline geldi. Tetramers dört MHC fluorescently etiketli kompleksleri vardır ben / TCRs, tek bir peptid için belirli bağlama peptid molekülleri. Günümüzde, onlar da hazır5özel sipariş, satın alınabilir ücretsiz olan Emory Üniversitesi6 NIH Tetramer çekirdek tesisinde veya üretilen laboratuvar7. MHC ı ve II tetramers çoğu CD8 için yani kullanılabilir, + ve CD4+ T hücreleri, anılan sıraya göre. Tetramer boyama etki gücüne zaman tasarrufu, oldukça basit ve kolay8 protokolleri ve duyarlılık9standartlaştırmak yatıyor. Ayrıca, Eğer kan ile çalışma, hayvanlar kurban edilmesi gerek yoktur ve örnek en az miktarda gerekmez. Bir ölçüm için tek bir antijen sınırlı değildir, ama birkaç antijenleri tetramers birleştirerek farklı fluorophores ile Birleşik zaman bir boyama olarak analiz edilebilir. Örneğin--dan peptid perde, yeni keşfedilen antijenleri kolayca tetramers içinde dahil ve T hücre alt miktar için kullanılan.
Tetramer boyama (i.e., sitokin üretimi, efektör fonksiyonları), CTL işlevselliği hakkında bilgi sadece özgüllük vermeyecektir. T hücre işlevi, hücre içi sitokin (ICS) boyama veya enzim bağlantılı IMMUNO Spot (ELISpot) tahlil olması gereken hakkında bilgi elde etmek için8,10gerçekleştirilen. Tetramer boyama ve ICS/ELISpot, ancak, gereksiz değildir ama oldukça birbirini tamamlar. İn vitro stimülasyon sitokin üretim ICS/ELISpot için ikna etmek için orijinal T hücre fenotip değiştirecek. Tetramer boyama, buna ek olarak, T hücre el değmemiş bırakır; özgün fenotip korunur ve analiz edilebilir. Ayrıca, başka bir büyük tetramers boyama manyetik sıralama ve zenginleştirme antijen spesifik hücreleri11ile kombine edilebilir olduğunu avantajdır. Bu tanımlanmış antijen-özelliklerine ile sıralanmış hücre kültürü çalışmalarının yanı sıra, nadir nüfus analizi sağlar — olan bir özellik değil diğer yöntemleri ile mümkün.
Burada açıklanan protokol, tetramer boyama, ICS/ELISpot kullanılarak yapılabilir bir organ dan çünkü sadece çok az malzeme (kan: 20 µL; dalak: 1 x 106 hücreler) tetramer boyama için gereklidir. Ancak, faiz antijen spesifik hücrelerinin sıklığı, bağlı olarak ilgili TCR ve deneysel içerik gücünü, hücreler gerekli miktarda ölçekli gerekebilir veya manyetik zenginleştirme uygulanması gerekebilir.
Tetramers yaygın olarak kullanılan, örneğin (antitümör) aşılar12,13,14,15 ya da immünoterapi16,17, fenotipik analiz etkinliğini değerlendirmek için ve mekansal Yerelleştirme antijen spesifik T hücre alt kümeleri18,19,20,21,22,23. Burada açıklanan yöntemi olan miktar ve fare antijen spesifik CD8 fenotipik analizi dahil etmek amacı çalışmalar için uygundur+ T hücreleri onların analizde hızlı ve uygun bir şekilde.
Protokol
Tüm yöntem tanımlamak Avusturya Ulusal hayvan deney yasa ile uyumlu ("Tierversuchsgesetz") gerçekleştirilen ve hayvan deneme izin Avusturya ulusal yetkililer tarafından verildi.
1. arabellek hazırlık ve örnek koleksiyonu
Not: Kullanılan fare zorlanma analiz epitope bağlıdır. Fareler, örneğin ifade bir MHC türü, C57BL/6 fareler için H - 2 Kb bağlar uygun bir tetramer seçin. Cinsiyet ve yaş hayvanların bilimsel soru bağlı olacaktır. Açıklanan deneyler çoğu için burada, dişi fareler 6 – 8 haftalık deneme, yani, ilk aşılama, kullanın.
- Hazırlamak FACS arabellek (fosfat tamponlu tuz çözeltisi (PBS) + % 1 fetal buzağı serum (FCS) + % 0,1 Sodyum azid + 2 mM Ethylenediaminetetraacetic asit (EDTA) ve FACS sabitleme arabellek (PBS %1,5 (v/v) formaldehit).
Not: Bu her iki arabellekleri önceden hazırlanmış tavsiye edilir. 4 ° C'de kadar kullanmak saklı. - Kan: tüpler, EDTA kaplı fare kuyruğu damardan kan fare başına 20 µL toplamak24daha önce açıklandığı gibi.
Not: Kan da diğer yolları, örneğin, vena Fasiyalis veya retro-orbital sinüs tarafından toplanabilir. Ancak, kan toplama yöntemi ulusal hayvan deney hukuk ve hayvan deneme uygulamaları ile uyumlu olmak zorunda. Kuyruk damardan kan toplanması nerede art arda küçük miktarda kan gerekli olan çalışmaları için idealdir. Ek malzeme tazminat ve sigara lekeli denetimi için gereklidir. - Dalak: org yalıtmak ve enjektör pompası yardımıyla, bir 70 nm ve 40 µm hücre süzgeç tuşuna basın. Eritrositler, lizis adım 6 ve sayısı bölümünde açıklandığı gibi gerçekleştirin. 1 x 107 hücre/mL PBS için konsantrasyon ayarlayın. Örnek, 1 x 106 hücreler gereklidir.
Not: Her zaman bazı sahte aşı veya aşı vektör hayvanlar negatif kontrol kontrol. Ovalbumin (OVA) için-tetramer, OT-1 fareler bir örnek pozitif kontrol olarak kullanılan. Günahı unutmayın ve hesaplama tazminat denetimleri. Gerekirse, bunun için farklı hayvan deneyinde örnekleri havuza. - Örnek toplandıktan sonra doğrudan boyama ile devam edin.
2. Kurulum boyama
- Bir FACS tüp her örnek için hazırlayın. Tüpler düzgün etiket ve organ süspansiyon (1 x 106 hücreleri), 100 μL veya kan 20 μL her tüpün içine aktarın.
- Dalak: 600 x g 4-8 ° c de 5 dk santrifüj kapasitesi ve süpernatant atın. Girdap hücre Pelet resuspend.
Not: Bu da kalan hacmi yaklaşık 20 µL kan örnekleri için birim olarak benzer yol açar. - Her kanal için de kullanılacak bir FACS tüp bir tazminat örnek için hazır olun. Bir ek örnek bir günahı denetimi olarak hazırlayın.
3. tetramer boyama
-
Her örnek için tetramer seyreltme 50 μL kullanın. Önerilen tetramers ve en iyi duruma getirilmiş dilutions için tablo 1'e bakın.
Not: Tetramers veya antikorlar ile çalışırken, güvenlik ışıkları kapat dolap çevirmek ve örnekleri ışıktan korumak.- Tüp bir FACS arabelleği ile hazırlamak (birim 50 μL × örnekleri sayısı artı ek pipetting hataları telafi etmek için toplam hacminin % 10 =).
- Tetramer(s) en iyi seyreltme Tablo 1' de listelenen gibi ekleyin. Girdap çözüm.
Not: Bütün antikor paneli (CD3, CD8, CD43, CD44, CD62L) ile listelenen fluorophores kullanırken, iki tetramers (içinde PE ve APC) dahil edilebilir. Her iki tetramers bir tek boyama içinde birleştirilebilir yani, her iki tetramers içeren hücrelerin boyama yapılabilir aynı anda.
| Tetramer | Peptit dizisi | Gen | Fluorophore | Seyreltme |
| MHC I / OVA | SIINFEKL | H - 2Kb | APC | 1:25 |
| MHC I/VSV-NP | RGYVYQGL | H - 2Kb | PE | 1:25 |
| MHC I / EGFP | HYLSTQSAL | H-2Kd | PE | 1:25 |
| MHC I/LCMV-GP | KAVYNFATC | H-2Db | APC | 1:25 |
| MHC I / HPV 16 E7 | RAHYNIVTF | H-2Db | APC | 1:10 |
Tablo 1: önerilen tetramers ve en iyi dilutions. Bazı immunodominant peptidler modeli antijenleri (Ovalbumin (OVA) ve gelişmiş yeşil flüoresan protein (eGFP)) veya patojen bileşenleri (Vesicular Stomatit virüs (VSV) nükleoprotein (NP), lenfositik Choriomeningitis virüs (LCMV için önerilen tetramers ) Glikoprotein (GP) ve insan Papilloma Virus (HPV) E7 oncoprotein (E7)). Her için peptit dizisi ve karşılık gelen alleli, de önerilen fluorophore ve en iyi duruma getirilmiş seyreltme listelenir.
- 50 μL tetramer seyreltme her örnek ve girdap yavaşça ekleyin. FACS arabellek yalnızca (tetramer) olmadan tazminat denetimleri ve günahı örnek ekleyin.
- Örnekleri ışıktan korunan 37 ° C'de 20 dk için kuluçkaya. Antikor boyama tetramer sorunsuz bir geçiş sağlamak için kuluçka süre içinde adım 4'te açıklandığı gibi antikor karışımı hazırlayın.
Not: Her bireysel tetramer için optimal koşullar (seyreltme, kuluçka zaman ve sıcaklık) ayarlanması gerekir.
4. antikorların hazırlanması
-
Her örnek için antikor Mix 50 µL hazırlayın.
- Tüp bir FACS arabelleği ile hazırlamak (birim 50 μL × örnekleri sayısı artı ek pipetting hataları telafi etmek için toplam hacminin % 10 =).
- Antikorlar dilutions içinde Tablo 2' de listelenen gibi ekleyin.
Not: Bilimsel soru bağlı olarak, burada açıklanan dışında diğer işaret kombinasyon kullanılabilir olur. Her zaman panelinde CD3 ve CD8 karşı antikor eklediğinizden emin olun. - Girdap çözüm.
| Antikor | Fluorophore | Seyreltme | µg/örnek | Marker |
| CD3 | PE-Cy7 | 1: 200 | 0,05 | CTL'ler (CD3+CD8+) |
| CD8 | Pasifik mavi | 1:750 | 0,013 | |
| V450 | 1: 100 | 0,1 | ||
| CD43 | FITC | 1: 100 | 0,25 | Harekete geçirmek (CD43+) |
| CD44 | PE-Cy5 | 1:250 | 0,04 | Naive (CD44-CD62L+) & efektör (CD44+CD62L-) |
| CD62L | APC-Cy7 | 1:500 | 0,02 |
Tablo 2: Bu protokolü ve en iyi dilutions kullanılan antikorlar. Önerilen yüzey işaretleyicileri (CD3, CD8, CD43, CD44 ve CD62L) ilk sütununda listelenir. Her biri için önerilen fluorophore, en iyi duruma getirilmiş seyreltme ve antikor/örnek miktarı listelenir. Son sütununda her işareti ile belirlenen hücre türü belirtilir.
-
Antikorlar tazminat denetimler için hazırlayın. Her tazminat denetim için ilgili renkli bir antikor-CD8 karşı kullanın.
- Her kanal için bir tüp ile 200 μL FACS arabelleği hazırlamak ve CD8 karşı 1: 200 seyreltme antikor 1 μL ilgili renk ekleyin.
- Girdap tüpler.
- Hemen boyama ile devam edin.
5. boyama örnekleri
- 600 x g 4-8 ° C'de, ~ 1 mL FACS arabellek ve 5 min için santrifüj ekleyerek örnekler bir kez yıkamak Santrifüjü sonra süpernatant atmak ve bir yığın kağıt havlu üzerinde kalan sıvı kapalı drenaj.
Not: Kan ile çalışırken, kalan sıvı drene zaman dikkatli olun. Eritrositler lizis önce kan FACS tüp altına girmiyor. Alternatif olarak, süpernatant Aspire edin. - Antikor Mix 50 μL her hücre Pelet ve girdap yavaşça ekleyin.
- Her tazminat Mix 50 μL ilgili tazminat denetimi ve girdap hücre Pelet yavaşça ekleyin.
- FACS arabelleği 50 μL günahı kontrol ve girdap hücre Pelet yavaşça ekleyin.
- Tüm örnekleri için ışıktan korunan 4 ° C'de 30 dk kuluçkaya.
- Organları ile çalışırken: adım 6 atlamak. ~ 1-2 ekleyerek bir kez yıkama mL FACS arabellek ve vasıl 600 x g 4-8 ° C'de 5 dakika santrifüj Santrifüjü sonra süpernatant atmak ve bir yığın kağıt havlu üzerinde kalan sıvı kapalı drenaj.
- Kan ile çalışırken: adım 6 (eritrositler lizis) devam etmek.
6. eritrositler lizis
- ACK (amonyum klorür potasyum) tampon25 500 μL her örnek ve yavaşça girdap ekleyin.
Not: ACK arabellek ozmotik şişlik ve özellikle, eritrositler lizis yol açacaktır. - Karanlık oda sıcaklığında 5 min için kuluçkaya.
- 600 x g 4-8 ° C'de, FACS tampon ve santrifüj 5 min için 1 mL ekleyin Santrifüjü sonra süpernatant atmak ve bir yığın kağıt havlu üzerinde kalan sıvı kapalı drenaj.
Not: Pelet oldukça kırmızıdır, eritrositler lizis yineleyin. - ~ 1-2 ekleyerek bir kez yıkama mL FACS tampon ve vasıl 600 x g 4-8 ° C'de 5 dakika santrifüj Santrifüjü sonra süpernatant atmak ve bir yığın kağıt havlu üzerinde kalan sıvı kapalı drenaj.
7. akış sitometrik ölçüm ve analiz
- 150 – 300 μL FACS sabitleme arabelleği her tüp ve vortexing tarafından karıştırın. İçin 20 µL kan 150 µL arabelleği yeterli olur.
Not: Fiksasyon önce hücre kümeleri oluşumunu önlemek için de yeniden askıya alınmış olduğundan emin olun. Akış sitometrik ölçüm ile mümkün olduğunca hızlı bir şekilde devam edin. - Tazminat denetimleri ölçmek ve herhangi bir spektral programların çakışmasını düzeltin.
-
CD3 için seçmek için Şekil 1 ' deki gösterildiği gibi sıralı kapıları, ayarla+/CD8+ hücreleri.
- İleriye ve yana dağılım (alan) (sigara Logaritmik ölçek) kullanarak lenfositler kapıda.
- Lenfosit nüfusun içinde ileri dağılım genişliği vs alan (sigara Logaritmik ölçek) kullanarak tek hücre kapısı.
- Tek hücre lenfositlerin CD3 ve CD8 kanalları (Logaritmik ölçek) kullanarak çizmek. CD8 tanımlamak+ T hücreleri üzerinde CD3 çoğunluğuna tarafından+/CD8+ hücreleri.
- CD8 Arsa+ vs Tetramer+ hücreleri ve CD8 kapıya+ Tetramer+ hücreleri, Şekil 2' de gösterildiği gibi.
- Mümkünse, 20.000 hücreleri (en az 5.000 kan hücreleri) CD3 kayıt+/CD8+ kapısı her örnek için ve FCS dosyası olarak kaydedin.
Not: Kaydetmek için hücre miktarı faiz antijen spesifik hücrelerinin Frekansa göre ayarlanması gerekir. - FCS dosyaları uygun analiz yazılımı ile analiz. Perdeleme strateji (7,3 Bölüm) açıklandığı gibi kullanın ve CD8 ölçmek+ Tetramer+ hücreleri.
Sonuçlar
Şekil 1 gösterir nasıl doğru bir şekilde bu iletişim kuralı, yani CD3 hedef hücrelerin kapısı+/CD8+ hücreleri. Bu kez tümleyici T hücre reseptör26,27 hücreleri aktive Not için ve bu nedenle, CD3düşük hücreleri de geçişi dahil edilmelidir 's. CD3 çoğunluğuna sonra+/CD8+ hücreleri, hücre-ebilmek var olmak olumlu tetramer tespit (Şekil 2). Temsilcisi olarak Iyi hayvanlar ya da OVA salgılayan Adenovirus ile 5 (Adeno-OVA) aşı ya da OVA ifade VSV-GP (VSV-GP-OVA) gösterilir bir negatif kontrol (saf) fare için engelliyor. Alt lekesi iki farklı görüldüğü gibi tetramers aynı tüp boyama için kombine edilebilir. Bu iki farklı CTL özelliklerine aynı anda miktar sağlar: virüs özgü (VSV N) ve transgene özgü (OVA) CTL. Tek ve Çift Kişilik tetramer stainings her tetramer için pozitif hücrelerinin benzer oranlarda verdiğini doğruladı. Bu iletişim kuralı, diğer virüs özgü (e.g., LCMV GP, HPV 16 E7) kullanarak veya transgene özgü (e.g., GFP) T hücre popülasyonları olabilir analiz (Tamamlayıcı Şekil 1). Ek tablo 1' de, bağışıklama VSV-GP-OVA ile sonra beş hayvanlar için-den sonuçlanmak göstermek — tetramer boyama sağlamlık gösteren.
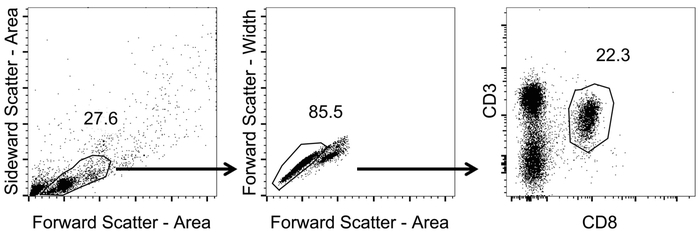
Resim 1: CD8 analiz etmek için strateji çoğunluğuna temsilcisi+ T kan hücreleri. Akış sitometrik çözümlemesi için kullanılan gating strateji şematik gösterimi. Tetramer boyama ve akış sitometrik ölçüm sonra veri analiz edildi. Lenfositler ileriye ve yana dağılım (alan) (sigara Logaritmik ölçek) ile tespit edilmiştir. Bu, ileri dağılım genişliği vs alan (sigara Logaritmik ölçek) uygulayarak tek hücreleri tespit edilmiştir. CD8+ T hücrelerin CD3 üzerinde Perdeleme tarafından tespit edildi+/CD8+ hücreleri (Logaritmik ölçek). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
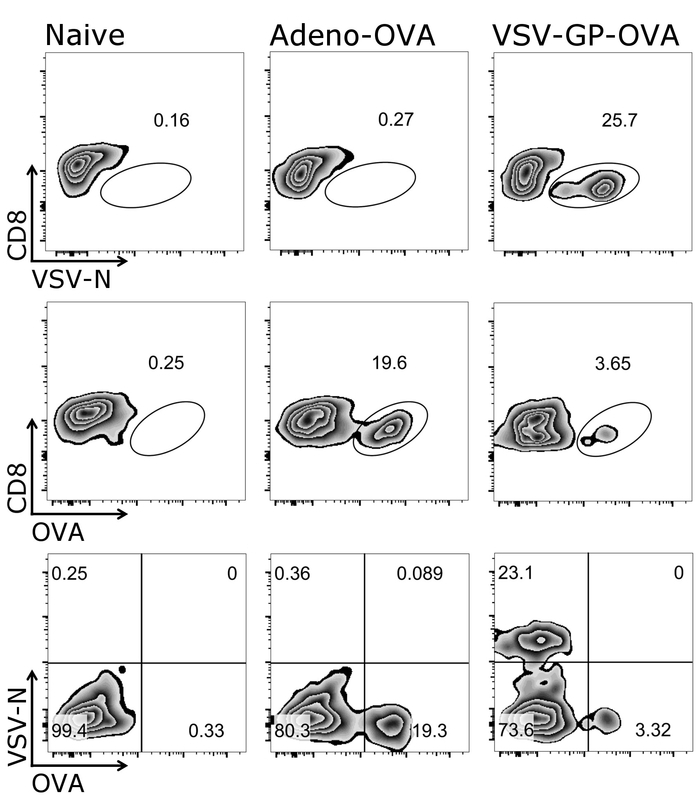
Resim 2: OVA ve N özel CD8 ölçmek için strateji çoğunluğuna temsilcisi+ T kan hücreleri. Akış sitometrik miktar tetramer+ hücre için kullanılan gating strateji şematik gösterimi. CD3+/CD8+ hücreleri tetramer analiz için kullanılmıştır. Üst ve orta paneli: CD8 işaretçiyi ilgili tetramer (Logaritmik ölçek) karşı çizildi. Alt paneli: her iki tetramers birbirine (Logaritmik ölçek) çizildi. Sol: denetimi (saf) fare; Orta: fare ile Adenovirus 5 (Adeno-OVA); OVA salgılayan aşı yapıldı. doğru: fare ovalbumin ile (OVA) aşı-VSV-GP (VSV-GP-OVA) ifade. Kan kuyruk ven gün 7 bağışıklama sonra toplanmıştır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
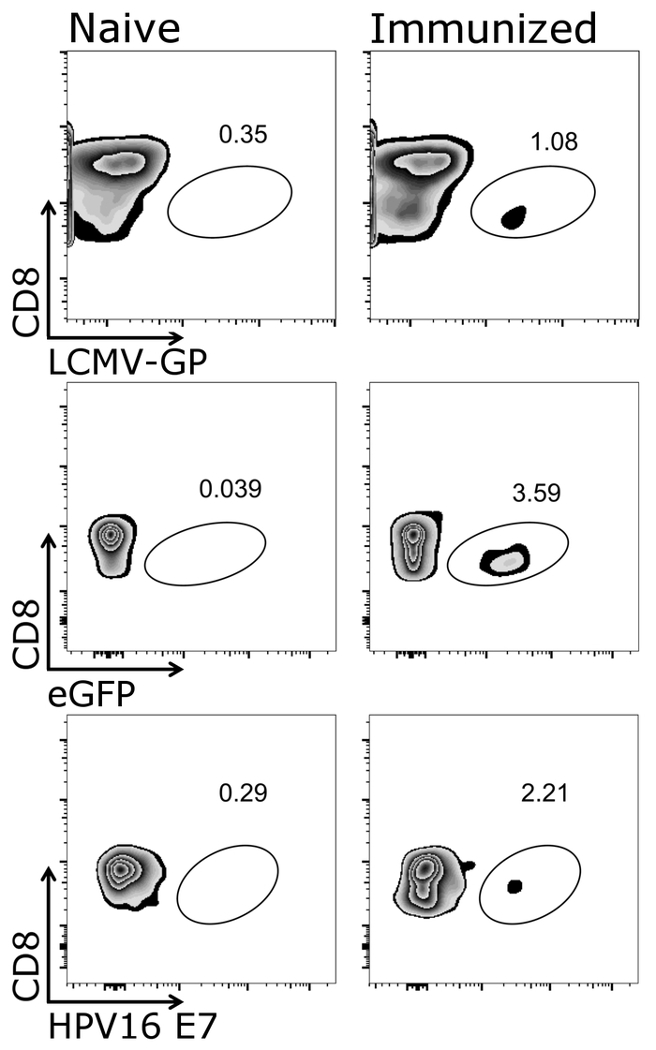
Ek resim 1: CD3 temsilcisi sonucu+/CD8+ sonrasi hipererjik tetramer+ hücreleri. Akış sitometrik miktar tetramer+ hücre şematik gösterimi. CD3+/CD8+ hücreleri tetramer analiz için kullanılan ve CD8 işaretçiyi ilgili tetramer (Logaritmik ölçek) karşı çizildi. Sol: fareler vardı saf, doğru: fareler VSV-GP ile (üst paneli) aşı, yeşil flüoresan Protein (eGFP) gelişmiş-VSV-GP (orta Masası) veya VSV-GP insan Papilloma Virus (HPV) E7 oncoprotein (E7) ifade ifade (alt paneli). Kan bağışıklama 7 günden kuyruk damar toplanan ve tetramers (LCMV-GP, eGFP ve HPV E7) ile lekeli. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Burada açıklanan protokol bir büyük avantajı sadece küçük miktarda kan her ölçüm için gerektiğinde aynı fare T hücre yanıtları zaman içinde izlenebilir olduğunu. Şekil 3 örnek sonuçları T hücre yanıt için zaman içinde gösterir. Antijen spesifik CTL'ler parametrelere ilaveten, onların fenotip da bu Protokolü (Şekil 4) kullanarak analiz edilebilir.
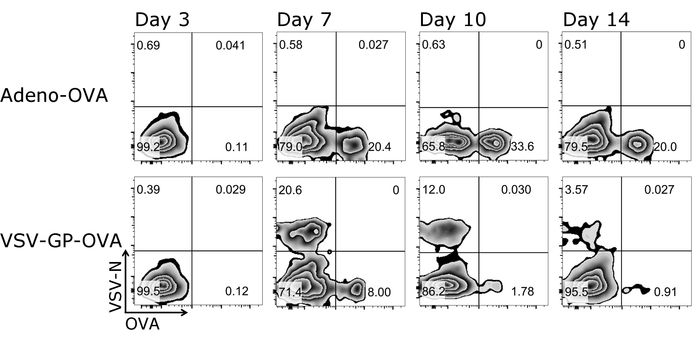
Şekil 3: Temsilcisi sonucu CD8+ T hücre kinetik sonrasi hipererjik kan içinde. Akış sitometrik miktar tetramer+ hücre için kullanılan gating strateji şematik gösterimi. CD3+/CD8+ hücreleri tetramer analiz için kullanılan ve her iki tetramers birbirine (Logaritmik ölçek) çizildi. Üst panelleri: fare ile Adenovirus 5 (Adeno-OVA); OVA salgılayan aşı yapıldı. alt paneller: fare ovalbumin ile (OVA) aşı-VSV-GP (VSV-GP-OVA) ifade. Kan kuyruk ven 3, 7, 10 ve 14 gün sonra aşılama toplanmıştır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
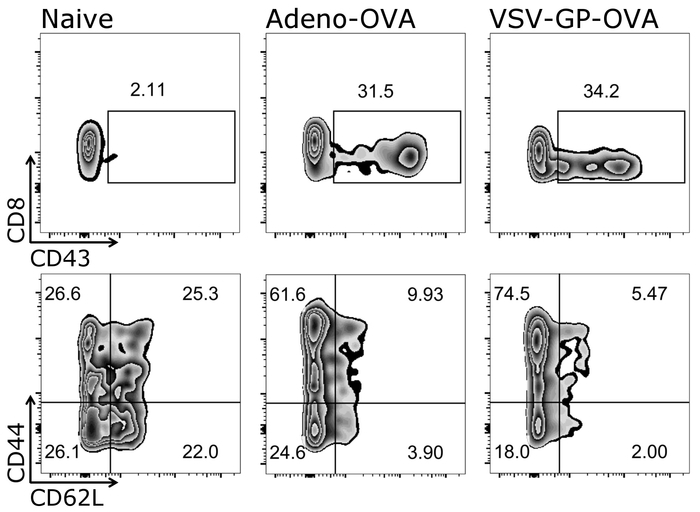
Şekil 4: Temsilcisi sonucu CD8+ T Hücre aktivasyonu ve sonrasi hipererjik naif ve efektör hücrelere farklılaşma. Akış sitometrik miktar için kullanılan gating strateji şematik gösterimi aktif (CD43+), saf (CD44-/CD62L+) ve efektör (CD44+/CD62L-) CD3+/CD8+ hücreleri () Logaritmik ölçek). Sol: denetimi (saf) fare; Orta: fare ile Adenovirus 5 (Adeno-OVA); OVA salgılayan aşı yapıldı. doğru: fare ovalbumin ile (OVA) aşı-VSV-GP (VSV-GP-OVA) ifade. Kan kuyruk ven gün 7 bağışıklama sonra toplanmıştır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Fare # | % CD43+ | % VSV-N Tetramer+ | % OVA Tetramer+ | |
| alay | 1 | 1.7 | 0,45 | 0,41 |
| 2 | 0.77 | 0,69 | 0,15 | |
| 3 | 1,34 | 0,35 | 0.31 | |
| 4 | 1,68 | 0,83 | 0,26 | |
| 5 | 0,84 | 0,47 | 0,23 | |
| VSV-GP-OVA | 1 | 23 | 13,2 | 3,69 |
| 2 | 32,6 | 15,9 | 3.54 | |
| 3 | 22,1 | 11,7 | 2.43 | |
| 4 | 15,1 | 8,89 | 1,79 | |
| 5 | 29.1 | 14,7 | 5.64 |
Ek tablo 1: Harekete geçirmek ve antijen spesifik CD3 oranlarda+/CD8+ hücreleri aşısından sonra. Fareler her iki saf olduğunu ya da ovalbumin ile (OVA) aşı-VSV-GP (VSV-GP-OVA) ifade (n = 5). Kan bağışıklama 7 günden kuyruk damar toplanan ve tetramers (VSV-N ve OVA) ile lekeli. Aktif (CD43+) ve antijen spesifik (tetramer+) CD3+/CD8+ hücreleri tarafından akış sitometresi sayısal.
Tartışmalar
Tetramer boyama T lenfosit fenotip ve peptid özgüllük analiz etmek için oldukça basit ve basit bir protokoldür. Kan analizi için kullanımı burada açıklandığı gibi minimal invaziv ve sürekli izlenmesi, örneğin aşılama çalışmaları sağlar. Vektör özel yanıt Aşı antijen28karşı etkili bir bağışıklık yanıtı engel gibi aşı alanında, vektör ve antijen spesifik yanıt miktar ilgi var. Not burada açıklanan protokolü ile her iki nüfus aynı anda içinde bir tek tetramer boyama, boyama değişkenliği ve örnek tutarlar böylece azaltmak sayısal ki var. Ancak, dikkatli bir şekilde doğru ölçüm ve güvenilir veri sağlamak için yapılması gereken bir kaç adım gerekir. Kuyruk damardan kan analiz için kullanılıyorsa, bir hayvan vazodilatasyon24ikna etmek için önceden ısıtmak emin olun. Böylece, yeterli kan kısa sürede toplanabilir, hayvanlar üzerinde stres azalır ve analiz Eğer kan yavaş yavaş toplanır, göre için iyidir. Ayrıca, örnek koleksiyon (kan veya organları) sonra doğrudan boyama TCR downregülasyon nedeniyle yanlış negatif sonuçlar önlemek için tavsiye edilir. Tüm sonraki adımlar için de geçerlidir: prosedür kesintiye ve tüm çamaşır adımları azaltmak için en az sayıda (olarak belirtilen iletişim kuralı). Uygun boyama emin olmak için girdap için tüm çözümleri ve örnekleri öncesinde ve kuluçka sonra özen gösterilmelidir. Bu hücrelerin topaklanma önlemek için örnekleri düzeltmeden önce özellikle önemlidir.
Protokol değiştirme açısından diğer yüzey işaretleyicileri ve tetramers, analiz amacı bağlı olarak kullanılabilir. Ancak, tüm reaktifler o zaman, en iyi şekilde paneli boyama bütün ile birlikte titre gerekir. Bazı burada belirtilen tetramers için üretici tarafından önerilen seyreltme artırabilir optimizasyonu ortaya (1:10 tavsiye, en iyi duruma getirilmiş 1:25) (Tablo 1). Spektral örtüşme telafi etmek için tazminat boncuk lekeli hücreler yerine kullanılabilir. Özellikle sinyal az olduğunda bu algılama - kolaylaştırır gibi tetramer birleştiğinde fluorochrome seçimi, parlak fluorochromes, kullanmak için bir göze ilgili. Dolton ve meslektaşları29, biz mükemmel bir tek boyama ve CD8 birleştirilebilir PE veya APC birleştiğinde tetramers kullanmayı tercih+ T hücreleri tek antijen özgüllük ile güzel olabilir (Şekil 2) algıladı. Sıcaklık ve kuluçka süreleri ile ilgili koşulları boyama tetramer çeşitli adlı biri yok. Bizim en iyi duruma getirme işleminde, bu sorun ve farklı koşullar (4 ° C, oda sıcaklığında veya 37 ° C) boyama tetramer gerçekleştirilen. Elde edilen sonuçları 37 ° C'de edebiyat30,31ile uyum içinde olan, 20 dk için leke için öneririz. Bu-ebilmek götürmek tetramer30 ve yanlış negatif sonuçlar içselleştirilmesi için uzun süreli kuluçka kaçınılmalıdır.
CD8 algılanması için doğru antikor seçimi+ hücreleri olduğunu dikkatle düşünülmüş (ve potansiyel olarak adapte) için bir başka önemli konu. Bu gerçeği bazı anti-CD8 antikor tetramers insan32 hem de fare33 örnekleri TCR için blok bağlama klonlar kaynaklanmaktadır. İletişim kuralı boyama bizim tetramer için biz klon için fare CD8 leke 53 – 6,7 seçilmiş+ hücreleri — hangi blok değildir ama oldukça tetramer boyama geliştirir bir klon.
Tetramer boyama önemli bağışıklık yanıtı T hücre yanıt doruğuna örneğin analiz ederken oldukça basit. Ancak, biraz daha 'sorunlu' olan nüfus olabilir. Hücreleri özel düşük benzeşme antijenleri için böyle örnekler (tümör, self), son etkinleştirilen hangi daha sonra aşağı düzenlenir hücreleri onların reseptörleri veya nadir hücre alt kümeleri (e.g. saf habercisi veya bellek hücre popülasyonlarının). Bu gibi durumlarda, protokolü boyama klasik tetramer geliştirilmiş veya diğer yöntemlerle kombine gerekir. Örneğin, protein kinaz inhibitörü (PKI) dasatinib TCR içselleştirilmesi engeller ve tetramer boyama önce eklenebilir. Tetramers da tetramer boyama sonra anti-fluorochrome çekimsiz birincil Abs dahil olmak üzere tarafından stabilize. Ayrıca, buna ek olarak bir ikinci Anti-Ab fluorochrome Birleşik Ab29,34,35,36tarafından floresan yoğunluğu artırılabilir. Biz koşulları seçerek bu protokol için belirtilen tetramers için en iyi duruma getirilmiş ve PKI veya ek Abs içermiyordu. Ancak, herhangi bir diğer tetramer için optimal koşullar ayrı ayrı ayarlanması gerekir. Nadir nüfus açısından tetramer boyama Manyetik Zenginleştirme11ile kombine edilebilir gerekebilir.
Kolaylaştırmak ve boyama tetramer analizini FACS doğrulamak için negatif ve pozitif denetimleri dahil edilmelidir. Bir negatif kontrol, her zaman ilgi bizim tetramer ile saf fare aynı yük hücreleri leke. Alternatif olarak, örnekleri ile tetramers alakasız peptidler, ama ilgi tetramer olarak aynı fluorochrome ile lekeli. Bu tür denetimler yanlış pozitif sinyaller, dışlamak için gerekli olan örneğin., ölmek üzere olan hücrelerden kaynaklanan. Buna ek olarak, propidium iyodür (PI) gibi bir canlı/ölü leke eklemek önerilir. Bu özel önemi ise hücreleri doğrudan yalıtım sonra lekeli değil. Autofluorescence arka planı kaldırmak için başka bir strateji bir kanalda birkaç T hücre işaretleri eklemek olabilir. Hücre pozitif bu kanaldaki hariç tutarak, T hücre popülasyonlarının dışlanabilir. Pozitif kontrol, bir OT-1 fare bir örnek örneğin OVA tetramer için kullanılabilir. Diğer tetramers için bu ayrı ayrı seçilecek vardır (e.g., birkaç kez aşı bir fareden örnek). Hem diğerleri37, biz de gözlemlemek aşağı Yönetmeliği CD8 reseptör T hücre yanıt efektör gün 7 CTL etkinleştirme sırasında. Bu nedenle, aktif tetramer+ efektör T hücrelerinin kaybı önlemek içindüşük CD8 hücreleri Analize dahil etmek için önerilir (en azından efektör aşamasında ölçme Eğer).
Biri bu protokolü alabilirsiniz bilgi miktarını ve kalitesini belirlenmesi için antigen hakkında bilgi, kullanılabilirlik ve özgüllük FACS makine (lazerler ve kullanılabilir dedektörleri sayısı) kalite ve tetramer bağımlı. Eğer hayvan örnekleri ile çalışma, bağışıklık yanıtındaki doğal ve kaçınılmaz çeşididir. Bu nedenle, boyama tetramer anlamlı sonuçlar elde etmek için en az 3-5 hayvanlar analiz edilmelidir. Eğer bitmiş öylesine, burada açıklanan Protokolü (örnek teşkil eden bir deney sonucu Ek tablo 1 bulunabilir) güvenilir ve tekrarlanabilir sonuçlar verecektir. Daha önce belirtildiği gibi bu yöntem fenotip ve antijen-CD8 özgüllüğü ölçmek için mükemmel uygundur+ T hücreleri (Şekil 3, 4; Tamamlayıcı Şekil 1), ama aynı zamanda insanlarda Mouse sadece. Granzyme indüklenen hücre ölümü, ICS ve/veya ELISpot lazım gibi yapılması ancak, CD8 analiz etmek için+ T hücre efektör, çalışmasını. Ancak, bir tüp bebek stimülasyon tarafından ölçülen T hücre fonksiyonları, gerçek durum içinde vivo gösterebilir değil akılda tutulması gereken. İn vivo baskılayıcı bir ortam tüp bebek ölçülür T hücre işlevlerini engelleyebilir.
Kendi, tetramer boyama tüm bilgi sağlamaz, ancak T hücre yanıt karakterize ve T hücre alt kümeleri içinde çok hassas şekilde38tüp bebek ölçmek için gerekli bir yöntem haline gelişti. Tetramers yalnızca kullanılamaz belirli alt kümeleri, ölçmek için aynı zamanda bu39izole, onları In situ hibridizasyon19,20 tarafından yerelleştirilmesine ve tümör ilişkili40, gibi düşük-benzeşme antijenleri çalışma için 41. tetramer teknoloji4keşfinden beri tetramer boyama T-hücre Analizi ve uygulama yelpazesi içinde önemli bir araç haline gelmiştir.
Açıklamalar
Dorothee von Laer VSV-GP bir mucidi ve biyoteknoloji firması ViraTherapeutics GmbH, VSV-GP için fikri mülkiyet hakları tutan azınlık hisse sahibidir. Diğer yazarlar için hiçbir rakip mali çıkarlarının adlı biri yok.
Teşekkürler
Bu proje FWF Avusturyalı bilim Fonu tarafından (proje numarası P 25499-B13) finanse edildi ve Avrupa Birliği'nin ufuk 2020 araştırma ve yenilik programı kapsamında Sözleşme No 681032 verin. Aşağıdaki reaktif NIH Tetramer çekirdek tesisi elde edildi: sınıf ı MHC Tetramer vesicular Stomatit virüs nükleoprotein (RGYVYQGL) için.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Safety cabinet class 2 | VWR | LBCP302411030 | |
| Flow cytometer (e.g. FACSCanto II) | BD | 338962 | |
| Analysis platform for flow cytometry analysis (e.g. FlowJo) | Fisher Scientific Co. L.L.C. | NC0887833 | |
| Binocular microscopes, VisiScope 100 | VWR | 630-1553 | |
| Vortex mixer | Phoenix Instrument | RS-VA 10 | |
| Centrifuge suitable for FACS tubes (e.g. Rotanta 460R) | Hettich | 5660 | |
| Sterile Scalpel Blades Nr. 10 | Braun | BB510 | |
| Cell strainer 40 µm | Sigma | CLS431750 | |
| Cell strainer 70 µm | Sigma | CLS431751 | |
| Neubauer counting chamber | VWR | 630-1506 | |
| Pipettes (20 μL, 200 µL and 1000 μL) | Eppendorf | 4924000037, 4924000061, 4924000088 | |
| Pipette tips, sterile (20 µL, 200 µL, 1,000 µL) | Biozym | 770050, 770200, 770400 | |
| Pipet Boy | Integra | 155 000 | |
| Sterile pipettes (5 mL, 10 mL, 25 mL) | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Multistep Pipette, HandyStep S | BRAND | 705110 | |
| 12.5 mL Combitips for Multistep Pipette | BrandTech Scientific | 702378 | |
| Microvette CB 300 K2E | Sarstedt | 16.444 | |
| Sterile reaction tubes (1.5 mL, 50 mL) | Sarstedt | 72.692.005, 62.547.254 | |
| FACS tubes (non-sterile) | Szabo Scandic | BDL352008 | |
| PBS | Lonza | LONBE17-516F | |
| Heat-inactivated FCS | ThermoFisher Scientific | 10500064 | |
| Formaldehyde | Roth | 4979.1 | |
| Sodium azide | Roth | K305.1 | |
| PE-Cy7 Rat Anti-Mouse CD3 Molecular Complex | BD | 560591 | Clone 17A2; Lot # 7235504 |
| Pacific Blu Rat Anti-Mouse CD8a | BD | 558106 | Clone 53-6.7; Lot # 5058904 |
| V450 Rat anti-Mouse CD8a | BD | 560469 | Clone 53-6.7; Lot # 5205945 |
| FITC anti-mouse CD43 | BioLegend | 121206 | Clone 1B11; Lot # B233778 |
| PE-Cy5 Rat Anti-Mouse CD44 | BD | 553135 | Clone IM7; Lot # 85660 |
| APC-Cy7 Rat Anti-Mouse CD62L | BD | 560514 | Clone MEL-14; Lot # 7215801 |
| OVA-tetramer/APC | MBL | TB-5001-2 | SIINFEKL, H-2Kb; Lot # T1702008 |
| VSV NP-tetramer/PE | MBL | TS-M529-1 | RGYVYQGL, H-2Kb; Lot # 007 |
| EGFP-tetramer/PE | MBL | TS-M525-1 | HYLSTQSAL, H-2Kd; Lot # 004 |
| LCMV-GP-tetramer/APC | MBL | TB-5002-2 | KAVYNFATC, H-2Db; Lot # T1412006 |
| HPV 16 E7-tetramer/APC | MBL | TB-5008-2 | RAHYNIVTF, H-2Db; Lot # T1804003 |
Referanslar
- Tober, R., et al. VSV-GP: a potent viral vaccine vector that boosts the immune response upon repeated applications. Journal of virology. 88 (9), 4897-4907 (2014).
- Muik, A., et al. Re-engineering vesicular stomatitis virus to abrogate neurotoxicity, circumvent humoral immunity, and enhance oncolytic potency. Cancer Reseaerch. 74 (13), 3567-3578 (2014).
- Eales, L. J., Farrant, J., Helbert, M., Pinching, A. J. Peripheral blood dendritic cells in persons with AIDS and AIDS related complex: loss of high intensity class II antigen expression and function. Clinical and Experimental Immunology. 71, 423-427 (1988).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- . Tetramers and Monomers Available from: https://www.mblintl.com/products/research/monomer-tetramers/filter/product_type/monomer (2016)
- Wolfl, M., et al. Quantitation of MHC tetramer-positive cells from whole blood: evaluation of a single-platform, six-parameter flow cytometric method. Cytometry A. 57 (2), 120-130 (2004).
- Burrows, S. R., et al. Peptide-MHC class I tetrameric complexes display exquisite ligand specificity. The Journal of Immunology. 165 (11), 6229-6234 (2000).
- Sims, S., Willberg, C., Klenerman, P. MHC-peptide tetramers for the analysis of antigen-specific T cells. Expert Review of Vaccines. 9 (7), 765-774 (2010).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. The Journal of Visualized Experiments. (68), (2012).
- Xie, Y., et al. A novel T cell-based vaccine capable of stimulating long-term functional CTL memory against B16 melanoma via CD40L signaling. Cellular & Molecular Immunology. 10 (1), 72-77 (2013).
- Nanjundappa, R. H., Wang, R., Xie, Y., Umeshappa, C. S., Xiang, J. Novel CD8+ T cell-based vaccine stimulates Gp120-specific CTL responses leading to therapeutic and long-term immunity in transgenic HLA-A2 mice. Vaccine. 30 (24), 3519-3525 (2012).
- Bowers, E. V., Horvath, J. J., Bond, J. E., Cianciolo, G. J., Pizzo, S. V. Antigen delivery by alpha(2)-macroglobulin enhances the cytotoxic T lymphocyte response. Journal of Leukocyte Biology. 86 (2), 1259-1268 (2009).
- Guo, H., Baker, S. F., Martinez-Sobrido, L., Topham, D. J. Induction of CD8 T cell heterologous protection by a single dose of single-cycle infectious influenza virus. The Journal of Immunology. 88 (20), 12006-12016 (2014).
- Sakai, K., et al. Dendritic cell-based immunotherapy targeting Wilms' tumor 1 in patients with recurrent malignant glioma. Journal of Neurosurgery. 123 (4), 989-997 (2015).
- Rosaely, C. G., et al. Immune responses to WT1 in patients with AML or MDS after chemotherapy and allogeneic stem cell transplantation. International Journal of Cancer. 138 (7), 1792-1801 (2016).
- Shane, H. L., Reagin, K. L., Klonowski, K. D. The Respiratory Environment Diverts the Development of Antiviral Memory CD8 T Cells. The Journal of Immunology. , (2018).
- Li, S., Mwakalundwa, G., Skinner, P. J. In Situ MHC-tetramer Staining and Quantitative Analysis to Determine the Location, Abundance, and Phenotype of Antigen-specific CD8 T Cells in Tissues. The Journal of Visualized Experiments. (127), e56130 (2017).
- De Vries, I. J. M., et al. In situ detection of antigen-specific T cells in cryo-sections using MHC class I tetramers after dendritic cell vaccination of melanoma patients. Cancer Immunology Immunotherapy. 56 (10), 1667-1676 (2007).
- Tan, H. X., et al. Induction of vaginal-resident HIV-specific CD8 T cells with mucosal prime-boost immunization. Mucosal Immunology. , (2017).
- Huang, H., et al. CD8(+) T Cell Immune Response in Immunocompetent Mice during Zika Virus Infection. Journal of Virology. 91 (22), (2017).
- Hensel, M. T., et al. Selective Expression of CCR10 and CXCR3 by Circulating Human Herpes Simplex Virus-Specific CD8 T Cells. Journal of Virology. 91 (19), (2017).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21 (1), 15-23 (2001).
- San Jose, E., Borroto, A., Niedergang, F., Alcover, A., Alarcon, B. Triggering the TCR complex causes the downregulation of nonengaged receptors by a signal transduction-dependent mechanism. Immunity. 12 (2), 161-170 (2000).
- Dietrich, J., Hou, X., Wegener, A. M., Geisler, C. CD3 gamma contains a phosphoserine-dependent di-leucine motif involved in down-regulation of the T cell receptor. EMBO Journal. 13 (9), 2156-2166 (1994).
- Schone, D., et al. Immunodominance of Adenovirus-Derived CD8(+) T Cell Epitopes Interferes with the Induction of Transgene-Specific Immunity in Adenovirus-Based Immunization. Journal of Virology. 91 (20), (2017).
- Dolton, G., et al. More tricks with tetramers: a practical guide to staining T cells with peptide–MHC multimers. Immunology. 146 (1), 11-22 (2015).
- Whelan, J. A., et al. Specificity of CTL Interactions with Peptide-MHC Class I Tetrameric Complexes Is Temperature Dependent. The Journal of Immunology. 163 (8), 4342-4348 (1999).
- Wooldridge, L., et al. Tricks with tetramers: how to get the most from multimeric peptide–MHC. Immunology. 126 (2), 147-164 (2009).
- Denkberg, G., Cohen, C. J., Reiter, Y. Critical role for CD8 in binding of MHC tetramers to TCR: CD8 antibodies block specific binding of human tumor-specific MHC-peptide tetramers to TCR. The Journal of Immunology. 167 (1), 270-276 (2001).
- Daniels, M. A., Jameson, S. C. Critical role for CD8 in T cell receptor binding and activation by peptide/major histocompatibility complex multimers. The Journal of Experimental Medicine. 191 (2), 335-346 (2000).
- Tungatt, K., et al. Antibody stabilization of peptide-MHC multimers reveals functional T cells bearing extremely low-affinity TCRs. The Journal of Immunology. 194 (1), 463-474 (2015).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. Journal of Immunological Methods. 340 (1), 11-24 (2009).
- Rius, C., et al. Peptide-MHC Class I Tetramers Can Fail To Detect Relevant Functional T Cell Clonotypes and Underestimate Antigen-Reactive T Cell Populations. The Journal of Immunology. 200 (7), 2263-2279 (2018).
- Xiao, Z., Mescher, M. F., Jameson, S. C. Detuning CD8 T cells: down-regulation of CD8 expression, tetramer binding, and response during CTL activation. The Journal of Experimental Medicine. 204 (11), 2667-2677 (2007).
- McMichael, A. J., O'Callaghan, C. A. A New Look at T Cells. The Journal of Experimental Medicine. 187 (9), 1367-1371 (1998).
- Hunsucker, S. A., et al. Peptide/MHC tetramer-based sorting of CD8(+) T cells to a leukemia antigen yields clonotypes drawn nonspecifically from an underlying restricted repertoire. Cancer Immunology Research. 3 (3), 228-235 (2015).
- Pittet, M. J., et al. Ex vivo analysis of tumor antigen specific CD8+ T cell responses using MHC/peptide tetramers in cancer patients. International Immunopharmacology. 1 (7), 1235-1247 (2001).
- Cohen, C. J., et al. Isolation of neoantigen-specific T cells from tumor and peripheral lymphocytes. The Journal of Clinical Investigation. 125 (10), 3981-3991 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır