A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
האורך פיזיולוגיים מורפולוגיים ניטור של Spheroids תלת מימדי הגידול באמצעות טומוגרפיה אופטית קוהרנטית
In This Article
Summary
טומוגרפיה אופטית קוהרנטית (אוקטובר), טכנולוגיה הדמיה תלת-ממדית, שימש כדי לפקח, לאפיין את קינטיקה גידול של הגידול multicellular spheroids. כימות הנפחי מדויק של גידול spheroids באמצעות voxel של סופרים ושל הרקמה המתה ללא תווית זיהוי spheroids מבוסס על ניגוד מהותי הנחתה אופטי, היו הדגים.
Abstract
הגידול spheroids פותחו כמודל תרבות תא תלת מימדי (3D), גילוי תרופות נגד סרטן ומחקר סרטן. עם זאת, כיום, שיטות הדמיה תפוקה גבוהה ניצול זיהוי שדה או קרינה פלואורסצנטית בהיר, אינן מצליחות לפתור מבנה תלת-ממדית הכוללת הגידול ספרואיד עקב חדירה קלה מוגבל, פעפוע של צבעי פלורסנט, עומק-resolvability. לאחרונה, המעבדה שלנו הדגים את השימוש טומוגרפיה אופטית קוהרנטית (אוקטובר), ללא תווית ולא הרסניות 3D הדמיה, לבצע אפיון האורך של הגידול multicellular spheroids בצלחת 96-ובכן. OCT היה מסוגל להשיג נתוני תלת-ממד פיזיולוגיים מורפולוגיים של גידול spheroids גדל עד כ-600 מיקרומטר בגובה. במאמר זה נדגים מערכת הדמיה מסוג תפוקה גבוהה OCT (HT-אוקטובר) כי סורקת את הצלחת כל רב טוב והוא מקבל נתונים תלת-ממדיים OCT של גידול spheroids באופן אוטומטי. אנו מתארים את הפרטים של הנחיות מערכת ובנייה של HT-אוקטובר בפרוטוקול. מנתוני OCT תלת-ממד, אחד יכול לדמיין את המבנה הכללי של ספרואיד עם 3D מעובד, פרוסות אורתוגונלית, לאפיין את עקומת גידול האורך של ספרואיד הגידול בהתבסס על מידע מורפולוגי של גודל ונפח, ולנטר את הצמיחה של האזורים תאים מתים ב ספרואיד הגידול מבוסס על ניגודיות אופטי הנחתה מהותי. אנו מראים כי HT-אוקטובר יכול לשמש כמו מודאליות הדמיה תפוקה גבוהה עבור סמים ההקרנה, כמו גם אפיון דגימות biofabricated.
Introduction
סרטן הוא הסיבה המובילה השניה של מוות העולם1. פיתוח תרופות מיקוד סרטן היא בעלת חשיבות מכרעת עבור חולים. עם זאת, ההערכה היא כי יותר מ-90% של תרופות נוגדות סרטן חדש להיכשל בשלב הפיתוח בשל חוסר יעילות ורעילות לא צפוי ניסויים קליניים2. אחת הסיבות ניתן לייחס את השימוש פשוט תא (2D) דו מימדי התרבות מודלים להקרנה מורכבות, אשר לספק תוצאות ערכי ניבוי מוגבל של תרכובת יעילות ורעילות לשלבים הבאים של גילוי סמים2 , 3 , 4. לאחרונה, פותחו מודלים ספרואיד הגידול תלת מימדי (3D) כדי לספק נתונים פיזיולוגיים ולא תרופתי הרלוונטית קלינית תרופה נגד סרטן דיסקברי3,4,5 ,6,7,8,9,10,11,12,13,14, 15,16,17,18,19,20,21,22,23, 24,25. מאחר spheroids האלה שיכולים לחקות רקמות ספציפיות המאפיינים של גידולים ויוו, כגון חומרי מזון וחמצן הדרגתיות, ובשפתיים ליבה, כמו גם ההתנגדות סמים19, השימוש של מודלים אלה יכול באופן פוטנציאלי לקצר צירי זמן גילוי סמים, הפחת את עלויות ההשקעה, ולהביא תרופות חדשות לחולים ביעילות רבה יותר. גישה אחת קריטית חישוב יעילות מתחם בהתפתחות הגידול 3D ספרואיד היא לנטר את הצמיחה ספרואיד ואת המופע החוזר תחת טיפולי9,26. כדי לעשות זאת, אפיוני כמותית של המורפולוגיה הגידול, מעורבים קוטר ונפח שלה, עם שיטות הדמיה ברזולוציה גבוהה, הם חובה.
שיטות הדמיה קונבנציונליים, כגון שדה בהיר, שלב ניגודיות7,9,22,24פלורסצנטיות מיקרוסקופ8,9,16, 18,22 יכול לספק מידה של הקוטר של ספרואיד אבל אין אפשרות לפענח את המבנה הכללי של ספרואיד במרחב תלת-ממדי. גורמים רבים תורמים מגבלות אלו, כולל חדירה של האור החקרנית ספרואיד; דיפוזיית צבעי פלורסנט לתוך ספרואיד; פולט אותות פלואורסצנט נרגש צבעי פלורסנט בתוך או על פני הנגדי ספרואיד עקב ספיגה חזקה, פזורה; עומק-resolvability אלה שיטות הדמיה. זה מוביל לעתים קרובות מדידה נפח לא מדויק. התפתחות נמק הליבה ב- spheroids מחקה נמק ויוו גידולים6,10,15,19,25. זו תכונה פתולוגית סביר לשכפל תאים 2D תרבויות19,25,27,28. עם גודל ספרואיד גדול מ 500 מיקרומטר בקוטר, מבנה קונצנטריים תלת שכבתי, כולל שכבה חיצונית של תאים מתרבים, שכבה אמצעית של תאים השבתה הדרגתית של גרעין נמק, יכול להיות שנצפו ב ספרואיד6,10 ,15,19,25, בשל חוסר חמצן וחומרים מזינים. תא חי ומת פלורסצנטיות הדמיה היא גישה סטנדרטי לתייג את הגבול של הליבה נמק. עם זאת, שוב, חדירות של אלה צבעי פלורסנט וגם האור הנראה לעכב את הפוטנציאל לחקור לליבה נמק לעקוב אחר התפתחותו בצורתו בפועל.
3D חלופי הדמיה, טומוגרפיה אופטית קוהרנטית (אוקטובר) הוא הציג לאפיין את spheroids הגידול. OCT היא טכניקת הדמיה ביו המסוגלת רכישת נתוני תלת-ממד ללא תווית, הרסניות של עד 1-2 מ מ עומק של רקמות ביולוגיות29,30,31,32,33 ,34. OCT מעסיקה נמוך-קוהרנטיות אינטרפרומטריה לגילוי אותות בחזרה מפוזרים בעומקים שונים של המדגם ומספק המשוחזרת נפתרה-עומק תמונות ברזולוציות המרחבי מיקרון ברמת לכיוונים הצדדיים ואנכיים. OCT אומצה באופן נרחב רפואת עיניים35,36,37 ו מסתמים38,39. מחקרים קודמים השתמשו OCT כדי להתבונן המורפולוגיה של במבחנה spheroids הגידול במטריצת קרום המרתף (למשל, Matrigel) ולהעריך את התגובות שלהם טיפול פוטודינמי40,41. לאחרונה, הקבוצה שלנו הקימה תפוקה גבוהה OCT פלטפורמה הדמיה כדי לפקח באופן שיטתי ולכמת את קינטיקה גידול של הגידול 3D spheroids רב טוב צלחות42. כימות הנפחי מדויק של spheroids הגידול תלת-ממד באמצעות voxel של סופרים גישה וזיהוי רקמת נמק ללא תווית ב spheroids מבוסס על ניגוד מהותי הנחתה אופטי היו הדגים. מאמר זה מתאר את הפרטים של איך פלטפורמת הדמיה OCT היה נבנה ולא מועסק כדי לקבל תמונות תלת-ממד ברזולוציה גבוהה של גידול spheroids. כמותני צעד אחר צעד של קינטיקה הצמיחה של הגידול 3D spheroids, כולל מדידות מדויקות של קוטר ספרואיד ואמצעי אחסון, מתואר. כמו כן, השיטה של גילוי הרסניות של רקמת נמק אזורים באמצעות OCT, בהתבסס על הניגוד הנחתה אופטי מהותי מוצג.
Protocol
1. הכנת תאים
- להשיג שורות תאים מן הספק מוסמך.
הערה: ודא כי התאים משורות תאים עניין ניתן טופס ספרואיד בתקשורת תרבות או עם העזרה של מצע (קרום המרתף מטריצה כמו Matrigel). להסתכל לתוך הספרות9 או לבצע סיבוב אחד של ניסוי טרום לבדיקה. - להפשיר את התאים קפוא בעקבות ההליך ספציפיים המסופקים על ידי הספק קו תא. נוהל כללי ניתן למצוא במקום אחר43.
- התרבות התאים עבור פסוקים 1-2 מבחנות תרבות2 25 ס מ. התאים ואז הם מוכנים לשימוש עבור תרבית תאים תלת-ממד.
- לפקח על מצב הבריאות של התאים בכל יום ולשמור אותם בתוך אינקובטור בתנאים סטנדרטיים (37 מעלות צלזיוס, 5% CO2, 95% לחות). רענן את המדיה לפי הצורך.
הערה: המדיום תרבות מורכב DMEM (גלוקוז 4.5 g/L), 1% אנטיביוטיקה-antimycotic, סרום שור עוברית 10%. תת-תרבות תאים לפני שהם מגיעים למפגש ב הבקבוקון תרבות. בצע את המנחה התרבות תאים הניתנים על ידי הספק. נוהל כללי ניתן למצוא elsehwhere44. - ביצוע תרבית תאים 3D צלחות רב טוב מבוסס על כללי הפרוטוקול הבא9.
- להסיר הבקבוקון תרבות התקשורת תרבות, לשטוף אותו עם פוספט סטיריליים buffered תמיסת מלח (PBS, מחומם ל 37 ° C).
- Resuspend בתאים על-ידי הוספת 1 מ"ל של טריפסין ethylenediaminetetraacetic חומצה (EDTA, 0.5%) לתוך הבקבוק למשך 3 דקות. לאחר מכן, להוסיף תרבות המדיה כדי לדלל את טריפסין.
- העברת התליה תא לתוך צינור צנטריפוגה 15 מ"ל צנטריפוגה למשך 5 דקות ב 500 x g ובטמפרטורת החדר.
- הסר את תגובת שיקוע ולאחר resuspend תאים עם 4 מיליליטר מראש ומחוממת תרבות בינוני. פיפטה טיפה אחת של המדגם אל hemocytometer לספירת תאים כדי לקבוע ריכוז התא. לדלל את התאים כדי הריכוז המתאים עבור זריעה (למשל, תאים למ"ל 3,000).
הערה: למטב את הריכוז תא הראשונית של ספרואיד עבור כל תא-שורה, כל סוג של רב טוב צלחת (96-ובכן, 384-ובכן או ובכן 1536). - תאי הזרע לתוך קובץ מצורף נמוך במיוחד (אולה) להטלטל סיבוב טוב רב צלחת. להוסיף 200 µL של תאים השעיה לבאר כל-הריכוז של תאים למ"ל 3,000 כך בכל טוב יש כ-600 תאים.
- במלון RT, centrifuge צלחת מלאה באמצעות מתאם צלחת במשך 7 דקות, מיד אחרי זריעה, מהירות של 350 x g או המהירות הנמוכה ביותר הזמינה.
הערה: לצנטריפוגה מסייע לאסוף תאים למרכז של הבאר כדי להקל על ויוצרים ספרואיד אחד, אחיד. הצעד צנטריפוגה מבוצע פעם אחת בלבד בהתחלה כדי ליצור את spheroids הגידול. זה לא יחזרו כשתפעיל spheroids הגידול גדל. - לשמר את הצלחת טוב רב-37 מעלות צלזיוס ו-5% CO2 בחממה תרבות ולרענן את המדיה תרבות כל 3 ימים.
הערה: זמן צמיחה עשויים להשתנות עבור תנאים שונים תרבות תלת-ממד. במחקר שלנו, תאים למ"ל 3,000 משמש עבור שורות תאים U-87 מ"ג והן של HCT 116 ב 96-ובכן צלחות, כך ספרואיד יכולים לגדל μm ~ 500 בימים 4\u20127 עבור תאים של HCT 116. שקול להוסיף תוספי מדיה ו פקטורי גדילה לדגמים ספרואיד שונה, המבוסס על הגנרל פרוטוקול תרבות תלת-ממד. - בצע הדמיה OCT של גידול spheroids כל ימים 3\u20124 עבור מחקר אורך הצמיחה שלהם.
הערה: נקודות הזמן המומלץ עבור הדמיה OCT יהיה יום 4, יום 7, היום ה-11, ביום 14, יום 18 וביום 21.
2. תפוקה גבוהה OCT הדמיה פלטפורמה
הערה: ראה הפניה עבודה29,30,31,32,33,34 סקירה מעמיקה של עקרונות ויישומים של OCT. ראה איור 1 ווונג. et al. 42 לפרטים של ה-OCT מותאם אישית מערכת השתמשו במחקר זה הדמיה.
- בחר מקור אור בפס רחב המתאים עבור מערכת OCT לדימות ספרואיד הגידול.
הערה: כאן, דיודה superluminescent (SLD, איור 1A,B) עם אורך גל המרכזי של ~ 1,320 nm ו ~ 110 רוחב פס nm שימש מקור אור בפס רחב. - לבנות את הפניה ואת היד מדגם של מערכת OCT בעקבות את התרשימים (ראה איור 1A,B לקבלת פרטים). ראה טבלה של חומרים עבור רשימה של רכיבים אופטיים כדי לבנות מערכת OCT. ודא כי אופטי אורך הפניה היד והזרוע מדגם מקרוב מתאימים.
- לבנות את ספקטרומטר, לרבות קולימטור על פומפיה, עדשת F-תטה, מצלמה קו-scan (ראה איור 1C עבור ההתקנה34) עבור הפרטים של ספקטרומטר העיצוב של אוקטובר לחלופין, בחרו ספקטרומטר מסחרי התואם מרכז גל של מקור האור. ודא ספקטרומטר מיושרת כהלכה כדי לכסות את רוחב הפס לייזר כולו, כדי להשיג יעילות גבוהה פוטון אוסף וכדי לספק איטי לרחיצת מתוך תבנית ההתאבכות.
- לאפיין את הביצועים של מערכת OCT, כולל את המדדים הבאים כגון דוגמת כוח הזרוע, הכולל הדמיה עומק, רגישות תלויי-עומק, רזולוציה צירית, עומק לרוחב והמיקוד הרזולוציה. במקום reflector חלש (למשל, מראה עם דחיסות נייטרלית מסנן) כמדגם כדי למדוד את רגישות תלויי-עומק, צירית הרזולוציה ועומק של המוקד. במקום חיל האוויר האמריקני רזולוציה תרשים במטרת דמה כמו לדוגמה כדי לבדוק את הרזולוציה לרוחב.
הערה: ראה הפניות34,45 עבור הגדרות של מדדי ביצועים OCT ופרוטוקולים כדי לאפיין מדדים אלה45. לקבלת רשימה של פרמטרים נמדד עבור מערכת OCT מותאם אישית השתמשו במחקר שלנו, ראה טבלה 1 . - בחר שלב התרגום ממונע לספק תנועה אופקית של צלחת רב טוב על התמונה spheroids הגידול בבארות השונים (ראה איור 1B). השתמש במה עם מגוון הנסיעות הגדולים מ- 108 מ"מ x 72 מ"מ כדי להבטיח סריקה מלאה של כל הבארות של צלחת רב טוב. השתמש במה 2D או 3D תרגום ממונע עם תוכנת שליטה כדי לאפשר מיקומו המדוייק של כל טוב ואוטומציה של מערכת OCT לדימות תפוקה גבוהה.
- להשתמש במתאם צלחת או עיצוב בעל לוחית (על-ידי הדפסת תלת-ממד) להחזיק את הצלחת טוב רב בעמדה קבועה.
- תקן את הטיית והסיבוב של צלחת רב טוב באמצעות 2D הטיית הבמה ואת שלב הסיבוב רכוב על הבמה translational (ראה איור 1 D), לפני ביצוע כל הדמיה OCT כדי למזער וריאציה של המטוס המוקד מבארות שונים. השתמש D2, D11, B6, D6, G6 ככל הבארות המנחה בעת פיקוח על עמדותיהם היחסי של תמונות OCT (איור 1 א').
- להתאים את זווית הסיבוב של צלחת כדי להבטיח שהקצוות של הצלחת מקבילים עם כיוון התנועה הבמה כך הבארות נשארות באותן משרות אופקי של תמונות OCT (איור 1E). התאם את הטיית של צלחת להיות מקביל השולחן האופטי כך הבארות תושאר אנכי מהמיקומים עבור OCT הדמיה (איור 1F).
הערה: כוונון של זווית הטיית, המוקד לסייע למטב את איכות התמונה OCT עבור כל הבארות. עם זאת, וריאציות של הגובה של תרבות התקשורת בבארות שונים עלולה לגרום לשינויים בנתיבים אופטי, דבר שעלול להוביל defocusing של התמונה ספרואיד. פוקוס אוטומטי ניתן ליישם כדי לשלוט על המטוס מוקד של OCT הדמיה כדי להשיג איכות תמונה ממוטבת. הצעד ההתאמה אינה פותרת באיכות התמונה OCT נמוכה הגידול ספרואיד עקב הבעיות הבאות: decentering ספרואיד עקב מיקום זריעה הראשונית; העלאת ספרואיד כאשר בתוך מטריצה חוץ-תאית biofabricated; צלחת המסכן איכות עם וריאציות גדול של הגובה תחתית היטב. ניתן ליישם תוכנות נוספות שליטה עם פוקוס אוטומטי או יישור עצמית פונקציות כדי למטב את הביצועים של ה-OCT מערכת הדמיה. - השתמש בתוכנת מחשב מותאם אישית כדי לשלוט הרכישה תמונת OCT והתנועה הבמה כדי לאסוף נתונים מכל טוב ברצף.
3. OCT סריקה ועיבוד של גידול Spheroids
- ביום של ההדמיה OCT של גידול spheroids, לוקח את הצלחת טוב רב מן החממה. להעביר את הצלחת רב טוב תחת OCT מערכת הדמיה. למקם אותו על המתאם צלחת.
הערה: ניתן לבצע OCT הדמיה של גידול spheroids עם המכסה פוליסטירן צלחת או ביטול. אולם, condensations מים על המכסה בשל התאיידות מן הבארות עשוי להשפיע על אור, לעוות את נתיב האור, מניב פחות תמונות OCT אופטימלית של spheroids. - להתאים את הגובה של הצלחת להזיז z-לכיוון הבמה תרגום. -שמרו את מטוס מוקד ~ 100-200 μm מתחת לפני השטח העליון של כל ספרואיד, כדי לצמצם את ההשפעה של אי-המדים depth-wise פרופיל מוקד.
- להגדיר OCT סריקה בטווח המתאים (למשל, 1 מ"מ x 1 מ"מ) התוכנה מותאמת אישית כדי לכסות את כל הגידול ספרואיד לפי שלבי ההתפתחות שלו. לחץ על שמור פרמטרים כדי לשמור את ההגדרה.
- להשתמש בתוכנה מותאם אישית כדי לרכוש תמונות תלת-ממד OCT של גידול spheroids אחד עבור כל הבארות של צלחת המכיל spheroids. לחץ על לחצן תצוגה מקדימה כדי להציג תצוגה מקדימה של התמונה, ולחץ על הלחצן ידרשו לרכוש את תמונת OCT.
הערה: ודא כי הנתונים ספרואיד OCT נאספים כאשר הבמה לא נמצא בתנועה. ספרואיד ממוקמת בדרך כלל במרכזו של U-התחתון טוב. עם זאת, ספרואיד עשוי להיות מוזז בתקשורת תרבות כאשר הבמה הוא מאיץ או. חבל הטבור הסתבך בגלל האינרציה של ספרואיד בתקשורת תרבות. - תהליך datasets OCT תלת-ממד של גידול spheroids כדי להפיק תמונות מבנית OCT באמצעות קוד מותאם אישית עיבוד C++. ראה איור 2A תרשים זרימה של שלאחר עיבוד נתונים OCT.
הערה: ראה איור 4A לתמונות שנוצר 3D OCT מבנית.- ראה פרק 5 של דרקסלר, פוג'ימוטו34 / Jian. et al. 46 לתיאורי פירוט של שלבי עיבוד דפוס של OCT נתונים. כיילו את גודל פיקסל כל בשלושה ממדים. מחדש את קנה המידה הדימויים מבניים OCT על סולמות המתוקן.
הערה: המרחק לכיוון צירית (z-כיוון) של תמונות OCT הוא מידת ההבדל אופטי הפניה היד והזרוע הדגימה. לפיכך, מקדם שבירה של המדגם (n) צריך להילקח בחשבון כאשר כיול גודל פיקסל לכיוון צירית בשביל לשנות קנה מידה. במחקר שלנו, אנו משתמשים n = 1.37 כמו מקדם שבירה של הגידול ספרואיד42.
- ראה פרק 5 של דרקסלר, פוג'ימוטו34 / Jian. et al. 46 לתיאורי פירוט של שלבי עיבוד דפוס של OCT נתונים. כיילו את גודל פיקסל כל בשלושה ממדים. מחדש את קנה המידה הדימויים מבניים OCT על סולמות המתוקן.
- צור את קולאז של תמונות ספרואיד באמצעות תמונות דו-ממד OCT 3 מטוסים XY, XZ yz ימאהה חתך לרוחב centroid של ספרואיד. ראה איור 3C-E עבור הפלט נציג של קולאז'ים מתמונות ספרואיד. בצע רישום תמונה עבור כל spheroids, שימוש של MATLAB פונקציה dftregistration47, כדי להבטיח centroids של כל ספרואיד ממוקמים באותו המיקום.
- להשיג עיבוד תלת-ממד ספרואיד באמצעות תוכנה מסחרית או מותאם אישית.
הערה: השלבים הבאים מראים כיצד להשיג רינדור 3D של גידול spheroids באמצעות תוכנה מסחרית.- לטעון את הנתונים OCT 3D לתוך התוכנה.
- לחץ על החלונית ' Surpass '. לאחר מכן, לחץ על הוסף אמצעי אחסון חדש. בחר את מצב המיזוג לשימוש ברינדור תלת-ממד.
- לכוון את זווית הצפייה על-ידי גרירת התמונה באמצעות מצביע העכבר.
4. כימות מורפולוגי של הגידול 3D Spheroids
הערה: נכתב קוד מותאם אישית ב- MATLAB תהליכים כימות הזה. לחץ על לחצן הפעל כדי להתחיל את התהליך. ראה איור 2B עבור תרשים הזרימה השלבים של כימות מורפולוגי של spheroids.
- לכמת ספרואיד קוטר, גובה, קוטר-מבוססות.
- בחר תמונות דו-ממד OCT 3 חתך הרוחב XY, XZ yz ימאהה מטוסים לחצות את centroid של ספרואיד.
- למדוד את קוטר וגובה ספרואיד. במישורים XY, XZ, בהתאמה.
- לחשב באמצעות אמצעי אחסון מבוסס-קוטר ספרואיד:
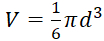 , עם תביעת בעלות צורה כדורית של הגידול.
, עם תביעת בעלות צורה כדורית של הגידול.
- לכמת ספרואיד מבוססי voxel נפח.
- החל מסנן חישוב ממוצע רגיל 3D על המידע המבני OCT של ספרואיד להסיר ספאקלס.
- קטע spheroids הגידול באמצעות המסנן48 זיהוי קצה מורכב, תמונה, עם סף תקין המפריד בין האזור ספרואיד הגידול מהחלק התחתון טוב.
- קבוצת voxels חיבור עבור נתוני תלת-ממד (ראה פונקציה מוכללת: bwconncomp).
- לחשב את המרחק הממוצע בין כל voxel חיבור בקבוצה את centroid ספרואיד (נבחר באופן ידני), עבור כל קבוצה. זיהוי האזור ספרואיד כקבוצת עם המרחק הממוצע המינימלי.
- לספור את מספר voxels בתוך אזור ספרואיד, ואז להכפיל נפח בפועל voxel בודדים (נפח/voxel), מניב את הנפח הכולל של ספרואיד.
5. המת-Cell אזור זיהוי של הגידול 3D Spheroids
הערה: במדיום הומוגנית, OCT הפזורים מאחור בעוצמה זוהה כפונקציה של עומק (אני(z)) יכול להיות מתואר על ידי חוק בר-למברט49: 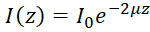 , שבה z מייצג את העומק, μ הוא הנחתה אופטי מקדם, ו אני0 הוא עוצמת האירוע כדי המדגם. ומכאן מקדם הנגזרת הנחתה אופטי ניתן לבטא:
, שבה z מייצג את העומק, μ הוא הנחתה אופטי מקדם, ו אני0 הוא עוצמת האירוע כדי המדגם. ומכאן מקדם הנגזרת הנחתה אופטי ניתן לבטא: 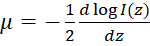 . מאז אוקטובר תמונות מותוות לעיתים קרובות בסרגל לוגריתמי, ניתן לאחזר את השיפוע של הפרופיל בעוצמה OCT להפיק את מקדם הנחתה אופטי. ראה איור 2C בתרשים זרימה של הדור של המפות הנחתה אופטי.
. מאז אוקטובר תמונות מותוות לעיתים קרובות בסרגל לוגריתמי, ניתן לאחזר את השיפוע של הפרופיל בעוצמה OCT להפיק את מקדם הנחתה אופטי. ראה איור 2C בתרשים זרימה של הדור של המפות הנחתה אופטי.
- לבצע פילוח להסיר אזורים בלתי רצויים החוצה ספרואיד. לבצע סינון ממוצע תלת-ממד כדי לדכא את הרעש חודרני הטמון בתמונות OCT.
- להשיג pixel-wise הנחתה אופטי מאת לינאריות מתאים לפרופיל בעוצמה של OCT יומן סרגל מעל עומק טווח מסוים (חלון נע), לחלץ את השיפוע שלו, והקבוע הכפל המדרון ב-1/2.
הערה: המקדם הנחתה על כל voxel בתוך אזור ספרואיד מקוטע מחושב בהתבסס על המדרון של OCT פרופיל בעוצמה בחלון עומק 10-voxel (μm ~ 40 עומק), voxel במרכז החלון. - להחיל את השיטות לעיל (שלבים 5.1 ו- 5.2) כל סריקה צירית בתוך מסגרת, כל מסגרת ב- dataset תלת-ממדי המכיל אזור ספרואיד מקוטע עד הנחתה אופטי המקדמים עבור כל voxels של האזור ספרואיד מקוטע מחושבים.
- לבצע את סף בינארי לסימון האזור גבוה-הנחתה.
הערה: ראה הואנג. et al. 42 עבור קביעת הסף של האזור גבוה-הנחתה באמצעות ניתוח ההיסטוגרמה. - סמן את המפה הנחתה אופטי binarized על התמונה המקורית כדי לסמן בתווית האזור המת-תא (מיזוג). ליצור את התמונה מעובד תלת-ממד של המפה הנחתה שמוזגו להמחיש חלוקת האזור המת-cell תלת-ממד.
6. היסטולוגיה ו אימונוהיסטוכימיה
הערה: היסטולוגיה ו אימונוהיסטוכימיה (IHC) צבעונית תמונות של גידול spheroids מתקבלים כדי לתאם עם התוצאות המתקבלות OCT.
- בנקודות זמן נבחר, בחר 1-2 הגידול spheroids מהצלחת רב טוב עבור היסטולוגיה ו- IHC מכתים. השתמש פיפטה עם העצות פיפטה 1 מ"ל כדי להעביר את ספרואיד מן הבאר שפופרת צנטרפוגה 1.5 mL.
הערה: חותכים את הטיפ פיפטה 1 מ"ל לפני העברה על מנת להבטיח כי גדול יותר מהגודל של ספרואיד הגידול כדי למנוע נזק למבנה ספרואיד הפתח של הקצה. - לאסוף את כל הגידול ספרואיד צינור microcentrifuge mL 1.5 יחיד מלא 10% פורמלדהיד, תיקון עבור 48 שעות.
- בצע את היסטולוגיה והתהליכים IHC עבור כל ספרואיד, באמצעות תקן פרפין הטמעת טכניקות.
הערה: כתם 5 μm קטעים עבה של גידול spheroids עבור hematoxylin ואאוזין (H & E) והסוף מסוף deoxynucleotidyl טרנספראז dUTP ניק תיוג זיהוי אפופטוזיס (TUNEL). Counterstaining של hematoxylin מוחל TUNEL. סורק שקופיות דיגיטלי שימש כדי לסרוק את הדגימה מוכתם ולקבל ברזולוציה גבוהה היסטולוגית ותמונות IHC.
תוצאות
הדמיה טומוגרפיה אופטית קוהרנטית תפוקה גבוהה של Spheroids בצלחת 96-ובכן
איור 3 תערוכות התוצאה של HT-אוקטובר סריקה של צלחת 96-ובכן עם spheroids הגידול של HCT 116 על יום 3. הסריקה רציפים של צלחת מלאה מתחיל מן הבאר הימנית התחתונה (H12). ...
Discussion
הגידול בפעילות רלוונטי מאוד במבנה מורפולוגי. בדומה ניטור עקומת גדילה אופיינית עבור תרביות תאים 2D, מעקב אחר עקומת גדילה עבור גידול 3D spheroids הוא גם גישה המקובלת לאפיין את התנהגות גדילה ספרואיד לטווח ארוך עבור שורות תאים שונים. ראוי לציין, ניתן לאפיין את התגובה סמים על ידי ניתוח גידול השפלה או ...
Disclosures
המחברים לחשוף שום עניין מתחרות.
Acknowledgements
עבודה זו נתמכה על ידי ה-NSF מעניקה IDBR (DBI-1455613), PFI:AIR-TT (השפה-1640707), NIH מענקים R21EY026380, R15EB019704, R01EB025209, אוניברסיטת ליהיי הפעלה קרן.
Materials
| Name | Company | Catalog Number | Comments |
| Custom Spectral Domain OCT imaging system | Developed in our lab | ||
| Superluminescent Diode (SLD) | Thorlabs | SLD1325 | light source |
| 2×2 single mode fused fiber coupler, 50:50 splitting ratio | AC Photonics | WP13500202B201 | |
| Reference Arm | |||
| Lens Tube | Thorlabs | ||
| Adapter | Thorlabs | ||
| Collimating Lens | Thorlabs | AC080-020-C | |
| Focusing Lens | Thorlabs | ||
| Kinematic Mirror Mount | Thorlabs | ||
| Mirror | Thorlabs | ||
| 1D Translational Stage | Thorlabs | ||
| Continuous neutral density filter | Thorlabs | ||
| Pedestrial Post | Thorlabs | ||
| Clamping Fork | Thorlabs | ||
| Sample Arm | |||
| Lens Tube | Thorlabs | ||
| Adapter | Thorlabs | ||
| Collimating Lens | Thorlabs | AC080-020-C | |
| Galvanometer | Thorlabs | ||
| Relay Lens | Thorlabs | AC254-100-C | two Relay lens to make a telescope setup |
| Triangle Mirror Mount | Thorlabs | ||
| Mirror | Thorlabs | ||
| Objective | Mitutoyo | ||
| Pedestrial Post | Thorlabs | ||
| Clamping Fork | Thorlabs | ||
| Polarization Controller | Thorlabs | ||
| 30mm Cage Mount | Thorlabs | ||
| Cage Rod | Thorlabs | ||
| Stage | |||
| 3D motorized translation stage | Beijing Mao Feng Optoelectronics Technology Co., Ltd. | JTH360XY | |
| 2D Tilting Stage | |||
| Rotation Stage | |||
| Plate Holder | 3D printed | ||
| Spectrometer | |||
| Lens Tube | Thorlabs | ||
| Adapter | Thorlabs | ||
| Collimating Lens | Thorlabs | AC080-020-C | |
| Grating | Wasatch | G = 1145 lpmm | |
| F-theta Lens | Thorlabs | FTH-1064-100 | |
| InGaAs Line-scan Camera | Sensor Unlimited | SU1024-LDH2 | |
| Name | Company | Catalog Number | Comments |
| Cell Culture Component | |||
| HCT 116 Cell line | ATCC | CCL-247 | |
| Cell Culture Flask | SPL Life Sciences | 70025 | |
| Pipette | Fisherbrand | 14388100 | |
| Pipette tips | Sorenson Bioscience | 10340 | |
| Gibco GlutaMax DMEM | Thermo Fisher Scientific | 10569044 | |
| Fetal Bovine Serum, certified, US origin | Thermo Fisher Scientific | 16000044 | |
| Antibiotic-Antimycotic (100X) | Thermo Fisher Scientific | 15240062 | |
| Corning 96-well Clear Round Bottom Ultra-Low Attachment Microplate | Corning | 7007 | |
| Gibco PBS, pH 7.4 | Thermo Fisher Scientific | 10010023 | |
| Gibco Trypsin-EDTA (0.5%) | Thermo Fisher Scientific | 15400054 | |
| Forma Series II 3110 Water-Jacketed CO2 Incubators | Thermo Fisher Scientific | 3120 | |
| Gloves | VWR | 89428-750 | |
| Parafilm | Sigma-Aldrich | P7793 | |
| Transfer pipets | Globe Scientific | 138080 | |
| Centrifuge | Eppendorf | 5702 R | To centrifuge the 15 mL tube |
| Centrifuge | NUAIRE | AWEL CF 48-R | To centrifuge the 96-well plate |
| Microscope | Olympus | ||
| Name | Company | Catalog Number | Comments |
| Histology & IHC | |||
| Digital slide scanner | Leica | Aperio AT2 | Obtain high-resolution histological images |
| Histology Service | Histowiz | Request service for histological and immunohistological staining of tumor spheroid | |
| Name | Company | Catalog Number | Comments |
| List of Commerical OCTs | |||
| SD-OCT system | Thorlabs | Telesto Series | |
| SD-OCT system | Wasatch Photonics | WP OCT 1300 nm | |
| Name | Company | Catalog Number | Comments |
| Software for Data Analyses | |||
| Basic Image Analysis | NIH | ImageJ | Fiji also works. |
| 3D Rendering | Thermo Fisher Scientific | Amira | Commercial software. Option 1 |
| 3D Rendering | Bitplane | Imaris | Commercial software. Option 2. Used in the protocol |
| OCT acquisition software | custom developed in C++. | ||
| Stage Control | Beijing Mao Feng Optoelectronics Technology Co., Ltd. | MRC_3 | Incorporated into the custom OCT acquisition code |
| OCT processing software | custom developed in C++. Utilize GPU. Incorporated into the custom OCT acquisition code. | ||
| Morphological and Physiological Analysis | custom developed in MATLAB |
References
- Kola, I., Landis, J. Can the pharmaceutical industry reduce attrition rates?. Nature Reviews Drug Discovery. 3 (8), 711-716 (2004).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18, 240-249 (2013).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Sutherland, R. M. Cell and environment interactions in tumor microregions: the multicell spheroid model. Science. 240 (4849), 177-184 (1988).
- Mueller-Klieser, W. Three-dimensional cell cultures: from molecular mechanisms to clinical applications. American Journal of Physiology - Cell Physiology. 273, C1109-C1123 (1997).
- Friedrich, J., Seidel, C., Ebner, R., Kunz-Schughart, L. A. Spheroid-based drug screen: considerations and practical approach. Nature Protocols. 4 (3), 309-324 (2009).
- Tung, Y. -. C., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC biology. 10, 29 (2012).
- LaBarbera, D. V., Reid, B. G., Yoo, B. H. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opinion on Drug Discovery. 7, 819-830 (2012).
- Pampaloni, F., Ansari, N., Stelzer, E. H. K. High-resolution deep imaging of live cellular spheroids with light-sheet-based fluorescence microscopy. Cell and Tissue Research. 352, 161-177 (2013).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Miniaturized three-dimensional cancer model for drug evaluation. Assay and Drug Development Technologies. 11 (7), 435-448 (2013).
- Wenzel, C., et al. 3D high-content screening for the identification of compounds that target cells in dormant tumor spheroid regions. Experimental Cell Research. 323 (1), 131-143 (2014).
- Astashkina, A., Grainger, D. W. Critical analysis of 3-D organoid in vitro cell culture models for high-throughput drug candidate toxicity assessments. Innovative tissue models for drug discovery and development. 69, 1-18 (2014).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- Gong, X., et al. Generation of multicellular tumor spheroids with microwell-based agarose scaffolds for drug testing. PLoS ONE. 10 (6), e0130348 (2015).
- Hoffmann, O. I., et al. Impact of the spheroid model complexity on drug response. Journal of biotechnology. 205, 14-23 (2015).
- Martinez, N. J., Titus, S. A., Wagner, A. K., Simeonov, A. High-throughput fluorescence imaging approaches for drug discovery using in vitroand in vivothree-dimensional models. Expert Opinion on Drug Discovery. 10, 1347-1361 (2015).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology, Therapeutics. 163, 94-108 (2016).
- Li, L., Zhou, Q., Voss, T. C., Quick, K. L., LaBarbera, D. V. High-throughput imaging: Focusing in on drug discovery in 3D. Methods. 96, 97-102 (2016).
- Ham, S. L., Joshi, R., Thakuri, P. S., Tavana, H. Liquid-based three-dimensional tumor models for cancer research and drug discovery. Experimental Biology and Medicine. 241 (9), 939-954 (2016).
- Kessel, S., et al. High-Throughput 3D Tumor Spheroid Screening Method for Cancer Drug Discovery Using Celigo Image Cytometry. Journal of Laboratory Automation. , 2211068216652846 (2016).
- Stock, K., et al. Capturing tumor complexity in vitro: Comparative analysis of 2D and 3D tumor models for drug discovery. Scientific Reports. 6, 28951 (2016).
- Thakuri, P. S., Ham, S. L., Luker, G. D., Tavana, H. Multiparametric analysis of oncology drug screening with aqueous two-phase tumor spheroids. Molecular Pharmaceutics. 13 (11), 3724-3735 (2016).
- Lin, R. Z., Chang, H. Y. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnology Journal. 3 (9-10), 1172-1184 (2008).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cancer multicellular spheroids: Volume assessment from a single 2D projection. Computer Methods and Programs in Biomedicine. 118 (2), 95-106 (2015).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
- Debnath, J., Brugge, J. S. Modelling glandular epithelial cancers in three-dimensional cultures. Nature Reviews Cancer. 5 (9), 675-688 (2005).
- Huang, D., et al. Optical coherence tomography. Science. 254 (5035), 1178-1181 (1991).
- Drexler, W., et al. Optical coherence tomography today: speed, contrast, and multimodality. Journal of Biomedical Optics. 19 (7), 071412 (2014).
- Fujimoto, J., Swanson, E. The development, commercialization, and impact of optical coherence tomography. Investigative Ophthalmology, Visual Science. 57 (9), (2016).
- Vakoc, B. J., Fukumura, D., Jain, R. K., Bouma, B. E. Cancer imaging by optical coherence tomography: preclinical progress and clinical potential. Nature Reviews Cancer. 12 (5), 363-368 (2012).
- Wojtkowski, M. High-speed optical coherence tomography: basics and applications. Applied optics. 49 (16), D30-D61 (2010).
- Drexler, W., Fujimoto, J. G. . Optical coherence tomography: technology and applications. , (2008).
- Geitzenauer, W., Hitzenberger, C. K., Schmidt-Erfurth, U. M. Retinal optical coherence tomography: past, present and future perspectives. British Journal of Ophthalmology. 95 (2), 171 (2011).
- Sakata, L. M., DeLeon-Ortega, J., Sakata, V., Girkin, C. A. Optical coherence tomography of the retina and optic nerve - a review. Clinical, Experimental Ophthalmology. 37 (1), 90-99 (2009).
- van Velthoven, M. E. J., Faber, D. J., Verbraak, F. D., van Leeuwen, T. G., de Smet, M. D. Recent developments in optical coherence tomography for imaging the retina. Progress in Retinal and Eye Research. 26 (1), 57-77 (2007).
- Kashani, A. H., et al. Optical coherence tomography angiography: A comprehensive review of current methods and clinical applications. Progress in Retinal and Eye Research. 60, 66-100 (2017).
- de Carlo, T. E., Romano, A., Waheed, N. K., Duker, J. S. A review of optical coherence tomography angiography (OCTA). International Journal of Retina and Vitreous. 1 (1), 5 (2015).
- Sharma, M., Verma, Y., Rao, K. D., Nair, R., Gupta, P. K. Imaging growth dynamics of tumour spheroids using optical coherence tomography. Biotechnology Letters. 29 (2), 273-278 (2006).
- Jung, Y., Nichols, A. J., Klein, O. J., Roussakis, E., Evans, C. L. Label-Free, Longitudinal Visualization of PDT Response In Vitro with Optical Coherence Tomography. Israel Journal of Chemistry. 52 (8-9), 728-744 (2012).
- Huang, Y., et al. Optical coherence tomography detects necrotic regions and volumetrically quantifies multicellular tumor spheroids. Cancer Research. 77 (21), 6011-6020 (2017).
- Spalteholz, W. . Über das Durchsightigmachen von menschlichen und tierischen Präparaten: nebst Anhang, Über Knochenfärbung. , (1911).
- Dodt, H. -. U., et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nature Methods. 4 (4), 331 (2007).
- Leitgeb, R., Hitzenberger, C., Fercher, A. F. Performance of fourier domain vs. time domain optical coherence tomography. Optics express. 11 (8), 889-894 (2003).
- Jian, Y., Wong, K., Sarunic, M. V. . Optical Coherence Tomography and Coherence Domain Optical Methods in Biomedicine XVII. , 85710Z (2013).
- Guizar-Sicairos, M., Thurman, S. T., Fienup, J. R. Efficient subpixel image registration algorithms. Optics Letters. 33 (2), 156-158 (2008).
- Canny, J. A computational approach to edge detection. IEEE Transactions on Pattern Analysis and Machine Intelligence. (6), 679-698 (1986).
- Vermeer, K. A., Mo, J., Weda, J. J. A., Lemij, H. G., de Boer, J. F. Depth-resolved model-based reconstruction of attenuation coefficients in optical coherence tomography. Biomedical Optics Express. 5 (1), 322-337 (2014).
- Klein, T., et al. Multi-MHz retinal OCT. Biomedical Optics Express. 4, 1890-1908 (2013).
- Klein, T., Huber, R. High-speed OCT light sources and systems [Invited]. Biomedical Optics Express. 8 (2), 828-859 (2017).
- Zhou, C., Alex, A., Rasakanthan, J., Ma, Y. Space-division multiplexing optical coherence tomography. Optics Express. 21, 19219-19227 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved