このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
光コヒーレンストモグラフィーを用いた三次元腫瘍回転楕円体の縦断的形態学的および生理学的監視
要約
光コヒーレンストモグラフィ (OCT)、3次元イメージング技術は、監視し、腫瘍細胞スフェロイドの成長カイネティクスを特徴付ける使用されました。アプローチ、およびラベル無料死んだ組織検出光減衰のコントラストに基づく回転楕円体を数えるボクセルを用いた腫瘍回転楕円体の正確な体積の数量を示した。
要約
腫瘍回転楕円体は、がん研究・がん創薬における三次元 (3 D) 細胞培養モデルとして開発されています。しかし、現在、高スループットのモダリティをイメージング明るいフィールドまたは蛍光検出を利用したはない蛍光染料の拡散限られた光穿腫瘍回転楕円体の全体的な 3 D 構造を解決することができると深さ-resolvability。最近では、私たちの研究室は、光干渉断層計 (OCT)、ラベル無料、非破壊 3 D 96 ウェル プレートで腫瘍細胞スフェロイドの縦断的評価を実行するためのモダリティをイメージングの使用を認めた。10 月は約 600 μ m の高さにまで成長している腫瘍回転楕円体の 3 D の形態学的および生理学的な情報を得ることができます。この記事では、全体ウェル プレートをスキャンし、自動的に腫瘍回転楕円体の 3 D 10 月データを取得する高スループット 10 月 (HT OCT) イメージング システムを示しています。プロトコルで、HT OCT システム施工指針の詳細について述べる。3 D 10 月データから 3 D レンダリングと回転楕円体の全体的な構造を視覚化できます 1 つと直交スライス サイズとボリュームの形態学的情報に基づく腫瘍回転楕円体の縦断的成長曲線の特徴しの増加率を監視光減衰のコントラストに基づく腫瘍回転楕円体で死んだセル領域。HT 10 月を薬物スクリーニングと同様、biofabricated のサンプルの特性の高スループットのイメージ投射様相として使用できるを示します。
概要
がんは世界1の死の 2 番目の主要な原因です。患者のための重大な重要性の癌をターゲットとする薬剤の開発です。ただし、新しい抗がん剤の 90% 以上が臨床試験2で予期しない毒性と有効性の不足のため開発段階で失敗することが推定されます。理由の一部は、化合物のスクリーニング、医薬品探索2の次の段階の化合物の有効性と毒性の限られた予測値と結果を提供するための単純な二次元 (2 D) 細胞培養モデルの使用に帰することができます。,3,4. 近年、三次元 (3 D) 腫瘍回転楕円体モデルは抗癌性の薬剤の発見3,4,5 の臨床的に関連する生理学的および薬理学的データを提供するために開発されています。、6,7,8,9,10、11,12,13,14、 15,16,17,18,19,20,21,22,23、 24,25。以来、これらの回転楕円体は、生体内で腫瘍の組織に固有のプロパティをまねることができる、栄養や酸素など薬剤抵抗19、これらのモデルの使用と同様に、グラデーション、低酸素のコア潜在的短縮できる薬の発見のタイムライン投資のコストを削減しより効果的に患者に新しい薬をもたらします。3 D 腫瘍回転楕円体開発化合物の有効性を評価する重要な方法の 1 つは、回転楕円体の成長と治療9,26再発を監視することです。これを行うには、その直径と高解像度の画像診断装置では、ボリュームを含む腫瘍形態の定量的な特徴づけが不可欠であります。
明視野、位相コントラスト7,9,22,24, 蛍光顕微鏡8,9,16など、従来の画像診断装置 18,22回転楕円体の直径の測定を提供することができますが、3 D 空間で回転楕円体の全体的な構造を解決することはできません。多くの要因は、回転楕円体; プローブ光の浸透を含むこれらの制限に貢献します。回転楕円体に蛍光染料の拡散励起蛍光染料中または強い吸収と散乱のため回転楕円体の反対側の面からの発光の蛍光信号これらの深さ resolvability 画像診断。これは多くの場合不正確なボリューム計測に します。回転楕円体の壊死性のコアの開発は、生体内で腫瘍6,10,15,19,25で壊死を模倣します。この病理学的機能は、2 D セル文化19,25,27,28で再現可能性があります。回転楕円体サイズの 3 層の同心円構造、直径 500 μ m よりも大きい増殖細胞の外側の層、中間層休止期の細胞の壊死性コアなどで観察できる回転楕円体6,10 ,,1519,25酸素や栄養素の不足のため。ライブとデッド細胞蛍光イメージングは、壊死性のコアの境界にラベルを付ける標準的なアプローチです。しかし、再び、これらの蛍光染料と可視光の両方の侵入は、実際の形でその開発を監視する壊死性コアにプローブする可能性を妨げます。
画像モダリティ別 3 D、腫瘍スフェロイドを特徴付けるため光コヒーレンストモグラフィ (OCT) を導入します。10 月までからラベル無料、非破壊の 3 D データを取得することができる生物医学イメージングは、1-2 mm 深さ生体29,30,31,32,33 、34。10 月サンプルのさまざまな深さからの後方散乱信号を検出する低コヒーレンス干渉計を採用しています、ミクロン レベルの水平および垂直方向の空間分解能で再建された深さ分解画像を提供しています。10 月は、眼科35,36,37および血管造影38,39で広く採用されています。以前の研究では、基底膜マトリックス (例えばマトリゲル) で腫瘍を回転楕円体の in vitroの形態を観察し、光線力学療法40,41への応答を評価する 10 月を使用しています。最近では、当社グループは体系的に監視し、ウェル プレート42で 3 D の腫瘍を回転楕円体の成長カイネティクスの定量化に高スループット OCT イメージング プラットフォームを設立しました。アプローチおよび回転楕円体の光減衰のコントラストに基づくラベル無料壊死検出を数えるボクセルを用いた 3 D 腫瘍回転楕円体の正確な体積の数量を示した。本稿では、OCT イメージング プラットフォームを構築して採用腫瘍回転楕円体の高解像度の 3 D イメージを取得する方法の詳細について説明します。回転楕円体の直径およびボリュームの正確な測定を含む 3 D 腫瘍の回転楕円体の成長カイネティクスのステップバイ ステップによる定量的評価を説明します。また、光減衰コントラストに基づいて、OCT を使用して壊死領域の非破壊検出の手法を提案します。
プロトコル
1. 細胞の調製
- 修飾されたサプライヤーからのセルの行を取得します。
注: は、文化メディアや基板 (マトリゲルのような基底膜マトリックス) の助けを借りて興味の細胞からの細胞は、回転楕円体を形成できることを確認します。文献9に見たり、チェックのため予備実験の 1 つのラウンドを実行します。 - 凍結細胞の細胞ラインのサプライヤーによって提供される特定の手順を解凍します。一般的な手順は、他の場所で43をで見つけることができます。
- 25 cm2培養フラスコで 1-2 箇所の細胞を培養します。セルは 3 D 細胞培養に使用する準備ができているし。
- 毎日細胞の健康状態を監視し、インキュベーター (37 ° C、5% CO2、湿度 95%) の標準的な条件の下でそれらを維持します。必要に応じて、メディアを更新します。
培養液は DMEM (4.5 G/L グルコース), 1% 抗生物質抗真菌薬, 10% 牛胎児血清で構成されています。サブカルチャー細胞培養用フラスコの合流点に達する前に。サプライヤーによって提供される細胞文化のガイドラインに従ってください。一般的な手順は、elsehwhere44を見つけることができます。 - 次の一般的なプロトコル9ウェルプレートで 3 D 細胞培養を実行します。
- 培地を培養用フラスコから外し、滅菌リン酸緩衝生理食塩水 (PBS、37 ° C に加熱) で洗ってください。
- 3 分間フラスコに 1 mL のトリプシン エチレンジアミン四酢酸 (EDTA、0.5%) を追加することによって、細胞を再懸濁します。トリプシンを希釈する培地を追加します。
- 15 mL 遠心管 500 × g室温で 5 分間遠心し、細胞懸濁液を転送します。
- 上澄みを除去し、予め温めておいた培養液 4 ml の細胞を再懸濁します。細胞濃度を決定するためのセルをカウントするための検定にサンプルの 1 つのドロップをピペットします。適切な濃度 (例えば、3,000 細胞/ml) 播種のために細胞を希釈します。
注: 各セルラインおよびウェル プレート (96 ウェル、384 ウェル、1536 ウェル) の種類ごとの回転楕円体の初期細胞濃度を最適化します。 - 超低添付ファイル (ULA) 丸底ウェル プレートにシード細胞。よく、それぞれの約 600 セル 3,000 細胞/ml の濃度を各ウェルに細胞懸濁液 200 μ L を追加します。
- 常温では、7 分間、350 g x の速度または利用可能な最低速度で, 播種後右プレート アダプターを使用して全体の板を遠心します。
注: 遠心分離機の単一の均一スフェロイド形成を容易にする井戸の中央に細胞を収集に役立ちます。遠心分離機ステップは腫瘍スフェロイドを形成する最初で一度だけ実行されます。それは腫瘍の回転楕円体が成長を開始するとき、繰り返されません。 - 文化のインキュベーターで CO2を 37 ° C、5% でウェル プレートを維持し、文化メディア 3 日ごとの更新します。
注: 異なる 3 D 培養条件の成長時間が異なる場合があります。本研究で 3,000 細胞/ml は、回転楕円体は、HCT 116 セルの 4\u20127 日 〜 500 μ m まで育てることができるので、96 ウェル プレートで U-87 MG と HCT 116 の両方の細胞に使用されます。メディア サプリメントとは異なる楕円体モデルの成長要因に基づいて一般的な 3 D 培養のプロトコルを追加することを検討してください。 - 彼らの成長に関する縦断的研究 3\u20124 日ごと腫瘍スフェロイドの OCT イメージングを実行します。
注: OCT イメージングの推奨される時間のポイントは、4 日目、7 日目、11 日目、14 日目、18 日目、21 日目になります。
2. 高スループット OCT イメージング プラットフォーム
注: 参照を参照してください仕事29,30,31,32,33,34 10 月の原則の徹底的な見直し等のため。図 1と黄らを参照してください。詳細については本研究で使用されるシステムをイメージング カスタム 10 月の42 。
- 腫瘍回転楕円体イメージング OCT システムの適切な広帯域光源を選択します。
注: ここでは、superluminescent ダイオード (SLD、図 1 a,B) ~ 1,320 の中心波長 nm と 〜 110 nm の帯域が広帯域光源として使用されました。 - 参照の腕と OCT システム概略図 (図 1 aBについてを参照してください)、次のサンプル腕を構築します。OCT システムを構築する光学コンポーネントの一覧については材料の表を参照してください。参照の腕とサンプル腕の光路長がほぼ一致していることを確認します。
- 分光光度計は、コリメーター、回折格子、F θ レンズ、ライン スキャン カメラ (セットアップ34の図 1を参照) を含む 10 月の分光器の設計の詳細または、選択に一致する市販装置の構築、光源の波長。高い光効率を達成するために、干渉パターンの遅いウォッシュ アウトを提供するために、全体のレーザー帯域幅をカバーする分光計が正しく整列されていることを確認します。
- サンプル腕パワー、合計イメージング深さ、深さ依存型感度、軸方向の解像度、フォーカスと水平解像度の深さなど次のメトリックを含む OCT システムの性能を評価します。深さ依存型感度、軸方向の解像度、焦点深度を測定するサンプルとして弱い反射 (例えば、中性密度フィルターでミラー) を配置します。横方向の解像度を確認するサンプルとして USAF の解像度テスト グラフ ターゲットを配置します。
注: 参照してください34,45 10 月パフォーマンス、これらのメトリックの45を特徴付けるためのプロトコルのメトリックの定義を参照します。我々 の研究で使用されるカスタムの OCT システムの測定パラメーターの一覧については表 1を参照してください。 - (参照してください図 1 b) さまざまな坑井におけるイメージ腫瘍スフェロイド ウェル プレートの水平方向の移動を提供するためにモーターを備えられた翻訳段階を選択します。108 mm × 72 mm より大きい旅行の範囲と段階を使用するウェル プレートのすべての井戸の完全なスキャンします。各ウェルの正確な位置と高スループット用 OCT システムの自動化を有効にソフトウェア制御で 2 D または 3 D のモーターを備えられた翻訳段階を使用します。
- プレート アダプターを使用または固定位置にウェルのプレートを保持する (3 D 印刷) によってプレート ホルダーを設計します。
- さまざまな坑井から焦点面の変化を最小限に抑えるため、10 月のイメージングを行う前に傾斜・ 2 D ステージおよび並進ステージ (参照してください図 1 D) にマウントされている回転ステージの傾斜を使用してウェル プレートの回転を修正します。10 月画像 (図 1 a) 内の相対位置を監視しているとき、指導の井戸として D2 D11、B6、D6、G6 を使用します。
- プレートのエッジは、OCT 画像 (図 1E) の同じ水平位置で井戸が残っているので、舞台上の動きの方向と平行してプレートの回転を調整します。井戸はイメージング (図 1F) 10 月の同じ垂直位置のまま、平行光学テーブルにするプレートの傾斜を調整します。
注: 傾斜角度とフォーカスの調整は、すべての井戸の OCT 画像の品質を最適化できます。ただし、さまざまな坑井での培地の高さのバリエーションは、回転楕円体画像のボケにつながる光のパスの変更を引き起こす可能性があります。オート フォーカスは、OCT イメージングに最適化されたイメージの質を達成するための焦点面を制御するために実装されるかもしれません。調整手順は、次の問題による腫瘍回転楕円体の OCT 画像質の悪さを解決しない: 初期シード場所による偏心回転楕円体biofabricated 細胞外マトリックス; に埋め込まれたときに回転楕円体の昇格井戸底の高さの大きな変化と貧しい板品質。自動焦点または自己調整機能を持つ追加のソフトウェア制御を実装して、OCT イメージング システムのパフォーマンスを最適化できます。 - OCT 画像の取得とも順番にそれぞれからデータを収集するのに、舞台上の動きを制御するのにカスタム プログラムを使用します。
3。 OCT スキャンおよび腫瘍回転楕円体の処理
- 腫瘍スフェロイドの OCT イメージングの日、インキュベーターからウェル プレートを取る。OCT イメージング システムの下でウェル プレートに転送します。プレート アダプター上にそれを置きます。
注: 腫瘍スフェロイドの OCT イメージングは、ポリスチレン板ふたをオンまたはオフ実行可能性があります。しかし、井戸から蒸発により蓋の上の水の凝縮が光透過率に影響を与える、光パスの少ない最適な OCT 画像を産する、回転楕円体を歪めます。 - 翻訳段階の z 方向に沿って移動することによって、プレートの高さを調整します。〜 100-200 の焦点面位置を維持 depth-wise 非一様の影響を最小限に抑えるため、各回転楕円体の上面の下 μ m 焦点のプロファイル。
- カスタム ソフトウェアの開発段階によると全体の腫瘍回転楕円体をカバーするために適切な OCT スキャン範囲 (例えば、1 mm × 1 mm) を設定します。設定を保存して保存パラメーターをクリックします。
- 腫瘍回転楕円体 1 つずつ回転楕円体を有する板のすべての井戸のための 3次元 OCT 画像を取得するのにには、カスタム ソフトウェアを使用します。OCT 画像を取得する取得ボタンをクリックしてプレビュー画像を表示するには、プレビューをクリックします。
メモ: は、ステージが動いていないときに 10 月の回転楕円体のデータを収集できることを確認します。回転楕円体は、U-下部の中央にも通常あります。しかし、ステージを加速または文化のメディアで回転楕円体の慣性のため減速時回転楕円体を文化メディアにシフト可能性があります。 - 10 月カスタム C++ 処理コードの構造イメージを生成する腫瘍を回転楕円体のプロセスの 3 D 10 月のデータセット。10 月データの後処理のフローチャートを図 2 aを参照してください。
注: 生成された 3 D OCT 構造イメージ図 4 aを参照してください。- ドレクスラーと藤本34と健らの 5 章を参照します。46 10 月データの後処理手順の詳細な説明のため。すべての 3 次元のピクセル サイズを調整します。再修正されたスケールで 10 月構造イメージを拡大縮小します。
注: OCT 画像の軸方向 (z 方向) の距離が参照アームとサンプル腕の光路差の尺度です。したがって、サンプル (n) の屈折は、再スケーリングの軸方向のピクセル サイズを調整する場合を考慮する必要があります。本研究では n を使用 = 1.37 腫瘍回転楕円体42の屈折として。
- ドレクスラーと藤本34と健らの 5 章を参照します。46 10 月データの後処理手順の詳細な説明のため。すべての 3 次元のピクセル サイズを調整します。再修正されたスケールで 10 月構造イメージを拡大縮小します。
- 3 つの断面 XY、XZ と YZ 平面内回転楕円体の重心に 2D の OCT 画像を用いた回転楕円体画像のコラージュを生成します。E回転楕円体画像のコラージュの代表的な出力の図 3-を参照してください。47MATLAB の関数 dftregistration のを使用してすべての回転楕円体の重心が同じ場所に約あることを確認するすべての回転楕円体の画像登録を実行します。
- 商業またはカスタム ソフトウェアを使用して回転楕円体の 3 D レンダリングを取得します。
注: 次の手順は、商用ソフトウェアを使用して腫瘍回転楕円体の 3 D レンダリングを取得する方法を示します。- 3 D 10 月データをソフトウェアに読み込みます。
- サーパスパネルをクリックします。新しいボリュームの追加をクリックします。3 D レンダリングに使用するブレンドモードを選択します。
- マウス ポインターを使用してイメージをドラッグして、角度を調整します。
3 D 腫瘍回転楕円体の形態学的数量化4。
注: MATLAB のカスタム書かれたコードは、この数量を処理します。プロセスを開始する [実行] ボタンをクリックします。回転楕円体の形態の定量化の手順のフローチャートを図 2 bを参照してください。
- 回転楕円体の直径、高さ、および直径ベースのボリュームを定量化します。
- 回転楕円体の重心を渡る 3 つの断面 XY、XZ と YZ 平面の 2 D の OCT 画像を選択します。
- それぞれ XY 平面、XZ 平面に回転楕円体の高さ、直径を測定します。
- ボリュームを使用して直径に基づく楕円体計算:
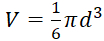 、腫瘍の球面形状の推定と。
、腫瘍の球面形状の推定と。
- 回転楕円体のボクセル ベース ボリュームを定量化します。
- 斑点を除去する回転楕円体の 10 月の構造データを 3 D 平均フィルターを適用します。
- ウェル底面から腫瘍の回転楕円体の領域を分離する適切なしきい値を持つフレームで気の利いたエッジ検出48フィルターを使用して腫瘍スフェロイドをセグメント化します。
- 3 D データの結合のボクセルをグループ (組み込み関数を参照してください: bwconncomp)。
- 各結合のボクセル群と各グループの回転楕円体の重心 (手動で選択) の間の平均距離を計算します。グループとして最小の平均距離と回転楕円体の地域を識別します。
- 回転楕円体領域内の画素の数をカウントして、回転楕円体の総量を降伏個々 のボクセル (ボリューム/ボクセル) の実際の量を乗算します。
5 3 D 腫瘍回転楕円体の死んだ細胞領域の検出
注: 均質媒質中で 10 月の後方散乱強度 (私(z)) 深さの関数として検出によって記述できるビール ランバート法49: 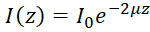 、ここではz深度を表し、 μは光の減衰係数、および私0のサンプルに入射強度です。したがって派生光減衰係数として表現できます:
、ここではz深度を表し、 μは光の減衰係数、および私0のサンプルに入射強度です。したがって派生光減衰係数として表現できます: 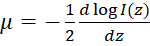 。OCT 画像を対数スケールでプロット頻繁ので、光減衰係数を導出する 10 月強度分布の傾きを取得できます。光減衰マップの生成のフローチャートは、図 2を参照してください。
。OCT 画像を対数スケールでプロット頻繁ので、光減衰係数を導出する 10 月強度分布の傾きを取得できます。光減衰マップの生成のフローチャートは、図 2を参照してください。
- 回転楕円体の外側の不要な領域を削除するのに分割を実行します。OCT 画像に固有のものは、スペックル ノイズを抑制する 3 D 平均フィルターを実行します。
- 画素単位取得光減衰係数線形対数目盛 10 月強度プロファイルを特定の深さの範囲 (移動ウィンドウ) に合わせ、その傾きを抽出し、斜面を-1 で乗算/2。
注: 各ボクセル分割回転楕円体領域内で減衰係数は算出 10 ボクセル深さウィンドウ (深さ 〜 40 μ m) で 10 月強度プロファイルの斜面にボクセルをウィンドウの中央に位置します。 - フレームの各軸のスキャンとセグメント化された回転楕円体領域のすべての画素の光減衰係数が計算されるまで、セグメント化された回転楕円体領域を含む 3 D データセット内の各フレームに (手順 5.1 および 5.2) 上記の方法を適用されます。
- 高減衰領域を強調表示するバイナリの閾値処理を実行します。
注: 黄らを参照してください。42のヒストグラム解析を用いた高減衰領域のしきい値決定のため。 - (ブレンディング) 死んだセル領域をラベルする元のイメージの 2 値化の光減衰マップをハイライト表示します。死んだセル領域の 3次元分布を可視化するブレンド減衰マップの 3 D レンダリングされたイメージを生成します。
6. 組織および免疫組織化学
注: 対応する 10 月の結果と相関するは、組織および免疫組織染色 (IHC) 腫瘍回転楕円体の画像を染色が得られます。
- 選択した時点で組織と IHC 染色のウェル プレートから 1-2 腫瘍回転楕円体を選択します。井戸から 1.5 mL 遠心チューブに回転楕円体を転送するのに 1 mL ピペット先端のピペットを使用します。
注: は、先端の開口部が回転楕円体の構造の損傷を避けるために回転楕円体腫瘍のサイズより大きいことを確認するために転送する前に 1 mL ピペット チップをカットします。 - 10% のホルムアルデヒドと 48 時間修正シングル 1.5 mL 遠心チューブには各腫瘍の回転楕円体を収集します。
- 埋め込み技術標準のパラフィンを使用して、各回転楕円体の組織学と IHC プロセスを実行します。
ヘマトキシリンとエオシン (H & E) と遊離トランスフェラーゼ dUTP 端標識 (TUNEL) アポトーシス検出のための腫瘍スフェロイドの注意: 汚れ 5 μ m 厚いセクション。ヘマトキシリンの counterstaining は、トンネルに適用されます。ステンド グラス サンプルをスキャンし、高解像度デジタル スライド スキャナーを用いて組織学的・ IHC 画像。
結果
96 ウェル プレートに回転楕円体の高スループット光干渉断層イメージング
図 3は、HT 10 月の 3 日目の HCT 116 腫瘍スフェロイドの 96 ウェル プレートのスキャンの結果を展示します。全体の板の逐次スキャンを右下の井戸 (H12) から開始します。図 3 bは、HT OCT システムのソフトウェ...
ディスカッション
腫瘍の活動は、その形態学的構造に関連性の高いです。2 D 細胞培養の特徴的な成長曲線を監視と同様に、3 D 腫瘍回転楕円体の成長曲線を追跡もです長期的な回転楕円体細胞進展挙動を特徴付けるための従来のアプローチ特に、我々 は腫瘍の低下や腫瘍の再成長成長曲線に直接反映を分析することによって薬剤反応を特徴付けることができます。したがって、腫瘍の 3 D 回転楕円体、サイズ?...
開示事項
著者は競合する利害を開示ないです。
謝辞
この作品は、NSF によって支えられた IDBR (DBI-1455613)、PFI:AIR を付与-TT (IIP-1640707)、NIH 助成 R21EY026380、R15EB019704、R01EB025209、およびリーハイ大学スタートアップ基金。
資料
| Name | Company | Catalog Number | Comments |
| Custom Spectral Domain OCT imaging system | Developed in our lab | ||
| Superluminescent Diode (SLD) | Thorlabs | SLD1325 | light source |
| 2×2 single mode fused fiber coupler, 50:50 splitting ratio | AC Photonics | WP13500202B201 | |
| Reference Arm | |||
| Lens Tube | Thorlabs | ||
| Adapter | Thorlabs | ||
| Collimating Lens | Thorlabs | AC080-020-C | |
| Focusing Lens | Thorlabs | ||
| Kinematic Mirror Mount | Thorlabs | ||
| Mirror | Thorlabs | ||
| 1D Translational Stage | Thorlabs | ||
| Continuous neutral density filter | Thorlabs | ||
| Pedestrial Post | Thorlabs | ||
| Clamping Fork | Thorlabs | ||
| Sample Arm | |||
| Lens Tube | Thorlabs | ||
| Adapter | Thorlabs | ||
| Collimating Lens | Thorlabs | AC080-020-C | |
| Galvanometer | Thorlabs | ||
| Relay Lens | Thorlabs | AC254-100-C | two Relay lens to make a telescope setup |
| Triangle Mirror Mount | Thorlabs | ||
| Mirror | Thorlabs | ||
| Objective | Mitutoyo | ||
| Pedestrial Post | Thorlabs | ||
| Clamping Fork | Thorlabs | ||
| Polarization Controller | Thorlabs | ||
| 30mm Cage Mount | Thorlabs | ||
| Cage Rod | Thorlabs | ||
| Stage | |||
| 3D motorized translation stage | Beijing Mao Feng Optoelectronics Technology Co., Ltd. | JTH360XY | |
| 2D Tilting Stage | |||
| Rotation Stage | |||
| Plate Holder | 3D printed | ||
| Spectrometer | |||
| Lens Tube | Thorlabs | ||
| Adapter | Thorlabs | ||
| Collimating Lens | Thorlabs | AC080-020-C | |
| Grating | Wasatch | G = 1145 lpmm | |
| F-theta Lens | Thorlabs | FTH-1064-100 | |
| InGaAs Line-scan Camera | Sensor Unlimited | SU1024-LDH2 | |
| Name | Company | Catalog Number | Comments |
| Cell Culture Component | |||
| HCT 116 Cell line | ATCC | CCL-247 | |
| Cell Culture Flask | SPL Life Sciences | 70025 | |
| Pipette | Fisherbrand | 14388100 | |
| Pipette tips | Sorenson Bioscience | 10340 | |
| Gibco GlutaMax DMEM | Thermo Fisher Scientific | 10569044 | |
| Fetal Bovine Serum, certified, US origin | Thermo Fisher Scientific | 16000044 | |
| Antibiotic-Antimycotic (100X) | Thermo Fisher Scientific | 15240062 | |
| Corning 96-well Clear Round Bottom Ultra-Low Attachment Microplate | Corning | 7007 | |
| Gibco PBS, pH 7.4 | Thermo Fisher Scientific | 10010023 | |
| Gibco Trypsin-EDTA (0.5%) | Thermo Fisher Scientific | 15400054 | |
| Forma Series II 3110 Water-Jacketed CO2 Incubators | Thermo Fisher Scientific | 3120 | |
| Gloves | VWR | 89428-750 | |
| Parafilm | Sigma-Aldrich | P7793 | |
| Transfer pipets | Globe Scientific | 138080 | |
| Centrifuge | Eppendorf | 5702 R | To centrifuge the 15 mL tube |
| Centrifuge | NUAIRE | AWEL CF 48-R | To centrifuge the 96-well plate |
| Microscope | Olympus | ||
| Name | Company | Catalog Number | Comments |
| Histology & IHC | |||
| Digital slide scanner | Leica | Aperio AT2 | Obtain high-resolution histological images |
| Histology Service | Histowiz | Request service for histological and immunohistological staining of tumor spheroid | |
| Name | Company | Catalog Number | Comments |
| List of Commerical OCTs | |||
| SD-OCT system | Thorlabs | Telesto Series | |
| SD-OCT system | Wasatch Photonics | WP OCT 1300 nm | |
| Name | Company | Catalog Number | Comments |
| Software for Data Analyses | |||
| Basic Image Analysis | NIH | ImageJ | Fiji also works. |
| 3D Rendering | Thermo Fisher Scientific | Amira | Commercial software. Option 1 |
| 3D Rendering | Bitplane | Imaris | Commercial software. Option 2. Used in the protocol |
| OCT acquisition software | custom developed in C++. | ||
| Stage Control | Beijing Mao Feng Optoelectronics Technology Co., Ltd. | MRC_3 | Incorporated into the custom OCT acquisition code |
| OCT processing software | custom developed in C++. Utilize GPU. Incorporated into the custom OCT acquisition code. | ||
| Morphological and Physiological Analysis | custom developed in MATLAB |
参考文献
- Kola, I., Landis, J. Can the pharmaceutical industry reduce attrition rates?. Nature Reviews Drug Discovery. 3 (8), 711-716 (2004).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18, 240-249 (2013).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Sutherland, R. M. Cell and environment interactions in tumor microregions: the multicell spheroid model. Science. 240 (4849), 177-184 (1988).
- Mueller-Klieser, W. Three-dimensional cell cultures: from molecular mechanisms to clinical applications. American Journal of Physiology - Cell Physiology. 273, C1109-C1123 (1997).
- Friedrich, J., Seidel, C., Ebner, R., Kunz-Schughart, L. A. Spheroid-based drug screen: considerations and practical approach. Nature Protocols. 4 (3), 309-324 (2009).
- Tung, Y. -. C., et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. The Analyst. 136 (3), 473-478 (2011).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC biology. 10, 29 (2012).
- LaBarbera, D. V., Reid, B. G., Yoo, B. H. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opinion on Drug Discovery. 7, 819-830 (2012).
- Pampaloni, F., Ansari, N., Stelzer, E. H. K. High-resolution deep imaging of live cellular spheroids with light-sheet-based fluorescence microscopy. Cell and Tissue Research. 352, 161-177 (2013).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Miniaturized three-dimensional cancer model for drug evaluation. Assay and Drug Development Technologies. 11 (7), 435-448 (2013).
- Wenzel, C., et al. 3D high-content screening for the identification of compounds that target cells in dormant tumor spheroid regions. Experimental Cell Research. 323 (1), 131-143 (2014).
- Astashkina, A., Grainger, D. W. Critical analysis of 3-D organoid in vitro cell culture models for high-throughput drug candidate toxicity assessments. Innovative tissue models for drug discovery and development. 69, 1-18 (2014).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- Gong, X., et al. Generation of multicellular tumor spheroids with microwell-based agarose scaffolds for drug testing. PLoS ONE. 10 (6), e0130348 (2015).
- Hoffmann, O. I., et al. Impact of the spheroid model complexity on drug response. Journal of biotechnology. 205, 14-23 (2015).
- Martinez, N. J., Titus, S. A., Wagner, A. K., Simeonov, A. High-throughput fluorescence imaging approaches for drug discovery using in vitroand in vivothree-dimensional models. Expert Opinion on Drug Discovery. 10, 1347-1361 (2015).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology, Therapeutics. 163, 94-108 (2016).
- Li, L., Zhou, Q., Voss, T. C., Quick, K. L., LaBarbera, D. V. High-throughput imaging: Focusing in on drug discovery in 3D. Methods. 96, 97-102 (2016).
- Ham, S. L., Joshi, R., Thakuri, P. S., Tavana, H. Liquid-based three-dimensional tumor models for cancer research and drug discovery. Experimental Biology and Medicine. 241 (9), 939-954 (2016).
- Kessel, S., et al. High-Throughput 3D Tumor Spheroid Screening Method for Cancer Drug Discovery Using Celigo Image Cytometry. Journal of Laboratory Automation. , 2211068216652846 (2016).
- Stock, K., et al. Capturing tumor complexity in vitro: Comparative analysis of 2D and 3D tumor models for drug discovery. Scientific Reports. 6, 28951 (2016).
- Thakuri, P. S., Ham, S. L., Luker, G. D., Tavana, H. Multiparametric analysis of oncology drug screening with aqueous two-phase tumor spheroids. Molecular Pharmaceutics. 13 (11), 3724-3735 (2016).
- Lin, R. Z., Chang, H. Y. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnology Journal. 3 (9-10), 1172-1184 (2008).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cancer multicellular spheroids: Volume assessment from a single 2D projection. Computer Methods and Programs in Biomedicine. 118 (2), 95-106 (2015).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
- Debnath, J., Brugge, J. S. Modelling glandular epithelial cancers in three-dimensional cultures. Nature Reviews Cancer. 5 (9), 675-688 (2005).
- Huang, D., et al. Optical coherence tomography. Science. 254 (5035), 1178-1181 (1991).
- Drexler, W., et al. Optical coherence tomography today: speed, contrast, and multimodality. Journal of Biomedical Optics. 19 (7), 071412 (2014).
- Fujimoto, J., Swanson, E. The development, commercialization, and impact of optical coherence tomography. Investigative Ophthalmology, Visual Science. 57 (9), (2016).
- Vakoc, B. J., Fukumura, D., Jain, R. K., Bouma, B. E. Cancer imaging by optical coherence tomography: preclinical progress and clinical potential. Nature Reviews Cancer. 12 (5), 363-368 (2012).
- Wojtkowski, M. High-speed optical coherence tomography: basics and applications. Applied optics. 49 (16), D30-D61 (2010).
- Drexler, W., Fujimoto, J. G. . Optical coherence tomography: technology and applications. , (2008).
- Geitzenauer, W., Hitzenberger, C. K., Schmidt-Erfurth, U. M. Retinal optical coherence tomography: past, present and future perspectives. British Journal of Ophthalmology. 95 (2), 171 (2011).
- Sakata, L. M., DeLeon-Ortega, J., Sakata, V., Girkin, C. A. Optical coherence tomography of the retina and optic nerve - a review. Clinical, Experimental Ophthalmology. 37 (1), 90-99 (2009).
- van Velthoven, M. E. J., Faber, D. J., Verbraak, F. D., van Leeuwen, T. G., de Smet, M. D. Recent developments in optical coherence tomography for imaging the retina. Progress in Retinal and Eye Research. 26 (1), 57-77 (2007).
- Kashani, A. H., et al. Optical coherence tomography angiography: A comprehensive review of current methods and clinical applications. Progress in Retinal and Eye Research. 60, 66-100 (2017).
- de Carlo, T. E., Romano, A., Waheed, N. K., Duker, J. S. A review of optical coherence tomography angiography (OCTA). International Journal of Retina and Vitreous. 1 (1), 5 (2015).
- Sharma, M., Verma, Y., Rao, K. D., Nair, R., Gupta, P. K. Imaging growth dynamics of tumour spheroids using optical coherence tomography. Biotechnology Letters. 29 (2), 273-278 (2006).
- Jung, Y., Nichols, A. J., Klein, O. J., Roussakis, E., Evans, C. L. Label-Free, Longitudinal Visualization of PDT Response In Vitro with Optical Coherence Tomography. Israel Journal of Chemistry. 52 (8-9), 728-744 (2012).
- Huang, Y., et al. Optical coherence tomography detects necrotic regions and volumetrically quantifies multicellular tumor spheroids. Cancer Research. 77 (21), 6011-6020 (2017).
- Spalteholz, W. . Über das Durchsightigmachen von menschlichen und tierischen Präparaten: nebst Anhang, Über Knochenfärbung. , (1911).
- Dodt, H. -. U., et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nature Methods. 4 (4), 331 (2007).
- Leitgeb, R., Hitzenberger, C., Fercher, A. F. Performance of fourier domain vs. time domain optical coherence tomography. Optics express. 11 (8), 889-894 (2003).
- Jian, Y., Wong, K., Sarunic, M. V. . Optical Coherence Tomography and Coherence Domain Optical Methods in Biomedicine XVII. , 85710Z (2013).
- Guizar-Sicairos, M., Thurman, S. T., Fienup, J. R. Efficient subpixel image registration algorithms. Optics Letters. 33 (2), 156-158 (2008).
- Canny, J. A computational approach to edge detection. IEEE Transactions on Pattern Analysis and Machine Intelligence. (6), 679-698 (1986).
- Vermeer, K. A., Mo, J., Weda, J. J. A., Lemij, H. G., de Boer, J. F. Depth-resolved model-based reconstruction of attenuation coefficients in optical coherence tomography. Biomedical Optics Express. 5 (1), 322-337 (2014).
- Klein, T., et al. Multi-MHz retinal OCT. Biomedical Optics Express. 4, 1890-1908 (2013).
- Klein, T., Huber, R. High-speed OCT light sources and systems [Invited]. Biomedical Optics Express. 8 (2), 828-859 (2017).
- Zhou, C., Alex, A., Rasakanthan, J., Ma, Y. Space-division multiplexing optical coherence tomography. Optics Express. 21, 19219-19227 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved