A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת התגובה החיסונית הסלולר של זבוב הפירות, דרוזופילה melanogaster, שימוש ב Vivo Phagocytosis Assay
In This Article
Summary
פרוטוקול זה מתאר וזמינותו של phagocytosis ויוו ב מבוגרים דרוזופילה melanogaster לכמת פגוציט הכרה ואישור של זיהומים חיידקים.
Abstract
כל בעלי החיים, מולדת חסינות מספקת של הגנה חזקה ומיידית נגד קשת רחבה של פתוגנים. תגובות חיסוניות ההורמונאלית וסלולריות הענפים העיקריים של מולדת חסינות הינם רבים הגורמים ויסות התגובות הללו אבולוציונית נשמרים בין חסרי חוליות, יונקים. Phagocytosis, היא מרכיב מרכזי של מולדת חסינות תאית, מבוצעת על ידי תאים מיוחדים דם של המערכת החיסונית. זבוב הפירות, דרוזופילה melanogaster, התפתחה מודל גנטי חזק כדי לחקור את המנגנונים המולקולריים ואת ההשפעות הפיזיולוגיות של phagocytosis בבעלי חיים שלם. כאן אנחנו מדגימים מבוססת על הזרקת phagocytosis ויוו assay לכמת את ספיגת החלקיקים ואת הרס על ידי דרוזופילה כדוריות הדם, hemocytes. ההליך מאפשר לחוקרים הבקרה בדיוק את ריכוז החלקיקים ואת המינון, מאפשר להשיג תוצאות מאוד לשחזור בתוך זמן קצר. הניסוי הוא כמותי, קל לביצוע, וניתן להחילם על המסך עבור גורמים מארח את זיהוי פתוגן השפעת ספיגת, סיווג.
Introduction
מערכות ההגנה החיסוניות מולדת יוצרים את השורה הראשונה של הגנה מפני חיידקים פתוגניים. תגובות אלה ניתן לחלק באופן פונקציונלי לתוך ההורמונאלית וסלולריות מולדת חסינות, אשר שניהם נמצאים מתווך על ידי קולטנים זיהוי התבנית בקידוד germline (PRRs) לחוש פתוגן-הקשורים דפוסי מולקולרית (PAMPs)1. רבים מן המסלולים איתות ומנגנונים אפקטור של מולדת חסינות נשמרים יונקים, חסרי חוליות, כגון של תולעים נימיות, Caenorhabditis elegans, זבוב הפירות, דרוזופילה melanogaster2. זבוב הפירות התפתחה מערכת חזקה ללמוד מארח הגנה מפני מיקרואורגניזמים זיהומיות3. דרוזופילה הוא צייתן גנטית, בקלות ובזול גדלו במעבדות, ויש לו זמן דור קצר. יתר על כן, זבוב הפירות המוצגים ההגנה היעילה ביותר נגד מערך של חיידקים, המאפשר הבחינה של המארח חסינות מפני גורמי מחלה ויראלי, חיידקי, פטרייתי או טפילים.
דרוזופילה immunologists היסטורית מסויימת קדימה מסכי גנטי, הגנום כולו בתיווך RNA הפרעה (RNAi) הקרנה של שורות תאים חרקים, קיימים זנים לעוף מוטנטים לבחון מולדת חסינות – המוביל זיהוי ואפיון של מספר המסלולים החיסונית ההורמונאלית אבולוציונית שנשמרת4,5,6,7,8. התגובה החיסונית מולדת ההורמונאלית, ניתן לטעון, הכי טוב מאופיין ההגנה החיסונית של זבובי פירות. לאחר ההדבקה, התגובה ההורמונאלית מוביל ייצור ושחרור מערכתית של פפטיד מיקרוביאלית (כח) מולקולות לתוך hemolymph, הדם המקביל בחרקים. מגברים המיוצרים על ידי אגרה מאוד שנשמרת Imd מסלולי איתות. מסלול אגרה זה הומולוגי ל בתרבית של קולטן TLR/IL-1R איתות, מסלול Imd הומולוגי ל הגידול נקרוזה מקדם יונקים-אלפא איתות. ב . דרוזופילה, אגרה איתות הנגרמת על ידי חיידקים גראם חיוביים, פטריות ו viru דרוזופילה Xs6,9,10 , Imd איתות הנגרמת על ידי חיידקים גראם שליליים11 ,12.
חסינות תאית, המורכב כימוס, melanization ו- phagocytosis של פתוגנים פולשני, שביצעו תאי דם מיוחד הנקרא hemocytes13. ישנם שלושה סוגים של hemocytes זבוב הפירות: קריסטל תאים, lamellocytes ו- plasmatocytes13. קריסטל תאים, אשר מהווים 5% של hemocytes במחזור של הזחלים, שחרור אנזימים proPhenoloxidase (צע) שמוביל melanization של פתוגנים ורקמות מארח באתרים הפצע. Lamellocytes, אשר לא כלל נמצאים העוברים בריאים או הזחלים, הם תאים חסיד הכומסים חפצים זרים. תאים אלה הם המושרה על pupariation או כאשר הביצים צרעה parasitizing מופקדים הזחלים. Plasmatocytes phagocytic, אשר מהווים 95% של מחזורי hemocytes של הזחלים, כל שנותר hemocytes אצל מבוגרים, לשחק תפקיד רקמת שיפוץ במהלך הפיתוח ולשמש, ראוי לציין, התא אפקטור הראשי של חסינות תאית דרוזופילה .
Phagocytosis קו מיידית וגם קריטיים של ההגנה החיסונית מולדת; חיידקים זה לפרוץ את מחסום האפיתל של המארח במהירות אפף, חוסל על ידי תאי דם phagocytic (לסקירה מקיפה של ביולוגיה של התא של phagocytosis ראה אסמכתא 14). תהליך זה הוא יזם בעת זיהוי תבניות מקודד germline רצפטורים (PRRs) על hemocytes מזהה את הפתוגן הקשורים דפוסי מולקולרית (PAMPs) של חיידקים. פעם קשור אל המטרות שלהם, PRRs ליזום cascades איתות להוביל להיווצרות של pseudopods דרך אקטין שיפוצים שלד התא. Pseudopods מקיפים תא החיידק, אשר לאחר מכן נבלע, הפנימו לתוך אברון המתהווה, phagosome. חיידקים מושמדים כמו phagosome עובר התהליך של התבגרות phagosome כאשר phagosome הוא הנסחר לכיוון הפנים של hemocyte acidifies דרך סדרה של אינטראקציות עם lysosomes. חוץ גופית ו תא לימודי ביולוגיה בתרבית של תאי העיקרי היה אינסטרומנטלי זיהוי ואפיון הגורמים לווסת phagocytosis, כגון בתרבית של קולטן Fc-גמא ו- C3b קולטנים15,16. ובכל זאת, היכולת לבצע מסכי בקנה מידה גדול או לימודים ויוו מוגבלים במערכות יונקים.
כאן נציג של assay ויוו עבור phagocytosis ב זבובי פירות למבוגרים, אשר מבוססת על הליך הוצג לראשונה על ידי המעבדה של דוד שניידר 200017. המעבדה שניידר הראה כי hemocytes sessile אכילת הכלי הגבי בטן בקלות phagocytose חרוזי פוליסטירן וחיידקים. כדי להמחיש phagocytosis, זבובים מוזרקים עם חלקיקים fluorescently שכותרתו (כגון e. coli המסומנת fluorescein isothiocyanate (e. coli -FITC)), מודגרות במשך 30 דקות לאפשר זמן hemocytes להחריב את החלקיקים, ולאחר מכן הזריקו trypan blue, אשר המרווה את זריחה של חלקיקים לא phagocytosed במהלך תקופת הדגירה. כלי הגבי לעוף ואז עם תמונה באמצעות מיקרוסקופ פלורסנט הפוכה. את העבודה הזו, באמצעות ניסוי פשוט יחסית, הדגימו כי hemocytes phagocytose חיידקים, חרוזים לייטקס, הזה phagocytosis חיידקי יכול להיות מעוכב מראש הזרקת טס עם חרוזים לייטקס, ואת זה לא טס בלי הסלולר והן ההורמונאלית תגובות חיסוניות רגישים אפילו e. coli. וזמינותו שהובאו בדו ח זה מתבסס על העבודה של המעבדה שניידר לכמת phagocytosis ויוו על ידי מדידת עוצמת קרינה פלואורסצנטית של חלקיקים נבלע על ידי כלי הגבי הקשורים hemocytes.
בדומה את הגישה במערכות יונקים, גנטיקאים דרוזופילה השתמשו בתחילה ברמת הגנום RNAi במבחנה מסכי לזיהוי גנים הדרושים עבור התגובה החיסונית הסלולר18,19,20 ,21,22,23. עם זאת, התפתחות וזמינותו phagocytosis ויוו למבוגרים מופעלת ניסויים מעקב יבוצע בקלות אצל בעלי חיים שלמה, ובכך מאפשר לחוקרים לוודא הביולוגי את התפקיד של הגורמים שזוהו במחקרים במבחנה. כזה היה המקרה עם הקולטן transmembrane אוכל, אשר זיהה לראשונה את כל קולטן חיידקי במסך RNAi באמצעות S2 תאים24 מוצג מאוחר יותר כדי לתווך Escherichia coli (e. coli), Enterococcus faecalis, , Staphylococcus aureus (S. aureus) phagocytosis מבוגרים25.
במעבדה מועסקים וזמינותו phagocytosis ויוו מסכי גנטי קדימה ולימודים הגנום כולו האגודה (באמצעות את דרוזופילה גנטי הפניה לוח (DGRP)) לזיהוי הרומן גנים המווסתים phagocytosis ב hemocytes למבוגרים. מחקרים אלה הובילו איפיון קולטני PGRP-SC1A, PGRP-SA26, את שלפוחית תאיים סחר חלבון Rab1427, גלוטמט טרנספורטר פוליפמוס28ו RNA-מחייב חלבון פוקס-129.
אנו צופים מסכי לעתיד שילוב של phagocytosis ויוו עלול להוביל הזיהוי של גנים נוספים חשובים עבור התגובה החיסונית הסלולר דרוזופילה. המסכים באמצעות וסודרו באופן מלא שורות המפגרים, כגון DGRP או את דרוזופילה סינתטי האוכלוסייה משאבים (DSPR), ניתן לזהות משתנים טבעיים המשפיעים על התפתחות phagocytosis או hemocyte. יתר על כן, הטכניקה בפרשה מינים אחרים של דרוזופילה או בשימוש למשאבי קהילה חדש המסך, כגון האוסף של 250 מינים דרוזופילה , נשמר על ידי נבחרת דרוזופילה מינים מניות מרכז (NDSSC ) בקורנל. ניסויים אלה יכולים להתבצע באמצעות fluorescently-ידי חיידקי או פטרייתי קיר bioparticles זמינים מסחרית או יכול להתבצע באמצעות מספר כלשהו של חיידקי או פטרייתי מינים – סיפק החיידק מבטאת את סמני פלורסנט .
Protocol
1. מכינים את חלקיקי Fluorescein להזרקה
- לשקם 10 מ ג של חיידקים זמינים מסחרית, חום-נהרג חלקיקים המסומנת fluorescein (ראה טבלה של חומרים) כדי ריכוז מניות של 10 מ"ג/מ"ל על-ידי הוספת 990 µL עקר 1 x PBS אזיד הנתרן 50 מ מ µL 10. מערבולת לערבב.
- לחלק לשימוש יחיד aliquots µL 8 צינורות 0.2 מ"ל ולאחסן בקופסא כהה ב 4 ° C כדי למזער את רגישות לאור המשויך.
הערה: משמר אזיד הנתרן הוא אופציונלי והוא יכול להיות מושמט אם המניות 10 מ"ג/מ"ל נעשים עם PBS עקר 1 x 1 מ"ל, aliquoted, ומאוחסן ב-20 ° C.
- לחלק לשימוש יחיד aliquots µL 8 צינורות 0.2 מ"ל ולאחסן בקופסא כהה ב 4 ° C כדי למזער את רגישות לאור המשויך.
- להפוך את פתרון 10 מ"ל של 5% מאכל ב- PBS 1 x על ידי ערבוב 500 µL מזרק מסונן אוכל ירוק צביעה ו- 9.5 mL x 1 סטרילי PBS.
- רחץ חלקיקים לפני הזרקת להסיר אזיד הנתרן. מיקס 42 µL 1 סטרילי-PBS ו- µL 8 של 10 מ"ג/מ"ל בשפופרת 1.7 מ. צנטריפוגה-מהירות מקסימלית 2.5 דקות בטמפרטורת החדר.
- הסר את תגובת שיקוע, להוסיף 50 µL 1 x PBS צנטריפוגה בכל מהירות מקסימלית 2.5 דקות בטמפרטורת החדר.
- חזור על שלבים 1.3 ו 1.3.1 x 2, עבור סכום כולל של 3 מנקי.
- לאחר השטיפה הסופית למחוק את תגובת שיקוע, מחדש להשעות חלקיקי 1.6 מ"ג/מ"ל ב- 50 µL של 5% מאכל ב- 1 x PBS.
- לעטוף את הצינור בנייר אלומיניום כדי להגן מפני אור. לאחסן ב 4 ° C, למחוק לאחר שבוע אחד.
2. מכינים את הזרקת תחנת וזבובים
- להכין משטח הזרקה. כדי להזריק עד 4 אחרים של זבובים באותו זמן, שימוש בקלטת מעבדה כדי לחלק זבוב2 CO מלבני פאד לתוך 4 סעיפים. על הספסל ליד המיקרוסקופ, לייעד שטחים כדי למקם את הבקבוקונים ברגע זבובים גויסו על משטח (אחד לכל פינה של כרית).
- מכינים צלוחיות של גיל-מתאימים, 4-7 ימים-זקן, זבובים להזרקה. עבור כל זן להיבדק, להעביר 5 זכרים ונקבות 5 לתוך בקבוקון טריים, עם תוויות של אוכל מוכן לטוס ולשמור על 25 מעלות צלזיוס.
- להכין את מזרק פנאומטיים (ראה טבלה של חומרים) על-ידי הגדרת המכשיר מצב מתוזמן -100 מילישניות (צרורות קצרים של גז בלחץ לגרש את הנוזל – המאפשר את המשלוח של אמצעי אחסון תת-nanoliter).
- הכינו את שקופיות מיקרוסקופ. לחתוך רצועות 1.5 אינץ של איזולירבנד, מקפלים לתוך לולאה עם הצד דבק החוצה, ולמקם לשקופית שכותרתו מיקרוסקופ.
3. מכינים מחטים נימי זכוכית
- משוך זכוכית מחטים (נימים זכוכית קיר דק) באמצעות של פולר המחט.
- להחזיק את המחט מתחת למיקרוסקופ מיקרומטר, שבור את הקצה באמצעות מלקחיים נירוסטה הצבע בסדר #5. 100 מיקרומטר טיפים מספיקים לחדור לקוטיקולה של הזבוב תוך מזעור ופצעו.
- למדוד את עוצמת הקול של נוזל זה יוזרקו כל זבוב. לטעון את המחט עם 5% סטרילי מאכל ב- PBS 1 x ולגרש את הנוזל על טיפה של שמן מינרלי-מיקרומטר הבמה 0.01 מ מ.
הערה: אם ה-droplet נוזלי כדורית, עוצמת הקול של picoliters מחושבת (גודל)3/1910. 30 מחט בקוטר 100 מיקרומטר יפלוט ~ 2 nL ב-100 מילישניות.
4. להזריק זבובים
- פיפטה µL 10 חלקיקים 1.6 מ"ג/מ"ל אל כיכר קטנה של מצלמות-מיקרוסקופים.
- משוך את הנוזל לתוך המחט והר בתוך הצינור מזרק (ראה טבלה של חומרים).
- עזים ומתנגד זבובים עם CO2 , סדר אותם בשורה באזור המיועד שלהם על flypad, עם הצד הבטני למעלה וראשי הפונה לכיוון החלק הקדמי של משטח. מניחים צלוחיות באזורים המתאימים על הספסל.
- להזריק זבובים בפינה העליונה של הבטן עם משאבות 5, 100 ms של נוזל (~ 10 nL סה כ).
- להעביר את הזבובים מוזרק הבקבוקונים המתאים, שים לב הפעם על המבחנה. לשמור על 25 מעלות צלזיוס.
- לטעון מחט חדשה עם 0.4% Trypan Blue פתרון.
- הגדר את מזרק פנאומטיים מגודרת, אשר מאפשר זרם קבוע של אוויר כדי לדחוף את הנוזלים המחט.
- עזים ומתנגד זבובים אחרי שנחו למשך 30 דקות, להזריק Trypan Blue עד הבטן נפוחה ומלאים.
הערה: כאשר בחינת ההבשלה phagosome עם חלקיקים עם צבע pH רגיש תוויות, לאפשר זבובים לנוח לשעה, לא להזריק trypan blue לפני הרכבה זבובים. - הר זבובים על שקופיות מיקרוסקופ עם איזולירבנד, בצד הגחוני למטה. לדחוף את הכנפיים לצד של הזבוב ולאבטח אותם לקלטת. בנוסף, בעדינות לדחוף את הראש לתוך הקלטת כדי להבטיח כי הזבוב לא יזוז.
- מיד לעבור שלב 5.
5. הדמיה זבובים
- התמונה זבובים, אחד בכל פעם, 25 x או 32 x הגדלה באמצעות מיקרוסקופ פלורסצנטיות הפוכה המצורפת ממצלמה דיגיטלית, מחשב (ראה טבלה של חומרים). להתמקד בכלי הגבי של הזבוב באמצעות תוכנת מחשב עבור המצלמה הדיגיטלית.
- להקליט את זמן החשיפה ואת ההגדלה בין ניסויים.
הערה: איבוד תחושת אחרים היא מקור פוטנציאלי של שגיאה כאשר מצלמים זנים מרובים במכה אחת. כדי להימנע המטעות זבובים, רשום את מספר התמונה התצלום הראשון והאחרון לטוס עבור כל גנוטיפ.
6. לכימות, נורמליזציה של קרינה פלואורסצנטית
- לפתוח את התוכנה ופתח תמונה אחת בכל פעם.
- למדוד את עוצמת קרינה פלואורסצנטית של כלי השיט הגבי. לצייר מצולע סביב הספינה הגבי. בחר מדד ולהקליט את עוצמת קרינה פלואורסצנטית בתוך המצולע.
- קבע את עוצמת קרינה פלואורסצנטית רקע. להעתיק את המצולע הראשונה ולהעביר אותה לאזור סמוך לכלי השיט הגבי של הזבוב. בחר מדד עוצמת קרינה פלואורסצנטית הרשומה של אזור רקע.
- לנרמל את הכלי הגבי זריחה על-ידי קרינה פלואורסצנטית הרקע:
כלי הגבי ÷ רקע. - לחשב שהממוצע מנורמל עוצמת קרינה פלואורסצנטית כלי הגבי זבובים כל זן.
- חזור על הניסוי 2 פעמים נוספות.
- שימוש תלמיד של אינטראקצית t-test כדי להשוות עוצמות קרינה פלואורסצנטית היחסי רשע זבובים שליטה ולבדוק טסה 3 ניסויים. לחשב את גודל האפקט באמצעות הנוסחה: של כהן d = (ז1- M2) ÷ SDבמאגר, כאשר M1 הוא הממוצע של גנוטיפ 1 ו- M2 הוא הממוצע של גנוטיפ 2 &
SD במאגר =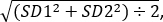
כאשר SD1 הוא סטיית התקן של גנוטיפ 1 ו- SD2 הוא סטיית התקן של גנוטיפ 2.
תוצאות
תיאור סכמטי של וזמינותו phagocytosis ויוו באמצעות חלקיקים התווית על-ידי fluorescein מוצג איור 1A. זבובים הם נטענים בצד הגחוני למטה על פיסת סרט בידוד והוא קודם שני מגזרים של הבטן, איפה נמצא כלי הקיבול הגבי, נראה בבירור (איור 1B). מפתח מקורות השגיאה ניסיונ?...
Discussion
חלקיקים זמינים מסחרית, שכותרתו fluorescently משמשים כדי להעריך phagocytosis באופן כללי (0.2 µm carboxylate-השתנה microspheres) או phagocytosis של חיידקים (שכותרתו fluorescently חום - או כימית להרוג חיידקים או שמרים). כדי להעריך את ההבשלה phagosome, החוקרים יכולים לבחור חלקיקים עם צבע pH רגיש הזה שזוהר כאשר pH מקטין מ ניטראלי כדי ...
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים מודים גונזלס בט ר ו ד ר Aprajita Garg על תמיכה בביצוע הניסויים phagocytosis ויוו. גרנט זרע של ה-NSF UMD מראש, UMD NIH T32 הכשרה, התא, ביולוגיה מולקולרית (מק) ומענקים של פתוגן-פונדקאי אינטראקציות (מדד מחירי הבתים של), מימנו את העבודה הזאת.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2μm Red Fluorescent Carboxylate Modified FluoSpheres | Invitrogen | F8810 | Fluorescently-labeled latex beads to test general phagocytic capacity of phagocytes. (~580/~605 nm) Inject a 1:20 dilution in PBS with 5% dye. |
| 5430-10 PicoNozzle Kit | World Precision Instruments | 5430-10 | Holder for 1.0mm pipette |
| E. coli (K-12 Strain) BioParticles, Alexa Fluor 488 conjugate | Invitrogen | E13231 | Killed E. coli labeled with Alexa Fluor 488. Use to test phagocyte recogntion and uptake of gram-negative bacteria. (~495/~519 nm) |
| E. coli (K-12 Strain) BioParticles, Alexa Fluor 594 conjugate | Invitrogen | E23370 | Killed E. coli labeled with Alexa Fluor 594. Use to test phagocyte recogntion and uptake of gram-negative bacteria. (~590/~617 nm) |
| E. coli (K-12 Strain) BioParticles, Fluorescein conjugate | Invitrogen | E2861 | Killed E. coli labeled with FITC (Fluorescein). Use to test phagocyte recogntion and uptake of gram-negative bacteria. (~494/~518 nm) |
| E. coli (K-12 Strain) BioParticles, Texas Red conjugate | Invitrogen | E2863 | Killed E. coli labeled with Texas Red. Use to test phagocyte recogntion and uptake of gram-negative bacteria. (~595/~615 nm) |
| E. coli (K-12 Strain) BioParticles, Texas Red conjugate | Invitrogen | E2863 | Killed E. coli labeled with Texas Red. Use to test phagocyte recogntion and uptake of gram-negative bacteria. (~595/~615 nm) |
| Needle Pipette Puller | David Kopf Instruments | Model 725 | |
| pHrodo Red E. coli BioParticles Conjugate for Phagocytosis | Invitrogen | P35361 | Killed E. coli labeled with pHrodo Red. Use to test phagocyte reconition, uptake, and phagosome maturation of gram-negative bacteria. (~560/~585 nm). No need to quench with Trypan Blue. |
| pHrodo Red S. aureus BioParticles Conjugate for Phagocytosis | Invitrogen | A10010 | Killed S. aureus labeled with pHrodo Red. Use to test phagocyte reconition, uptake, and phagosome maturation of gram-positve bacteria. (~560/~585 nm). No need to quench with Trypan Blue. |
| Pneumatic PicoPump PV820 | World Precision Instruments | SYS-PV820 | The World Precision Instruments Pneumatic PicoPump PV820 uses differential pressures to hold liquid in the glass needle between injections. The user manually controls short bursts of gas pressure to expel the liquid – allowing delivery of sub-nanoliter volumes. The amount of liquid delivered depends on two main variables – the size of the glass needle opening and the amount of time injection pressure is applied. set the instrument to 100 ms “TIMED” mode. |
| S. aureus (Wood Strain without protein A) BioParticles, Alexa Fluor 488 conjugate | Invitrogen | S23371 | Killed S. aureus labeled with Alexa Fluor 488. Use to test phagocyte recogntion and uptake of gram-positive bacteria. (~495/~519 nm) |
| S. aureus (Wood Strain without protein A) BioParticles, Alexa Fluor 594 conjugate | Invitrogen | S23372 | Killed S. aureus labeled with Alexa Fluor 594. Use to test phagocyte recogntion and uptake of gram-positive bacteria. (~590/~617 nm) |
| S. aureus (Wood Strain without protein A) BioParticles, Fluorescein conjugate | Invitrogen | E2851 | Killed S. aureus labeled with FITC (Fluorescein). Use to test phagocyte recogntion and uptake of gram-positive bacteria. (~494/~518 nm) |
| Thin Wall Glass Capillaries | World Precision Instruments | TW100F-3 | Needles for injection. OD = 1.0 mm |
| Trypan Blue Solution (0.4%) | Sigma | T8154 | Used to quench extracellular fluorescence of Fluorescein, Alexa Fluor, or Texas Red labeled particles. |
| ZEISS SteREO Microscope (Discovery.V8) | Zeiss | SteREO Discovery.V8 | Inverted fluorescence microscope for imaging flies. Use a digital camera (example: AxioCam HC camera) and the accompanying software (example: AxioVision 4.7 software) to take pictures. |
| Zymosan A (Saccharomyces cerevisiae) BioParticles, Alexa Fluor 488 conjugate | Invitrogen | Z23373 | Killed labeled with Alexa Fluor 488. Use to test phagocyte recogntion and uptake of yeast. (~495/~519 nm) |
| Zymosan A (Saccharomyces cerevisiae) BioParticles, Alexa Fluor 594 conjugate | Invitrogen | Z23374 | Killed labeled with Alexa Fluor 594. Use to test phagocyte recogntion and uptake of yeast. (~590/~617 nm) |
| Zymosan A (Saccharomyces cerevisiae) BioParticles, Fluorescein conjugate | Invitrogen | Z2841 | Killed labeled with FITC (Fluorescein). Use to test phagocyte recogntion and uptake of yeast. (~494/~518 nm) |
| Zymosan A (Saccharomyces cerevisiae) BioParticles, Texas Red | Invitrogen | Z2843 | Killed labeled with Texas Red. Use to test phagocyte recogntion and uptake of yeast. (~595/~615 nm) |
References
- Akira, S., Uematsu, S., Takeuchi, O. Pathogen recognition and innate immunity. Cell. 124 (4), 783-801 (2006).
- Kim, D. Studying host-pathogen interactions and innate immunity in Caenorhabditis elegans. Disease Models & Mechanisms. 1 (4-5), 205-208 (2008).
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annual Review Immunology. 25, 697-743 (2007).
- Wu, L. P., Choe, K. M., Lu, Y., Anderson, K. V. Drosophila Immunity: Genes on the Third Chromosome Required for the Response to Bacterial Infection. Genetics. 159 (1), 189-199 (2001).
- De Gregorio, E., Spellman, P. T., Tzou, P., Rubin, G. M., Lemaitre, B. The Toll and Imd pathways are the major regulators of the immune response in Drosophila. EMBO Journal. 21 (11), 2568-2579 (2002).
- Michel, T., Reichhart, J. M., Hoffmann, J. A., Royet, J. Drosophila Toll is activated by Gram-positive bacteria through a circulating peptidoglycan recognition protein. Nature. 414 (6865), 756-759 (2001).
- Choe, K. M., Werner, T., Stoven, S., Hultmark, D., Anderson, K. V. Requirement for a peptidoglycan recognition protein (PGRP) in Relish activation and antibacterial immune responses in Drosophila. Science. 296 (5566), 359-362 (2002).
- Wu, J., Randle, K. E., Wu, L. P. ird1 is a Vps15 homologue important for antibacterial immune responses in Drosophila. Cellular Microbiology. 9 (4), 1073-1085 (2007).
- Lemaitre, B., Nicolas, E., Michaut, L., Reichhart, J. M., Hoffmann, J. A. The dorsoventral regulatory gene cassette spatzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell. 86 (6), 973-983 (1996).
- Zambon, R. A., Nandakumar, M., Vakharia, V. N., Wu, L. P. The Toll pathway is important for an antiviral response in Drosophila. Proceedings of the National Academy of Science of the United States of America. 102 (20), 7257-7262 (2005).
- Lemaitre, B., et al. A recessive mutation, immune deficiency (imd), defines two distinct control pathways in the Drosophila host defense. Proceedings of the National Academy of Science of the United States of America. 92 (21), 9465-9469 (1995).
- Leulier, F., Rodriguez, A., Khush, R. S., Abrams, J. M., Lemaitre, B. The Drosophila caspase Dredd is required to resist gram-negative bacterial infection. EMBO Reports. 1 (4), 353-358 (2000).
- Meister, M., Lagueux, M. Drosophilablood cells. Cellular Microbiology. 5 (9), 573-580 (2003).
- Flannagan, R. S., Jaumouille, V., Grinstein, S. The cell biology of phagocytosis. Annual Review Pathology. 7, 61-98 (2012).
- Anderson, R. A., Sando, G. N. Cloning and expression of cDNA encoding human lysosomal acid lipase/cholesteryl ester hydrolase. Similarities to gastric and lingual lipases. Journal of Biological Chemistry. 266 (33), 22479-22484 (1991).
- Ross, G. D., Reed, W., Dalzell, J. G., Becker, S. E., Hogg, N. Macrophage cytoskeleton association with CR3 and CR4 regulates receptor mobility and phagocytosis of iC3b-opsonized erythrocytes. Journal of Leukocyte Biology. 51 (2), 109-117 (1992).
- Elrod-Erickson, M., Mishra, S., Schneider, D. S. Interactions between the cellular and humoral immune responses in Drosophila. Current Biology. 10, 781-784 (2000).
- Ramet, M., Pearson, A. M., Manfruelli, P., Li, X., Koziel, H., Gobel, V. Drosophila Scavenger Receptor CI Is a Pattern Recognition Receptor for Bacteria. Immunity. 15 (6), 1027-1038 (2001).
- Ramet, M., Manfruelli, P., Pearson, A. M., Mathey-Prevot, B., Ezekowitz, R. A. Functional genomic analysis of phagocytosis and identification of a Drosophila receptor for E. coli. Nature. 416 (6881), 644-648 (2002).
- Philips, J. A., Rubin, E. J., Perrimon, N. Drosophila RNAi screen reveals CD36 family member required for mycobacterial infection. Science. 309, 1251-1253 (2005).
- Agaisse, H., Burrack, L. S., Philips, J. A., Rubin, E. J., Perrimon, N., Higgins, D. E. Genome-wide RNAi screen for host factors required for intracellular bacterial infection. Science. 309 (5738), 1248-1251 (2005).
- Stuart, L. M., et al. Response to Staphylococcus aureus requires CD36-mediated phagocytosis triggered by the COOH-terminal cytoplasmic domain. Journal of Cell Biology. 170 (3), 477-485 (2005).
- Stroschein-Stevenson, S. L., Foley, E., O’Farrell, P. H., Johnson, A. D. Identification of Drosophila gene products required for phagocytosis of Candida albicans. PLoS Biology. 4 (1), e4 (2006).
- Kocks, C., et al. Eater, a transmembrane protein mediating phagocytosis of bacterial pathogens in Drosophila. Cell. 123 (2), 335-346 (2005).
- Nehme, N. T., et al. Relative roles of the cellular and humoral responses in the Drosophila host defense against three gram-positive bacterial infections. PLoS One. 6 (3), e14743 (2011).
- Garver, L. S., Wu, J., Wu, L. P. The peptidoglycan recognition protein PGRP-SC1a is essential for Toll signaling and phagocytosis of Staphylococcus aureus in Drosophila. Proceedings of the National Academy of Science of the United States of America. 103 (3), 660-665 (2006).
- Garg, A., Wu, L. P. Drosophila Rab14 mediates phagocytosis in the immune response to Staphylococcus aureus. Cellular Microbiology. 16 (2), 296-310 (2014).
- Gonzalez, E. A., Garg, A., Tang, J., Nazario-Toole, A. E., Wu, L. P. A glutamate-dependent redox system in blood cells is integral for phagocytosis in Drosophila melanogaster. Current Biology. 23 (22), 2319-2324 (2013).
- Nazario-Toole, A. E., Robalino, J., Okrah, K., Corrada-Bravo, H., Mount, S. M., Wu, L. P. The Splicing Factor RNA-Binding Fox Protein 1 Mediates the Cellular Immune Response in Drosophila melanogaster. Journal of Immunology (Baltimore, Md: 1950). 201 (4), 1154-1164 (2018).
- Guille, M. . Molecular Methods in Developmental Biology: Xenopus and Zebrafish. , (1999).
- Koundakjian, E. J., Cowan, D. M., Hardy, R. W., Becker, A. H. The Zuker collection: a resource for the analysis of autosomal gene function in Drosophila melanogaster. Genetics. 167 (1), 203-206 (2004).
- Horn, L., Leips, J., Starz-Gaiano, M. Phagocytic ability declines with age in adult Drosophila hemocytes. Aging Cell. 13 (4), 719-728 (2014).
- Brennan, C. A., Delaney, J. R., Schneider, D. S., Anderson, K. V. Psidin is required in Drosophila blood cells for both phagocytic degradation and immune activation of the fat body. Current Biology. 17 (1), 67-72 (2007).
- Akbar, M. A., Tracy, C., Kahr, W. H., Kramer, H. The full-of-bacteria gene is required for phagosome maturation during immune defense in Drosophila. Journal of Cell Biology. 192 (3), 383-390 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved