このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ミバエショウジョウバエVivo で貪食能アッセイを使用しての細胞性免疫能を評価します。
要約
このプロトコルでは、食細胞の認識および微生物感染症のクリアランスを定量化する大人のショウジョウバエの体内貪食アッセイについて説明します。
要約
すべての動物の生得の免除は幅広い病原体に対する即時かつ堅牢な防御を提供します。体液と細胞の免疫応答は、自然免疫の主枝とこれらの反応を規定する要因の多くは、無脊椎動物、哺乳類間保存されました。貪食細胞の自然免疫の中心的なコンポーネントは、免疫システムの特殊な血液細胞によって行われます。ミバエショウジョウバエ、分子メカニズムと貪食全体動物の生理学的影響を調査するための強力な遺伝モデルとして浮上しています。ショウジョウバエ血液細胞、血球粒子の吸収および破壊を定量化する生体内で貪食のインジェクション ベース試金、ここに示します。手順粒子濃度と投与量、短時間で再現性の高い結果を得ることを正確に制御できます。実験は、実行するために簡単に定量的および宿主因子その影響病原体認識、吸収、およびクリアランスの画面に適用できます。
概要
生得の免疫の防衛は、病原性微生物に対する防御の最初の行を形成します。これらの応答は、体液性および細胞免疫、病原体関連分子パターン (PAMPs)1を意味する生殖細胞でエンコードされたパターン認識受容器 (PRRs) によって仲介されるどちらに機能的に分けることができます。自然免疫エフェクター機構とシグナル伝達経路の多くは哺乳類や無脊椎動物で、マツの材線虫病、線虫ショウジョウバエ、キイロショウジョウバエ2などで保存されています。ショウジョウバエは、伝染性の微生物3防御を勉強する強力なシステムとして登場しました。ショウジョウバエは遺伝的扱い容易そして安く飼育所で、短い世代時間。さらに、フルーツ フライは、微生物、ウイルス、細菌、真菌、または寄生病原体に対する宿主免疫の検査を有効にするの配列に対する非常に効率的な防御を展示します。
ショウジョウバエ免疫歴史的に前方遺伝スクリーン、ゲノム RNA を介した干渉 (RNAi) 昆虫細胞株のスクリーニングおよび既存の調べる免疫-につながる変異ハエ系統を利用して、同定およびいくつか進化上保存された体液性免疫経路4,5,6,7,8。体液性自然免疫応答は、間違いなく、最も特徴的な果実ハエの免疫の防衛。感染は、体液性応答が、それらの昆虫に相当の血液、体液に (AMP) 分子生産と抗菌ペプチドの全身性のリリースに します。アンプは、非常に節約された死者と Imd シグナル伝達経路によって生成されます。通行経路は哺乳類の相同性 TLR/IL-1 r 受容体、シグナル伝達、Imd 経路は哺乳類の腫瘍壊死因子-α シグナルに相同。ショウジョウバエの通行料のグラム陽性の細菌、菌類およびショウジョウバエ X ヴィルの6,9,10によって誘導される信号と11 のグラム陰性菌による Imd シグナリング ,12。
細胞性免疫、侵襲的な病原体の食作用、メラニン化、カプセル化の構成は、血球13と呼ばれる特殊な血液細胞によって実施。フルーツ フライで血液細胞の 3 つのクラスがある: 結晶セル、lamellocytes、および plasmatocytes の13。幼虫の循環血球の 5% を構成する、液晶セルを解放 proPhenoloxidase (プロポ) 酵素病原体と傷のサイトでホスト組織のメラニン化に 。Lamellocytes は、通常健康な胚や幼虫で発見されていない、外部オブジェクトをカプセル化する付着性細胞では。これらの細胞は、pupariation または寄生ハチの卵が幼虫に到着したときに誘導されます。循環血球幼虫と大人の残りすべての血球の 95% を占める食 plasmatocytes は組織開発中に改造の役割を果たすし、特に、ショウジョウバエの細胞性免疫能の主なエフェクター細胞として機能します。
貪食生得の免疫の防衛の即時および重要なラインホスト上皮障壁を突破する微生物迅速に包まれて、白血球の貪食細胞によって排除 (貪食の細胞生物学の包括的な見直し参照14を参照してください)。血液細胞の受容器 (PRRs) 病原体を認識する生殖細胞でエンコードされたパターン認識に微生物の分子パターン (PAMPs) が関連付けられている場合、このプロセスが開始されます。そのターゲットにバインドされた後、PRRs はアクチン細胞骨格改造で仮足の形成につながるシグナル伝達カスケードを開始します。仮足は、その後を巻き込んだ、新生細胞小器官、ファゴソームを内面化微生物を囲んでいます。微生物は、ファゴソーム ファゴソーム成熟の過程を経るは、ファゴソーム、血球の内部に向かって人身売買し、リソソームとの相互作用のシリーズを通して自分ように破棄されます。In vitro 試験および細胞哺乳類細胞の生物学の調査は識別して哺乳動物の Fc γ レセプターおよび C3b 受容体15,16などの貪食能を調節する因子を特徴づけるに尽力されています。それにもかかわらず、哺乳類システムの大型画面や生体内での研究を実行する機能が制限されます。
デビッド ・ シュナイダーの 2000年17の研究所で最初に導入されたプロシージャに基づいている大人のショウジョウバエの貪食の in vivo アッセイをご紹介します。シュナイダー実験室は、クラスター化腹部背脈管に沿って容易に無柄の血球貪食ポリスチレン ビーズと細菌ことを示した。(大腸菌かに (大腸菌 -FITC) が付いた) などの蛍光に分類された粒子が注入されるハエ貪食を視覚化する血球粒子を巻き込むまでに 30 分間インキュベートし、トリパン ブルー、ない潜伏期間中に貪食粒子の蛍光を消光すると注入されます。背血管のハエが倒立蛍光顕微鏡を使用して、作成されます。この精液のペーパー血球貪食細菌, ラテックス ビーズ、その細菌の貪食は事前に注射することによって禁じることができる比較的簡単な実験を使用してラテックス ビーズ、ハエや携帯電話や体液なしで飛ぶこと免疫応答は、大腸菌にもなりやすいです。このレポートに表示されるアッセイは、関連付けられている背脈管血球によって包まれている粒子の蛍光強度を測定することによって体内の貪食を定量化するシュナイダー ラボの作業に基づいています。
哺乳類システムで取られたアプローチと同様に、ショウジョウバエ遺伝最初ゲノムを使用in vitro における RNAi の細胞性免疫能18,報19,20 に必要な遺伝子を識別する画面 ,21,22,23。ただし、成人体内貪食能の測定法の開発には、in vitro 試験因子の役割、生物を確認する研究者がように全体の動物で容易に実施されるフォロー アップの実験が有効になります。膜貫通受容体最初 S2 を使用して RNAi スクリーニングにおける細菌の受容体細胞24を識別され、エシェリヒア属大腸菌(E. 大腸菌)、腸球菌を媒介に喰いそうであったような球菌、 、黄色ブドウ球菌(ブドウ球菌) の貪食大人25。
私たちの研究室は、大人の血球の貪食を調節する新規の遺伝子を識別するために前方遺伝スクリーンとゲノムワイド関連研究 (ショウジョウバエ遺伝的参照パネル (DGRP) を使用して) 生体内で貪食アッセイを採用しました。これらの研究は、細胞内小胞輸送タンパク質 Rab1427グルタミン酸トランスポーター ポリフェムス28、RNA 結合タンパク質フォックス 129、PGRP SA26PGRP SC1A 受容体特性につながった。
生体内で貪食能を組み込んだ未来の画面がショウジョウバエの細胞性免疫応答に重要な遺伝子の同定につながることを期待しています。DGRP や、ショウジョウバエ合成人口リソース (DSPR) など、完全にシーケンスの自殖系統を使用した画面は、貪食能や血球の開発に影響を与える自然な変形を識別できます。さらに、テクニックをショウジョウバエの他の種に採用または画面新しいコミュニティ リソース、250 のショウジョウバエ種の維持によって、国立ショウジョウバエ種在庫センター (NDSSC のコレクションなどに使用できます。) コーネル大学。これらの実験は蛍光標識した細菌や菌体壁バクテリア市販されているを使用して遂行することができるまたは細菌や真菌種-微生物が蛍光マーカーを表現することを提供の任意の番号を使用して実行することがあります。.
プロトコル
1. 注射用蛍光粒子を準備します。
- 市販の熱殺された細菌の 10 mg を再構成フルオレセインの付いた粒子 (材料の表を参照してください) ストック濃度 10 mg/mL 990 μ L 滅菌 1 × PBS とアジ化ナトリウム 10 μ L 50 ミリメートルを追加することによって。ミックスする渦。
- 0.2 mL チューブの単回使用 8 μ 因数に分割し、関連付けられている感度を最小限に抑えるための 4 ° C で暗いボックスに格納します。
注: 防腐剤としてアジ化ナトリウムはオプションで、10 mg/mL 株が 1 mL 滅菌 1x PBS で作られて 場合省略できます、避けようと-20 ° C で保存されます
- 0.2 mL チューブの単回使用 8 μ 因数に分割し、関連付けられている感度を最小限に抑えるための 4 ° C で暗いボックスに格納します。
- 1x PBS で 500 μ L シリンジ フィルター緑色食品着色と 9.5 mL 滅菌 1 × PBS を混合することによって着色 5% 食品の 10 mL の溶液を作る。
- アジ化ナトリウムを削除への注入前に粒子を洗浄します。ミックス 42 μ x PBS と 1.7 mL チューブ 10 mg/mL の 8 μ L 滅菌 1。最大速度 2.5 分間室温で遠心分離機します。
- 上澄みを除去、最大速度 2.5 分間室温で 50 μ L 1 × PBS と遠心を追加します。
- 手順 1.3 と 1.3.1 3 洗浄の合計のための 2 倍。
- 最終的な洗浄後上澄みを廃棄し、再 5% 食品 1x PBS で着色の 50 μ L で 1.6 mg/mL に粒子を中断します。
- 光から保護するためにアルミ箔にチューブを巻いてください。4 ° C で保存、1 週間後破棄します。
2. 注入駅とハエを準備します。
- 注入のパッドを準備します。まで注入するには、同時に、長方形の CO2フライを分割する使用研究室テープ ハエの遺伝子型の 4 は 4 つのセクションにパッドします。顕微鏡の近くのベンチにパッド (パッドのそれぞれの角に 1 つ) のハエが並んでされている一度にバイアルを配置する領域を指定します。
- 年齢をマッチさせた 4-7 日のバイアルを準備-注入の古い、ハエ。各ひずみテストする準備はえの食糧の新鮮なラベル付きバイアルに男性 5 名, 女性 5 例を転送および 25 ° C で維持
- 空圧インジェクターを準備 (材料の表を参照してください)、楽器を 100 ms (サブ ナノリットル ボリュームの配信を許可する-液体を追放するガス圧の短いバースト)定刻モードに設定すると。
- 顕微鏡スライドを準備します。電気テープの 1.5 インチのストリップを切り取って、接着面でループにフォールド ラベル付き顕微鏡スライド上に配置。
3. ガラス キャピラリー針を準備します。
- 針の引き手を使用してガラス針 (薄壁ガラス管) を引き出します。
- マイクロメータをもつ顕微鏡下で針を押しながら #5 細かい点ステンレス ピンセットを使用してヒントを破る。100 μ m のヒントで負傷を最小限に抑えながらハエの表皮を貫通して十分です。
- 各フライに注入される液体の量を測定します。滅菌 5% 食糧 1x PBS で着色と針をロードし、0.01 mm ステージ マイクロメータに鉱物油のドロップに液体を排出します。
注: 液体の液滴は球状、ピコリットルのボリュームが (サイズ)3/1910 として計算されます。30 100 μ m の直径が付いている針がイジェクト 2 ~ 100 ms で nL。
4. ハエを注入します。
- 1.6 mg/mL 粒子パラフィルムの小さな正方形の 10 μ L をピペットします。
- 針の中に液体を引っ張って、インジェクター ノズル マウント (材料の表を参照してください)。
- CO2のハエを麻酔し、腹側とパッドの前面に向かって指向ヘッド、flypad に指定された区域でそれらを整列します。、ベンチに対応する領域にバイアルを配置します。
- 5、100 ms ポンプ液体 (~ 10 nL 合計) と腹部の隅でハエを挿入します。
- 適切なバイアルに注入されたハエを転送、バイアルに時間に注意してください。25 ° C で維持します。
- 0.4% で新しい針を読み込むトリパン ブルー ソリューション。
- ゲート、針から液体をプッシュする空気の一定の流れを可能にするには、空圧インジェクターを設定します。
- 彼らが 30 分間休ませた後、ハエを麻酔し、腹部が膨張したとまでトリパン ブルーで注入します。
注: pH 感受性色素の付いた粒子ファゴソーム成熟を調べると、1 時間の残りの部分にハエを許可、トリパン青のマウント飛ぶ前に挿入されません。 - 顕微鏡のスライドを腹側に、電気テープでハエをマウントします。場の側に翼をプッシュしてテープに固定します。また、フライが移動しないようにテープに頭をそっと押し込みます。
- すぐに手順 5 に進みます。
5. イメージング ハエ
- 画像が飛んで、25 x またはデジタル カメラとコンピューター (材料の表を参照) に接続されている倒立蛍光顕微鏡を用いた 32 倍の倍率で、時に 1 つ。デジタル カメラのコンピューターのソフトウェアを使用してフライの背脈管に焦点を当てます。
- 露光時間と実験間の倍率を記録します。
注: は、複数系統を 1 つのリビングで撮影するとき、エラーの潜在的なソースは遺伝子型のトラックを失うことです。ハエを偽装を避けるため、各遺伝子型の最初と最後の飛行写真の画像の番号のメモしておきます。
6. 定量化し、蛍光の正規化
- ソフトウェアを開き、一度に 1 つの画像を開いています。
- 背脈管の蛍光強度を測定します。背脈管周囲多角形を描画します。メジャーを選択し、ポリゴンの内部の蛍光強度を記録します。
- 背景の蛍光強度を決定します。最初の多角形をコピーおよびはえの背脈管に隣接するエリアに移動します。メジャーと背景領域のレコードの蛍光強度を選択します。
- 背脈管蛍光バック グラウンド蛍光を正規化するには。
背脈管 ÷ 背景。 - 平均正規化の緊張ですべてのハエの背脈管蛍光強度を計算します。
- 2 回以上の実験を繰り返します。
- 使用学生対になっていないt-コントロール ハエの平均相対的な蛍光強度を比較し、テストにテストを 3 つの実験から飛ぶ。数式を使用して効果のサイズを計算: cohen's d = (M1- M2) ÷ SDプール、どこ M1は遺伝子型 1 の平均、M2遺伝子型 2 の平均があると
SDプール=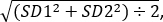
SD1は遺伝子型 1 の標準偏差、 SD2は遺伝子型 2 の標準偏差。
結果
フルオレスセイン分類された粒子を用いた生体内で貪食試験の概略は、図 1 aに表示されます。電気テープの部分に「ハエ」が「ダウン マウント腹側および背脈管のある腹部の最初の 2 つセグメント明確に表示されている (図 1 b)。実験誤差の主要原因は注射とイメージングの手順 (図 1) で発生します?...
ディスカッション
市販、蛍光に分類された粒子は、一般 (0.2 μ m カルボキシル基修飾マイクロスフィア) の貪食や微生物 (蛍光標識した耐熱または化学的に殺された細菌や酵母) の貪食能を評価するために使用されます。ファゴソーム成熟を評価するために、研究者は、pH が中性から酸性ファゴリソソームと同様にまで減少したときに蛍光を発する pH 感受性色素の付いた粒子を選択できます。また、貪...
開示事項
著者が明らかに何もありません。
謝辞
著者は、博士ベス ・ ゴンザレスと博士 Aprajita Garg を生体内で貪食実験の遂行に支援ありがちましょう。宿主-病原体相互作用 (HPI) と分子生物学 (CMB) セル UMD NIH T32 訓練助成金 NSF UMD 事前シード補助金資金この作品。
資料
| Name | Company | Catalog Number | Comments |
| 0.2μm Red Fluorescent Carboxylate Modified FluoSpheres | Invitrogen | F8810 | Fluorescently-labeled latex beads to test general phagocytic capacity of phagocytes. (~580/~605 nm) Inject a 1:20 dilution in PBS with 5% dye. |
| 5430-10 PicoNozzle Kit | World Precision Instruments | 5430-10 | Holder for 1.0mm pipette |
| E. coli (K-12 Strain) BioParticles, Alexa Fluor 488 conjugate | Invitrogen | E13231 | Killed E. coli labeled with Alexa Fluor 488. Use to test phagocyte recogntion and uptake of gram-negative bacteria. (~495/~519 nm) |
| E. coli (K-12 Strain) BioParticles, Alexa Fluor 594 conjugate | Invitrogen | E23370 | Killed E. coli labeled with Alexa Fluor 594. Use to test phagocyte recogntion and uptake of gram-negative bacteria. (~590/~617 nm) |
| E. coli (K-12 Strain) BioParticles, Fluorescein conjugate | Invitrogen | E2861 | Killed E. coli labeled with FITC (Fluorescein). Use to test phagocyte recogntion and uptake of gram-negative bacteria. (~494/~518 nm) |
| E. coli (K-12 Strain) BioParticles, Texas Red conjugate | Invitrogen | E2863 | Killed E. coli labeled with Texas Red. Use to test phagocyte recogntion and uptake of gram-negative bacteria. (~595/~615 nm) |
| E. coli (K-12 Strain) BioParticles, Texas Red conjugate | Invitrogen | E2863 | Killed E. coli labeled with Texas Red. Use to test phagocyte recogntion and uptake of gram-negative bacteria. (~595/~615 nm) |
| Needle Pipette Puller | David Kopf Instruments | Model 725 | |
| pHrodo Red E. coli BioParticles Conjugate for Phagocytosis | Invitrogen | P35361 | Killed E. coli labeled with pHrodo Red. Use to test phagocyte reconition, uptake, and phagosome maturation of gram-negative bacteria. (~560/~585 nm). No need to quench with Trypan Blue. |
| pHrodo Red S. aureus BioParticles Conjugate for Phagocytosis | Invitrogen | A10010 | Killed S. aureus labeled with pHrodo Red. Use to test phagocyte reconition, uptake, and phagosome maturation of gram-positve bacteria. (~560/~585 nm). No need to quench with Trypan Blue. |
| Pneumatic PicoPump PV820 | World Precision Instruments | SYS-PV820 | The World Precision Instruments Pneumatic PicoPump PV820 uses differential pressures to hold liquid in the glass needle between injections. The user manually controls short bursts of gas pressure to expel the liquid – allowing delivery of sub-nanoliter volumes. The amount of liquid delivered depends on two main variables – the size of the glass needle opening and the amount of time injection pressure is applied. set the instrument to 100 ms “TIMED” mode. |
| S. aureus (Wood Strain without protein A) BioParticles, Alexa Fluor 488 conjugate | Invitrogen | S23371 | Killed S. aureus labeled with Alexa Fluor 488. Use to test phagocyte recogntion and uptake of gram-positive bacteria. (~495/~519 nm) |
| S. aureus (Wood Strain without protein A) BioParticles, Alexa Fluor 594 conjugate | Invitrogen | S23372 | Killed S. aureus labeled with Alexa Fluor 594. Use to test phagocyte recogntion and uptake of gram-positive bacteria. (~590/~617 nm) |
| S. aureus (Wood Strain without protein A) BioParticles, Fluorescein conjugate | Invitrogen | E2851 | Killed S. aureus labeled with FITC (Fluorescein). Use to test phagocyte recogntion and uptake of gram-positive bacteria. (~494/~518 nm) |
| Thin Wall Glass Capillaries | World Precision Instruments | TW100F-3 | Needles for injection. OD = 1.0 mm |
| Trypan Blue Solution (0.4%) | Sigma | T8154 | Used to quench extracellular fluorescence of Fluorescein, Alexa Fluor, or Texas Red labeled particles. |
| ZEISS SteREO Microscope (Discovery.V8) | Zeiss | SteREO Discovery.V8 | Inverted fluorescence microscope for imaging flies. Use a digital camera (example: AxioCam HC camera) and the accompanying software (example: AxioVision 4.7 software) to take pictures. |
| Zymosan A (Saccharomyces cerevisiae) BioParticles, Alexa Fluor 488 conjugate | Invitrogen | Z23373 | Killed labeled with Alexa Fluor 488. Use to test phagocyte recogntion and uptake of yeast. (~495/~519 nm) |
| Zymosan A (Saccharomyces cerevisiae) BioParticles, Alexa Fluor 594 conjugate | Invitrogen | Z23374 | Killed labeled with Alexa Fluor 594. Use to test phagocyte recogntion and uptake of yeast. (~590/~617 nm) |
| Zymosan A (Saccharomyces cerevisiae) BioParticles, Fluorescein conjugate | Invitrogen | Z2841 | Killed labeled with FITC (Fluorescein). Use to test phagocyte recogntion and uptake of yeast. (~494/~518 nm) |
| Zymosan A (Saccharomyces cerevisiae) BioParticles, Texas Red | Invitrogen | Z2843 | Killed labeled with Texas Red. Use to test phagocyte recogntion and uptake of yeast. (~595/~615 nm) |
参考文献
- Akira, S., Uematsu, S., Takeuchi, O. Pathogen recognition and innate immunity. Cell. 124 (4), 783-801 (2006).
- Kim, D. Studying host-pathogen interactions and innate immunity in Caenorhabditis elegans. Disease Models & Mechanisms. 1 (4-5), 205-208 (2008).
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annual Review Immunology. 25, 697-743 (2007).
- Wu, L. P., Choe, K. M., Lu, Y., Anderson, K. V. Drosophila Immunity: Genes on the Third Chromosome Required for the Response to Bacterial Infection. Genetics. 159 (1), 189-199 (2001).
- De Gregorio, E., Spellman, P. T., Tzou, P., Rubin, G. M., Lemaitre, B. The Toll and Imd pathways are the major regulators of the immune response in Drosophila. EMBO Journal. 21 (11), 2568-2579 (2002).
- Michel, T., Reichhart, J. M., Hoffmann, J. A., Royet, J. Drosophila Toll is activated by Gram-positive bacteria through a circulating peptidoglycan recognition protein. Nature. 414 (6865), 756-759 (2001).
- Choe, K. M., Werner, T., Stoven, S., Hultmark, D., Anderson, K. V. Requirement for a peptidoglycan recognition protein (PGRP) in Relish activation and antibacterial immune responses in Drosophila. Science. 296 (5566), 359-362 (2002).
- Wu, J., Randle, K. E., Wu, L. P. ird1 is a Vps15 homologue important for antibacterial immune responses in Drosophila. Cellular Microbiology. 9 (4), 1073-1085 (2007).
- Lemaitre, B., Nicolas, E., Michaut, L., Reichhart, J. M., Hoffmann, J. A. The dorsoventral regulatory gene cassette spatzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell. 86 (6), 973-983 (1996).
- Zambon, R. A., Nandakumar, M., Vakharia, V. N., Wu, L. P. The Toll pathway is important for an antiviral response in Drosophila. Proceedings of the National Academy of Science of the United States of America. 102 (20), 7257-7262 (2005).
- Lemaitre, B., et al. A recessive mutation, immune deficiency (imd), defines two distinct control pathways in the Drosophila host defense. Proceedings of the National Academy of Science of the United States of America. 92 (21), 9465-9469 (1995).
- Leulier, F., Rodriguez, A., Khush, R. S., Abrams, J. M., Lemaitre, B. The Drosophila caspase Dredd is required to resist gram-negative bacterial infection. EMBO Reports. 1 (4), 353-358 (2000).
- Meister, M., Lagueux, M. Drosophilablood cells. Cellular Microbiology. 5 (9), 573-580 (2003).
- Flannagan, R. S., Jaumouille, V., Grinstein, S. The cell biology of phagocytosis. Annual Review Pathology. 7, 61-98 (2012).
- Anderson, R. A., Sando, G. N. Cloning and expression of cDNA encoding human lysosomal acid lipase/cholesteryl ester hydrolase. Similarities to gastric and lingual lipases. Journal of Biological Chemistry. 266 (33), 22479-22484 (1991).
- Ross, G. D., Reed, W., Dalzell, J. G., Becker, S. E., Hogg, N. Macrophage cytoskeleton association with CR3 and CR4 regulates receptor mobility and phagocytosis of iC3b-opsonized erythrocytes. Journal of Leukocyte Biology. 51 (2), 109-117 (1992).
- Elrod-Erickson, M., Mishra, S., Schneider, D. S. Interactions between the cellular and humoral immune responses in Drosophila. Current Biology. 10, 781-784 (2000).
- Ramet, M., Pearson, A. M., Manfruelli, P., Li, X., Koziel, H., Gobel, V. Drosophila Scavenger Receptor CI Is a Pattern Recognition Receptor for Bacteria. Immunity. 15 (6), 1027-1038 (2001).
- Ramet, M., Manfruelli, P., Pearson, A. M., Mathey-Prevot, B., Ezekowitz, R. A. Functional genomic analysis of phagocytosis and identification of a Drosophila receptor for E. coli. Nature. 416 (6881), 644-648 (2002).
- Philips, J. A., Rubin, E. J., Perrimon, N. Drosophila RNAi screen reveals CD36 family member required for mycobacterial infection. Science. 309, 1251-1253 (2005).
- Agaisse, H., Burrack, L. S., Philips, J. A., Rubin, E. J., Perrimon, N., Higgins, D. E. Genome-wide RNAi screen for host factors required for intracellular bacterial infection. Science. 309 (5738), 1248-1251 (2005).
- Stuart, L. M., et al. Response to Staphylococcus aureus requires CD36-mediated phagocytosis triggered by the COOH-terminal cytoplasmic domain. Journal of Cell Biology. 170 (3), 477-485 (2005).
- Stroschein-Stevenson, S. L., Foley, E., O’Farrell, P. H., Johnson, A. D. Identification of Drosophila gene products required for phagocytosis of Candida albicans. PLoS Biology. 4 (1), e4 (2006).
- Kocks, C., et al. Eater, a transmembrane protein mediating phagocytosis of bacterial pathogens in Drosophila. Cell. 123 (2), 335-346 (2005).
- Nehme, N. T., et al. Relative roles of the cellular and humoral responses in the Drosophila host defense against three gram-positive bacterial infections. PLoS One. 6 (3), e14743 (2011).
- Garver, L. S., Wu, J., Wu, L. P. The peptidoglycan recognition protein PGRP-SC1a is essential for Toll signaling and phagocytosis of Staphylococcus aureus in Drosophila. Proceedings of the National Academy of Science of the United States of America. 103 (3), 660-665 (2006).
- Garg, A., Wu, L. P. Drosophila Rab14 mediates phagocytosis in the immune response to Staphylococcus aureus. Cellular Microbiology. 16 (2), 296-310 (2014).
- Gonzalez, E. A., Garg, A., Tang, J., Nazario-Toole, A. E., Wu, L. P. A glutamate-dependent redox system in blood cells is integral for phagocytosis in Drosophila melanogaster. Current Biology. 23 (22), 2319-2324 (2013).
- Nazario-Toole, A. E., Robalino, J., Okrah, K., Corrada-Bravo, H., Mount, S. M., Wu, L. P. The Splicing Factor RNA-Binding Fox Protein 1 Mediates the Cellular Immune Response in Drosophila melanogaster. Journal of Immunology (Baltimore, Md: 1950). 201 (4), 1154-1164 (2018).
- Guille, M. . Molecular Methods in Developmental Biology: Xenopus and Zebrafish. , (1999).
- Koundakjian, E. J., Cowan, D. M., Hardy, R. W., Becker, A. H. The Zuker collection: a resource for the analysis of autosomal gene function in Drosophila melanogaster. Genetics. 167 (1), 203-206 (2004).
- Horn, L., Leips, J., Starz-Gaiano, M. Phagocytic ability declines with age in adult Drosophila hemocytes. Aging Cell. 13 (4), 719-728 (2014).
- Brennan, C. A., Delaney, J. R., Schneider, D. S., Anderson, K. V. Psidin is required in Drosophila blood cells for both phagocytic degradation and immune activation of the fat body. Current Biology. 17 (1), 67-72 (2007).
- Akbar, M. A., Tracy, C., Kahr, W. H., Kramer, H. The full-of-bacteria gene is required for phagosome maturation during immune defense in Drosophila. Journal of Cell Biology. 192 (3), 383-390 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved