A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חקירה מקבילה של גיוס β-Arrestin2 עבור ליגיון הקרנה בקנה מידה מוקטן של הסרט באמצעות שיטת הטנגו-פרסטו
In This Article
Summary
בהינתן כי GPCRs הם מטרות druggable אטרקטיבי, gpcr ליגנד הקרנה היא הכרחית ובכך לזיהוי תרכובות עופרת ולמחקרים de aniטיזציה. לקראת מאמצים אלה, אנו מתארים את פרסטו-טנגו, פלטפורמת משאב מקור פתוח המשמש ליצירת פרופיל סימולטני של גיוס β-arrestin2 ארעי ב כ 300 GPCRs באמצעות שיטת העיתונאי מבוסס TEV.
Abstract
כמו הגדול ביותר ואת המגוונת ביותר גן המשפחה ומגשרים של סולם הצבעים של מסלולים איתות סלולרי, G-חלבון מצמידים קולטנים (GPCRs) מייצגים אחד היעדים המבטיחים ביותר עבור תעשיית התרופות. מכאן, העיצוב, יישום, אופטימיזציה של gpcr ליגנד הקרנת ההקרנה הוא קריטי, כפי שהם מייצגים כלי בקרה מרחוק עבור גילוי סמים ולטיפול בפרמקולוגיה gpcr ותוצאות. בעבר, ה-G-חלבון התלוי מאופיין בתחום זה של מחקר, גילוי אירועים המושרה וכימות הדור של שליחים משניים. עם זאת, מאז הופעתו של בסלקטיביות תפקודית, כמו גם מודעות מוגברת של מסלולים אחרים חלבון בלתי תלוי בחלבונים והמגבלות הקשורות ל-G-חלבון תלוי assays, יש דחיפה גדולה יותר לקראת יצירת חלופה GPCR ליגיון. לקראת מאמץ זה, אנו מתארים את היישום של משאב כזה, פלטפורמת הטנגו פרסטו, מערכת מבוססת כתבת לוציפראז המאפשרת את החקירה המקבילה והזמנית של GPCR של האדם, הישג שנחשב בעבר . טכנית ובלתי אפשרי מבחינה כלכלית מבוסס על מערכת הגיוס העצמאית של G-חלבון β-arrestin2, אוניברסליות של β-arrestin2 בתיווך הסחר ואיתות ב GPCRs עושה פרסטו-טנגו כלי מתאים ללמוד כ 300 האדם שאינו הריח, כולל כ 100 קולטנים יתומים. לפרסטו-רגישות של טנגו וחוסן להפוך אותו מתאים מסכי תפוקה גבוהה הראשי באמצעות ספריות מורכבות, מועסק לחשוף מטרות GPCR חדש עבור סמים ידועים או כדי לגלות ליגטים חדשים עבור קולטנים יתומים.
Introduction
G-חלבון מצמידים קולטנים (GPCRs) מהווים את המשפחה הגדולה והמגוונת ביותר של חלבונים transממברני, הפעלה כממשקי תקשורת בין תא לסביבתו1. רב-תכליתיות של GPCRs מודגשת על ידי היכולת שלהם לזהות מגוון מגוון של ליגנדס – מ נוירוטרנסמיטורים כדי נוקלאוטידים, פפטידים לפוטונים, ועוד רבים – כמו גם היכולת שלהם להסדיר מפלים רבים במורד הזרם מעורב בצמיחה תאית, הגירה, בידול, אפופטוזיס, תא ירי, וכו '2,3. בהתחשב הייתה שלהם ומעורבות בהמון תהליכים פיסיולוגיים, משפחת הקולטן הזאת היא בעלת חשיבות טיפולית מירבית, לראווה על ידי העובדה כי יותר משליש של כרגע זמין תרופות מרשם היעד GPCRs4. עם זאת, הtherapeutics הקיימים האלה מכוונים רק לקבוצת משנה קטנה של סופרמשפחה (מוערך של 10%), והפרמקולוגיה של GPCRs רבים נותרה ללא מובהר. יתר על כן, יותר מ 100 GPCRs להתקיים כמו קולטנים יתומים, כפי שהם לא התאימו עם ליגני אנדוגניים5. כך, gpcr ליגנד הקרנה היא קריטית בדאוראנזציה ופיתוח התרופה, כפי שהוא מפעיל את הדרך לקראת גילוי המוביל ואופטימיזציה, ואולי לשלב ניסוי קליני.
שיטות ל-gpcr ליגנד ההקרנה באופן מסורתי נפלו באחת משתי קטגוריות, g-חלבון תלוי או g-חלבון בלתי תלוי תפקודית מספר6. האיתות gpcr מוסדר על ידי heterotrimeric G-חלבונים (Gαβγ), אשר מופעלים על ידי חילופי gtp עבור התוצר המאוגד על gα יחידת7. אותות מן הקולטן המופעל הם התמרה ידי G-חלבונים באמצעות שליחים משניים, כגון מחנה, סידן, דאג, ו IP3, כדי לתווך איתות במורד הזרם במורד הזרם8. האופי של ההשלכות הפונקציונליות של מאותת G-חלבון נוצל כדי ליצור תא מבוסס בחני כי לשקף את הפעלת הקולטן. שיטות אלה, אשר למדוד הקרובות (ישיר) האירועים (עקיף) מערכת איתות G-חלבון, הם בשימוש התכוף ביותר GPCR ליגיון ו כבר המועסקים בעיקר במחקרים deהניניזציה6. דוגמאות של בחני אומר כי באופן ישיר למדוד gpcr-מתווך G-חלבון הפעלה כוללים את שיטת הכריכה של [35s] GTPγS, אשר מודד את הכריכה של רדיויניום ו-hydrolyzable gtp אנלוגי ליחידת המשנה gα, ו förster/ביולומינסנציה העברת אנרגיה (לדאוג/ברט, בהתאמה) רגשים כדי לנטר gpcr-gα ו gα/Gγ אינטראקציות, אשר כבר צובר המתיחה על השנים9,10. Assays כי ניטור האירועים הם הכלים הנפוצים ביותר עבור פרופיל GPCR; לדוגמה, מחנה ו IP1/3 בחני למדוד תאיים הצטברות של G-חלבון שליחים משניים תלויים, בעוד [Ca2 +] השטף הכתב בחני מעורבים אלמנטים תגובה ספציפיים מעורב בהפעלת G-חלבון (היצור, nfat-RE, sre, srf-re) לבחון את האירועים עוד במורד הזרם איתות1 בעוד שרוב האמור לעיל ניתן לבצע ברמת תפוקה גבוהה, הם רגישים למדי, ומתגאים ביתרונות מסוימים של שיטה מסוימת (למשל, הפליה בין האגוניסטים מלאים/חלקיים, אנטוניסטים ניטרליים ו אגוניסטים הופכי במקרה של איגוד GTPγS, או לספק פונקציונליות על תאים חיים כגון [Ca2 +] ו IP1/3)6, למרבה הצער לא קיים שיטות התלויות g-חלבון ההולם את החקירה זה בעיקר בשל צימוד מקורי של משפחות משנה G-חלבון GPCRs, וכתוצאה מכך איתות על מפלי מספר וצימוד G-חלבון לא ידוע ב GPCRs יתום. כדי להמתיק את הבעיה, שפותחה כדי לכפות צימוד G-חלבון מופקר באמצעות איתות יחיד משותף הקריאה-out, כגון מחנה, ו-Ca2 +, למרות שרובם הם תפוקה נמוכה12.
היבט חשוב של מחזור החיים GPCR הוא לסיום של האיתות התלוי בחלבון G, אשר מתרחשת בחלק הגדול באמצעות גיוס של β-הפיגור אשר מעורר את הדיסוציאציה של G-חלבון, ובסופו של דבר הפחתת הרגישות של הקולטן, אשר מיועדת עבור הפנמה מצופה קלטרין13. הבלתי-מβ ביותר בעלי הצורה האוביייתית ביותר, הם הβ-arrestin1 וβ-arrestin2, מסומנים גם כפיגור של 2 ופיגור-3, בהתאמה ל-14. הזן G-חלבון עצמאי מבוסס תא המבוסס, אשר מוסיפים ממד חדש GPCR ליגיון והקרנה; הקולטן הסחר, תא שלם ללא תווית, ו β מפיגור הגיוס מוסר הם כל הדוגמאות הבולטות. Gpcr סחר בחני מעסיקים שימוש fluorophore מתויג ליגטים או שיתוף הפניהפנטים מיקוד הקולטן15, ואילו התווית של תא שלם חינם השימוש בביוחיישנים לתרגם שינויים סלולריים המושרה על ידי ligands קשירה לתוך כימות תפוקות, כגון אותות חשמליים או אופטיים16. בעיקר, התמציתי gpcr-β-מפיגור האינטראקציות אופנה הβ מפיגור שיטת הגיוס ככלי אטרקטיבי ברפרטואר של בחני פונקציונלי17. מערכת הטנגו, שפותחה לראשונה על ידי ברנע ואח '. רק לפני עשור, כרוכה המבוא של שלושה אלמנטים גנטיים אקסוסוגני: היתוך חלבון המורכב β-arrestin2 עם וירוס איכול הטבק פרוטאז (tevp), טטרציקלין transactivator (tTA) כי הוא קשור gpcr באמצעות וירוס איכול הנגיף פרוטאז באתר (בטביה) והוא לפניו על ידי רצף מ-C הטרמינוס של הקולטן v2 וזופרסין סין (v2 זנב) כדי לקדם את הגיוס הפיגור, ואת הכתב הגן לוציפראז אשר שעתוק מופעלות על ידי ה tTA שעתוק גורם הטרנסלוקציה לגרעין, אשר שוחרר מן הקרום עיגון בעקבות גיוס β-arrestin2 (איור 1)18. קריאות כמותי של הפעלה GPCR ו-β-arrestin2 ניתן לקבוע לאחר מכן על ידי קריאה לאור. הבחנה בולטת היא שבזמן הסחר בקולטן ושיטות התא ללא תווית שלמות הם בעלי תפוקה נמוכה יחסית, לטנגו יש מספר יתרונות, כולל לקריאה סלקטיבית כי הוא ספציפי קולטן היעד ואת הרגישות בשל שילוב אותות, מה שעושה את זה מועמד מתאים עבור ליגיון הקרנה בקנה מידה גדול יותר18.
לאור התכונות האסטרטגיות הללו, Kroéet al. פיתח-טנגו (קולטן מקבילי-ביטוי ome והקרנה דרך Transcript פלט-טנגו), פלטפורמת הקוד הפתוח של תפוקה גבוהה המשתמשת בגישה טנגו לפרופיל druggable GPCR-ome באופן מקבילי וסימולטני19. ניצול "מופקר" הגיוס של β-arrestin2 כמעט כל GPCRs, פרסטו-טנגו הוא הראשון-של-שלה מסוג במונחים של מבוסס התא assays, הפעלת מהירה "בסיבוב הראשון" הקרנה של תרכובות מולקולה קטנה בכמעט כל הריח הGPCRs, כולל יתומים, עצמאית של G-חלבון צימוד משפחה.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הקרנה ראשונית: תרבית תאים וזריעת צלחות
- כדי להכין פולי-L-ליזין (PLL) לוחות מצופים, לוותר 20 μL/טוב של 25 μg/mL פתרון מניות של PLL ב לבן או שחור 384-היטב אופטי לוחות באמצעות פיפטה מרב-ערוצי אלקטרוניים או מנפק מגיב. מודב את הצלחות בטמפרטורת החדר עבור 0.5 – 2 h.
הערה: אם השימוש בלוחות הצבע השחור 384-היטב, צפה שאות הרקע יהיה נמוך יותר בהשוואה ללוחות הלבנים. לוחות שחורים מומלץ להפחית את הבליד דרך האור בין הבארות הסמוכות. - כדי לשמר את הצלחות מצופה ולשטוף את העודפים PLL, להסיר את PLL על ידי מצליף אותו מעל הכיור, ברז יבש מעל מגבת נייר, ולהוסיף 40 μL/טוב של פתרון 1x מדולל של אנטיביוטיקה-antimycotic באמצעות מתקן הצינורות אלקטרוניים או מנפק מגיב. חנות לוחות מצופים ב -4 ° c עד שהיא מוכנה לזריעת הצלחות.
- לשמור על התאים HTLA (באדיבות מסופק על ידי ד ר. ריצ'רד אקסל) – האדם כליה מעובריים קו (HEK293T) באופן בלתי נשכח β-arrestin2-TEV ו-tTA מונחה לוציפראז – ב בינונית שונה באופן מושלם של הנשר של מדיום (DMEM) שיושלם עם 5% סרום בקר עוברי 5% סרום עגל של שור, 2.5 μg/mL של puromycin, 50 μg/mL של hygromycin, 100 U/mL, ו100 μg/mL סטרפטומיצין בתוך 37 ° c בחממה לחות המכילה 5% CO2.
- התרבות HTLA התאים במנות 150 מ"מ ולעבור תאים פעמיים בשבוע בפקטור דילול של 1:10, עם מספר מעבר התאים האופטימלי של 5 – 25. ודאו שמספר מספיק של מנות 150 מ"מ מספקות את היום של היקף הזריעה של 384, בהתאם לקנה המידה של המסך הראשי.
הערה: שימוש בתאי HTLA הגדול ממעבר 25 עלול לגרום לכדאיות מופחתת, לקבלת תוצאות מיטביות. - לתאי HTLA הזרע עבור המסך הראשי, לשטוף בעדינות את הכלים 150 mm שוטפת (es) עם מלוחים 1x פוספט מאגור (PBS), pH 7.4. ניתוק תאים עם כ 6 מ ל של 0.05% טריפסין/0.53 mM EDTA, ולהעביר לצינור צנטריפוגה המכיל לפחות שווה כמות מלאה של מדיום הנשר המלא של Dulbecco (DMEM) כדי לנטרל את טריפסין.
- ספין למטה התאים HTLA ב 500 x g עבור 3 דקות ולהשעות את הגלולה התא בצפיפות של 0.22 x 106 תאים/mL ב-dmem לאחר השמטת התוספת של 2.5 μg/ml של puromycin 50 ו-μg/ml של hygromycin כפי שהם יכולים להקטין את יעילות החצייה.
- מודב 384 הדרושים-היטב PLL-מצופה צלחות ב 37 ° צ' כדי לחמם אותם לפני זריעת תאים. הסר את פתרון האחסון של 1x אנטיביוטי-antimycotic מלוח 384-ובכן PLL-מצופה (s) על ידי מצליף את הצלחת מעל הכיור ומדביק אותו על נייר מגבת יבש.
- תאים הזרע לתוך 384-היטב PLL-מצופה צלחות בצפיפות הסופית של 10,000 תאים/גם על ידי חילוק 45 μL של 0.22 x 106 תאים/ML htla ההשעיה באמצעות pipet רב-ערוצי אלקטרוניים. לוחות הדגירה ב 37 ° c בלילה. אם הדבר המועדף על אותו יום הוא מועדף, תאי הזרע בצפיפות של 16,000 תאים/ובכן לבצע את ההעברה 4 h מאוחר יותר.
הערה: ליעילות מעבר גבוה, 50-70% שטף התאים הוא אופטימלי.
2. הקרנה ראשונית: הכנה ללוחיות דנ א
- כדי להכין את הצלחת 384-ובכן לוחית המקור של ה-DNA עבור החצייה כפי שמוצג באיור 2, להפיץ את הפלבמיד cdnas קידוד מבנים Gpcr-טנגו של העניין בצלחת 96-באר, עם gpcr שונים/טוב. ה-DNA פלמיד צריך להיות מושעה 0.1 x טריס-EDTA (TE) מאגר בריכוז של 50 ng/μL.
הערה: לוחיות ה-DNA של 96-ובכן ניתן לאטום ולאחסן ב-20 ° c, ולהשתמש מחדש בניסויים מרובים בהקרנה. כל cDNA קידוד GPCR-טנגו בנייה זמינים מסחרית (לראות את הטבלה של חומרים) ומשובטת ב pcdna 3.1 neomycin פלמיד. מורכב-טנגו GPCR Kit כולל 4 96-טוב צלחות, אשר כוללים 80 GPCRs כל אחד, כמה בארות עם וקטור ריק כמו פקדים שליליים, ובארות בקרה חיובית להחזיק את הקולטן דופמין D2 (DRD2), ובארות כי לשאת קידוד פלבאמצע חלבון פלורסנט (YFP) כדי לעקוב אחר יעילות הזיהום. - באמצעות הצנרת רב-ערוצי, להעביר באופן ידני את פתרון ה-DNA מן 96-ובכן כדי 384-היטב צלחת מקור ה-DNA, הוספת 10 μL לכל 384-ובכן. כדי לוודא שכל תנאי, הניסוי ממוקם בתוך החדר מחצית של 96-ובכן צלחת ה-DNA (שורות A-D או E-H) יכסה מלא 384-באר צלחת על ידי הפצת כל GPCR בשני הרבעים (הרביע הראשון =-מתחם, הרביע השני = + מתחם), כך GPCR זהה יהיה מעורב ב 8 בארות של 384-באר צלחת (ראה איור 2
- להרכיב את החומרים הבאים הדרושים עבור שיטת המשקעים סידן פוספט, כפי שמתואר על ידי ירדן ואח '20: 0.1 x TE מאגר (1 mM טריס-HCl ו 0.1 MM edta); 2.5 מ ל2 פתרון; 2x מאגר Hepes, pH 7.05 (50 מ"מ HEPES, 280 מ"מ הנאל, 1.5 mM Na2hpo4). מעקר את כל הפתרונות באמצעות סינון ואחסון ב -4 ° c. ביום החצייה, אפשר לריאגנטים להגיע לטמפרטורת החדר לפני השימוש.
- לדלל את 2.5 M CaCl2 מניות פתרון ב 0.1 x TE (1:8 דילול) לריכוז הסופי של 0.313 M cacl2 ו מערבולת. העברת 40 μL של 0.313 M CaCl2 כדי 384-ובכן צלחת מקור ה-DNA ומערבבים על ידי ליטוף למעלה ולמטה עם מחזיק ביד צינור רב ערוצי או העליון שחקן הספסל האוטומטי 384-הערוץ.
- הוסף 50 μL של מאגר של 2x Hepes ללוחית המקור 384 של ה-DNA הטוב ביותר, לערבב שוב על ידי ליטוף למעלה ולמטה ולתת לעמוד 1 דקות; כל 384-ובכן יהיה כמות נאותה של שילוב של דנ א/העברה עבור החצייה של 9 384-טוב צלחות, בהתאם למספר תרכובות צריך להיבדק. העבר 10 μL של התערובת DNA/העברת הזיהום מן 384-היטב לוחית המקור של ה-DNA לתאי HTLA הנזרע ומודקת את הצלחות לילה ב 37 ° c.
3. הקרנה ראשונית: גירוי תא
- עשרים וארבע שעות לאחר מכן, החדירו את מדיית התא המבוקר על ידי הגשת בעדינות את הצלחת ה384-היטב מעל הכיור ומדביק אותו על מגבת נייר, או עם ראש עם מייבש שעור. לאט להוסיף 40 μL של מדיה מורעב (DMEM שיושלם עם 1% סרום העוברי העובר (dFBS) ו-1x אנטיביוטי/antimycotic), להיות זהיר כדי להימנע מלגעת בתאים ישירות.
- Pipet 20 μL של המתחם של עניין בריכוז 3x (ריכוז סופי של הסם בצלחת התא יהיה 1x) לתוך שורות לסירוגין עם (+) גירוי, ו 20 μL של מאגר הרכב עבור שורות לסירוגין ללא (-) מתחם. החזר את הצלחת התא ב 37 ° צ' ב 5% CO2 ו-הדגירה עבור לפחות 16 h.
4. הקרנה ראשונית: קריאה לומינסנציה
- להכין את מגיב גלו, השתנה מ בייקר ו Boyce21: 108 mM טריס-HCl; 42 mM Tris בסיס, 75 מ"מ הנאל, 3 מ"מ MgCl2, 5 מ"מ Dithio, טול (DTT), 0.2 מ"מ Co, 0.14 mg/ml D-לluciferin, 1.1 מילימטר ATP, 0.25% v/v טריטון X-100, 2 מ"מ נתרן הידרוסולפיט.
הערה: פתרונות מניות של הריאגנטים ניתן לעשות מראש, למעט D-לluciferin, אשר תמיד טרי הוסיף מגיב גלו בצורתו האבקה. אם השתמשו בלוחות שחורים, כמות ה-D-לluciferin יכולה להיות מוגברת עד 0.25 מ"ג/mL. - במהלך 16 – 24 שעות לאחר הגירוי, decant מדיה תא מנוכר על ידי בעדינות מצליף הצלחת 384-טוב מעל הכיור ומדביק אותו על מגבת נייר. הוסף 20 μL/באר של גלו מגיב ומודקת את הצלחת בטמפרטורת החדר עבור 5 – 20 דקות. לקרוא את הצלחות באמצעות מונה מיקרופלייט האור, עם זמן שילוב של 1 s/טוב.
5. הקרנה ראשונית: ניתוח נתונים
- יצא את הקבצים השמורים מהקונטרה-לומינציה כגיליון אלקטרוני; התוצאות יירשמו ביחידות האור היחסיות (RLU). בהתבסס על הפריסה של הצלחת 384-באר, לחשב את ההפעלה (שינוי קיפול) של כל קולטן באמצעות הנוסחה הבאה:
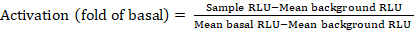
הערה: כאן לדוגמה RLU מתייחס לערך של כל אחד מארבעת הבארות שכפול של מגרה (+ מורכב) רביע, משמעות הרקע RLU הוא הממוצע של פקדים שליליים על הצלחת, ו מתכוון בסיס RLU מתייחס הממוצע של הרביע הלא מטופל של אותו קולטן (- תרכובת). בנוסף, חשב את סטיית התקן של 4 נקודות הנתונים כדי לאמת את איכות התוצאות. מומלץ לבצע המרה log2 על הממוצע של שינויים מקפלים כדי לתקן את כל הסטיות הפשפשים; בסיס log2 הוא בחירה מעשית כדי לסייע בזיהוי כניסות חיוביות. הערכה האמפירי מהווה את ספי הפגיעה החיוביים; יש לציין כי כמה קולטנים יכולים להיות נמוך כמו להגדיל 2-קיפול עד 40-קיפול להגדיל עבור אחרים עם אגוניסט מלא. - בהתבסס על התוצאות, בחר את GPCRs כי הם כניסות חיוביות פוטנציאליות עבור הקרנה משנית.
6. הקרנה משנית: זריעה והעברה של תאים
- התאים HTLA תת-תרבות במנות 100 מ"מ בצפיפות תא כולל של 5 x 106 תאים ב 11 מ ל של מדיה מלאה (4.55 x 105/mL) ו דגירה ב 37 ° צ' עבור 24 h. אם המצב באותו יום מועדף, תאי הזרע בצפיפות של 7.5 x 106 תאים ולבצע את התרגום 4 שעות מאוחר יותר.
- לחמם מראש את הריאגנטים הדרוש למשקעים סידן פוספט בטמפרטורת החדר. לשלב 450 μL של 0.1 x TE מאגר עם 50 μL של 2.5 M CaCl2 ומערבולת במהירות; סכומים אלה הם ספציפיים עבור 1 100 mm צלחת, בהתבסס על נפח של בינוני גדילה זה מחזיק.
- בצינור, להוסיף 500 μL של הפתרון TE/CaCl2 כדי 10 ΜG של Gpcr cdna ו מערבולת. הוסף 500 μL של הפתרון 2x מאגר Hepes בצינור, לנער במרץ (לא מערבולת), ו דגירה עבור 1 דקות.
הערה: 1 μg של הקידוד הפלאואני של חלבון פלורסנט (g. YFP, mCherry, וכו ') יכול להיות co-transfect עם 9 μg של GPCR cDNA עבור סך של 10 μg. חלבון הפלורסנט משמש למעקב אחר יעילות התרגום, וכמות מינימלית זו לא תפריע לאותה שיטת הפעולה. - מיד לאחר הדגירה הקצרה, לוותר על הפתרון 1 mL dropwise על התאים. בעדינות לנדנד את הצלחת הלוך ושוב כדי להפיץ את הזרז באופן שווה, מטפלת לא למערבולת את הצלחת, ו הדגירה ב 37 ° c עבור 24 h.
- ביום שלמחרת, התבוננו ביעילות התרגום על ידי התבוננות בביטוי של חלבון הפלורסצנט מתחת לאנג'ר תא פלורסנט; הכיסוי הגדול יותר מ-50% הם אידיאליים.
- מודקת את הלוח הדרוש 384-היטב PLL-מצופה (s) בחממה ב 37 ° צ' כדי לחמם אותו לפני זריעת תאים. הסר את פתרון האחסון של 1x אנטיביוטי-antimycotic מלוח 384-ובכן PLL-מצופה (s) על ידי מצליף את הצלחת מעל הכיור ומדביק אותו על נייר מגבת יבש.
- לשטוף בעדינות את התאים מנוכר עם פתרון Versene (1X PBS, pH 7.4; 0.53 mM EDTA), ולנתק על ידי הוספת 3 מ מ 0.05% טריפסין/0.53 mM EDTA למנה. העבר את התוכן לצינורית צנטריפוגה המכילה לפחות כמות שווה של DMEM כדי לנטרל את הטריפסין.
- לסובב את התאים ב 500 x g עבור 3 דקות ולהשעות מחדש את התאים בצפיפות של 0.4 x 106 תאים/mL במדיה הרעבים. תאי הזרע לתוך הלוח 384-ובכן PLL-מצופה (s) בצפיפות הסופית של 25,000 תאים/גם על ידי חילוק 45 μL של ההשעיה התא באמצעות pipet רב-ערוצי אלקטרונית. החזר את הצלחות 37 ° צ' למינימום של 4 שעות, המאפשר לתאים לצרף כראוי לבארות לפני שתמשיך הגירוי.
7. הקרנה משנית: הכנה לוחית התרופות של 16 נקודות (חצי יומן) מינון-עקומת
- בצלחת 96-באר, להוסיף 270 μL של 1X HBSS מאגר תרופות (1X האנק ' s מאוזנת תמיסת מלח [HBSS], 20 מ"מ HEPES pH 7.4, 1X אנטיביוטי-antimycotic), למעט השורה האחרונה (שורה H) של הצלחת, כפי שמוצג באיור 4.
הערה: עבור פפטידים, מולקולות קולאידית ותרכובות מסיסים במים ירודים, תוספת של 0.1 – 1% BSA הוא הציע. כדי למנוע חמצון סמים, ניתן גם להוסיף עד 0.01% חומצה אסקורבית. - ממניות התרופות, להכין פתרון תרופה (המכונה ריכוז "גבוה") על ידי חישוב ריכוז 3x הסופי (ריכוז סופי של הסם בצלחת התא יהיה 1x). כדוגמה, עבור מנה – עקומת התגובה עם 10 μM כריכוז הגבוהה ביותר שלה, להכין את הריכוז "גבוה" ב 30 μM. Pipet 300 μL של ריכוז "גבוה" לבארות בשורה H.
- בצינור אחר, הכן את הריכוז "הנמוך", המייצג את הריכוז "הגבוה" המחולק ב-3.16 (חצי יומן). בהתבסס על הדוגמה הקודמת, ריכוז "נמוך" יהיה 9.49 μM. Pipet 300 μL של ריכוז "נמוך" לבארות בשורה H, בצמוד בארות "גבוהה".
הערה: המספר הכולל של 96-בארות הדרושים בשורה H יהיה תלוי במספר התאים ובתנאי הגירוי. ארבע בארות (שני "גבוהה" ושני "נמוך") יהיה פתרון הסמים בשפע כדי לעורר את כל צלחת 384 במלואו. - לבצע דילול סדרתי על ידי ליטוף 30 μL של פתרון התרופה מתוך "גבוהה" ו-"נמוך" בארות של שורה H לשורה הקודמת (שורה G) ולערבב על ידי ליטוף ידנית למעלה ולמטה, או כמומלץ, באמצעות הצנרת האלקטרונית רב-ערוצי עם הפונקציה "פיפטה ו Mix". חזור על שלב זה עד לשורה הראשונה והמדוללת ביותר (שורה א'), תוך השמטת עצות בין מדלל.
הערה: אם רצונך בכך, ניתן לעצור את הדילול הסדרתי לפני שורה A, המייצג פקד פנימי ללא סמים, במילים אחרות, "אפס אמיתי". - שימוש באיור 4 כהפניה, להמריץ את התאים המזוהמים על ידי ליטוף 20 μl של העמודה "נמוכה" מדלל את הצלחת 96-באר לשורות a – O של הצלחת בעבר הזרע 384-באר, כמו גם 20 μl של העמודה "גבוהה" דילול בארות B – P. מארג את הצלחת ב 37 ° c עבור לפחות 16 h.
8. הקרנה משנית: קריאה לומינסנציה וניתוח מידע
- במהלך 16 – 24 שעות לאחר הגירוי, decant מדיה תא מנוכר על ידי בעדינות מצליף הצלחת 384-טוב מעל הכיור ומדביק אותו על מגבת נייר. הוסף 20 μL/באר של גלו מגיב ומודקת את הצלחת בטמפרטורת החדר עבור 5 – 20 דקות. לקרוא את הצלחות באמצעות מונה מיקרופלייט האור, עם זמן שילוב של 1 s/טוב.
- יצא את הקבצים השמורים מהקונטרה-לומינציה כגיליון אלקטרוני; התוצאות יירשמו ביחידות האור היחסיות (RLU). העבר את הנתונים של הצלחת 384-באר לתוכנת סטטיסטיקה כדי לנתח את התוצאות באמצעות ניתוח XY מובנה עבור עקומת רגרסיה לא לינארית. בחר בפונקציית הגירוי המובנית של 3 הפרמטרים לתגובה למינון מובנה "Log (אגוניסט) לעומת תגובה (שלושה פרמטרים)",

הערה: כאן העליון והתחתון הם רמות ביחידות של ציר Y, בהתאמה התגובה המקסימלית ואת רמת הבסיס, EC50 הוא ריכוז של אגוניסט שיוצר 50% תגובה בין העליון והתחתון, ו-X מתייחס ריכוז היומן של אגוניסט. מודל זה מניח כי עקומת המינון-תגובה יש שיפוע הגבעה סטנדרטי של 1.
Access restricted. Please log in or start a trial to view this content.
תוצאות
באמצעות פרוטוקול הטנגו פרסטו הציג לעיל, chromaffin גרגר עושה (CG) תמצית הוקרן נגד 168 מטרות gpcr לא הריח, עם רוב להיות קולטנים יתומים. יצירת פרופיל של תמצית שנאמר בוצעה על ידי בחינת β-arrestin2 הגיוס על הקולטנים שנבחרו, על בסיס העיקרון שתוכנן על ידי ברנע ואח '18 (איור 1). פלמיד cDNA ...
Access restricted. Please log in or start a trial to view this content.
Discussion
הGPCRs הדינמיים הם בתים. מכוח הקליטה המאפיינים הפיזיוכימיים של כיסי הכריכה של קולטני האלה, כמו גם הרלוונטיות הפיזיולוגית שלהם מדגישים את הצורך בכלי הסינון של GPCR. כפי שהוצג לעיל, שיטת הטנגו פרסטו מהירה, רגישה וידידותית למשתמש, ומשאילה את עצמה לפיתוח סמים. לא רק שאלה מדידה הפעלה אגוניסט המושרה,...
Access restricted. Please log in or start a trial to view this content.
Disclosures
. האלה לא מצהירים על אינטרסים מתחרים
Acknowledgements
עבודה זו נתמכת על ידי המכונים הקנדיים לחקר הבריאות (מענק CIHR #MOP142219).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, BLACK, with lid, Sterile | NUNC | 12-566 | |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, White, with lid, Sterile | NUNC | 12-566-1 | |
| 384 Well Round Bottom, Polypropylene, Non-Treated, Blue, non-sterile, without lid | ThermoFisher | 12-565-390 | |
| Antibiotic-Antimycotic | Wisent | 450-115-EL | |
| D-Luciferin, sodium salt | GoldBio | LUCNA | |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10-013-CV | |
| Eppendorf Xplorer, 12-channel, variable, 15–300 µL | Eppendorf | 4861000155 | |
| Eppendorf Xplorer, 12-channel, variable, 5–100 µL | Eppendorf | 4861000139 | |
| Matrix Platemate 2x3 | ThermoFisher | 801-10001 | |
| MicroBeta 1450 Wallac | Perkin Elmer | ||
| Penicilin-Streptomycin | Wisent | 450-201-EL | |
| Poly-L-Lysine hydrobromide | Millipore-Sigma | P2636-500MG | |
| Roth Lab PRESTO-Tango GPCR Kit | Addgene | Kit #1000000068 |
References
- Liapakis, G., et al. The G-protein coupled receptor family: actors with many faces. Current pharmaceutical design. 18 (2), 175-185 (2012).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3 (9), 639-650 (2002).
- Kroeze, W. K., Sheffler, D. J., Roth, B. L. G-protein-coupled receptors at a glance. Journal of cell science. 116, Pt 24 4867-4869 (2003).
- Rask-Andersen, M., Almén, M. S., Schiöth, H. B. Trends in the exploitation of novel drug targets. Nature Reviews Drug Discovery. 10 (8), 579-590 (2011).
- Ngo, T., et al. Identifying ligands at orphan GPCRs: current status using structure-based approaches. British journal of pharmacology. 173 (20), 2934-2951 (2016).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta pharmacologica Sinica. 33 (3), 372-384 (2012).
- Kimple, A. J., Bosch, D. E., Giguere, P. M., Siderovski, D. P. Regulators of G-Protein Signaling and Their G Substrates: Promises and Challenges in Their Use as Drug Discovery Targets. Pharmacological Reviews. 63 (3), 728-749 (2011).
- Wettschureck, N., Offermanns, S. Mammalian G Proteins and Their Cell Type Specific Functions. Physiological Reviews. 85 (4), 1159-1204 (2005).
- Denis, C., Saulière, A., Galandrin, S., Sénard, J. -M., Galés, C. Probing heterotrimeric G protein activation: applications to biased ligands. Current Pharmaceutical Design. 18 (2), 128-144 (2012).
- Yin, H., et al. Lipid G protein-coupled receptor ligand identification using beta-arrestin PathHunter assay. The Journal of Biological Chemistry. 284 (18), 12328-12338 (2009).
- Cheng, Z., et al. Luciferase Reporter Assay System for Deciphering GPCR Pathways. Current Chemical Genomics. 4, 84-91 (2010).
- Roth, B. L., Kroeze, W. K. Integrated Approaches for Genome-wide Interrogation of the Druggable Non-olfactory G Protein-coupled Receptor Superfamily. The Journal of Biological Chemistry. 290 (32), 19471-19477 (2015).
- Jean-Charles, P. -Y., Kaur, S., Shenoy, S. K. G Protein-Coupled Receptor Signaling Through β-Arrestin-Dependent Mechanisms. Journal of Cardiovascular Pharmacology. 70 (3), 142-158 (2017).
- Smith, J. S., Rajagopal, S. The β-Arrestins: Multifunctional Regulators of G Protein-coupled Receptors. The Journal of Biological Chemistry. 291 (17), 8969-8977 (2016).
- Böhme, I., Beck-Sickinger, A. G. Illuminating the life of GPCRs. Cell Communication and Signaling. 7 (1), 16(2009).
- Fang, Y. Label-Free Receptor Assays. Drug discovery today. Technologies. 7 (1), 5-11 (2011).
- Wang, T., et al. Measurement of β-Arrestin Recruitment for GPCR Targets. Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Barnea, G., et al. The genetic design of signaling cascades to record receptor activation. Proceedings of the National Academy of Sciences of the United States of America. 105 (1), 64-69 (2008).
- Kroeze, W. K., et al. PRESTO-Tango as an open-source resource for interrogation of the druggable human GPCRome. Nature Structural & Molecular Biology. 22 (5), 362-369 (2015).
- Jordan, M., Schallhorn, A., Wurm, F. M. Transfecting Mammalian Cells: Optimization of Critical Parameters Affecting Calcium-Phosphate Precipitate Formation. Nucleic Acids Research. 24 (4), 596-601 (1996).
- Baker, J. M., Boyce, F. M. High-throughput functional screening using a homemade dual-glow luciferase assay. Journal of Visualized Experiments. (88), 50282(2014).
- Li, H., Eishingdrelo, A., Kongsamut, S., Eishingdrelo, H. G-protein-coupled receptors mediate 14-3-3 signal transduction. Signal Transduction and Targeted Therapy. 1 (1), 16018(2016).
- Walther, C., Ferguson, S. S. G. Minireview: Role of intracellular scaffolding proteins in the regulation of endocrine G protein-coupled receptor signaling. Molecular Endocrinology. 29 (6), Baltimore, Md. 814-830 (2015).
- Gurevich, E. V., Benovic, J. L., Gurevich, V. V. Arrestin2 expression selectively increases during neural differentiation. Journal of Neurochemistry. 91 (6), 1404-1416 (2004).
- Shaikh, S., Nicholson, L. F. B. Optimization of the Tet-On system for inducible expression of RAGE. Journal of Biomolecular Techniques JBT. 17 (4), 283-292 (2006).
- Blau, H. M., Rossi, F. M. Tet B or not tet B: advances in tetracycline-inducible gene expression. Proceedings of the National Academy of Sciences of the United States of America. 96 (3), 797-799 (1999).
- Roche, O., et al. Development of a Virtual Screening Method for Identification of "Frequent Hitters" in Compound Libraries. Journal of Medicinal Chemistry. 45 (1), 137-142 (2002).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved