Method Article
מניפולציה אופטוגנטית של פעילות עצבית לווסת את ההתנהגות בעכברים נעים בחופשיות
In This Article
Summary
עם מניפולציה אופטוגנטית של אוכלוסיות עצביות ספציפיות או אזורים במוח, התנהגות ניתן לשנות עם רזולוציה זמנית ומרחבית גבוהה בבעלי חיים נעים בחופשיות. באמצעות כלים אופטוגנטיים שונים בשילוב עם סיבים אופטיים מושתלים כרונית, ניתן לבצע מגוון של אפנון עצבי ובדיקות התנהגותיות.
Abstract
אפנון אופטוגנטי של מעגלים עצביים בעכברים נעים בחופשיות משפיע על התנהגות חריפה וארוכית טווח. שיטה זו מסוגלת לבצע מניפולציות של נוירונים בודדים ושחרור משדר ספציפי לאזור, עד מעגלים עצביים שלמים במערכת העצבים המרכזית, ומאפשרת מדידה ישירה של תוצאות התנהגותיות. נוירונים לבטא כלים אופטוגנטיים באמצעות הזרקה של וקטורים ויראליים נושאים את ה-DNA של בחירה, כגון Channelrhodopsin2 (ChR2). האור מובא לאזורי מוח ספציפיים באמצעות שתלים אופטיים כרוניים המחלים ישירות מעל אזור היעד. לאחר שבועיים של התאוששות וביטוי כלי נכון, עכברים יכולים לשמש שוב ושוב לבדיקות התנהגותיות עם גירוי אופטוגנטי של הנוירונים של עניין.
אפנון אופטוגנטי יש רזולוציה זמנית ומרחבית גבוהה שניתן להשיג עם ספציפיות תא גבוהה, בהשוואה לשיטות הנפוצות כגון גירוי כימי או חשמלי. האור אינו פוגע ברקמה עצבית ולכן ניתן להשתמש בו לניסויים ארוכי טווח, כמו גם לניסויים התנהגותיים מרובים בעכבר אחד. האפשרויות של כלים optogenetic הם כמעט בלתי מוגבלים ולאפשר הפעלה או השתקה של נוירונים שלמים, או אפילו מניפולציה של סוג קולטן מסוים על ידי אור.
התוצאות של ניסויים התנהגותיים כאלה עם גירוי אופטוגנטי משולב מדמיינת באופן ישיר שינויים בהתנהגות הנגרמים על ידי המניפולציה. ההתנהגות של אותה חיה ללא גירוי אור כבסיס היא שליטה טובה לשינויים מושרה. זה מאפשר סקירה מפורטת של סוגים עצביים או מערכות נוירוטרנסמיטר מעורב בהתנהגויות ספציפיות, כגון חרדה. הפלסטיות של רשתות עצביות ניתן גם לחקור בפירוט רב באמצעות גירוי לטווח ארוך או תצפיות התנהגותיות לאחר גירוי אופטי. Optogenetics יעזור להאיר איתות עצבי במספר סוגים של מחלות נוירולוגיות.
Introduction
אפנון של מעגלים עצביים במערכת העצבים המרכזית והתוצאות ההתנהגותיות שלהם חשובים להבנת איך המוח עובד, במיוחד במחלות פסיכיאטריות ומשימות קוגניטיביות כגון למידה וזיכרון. עם אופטוגנטיקה, תאים בודדים או אוכלוסיות תאים עד מעגלים שלמים ניתן לאפנן על ידי אור. כלים אופטוגנטיים נפוצים כמו Channelrhodopsin2 (ChR2) או Archaerhodopsin (קשת) מסוגלים להפעיל או להשתיק נוירונים, או להגדיל או לעכב שחרור משדר במסופי axon הקרנת אזורי מוחנפרדים 1,,2,,3,,4. עם זאת, קשת צריך לשמש בזהירות כפי שהוכח כי הפעלתה במסופי presynaptic מגביר שחרור משדר ספונטני5. קשת היא משאבת פרוטון החוצה ותוקן שמשנה את ערך ה-pH בתוך התא. מיליה אלקליין זה גורם זרם סידן ומשפר שחרור משדר5. כדי לווסת באופן ספציפי מסלולי איתות תאיים, כימרות קולטן המורכב של כלי optogenetic אור מופעל, כגון רודופסין או קונוס opsin, בשילוב עם קולטן G-חלבון מתאים יחד, ניתן ליצור6,7,8. הכמות והווריאציה של כלים אופטוגנטיים זמינים גדל באופן משמעותי במהלך העשור האחרון9.
המטרה של optogenetics היא לתמרן מעגלים עצביים במהלך התנהגות. Optogenetics מאפשר, למשל, מדידה של שינויים התנהגותיים חריפים כגון שינויים בהתנהגות חרדה. כלים אופטוגנטיים מועברים לאזורי היעד של המוח באמצעות וקטורים ויראליים. בעזרת יזמים ומשפרים מיוחדים, או מערכת Cre-loxP, ניתן להבטיח את ספציפיות סוג התא עבור הביטוי של כלים אופטוגנטיים(איור 1A). ישנם מספר קווי עכבר מהונדסים גנטית המבטאים את האנזים Cre-Recombinase בסוגים מסוימים של תאים בלבד. לדוגמה, עכברי Nex-Cre לבטא את Cre-Recombinase בנוירונים פירמידה בקליפת המוח ואת ההיפוקמפוס תחת שליטתו של Nex-מקדם10. אנזים זה מסוגל להפוך רצפי DNA, אשר מוקפים על ידי צדדים loxP11. כתוצאה מכך, רצף ה-DNA של כלי אופטוגנטי כפול floxed, אשר הפוך ומוקף על ידי צדדים loxP, ניתן לתמלל רק על ידי נוירונים בעלי Cre-Recombinase, אבל לא על ידי סוגים עצבייםאחרים 12,13. במקרה של עכברי Nex-Cre, הכלי optogenetic יתבטא אך ורק בנוירונים פירמידה. גירוי אור של אזורים מסוימים במוח מושגת לאחר מכן באמצעות השתלה כרונית של סיבים אופטיים ישירות מעל אזור העניין. לאחר מכן ניתן לזוג בעלי חיים למקור אור מתאים ולהתנהג בחופשיות כמעט בכל מיני בדיקות התנהגותיות.
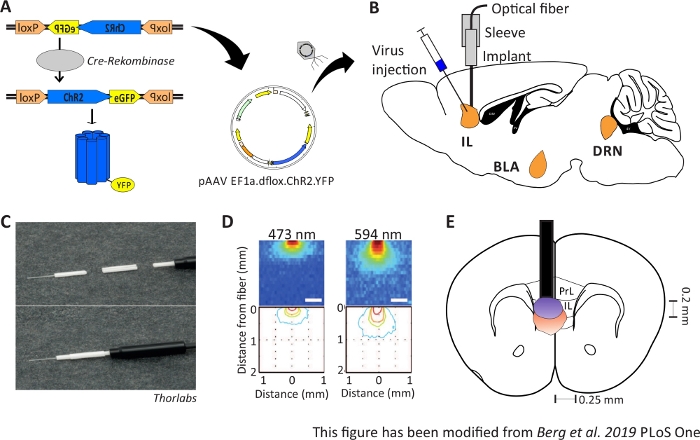
איור 1: הזרקה והשתלה. א) מערכת Cre-loxP עבור ChR2-YFP. כלי אופטוגנטי כפול נארז בווירוס אדנו המשויך (AAV) להזרקה לתוך רקמת המוח. ב) מבט Sagittal של הזרקת וירוסים והשתלה של ממשק עצבי אופטי לתוך /מעל אזור IL של mPFC. הזרקה והשתלה נעשו מלמעלה. כל תחומי העניין, IL, BLA ו- DRN מוצגים. C) תצוגה מפורטת של הסיבים האופטיים המושתלים, השרוול ומקור האור. ד)התפשטות של גירוי אור לייזר כחול ואדום ברקמת מוח של חומר אפור מסיב אור של 200 μm (יזהר ואח ' 2011). אור כחול מתפשט, לכל היותר, 0.5 מ"מ לתוך הרקמה, אור אדום על 1 מ"מ. קידוד צבע: אדום 50%, צהוב 10%, ירוק 5%, כחול 1% אם האור מגיע לאזור זה. ה) מבט קורונלי על ההשתלה החד-צדדית ישירות מעל IL השמאלי עם סיב אופטי של 200 μm. אזור IL ברוחב של 0.25 מ"מ בכל חצי הכדור ועומק של 0.2 מ"מ. נורות כחולות ואדומים הן ההתעוות של 5% התפשטות אור ומועברות מיזהר ואח ' לגודל הנכון. LoxP: לוקוס של X-over P1; ChR2: ערוץrhodopsin; YFP: חלבון פלורסנט צהוב; dflox: כפול floxed; IL: קליפת המוח האינפרה-לימבית; אמיגדלה באסולטרל; גרעין ראף גב; PrL: אזור טרום לימבי. נתון זה שונה מברג 201948. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
גישות Optogenetic מנוצלות כפי שהוא מאפשר הן רזולוציה זמנית גבוההומרחבית 14 ואפנון ספציפי סוג התא. בנוסף, ניתן להשתמש שוב בהתקן המושתל ללא טיפול נוסף. לאחר ניתוח סטריאוטיפי, שבו הזרקת וירוס אדנו הקשורים נושא את הכלי האופטוגנטי ואת ההשתלה של הסיב האופטי מבוצע, עכברים יכולים להתאושש במשך שבועיים. בחרנו זמן התאוששות של 2 שבועות בלבד, כי זה מספיק זמן כדי להתאושש מהניתוח ולנגיף לבטא. כמו ניסויים התנהגותיים מלווה על ידי אימונוהיסטוכימיה, אנחנו צריכים לוודא כי עכברים לא להיזקן מדי במהלך הניסוי; אחרת איכות הרקמה יורדת. הם לא מראים ליקויים התנהגותיים ברורים מהשתל ועוסקים בהתנהגות כלוב טיפוסית. כמובן, ההשתלה מלווה בבעיה כירורגית משמעותית; לכן, העכברים מנוטרים באופן אינטנסיבי. לאחר הניתוח, עכברים צריכים להיות רווקים, כמו עכברים שהקבוצה שותה נוטים לפגוע הפצעים הטריים של זה ושתלים. עם זאת, תנאי הדיור יש השפעה רבה על רמת החרדה של עכברים זכרים, כמו עכברים מאוכלנים יחידלהראות רמות חרדה נמוכות יותר 15 ובאופן כללי פחות דיכאון כמוסימפטומים 16.
מניפולציה כימית או חשמלית של מעגלים במוח חסר את סוג התא הגבוה ספציפיות של optogenetics ויש להם רזולוציה זמנית ומרחביתנמוכה יותר 14,17,18. בהתאם לשאלה ניסיונית, גירוי חשמלי או כימי יכול להיות יתרונות שונים. כאשר עובר מסופי סיבים באזור מסוים גם צריך להיות מגורה, גירוי חשמלי היא השיטה הטובה ביותר. גירוי כימי הוא בחירה טובה כאשר קולטנים ספציפיים משדר באזור שלם צריך להיות מופעל על ידי אגוניסטים. יתרון גדול נוסף של optogenetics לעומת גירוי כימי או חשמלי הוא כי אנדוגני, נוירונים אינם רגישים לאור, אשר מונע את המופע של תופעותלוואי 19. אכן, עוצמת אור גבוהה עלולה לגרום להשפעותחימום 8,20, אבל בשל קבוצות בקרה נכונה, ניתן לבטל את ההשפעות ההתנהגותיות עקב מניפולציה אופטוגנטית.
חקירת התנהגות מכרסמים, במיוחד בכל הנוגע למחלות פסיכיאטריות, השתפרה מאוד עם אופטוגנטיקה בבעלי חיים נעים בחופשיות, כפי שהוא מאפשר אפנון ישיר של קולטנים יחיד עד אוכלוסיות תאיםספציפיים 21 ומעגלים22. האפשרות למדוד את ההשפעות החריפות של אפנון כזה, כמו גם את ההשפעות ההתנהגותיות לטווח ארוך לאחרזמן מוגדר 23 או אחרי גירוי כרוני24, מאפשר גמישות רחבה של עיצובים ניסיוניים ומספק תובנות מפורטות מאוד על מעגלים במוח. גירוי אור יכול לשמש לווסת נוירונים הממוקמים באתר ההזרקה של הכלי optogenetic. כאשר הן הזריקה וההשתלה לטפל באותו אזור המוח, גופים תא ובחזרה הקרנת אקסונים של נוירונים עקרוניים ו interneurons באזור זה יכול להיות ממוקד3,,6,8. עם זאת, סיבים בהירים יכולים להיות מושתלים גם באזור שונה מזה המוזרק. במקרה זה, גירוי אור יכול לווסת שחרור משדר במסופי axon באזורי הקרנה של האזורהמוזרק 25,26,27.
במחקר כאן, optogenetics משמש בשילוב עם ניסויים כדי לנתח התנהגות הקשורה לחרדה. מחלות פסיכיאטריות הקשורות לחרדה משפיעות על יותר משליש מאוכלוסיית העולם28,29,30 ולגרום לנטל כלכלי גבוה31. הנפגעים סובלים מתחושה של עוררות, מתח ודאגה ולאחר מכן התנהגותהימנעות 32,33. רגשות שליליים כרוניים אלה, המתמקדים בעיקר באירועיםעתידיים 34, מפריעים מאוד לחיי היומיום של החולים. טיפולים נפוצים כמו בנזודיאזפינים או מעכבי ספיגה מחדש של סרוטונין (SSRIs) מצליחים רק בחלק מהחולים. כמות גדולה של אנשים אינם מגיבים לטיפולכלל 35, מראה כי המנגנון הבסיסי מחלות כאלה עדיין לא מובן במלואו. קליפת המוח הקדם חזיתית המי רקדלית (mPFC) ידועה כמחזה תפקיד חשוב בהתפתחות ובביטוי שלחרדה 21,,25,27,36,37,38. באופן ספציפי, פעילות יתר של אזור קליפת המוח האינפרלימית (IL) ב-mPFC עשויה להיות חלק מהפרעות הקשורות לחרדה39,40. הניסוי לדוגמה המתואר כאן יכול לעזור להבין כיצד אפנון באזור IL של mPFC להשפיע על התנהגות חרדה. בנוסף, פיתוח אסטרטגיות טיפוליות חדשות למחלות פסיכיאטריות הקשורות לחרדה יכול גם להיות נתמך.
עכברי Nex-Cre זכר בן 2-6 חודשים משמשים כדי לבטא ChR2 במיוחד נוירונים פירמידה בתוך אזור IL של mPFC41. לעכברי Nex-Cre יש רקע C57Bl/6 ומבטאים את האנזים Cre-recombinase במיוחד בנוירונים פירמידה. במהלך ניתוח סטריאוטיפי, כפול floxed ChR2-DNA מוזרק לאזור IL באמצעות אדנו הקשורים וקטורים ויראליים. השתל האופטי ממוקם ישירות מעל אזור העניין (איור 1B) והשתל קבוע במלט דנטלי. בעלי חיים שליטה לקבל הזרקה של tdTomato-DNA כפול פלוקסי באותו אזור לחקות ביטוי ספציפי לתא.
בעלי חיים הם קבוצה שוחסנים עד יום הניתוח ולאחר מכן הם רווקים שוחסנים כדי למנוע פציעות מעכברים אחרים. עכברים שותים במדפים בודדים של כלוב מאוורר (IVC) בכלובים TypI-L לעכברים בודדים. מחזור החשכה-בהיר עוקב אחר קצב של 12:12 שעות, שלב האור החל מ-10 בבוקר. כל הניסויים ההתנהגותיים מבוצעים בשלב האפל, הדומה לשלב הפעיל של המכרסמים. מים וכדורי מזון סטנדרטיים זמינים עד libitum. לאחר שבועיים של התאוששות, אשר מבטיח ביטוי מספיק של ChR2 בנוירונים פירמידה, עכברים משמשים לניסויים התנהגותיים.
השדה הפתוח (OF) הוא מבוך בריבוע של 50 ס"מ על 50 ס"מ עם קירות בגובה 40 ס"מ. הקרקע מחולקת 16 ריבועים שבו הפנימי 4 מייצגים את המרכז. אופן הפעולה הנמדד הוא: 1) הזמן שהושקע במרכז, 2) מספר ערכי המרכז ו- 3) המרחק הכולל שהועבר. במהלך ניסוי זה, ישנם 4 ניסויים בסך הכל 20 דקות. בניסויים 1 ו-3, לא מתרחש גירוי אור, ובניסויים 2 ו-4, גירוי של 20 הרץ עם פעימה של 5 אלפיות השנייה ועוצמת אור של 1 מ"ר של 473 נה"מ מבוצעת(איור 2A). בניסויים מאוחרים יותר נלקח בחשבון המגורים באזור הבדיקה, אך השימוש בבעלי חיים שהוזרקו על-ידי זיוף מצביע על אופן התבטאות המגורים.
מבוך בארנס הוא ניסוי ללמידה וזיכרון. זוהי פלטפורמה מעגלית בקוטר 92 ס"מ ומכילה 20 חורים בקווי ם סביב היקף. 19 מהחורים סגורים ותחת חור אחד מוצגת תיבת בריחה. במשך 4 ימים רצופים, לעכברים יש 4 ניסויים באימונים כדי ללמוד את המיקום של תיבת המילוט. ביום ה-5, תיבת המילוט מוסרת, ועכברים נבדקים על כמה זמן הם צריכים כדילמצוא את החור הנכון. אופן הפעולה הנמדד הוא: 1) זמן עד תיבת הבריחה / החור הנכון נמצא, 2) מספר ביקורי היעד ושגיאות, ו 3) מרחק עבר עד בתיבת הבריחה. הגירוי הקל בקבוצות שונות נעשה במהלך רכישה או קונסולידציה, המתקיימות בימי האימון 1-4, או במהלך האחזור ביום הבדיקה, שהוא היום ה-5(איור 2D).
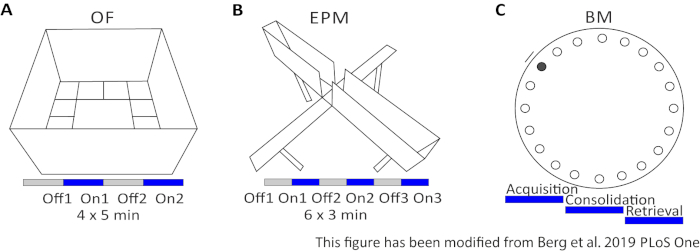
איור 2: ניסויים התנהגותיים בפרוטוקולים אופטוגנטיים. A) ציור סכמטי של ניסוי שדה פתוח עם פרוטוקול גירוי האור המתאים. C) ציור סכמטי של ניסוי מבוך מוגבה פלוס עם פרוטוקול גירוי האור המתאים. ד)ציור סכמטי של ניסוי מבוך בארנס עם פרוטוקול גירוי האור המתאים. EPM: מבוך מוגבה פלוס; OF: שדה פתוח; מבחן המבוך של בארנס. נתון זה שונה מברג 201948. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
עבור גירוי אופטוגנטי, עוצמת האור והתדירות יש להתאים לכלי אופטוגנטי וסוג עצבי כי הוא תחת חקירה. עוצמת האור הנמוכה ביותר האפשרית יש להשתמש על מנת למנוע נזק לרקמות, כמו מספר מחקרים הראו כי ישנן השפעות חימום אפשריות בשל עוצמת אור חזקה8,20. עבור ChR2, גירוי 20 הרץ עם פעימה אור 5 ms משמש בדרך כלל2. כמו ChR2 הוא די רגיש לאור, עוצמת אור 1 mW מספיק. פרוטוקול גירוי האור מתחלפים בין אור כבוי ועל ניסויים כדי למדוד ישירות שינויים התנהגותיים. תנאי החדר החיצוני לניסויים התנהגותיים צריכים להישאר יציבים עבור כל קבוצת בעלי החיים. התנאים החשובים שיש לקחת בחשבון הם הרעש (זכור שהמכשירים עצמם עשויים לעשות רעש), הריח (תמיד לנקות את הגדרות התנהגות עם אתנול), עוצמת האור, ואת הנסוי. הנסוי תמיד צריך להיות אותו אדם. בנוסף, השעה ביום של הניסויים צריכה להיות זהה עבור כל בעלי החיים בקבוצה אחת, כמה שעות לאחר תחילת השלב האפל במתקן הוא המועדף.
מטרת הניסוי היא להגדיל את יחס העירור/עיכוב (E/I) באזור IL באמצעות הפעלה חזקה של נוירונים פירמידתיים מעוררים. יחס E/I משופר באזור קליפת המוח המיוחד הזה ידוע כדי להגדיל את רמות החרדהבעכברים 40,42,43,44.
Protocol
הליכים הקשורים לנבדקים בעלי חיים אושרו על ידי מתקן המחקר המוסדי לחקר בעלי חיים ו"Senatorin für Wissenschaft, Gesundheit und Verbraucherschutz" באוניברסיטת ברמן (#146)
1. הכנת השתל האופטי9 (איור 1C)
- מניחים את הצד השטוח של פרל קרמיקה על הספסל.
- רצועת השכבה של סיבי זכוכית בקוטר 200 μm עם כלי הפשטת סיבים ולחתוך 2-3 ס"מ חתיכות ארוכות עם סופר סיבים קרמיים.
- מניחים את חתיכת סיבי הזכוכית בפרול הקרמיקה עם עודף משני הצדדים.
- מניחים טיפה של דבק מגע בצד השטוח של ferrule קרמיקה עם canula הזרקה.
הערה: ניתן להשהות את הפרוטוקול כאן. - להוציא את השתל מראש מהספסל ו בצד העגול של ferrule קרמיקה, לחתוך את סיבי הזכוכית קצר ככל האפשר עם סופר סיבים קרמיים.
- מניחים את השתל הקדם-שתל בדיסקית ליטוש ומצחצחים את הצד העגול ב-4 ניירות ליטוש שונים, על ידי ציור של שמונה 20 פעמים בנייר (30 μm grit, 6 μm grit, 1 μm grit, וסוף סוף 0.02 μm חצץ).
- להוציא את השתל מראש מדיסקית הליטוש ferrule ולחתוך את סיבי הזכוכית בצד השטוח של ferrule קרמיקה לאורך הדרוש להשתלה. התחל למדוד את האורך מאחורי דבק-על בולט.
- אפילו משטח חיתוך פשוט לגרד את סיבי הזכוכית 2-3 פעמים ולאחר מכן לשבור אותו.
הערה: השתמש אטלס מוח העכבר מ Paxinosופרנקלין 45 כדי לחשב את אורך השתל. השתל חייב להסתיים ישירות מעל אזור העניין ואת עובי הגולגולת צריך להיכלל בחישוב אורך. כדי לעורר את אזור IL, סיבי הזכוכית יש אורך של 1.8 מ"מ(איור 3).
- אפילו משטח חיתוך פשוט לגרד את סיבי הזכוכית 2-3 פעמים ולאחר מכן לשבור אותו.
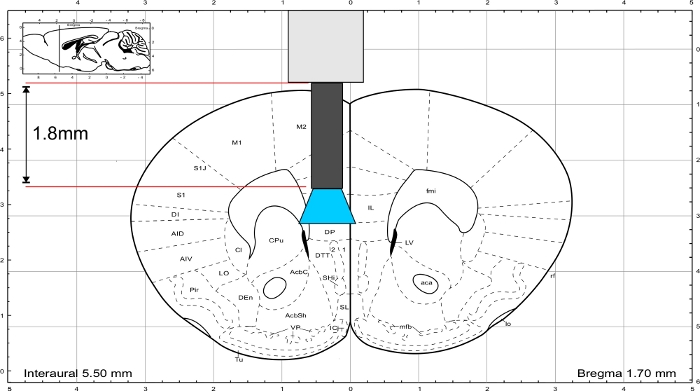
איור 3: אטלס מוח העכבר (Paxinos ופרנקלין) עם אורך מייצג של השתל כדי להגיע לאזור IL. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
- חיטו את השתל המוגמר למשך 10 דקות באתנול ותנו לו להתייבש לפני ההשתלה.
2. הזרקה והשתלה
- להעביר עכבר אחד לחדר הניתוח ולשקול אותו. למרוח הרדמה עם הזרקת תוך אפרטונאל (i.p. ) של קטמין / Xylazine (קטמין 0.12 מ"ג/ גרם, Xylazine 0.01 מ"ג / גרם).
- לתקן את העכבר עם היד השמאלית ולהפוך אותו על גבו עם הראש מוחזק נמוך.
- כוון לרביע השמאלי התחתון של הבטן עם המזרק והזן את ההזרקה canula 1 ס"מ מתחת לעור.
- להזריק הרדמה בתנועה איטית וקבועה לתוך חלל הבטן.
- מניחים את העכבר בחזרה לכלוב שלו ולחכות עד שהוא מגיע למצב עמוק של הרדמה.
הערה: עומק ההרדמה יכול להיקבע על ידי היעדר רפלקסים מהבהבים ובין בהונות.
- מניחים את העכבר על לוח חימום ומסדרים את הראש במסגרת סטריאוטיפית. לתקן את האף והשיניים מלפנים, ואת האוזניים משני הצדדים.
הערה: על הראש להיות ישר על ציר שמאל-ימין ורוזל-סיבתי כדי להבטיח קואורדינטות סטריאוטיפיות נכונות. - למרוח משכך כאבים עם 2 מ"ג/ק"ג Carprofen תת עורית לתוך החלק האחורי של העכבר ולהחיל משחה עיניים אטומה על שתי העיניים כדי להגן עליהם מפני ייבוש.
- להרטיב את השיער על הקרקפת עם מגבת נייר רטובה ולאחר מכן לחתוך אותו באמצעות מספריים. הקפד להסיר את כל השיער הרופף עם מגבת נייר רטובה. כדי לחטא את הקרקפת, להשתמש במקל כותנה ולקחת 0.5 מ"ל של תמיסה המכילה יוד (Betaisodona 100 מ"ג / מ"ל Povidon יוד ו 11 מ"ג / מ"ל יוד) ולתת לו אוויר יבש.
הערה: במקום מספריים, גם קוצץ חשמלי יכול לשמש להסרת שיער נכונה. - הרם את הקרקפת מעל אזור העניין עם פינצטה וחתוכה 1 ס"מ לאורך קו האמצע. השתמש בשתי פינצטה כדי לדחוף את העור הצידה כדי לחשוף את הגולגולת. הקפד גם להסיר את העור הדק מעל הגולגולת ולתת את הגולגולת החשופה להתייבש.
- תחוסל את הגולגולת להשתלה מאוחרת יותר.
- למרוח טיפה של 2 מ"מ x 2 מ"מ של חומצה זרחנית (37%) מתוך ערכת הדבק (למשל, Optibond) על הגולגולת, להפיץ אותו עם קצה המזרק ולתת לו להשפיע עבור 15 s.
- מסירים את כל החומצה עם מקל כותנה ושולחים את הגולגולת עם 1 מ"ל של 0.9% NaCl פעמיים.
- יבש את הגולגולת עם מקל כותנה ואוויר דחוס.
אזהרה: חומצה זרחנית היא מסוכנת ויש להסירה לחלוטין כדי למנוע נזק לרקמות.
- חשב את ה-F-Factor עבור קואורדינטות בודדות.
- מניחים קנולה זכוכית במסגרת הסטריאוטיפית ואתרו אותה ישירות מעל ברגמה.
- אפס את מערכת הקואורדינטות והעביר את התות הזכוכית למבדה.
- חשב את F-factor46 באמצעות הנוסחה הבאה:
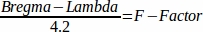
- הכפל את ה-F-Factor עם הקואורדינטות של אטלס מוח העכבר כדי להתאים אותם לעכבר הבודד.
- לקדוח חור בגולגולת להזרקה.
- השתמש בקואורדינטות המותאמות כדי למצוא את המיקום על הגולגולת ישירות מעל מבנה העניין ולסמן אותו באמצעות קצה של canula הזרקה על ידי גירוד אותו מעל פני העצם.
- השתמש canula הזרקה לקדוח חור לתוך הגולגולת במיקום המסומן על ידי סיבוב הנוולה על המקום. אם דם דולף מתוך חור הבור, לשטוף עם 1 מ"ל של 0.9% NaCl לייבש את הגולגולת לאחר מכן.
- קח את תמיסת הווירוס לתוך התותח זכוכית.
- מניחים טיפה של 100 μL של 0.9% NaCl על הגולגולת וחתיכת parafilm (1 ס"מ x 1 ס"מ) על גבי, צד סטרילי למעלה.
- מניחים 1-2 μL של תמיסת וירוס על parafilm ולהוריד את קצה התותח זכוכית לתוכו.
- חבר את התותח זכוכית למזרק, להפעיל לחץ שלילי מינימלי ולחכות עד פתרון הווירוס נלקח על ידי cannula (בתוך שניות).
הערה: חשוב לעצור את היישום של לחץ שלילי, לפני האוויר הרים לתוך הנוולה. לכן, תמיד יהיה שריד קטן של פתרון הווירוס.
- להזריק את פתרון הווירוס לאזור של עניין.
- מניחים את הוירוס מלא זכוכית canula מעל חור בר.
- לאט לאט להוריד את הנוולה לתוך חור בר ולאפס את z-קואורדינטות כאשר קצה הנולה הוא ברמה של הגולגולת.
- הנמך את הנולה בזהירות למיקום הנמוך ביותר של אתר ההזרקה.
- למקד את המשקפת על מניסקוס של פתרון וירוס בתוך הנוולה.
- למרוח כמות קטנה של לחץ חיובי עם המזרק עד מניסקוס הוא הוריד שולית.
- תנו לווירוס להתפשט 2-3 דקות לפני הזזת התותחים מזכוכית כלפי מעלה למיקום הבא.
- החל את פתרון הווירוס כל 200-300 μm בכל האזור של עניין.
- הסר את האפשרות זכוכית לאט מאוד ולזרוק אותו לאחר הזריקה הסופית.
- הכן את הגולגולת להשתלה באמצעות ערכת ההדבקה (לדוגמה, OptibondTMFL).
- יבש את הגולגולת עם אוויר דחוס.
- למרוח 5 μL של פריימר (למשל, Optibond, 1-30% (אתנול, חומצה סיליצית, גליצרינפוספטדימהאקרילאט, 2-(2-(Methacryloyloxy)אתוקסיקקרבוניל)בנזואזאור, 2-Hydroxyethylmethacrylat)) עם המקל המתאים ולתת לו להתייבש במשך 15 s.
- החל 5 μL של אג"ח (למשל, Optibond, 15-20% 2-Hydroxyethylmethacrylat + 1-2% אלקליהאקספלואורוסיליקאט(Na)) עם אותו מקל לרפא אותו עבור 20 s עם אור UV (420-480 מיליומטר).
הערה: חיוני שהגולגולת יבשה ושהטבר והקשר מוחלים בשכבה דקה מאוד.
אזהרה: אין להסתכל ישירות לתוך אור UV, כמו אור UV עלול לפגוע בעיניים.
- מקם את השתל ישירות מעל אזור העניין.
- תקן את השתל במחזיק המתאים.
- יבש את הגולגולת עם אוויר דחוס.
- מקם את קצה סיב הזכוכית ישירות מעל חור הבור ומוריד אותו בזהירות.
- תפסיק להוריד את השתל כאשר הנורה הנותרת של דבק מגעים בגולגולת. אל תפעיל לחץ על הגולגולת!
הערה: אם ההזרקה וההשתלה נעשות באזורים שונים (למשל, ראף גב והיפוקמפוס),לקדוח את כל החורים הדרושים לאחר החלת חומצה זרחנית, אבל לפני הדבקה 2-רכיבים, לאחר מכן בצע את ההוראות כמתואר קודם לכן (שלב 2.8-2.14).
- תקן את השתל.
- בדוק אם הגולגולת עדיין יבשה לגמרי.
- למרוח מלט שיניים נוזלי (למשל, גרדיה ישיר flo) סביב השתל ובסביבה ולרפא עבור 20 s עם אור UV (420-480 נמיות).
הערה: כמות הבטון הדנטלי תלויה באזור הגולגולת החופשית. כל הגולגולת צריכה להיות מכוסה על ידי מלט שיניים. - למרוח עוד שתי שכבות של מלט ולמלא לחלוטין את אזור הגולגולת החופשית והיבשה. לרפא כל שכבה עם אור UV (420-480 נה"ר).
- תסיימי את הניתוח.
- למרוח 0.5 גרם משחת יוד (Betaisodona 100 מ"ג / מ"ל יוד povidone ו 11 מ"ג / מ"ל יוד) על הפצע כולו.
- להזריק 0.1 מ"ל של גלוקוז מומס ב 0.9% NaCl תת עורית לתוך הצוואר להחלמה מהירה.
- שחררו את קיבעון האף והאוזן, הביאו את העכבר לכלוב טרי והנימו אותו תחת מנורת חימום כדי למנוע אובדן חום הגוף.
- כשהעכבר יתעורר, תחזיר אותו למתקן.
- בדוק את מצבה הבריאותי לפחות פעם ביום. לנקוט בפעולה המתאימה אם עכברים מציגים חוקות גרועות כלשהן (לדוגמה, ודאו משכך כאבים לאחר הניתוח עם Carprofen עד 3 ימים אם עכברים מציגים סימני כאב כלשהם).
הערה: לאחר שבועיים של התאוששות, עכברים יכולים לשמש לניסויים התנהגותיים.
3. הגדרת ניסוי חדש (גירוי ChR2 לדוגמה ושדה פתוח)
- פולס (פולס)
- לתכנת את הדופק (למשל, פריזמטיקס) לגירוי אור.
- פתח את התוכנה ובחר את יציאת ה- USB COM למקור האור מחובר לה.
- בחר בחר מצב פעולה (3) | בצע רצף פולסים לאחר גורם מפעיל גבוה, ולאחר מכן הפסק כאשר LOW כדי לאפשר לתוכנה חיצונית לשלוט במקור האור.
- תכנת את פרוטוקול האור. לגירוי של 20 הרץ עם פעימה קלה של 5 השנייה: בחר TI = 23 ms, P1D = 5 ms, P1I = 22 ms ו- P2D = 0 ms.
- הקש על רצף התחל. מצב זה יישאר עד לסיום הניסויים.
הערה: יש להפעיל את תוכנת pulser (Prizmatix Pulser) לפני תוכנת מעקב הווידאו; אחרת תוכנת מעקב וידאו לא תוכל לזהות את ההתקן.
- תוכנת מעקב וידאו (לדוגמה, אתויז'ן XT)
- צור ניסוי חדש מתבנית מוגדרת מראש.
- פתח את התוכנה, עבור אל קובץ, בחר חדש מתוך תבנית. בחר החל תבנית מוגדרת מראש.
- בחר מעקב חי ובחר את המצלמה על-ידי לחיצה על מקור ואשר את ה-Basler GenICam המחובר.
הערה: התמונה החיה של המצלמה תוצג כעת בחלון בפינה השמאלית העליונה. - לחץ על הבא ובחר את החיה אשר יש להקליט(מכרסמים, עכבר).
- הקש על הבא ובחר את תבנית הזירה פתח שדה, מרובע. בחר את מרכז תבנית האזור, גבול, פינות ואשר באמצעות הבא.
- אשר נושא אחד שיש לעקוב אחריו באמצעות הבא.
- בחרו בנקודת מרכז, בנקודת האף ובסיס הזנב ואשרו את צבע החי בהשוואה לרקע כהה יותר עם Next.
- אשר את קצב הדגימה המומלץ של 12.5 עם הבא וסיום השלב.
- תן שם לניסוי המתאים ובחר מיקום לשמירה.
- הגדר את ההגדרות הניסיוניות.
- עבור אל הגדרות התקנה וניסיוניות. בחר נקודת מרכז, נקודת האף וזיהוי בסיס הזנב כתכונות במעקב.
- בחר שימוש בחומרת בקרת ניסיון ולך אל הגדרות.
- בחר Noldus USB-IO תיבת ואישר עם אישור.
- בחר חומרה מותאמת אישית כסוג התקן ביציאת TTL, המחוברת להתקן הדופק, ואשר עם אישור.
- הגדר את הגדרות הזירה.
- עבור אל הגדרות ארנה ובחר הגדרות ארנה 1.
הערה: המצלמה תפתח כעת תמונת רקע באופן אוטומטי. - אשר את התמונה באמצעות Grab.
- התאם את האזורים המוגדרים מראש לזירה האמיתית על-ידי שינוי גודלם. השתמש בחץ וב שני הסמלים מימין. אם אזורים מסוימים אינם נחוצים, מחק אותם.
- הקש 1. צייר קנה מידה לכייל ולמשוך קו מפינה אחת של המבוך לשני. הזן את אורך המרחק האמיתי בס"מ.
- חזור על זה עבור הציר השני.
- עבור אל הגדרות ארנה ובחר הגדרות ארנה 1.
- בדוק אם גירוי האור עובד.
- עבור אל ארנה - מיפוי חומרה ובחר בדוק את הסרג האפור.
- בחר פלט פקודה 1 גבוה ולחץ על Test.
הערה: צריך להיות אור פולט מסוף הסיב האופטי. בעת בחירה בפלט 1 נמוך ובדיקה, הגירוי אמור להיפסק.
- הגדר את הגדרות בקרת הניסיון למשך 20 דקות של ניסוי. הגדר ניסויים Off1, On1, Off2 ו- On2 לכל אחד מהם באורך של 5 דקות.
- עבור אל הגדרת בקרת ניסיון ובחר עקוב אחר משך 30 דקות.
- הכן את הכלל הראשי על-ידי התאמת התנאי: שעה ל- 20 דקות על-ידי בחירת הגדרות ושינוי 30 עד 20 דקות. אשר עם אישור.
הערה: התנאי עבור מסלול התחלה צריך להיות כאשר הנושא נמצא בזירה למשך 2 שניות. בדרך זו המערכת תתחיל באופן אוטומטי מעקב כאשר העכבר הוא בזירה. - צור כלל משנה עבור גירוי האור: עבור אל מבנים, עוד ובחר כלל משנה.
- תן לו שם כגון פרוטוקול גירוי אור.
- מקם אותו מתחת לכלל הראשי ופרוש את שתי התיבות על-ידי בחירת האזור הכחול עם כמובן העכבר.
- עבור אל תנאים , זמן ולתת לו שם כמו אור על 1.
- התאמת מצב הוא נפגש עם לאחר 5 דקות. אשר עם אישור.
- מקם את התיבה ישירות מאחורי התיבה התחלה של כלל המשנה על-ידי משיכתה לקו השחור.
- עבור אל פעולה | חומרה מותאמת אישית ותן לה שם: אור ב- 1.
- בחר פעולה כדי לבצע כפלט 1 גבוה ולאשר עם אישור.
- מקם את התיבה ישירות מאחורי התיבה תנאי.
הערה: כעת, לאחר 5 דקות של הניסוי, גירוי האור אמור להתחיל. - חזור על השלבים כדי להגדיר את תנאי הזמן לאחר 5 דקות ואת הפעולה פלט 1 נמוך כדי לעצור את גירוי האור לאחר 5 דקות נוספות.
- חזור על השלבים שוב כדי לתכנת אור נוסף כבוי ולהאיר במשפט.
- עבור אל מבנים | הפניה לכלל משנה ותבדוק שההפניה שייכת לכלל המשנה הנכון.
- בחר תנאי התחלה בשם ללא דיחוי ועצור תנאים כהפעלה פעם אחת לכל תנאי התחלה. אשר עם אישור.
- מקם את תיבת ההפניה בין תיבת הפעולה 1 לבין תיבת התנאי 2 של הכלל הראשי וצייר קו מפעולה - התחל רצועה אל ההפניה . Reference
הערה: כעת הכלל הראשי מפעיל ישירות את כלל המשנה לאחר הפעלת המסלול.
- הגדר את הגדרות הזיהוי כדי להראות למערכת מה יש לעקוב אחריה.
- עבור אל הגדרות זיהוי ובחר הגדרות זיהוי 1.
- מקם עכבר בדיקה בזירה ובחר התקנה אוטומטית.
- בחר מכרסם כסוג בעלי חיים ולהשתמש מקלל העכבר לצייר תיבה סביב העכבר בזירה. אשר את השאלה אישור התוצאות עם כן?
- הגדר את רשימת הניסויים עבור כל בעלי החיים הניסיוניים שיש לעקוב אחריהם.
- עבור אל רשימת ניסיון ותכנן את כל בעלי החיים להקליט היום: בחר הוסף ניסויים ובחר מספר.
- בחר את כל התנאים שהוגדרו לפני עבור כל עכבר.
- תן שם למזהה בעל החיים ולטיפול כראוי כדי לפשט את הניתוח מאוחר יותר.
הערה: מזהה בעלי חיים אינו רלוונטי עבור המערכת וחשוב רק לניתוח נתונים מאוחר יותר על ידי הנסוי. לקבץ בקבוצת טיפול ובקרה חשוב למערכת לדעת כיצד לקבץ וכיצד להשוות את כל המסלולים בשלבים מאוחרים יותר של ניתוח.
- עבור לרכישה ולהתחיל עם הניסוי.
- צור ניסוי חדש מתבנית מוגדרת מראש.
4. ניסוי בשטח פתוח (חרדה)
- הביאו את העכבר הניסיוני לחדר ההתנהגותי ממש לפני הניסוי כדי להבטיח רמה נאותה של חרדה.
הערה: יש לבצע את הניסויים ההתנהגותיים בשלב האפל כאשר עכברים ערים, ותמיד באותו זמן כדי להבטיח השוואה. - זוג העכבר דרך שרוול למקור האור על ידי לחיצה עליו בעדינות על הרשת של הכלוב.
- מניחים אותו בכלוב המתנה עם פסולת טרייה למשך 10 דקות כדי להתאקלם עם כבל האור.
- התחל רכישה על-ידי לחיצה על לחצן התחל תוכנת מעקב וידאו (לדוגמה, אתויז'ן XT).
- העבר את העכבר מכלוב ההמתנה לפינה השמאלית העליונה של השדה הפתוח. הסר את הזרוע תוך 2 שניות כדי להימנע ממעקב אחר זרוע במקום העכבר.
- השאר את השדה החזותי של העכבר במהלך הניסוי ולשמור על קור רוח.
- לאחר 20 דקות, כאשר הניסוי הסתיים, הסר את העכבר מהמבוך, נתק את כבל האור והחזיר אותו לכלוב הביתי שלו.
- תחזיר את העכבר למתקן.
5. בארנס מבוך (למידה)
- הביאו את כל העכברים הניסיוניים לחדר ההתנהגות כשעה לפני הניסוי.
- הכן את מבוך בארנס על ידי סגירת כל החורים מלבד אחד, שתחתיו תיבת בריחה ממוקמת. מניחים קיר קרטון באמצע הרציף, שהוא אזור ההתחלה של העכבר.
- חבר עכבר אחד למקור האור (שרוול על כבל אור) בשני השתלים.
- מקם את העכבר ישירות באמצע מבוך בארנס לתוך קיר קרטון, אשר מונע מהעכבר להתרוצץ לפני שהניסוי מתחיל.
- לחץ על התחל תוכנת מעקב וידאו (לדוגמה, אתויז'ן XT) והסר את קרטון.
הערה: התוכנה עוקבת אחר העכבר עד לתום החור הנכון, אך להיות מוכן לעצור את הניסיון באופן ידני רק במקרה התוכנה אינה מזהה את מעבר החור. - להוציא את העכבר מהמבוך ולהסיר את החיבור כבל האור.
הערה: אם זהו יום אימונים עם מספר ניסויים לכל עכבר, השאר את העכבר בחדר ההמתנה לצד חדר ההתנהגות עד שהאימונים הבאים מתחילים. אם זה היה יום הבדיקה עם ניסוי בדיקה אחד בלבד לכל עכבר, להחזיר את העכבר למתקן.
6. ניתוח נתונים (נתוני שדה פתוח לדוגמה עם 4 ניסויים ייחודיים)
- תוכנת מעקב וידאו (לדוגמה, אתויז'ן XT)
- הגדר את הקבוצות והניסויים הניסיוניים בפרופיל הנתונים.
- עבור אל פרופילי נתונים מימין ובחר טופל לעומת פקד.
- עבור אל קינון בחלון החדש בצד שמאל האמצעי ובחר מצב בקרת ניסיון.
- בחר את מרווח הזמן של המצב מתוך פעולת הרכיב: הפעל את Track אל פעולת הרכיב: האור עובר ב- 1.
- מקם את התיבה קינון בין תיבת הסינון טיפול לבין תיבת התוצאה המתאימה.
הערה: מרווח זמן מוגדר זה הוא Off1, המתאר את 2.5 הדקות הראשונות של הניסוי שבהן לא קיים גירוי אור. - חזור על השלבים עבור מרווחי זמן On1 (מתוך רכיב פעולה: האור נכבה 1 לרכיב פעולה:האור יוצא 1 ), Off2 (מן האלמנט פעולה: האור יוצא 1 לאור היסוד הולך על 2) ו On2 (מן הפעולה אלמנט: אור ממשיך על 2 לרכיב פעולה: להפסיק את המסלול).
- חזור על 4 המרווחים עבור קבוצת מסנני הבקרה.
הערה: כל תיבת קינון זקוקה לתיבית תוצאות משלה עם השמות Off1, On1, Off2, On2. כעת הן קבוצת הטיפול והן קבוצת הביקורת מחולקים ל-4 ניסויים שונים של גירוי אור אשר מנותחים בנפרד.
- הגדר את הפרמטרים שיש לנתח בפרופיל הניתוח.
- עבור אל פרופילי ניתוח מימין ובחר באזורים .
- בחר את המשתנה התלוי באזור ובחר מרכז כאזור.
- לחץ פעמיים במרכז ובחר אחת מהנקודות שנבחרו ובחר רק במרכז.
- לפני עזיבת החלון, עבור אל סטטיסטיקת ניסיון ובחר תדירות, משך מצטבר וההשארה ל- ראשון.
- הוסף את המרחק המשתנה התלוי מועבר.
הערה: בסטטיסטיקת קבוצה, בחר אם להשתמש בשגיאה הרגילה או סטיית התקן כשגיאה. עם פרופיל זה, הנתונים עבור הזמן שהושקע במרכז , ערכי מרכז והמרחק הכולל שהועבר זמינים.
- חלץ נתונים
- עבור אל תוצאות ובחר סטטיסטיקה ותרשימים.
- לחץ על חשב כדי לראות את הנתונים שנותחו.
הערה: סטטיסטיקת הניסיון מספקת מידע אודות כל סטטיסטיקה של עכבר וקבוצה מנתחת את ממוצע השגיאה עבור שתי הקבוצות, מחולק ל- 4 ניסויים עם התוויית העמוד המתאימה. - לחץ על יצא נתונים ובחר את סטטיסטיקת הניסיון ואת המיקום לשמירה.
הערה: הנתונים המיוצאים נשמרים כקובץ Excel ועם ערכים בודדים עבור כל עכבר. בקובץ Excel זה מזהה בעלי חיים מסייע לזהות את העכברים. - עבור אל פריט חזותי של מפת חום ולחץ על מפות חום של התוויית .
- בחר ניסויים מימין כדי לראות מפות חום בודדות עבור כל עכבר וניסיון.
- לעשות לחיצה ימנית על העכבר ולייצא מפות חום כמו תמונות.
- הגדר את הקבוצות והניסויים הניסיוניים בפרופיל הנתונים.
- התוויית
- פתח את קובץ הגיליון האלקטרוני במחשב וחשב את האמצעים ואת השגיאות הסטנדרטיות (SEM) עבור כל 4 הניסויים בכל תנאי וקבוצה שנמדדו.
- צור גרפים בתוכנית סטטיסטיקה (לדוגמה, התוויית סיגמא).
- העתק את האמצעים ואת SEM לסדר הנכון מקובץ הגיליון האלקטרוני להתוויה של סיגמא. השורות צריכים להכיל את הנתונים עבור Off1, On1 וכו ' והעמודות מכילות ניסיון, ממוצע ו- SEM כראשים.
- בחר את כל שלוש העמודות ולעבור אל צור גרף.
- בחר בתיבה סרגל שורת ובחר עמודות לא מקובץ עם שגיאה (שורה עליונה, תיבה שלישית).
- אשר עם סיום כדי לפתוח עמוד גרף חדש.
- תייג את הגרף כולו ולאחר מכן עבור אלבית , בחר את התיבה גרף מימין ולחץ על יצא. בחר תיקיית יעד ובחר MetaFile ( *.wmf) כתבנית.
הערה: ניתן לעבד את פורמט .wmf מאוחר יותר בתוכנה גרפית כמו CorelDraw.
- חשב סטטיסטיקה עבור נתונים שהושגו.
- העתק נתונים גולמיים מהגיליון האלקטרוני (Off1, On1 וכו') לעמודות בודדות של מגרש סיגמא.
- סמן את העמודות כדי להשוות ולעבור ניתוח, בחר t-מבחן ולחץ על הפעל.
- אשר את תבנית הנתונים Raw עם הבא והריץ את הבדיקה באמצעות סיום.
תוצאות
מטרת פרוטוקול זה היא למדוד שינויים בהתנהגותם של עכברים מהונדסים גנטית במהלך ניסוי אופטוגנטי. מניפולציה אופטוגנטית נעשית על ידי הזרקה של וקטור ויראלי הקשור אדנו. גירוי אור בעכברים הנעים בחופשיות אפשרי באמצעות השתלת סיבים בהירים ישירות מעל אזור העניין.
באות 4מוצגות תוצאות של ניסוי אופטוגנטי. הפעלה חזקה של נוירונים פירמידתיים מעוררים באזור IL באמצעות ChR2 התנהגות מוגברת הקשורים לחרדה בשדה הפתוח. ChR2 הוזרק באזור IL של mPFC בעכברים Nex-Cre לביטוי בנוירונים פירמידה (איור 4A). במהלך שתי בדיקות חרדה, השדה הפתוח (איור 4B,C)ומבחן האכלה מודחק חידוש(איור 4F,G),ChR2 מגורה באור כחול ומפעיל נוירונים פירמידה. כשליטה, קבוצה אחרת של עכברים קיבלה הזרקה של tdTomato פלואורופור במקום ChR2 (איור 4D,G). בניסוי כזה, חרדה מוגדרת כהימנעות מהאזור המרכזי הבהיר יותר. עכברים מראים הימנעות פנימית של שטחים פתוחים כי הם חרדים לטורפים.
בניסוי שדה פתוח, המוצג בדמות 4B , עכבריםביצעו 4 ניסויים של 5 דקות כל אחד. בניסויים 1 ו-3 לא התרחש גירוי אור (כבוי 1,2) ובניסויים 2 ו-4, בוצע גירוי אור כחול עם 20 הרץ (פעימה קלה של 5 מ"ר) ועוצמת 1 mW (On1,2). מפות החום מראות כי, בקבוצה ניסיונית, משך המרכז שונה בין ניסויים כבוי על. במהלך גירוי אור, עכברים מעדיפים להישאר באזור הגבול. בעלי השליטה מעדיפים גם את הגבול, אך אינם משנים את התנהגותם על גירוי קל. באות 4C, המדידות ההתנהגותיות העיקריות במהלך הניסוי בשטח פתוח מוצגות עבור הקבוצה הניסיונית. אם הנתונים עברו את מבחן שפירו-וילק לנורמליות, הסטטיסטיקה נעשתה עם מבחן T דו-זנבי עצמאי. אם בדיקת הנורמליות נכשלה, מבחן הסכום של מאן-וויטני שימש כחלופה לא פרמטרית. עבור סוגים אלה של ניסויים, השוואה קבוצתית בתוך נבחר לחקור אם גירוי אור יכול ישירות לשנות את התנהגות חרדה לאורך זמן, ללא קשר לחרדה הבסיסית של בעלי חיים ניסיוניים ולשלוט. משך המרכז ירד באופן משמעותי במהלך שני ניסויי גירוי אור, המציין רמות חרדה מוגברות. המרחק הכולל שהוזז לא השתנה, ומראה שהתנהגות הקטר לא הושפעה. מספר ערכי המרכז גדל, אם כי לא באופן משמעותי. ב איור 4D, הנתונים של קבוצת הבקרה מוצגים. בעלי השליטה לא הראו שינויים התנהגותיים כלשהם בין ניסויים כבויים ו-On באף אחד מהפרמטרים שנותחו, מה שמראה כי גירוי אור או השתלה לא גורמים להשפעות שנצפו. לסיכום, בדיקה זו מראה חרדה מוגברת במהלך גירוי אור של נוירונים פירמידה IL באמצעות ChR2.
באות 5, הנתונים של ניסוי אופטוגנטי כושל מוצגים עבור מבוך מוגבה פלוס. במהלך ניסוי המבוך המוגבה פלוס, המוצג בדמות 5A , עכברים השלימו6 ניסויים של 3 דקות כל אחד. בניסויים 1, 3 ו-5 לא בוצע גירוי אור (Off1, Off2, Off3) ובניסויים 2, 4 ו-6, גירוי אור כחול עם 20 הרץ (פעימה קלה של 5 מ"ס) ועוצמת 1 mW בוצע (On1, On2, On3). בתוצאות למופת אלה, אורך הפרוטוקול האופטוגנטי ובניית המבוך עצמו לא היו מתאימים לקו העכבר הטרנסגני. בדמות 5ב,ניתן לראות, כי כמה עכברים החליקו מהמבוך עם כפות רגליהם האחוריות או אפילו נפלו. כשזה קרה, עכברים קיבלו הזדמנות שנייה לבצע את ה-EPM יום אחד לאחר מכן. אם הם נפלו שוב, הם לא נכללו בניתוח. כאשר עכברים החליקו מספר פעמים אך הצליחו להישאר במבוך, הנתונים נותחו כרגיל. עם זאת, יש לפרש את הנתונים בזהירות רבה ולשלוט בבעלי חיים לקבל חשיבות רבה יותר. עכברי Nex-Cre התקשו להישאר בזרועות הפתוחות הצרות. כדי להימנע מכך, קירות קטנים, בגובה של 1 ס"מ, היו עוזרים לאחיזה מאובטחת של כפות הרגליים האחוריות על זרועות המבוך. הן מפות החום והן הגרפים מראים כי ניסיוני, כמו גם עכברי שליטה, התחיל להימנע זרועות פתוחות ממשפט 2 (On1) על(איור 5C-E). הזמן בזרועות הפתוחות פוחת באופן משמעותי עבור שתי הקבוצות, כמו גם ערכי הזרוע הפתוחה. ניתוח הקבוצה הניסיונית השיג רק נתונים המסבך אפקט נוגדנות גדול של גירוי האור, כמו הזמן על הזרוע הפתוחה וערכי זרוע פתוחה מופחתים באופן משמעותי במהלך המשפט On1. עם זאת, כאשר משווים נתונים אלה לקבוצת הביקורת, אשר מראים את אותה התנהגות, מתברר כי ההתנהגות שנצפתה אינה מתווכת על ידי הגירוי האופטוגנטי, אלא על ידי הימנעות של הזרועות הפתוחות באופן כללי בשל מגורים במבוך. נתונים אלה מדגישים את החשיבות של קבוצת בקרה מתאימה להבחין בין השפעות התנהגותיות בתיווך גירוי אופטוגנטי והסתגלות התנהגותית אפשרית. כמו כן, נתונים אלה שופכים אור על החשיבות של התאמה נכונה של התקנה ניסיונית כך שיתאימו לקו המוס הספציפי ולשאלה ניסיונית.
כדי לאמת ולחזק נתונים התנהגותיים שנאספו, מוחם של עכברים מוסר לאחר הניסוי האחרון כדי לשלוט על הזריקה וההשתלה הנכונות (איור 6). המוח קבוע ב-4% פארפורמלדהיד ומורחק מהגולגולת. המוח מיובש ב-30% סוכרוז במשך 1-2 ימים ומתייבש לאחר מכן. 40 μm עבה פרוסות המוח קורונאל נשטפים ומורכבים על שקופיות אובייקטיביות superfrost עם מדיום הרכבה המכיל DAPI, אשר מכתים גרעין התא. הדבר מאפשר זיהוי של אזורי יעד בפרוסות הקורונה. פלואורסצנס של תג YFP או tdTomato עצמו מציין את המיקום של הזרקת וירוס. ב איור 6B מוצגים אתרי הזרקה למופת של ChR2-YFP משמאל (צהוב) ו- tdTomato מימין (אדום). בעזרת תבנית, המותאמת לאתל המוח של Paxinosופרנקלין 45 עכבר, ניתן לזהות את אזור IL. בשתי השקופיות, הכלי optogenetic מבוטא באזור IL, אך גם באזורי מוח סמוכים. לפרשנות נכונה, התפשטות האור הכחול ברקמת המוח היא התייעצה8 (איור 1D,E). ניתן לראות כי האור הכחול יגיע לאזור DP מתחת IL עם רק פחות מ 5% של עוצמת האור הראשונית 1 mW בקצה הסיבים (קו כחול בדמות 1D)8. בנוסף, כמות קטנה של אור יכולה לעלות לאזור PrL בשל פיזור לאחור47. כתוצאה מכך ניתן לומר כי אזור IL מואר ביותר, עם זאת אזורים סמוכים כמו DP ואזור PrL עשוי גם להיות מגורה מעט. לכן, גירוי ספציפי IL-תא אינו מובטח וניתוח אימונוהיסטוכימי של האזורים הסמוכים יש לבצע, כדי לראות אם הפעילות של תאי PrL ו DP מאופנן באמצעות אור. באות 6Cמוצג פקד חשוב נוסף: הספציפיות של קו העכבר Nex-Cre. באמצעות כתמים נוגדנים נגד שני סוגי התאים באזור IL, נוירונים עקרון גלוטמטורגית ו interneurons GABAergic, ניתן לראות, כי הביטוי ChR2-YFP מתרחשת רק בתאי עצב גלוטמטורגיים ולא עם אלה GABAergic.
בסך הכל, הניסויים שלנו מראים כי עם מניפולציה אופטוגנטית במהלך בדיקות התנהגותיות, ניתן לצפות בשינויים בהתנהגות הקשורה לחרדה. על ידי שימוש ביותר ממבחן אחד עבור אותה התנהגות, ניתן להסיק מסקנה אמינה. בנוסף, ניתוח חיסוני מאשר את הנתונים שהושגו. הניסויים שלנו מראים, כי ההפעלה הספציפית של נוירונים פירמידה בקליפת המוח האינפרלימית הגדילה התנהגות הקשורה לחרדה בsaysays מסוימים.
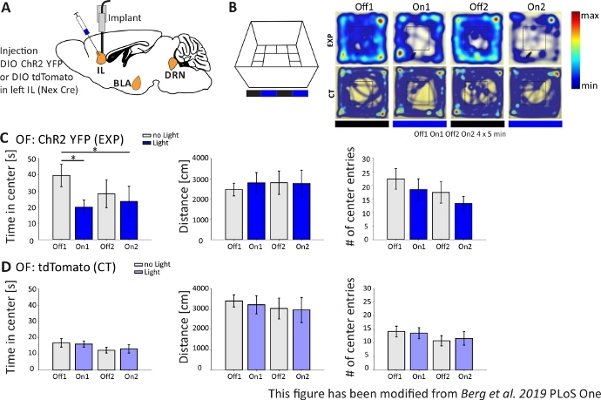
איור 4: הפעלה אופטוגנטית של תאי עצב פירמידה IL מגבירה את התנהגות החרדה. גירוי אור במהלך ניסויים: 473 נה"מ, 1 mW, 20 הרץ גירוי. A) ציור סכמטי של אתר הזרקה והשתלה עבור ChR2-YFP או tdTomato לתוך IL. במהלך הניסוי, נוירונים פירמידה באזור IL של mPFC מופעלים על ידי ChR2. פרוסות מוח Saggital הותאמו מן האטלס המוח Paxinos ו פרנקלין עכבר, saggital: לחוץ o,6. B) מבוך שדה פתוח עם פרוטוקול גירוי אור (20 דקות עם 4x5 דקות לסירוגין כבוי ועל ניסויים; שמאל) ומפות חום של המופת ChR2 מוזרק (EXP) ו tdTomato מוזרק (CT) עכברים בכל 4 ניסויים של הניסוי (מימין). בעלי חיים EXP לבלות פחות זמן במרכז OF כאשר מגורה עם אור לייזר כחול. עבור בעלי חיים CT, הזמן בילה במרכז אינו שונה בין אור כבוי על ניסויים. C) קבץ נתונים עבור בעלי חיים EXP ב- OF, n = 11. עכברים מבלים באופן משמעותי פחות זמן במרכז OF כאשר מגורה עם אור כחול (Off1 39.49±6.9 s, ב-1 19.87±4.47 שניות, Off2 28.13±8.55 שניות, On2 23.42±9.32 שניות, Off1:On1, t-test, p = 0.033, *; כבוי1:On2, MWRS, p = 0,049, *). המרחק אינו מושפע (Off1 2703.09±292.65 ס"מ, On1 3113.4±491.15 ס"מ, Off2 3331.86 ±482.62 ס"מ, On2 3082.17±658,61 ס"מ). # של ערכי מרכז להקטין עם הזמן, אבל לא להראות הבדלים משמעותיים (כבוי 1 22.36±3.78, On1 18.45±3.95, Off2 17.36±1.99, On2 13.27±2.64). D) קיבצה נתונים עבור בעלי חיים CT ב- OF, n = 15. עכברים מבלים זמן במרכז ה-OF, המרחק עבר, # של ערכי מרכז אינו משתנה בין ניסויים אור און וחוץ (זמן במרכז Off116.73±2.65 s, On1 16.02±1.89 s, Off2 12.02±1.76 s, On2 13.04±2.58 s; מרחק 1 3399.69±296.77 ס"מ, On1 3210.6±446.9 ס"מ, Off2 3030.28±513.83 ס"מ, On2 2955±617.7 ס"מ; # של ערכי מרכז Off1 14.2±1.98, On1 13.6±2.02, Off2 10.8±1.88, On2 11.67±2.5). עכברי CT מראים חרדה בסיסית גבוהה משמעותית (Off1 EXP:CT, MWRS, p = 0.005, **). ערכים הם ממוצעים±S.E.M. * מצביעים על הבדלים משמעותיים (p≤0.05), ** מצביעים על הבדלים משמעותיים (p≤0.01). t-מבחן תמיד דו-זנב, MWRS: מאן-ויטני דירוג סכום מבחן; IL: קליפת המוח האינפרה-לימבית; אמיגדלה באסולטרל; גרעין ראף גב; OF: שדה פתוח; CT: שליטה בבעלי חיים; EXP: בעלי חיים ניסיוניים; ל: אור. נתון זה שונה מברג ואח' 2019, PLoS One43 ומברג 201948. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
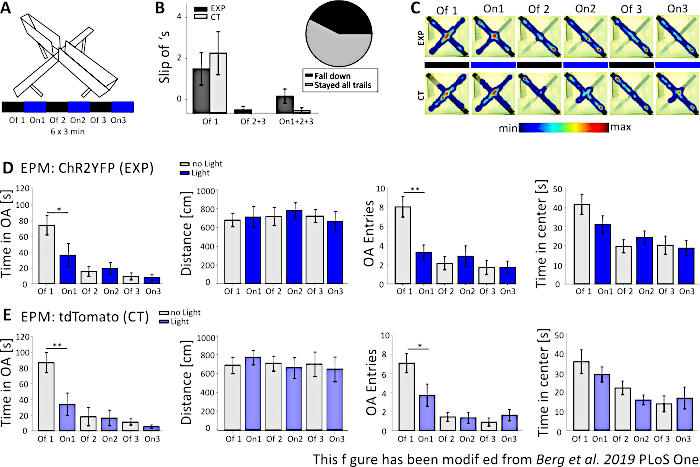
איור 5: ניסוי EPM נכשל בהתראות השפעות התנהגותיות בעכברים של Nex-Cre. גירוי אור במהלך ניסויים: 473 נה"מ, 1 mW, 20 הרץ גירוי. A) מבוך מוגבה פלוס עם פרוטוקול גירוי אור (18 דקות, 6x3 דקות, לסירוגין כבוי ועל ניסויים). ב)קיבוץ נתונים עבור העכברים ש"מחליקים" כלולים בנתונים, בסך הכל n=23. לעכברי Nex-Cre הייתה נטייה לחמוק מהזרוע הפתוחה עם כפות רגליהם האחוריות, ללא תלות בקבוצה הניסיונית (משמאל). רק עכברים שנשארו במבוך במשך כל 6 הניסויים נשקלו בניתוחים מאוחרים יותר. Slip off-s בשלב Off1 הראשון הם סיבה מאוחר יותר הימנעות של הזרועות הפתוחות (Off1 EXP 1.63±0.6, CT 2.2±0.79, Off2+3 EXP 0.125±0.125, CT 0±0, On1+2+3 EXP 0.625±0.26, CT 0.1±0.1). תרשים עוגה (מימין) מראה עכברים נופלים מהמבוך במהלך 18 דקות עם 42.42%. רק 57.57% סיימו את הניסוי. C) מפות חום של עכברי EXP ו-CT למופת בכל 6 הניסויים של הניסוי. שתי הקבוצות מציגות ירידה במשך הזרוע הפתוחה לאחר הניסיון של Off1. D) קבץ נתונים עבור בעלי חיים EXP ב- EPM, n = 12. הזמן שהושקע בזרועות הפתוחות ירד באופן משמעותי במהלך שני הניסויים הראשונים ובאופן קבוע לאחר מכן (Off1 73.91±12.22 s, On1 36.15±14.65 s, Off2 15.61±6.23 s, On2 19.49±7.51 s, Off3 9.36±4.44 s, On3 7.96±3.47 s. Off1:On1, t-test, p=0,041, *). המרחק שהועבר אינו מושפע (Off1 679.96±71.63 ס"מ, On1 712.24±112.82 ס"מ, 717.49±97.39 ס"מ, On2 782.51±81.11 ס"מ, 722.11±68.60 ס"מ, On3 663.90±106.57 ס"מ). כמות ערכי הזרוע הפתוחה יורדת באופן משמעותי מ- Off1 ל- On1 ולאחר מכן נשארת קבועה (Off1 8.08±1.08, On1 3.33±0.76, Off2 2.16±0.69, On2 2.91±1.09, Off3 1.73±0.75, On3 1.73±0.66. Off1:On1, t-מבחן, p = 0.002, **). הזמן שהושקע במרכז ה-EPM פוחת לאורך ניסויים אך אינו מראה הבדל משמעותי בין Off ל- On Trial (Off1 41.71±5.34 s, ב-1 31.2±4.59 שניות, 19.8±3.44 שניות, ב-24.49±3.38 ש', ב-20.37±4.77 שניות, ב-3 18.85±4.07 שניות). E) קבץ נתונים עבור בעלי CT ב- EPM, n= 11. נתוני CT מראים את אותן ירידות משמעותיות כמו נתוני EXP, המציין שהניסוי לא עבד כראוי (זמן בזרועות פתוחות Off1 86.92±12.74 s, On1 33.78±14.38 s, Off2 18.01±11.61 s, On2 16.41±9.61 s, Off3 11.36±4.01 s, On3 5.43±2.07 s. Off1:On1, MWRS, p =0.009, **; מרחק 1 705.11±88.36 ס"מ, On1 789.45±77.53 ס"מ, Off2 724.74±80.49 ס"מ, On2 676.57±111.99 ס"מ, Off3 716.99±132.47 ס"מ, On3 663.03±132.46 ס"מ; פתוח זרוע ערכים Off1 7.09±1, On1 3.72±1.17, Off2 1.45±0.47, On2 1.36±0.58, Off3 0.91±0.43, Off3 1.64±0.59. כבוי1:On1, MWRS, p = 0.01, *; זמן לבלות במרכז Off1 35.89 s, ב-1 29.25±3.96 שניות, 22.17±3.58 שניות, ב-15.9±2.57 שניות, ב-13.86±4.2 שניות, ב-3 16.89±5.75 שניות). ערכים הם ± S.E.M. * מצביעים על הבדלים משמעותיים (p≤0.05), ** מצביעים על הבדלים משמעותיים (p≤0.01). t-מבחן הוא תמיד שני זנבות, MWRS: מאן-ויטני דירוג סכום מבחן; EPM: מבוך מוגבה פלוס; CT: שליטה בבעלי חיים; EXP: בעלי חיים ניסיוניים; זרועות פתוחות. נתון זה שונה מברג ואח' 2019, PLoS One43 ומברג 201948. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
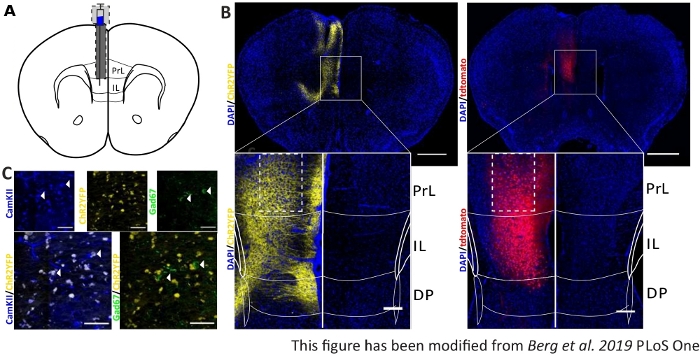
איור 6: צד הזרקה של ChR2 ו- tdTomato בפרטיות IL ו- Nex-Cre. A) ציור סכמטי של אתר ההשתלה על פרוסות מוח קורונליות ב AP + 1.66 מ"מ, מ"ל 0.3 מ"מ, DV -1.8 מ"מ, עם הזרקה והשתלה חד-צדדית (הותאם מאטלס מוח העכבר, Paxinos ופרנקלין, Bregma +1.54 מ"מ). ב) אתרי הזרקה למופת של ChR2-YFP (שמאל, צהוב) ו- tdTomato (מימין, אדום) התמזגו עם גרעין תא מוכתם DAPI (כחול) בעכברים Nex-Cre. סרגל קנה מידה 1 מ"מ. Insets להראות הגדלה גבוהה של אזור IL. סרגל קנה מידה 150 μm. תיבות לבנות מציינות את המיקום של insets. ג) שורה למעלה: תמונות קונפוקליות של אזור IL השמאלי של עכבר Nex-Cre מוכתם CamKII כסמן עבור נוירונים גלוטמטורגיים (כחול), ו ChR2-YFP (צהוב) או Gad67 כסמן לנוירונים GABAergic (ירוק), של עכבר Nex-Cre. שורה התחתונה: colocalization של ChR2-YFP (צהוב) עם CamKII (שמאל, כחול), אבל לא עם Gad67 (ימין, ירוק), מראה ספציפיות של עכברי Nex-Cre עבור נוירונים גלוטמטורגיים. סרגל קנה מידה 50 μm. PrL: קליפת המוח המוקדמת; IL: קליפת המוח האינפרה-לימבית; DP: קליפת המוח פדונקולר גב. נתון זה שונה מברג ואח' 2019, PLoS One43 ומברג 201948. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
Discussion
שימוש באור כדי לתמרן איתות עצבי היה שיטת הבחירה במשך כמעט עשור. מאז 2005, מספר המאמרים שפורסמו על פיתוח כלים אופטוגנטייםחדשים 4, 6,8,14,14,49,50,51, מחקרים שבהם כלים כאלהמנוצלים כדי לחקור מעגלים במוח 21,23,40,43,52, גדל מאוד., מצד אחד, עם המגוון העצום של כלים אופטוגנטיים להזרקה, משתני השתלה, קווי עכבר טרנסגניים וניסויים התנהגותיים, האפשרות לניסויים היא סעפת ובלתי מוגבלת. מצד שני, האפשרות לבצע תקלות בבחירת תנאים ניסיוניים היא גבוהה מאוד והניסויים כל כך ספציפיים, שלעתים קרובות ההשוואה ללימודים אחרים היא קשה.
שלבים קריטיים
אחד הצעדים הקריטיים החשובים בפרוטוקול זה הוא תכנון נכון. הבחירה בכלי האופטוגנטי צריכה להתאים את השאלה המדעית. האם זה רק הכרחי כדי לתמרן את הפעילות הכוללת של נוירון או סינפסה? אז כלים מסחריים כמו ChR221,25,,27 ו קשת37 הם בחירה טובה. אבל חוץ מזה, אם מערכת נוירוטרנסמיטר אחת מיוחדת או אפילו קולטן יחיד צריך להיות מניפולציה, כימרה קולטן בודד הוא לעתים קרובות הבחירה הטובהיותר 3,,6. כמה כימרות קולטן עם GPCRs, מה שנקרא Opto-XRs, והנחיות לייצר אותם כברזמינים 4,50. מלבד הבחירה של כלים אופטוגנטיים, קו העכבר בשילוב עם הניסוי ההתנהגותי הוא גם קריטי. זנים שונים של רקע, כמו למשל C57Bl/6 ו-BALB/cByJ, מציגים פנוטיפים התנהגותיים שונים בכמהפעמים 53,54. עכברים C57Bl/6 יש חרדה בסיסית נמוכה והוא יכול לשמש למניפולציה anxiogenic, בעוד BALB / cByJ להראות רמות חרדה גבוהות יותר ולכן רגישים יותר תרופות חרדה. בנוסף, הגרסאות הטרנסגנית של זנים אלה רקע עשויים להשתנות גם פנוטיפשלהם 48. עם שילוב נכון של יזמים ספציפיים בשילוב עם כלי אופטוגנטי וקו עכבר טרנסגני, כמעט כל אוכלוסיית תאים רצויה יכולה להיות ממוקדת.
צעד קריטי במהלך הניתוח הוא מיקוד המיקום הנכון. בעזרת אטלס מוח העכבר, ניתן לקבעו קואורדינטות מתאימות לציר הקדמי-אחורי, וציר רוחב-ממדי, ועומק המבנהניתן להתבסס 45. במציאות, לכל גולגולת יש צורה וגודל מעט שונים. לכן, F-factor46 כדי להתאים את הקואורדינטות הסטריאוטיפיות הוא די חשוב, כמו גם קיבעון האף והאוזן הנכון במהלך ניתוח סטריאוטיפי. אם ראש העכבר מוטה, ההזרקה canula לא יצליח למקד את האזור הרצוי של עניין.
בנוסף, הקוטר של canula הזרקה הוא גם קריטי. אם הוא קטן מדי, לא ניתן להשתחרר וירוס לתוך הרקמה, אם הוא רחב מדי, הנוולה תדליף פתרון וירוס בדרכו לאזור של עניין. אם הסיב האופטי המושתל מסתיים ישירות מעל אזור היעד, ביטוי הווירוס באזורי קליפת המוח לעיל אינו משנה. אבל אם השתל ממוקם מעל אזורים אחרים כדי לעורר מסופי axon, האקסונים של אזורי קליפת המוח העליונה יופעלו גם על ידי אור ולזיוף נתונים שהושגו. כדוגמה: אזור IL ואזור prelimbic (PrL) שניהם פרויקט אמיגדלהבסיס 55,56 אבליש פונקציות ותפקידים שונים לחלוטין אפנון שלחרדה 26,57. אם השתל ממוקם מעל האמיגדלה כדי להפעיל מסופי axon מאזור IL, ובמהלך פתרון וירוס ההזרקה גם הוכנס לתוך PrL בשל ההזרקה הלא נכונה canula, הסיכון של הפעלת מסופי axon מ PrL הוא גבוה מאוד.
במהלך הכנת הגולגולת עבור קיבעון השתל, השימוש ה דליל של פריימר וקשר הוא קריטי עבור קיבעון אמין ועמיד. אם מערכת ההדבקה של שני רכיבים אינה מיושמת דק, המלט הדנטלי עשוי להתנתק מהגולגולת לאחר כמה ימים או שבועות. בנוסף, הגולגולת גם צריכה להיות מיובשת לחלוטין לפני תיקון השתל, כמו אחרת המלט לא יהיה מחובר כראוי לגולגולת.
שלבים קריטיים קיימים גם בחלק ההתנהגותי של פרוטוקול זה. ראשית, בניית המבוך חשובה מאוד. בכל הגדרה התנהגותית קיימות מספר גרסאות בספרות לגבי גודל וצורה, כמו גם עבור ההליך עצמו58,59,60. חשוב לבחור משתנה שהופך את הנתונים לדומים ותו לא. כמו כן, יש לקחת בחשבון דרישות מיוחדות עבור קווי עכבר מנוצלים43,48. בנתונים המייצגים של ה-EPM ניתן לראות כי מספר עכברי Nex-Cre נפלו מהמבוך או החליקו מספרפעמים (איור 2b). עבור עכברים אלה, מבוך עם קיר קטן סביב הזרועות הפתוחות היה יכול להיות אלטרנטיבה טובה יותר.
שנית, זה קריטי לשמור על כל תנאי החדר החיצוני קבוע61, אחרת קבוצות שונות של עכברים לא יהיה דומה בכלל. בהקשר זה, חשוב מאוד לבחור את זמן הניסוי ככזה שבו ההתקנה הניסיונית ריקה והתנסה תמיד נוכח. כמו כן, יש לשקול אירועים בבניין, כגון עבודות בנייה, בדיקת מערכות כלשהן (אזעקת אש) או יום הניקיון של מתקן העכבר, על מנת למנוע הפרעה לנתונים שהושגו.
לבסוף, תנאי הטיפול והדיור הם קריטיים לניסויים התנהגותיים. כאשר מתבצעת השתלה, עכברים צריכים להיות בודדים בשל הסיכון לפציעה מעכברים אחרים. כדי להבטיח השוואה טובה בין קבוצות ושגייה נמוכה בתוך קבוצה אחת, כל עכבר צריך להיות באותו גודל כלוב והעשרה. עבור ניסויים הקשורים לחרדה, דיור יחיד יש כמה יתרונות כמו עכברים זכרים מסינג שוכנו להראות רמת חרדה בסיסית נמוכה יותר, פחות וריאציה ברמת החרדה שלהם, ופחותכמו דיכאון סימפטומים 15,16. עכברים זכרים הקבוצה מאוססנים עשויים להיות שונים מאוד ברמת החרדה שלהם בגלל היררכיה בקרב העכברים. מלבד הדיור, טיפול קבוע ושווה של כל העכברים והקבוצות חשוב גם כן. לתפוס את העכבר כדי לחבר את הסיבים הקלים על השתל הוא מאוד מלחיץ. לכן, הליך זה חייב להיות זהה עבור כל עכבר, כלומר אותה טכניקה ואותו ניסוי. יתר על כן, זמן המגורים בכלוב ההמתנה, שאמור להרגיע את העכבר מהליך החיבור המלחיץ, צריך גם תנאים שווים לאורך זמן, המלטה ומיקום למבוך. הטיפול במתקן העכבר הוא גם קריטי לביצועים התנהגותיים מאוחרים יותר. בעלי חיים ניסיוניים ובקרה לא צריך להיות ניקה בימים שונים או על ידי אנשים שונים, כמו זה גם מלחיץ עבור עכברים. בנוסף, יום הניקוי לא צריך להיות היום הניסיוני כדי למנוע הבדלים בהתנהגות.
פתרון בעיות
קיימות מספר בעיות שעלולות להתרחש במהלך הפרוטוקול. לדוגמה, קידוח שלם בגולגולת במהלך הניתוח הסטריאוטיפי עלול לפגוע בכלי הדם. בדרך כלל, דימום חזק מתרחש, במיוחד מעל bregma ו lambda. אם זה קורה, לא לנסות לעצור את הדימום עם מקלות כותנה כפי שהם נוטים להאריך עוד יותר דימום מתוך הכלי בגלל הספיגה שלהם, במקום, ישירות לשטוף עם NaCl.
זה גם יכול לקרות כי הזרקת הלחץ של פתרון הווירוס לא עובד. במקרה הזה, זה יכול להיות שparafilm, גלד מחור בר או רקמת המוח, הוא סותם את קצה הנוולה. במקרה זה, להסיר את הנוולה לאט מתוך המוח מבלי לשנות את x- או y-ציר ולהשתמש פינצטה כדי להסיר 1-2 מ"מ של החלק הקדמי של קצה canula. לפני הורדת הנולה שוב, בדוק פונקציונליות על ידי החלת כמות קטנה של לחץ כדי לראות אם וירוס יוצא מהקצה canula. כדי למנוע עצירות, הנמיכו את הנולה במהירות קבועה ואל תעצרו את התנועה עד שהעומק העמוק ביותר של צד ההזרקה מגיע. אם יותר מדי קצה הנולה מוסר הקוטר גדול מדי, הנוולה תפגוע ברקמה והסיכון להחלת הנגיף בבת אחת יגדל. לכן, ודא כי רק החלק הסתום של הקצה מוסר בזהירות.
במהלך הניסוי ההתנהגותי, ההתקנה של הניסוי בתוכנה למעקב וידאו (לדוגמה, אתויז'ן XT) עלולה לגרום לבעיות. אם, לדוגמה, תפוקת האור אינה פועלת כראוי, הדבר עשוי לכך מכמה סיבות. יש לפתוח, לתכנת ולהתחיל לפני פתיחת אתויז'ן XT. יש לבחור את החומרה כראוי ב"התקנה ניסיונית" (שלב 3.2.2.4). אם תיבת ה- IO הלא נכונה, או כל דבר אחר מלבד "חומרת תלבושות" נבחרה, לא ניתן לשלוט בהתקן Pulser על-ידי Ethovision. אם הבדיקה של פלט האור מצליחה, אך פרוטוקול האור המתוכנת ב"הגדרות בקרת ניסיון" אינו פועל במהלך הרכישה, ייתכן שההפניה לכלל המשנה או לכלל המשנה ממוקמת באופן שגוי או שהתנאים והפעולות אינם ברורים. לדוגמה: האם ההפניה שייכת לכלל המשנה הנכון? האם ההפניה מתוכנתת כראוי (לדוגמה, באיזו תדירות מבוצע כלל המשנה)?
בנוסף, ייתכן שבמהלך "הגדרות זיהוי" החיה נמצאת במעקב הולם, אך במהלך הרכישה קיימות דגימות שבהן הנושא לא נמצא. במקרה זה, בדוק אם התאורה בחדר הניסויים שונתה, או אם משהו יצר צללים לא רצויים בתוך המבוך. לתחתית כולה של המבוך חייב להיות באותו צבע, מכיוון שההגדרה תיעבוד רק עבור שילוב ספציפי אחד. אם מסיבה כלשהי לא ניתן להימנע מצבעים תחתונים או צללים שונים, הגדר את הגדרת הזיהוי בחלק האפל ביותר של המבוך.
כדי לשנות הגדרות כלשהן לאחר רכישת בעלי החיים הראשונים, אל תחיל שינויים אלה בהגדרות שכבר נעשה בהן שימוש. שכפל אותם כדי להתאים אותם. משמעות הדבר היא גם כי הניסיון שכבר נרשם אינו חוקי עוד עבור ניתוח נתונים. במקרה כזה, להקליט את כל בעלי החיים עבור קבוצה ניסיונית זו עם ההגדרות המקוריות, וליצור ניסוי חדש לאחר מכן שבו קטעי וידאו מוקלטים מנותחים במקום מעקב חי. בניסוי זה "מתוך וידאו", ניתן להשתמש במספר הגדרות לניתוח מבלי לאבד את ההשוואה בין בעלי חיים או אפילו נתונים.
מגבלות ויישומים עתידיים
שיטה זו של מניפולציה התנהגות עם optogenetics בבעלי חיים נעים בחופשיות כוללת גם מגבלות. במהלך הניתוח, הקרבה של שני השתלים מוגבלת. עבור השתלה כפולה, המרחק בין שני השתלים חייב להיות מינימלי ברוחב של ההתל כדי להחזיק את השתל. התקן צריך להוריד את השתל השני לתוך חור הבור, בעוד השתלים הראשונים כבר קבועים. פתרון לכך עשוי להיות השתלה זוויתית, שבה קצות סיבי הזכוכית יכולים להיות קרובים מאוד בעוד שלפרולות הקרמיקה שמעלהגולגולת יש מרחק גדול יותר 23,,55,,56,,57,,62,,63. חיסרון של השתלה זוויתית הוא האור מתפשט. כאשר קצה הסיבים משוליוים במקום ישר מלמעלה, האזור המגורה שונה. במקרה של שני אזורי יעד בקרבת מקום, יש לקחת בחשבון את המיקום ההתנוי של גירוי האור.
במהלך הניסוי ההתנהגותי, בניית המבוך עלולה להפריע לכבלים האופטיים המחוברים לחיה. בדיקות התנהגות מסוימות, כגון התיבה כהה-בהירה, מכילותאזור מקורה 64,65, מבוכים אחרים מכילים תאים שהעכבר צריך להיכנס אליהם. אין אפשרות לבצע ניסויים כאלה עם התקנה זו. לחלופין, מערכת אלחוטית עשויה להיותאפשרות 22,26,66. אבל למרבה המזל כמה מבוכים, כגון מבוך בארנס, ניתן לארגן באופן כזה, כי העכברים מסוגלים להיכנס לתאים הרלוונטיים67.
מלבד אלה עם אזורים סגורים, מבוכים רחבים מדי יכולים לגרום גם לבעיות. ככל שהתחום במבוך גדול יותר, כך הכבל צריך להיות ארוך יותר כדי לאפשר לחיה להגיע לכל תנוחה במבוך. יש לנקוט בתשומת לב כי בעל החיים אינו מסוגל לדרוך על הכבל או לתפוס אותו ולנשוך אותו. פתרון לכך עשוי להיות בנייה שמגלגלת את הכבל המיותר. חיסרון הוא כי לגרור כדי לגלגל את הכבל קשה עבור עכברים. פתרון זה יתאים יותר לחולדות. אפשרות אפשרית נוספת יכולה להיות לעשות את גירוי האור מראש, במקום במהלך הניסוי, כמובן שזה אפשרי רק אם השפעה לטווח ארוך בשל גירוי האורמתרחשת 23.
השוואה לשיטות קיימות/חלופיות
שיטות חלופיות יהיו גירוי כימי או חשמלי במהלך התנהגות8,,18. אגוניסטים כימיים או אנטגוניסטים מסוגלים להפעיל או להשתיק נוירונים באמצעות קולטנים ספציפיים יכולים גם לתמרן מערכות נוירוטרנסמיטריחיד 38,68. מצד אחד, ספציפיות קולטן הוא די גבוה עבור כימיקלים, כי אגוניסט ספציפי או אנטגוניסט להפעיל רק קולטנים מסוימים39. מצד שני, את ה הספציפיות עבור סוגי משנה קולטן של אותה קבוצת מוליך עצבי הוא לעתים קרובות לא מספיק. רוב הכימיקלים נקשרים לפחות לשני סוגי משנה עם הסתברויותשונות 69. בנוסף, כימיקלים לא יכולים להבחין בין סוגי תאים עצביים כל עוד יש להם את אותם סוגי קולטן. מעבר לכך, רזולוציה זמנית ומרחבית היא גרועה עבור מניפולציות כימיות בהשוואה optogenetics. אגוניסטים או אנטגוניסטים מנוהלים לעתים קרובותדרך דרך דרך דרך 35 אובאמצעות זריקות מערכתיות 57,70. אם האינפוזיה של הכימיקל נעשית ישירות ברקמת המוח, ההשפעות מופיעות מהר יותר מאשר עם יישומים אוראליים, אבל עדיין על ציר זמן איטי יותר מאשר עם גירוי אור. כמו הכימיקלים המנוהלים מפוזרים במוח והם אינם ספציפיים עבור סוגים עצביים או אזורים במוח, מניפולציה של מעגלים מוחיים ספציפיים זה לא אפשרי.
לגירוי חשמלי יש רזולוציה זמנית גבוהה יותר מאשר גירוי כימי9,,14. ההתפשטות בתוך רקמה עצבית היא פחות עם גירוי כימי ואת הרזולוציה המרחבית היא טובה יותר מאשר עם גירוי כימי. עם זאת, גירוי חשמלי חסר את האפשרות לטפל באופן ספציפי סוגי תאים עצביים שונים או סוגי קולטן, כמו כל נוירון בסמיכות אלקטרודה יגיב לגירוי חשמלי.
שיטות חלופיות להתנהגות בעכברים נעים בחופשיות הן למשל הקלטות אלקטרופיזיולוגיות בפרוסות מוח, שבו נוירונים בודדים או אקסונים ניתן לאפנן עם optogenetics ואפקטים מעוררים ניתן למדוד באמצעות אלקטרודותהקלטה 6,71. בניסויים מבחנה מציעים את האפשרות לחקור את הבסיס המולקולרי והסלולרי של גירויים אופטוגנטיים, אבל יש את המגבלה כי קישוריות פנימית וקלט מאזורים אחרים במוח חסר. אפשרות נוספת היא להשתמש optogenetic בשילוב עם הדמיה multiphoton1,72. במקרה זה, עכברים יש את הראש שלהם קבוע והוא יכול להיות מנומס או להיות ער כדי לפתור משימות פשוטות.
כדי לבצע ניסוי אופטוגנטי מוצלח, מגוון רחב של כלים ויישומים זמינים כיום. הבחירה בכלים אופטוגנטיים והגדרה התנהגותית היא קריטית כדי לענות על שאלות מחקר ספציפיות. אם נבחר השילוב הנכון של כלים וניסויים, optogenetics מאפשר חקירה חסרת תקדים, מעמיקה של מעגלים עצביים עם רזולוציה זמנית ומרחבית גבוהה. זה יעזור להבין ולפתח אסטרטגיות טיפוליות חדשות למחלות פסיכיאטריות וקוגניציה.
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
תודה רבה לפרופ' קלאוס-ארמין נרב וד"ר סנדרה גבלס (מקס-פלאנק-מכון לרפואה ניסיונית, גטינגן, גרמניה) על שסיפקו בחביבות עכברי Nex-Cre. כמו כן, אנו מודים לצוות הווידאו שלנו יונוס Dikici ורובן Wiesner על הקלטה ועיבוד של וידאו JoVE עבור מאמר זה. בנוסף, תודה רבה לקריסטין קלוסן על קריינותה וקימברלי אן גו על הגהה של כתב היד.
התוצאות שהוצגו התקבלו באוניברסיטת רוהר בבוכום והווידאו הוקלט באוניברסיטת ברמן.
עבודה זו מומנה על ידי דויטשה Forschungsgemeinschaft (DFG, קרן המחקר הגרמנית) - Projektnummer 122679504 - SFB 874 ו DFG MA 4692/3-2.
Materials
| Name | Company | Catalog Number | Comments |
| Ketamin | Sigma-Aldrich | K2753-64 | Anestasia |
| 20 % Glucose | AlleMan Pharma | Injection s.c. for fast recovery | |
| Behavioral mazes | Costum made | Measure anxiety | |
| Bepanthen | Bayer | Ophthalmic oinment | |
| Betaisodona | Monodipharma | Sterilant containing iodine | |
| Betaisodona | Monodipharma | Iodine oinment | |
| Binocular | Olympus | SZ52, 110AL0.62x WD160 | Surgery |
| Ceramic ferrules | Thorlabs | CFLC230-10 | Implant |
| Ceramic Fiber Scribe | Thorlabs | CSW12.5 | Cutting of the glass fiber |
| Channelrhodopsin2-YFP virus | Penn Vector Core | Addgene 20298 | Optogenetic tool |
| Compressed air | Kontakt Chemie | Druckluft 67 | Drying of the skull |
| Coordinate system | Stoelting | Stereotactic coordinates for the surgery | |
| Correl Draw | Graphical software version 13 | ||
| Cryoslicer | MICROM | HM500OM | Production of brain slices for staining |
| Ethovision XT 14 | Noldus | Software for behavioral tracking | |
| Exel | Statistical Software | ||
| Ferrule Polishing Puck | Thorlabs | D50-F | Polishing implants round side |
| Fiber Patch Cord dual | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cables, which are connected with the two implants of a bilateral implantation |
| Fiber Patch Cord single | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cable, which is connected with the implant via a sleeve |
| Fiber Stripping Tool | Thorlabs | T06S13 | Stripping glass fiber for implant |
| Filter paper | VWR European | 516-0300 | Cut into pieces for the Novelty-Suppressed Feeding test |
| Food pellets | Mühle Levers | Höveler Nagerfutter | Nutrition for the mice |
| Glass pipettes | Harvard Apparatus | GC150-10 | Injection pipettes |
| Gradia direct-Flo | Henry Schein | 103322 | Fluid dental cementum |
| Heating lamp | efbe-Schott/Phillips | R95E | Prevent the mice from cooling after the surgery |
| Heating plate | Stoelting | Integrated into coordinate system | |
| Injection canula | Braun | 100 Sterican, 0,4 x 20 mm, Gr. 20 | All injections and to bore hole into the skull |
| Litter | T 1350 | Grounding for the Novelty-Supressed Feeding test | |
| Mouse cages | Zoonlab | 405 cm^2 | Single housing for experiments |
| Optibond FL | Kerr | 26684E | Preparation of the skull for implantation |
| Optical glass fiber | Thorlabs | FT200EMT | Light fiber for implant |
| Optogenetics-LED.STSI | Prizmatix | Optogenetic toolbox for light stimulation during behavioral experiments | |
| Paraformaldehyde | Sigma-Aldrich | 16005-1KG-R | Perfusion of mice to remove the brains |
| Polishing sheet 0.02 µm grit | Thorlabs | LFCF | Polishing implants round side |
| Polishing sheet 1 µm grit | Thorlabs | LF1D | Polishing implants round side |
| Polishing sheet 30 µm grit | Thorlabs | LF30D | Polishing implants round side |
| Polishing sheet 6 µm grit | Thorlabs | LF6D | Polishing implants round side |
| Pulser Software | Prizmatix | Software for light device control | |
| Rimadyl-Carprofen | Zoetis | Analgesia | |
| Sigma Plot | Software for statistics | ||
| Sleeve | Thorlabs | FT200EMT | Connection of implant and light cable |
| SodiumCloride (NaCl) | Braun | 3570410 | Rinsing of the skull |
| Superglue | Pattex Henkel | To Fix the glass fiber in the ferrule | |
| td-Tomato virus | Penn Vector Core | Addgene 51503 | Optogenetic tool |
| UV light | KoQGHJ | wireless, 1200 mW/cm^2 | Polymeration lamp for dental cementum |
| Xylavet-Xylazin | cp pharma | Anesthesia |
References
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature Letters. 463, 98-102 (2010).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Spoida, K., Masseck, O. A., Deneris, E. S., Herlitze, S. Gq/5-HT2c receptor signals activate a local GABAergic inhibitory feedback circuit to modulate serotonergic firing and anxiety in mice. Proceedings of the National Academy of Science of the United States of America. 111, 6479-6484 (2014).
- Kleinlogel, S. Optogenetic user's guide to Opto-GPCRs modified GPCRs. Frontiers in Bioscience. 21, 794-805 (2016).
- Mahn, M., Prigge, M., Ron, S., Levy, R., Yizhar, O. Biophysical constraints of optogenetic inhibition at presynaptic terminals. Nature Neuroscience. 19, 554-556 (2016).
- Masseck, O. A., et al. Vertebrate Cone Opsins Enable Sustained and Highly Sensitive Rapid Control of Gi/o Signaling in Anxiety Circuitry. Neuron. 81, 1263-1273 (2014).
- Oh, E., Maejima, T., Liu, C., Deneris, E., Herlitze, S. Substitution of 5-HT 1A Receptor signaling by a light-activated G protein-coupled receptor. Journal of Biological Chemistry. 285, 30825-30836 (2010).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in Neural Systems. Neuron Primer. 71, 9-34 (2011).
- Masseck, O. A., Manahan-Vaughan, D. A Guide to Optogenetic Applications, With special Focus on Behavioral and In Vivo Electrophysiological Experiments. HandboOk of In Vivo Neural Plasticity Techniques - A Systems Neuroscheince Approach to the Neural Basis of Memory and Cognition. , 557 (2019).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. , 611-621 (2006).
- Yang, Y. S., Hughes, T. E. Cre Stoplight: A red/green fluorescent reporter of Cre recombinase expression in living cells. Biotechniques. 31, 1036-1041 (2001).
- Schnütgen, F., et al. A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse. Nature Biotechnology. 21, 562-565 (2003).
- Taniguchi, H., et al. A Resource of Cre Driver Lines for Genetic Targeting of GABAergic Neurons in Cerebral Cortex. Neuron. 71, 995-1013 (2011).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 268-273 (2011).
- Palanza, P., Gioiosa, L., Parmigiani, S. Social stress in mice: Gender differences and effects of estrous cycle and social dominance. Physiology and Behavior. 73, 411-420 (2001).
- Karolewicz, B., Paul, I. A. Group housing of mice increases immobility and antidepressant sensitivity in the forced swim and tail suspension tests. European Journal of Pharmacology. 415, 197-201 (2001).
- Masseck, O. A., Rubelowski, J. M., Spoida, K., Herlitze, S. Light- and drug-activated G-protein-coupled receptors to control intracellular signalling. Experimental Physiology. 96, 51-56 (2011).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4, (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature Article. 446, 633-639 (2007).
- Owen, S. F., Liu, M. H., Kreitzer, A. C. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience. 22, 1061-1065 (2019).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nature Communication. 10, 1-12 (2019).
- Allsop, S. A., Vander Weele, C. M., Wichmann, R., Tye, K. M. Optogenetic insights on the relationship between anxiety-related behaviors and social deficits. Frontiers in Behavioral Neuroscience. 8, 1-14 (2014).
- Fuchikami, M., et al. Optogenetic stimulation of infralimbic PFC reproduces ketamine's rapid and sustained antidepressant actions. Proceedings of the National Academy of Science of the United States of America. 112, 8106-8111 (2015).
- Correia, P. A., et al. Transient inhibition and long-term facilitation of locomotion by phasic optogenetic activation of serotonin neurons. Elife. 6, 1-26 (2017).
- Felix-Ortiz, A. C., Burgos-Robles, A., Bhagat, N. D., Leppla, C. A., Tye, K. M. Bidirectional modulation of anxiety-related and social behaviors by amygdala projections to the medial prefrontal cortex. Neuroscience. 321, 197-209 (2016).
- Marek, R., Xu, L., Sullivan, R. K. P., Sah, P. Excitatory connections between the prelimbic and infralimbic medial prefrontal cortex show a role for the prelimbic cortex in fear extinction. Nature Brief Communication. , (2018).
- Parfitt, G. M., et al. Bidirectional Control of Anxiety-Related Behaviors in Mice: Role of Inputs Arising from the Ventral Hippocampus to the Lateral Septum and Medial Prefrontal Cortex. Neuropsychopharmacology. 42, 1715-1728 (2017).
- Bandelow, B., Michaelis, S. Epidemiology of anxiety disorders in the 21st century. Dialogues in Clinical Neuroscience. 17, 327-335 (2015).
- Kessler, R. C., et al. Lifetime Prevalence and Age-of-Onset Distributions of DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 62, 593-602 (2005).
- Kessler, R. C., Petukhova, M., Sampson, N. A., Zaslavsky, A. M., Wittchen, H. U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. International Journal of Methods Psychiatric Research. 21, 169-184 (2014).
- Andlin-Sobocki, P., Wittchen, H. U. Cost of anxiety disorders in Europe. European Journal of Neurology. 12, 39-44 (2005).
- Forster, G. L., Novick, A. M., Scholl, J. L., Wall, M. J. The Role of the Amygdala in Anxiety Disorders. Intech. , 61-102 (2012).
- Liberzon, I. Neural circuits in anxiety and stress disorders a focused review. Therapeutics and Clinical Risk Management. 11, 115-126 (2015).
- Sylvers, P., Lilienfeld, S. O., LaPrairie, J. L. Differences between trait fear and trait anxiety: Implications for psychopathology. Clinical Psychology Review. 31, 122-137 (2011).
- Daws, L. C., Koek, W., Mitchell, N. C. Revisiting Serotonin Reuptake Inhibitors and the Therapeutic Potential of 'Uptake-2' in Psychiatric Disorders. ACS Chemical Neuroscience. 4, 16-21 (2013).
- Felix-Ortiz, A. C., et al. BLA to vHPC inputs modulate anxiety-related behaviors. Neuron Report. 79, 658-664 (2013).
- Padilla-Coreano, N., et al. Direct Ventral Hippocampal-Prefrontal Input Is Required for Anxiety-Related Neural Activity and Behavior. Neuron Article. 89, 857-866 (2016).
- Lisboa, S. F., Stecchini, M. F., Corrêa, F. M. A., Guimarães, F. S., Resstel, L. B. M. Different role of the ventral medial prefrontal cortex on modulation of innate and associative learned fear. Neuroscience. 171, 760-768 (2010).
- Bi, L. L., et al. Enhanced excitability in the infralimbic cortex produces anxiety-like behaviors. Neuropharmacology. 72, 148-156 (2013).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature Article. 477, 171-178 (2011).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. 44, 611-621 (2006).
- Rubenstein, J. L. R., Merzenich, M. M. Model of autism: increased ratio of excitation/ inhibition in key neural systems. Genes, Brain and Behavior. 2, 255-267 (2003).
- Berg, L., Eckardt, J., A, M. O. Enhanced activity of pyramidal neurons in the infralimbic cortex drives anxiety behavior. PLoS One. 14, 1-19 (2019).
- Meunier, C. N. J., Amar, M., Lanfumey, L., Hamon, M., Fossier, P. 5-HT1A receptors direct the orientation of plasticity in layer 5 pyramidal neurons of the mouse prefrontal cortex. Neuropharmacology. 71, 37-45 (2013).
- Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J. . Mouse Brain in Stereotaxic Coordinates. 2, (2004).
- Gore, B. B., Soden, M. E., Zweifel, L. S. Manipulating gene expression in projection-specific neuronal populations using combinatorial viral approaches. Current Protocols in Neuroscience. 435, 1-6 (2014).
- Stujenske, J. M., Spellman, T., Gordon, J. A. Modeling the Spatiotemporal Dynamics of Light and Heat Propagation for InVivo Optogenetics. Cell Report. 12, 525-534 (2015).
- Berg, L. Imbalance of excitation and inhibition within the prefrontal cortex supports anxiety behavior. Ruhr-University Bochum. , (2019).
- Boyden, E. S. A history of optogenetics: The development of tools for controlling brain circuits with light. F1000 Biology Reports. 3, 1-12 (2011).
- Airan, R. D., Thompson, K. R., Fenno, L. E., Bernstein, H., Deisseroth, K. Temporally precise in vivo control of intracellular signalling. Nature. 458, 1025-1029 (2009).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7, 12-23 (2012).
- Covington, H. E., et al. Antidepressant Effect of Optogenetic Stimulation of the Medial Prefrontal Cortex. Journal of Neuroscience. 30, 16082-16090 (2010).
- Lepicard, E. M., Joubert, C., Hagneau, I., Perez-Diaz, F., Chapouthier, G. Differences in anxiety-related behavior and response to diazepam in BALB/cByJ and C57BL/6J strains of mice. Pharmacology, Biochemistry and Behavior. 67, 739-748 (2000).
- Schmidt, M. V., Müller, M. B. Animal models of anxiety. Elsevier. 3, 369-374 (2006).
- Cho, J. H., Deisseroth, K., Bolshakov, V. Y. Synaptic Encoding of Fear Extinction in mPFC-amygdala Circuits. Neuron Article. 80, 1491-1507 (2013).
- Adhikari, A., et al. Basomedial amygdala mediates top-down control of anxiety and fear. Nature. 527, 179-185 (2015).
- Suzuki, S., et al. The infralimbic and prelimbic medial prefrontal cortices have differential functions in the expression of anxiety-like behaviors in mice. Behavioural Brain Research. 304, 120-124 (2016).
- Carola, V., D'Olimpio, F., Brunamonti, E., Mangia, F., Renzi, P. Evaluation of the elevated plus-maze and open-field tests for the assessment of anxiety-related behaviour in inbred mice. Behavioural Brain Research. 134, 49-57 (2002).
- Prut, L., Belzung, C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: A review. European Journal of Pharmacology. 463, 3-33 (2003).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature Letter. 471, 358-362 (2011).
- Bouwknecht, J. A., et al. Differential effects of exposure to low-light or high-light open-field on anxiety-related behaviors: Relationship to c-Fos expression in serotonergic and non-serotonergic neurons in the dorsal raphe nucleus. Brain Research Bulletin. 72, 32-43 (2007).
- Overstreet, D. H., Knapp, D. J., Angel, R. A., Navarro, M., Breese, G. R. Reduction in repeated ethanol-withdrawal-induced anxiety-like behavior by site-selective injections of 5-HT1A and 5-HT2C ligands. Psychopharmacology. 187, 1-12 (2006).
- Takahashi, A., et al. Glutamate Input in the Dorsal Raphe Nucleus As a Determinant of Escalated Aggression in Male Mice. Journal of Neuroscience. 35, 6452-6463 (2015).
- Klemenhagen, K. C., Gordon, J. A., David, D. J., Hen, R., Gross, C. T. Increased Fear Response to Contextual Cues in Mice Lacking the 5-HT1A Receptor. Neuropsychopharmacology. 31, 101-111 (2006).
- Ramos, A. Animal models of anxiety: do I need multiple tests. Trends in Pharmacological Science. 29, 493-498 (2008).
- Isosaka, T., et al. Htr2a-Expressing Cells in the Central Amygdala Control the Hierarchy between Innate and Learned Fear. Cell. 163, 1153-1164 (2015).
- Regev, L., Goshen, I. Employing Optogenetics in Memory Research. Optogenetics: A Roadmap. , 219-256 (2017).
- Shah, A. A., Sjovold, T., Treit, D. Inactivation of the medial prefrontal cortex with the GABA A receptor agonist muscimol increases open-arm activity in the elevated plus-maze and attenuates shock-probe burying in rats. Brain Research. 1028, 112-115 (2004).
- Knight, A. R., et al. Pharmacological characterisation of the agonist radioligand binding site of 5-HT2A, 5-HT2B and 5-HT2C receptors. Naunyn-Schmiedebergs Archiv of Pharmacology. 370, 114-123 (2004).
- Graeff, F. G., Viana, M. B., Mora, P. O. Dual Role of 5-HT in Defense and Anxiety. Neuroscience and Biobehavioral Reviews. 21, 791-799 (1997).
- Cheriyan, J., Sheets, P. L. Altered Excitability and Local Connectivity of mPFC-PAG Neurons in a Mouse Model of Neuropathic Pain. Journal of Neuroscience. 38, 4829-4839 (2018).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved