Method Article
자유롭게 움직이는 마우스에 있는 행동을 조절하기 위하여 신경 활동의 광유전학 조작
요약
특정 신경 인구 또는 뇌 영역의 광유전학 적 조작으로, 행동은 자유롭게 움직이는 동물에 있는 높은 시간 및 공간 해상도로 수정될 수 있습니다. 만성 이식 된 광섬유와 함께 다른 광유전학 도구를 사용하여 다양한 신경 변조 및 행동 테스트를 수행 할 수 있습니다.
초록
자유롭게 움직이는 마우스에 있는 신경 회로의 광유전학 변조는 급성 및 장기 행동에 영향을 미칩니다. 이 방법은 중추 신경계의 전체 뉴런 회로까지 단일 뉴런 및 지역 별 송신기 방출의 조작을 수행할 수 있으며 행동 결과의 직접 측정을 허용합니다. 뉴런은 채널로돕신2(ChR2)와 같은 선택의 DNA를 운반하는 바이러스 벡터의 주입을 통해 광유전학 적 도구를 표현한다. 빛은 표적 영역 바로 위에 종료 만성 광학 임플란트를 통해 특정 뇌 영역으로 가져온다. 회복과 적절한 도구 발현의 2 주 후에, 마우스는 관심있는 뉴런의 광유전학 자극을 가진 행동 시험에 반복적으로 사용될 수 있습니다.
광유전학 변조는 화학적 또는 전기 자극과 같은 일반적으로 사용되는 방법에 비해 높은 세포 특이성으로 달성 될 수있는 높은 측두및 공간 해상도를 가지고 있습니다. 빛은 신경 조직에 해를 끼치지 않으며 따라서 한 마우스에 있는 다중 행동 실험뿐만 아니라 장기 실험에 사용될 수 있습니다. 광유전학 적 도구의 가능성은 거의 무제한이며 전체 뉴런의 활성화 또는 침묵, 또는 빛에 의해 특정 수용체 유형의 조작을 가능하게합니다.
통합 된 광유전학 자극을 가진 이러한 행동 실험의 결과는 조작으로 인한 행동의 변화를 직접 시각화합니다. 기준선과 같은 자극이 없는 동일한 동물의 동작은 유도된 변화에 대한 좋은 제어입니다. 이 특정 행동에 관련 된 신경 유형 또는 신경 전달 물질 시스템의 자세한 개요를 허용, 불안 등. 신경 네트워크의 가소성은 또한 광학 자극 후에 장기 자극 또는 행동 관측을 통해 중대한 세부으로 조사될 수 있습니다. 광유전학은 신경 질환의 여러 종류에서 계몽 신경 신호에 도움이 될 것입니다.
서문
중추 신경계의 신경 회로와 행동 결과의 변조는 뇌가 어떻게 작동하는지 이해하는 데 중요합니다, 특히 정신 질환과 학습 및 기억과 같은 인지 작업. 광유전학을 사용하면 단일 세포 또는 전체 회로까지의 세포 집단이 빛에 의해 변조 될 수 있습니다. Channelrhodopsin2 (ChR2) 또는 Archaerhodopsin (아치)와 같은 일반적인 광유전학 적 도구는 뉴런을 활성화하거나 침묵시킬 수 있으며, 또는 뚜렷한 뇌영역으로투사되는 축산 단자에서 송신기 방출을 증가 또는 억제 할 수 있습니다1,2,,3,,4. 그러나, 아치는 사전 시냅스 단자에서의 활성화가 자발적인 송신기 릴리즈5를증가시킨다는 것을 보여주었기 때문에 신중하게 사용되어야 한다. 아치는 셀 내부의 pH 값을 변경하는 바깥쪽 정류 양성자 펌프입니다. 이 알칼리성 밀리유는 칼슘 유입을 유도하고 송신기 방출을 향상시킵니다5. 세포내 신호 경로를 구체적으로 조절하기 위해, 류독신 이나 콘 옵신과 같은 가벼운 활성성 광유전학 적 도구로 구성된 수용체 키메라가 적절한 G 단백질 결합 수용체와 함께6,,7,,8을생성할 수 있다. 사용 가능한 광유전학 공구의 양 그리고 변이는 지난 10년간9일도중 현저하게 증가했습니다.
광유전학의 목적은 행동 도중 신경 회로를 조작하는 것입니다. 광유전학은, 예를 들면, 불안 행동에 있는 변경과 같은 심각한 행동 변경의 측정을 가능하게 합니다. 광유전학 적 도구는 바이러스 벡터를 통해 뇌의 표적 영역으로 전달됩니다. 특수 발기인 및 증강제, 또는 Cre-loxP 시스템의 도움으로 세포 유형 특이성은 광유전학 적 도구(도 1A)의발현을 보장 할 수 있습니다. 특정 세포 유형에서만 효소 Cre-Recombinase를 표현하는 몇몇 유전자 변형 마우스 라인이 있습니다. 예를 들어, 넥스-크레 마우스는넥스-프로모터(10)의제어하에 피질과 해마의 피라미드 뉴런에서 Cre-Recombinase를 발현한다. 이 효소는 loxP측(11)에의해 좌우되는 DNA 서열을 반전시킬 수 있다. 따라서, loxP 측에 의해 반전되고 측면이 있는 이중 플록스 광유전학 적 도구의 DNA 서열은 Cre-Recombinasase를소유하는 뉴런에 의해서만 전사될 수 있지만 다른 뉴런유형(12,,13)에의해서만 전사될 수 있다. 넥스-크레마우스의 경우, 광유전학 적 도구는 피라미드 뉴런에서만 발현될 것이다. 특정 뇌 영역의 빛 자극은 관심 영역 바로 위에 광섬유의 만성 이식을 통해 달성된다. 그런 다음 동물은 적절한 광원에 결합하고 거의 모든 종류의 행동 테스트에서 자유롭게 행동 할 수 있습니다.
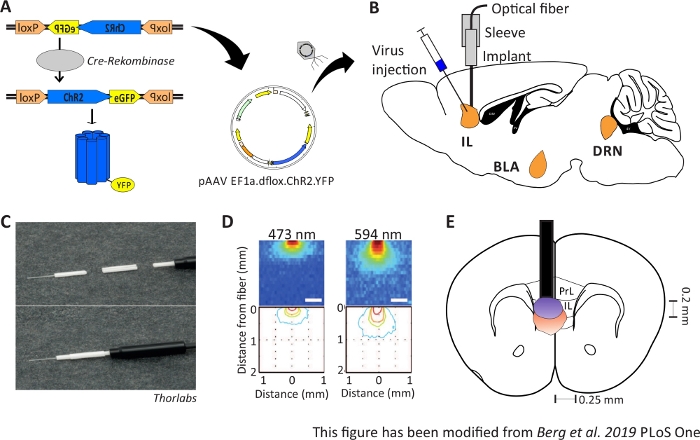
그림 1: 사출 및 이식. A) ChR2-YFP용 Cre-loxP 시스템. 이중 플록스 광유전학 도구는 뇌 조직에 주입을 위한 아데노 관련 바이러스(AAV)에 포장됩니다. B)mPFC의 IL 영역 내/위에 광학 뉴런 인터페이스의 바이러스 주입 및 이식의 적발보기. 주사와 이식은 위에서 수행되었다. 관심의 모든 영역, IL, BLA 및 DRN, 표시됩니다. C)이식된 광섬유, 슬리브 및 광원의 상세한 보기. D)200 μm 광 섬유 (Yizhar et al. 2011)에서 회색 물질 뇌 조직에서 파란색과 빨간색 레이저 빛 자극의 확산. 청색광은 최대 0.5mm의 티슈로 확산되어 붉은 빛이 약 1mm 나아갑니다. 색상 코딩: 빨간색 50%, 노란색 10%, 녹색 5%, 파란색 1% 빛이 이 영역에 도달하면. E)200 μm 광섬유를 가진 좌측 IL 바로 위에 일방적 이식의 관상적 시각. IL 영역의 폭은 각 반구에 0.25mm이고 깊이는 0.2 mm입니다. 파란색과 빨간색 전구는 5% 광 확산의 보더이며 Yizhar 등에서 올바른 크기로 전송됩니다. LoxP: X 오버 P1의 궤적; ChR2: 채널로독신; YFP: 황색 형광 단백질; dflox: 이중 플로스; IL: 인프라 피질; BLA: 바소포탈 편도체; DRN: 등쪽 라페 핵; PrL: 전두엽 지역. 이 수치는 Berg 201948에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
광유전학적 접근법은 높은 측두및 공간 분해능14 및 세포형 특이적 변조를 가능하게 하기 때문에 활용된다. 또한, 추가 치료 없이 이식된 장치를 반복적으로 사용할 수 있다. 관제수술 후, 광섬유의 광유전학적 도구와 이식을 운반하는 아데노 관련 바이러스의 주입이 수행되고, 마우스는 2주 동안 회복될 수 있다. 우리는 단지 2 주의 회복 시간을 선택했습니다, 이것은 수술에서 복구하고 바이러스가 표현하기에 충분한 시간이기 때문에. 행동 실험은 면역 조직 화학에 선행되기 때문에, 우리는 마우스가 실험 도중 너무 오래되지 않도록 해야합니다; 그렇지 않으면 조직 품질이 저하됩니다. 그(것)들은 임플란트에서 명백한 행동 손상을 보여주지 않으며 일반적인 케이지 행동에 관여합니다. 물론, 이식은 중요한 외과 병변을 동반한다; 따라서, 마우스는 집중적으로 모니터링된다. 수술 후, 마우스는 그룹 수용 마우스가 서로의 신선한 상처와 임플란트를 다치게하는 경향이 있기 때문에, 단일 보관해야합니다. 그러나, 주거 조건은 남성 마우스의 불안 수준에 큰 영향을 미칠, 단일 집 쥐 낮은 불안 수준을 보여 으로15 일반적으로 덜 우울 같은 증상16.
뇌 회로의 화학적 또는 전기적 조작은 광유전학의 높은 세포형 특이성이 결여되어 있으며, 낮은 측두및 공간분해능(14,,17,,18)을갖는다. 실험적 질문에 따라 전기 또는 화학 자극은 다른 장점을 가질 수 있습니다. 특정 영역에서 섬유 단자통과도 자극해야 할 때, 전기 자극이 가장 좋은 방법입니다. 화학 자극은 전체 영역에서 송신기 특정 수용체가 작용제에 의해 활성화되어야 할 때 좋은 선택입니다. 화학적 또는 전기 자극에 비해 광유전학의 또 다른 큰 장점은 내인성, 뉴런은 부작용의 발생을 피하는 빛에 민감하지 않다는것입니다(19). 실제로, 높은 빛 강도는 가열 효과를 유도 할 수있다8,,20,하지만 적절한 대조군으로 인해, 광유전학 적 조작으로 인한 행동 효과를 제거 할 수 있습니다.
설치류 행동을 조사하는 것은, 특히 정신 질환에 관해서, 그것은 특정 세포 인구까지 단일 수용체의 직접 변조를 가능하게하기 때문에, 자유롭게 움직이는 동물에 있는 광유전학으로 크게 향상되었습니다21 회로22. 이러한 변조의 급성 효과뿐만 아니라 정의 된 시간23 또는 만성 자극24후 장기 행동 효과를 측정 할 수있는 가능성은 실험 설계의 넓은 유연성을 가능하게하고 뇌 회로에 대한 매우 상세한 통찰력을 제공합니다. 광 자극은 광유전학 적 도구의 주사 부위에 위치한 뉴런을 조절하는 데 사용할 수 있습니다. 주사와 이식이 모두 동일한 뇌 영역을 다룰 때, 세포 체 및 이 지역에서 원리 뉴런및 인터뉴런의 축축을 투사하는 후3,6,,8을표적으로 할 수 있다.3 그러나, 광섬유는 또한 주입된 것과 다른 부위에 이식될 수 있다. 이 경우,,광 자극은 주입된영역(25,26,27)의투영 영역에서 축산 단자에서 송신기 방출을 조절할 수 있다.,
여기에서 연구 결과에서는, 광유전학은 불안 관련 행동을 분석하기 위하여 실험과 조합에서 이용됩니다. 불안 관련 정신질환은 세계 인구의 3분의 1이상에영향을 미치고28,29,,30으로 경제적 부담이 높은31명이다. 그 영향 받은 사람들은 각성, 긴장 및 걱정의 감각때문에 손해를 입습니다 회피 행동32,,33뒤에. 이러한 만성 발생 부정적인 감정, 주로 미래 이벤트에 초점을 맞추고있다 34,강하게 환자의 일상 생활을 방해. 벤조디아제핀 또는 선택적 세로토닌 재uptake 억제제 (SSRIs)와 같은 일반적인 치료는 일부 환자에서만 성공적입니다. 많은 양의 사람들이35전혀 치료에 반응하지 않으며, 그러한 질병의 기본 메커니즘이 아직 완전히 이해되지 않는다는 것을 보여준다. 내측 전두엽 피질(mPFC)은 불안21,,25,,27,36,,,37,,38의발달 및 증상에 중요한 역할을 하는 것으로 알려져 있다.37 구체적으로, mPFC에서 의 적외선 피질(IL) 부위의 과잉활성화는 불안 관련장애(39,,40)의일부가 될 수 있다. 여기에 설명된 예제 실험은 mPFC의 IL 영역에서 변조가 불안 행동에 미치는 영향을 이해하는 데 도움이 될 수 있습니다. 추가적으로, 불안 관련 정신 질병을 위한 새로운 치료 전략의 발달은 또한 잠재적으로 지원될 수 있습니다.
2-6개월 된 수컷 넥스-Cre 마우스는mPFC(41)의IL 영역 내의 피라미드 뉴런에서 특별히 ChR2를 발현하는 데 사용된다. 넥스-Cre 마우스는 C57Bl/6 배경을 가지고 있으며, 피라미드 뉴런에서 특별히 효소 Cre-recombinase를 표현한다. 입체 수술 중, 이중 플로스 ChR2-DNA는 아데노 관련 바이러스 벡터를 통해 IL 부위에 주입된다. 광학 임플란트는 관심영역(도 1B)바로 위에 배치되며 임플란트는 치과 시멘트로 고정됩니다. 대조군 동물은 세포 특이적 발현을 모방하기 위해 동일한 부위에 이중 플록스 tdTomato-DNA의 주사를 받는다.
동물은 수술 일까지 그룹 보관되며 그 후 다른 마우스의 부상을 피하기 위해 단독 으로 보관됩니다. 마우스는 단일 수용 마우스를 위한 TypI-L 케이지에 있는 개별 환기 케이지 (IVC) 랙에 보관됩니다. 밝은 어두운 주기는 오전 10시부터 시작되는 12:12 h 리듬을 따릅니다. 모든 행동 실험은 설치류의 활성 단계와 유사한 어두운 단계에서 수행됩니다. 물과 표준 식품 펠릿은 광고 리비툼을 사용할 수 있습니다. 피라미드 뉴런에서 ChR2의 충분한 발현을 보장하는 2 주 간의 회복 후 마우스는 행동 실험에 사용됩니다.
오픈 필드 (OF)는 모래가 40cm 높이의 벽으로 50cm x 50cm 제곱 미로입니다. 지면은 내부 4가 중심을 나타내는 16 개의 사각형으로 나뉩니다. 측정된 동작은 중앙에서 소요되는 시간 1, 센터 항목 2개 수 및 3) 총 거리 이동입니다. 이 실험 중에는 총 20분 동안 4번의 시험이 있습니다. 시험 1과 3에서는, 빛 자극이 발생하지 않으며, 시험 2 및 4에서는, 5 ms 광 펄스와 473 nm의 1 mW 광 강도로 20 Hz 자극이 수행된다(그림2A). 이후 시험에서는 시험 영역에 대한 습관이 고려되었지만, 샴 주입 대조군 동물의 사용은 습관이 어떻게 표현되는지를 나타냅니다.
반즈 미로는 학습과 기억을 위한 실험입니다. 직경 92cm의 원형 플랫폼으로 둘레 주변에 20개의 등거리 구멍이 들어 있습니다. 구멍의 19개는 닫혀 있고 1개 구멍 아래에 이스케이프 박스가 제시됩니다. 4일 연속, 마우스는 탈출 상자의 위치를 배우기 위해 4개의 훈련 시험을 가지고 있다. 5일째에는 이스케이프 박스가 제거되고 마우스는 올바른 구멍을 찾는 데 필요한 시간을 테스트합니다. 측정된 동작은 : 1) 이스케이프 박스/올바른 구멍이 발견될 때까지의 시간, 2) 대상 방문 및 오류 수, 3) 이스케이프 박스까지 이동된 거리. 다른 그룹의 빛 자극은 1-4 일 훈련 일 또는 테스트 당일 검색 중에 이루어지는 수집 또는 통합 중에 수행됩니다(그림 2D).
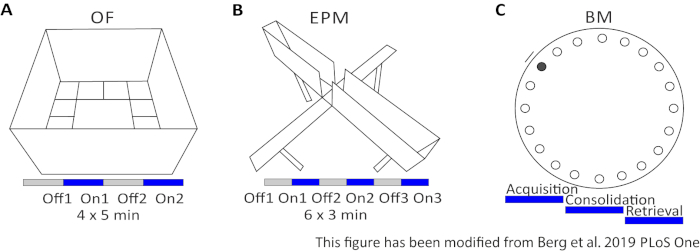
그림 2: 광유전학 프로토콜을 가진 행동 실험. A)해당 광 자극 프로토콜을 가진 오픈 필드 실험의 회로도 도면. C)해당 광 자극 프로토콜을 가진 고가-플러스 미로 실험의 회로도. D)반즈 미로의 회로도는 해당 광 자극 프로토콜을 가지고 실험한다. EPM: 고급 플러스 미로; OF: 오픈 필드; BM : 반즈 미로 테스트. 이 수치는 Berg 201948에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
광유전학 자극의 경우, 광강도와 주파수는 조사 중인 광유전학 도구 및 신경 유형에 적응해야 합니다. 가능한 가장 낮은 광 강도는 조직에 손상을 피하기 위해 사용되어야한다, 여러 연구는 강한 빛 강도로 인해 가능한 가열 효과가 있음을 보여주었다으로 8,,20. ChR2의 경우 5ms 광 펄스가 있는 20Hz 자극이 일반적으로2로사용됩니다. ChR2는 매우 가볍기 때문에 1 mW 광 강도가 충분합니다. 빛 자극 프로토콜은 라이트 오프와 시험 을 번갈아 가며 행동 변화를 직접 측정합니다. 행동 실험을 위한 외부 방 조건은 동물의 전체 단에 대한 안정상태를 유지해야 합니다. 고려해야 할 중요한 조건은 소음(장치 자체가 소음을 낼 수 있음), 냄새(항상 에탄올로 행동 설정을 청소), 광 강도 및 실험자입니다. 실험자는 항상 같은 사람이어야합니다. 또한, 실험의 하루 시간은 한 그룹의 모든 동물에 대해 동일해야하며, 시설에서 어두운 단계가 시작된 후 몇 시간 후에 바람직하다.
이 실험의 목적은 흥분 피라미드 뉴런의 강력한 활성화를 통해 IL 영역에서 흥분/억제(E/I) 비율을 증가시키는 것이다. 이 특별한 피질 지역에서 향상된 E/I 비율은 마우스40,,42,,43,44에서불안 수준을 증가시키는 것으로 알려져있다.
프로토콜
동물 과목과 관련된 절차는 브레멘 대학의 기관 동물 연구 시설과 "세나토린 퓌르 위센샤프트, 게순데이트 und Verbraucherschutz"에 의해 승인되었습니다 (#146)
1. 광학 임플란트9의 준비(도 1C)
- 벤치 비스에 세라믹 페룰 플랫 사이드를 올려 놓습니다.
- 섬유 스트리핑 도구로 200 μm 직경의 유리 섬유의 코트를 제거하고 세라믹 섬유 서기로 2-3cm 길이의 조각을 잘라냅니다.
- 유리 섬유 조각을 세라믹 페룰에 넣고 양쪽에 도저히 오버행을 합니다.
- 사출 카눌라와 세라믹 페룰의 평평한 측면에 슈퍼 접착제 한 방울을 놓습니다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다. - 사전 임플란트를 벤치 바이스와 세라믹 페룰의 둥근 쪽에서 꺼내 세라믹 섬유 서기로 가능한 한 짧게 유리 섬유를 자른다.
- 사전 임플란트를 ferrule 연마 퍽에 놓고 종이 당 8 20회(30μm 모래, 6μm 그릿, 1 μm 모래, 그리고 마지막 0.02 μm 모래)를 그려 서 둥근 면을 4가지 연마 용지에 연마합니다.
- 페룰 연마 퍽에서 사전 임플란트를 꺼내 세라믹 페룰의 평평한 쪽에 있는 유리 섬유를 이식에 필요한 길이로 자른다. 튀어나온 초접착제 뒤에 있는 길이를 측정하기 시작합니다.
- 심지어 절단 표면을 위해 그냥 유리 섬유를 긁어 2-3 시간 다음 그것을 깰.
참고: 팍시노스와프랭클린(45)의 마우스 뇌 아틀라스를 사용하여 임플란트의 길이를 계산합니다. 임플란트는 관심 영역 바로 위에 끝나야 하며 두개골의 두께는 길이 계산에 포함되어야 합니다. IL 영역을 자극하기 위해 유리 섬유의 길이는Figure 31.8mm(도 3)입니다.
- 심지어 절단 표면을 위해 그냥 유리 섬유를 긁어 2-3 시간 다음 그것을 깰.
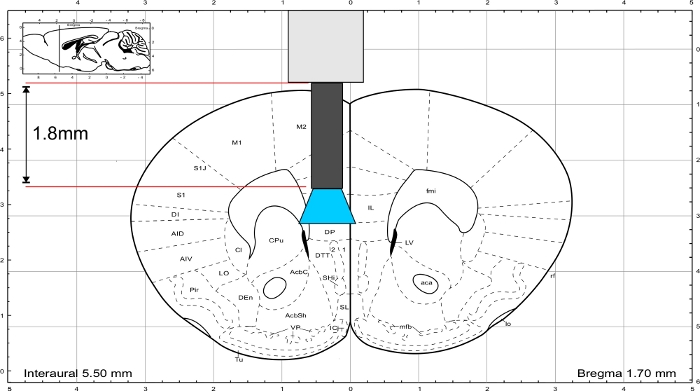
그림 3: 마우스 뇌 아틀라스 (Paxinos 및 프랭클린) IL 영역에 도달 하는 임플란트의 대표 길이. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 완성된 임플란트를 에탄올로 10분 동안 소독하고 이식 전에 공기를 건조시키십시오.
2. 사출 및 이식
- 하나의 마우스를 수술실로 운반하고 무게를 측정합니다. 케타민/자일라진 주사(케타민 0.12 mg/g, 자일라진 0.01 mg/g)로 마취를 적용하십시오.
- 마우스를 왼손으로 고정하고 머리를 낮게 유지하여 뒷면에 켭니다.
- 주사기로 복부의 왼쪽 하부 사분면을 표적으로 하고 피부 밑에 1cm의 주사 카누라를 입력합니다.
- 복강으로 느리고 일정한 움직임에 마취를 주입합니다.
- 마우스를 다시 케이지에 넣고 마취의 깊은 상태에 도달 할 때까지 기다립니다.
참고: 마취의 깊이는 깜박임과 발가락 사이의 반사 신경이 없는 것에 의해 결정될 수 있습니다.
- 가열 판에 마우스를 놓고 고정 프레임에 머리를 고정합니다. 앞면의 코와 치아와 양쪽의 귀를 고정합니다.
참고: 올바른 입체 좌표를 보장하기 위해 머리는 왼쪽-오른쪽 및 로스트랄-코달 축에 직진해야 합니다. - 2 mg/ kg Carprofen을 마우스 뒤쪽에 피하로 발라주고 양눈에 불투명한 눈 연고를 적용하여 건조로부터 보호하십시오.
- 젖은 종이 타월로 두피에 머리카락을 적신 다음 가위를 사용하여 잘라냅니다. 젖은 종이 타월로 느슨한 머리카락을 모두 제거하십시오. 두피를 소독하려면 면 봉을 사용하고 요오드 (베타이소도나 100 mg / mL 포비돈 요오드 및 11 mg / mL 요오드)가 들어있는 팅크의 0.5 mL을 섭취하고 공기를 건조시키십시오.
참고: 가위 대신 전기 클리퍼를 적절한 제모에 사용할 수도 있습니다. - 트위저로 관심 영역 위에 두피를 올리고 중간선을 따라 1cm를 자른다. 두 개의 핀셋을 사용하여 피부를 옆으로 밀어 두개골을 노출시십시오. 또한 두개골 위의 얇은 피부를 제거하고 노출 된 두개골을 건조하게하십시오.
- 나중에 이식하기 위해 두개골을 거칠게 합니다.
- 인산 2mm x 2mm 낙하(37%) 적용 두개골에 접착 키트(예: Optibond)에서 주사기 의 끝으로 나누어 15s에 적용됩니다.
- 면 봉으로 모든 산을 제거하고 0.9 % NaCl의 1 mL로 두개골을 헹구습니다.
- 면 스틱과 압축 공기로 두개골을 건조.
주의: 인산은 위험하며 조직 손상을 피하기 위해 완전히 제거해야합니다.
- 개별 좌표에 대한 F계수를 계산합니다.
- 스테레오테스트 프레임에 유리 카눌라를 놓고 브레그마 바로 위에 놓습니다.
- 좌표 계열을 제로화하고 유리 카눌라를 람다로 이동합니다.
- 다음 수식으로 F-factor46을 계산합니다.
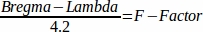
- 개별 마우스로 조정하기 위하여 마우스 두뇌 아틀라스에서 좌표와 F-Factor를 곱합니다.
- 주입을 위해 두개골에 구멍을 뚫습니다.
- 조정된 좌표를 사용하여 관심 구조 바로 위에 두개골의 위치를 찾아 뼈 표면 위에 긁음으로써 주사 카누라의 끝을 사용하여 표시하십시오.
- 주사 카눌라를 사용하여 그 자리에서 카눌라를 회전하여 표시된 위치에서 두개골에 구멍을 뚫습니다. 버 구멍에서 혈액이 누출되면 0.9 % NaCl의 1 mL로 헹구고 나중에 두개골을 건조시십시오.
- 유리 카눌라에 바이러스 솔루션을 가져 가라.
- 두개골에 0.9 %의 100 μL의 방울을 놓고 파라 필름 (1cm x 1cm)을 위에 올려 놓고 멸균 면을 위로 놓습니다.
- 바이러스 용액의 1-2 μL을 파라필름에 넣고 유리 카눌라의 끝을 그 안으로 낮춥니다.
- 유리 카눌라를 주사기에 연결하고 최소한의 음압을 적용하고 바이러스 솔루션이 캐뉼라에 의해 채택 될 때까지 기다립니다 (초 내).
참고: 공기가 카눌라로 이동하기 전에 음의 압력의 적용을 중지하는 것이 중요합니다. 따라서, 항상 바이러스 솔루션의 작은 잔재가있을 것입니다.
- 관심 영역에 바이러스 솔루션을 주입합니다.
- 바이러스가 채워진 유리 카눌라를 버 구멍 위에 놓습니다.
- 카누구멍을 버 구멍으로 천천히 낮추고 카누라 끝이 두개골 의 수준에있을 때 z 좌표를 0으로 낮춥니다.
- 카누라를 사출 부위의 가장 낮은 위치로 주의 깊게 낮추어보도록 한다.
- 카눌라 내의 바이러스 용액의 반월 상 연골에 쌍안경을 집중하십시오.
- 반월 상 연골이 약간 낮아질 때까지 주사기로 소량의 양압을 적용하십시오.
- 유리 카눌라를 다음 위치로 위로 이동하기 전에 바이러스가 2-3 분 동안 확산시키십시오.
- 관심 영역 전체에 걸쳐 200-300 μm마다 바이러스 용액을 적용합니다.
- 유리 카누라를 매우 천천히 제거하고 최종 주입 후 폐기하십시오.
- 접착 키트(예: 옵티본드TMFL)로 두개골이식을 준비합니다.
- 압축 공기로 두개골을 건조.
- 프라이머 5μL(예: 옵티본드, 1-30% (에탄올, 실리시산, 글리세린포스파티메타크라우트, 2-(2-(메타크라이로일록시)에톡시카보릴)벤조세우레, 2-하이드록세티힐메타킬메타크라이라트, 2-하이드록예틸메트라크릴라크라크라우, 2-하이드록쉬헬메트라크릴라크라크라우어 를 적용하여 15개의 드라이를 제공합니다.
- 5 μL의 본드(예: 옵티본드, 15-20% 2-하이드록시틸메트하크라일라트 + 1-2% 알칼리헥사플루오로실리캣(Na))를 동일한 스틱으로 적용하고 UV 라이트(420-480 nm)로 20s동안 치료합니다.
참고 : 두개골이 건조하고 프라이머와 결합이 매우 얇은 층에 적용되는 것이 필수적입니다.
주의: 자외선이 눈에 해를 끼칠 수 있기 때문에 자외선을 직접 들여다보지 마십시오.
- 임플란트를 관심 영역 바로 위에 배치합니다.
- 해당 홀더에 임플란트를 고정합니다.
- 압축 공기로 두개골을 건조.
- 유리 섬유의 끝을 버 구멍 바로 위에 놓고 조심스럽게 낮춥습니다.
- 수퍼글루의 나머지 전구가 두개골에 닿으면 임플란트를 낮추는 것을 중단하십시오. 두개골에 압력을 가하지 마십시오!
참고: 주사 및 이식이 다른 영역(예를 들어, 등쪽 라페 및 해마)에서수행되는 경우 인산을 적용한 후 필요한 모든 구멍을 뚫고 2성분 접착 전에, 이전에 설명된 대로 지침을 따르십시오(2.8-2.14 단계).
- 임플란트를 수정합니다.
- 두개골이 여전히 완전히 건조한지 확인합니다.
- 임플란트 주변과 주변 지역에 유체 치과 시멘트(예: 그라디아 다이렉트 플로)를 적용하고 UV 광(420-480 nm)으로 20s를 치료합니다.
참고 : 치과 시멘트의 양은 무료 두개골 영역에 따라 달라집니다. 전체 두개골은 치과 시멘트에 의해 덮여 있어야합니다. - 시멘트의 두 층을 더 적용하고 완전히 무료 건조 두개골 영역을 채웁니다. 자외선(420-480 nm)으로 모든 층을 치료합니다.
- 수술을 마칩니다.
- 전체 상처에 0.5 g 요오드 연고 (베타이소도나 100 mg /mL 포비도네 요오드 및 11 mg /mL 요오드)를 적용하십시오.
- 0.9%에 용해된 포도당 0.1mL을 목에 피하하여 빠른 회복을 위해 주입한다.
- 코와 귀 고정을 해제하고 마우스를 신선한 케이지에 넣고 체온손실을 피하기 위해 가열 램프 아래에 놓습니다.
- 마우스가 깨어나면 시설로 다시 가져온다.
- 적어도 하루에 한 번 건강 상태를 확인하십시오. 쥐가 나쁜 체질을 표시하는 경우 적절한 조치를 취하십시오 (예 : 쥐가 통증의 징후를 표시하는 경우 최대 3 일 까지 Carprofen과 수술 후 진통제를 확인하십시오).
참고: 2주 간의 회복 후 마우스는 행동 실험에 사용할 수 있습니다.
3. 새로운 실험 설정(예 ChR2 자극 및 오픈 필드)
- 펄서
- 라이트 자극을 위해 펄스(예: Prizmatix)를 프로그래밍합니다.
- 소프트웨어를 열고 광원이 연결된 USB COM 포트를 선택합니다.
- 선택 작동 모드 (3) | 트리거 HIGH 후 펄스 시퀀스를 실행한 다음 LOW때 중지하여 외부 소프트웨어가 광원을 제어할 수 있도록 합니다.
- 라이트 프로토콜을 프로그래밍합니다. 5 ms 라이트 펄스와 20 Hz 자극 : TI = 23 ms, P1D = 5 ms, P1I = 22 ms 및 P2D = 0 ms를 선택합니다.
- 시작 시퀀스를누릅니다. 이 상태는 실험이 완료될 때까지 유지됩니다.
참고: 비디오 추적 소프트웨어 전에 펄스 소프트웨어(Prizmatix Pulser)를 출시해야 합니다. 그렇지 않으면 비디오 추적 소프트웨어가 장치를 인식할 수 없습니다.
- 비디오 추적 소프트웨어(예: 에토비전 XT)
- 미리 정의된 템플릿에서 새 실험을 만듭니다.
- 소프트웨어를 열고 파일로이동하여 템플릿에서 새 를 선택합니다. 미리 정의된 템플릿 적용을 선택합니다.
- 라이브 추적을 선택하고 소스를 눌러 카메라를 선택하고 연결된 Basler GenICam을 확인합니다.
참고: 카메라의 라이브 이미지가 이제 오른쪽 상단의 창에 표시됩니다. - 다음을 누르고 기록해야 하는동물(설치류, 마우스)을 선택합니다. Mouse
- 다음을 누르고 경기장 템플릿 오픈 필드, 사각형을 선택합니다. 영역 템플릿 센터, 테두리, 모서리를 선택하고 다음으로확인합니다.
- 다음으로 추적해야 하는 1개의 피사체를 확인합니다.
- 센터 포인트, 코 포인트 및 꼬리 베이스를 선택하고 다음으로 어두운 배경으로 비교하여 동물의 색상을 확인합니다.
- 다음으로 권장 시료 12.5를 확인하고 단계를 완료합니다.
- 실험의 이름을 적절히 지정하고 저장할 위치를 선택합니다.
- 실험 설정을 정의합니다.
- 설정 및 실험 설정으로 이동합니다. 추적 된 피쳐로 센터 포인트, 코 점 및 꼬리 베이스 감지를 선택합니다.
- 평가판 제어 하드웨어 사용을 선택하고 설정으로이동합니다.
- Noldus USB-IO 상자를 선택하고 확인으로 확인합니다.
- 펄스 장치에 연결된 TTL 포트에서 사용자 지정 하드웨어를 장치 유형으로 선택하고 확인을 확인합니다.
- 경기장 설정을 정의합니다.
- 아레나 설정으로 이동하여 아레나 설정 1을선택합니다.
참고: 이제 카메라가 배경 이미지를 자동으로 엽니다. - 그랩으로 이미지를 확인합니다.
- 미리 정의된 영역을 크기를 변경하여 실제 영역에 맞게 조정합니다. 오른쪽에 있는 화살표와 두 기호를 사용합니다. 일부 영역이 필요하지 않으면 삭제합니다.
- 1을 누릅니다. 스케일을 보정하여 미로의 한 구석에서 다른 쪽 구석으로 선을 당깁니다. 실제 거리의 길이를 cm로 입력합니다.
- 다른 축에 대해 반복합니다.
- 아레나 설정으로 이동하여 아레나 설정 1을선택합니다.
- 빛 자극이 작동하는지 테스트합니다.
- 아레나로 이동 - 하드웨어 매핑및 회색 막대에 테스트를 선택합니다.
- 명령 출력 1 높이 및 프레스 테스트를 선택합니다.
참고: 광섬유의 끝에서 발광이 있어야 합니다. 출력 1 낮음 및 테스트를선택할 때 자극이 중지됩니다.
- 20분간 실험 제어를 정의합니다. 평가판을 Off1, On1, Off2 및 On2에 각각 5분 길이로 설정합니다.
- 평가판 제어 설정으로 이동하여 트랙 시간 30분을선택합니다.
- 조건을 조정하여 기본 규칙을 준비: 설정을 선택하여 20분까지 의 시간 및 30~20분 변경합니다. 확인으로확인 .
참고: 시작 트랙의 조건은 피사체가 경기장에 2초 동안 있을 때여야합니다. 이렇게 하면 마우스가 경기장에 있을 때 시스템이 자동으로 추적을 시작합니다. - 라이트 자극에 대한 하위 규칙 만들기: 구조로이동하여 하위 규칙을선택합니다.
- 빛 자극 프로토콜과같은 이름을 지정합니다.
- 주 규칙 아래에 놓고 마우스 코스러가 있는 파란색 영역을 선택하여 두 상자를 분산시보세요.
- 조건, 시간으로 이동하고 1에 빛과같은 이름을 제공합니다 .
- 조정 조건은 5 분 후에 충족됩니다. 확인으로확인 .
- 상자를 검은색 선으로 당겨 하위 규칙의 규칙 시작 상자 바로 뒤에 놓습니다.
- 행동으로 이동 | 사용자 정의 하드웨어 및 이름을 : 조명 1.
- 출력 1 높이로 수행할 작업을 선택하고 확인을 확인합니다.
- 상자를 조건 상자 바로 뒤에 놓습니다.
참고: 이제 실험 5분 후에 빛 자극이 시작됩니다. - 5분 후 시간 조건을 정의하는 단계를 반복하고 작업 출력 1을 낮게 정의하여 5분 후에 광 자극을 중지합니다.
- 다시 단계를 반복하여 다른 라이트 오프를 프로그래밍하고 시험 시 조명을 표시합니다.
- 구조로 이동 | 하위 규칙 참조 및 참조가 올바른 하위 규칙에 속하는지 확인합니다.
- 시작 조건당 실행한 상태로 지연 없이 조건을 시작하고 조건을 중지합니다. Stop conditions 확인으로확인 .
- 참조 상자 1과 메인 규칙의 조건 상자 2 사이에 참조 상자를 배치하고 작업에서 선을 그립니다 - 참조로 트랙을 시작합니다.
참고: 이제 기본 규칙은 트랙을 시작한 후 하위 규칙을 직접 시작합니다.
- 검색 설정을 정의하여 추적해야 하는 것을 시스템에 표시합니다.
- 검색 설정으로 이동하여 검색 설정 1을선택합니다.
- 테스트 마우스를 경기장에 배치하고 자동 설정을 선택합니다.
- 설치류를 동물 유형으로 선택하고 마우스 저주자를 사용하여 경기장에서 마우스 주위에 상자를 그립니다. 결과 확인 확인? 질문 예.
- 추적해야 하는 모든 실험 동물에 대한 시험 목록을 정의합니다.
- 평가판 목록으로 이동하여 오늘 기록할 모든 동물을 계획합니다: 시험 추가 및 숫자를 선택합니다.
- 모든 마우스에 대해 이전에 정의된 모든 조건을 선택합니다.
- 나중에 분석을 단순화하기 위해 동물 ID와 치료의 이름을 올바르게 지정합니다.
참고: Animal-ID는 시스템에 관련이 없으며 실험자의 이후 데이터 분석에만 중요합니다. 치료 및 제어 그룹의 그룹화는 시스템이 그룹화하는 방법과 나중에 단계 분석에서 모든 트랙을 비교하는 방법을 아는 것이 중요합니다.
- 인수로 이동하여 실험부터 시작합니다.
- 미리 정의된 템플릿에서 새 실험을 만듭니다.
4. 오픈 필드 실험 (불안)
- 실험 직전에 실험용 마우스를 행동실에 가져와 적절한 수준의 불안을 보장합니다.
참고: 마우스가 깨어있을 때 행동 실험은 어두운 단계 동안 수행되어야 하며 항상 동일한 시간에 슬롯에서 비교를 보장해야 합니다. - 소매를 통해 마우스를 원원에 부드럽게 눌러 케이지의 격자에 밀어 줍니다.
- 10분 동안 신선한 쓰레기가 있는 대기 케이지에 넣고 라이트 케이블에 적응합니다.
- 비디오 추적 소프트웨어(예: Ethovision XT)에서 시작 버튼을 눌러 획득을 시작합니다.
- 대기 케이지에서 마우스를 열린 필드의 왼쪽 위 모서리로 옮습니다. 마우스 대신 팔을 추적하지 않도록 2초 이내에 팔을 제거합니다.
- 실험 중에 마우스의 시야를 그대로 두고 침착하게 하십시오.
- 20분 후 실험이 끝나면 미로에서 마우스를 제거하고 라이트 케이블을 분리하여 홈 케이지에 다시 넣습니다.
- 마우스를 시설로 다시 가져옵니다.
5화 반즈 미로 (학습)
- 실험 전에 모든 실험 마우스를 행동실에 약 1시간 전에 가져옵니다.
- 이스케이프 박스가 놓인 홀을 제외한 모든 구멍을 닫아 반즈 미로를 준비한다. 플랫폼 중앙에 판지 벽을 배치합니다.
- 두 임플란트모두에서 마우스 한 개를 광원(광케이블의 슬리브)에 연결합니다.
- 실험을 시작하기 전에 마우스가 주위를 실행하지 못하게하는 반즈 미로의 중간에 마우스를 직접 놓습니다.
- 비디오 추적 소프트웨어(예: Ethovision XT)에서 시작하여 판지 제거합니다.
참고: 소프트웨어는 올바른 구멍에 도달할 때까지 마우스를 추적하지만 소프트웨어가 구멍 전환을 인식하지 못하는 경우에 대비하여 수동으로 평가판을 중지할 준비를 합니다. - 미로에서 마우스를 꺼내 라이트 케이블에 대한 연결을 제거합니다.
참고: 마우스당 여러 번의 시험이 있는 훈련의 날인 경우 다음 교육 세션이 시작될 때까지 행동실 옆 대기실에 마우스를 둡니다. 이 테스트 일 마우스 당 하나의 테스트 시험, 시설에 다시 마우스를 가지고.
6. 데이터 분석 (4개의 구별가능한 시험이 있는 예제 오픈 필드 데이터)
- 비디오 추적 소프트웨어(예: 에토비전 XT)
- 데이터 프로필에서 실험 그룹 및 예심을 정의합니다.
- 왼쪽의 데이터 프로파일로 이동하여 처리된 대 컨트롤을 선택합니다.
- 왼쪽 중앙에 새 창에 중첩으로 이동하여 평가판 컨트롤 상태를 선택합니다.
- 요소 작업에서 상태 간격을 선택합니다: 요소 동작으로 트랙을 시작: 빛은 ON 1로 이동합니다.
- 중첩 상자를 필터 상자 처리와 해당 결과 상자 사이에 배치합니다.
참고: 이 정의된 간격은 Off1이며, 이는 빛 자극이 없는 실험의 처음 2.5분을 설명합니다. - 간격 On1에 대한 단계를 반복 (요소 작업에서 : 빛이 요소 동작에 1에 간다: 빛이 1 간다),Off2 (요소 작업에서 : 빛이 요소 빛에 간다 1 에 간다 2)및 On2 (요소 작업에서 : 빛은 요소 동작에 2에 간다 : 정지 트랙).
- 제어 필터 그룹에 대한 4 간격을 반복합니다.
참고: 모든 중첩 상자에는 Off1, On1, Off2, On2라는 이름이 있는 자체 결과 상자가 필요합니다. 이제 치료 및 대조군 모두 별도로 분석되는 4가지 다른 빛 자극 시험으로 나뉩니다.
- 분석 프로파일에서 분석할 매개 변수를 정의합니다.
- 왼쪽의 분석 프로파일로 이동하여 영역 에서선택합니다.
- 영역의 종속 변수를 선택하고 센터를 영역으로 선택합니다.
- 가운데를 두 번 클릭하고 선택한 점을 선택하고 가운데에서만선택합니다.
- 창을 떠나기 전에 평가판 통계로 이동하여 빈도, 누적 기간 및 대기 시간을 먼저 선택합니다.
- 이동된 종속 변수 거리를 추가합니다.
참고: 그룹 통계에서표준 오류 또는 표준 편차를 오류로 사용할지 여부를 선택합니다. 이 프로필을 사용하면 중앙에서 보낸 시간, 센터 항목 및 총 이동 거리를 사용할 수 있습니다.
- 데이터 추출
- 결과로 이동하여 통계 및 차트를 선택합니다.
- 계산을 Calculate 눌러 분석된 데이터를 확인합니다.
참고: 시행 착오 통계는 모든 단일 마우스 및 그룹 통계에 대한 정보를 제공하여 해당 막대 플롯을 가진 4개의 시험으로 나눈 두 그룹의 평균 및 오류를 분석합니다. - 내보내기 데이터를 누르고 평가판 통계와 저장할 위치를 선택합니다.
참고: 내보낸 데이터는 Excel 파일로 저장되며 모든 마우스에 대한 개별 값입니다. 이 Excel 파일에서 Animal-ID는 마우스를 식별하는 데 도움이 됩니다. - 히트맵 시각화로 이동하여 플롯 히트맵을누릅니다.
- 오른쪽에서 시험을 선택하여 모든 마우스 및 평가판에 대한 개별 히트맵을 볼 수 있습니다.
- 마우스를 마우스오른쪽 으로 클릭하고 히트맵을 이미지로 내보냅니다.
- 데이터 프로필에서 실험 그룹 및 예심을 정의합니다.
- 플로팅
- 컴퓨터에서 스프레드시트 파일을 열고 측정된 모든 조건 및 그룹에서 모든 4개의 시험에 대한 수단 및 표준 오류(SEM)를 계산합니다.
- 통계 프로그램(예: 시그마 플롯)에서 그래프를 생성합니다.
- 수단과 SEM을 스프레드시트 파일에서 시그마 플롯에 올바른 순서로 복사합니다. 행은 Off1, On1 등에 대한 데이터를 포함해야 하며 열에는 평가판, 평균 및 SEM이 헤드로 포함되어 있습니다.
- 세 열을 모두 선택하고 그래프 만들기로 이동합니다.
- 막대 상자를 선택하고 오류가 있는 그룹화되지 않은 막대(위쪽 행, 세 번째 상자)를 선택합니다.
- 완료를 통해 확인하여 새 그래프 페이지를 엽니다.
- 전체 그래프에 레이블을 지정한 다음 홈으로이동하여 왼쪽의 그래프 상자를 선택하고 내보내기를누릅니다. 대상 폴더를 선택하고 메타파일(*.wmf)을 형식으로 선택합니다.
참고: .wmf 형식은 CorelDraw와 같은 그래픽 소프트웨어에서 나중에 처리할 수 있습니다.
- 얻은 데이터에 대한 통계를 계산합니다.
- 스프레드시트(Off1, On1 등)에서 원시 데이터를 시그마 플롯의 단일 열로 복사합니다.
- 열을 표시하여 분석으로이동하고 t-test를 선택하고 실행을누릅니다.
- 다음으로 데이터 포맷 Raw를 확인하고 완료로 테스트를 실행합니다.
결과
이 프로토콜의 목적은 광유전학 실험 도중 유전자 변형마우스의 행동에 있는 변경을 측정하는 것입니다. 광유전학 적 조작은 아데노 관련 바이러스 벡터의 주입에 의해 수행됩니다. 자유롭게 움직이는 마우스의 빛 자극은 관심 영역 바로 위에 광섬유의 이식을 통해 가능하다.
도 4에서,광유전학 실험의 결과가 제시된다. ChR2를 통해 IL 지역에서 흥분 피라미드 뉴런의 강력한 활성화는 오픈 필드에서 불안 관련 행동을 증가. ChR2는 피라미드 뉴런에서 발현을 위해 넥스-Cre 마우스에서 mPFC의 IL 부위에 주입되었다(도4A). 두 가지 불안 테스트 동안, 오픈 필드(그림 4B,C)및 참신 억제 먹이 테스트(그림 4F, G),ChR2는 청색 빛으로 자극하고 피라미드 뉴런을 활성화합니다. 대조군으로서, 다른 마우스군은 ChR2 대신 플루오로포레 tdTomato의 주사를받았다(도 4D, G). 이러한 실험에서 불안은 더 밝은 중앙 영역의 회피로 정의됩니다. 마우스는 포식자의 염려 때문에 열린 지역의 본질적인 회피를 보여줍니다.
도 4B에도시된 오픈 필드 실험에서 마우스는 각각 5분의 4의 시험을 실행하였다. 시험에서 1 및 3에서는 빛 자극이 발생하지 않았고(Off1,2) 및 시험 2 및 4에서는 20Hz(5ms 광 펄스) 및 1mW 강도(On1,2)로 청색광 자극이 수행되었다. 히트맵은 실험 그룹에서 오프와 온 시험 사이에 중심 기간이 다르다는 것을 보여줍니다. 빛 자극 동안, 마우스는 우선 국경 영역에 머물. 제어 동물은 또한 국경을 선호하지만, 빛 자극에 자신의 행동을 변경하지 않습니다. 도 4C에서,개방 필드 실험 중 의 주요 행동 측정은 실험 군에 대해 도시된다. 데이터가 정상성을 위해 Shapiro-Wilk 테스트를 통과한 경우, 통계는 독립적인 두 꼬리 t-test로 수행되었습니다. 정상 시험에 실패하면 Mann-Whitney-Rank Sum 테스트가 비 파라메트릭 대안으로 사용되었습니다. 이러한 종류의 실험에 대해, 그룹 내 비교는 빛 자극이 실험 및 대조동물의 기준선 불안과 는 무관하게 시간이 지남에 따라 불안 행동을 직접적으로 바꿀 수 있는지 조사하기 위해 선택되었다. 센터 기간은 두 빛 자극 시험 도중 현저하게 감소했습니다, 증가한 불안 수준을 나타내는. 이동된 총 거리는 변경되지 않았으며, 운동 동작이 영향을 받지 않음을 보여 주어. 센터 엔트리수는 크게 증가하지는 않았다. 도 4D에서제어 그룹의 데이터가 표시됩니다. 대조군 동물은 분석된 매개변수중 Off와 On 예심 사이에 어떠한 행동 변화도 표시하지 않았으며, 빛 자극이나 이식이 관찰된 효과를 일으키지 않았다는 것을 보여준다. 요약하자면, 이 시험은 ChR2를 통해 IL 피라미드 뉴런의 빛 자극 도중 증가한 불안을 보여줍니다.
도 5에서,실패한 광유전학 실험의 데이터는 고상승 플러스 미로를 위해 도시된다. 도 5A에제시되는 고액 플러스 미로 실험 동안, 마우스는 각각 3 분의 6 시험을 완료했다. 시험 1, 3 및 5 에서 빛 자극이 수행되지 않았다 (Off1, Off2, Off3) 및 시험에서 20 Hz (5 ms 빛 펄스) 및 1 mW 강도 (On1, On2, On3)와 청색 광 자극이 수행되었다. 이러한 예시적인 결과에서, 광유전학 프로토콜의 길이와 미로 자체의 시공은 형질형 마우스 라인에 적합하지 않았다. 도 5B에서,몇몇 마우스가 그들의 뒤발로 미로에서 미끄러졌거나 심지어 아래로 떨어졌다는 것을 볼 수 있습니다. 이런 일이 일어났을 때, 마우스는 하루 후에 EPM을 능력을 발휘할 수 있는 두 번째 기회를 얻었습니다. 만약 그들이 다시 쓰러졌다면, 그들은 분석에서 제외되었다. 마우스가 여러 번 미끄러졌지만 미로에 머무를 수 있었던 경우, 데이터는 정상적으로 분석되었습니다. 그럼에도 불구하고, 데이터는 매우 신중하게 해석되어야하고 제어 동물은 더 큰 중요성을 얻을 수있다. 넥스-Cre 마우스는 좁은 열린 팔에 머무르는 데 어려움을 겪었습니다. 이를 피하기 위해 높이가 1cm인 작은 벽은 미로의 팔에 뒷발을 안전하게 잡는 데 도움이 되었을 것입니다. 히트맵과 그래프 모두 실험뿐만 아니라 대조마우스가 시험 2(On1)에서 열린 팔을 피하기 시작했다는 것을보여준다(그림 5C-E). 열린 팔 항목과 마찬가지로 두 그룹 모두에 대해 두 그룹의 경우 팔을 벌리는 시간이 크게 줄어듭니다. On1 시험 기간 동안 개방팔 및 개방암 항목에 대한 시간이 현저히 감소함에 따라 광 자극의 큰 항불안 효과를 연루시키는 데이터만 을 획득한 실험군을 분석한다. 그러나, 이 데이터를 동일한 동작을 보이는 대조군에 비교할 때, 관찰된 동작은 광유전학 자극에 의해 중재되지 않고, 미로에 대한 습관으로 인해 일반적으로 열린 팔의 회피에 의해 서두르는 것이 분명해진다. 이 데이터는 광유전학 자극및 가능한 행동 적응에 의해 매개되는 행동 효력을 구별하기 위하여 적당한 통제 단의 중요성을 강조합니다. 또한 이 데이터는 특정 무스 라인과 실험 적 질문에 맞게 실험 설정을 올바르게 조정하는 것의 중요성을 조명합니다.
수집된 행동 데이터를 검증하고 강화하기 위해 마우스의 뇌는 올바른 주입 및 이식을 제어하기 위해 마지막 실험 후에 제거됩니다(도6). 뇌는 4% 파라포름알데히드로 고정되어 두개골에서 제거됩니다. 뇌는 1-2 일 동안 30 % 자당에서 탈수되고 나중에 냉동 슬라이스됩니다. 40 μm 두께의 관상 동맥 뇌 슬라이스는 세포 핵을 얼룩지게 하는 DAPI를 함유한 마운팅 배지를 사용하여 슈퍼프로스트 객관적 슬라이드에 세척및 장착됩니다. 이를 통해 관상 슬라이스의 대상 영역을 식별할 수 있습니다. YFP 태그 또는 tdTomato 자체의 형광은 바이러스 주입의 위치를 나타냅니다. 도 6B에서 왼쪽(노란색)에 ChR2-YFP의 예시주입 부위를 제시하고, 오른쪽에 있는 tdTomato(빨간색)이 제시된다. Paxinos와 프랭클린45 마우스 뇌 아틀라스에서 적응 된 템플릿의 도움으로 IL 영역을 식별 할 수 있습니다. 두 슬라이드에서, 광유전학 공구는 IL 지구에서, 그러나 또한 인접한 두뇌 지구에서 표현됩니다. 적절한 해석을 위해 뇌 조직에서 청색광의8 확산을8(도 1D, E)에상담한다. 청색광이 섬유 팁(도 1D의블루 라인) 8에서 초기 1mW 광강도의 5% 미만만으로 IL 아래 DP 영역에 도달할 것으로 볼 수있다. 또한, 소량의 빛은 백산란(47)으로인해 PrL 영역으로 위쪽으로 올라갈 수 있다. 따라서 IL 영역이 가장 강하게 조명되고 있다고 말할 수 있지만 DP 및 PrL 지역과 같은 인접 지역도 약간 자극될 수 있습니다. 따라서, IL-세포 특이적 자극은 보장되지 않으며 인접한 지역의 면역히스토화학적 분석이 수행되어야 하며, PrL 및 DP 세포의 활성이 빛을 통해 변조되는지 확인한다. 도 6C에서,또 다른 중요한 컨트롤이 나타난다: 넥스-크레 마우스 라인의 특이성. IL 영역에서 두 세포 유형에 대 한 염색 항 체를 통해, 글루타머지 원리 뉴런과 GABAergic interneurons, 그것은 볼 수 있습니다., ChR2-YFP 발현 은 글루타머기 뉴런에서만 발생 하 고 GABAergic 것 들.
모두 모두, 우리의 실험은 행동 테스트 도중 광유전학 조작으로, 불안 관련 행동에 있는 변경이 관찰될 수 있었다는 것을 보여줍니다. 동일한 동작에 대해 두 개 이상의 테스트를 사용하면 신뢰할 수 있는 결론을 도출할 수 있습니다. 또한, 면역히토화학 분석은 얻어진 데이터를 확인한다. 우리의 실험은 제안, 인프라 피질에서 피라미드 뉴런의 특정 활성화는 특정 연구약에서 불안 관련 행동을 증가.
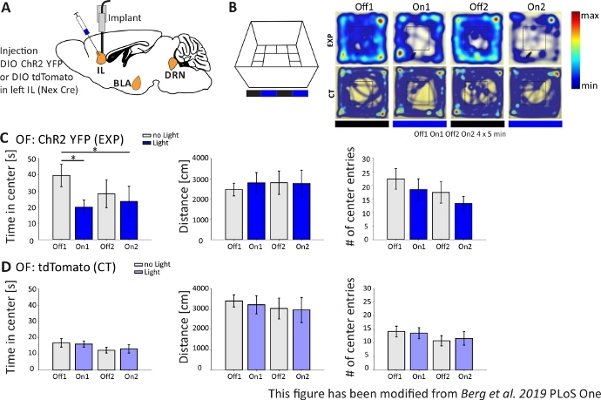
그림 4: IL 피라미드 뉴런의 광유전학 활성화는 불안 행동을 증가시킵니다. 실험 중 빛 자극: 473 nm, 1 mW, 20 Hz 자극. A)ChR2-YFP 또는 tdTomato을 위한 주입 및 이식 부위의 회로도 도면이 IL에 들어갑니다. 실험 중, mPFC의 IL 영역에서 피라미드 뉴런은 ChR2에 의해 활성화된다. Paxinos와 프랭클린 마우스 뇌 아틀라스에서 적응 된 처진 뇌 조각, 처진 : 측면 o,6. B)빛 자극 프로토콜 (20 분 4x5 분 교대 및 시험; 왼쪽) 및 예시 ChR2 주입 (EXP)의 열지도 및 tdTomato 주입 (모든 실험). EXP 동물은 파란색 레이저 빛으로 자극 할 때 OF의 중심에 적은 시간을 보낸다. CT 동물의 경우, 센터에서 보낸 시간은 빛 끄기와 시험 중사이에 다르지 않습니다. C)OF, n=11내의 EXP 동물에 대한 그룹 데이터. 마우스는 청색광으로 자극할 때 OF의 중앙에 훨씬 적은 시간을 소비합니다 (Off1 39.49±6.9 s, On1 19.87±4.47 s, Off2 28.13±8.55 s, On2 23.42±9.32 s, Off1:On1, t-test, p =0.03* Off1:On2, MWRS, p=0,049, *). 이동거리는 영향을 받지 않는다(Off1 2703.09±292.65cm, On1 3113.4±491.15cm, Off2 3331.86 ±482.62cm, On2 3082.17±658,61cm). # 센터 항목은 시간에 따라 감소하지만, 큰 차이를 표시하지 않습니다 (오프 1 22.36±3.78, On1 18.45±3.95, Off2 17.36±1.99, On2 13.27±2.64). D)OF, n=15에서 CT 동물에 대한 그룹 데이터. 시간 마우스는 OF의 중심에 지출, 거리 이동, 센터 항목의 #은 빛 온과 오프 시험 사이에 변경되지 않습니다 (센터 Off116.73±2.65 s, On1 16.02±1.89 s, Off2 12.02±1.76 s, On2 13.04±2.58 s; 거리 Off1 3399.69±296.77cm, On1 3210.6±446.9cm, Off2 3030.28±513.83cm, On2 2955±617.7cm; # 센터 엔트리 Off1 14.2±1.98, On1 13.6±2.02, Off2 10.8±1.88, On2 11.67±2.5). CT 마우스는 상당히 높은 기준선 불안을 보여줍니다 (Off1 EXP:CT, MWRS, p=0.005, **). 값은 평균±S.E.M. * 상당한 차이 (p≤0.05)를 나타내며, ** 상당한 차이 (p≤0.01)를 나타냅니다. t-테스트 항상 두 꼬리, MWRS: Mann-Whitney 랭크 합계 테스트; IL: 인프라 피질; BLA: 바소포탈 편도체; DRN: 등쪽 라페 핵; OF: 오픈 필드; CT: 동물 제어; EXP: 실험 동물; L: 빛. 이 수치는 Berg 외. 2019, PLoS One43 및 Berg 201948에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
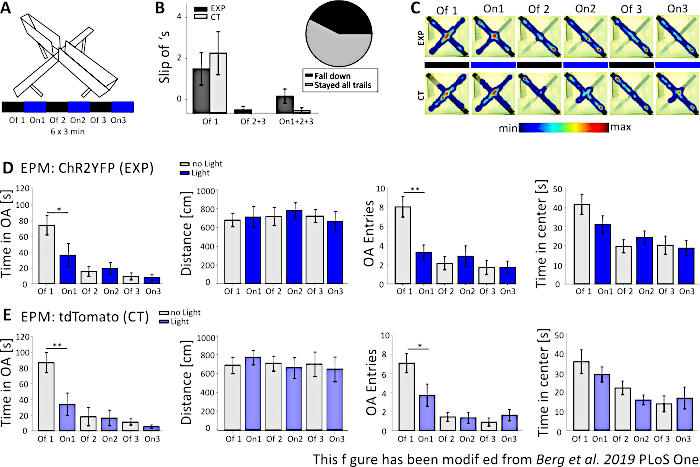
그림 5: EPM 실험은 넥스-Cre 마우스에서 행동 효과를 보여주지 못했습니다. 실험 중 빛 자극: 473 nm, 1 mW, 20 Hz 자극. A)빛 자극 프로토콜 (18 분, 6x3 분, 교대 및 시험)과 높은 플러스 미로. B)"미끄러짐"이 데이터, 총 n=23에 포함된 마우스에 대한 그룹 데이터가 포함된다. 넥스-Cre 마우스는 실험군(왼쪽)과 는 별개로 등발로 열린 팔에서 미끄러지는 경향이 있었다. 모든 6 예심을 위한 미로에 머물렀던 마우스만 나중에 분석에서 고려되었습니다. 첫 번째 Off1 단계에서 슬립 오프는 오픈 암의 나중에 회피하는 이유입니다 (Off1 EXP 1.63±0.6, CT 2.2±0.79, Off2+3 EXP 0.125±0.125, CT 0±0, On1+2+3 EXP 0.625±0.26, CT 0.± 10). 원형 차트(오른쪽)는 42.42%로 18분 동안 미로에서 떨어지는 마우스를 나타낸다. 57.57%만이 실험을 마쳤습니다. C)실험의 모든 6 시험에서 모범적인 EXP 및 CT 마우스의 열지도. 두 그룹 모두 Off1 재판 후 열린 팔 지속 시간이 감소하는 것으로 나타났습니다. D)EPM, n=12에서 EXP 동물에 대한 그룹 데이터. 첫 두 번의 시험 에서 팔을 벌려 보낸 시간은 크게 감소했으며 그 후 지속적으로 감소했습니다 (Off1 73.91±12.22 s, On1 36.15±14.65s, Off2 15.61±6.23 s, On2 19.49±7.51 s, Off3 9.36±4.44s, On3 7.96±3.47 s. Off1:On1, t-test, p=0,041, *). 이동거리는 영향을 받지 않는다(Off1 679.96±71.63cm, On1 712.24±12.82cm, Off2 717.49±97.39cm, On2 782.51±81.11cm, Off3 722.11±68±.60cm, 66.66cm). 오픈 암 엔트리의 양은 Off1에서 On1로 크게 감소한 다음 일정하게 유지됩니다(Off1 8.08±1.08, On1 3.33±0.76, Off2 2.16±0.69, On2 2.91±1.09, Off3 1.73±0.75, On3 1.73±0.66. Off1:On1, t-테스트, p=0.002, **). EPM의 중심에 소요된 시간은 시련을 따라 감소하지만 오프에서 온 시험(Off1 41.71±5.34s, On1 31.2±4.59s, Off2 19.89±3.44s, On2 24.49±3.38s, Off3 20.37±4.07.± 07)에서 큰 차이를 보이지 않습니다. EPM,n=11에서 CT 동물에 대한 그룹 데이터. CT 데이터는 실험이 제대로 작동하지 않았다는 것을 나타내는 EXP 데이터와 동일한 현저한 감소를 나타낸다(열린 팔의 시간 Off1 86.92±12.74s, On1 33.78±14.38 s, Off2 18.01±11.61 s, On2 16.41±9.61 s, Off3 11.36±4.01 s, On3 5.43±2.07 s. Off1:On1, MWRS, p=0.009; 거리 Off1 705.11±88.36 cm, On1 789.45±77.53 cm, Off2 724.74±80.49cm, On2 676.57±11.99 cm, Off3 716.99±132.47cm, On3 66.99±132.47cm, On3 663.03.03.03± 오픈 암 엔트리 Off1 7.09±1, On1 3.72±1.17, Off2 1.45±0.47, On2 1.36±0.58, Off3 0.91±0.43, Off3 1.64±0.59. Off1:On1, MWRS, p=0.01, *; 센터 Off1 35.89 s, On1 29.25±3.96 s, Off2 22.17±3.58 s, On2 15.9±2.57s, Off3 13.86±4.2s, On3 16.89±5.75 s). 값은 S.E.M. * ± 의미하며 상당한 차이(p≤0.05)를 나타내며, ** 상당한 차이(p≤0.01)를 나타냅니다. t-테스트는 항상 두 꼬리, MWRS: Mann-Whitney 랭크 합계 테스트; EPM: 고급 플러스 미로; CT: 동물 제어; EXP: 실험 동물; OA: 팔을 벌려. 이 수치는 Berg 외. 2019, PLoS One43 및 Berg 201948에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
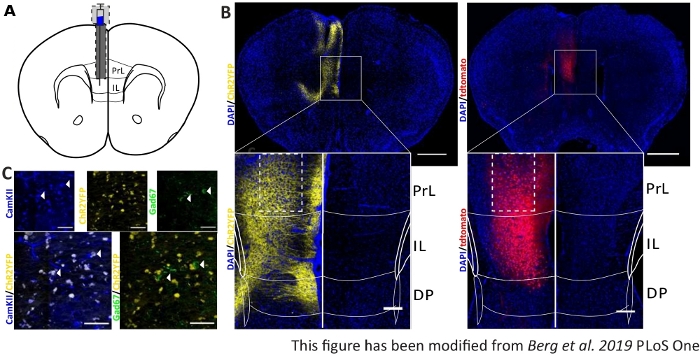
그림 6: IL 및 넥스-Cre 특이성에서 ChR2 및 tdTomato의 주입 측. A)AP + 1.66mm, mL 0.3mm, DV -1.8mm의 관상 동맥 에 이식 부위의 회로도 도면, 일방적인 주입 및 이식(마우스 뇌 아틀라스, 팍시노스 및 프랭클린, 브레그마 +1.54mm에서 적응). B)넥스-크레마우스에서 DAPI 염색 세포 핵(blue)과 합병된 ChR2-YFP(왼쪽, 노란색) 및 tdTomato(오른쪽, 빨간색)의 예시적인 주사 부위. 스케일 바 1mm. 인셋은 IL 영역의 높은 배율을 보여줍니다. 스케일 바 150 μm. 흰색 상자는 인셋의 위치를나타냅니다. C)상단 행: Nex-Cre 마우스의 왼쪽 IL 영역의 공초점 이미지는 Nex-Cre 마우스의 GABAergic 뉴런(green)에 대한 마커로서 CamKII로 염색된 글루타머기뉴런(blue), ChR2-YFP(노란색) 또는 Gad67을 위한 마커로 염색했다. 맨 아래 줄: CamKII (왼쪽, 파란색)와 ChR2-YFP (노란색)의 공동 지역화(왼쪽, 파란색),하지만 Gad67(오른쪽, 녹색)과는 달리 글루타마테어릭 뉴런용 넥스-크레 마우스의 특이성을 나타낸다. 스케일 바 50 μm. PrL: 전두엽 피질; IL: 인프라 피질; DP: 등받이 받침대 피질. 이 수치는 Berg 외. 2019, PLoS One43 및 Berg 201948에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
신경 신호를 조작 하기 위해 빛을 사용 하 여 지금 거의 10 년 동안 선택의 방법 되었습니다. 2005년 이후, 새로운 광유전학 적,도구,,,4,6,8,814,49,,50, 51 및 이러한 도구가 뇌 회로21, 23,,,50,40,,43,52,높게 증가한 뇌 회로를 조사하는 데 사용되는 연구 결과에 대한 출판 된 기사의 수가 매우 증가했습니다.43 한편으로는 주 사용 가능한 광유전학 도구, 이식 변형, 형질전환 마우스 라인 및 행동 실험의 엄청난 다양성으로 실험 가능성은 다양하고 무제한입니다. 다른 한편으로는, 실험 조건을 선택에 있는 결함을 만드는 가능성은 아주 높고 실험은 너무 구체적입니다, 수시로 그밖 연구 결과와 비교하기 어렵습니다.
중요한 단계
이 프로토콜의 중요한 한 가지 중요한 단계는 적절한 계획입니다. 광유전학 적 도구의 선택은 과학적 질문과 일치해야합니다. 뉴런이나 시냅스의 전반적인 활동을 조작하는 것만 필요합니까? 그런 다음 상업적으로 ChR221,,25, 27,및 아치37과 같은 도구를 제공하는 것이 좋습니다.37 그러나 그 외에도 하나의 특수 신경 전달 물질 시스템 또는 단일 수용체를 조작해야하는 경우 개별 수용체 키메라는 종종 더 나은 선택3,,6. GPCR을 가진 몇몇 수용체 키메라, 소위 Opto-XRs 및 그(것)들을 생성하는 지침은 이미4유효4,50입니다. 광유전학 적 도구의 선택 이외에, 행동 실험과 함께 마우스 라인도 중요합니다. C57Bl/6 및 BALB/cByJ와 같은 다른 배경 균주는 어떤 면에서 다른 행동 표현형을표시53,,54. C57Bl/6 마우스는 낮은 기준선 불안을 가지고 있고 완화성 조작에 사용될 수 있는 반면, BALB/cByJ는 더 높은 불안 수준을 보이고 따라서 완화제에 더 민감합니다. 또한, 이러한 배경 균주의 형질 변형은 또한 자신의 표현형(48)에서다를 수 있습니다. 광유전학 공구 및 형질전환 마우스 선과 더불어 특정 프로모터의 적당한 조합으로, 거의 모든 원하는 세포 인구는 표적으로 할 수 있습니다.
수술 중 중요한 단계는 올바른 위치를 대상으로하는 것입니다. 마우스 뇌 아틀라스의 도움으로 전방 후방 축및 내측 축및 구조의 깊이에 대한 적절한 좌표가45를확립할 수 있다. 현실에서, 모든 두개골은 약간 다른 형태와 크기를 가지고있다. 따라서, 입체 좌표를 조정하는F-factor(46)는 입체 수술 중 코와 귀 고정이 올바른 것과 마찬가지로 매우 중요하다. 마우스의 머리가 기울어지면, 사출 카눌라가 원하는 관심 영역을 대상으로 하지 못합니다.
또한, 사출 카누의 직경도 중요합니다. 너무 작으면 조직이 너무 넓으면 카눌라가 관심 지역으로 가는 길에 바이러스 용액을 누출할 수 없습니다. 이식된 광섬유가 표적 영역 바로 위에 종료되면 위의 피질 영역에서의 바이러스 발현은 중요하지 않습니다. 그러나 임플란트가 축삭 단자자극을 다른 부위 위에 배치하면 상부 피질 영역의 축삭도 빛에 의해 활성화되고 얻어진 데이터를 위조한다. 예를 들어: IL 영역과 전두엽(PrL) 영역은 모두 기저편도체(55)56, 56으로 진행되지만불안(26),57의변조에 완전히 다른 기능과 역할을 가지고 있다., 임플란트가 IL 영역에서 축축단을 활성화하기 위해 편도체 위에 배치되고 주사 바이러스 용액이 잘못된 주입 카눌라로 인해 PrL에 배치된 경우 PrL에서 축축 단자가 활성화될 위험이 매우 높다.
임플란트의 고정을 위해 두개골을 준비하는 동안, 프라이머와 결합의 희소한 사용은 안정적이고 내구성있는 고정에 매우 중요합니다. 2성분 접착 시스템이 얇게 적용되지 않으면 치과 시멘트가 며칠 또는 몇 주 후에 두개골에서 분리될 수 있습니다. 또한, 두개골은 그렇지 않으면 시멘트가 두개골에 제대로 부착되지 않기 때문에 임플란트를 고정하기 전에 완전히 건조해야합니다.
중요한 단계는 이 프로토콜의 동작 부분에도 존재합니다. 첫째, 미로의 건설은 매우 중요합니다. 모든 행동 설정에서, 몇몇 변종은 크기와 양식에 관하여 문헌에 존재할 뿐만 아니라 절차 자체58,,59,,60에대해 존재한다. 데이터를 비교하고 재현할 수 있도록 하는 변형을 선택하는 것이 중요합니다. 또한, 활용 마우스 라인에 대한 특별한 요구 사항은고려43,,48. EPM에 대한 대표적인 데이터에서 몇몇 넥스-Cre 마우스가 미로에서 떨어졌거나 여러 번 미끄러졌다는 것을 알 수있다(도 2b). 이 마우스를 위해, 열린 팔 주위에 작은 벽이 있는 미로는 더 나은 대안이었을 것입니다.
둘째, 모든 외부 실 조건을일정하게유지하는 것이 중요하며, 그렇지 않으면 다른 마우스 그룹은 전혀 비교할 수 없을 것이다. 이와 관련하여 실험 용 설정이 비어 있고 실험자가 항상 존재하는 것으로 실험 시간을 선택하는 것이 매우 중요합니다. 또한, 수집된 데이터와의 간섭을 피하기 위해 시공 작업, 시스템(화재 경보) 또는 마우스 시설의 청소일과 같은 건물의 사건을 고려해야 합니다.
마지막으로, 처리 및 주거 조건은 행동 실험에 매우 중요합니다. 이식이 수행될 때, 마우스는 그밖 마우스에서 상해의 리스크 때문에 단 하나 수용될 필요가 있습니다. 그룹 간의 비교도가 좋고 한 그룹 내에서 낮은 오류를 보장하기 위해 모든 마우스는 동일한 케이지 크기와 보강이 필요합니다. 불안 관련 실험에 대 한, 단일 하우징 은 singe 집 수 컷 쥐 낮은 기준선 불안 수준을 보여 으로 몇 가지 장점이 있다, 그들의 불안 수준에 적은 변화, 덜 우울 같은 증상15,,16. 그룹 수용 남성 마우스 쥐 쥐 중 계층 구조 때문에 그들의 불안 수준에서 강하게 다를 수 있습니다. 하우징 외에도 모든 마우스와 그룹의 상수 및 동등한 취급도 중요합니다. 임플란트의 광섬유를 연결하기 위해 마우스를 잡는 것은 매우 스트레스가 됩니다. 따라서 이 절차는 동일한 기술과 동일한 실험자가 의미하는 모든 마우스에 대해 동일해야 합니다. 또한, 스트레스가 많은 연결 절차에서 마우스를 진정시키기위한 대기 케이지의 습관 시간은 미로에 지속 시간, 쓰레기 및 위치의 동일한 조건이 필요합니다. 마우스 시설 내의 처리는 이후 행동 성능에도 중요합니다. 실험 및 제어 동물은 다른 일 또는 다른 사람들에 의해 청소 해서는 안, 이것은 또한 쥐에 대 한 스트레스. 또한, 청소 일은 행동의 차이를 피하기 위해 실험적인 날이 되어서는 안됩니다.
문제 해결
프로토콜 중에 발생할 수 있는 몇 가지 문제가 있습니다. 예를 들어, 스테레오테틱 수술 중 두개골 전체를 드릴링하면 혈관이 손상될 수 있습니다. 일반적으로, 강한 출혈이 발생, 특히 bregma와 람다 위에. 이 경우, 그들은 그들의 흡수성 때문에 용기에서 더 많은 출혈을 확장 하는 경향이 면 스틱으로 출혈을 중지 하려고 하지 마십시오, 대신, NaCl와 직접 헹구는.
또한 바이러스 용액의 압력 주입이 작동하지 않는 것을 발생할 수 있습니다. 이 경우, 버 구멍이나 뇌 조직에서 딱지 인 파라 필름이 카눌라의 끝을 막고있을 수 있습니다. 이 경우 x 축 또는 y축을 변경하지 않고 뇌에서 천천히 카누를 제거하고 트위저를 사용하여 카눌라 팁의 앞부분의 1-2mm를 제거합니다. 카누라를 다시 낮추기 전에 소량의 압력을 가하여 바이러스가 카눌라 팁에서 나오는지 확인하여 기능을 테스트합니다. 변비를 피하기 위해, 일정한 속도로 카누라를 낮추고 주입 측의 깊이에 도달 할 때까지 움직임을 중지하지 않습니다. 카눌라 팁의 너무 많은 제거 하 고 직경이 너무 큰 경우, 카눌라 조직을 손상 하 고 한 번에 바이러스를 적용의 위험이 증가 될 것 이다. 따라서 팁의 막힌 부분만 신중하게 제거되었는지 확인합니다.
행동 실험 중에 비디오 추적 소프트웨어(예: Ethovision XT)에서 실험을 설정하면 문제가 발생할 수 있습니다. 예를 들어 광 출력이 제대로 작동하지 않으면 여러 가지 이유로 인해 이 때문일 수 있습니다. 펄스는 Ethovision XT가 열리기 전에 열고 프로그래밍하고 시작해야 합니다. 하드웨어는 "실험 설정"(단계 3.2.2.4)에서 올바르게 선택해야 합니다. 잘못된 IO-Box 또는 "의상 하드웨어"이외의 다른 항목이 선택된 경우 Pulser 장치는 Ethovision에서 제어할 수 없습니다. 라이트 출력 테스트가 성공했지만 "평가판 제어 설정"의 프로그래밍된 라이트 프로토콜이 획득 하는 동안 작동하지 않는 경우 하위 규칙 또는 하위 규칙 참조가 잘못 위치하거나 조건 및 작업이 명확하지 않을 수 있습니다. 예를 들어 참조가 올바른 하위 규칙에 속하는가? 참조가 올바르게 프로그래밍되었습니까(예: 하위 규칙이 실행되는 빈도)?
또한 "탐지 설정"중에 동물이 적절하게 추적될 수 있지만 수집 중에 피사체가 발견되지 않는 샘플이 있습니다. 이 경우 실험실의 조명이 변경되었는지 또는 미로 내에서 원치 않는 그림자가 생성되었는지 확인하십시오. 미로의 전체 하단은 하나의 특정 조합에 대해서만 작동하므로 동일한 색상을 가져야 합니다. 다른 바닥 색상이나 그림자를 피할 수 없는 경우 미로의 가장 어두운 부분에서 감지 설정을 정의합니다.
첫 번째 동물을 수집한 후 설정을 변경하려면 이미 사용된 설정에 이러한 변경 내용을 적용하지 마십시오. 그들을 복제하여 조정합니다. 이는 이미 기록된 평가판이 데이터 분석을 위해 더 이상 유효하지 않다는 것을 의미합니다. 이러한 경우 이 실험 그룹에 대한 모든 동물을 원래 설정으로 기록하고, 나중에 녹화된 비디오가 실시간 추적 대신 분석되는 새로운 실험을 만듭니다. 이 "비디오에서" 실험에서는 동물이나 데이터 간의 비교도를 잃지 않고 분석에 여러 설정을 사용할 수 있습니다.
제한 사항 및 향후 응용 프로그램
자유롭게 움직이는 동물에 있는 광유전학으로 행동을 조작하는 이 방법은 또한 한계를 포함합니다. 수술 중에는 두 임플란트의 근접이 제한됩니다. 이중 이식의 경우, 두 임플란트 사이의 거리는 임플란트를 보유하기 위한 장치의 폭이어야 한다. 장치는 첫 번째 임플란트가 이미 고정되어있는 동안 두 번째 임플란트를 버 구멍으로 낮출 필요가 있습니다. 이를 위한 해결책은 유리 섬유의 끝이 매우 가까우며 두개골 위의 세라믹 ferules는,23,55,,56,57,,62,,63의거리가 더 큽니까., 각진 이식의 단점은 빛이 퍼지는 것입니다. 섬유 팁이 바로 위에서 비스듬히 기울어지면 자극 영역이 다릅니다. 근접한 두 대상 영역의 경우 빛 자극의 변경된 위치를 고려해야 합니다.
행동 실험 중에 미로의 시공이 동물에 연결된 광 케이블을 방해할 수 있습니다. 밝은 어두운 상자와 같은 일부 행동 테스트에는 실내 영역64,65및기타 미로에는 마우스가 입력해야 하는 구획이 포함되어 있습니다. 이러한 실험은 이 설정으로 수행할 수 없습니다. 또는 무선 시스템이 옵션22,,26,,66이될 수 있습니다. 그러나 다행히 반스 미로와 같은 일부 미로는 마우스가 관련구획(67)에들어갈 수 있도록 이러한 방식으로 배열될 수 있다.
닫힌 구역이있는 것 외에도 너무 넓은 미로도 문제가 발생할 수 있습니다. 미로 영역이 클수록 케이블이 길어질수록 동물이 미로의 모든 위치로 이동하도록 허용해야 합니다. 동물이 케이블을 밟거나 잡아 서 그것을 물린 수 없습니다 주의 해야 합니다. 이에 대한 해결책은 중복 케이블을 롤업하는 구성일 수 있습니다. 단점은 케이블을 풀기 위해 드래그가 마우스에 대해 어렵다는 것입니다. 이 해결책은 쥐에게 더 적합할 것입니다. 또 다른 가능한 옵션은 실험 중에 아니라 사전에 빛 자극을 수행하는 것이 가능할 수 있으며, 물론 빛 자극으로 인한 장기적인 효과가23으로인해 발생할 경우에만 가능합니다.
기존/대체 메서드와 비교
대체 방법은 동작8,,18동안 화학적 또는 전기 자극이 될 것이다. 화학 작용제 또는 길항제는 특정 수용체를 통해 뉴런을 활성화하거나 침묵시킬 수 있으며 단일 신경 전달 물질 시스템38,,68을조작할 수도 있다. 한편으로는, 수용체 특이성은 화학물질에 대해 매우 높다, 특정 고뇌주의자 또는 길항제만 특정 수용체를 활성화하기 때문에(39). 한편, 동일한 신경전달물질 그룹의 수용체 특수형에 대한 특이성은 종종 불충분하다. 대부분의 화학 물질은 서로 다른 확률69를가진 적어도 두 개의 하위 유형에 결합합니다. 추가적으로, 화학 물질은 같은 수용 체 유형을 소유 하는 한 신경 세포 유형 사이 구별할 수 없습니다. 이 외에도, 시간적 및 공간 적 해상도는 광유전학에 비해 화학 적 조작에 대한 가난한. 작용제 또는 길항제는 종종 구두로투여35 또는 전신 주사를 통해57,,70. 화학 물질의 주입이 뇌 조직에서 직접 수행되는 경우, 효과는 구강 응용 프로그램보다 빠르게 나타납니다, 하지만 여전히 가벼운 자극보다 느린 기간에. 투여 된 화학 물질은 뇌에서 확산되고 신경 유형 이나 뇌 영역에 특이 하지 않은, 특정 뇌 회로의 조작 은 불가능.
전기 자극은 화학 자극9,,14보다더 높은 측두성 분해능을 가지게 한다. 신경 조직 내의 확산은 화학 자극보다 적으며 공간 해상도는 화학 자극보다 낫습니다. 그러나, 전기 자극은 전극에 근접한 모든 뉴런이 전기 자극에 반응하기 때문에 다른 뉴런 세포 유형 또는 수용체 유형을 구체적으로 해결할 가능성이 부족하다.
마우스를 자유롭게 움직이는 마우스의 행동에 대한 대체 방법은 예를 들어 뇌 슬라이스의 전기 생리학적 기록이며, 여기서 단일 뉴런 또는 축축은 광유전학으로 변조될 수 있고 유도된 효과는 전극6,,71을기록하여 측정될 수 있다. 시험관 내 실험은 광유전학 자극의 분자 및 세포 기초를 조사할 가능성을 제공하지만 다른 뇌 영역의 본질적인 연결성 및 입력이 누락되는 한계가 있습니다. 또 다른 옵션은 다광 화상 진찰1,,72와함께 광유전학을 사용하는 것입니다. 이 경우 마우스는 머리를 고정하고 마취하거나 간단한 작업을 해결하기 위해 깨어있을 수 있습니다.
성공적인 광유전학 실험을 수행하기 위해, 도구와 응용 프로그램의 넓은 범위는 요즘 사용할 수 있습니다. 광유전학 적 도구의 선택과 행동 설정은 특정 연구 질문에 대답하는 데 중요합니다. 도구와 실험의 올바른 조합을 선택하면 광유전학은 높은 시간적 및 공간 해상도를 가진 신경 회로에 대한 전례없는 심층조사를 허용합니다. 이것은 정신과 질병 및 인식에 대한 새로운 치료 전략을 이해하고 개발하는 데 도움이 될 것입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
클라우스-아르만 나르브 교수와 산드라 괴벨스 박사(막스 플랑크-실험 의학 연구소, 괴팅겐, 독일)에게 감사드리며 넥스-크레마우스를 친절하게 제공합니다. 또한, 이 기사에 대한 JoVE 비디오의 녹화 및 처리에 대한 비디오 팀 유누스 디키치와 루벤 비스너에게 감사드립니다. 또한, 크리스틴 클라우센이 보이스오버를 한 것에 대해 큰 감사를 표하고 킴벌리 앤고는 원고를 교정해 주셔서 감사합니다.
제시된 결과는 보훔의 루르 대학교에서 입수되었으며 비디오는 브레멘 대학교에서 녹화되었습니다.
이 작품은 도이치 포르충스게마인샤프트(DFG, 독일 연구재단)-프로제크트넘머 122679504 - SFB 874 및 DFG MA 4692/3-2에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Ketamin | Sigma-Aldrich | K2753-64 | Anestasia |
| 20 % Glucose | AlleMan Pharma | Injection s.c. for fast recovery | |
| Behavioral mazes | Costum made | Measure anxiety | |
| Bepanthen | Bayer | Ophthalmic oinment | |
| Betaisodona | Monodipharma | Sterilant containing iodine | |
| Betaisodona | Monodipharma | Iodine oinment | |
| Binocular | Olympus | SZ52, 110AL0.62x WD160 | Surgery |
| Ceramic ferrules | Thorlabs | CFLC230-10 | Implant |
| Ceramic Fiber Scribe | Thorlabs | CSW12.5 | Cutting of the glass fiber |
| Channelrhodopsin2-YFP virus | Penn Vector Core | Addgene 20298 | Optogenetic tool |
| Compressed air | Kontakt Chemie | Druckluft 67 | Drying of the skull |
| Coordinate system | Stoelting | Stereotactic coordinates for the surgery | |
| Correl Draw | Graphical software version 13 | ||
| Cryoslicer | MICROM | HM500OM | Production of brain slices for staining |
| Ethovision XT 14 | Noldus | Software for behavioral tracking | |
| Exel | Statistical Software | ||
| Ferrule Polishing Puck | Thorlabs | D50-F | Polishing implants round side |
| Fiber Patch Cord dual | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cables, which are connected with the two implants of a bilateral implantation |
| Fiber Patch Cord single | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cable, which is connected with the implant via a sleeve |
| Fiber Stripping Tool | Thorlabs | T06S13 | Stripping glass fiber for implant |
| Filter paper | VWR European | 516-0300 | Cut into pieces for the Novelty-Suppressed Feeding test |
| Food pellets | Mühle Levers | Höveler Nagerfutter | Nutrition for the mice |
| Glass pipettes | Harvard Apparatus | GC150-10 | Injection pipettes |
| Gradia direct-Flo | Henry Schein | 103322 | Fluid dental cementum |
| Heating lamp | efbe-Schott/Phillips | R95E | Prevent the mice from cooling after the surgery |
| Heating plate | Stoelting | Integrated into coordinate system | |
| Injection canula | Braun | 100 Sterican, 0,4 x 20 mm, Gr. 20 | All injections and to bore hole into the skull |
| Litter | T 1350 | Grounding for the Novelty-Supressed Feeding test | |
| Mouse cages | Zoonlab | 405 cm^2 | Single housing for experiments |
| Optibond FL | Kerr | 26684E | Preparation of the skull for implantation |
| Optical glass fiber | Thorlabs | FT200EMT | Light fiber for implant |
| Optogenetics-LED.STSI | Prizmatix | Optogenetic toolbox for light stimulation during behavioral experiments | |
| Paraformaldehyde | Sigma-Aldrich | 16005-1KG-R | Perfusion of mice to remove the brains |
| Polishing sheet 0.02 µm grit | Thorlabs | LFCF | Polishing implants round side |
| Polishing sheet 1 µm grit | Thorlabs | LF1D | Polishing implants round side |
| Polishing sheet 30 µm grit | Thorlabs | LF30D | Polishing implants round side |
| Polishing sheet 6 µm grit | Thorlabs | LF6D | Polishing implants round side |
| Pulser Software | Prizmatix | Software for light device control | |
| Rimadyl-Carprofen | Zoetis | Analgesia | |
| Sigma Plot | Software for statistics | ||
| Sleeve | Thorlabs | FT200EMT | Connection of implant and light cable |
| SodiumCloride (NaCl) | Braun | 3570410 | Rinsing of the skull |
| Superglue | Pattex Henkel | To Fix the glass fiber in the ferrule | |
| td-Tomato virus | Penn Vector Core | Addgene 51503 | Optogenetic tool |
| UV light | KoQGHJ | wireless, 1200 mW/cm^2 | Polymeration lamp for dental cementum |
| Xylavet-Xylazin | cp pharma | Anesthesia |
참고문헌
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature Letters. 463, 98-102 (2010).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Spoida, K., Masseck, O. A., Deneris, E. S., Herlitze, S. Gq/5-HT2c receptor signals activate a local GABAergic inhibitory feedback circuit to modulate serotonergic firing and anxiety in mice. Proceedings of the National Academy of Science of the United States of America. 111, 6479-6484 (2014).
- Kleinlogel, S. Optogenetic user's guide to Opto-GPCRs modified GPCRs. Frontiers in Bioscience. 21, 794-805 (2016).
- Mahn, M., Prigge, M., Ron, S., Levy, R., Yizhar, O. Biophysical constraints of optogenetic inhibition at presynaptic terminals. Nature Neuroscience. 19, 554-556 (2016).
- Masseck, O. A., et al. Vertebrate Cone Opsins Enable Sustained and Highly Sensitive Rapid Control of Gi/o Signaling in Anxiety Circuitry. Neuron. 81, 1263-1273 (2014).
- Oh, E., Maejima, T., Liu, C., Deneris, E., Herlitze, S. Substitution of 5-HT 1A Receptor signaling by a light-activated G protein-coupled receptor. Journal of Biological Chemistry. 285, 30825-30836 (2010).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in Neural Systems. Neuron Primer. 71, 9-34 (2011).
- Masseck, O. A., Manahan-Vaughan, D. A Guide to Optogenetic Applications, With special Focus on Behavioral and In Vivo Electrophysiological Experiments. HandboOk of In Vivo Neural Plasticity Techniques - A Systems Neuroscheince Approach to the Neural Basis of Memory and Cognition. , 557 (2019).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. , 611-621 (2006).
- Yang, Y. S., Hughes, T. E. Cre Stoplight: A red/green fluorescent reporter of Cre recombinase expression in living cells. Biotechniques. 31, 1036-1041 (2001).
- Schnütgen, F., et al. A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse. Nature Biotechnology. 21, 562-565 (2003).
- Taniguchi, H., et al. A Resource of Cre Driver Lines for Genetic Targeting of GABAergic Neurons in Cerebral Cortex. Neuron. 71, 995-1013 (2011).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 268-273 (2011).
- Palanza, P., Gioiosa, L., Parmigiani, S. Social stress in mice: Gender differences and effects of estrous cycle and social dominance. Physiology and Behavior. 73, 411-420 (2001).
- Karolewicz, B., Paul, I. A. Group housing of mice increases immobility and antidepressant sensitivity in the forced swim and tail suspension tests. European Journal of Pharmacology. 415, 197-201 (2001).
- Masseck, O. A., Rubelowski, J. M., Spoida, K., Herlitze, S. Light- and drug-activated G-protein-coupled receptors to control intracellular signalling. Experimental Physiology. 96, 51-56 (2011).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4, (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature Article. 446, 633-639 (2007).
- Owen, S. F., Liu, M. H., Kreitzer, A. C. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience. 22, 1061-1065 (2019).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nature Communication. 10, 1-12 (2019).
- Allsop, S. A., Vander Weele, C. M., Wichmann, R., Tye, K. M. Optogenetic insights on the relationship between anxiety-related behaviors and social deficits. Frontiers in Behavioral Neuroscience. 8, 1-14 (2014).
- Fuchikami, M., et al. Optogenetic stimulation of infralimbic PFC reproduces ketamine's rapid and sustained antidepressant actions. Proceedings of the National Academy of Science of the United States of America. 112, 8106-8111 (2015).
- Correia, P. A., et al. Transient inhibition and long-term facilitation of locomotion by phasic optogenetic activation of serotonin neurons. Elife. 6, 1-26 (2017).
- Felix-Ortiz, A. C., Burgos-Robles, A., Bhagat, N. D., Leppla, C. A., Tye, K. M. Bidirectional modulation of anxiety-related and social behaviors by amygdala projections to the medial prefrontal cortex. Neuroscience. 321, 197-209 (2016).
- Marek, R., Xu, L., Sullivan, R. K. P., Sah, P. Excitatory connections between the prelimbic and infralimbic medial prefrontal cortex show a role for the prelimbic cortex in fear extinction. Nature Brief Communication. , (2018).
- Parfitt, G. M., et al. Bidirectional Control of Anxiety-Related Behaviors in Mice: Role of Inputs Arising from the Ventral Hippocampus to the Lateral Septum and Medial Prefrontal Cortex. Neuropsychopharmacology. 42, 1715-1728 (2017).
- Bandelow, B., Michaelis, S. Epidemiology of anxiety disorders in the 21st century. Dialogues in Clinical Neuroscience. 17, 327-335 (2015).
- Kessler, R. C., et al. Lifetime Prevalence and Age-of-Onset Distributions of DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 62, 593-602 (2005).
- Kessler, R. C., Petukhova, M., Sampson, N. A., Zaslavsky, A. M., Wittchen, H. U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. International Journal of Methods Psychiatric Research. 21, 169-184 (2014).
- Andlin-Sobocki, P., Wittchen, H. U. Cost of anxiety disorders in Europe. European Journal of Neurology. 12, 39-44 (2005).
- Forster, G. L., Novick, A. M., Scholl, J. L., Wall, M. J. The Role of the Amygdala in Anxiety Disorders. Intech. , 61-102 (2012).
- Liberzon, I. Neural circuits in anxiety and stress disorders a focused review. Therapeutics and Clinical Risk Management. 11, 115-126 (2015).
- Sylvers, P., Lilienfeld, S. O., LaPrairie, J. L. Differences between trait fear and trait anxiety: Implications for psychopathology. Clinical Psychology Review. 31, 122-137 (2011).
- Daws, L. C., Koek, W., Mitchell, N. C. Revisiting Serotonin Reuptake Inhibitors and the Therapeutic Potential of 'Uptake-2' in Psychiatric Disorders. ACS Chemical Neuroscience. 4, 16-21 (2013).
- Felix-Ortiz, A. C., et al. BLA to vHPC inputs modulate anxiety-related behaviors. Neuron Report. 79, 658-664 (2013).
- Padilla-Coreano, N., et al. Direct Ventral Hippocampal-Prefrontal Input Is Required for Anxiety-Related Neural Activity and Behavior. Neuron Article. 89, 857-866 (2016).
- Lisboa, S. F., Stecchini, M. F., Corrêa, F. M. A., Guimarães, F. S., Resstel, L. B. M. Different role of the ventral medial prefrontal cortex on modulation of innate and associative learned fear. Neuroscience. 171, 760-768 (2010).
- Bi, L. L., et al. Enhanced excitability in the infralimbic cortex produces anxiety-like behaviors. Neuropharmacology. 72, 148-156 (2013).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature Article. 477, 171-178 (2011).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. 44, 611-621 (2006).
- Rubenstein, J. L. R., Merzenich, M. M. Model of autism: increased ratio of excitation/ inhibition in key neural systems. Genes, Brain and Behavior. 2, 255-267 (2003).
- Berg, L., Eckardt, J., A, M. O. Enhanced activity of pyramidal neurons in the infralimbic cortex drives anxiety behavior. PLoS One. 14, 1-19 (2019).
- Meunier, C. N. J., Amar, M., Lanfumey, L., Hamon, M., Fossier, P. 5-HT1A receptors direct the orientation of plasticity in layer 5 pyramidal neurons of the mouse prefrontal cortex. Neuropharmacology. 71, 37-45 (2013).
- Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J. . Mouse Brain in Stereotaxic Coordinates. 2, (2004).
- Gore, B. B., Soden, M. E., Zweifel, L. S. Manipulating gene expression in projection-specific neuronal populations using combinatorial viral approaches. Current Protocols in Neuroscience. 435, 1-6 (2014).
- Stujenske, J. M., Spellman, T., Gordon, J. A. Modeling the Spatiotemporal Dynamics of Light and Heat Propagation for InVivo Optogenetics. Cell Report. 12, 525-534 (2015).
- Berg, L. Imbalance of excitation and inhibition within the prefrontal cortex supports anxiety behavior. Ruhr-University Bochum. , (2019).
- Boyden, E. S. A history of optogenetics: The development of tools for controlling brain circuits with light. F1000 Biology Reports. 3, 1-12 (2011).
- Airan, R. D., Thompson, K. R., Fenno, L. E., Bernstein, H., Deisseroth, K. Temporally precise in vivo control of intracellular signalling. Nature. 458, 1025-1029 (2009).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7, 12-23 (2012).
- Covington, H. E., et al. Antidepressant Effect of Optogenetic Stimulation of the Medial Prefrontal Cortex. Journal of Neuroscience. 30, 16082-16090 (2010).
- Lepicard, E. M., Joubert, C., Hagneau, I., Perez-Diaz, F., Chapouthier, G. Differences in anxiety-related behavior and response to diazepam in BALB/cByJ and C57BL/6J strains of mice. Pharmacology, Biochemistry and Behavior. 67, 739-748 (2000).
- Schmidt, M. V., Müller, M. B. Animal models of anxiety. Elsevier. 3, 369-374 (2006).
- Cho, J. H., Deisseroth, K., Bolshakov, V. Y. Synaptic Encoding of Fear Extinction in mPFC-amygdala Circuits. Neuron Article. 80, 1491-1507 (2013).
- Adhikari, A., et al. Basomedial amygdala mediates top-down control of anxiety and fear. Nature. 527, 179-185 (2015).
- Suzuki, S., et al. The infralimbic and prelimbic medial prefrontal cortices have differential functions in the expression of anxiety-like behaviors in mice. Behavioural Brain Research. 304, 120-124 (2016).
- Carola, V., D'Olimpio, F., Brunamonti, E., Mangia, F., Renzi, P. Evaluation of the elevated plus-maze and open-field tests for the assessment of anxiety-related behaviour in inbred mice. Behavioural Brain Research. 134, 49-57 (2002).
- Prut, L., Belzung, C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: A review. European Journal of Pharmacology. 463, 3-33 (2003).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature Letter. 471, 358-362 (2011).
- Bouwknecht, J. A., et al. Differential effects of exposure to low-light or high-light open-field on anxiety-related behaviors: Relationship to c-Fos expression in serotonergic and non-serotonergic neurons in the dorsal raphe nucleus. Brain Research Bulletin. 72, 32-43 (2007).
- Overstreet, D. H., Knapp, D. J., Angel, R. A., Navarro, M., Breese, G. R. Reduction in repeated ethanol-withdrawal-induced anxiety-like behavior by site-selective injections of 5-HT1A and 5-HT2C ligands. Psychopharmacology. 187, 1-12 (2006).
- Takahashi, A., et al. Glutamate Input in the Dorsal Raphe Nucleus As a Determinant of Escalated Aggression in Male Mice. Journal of Neuroscience. 35, 6452-6463 (2015).
- Klemenhagen, K. C., Gordon, J. A., David, D. J., Hen, R., Gross, C. T. Increased Fear Response to Contextual Cues in Mice Lacking the 5-HT1A Receptor. Neuropsychopharmacology. 31, 101-111 (2006).
- Ramos, A. Animal models of anxiety: do I need multiple tests. Trends in Pharmacological Science. 29, 493-498 (2008).
- Isosaka, T., et al. Htr2a-Expressing Cells in the Central Amygdala Control the Hierarchy between Innate and Learned Fear. Cell. 163, 1153-1164 (2015).
- Regev, L., Goshen, I. Employing Optogenetics in Memory Research. Optogenetics: A Roadmap. , 219-256 (2017).
- Shah, A. A., Sjovold, T., Treit, D. Inactivation of the medial prefrontal cortex with the GABA A receptor agonist muscimol increases open-arm activity in the elevated plus-maze and attenuates shock-probe burying in rats. Brain Research. 1028, 112-115 (2004).
- Knight, A. R., et al. Pharmacological characterisation of the agonist radioligand binding site of 5-HT2A, 5-HT2B and 5-HT2C receptors. Naunyn-Schmiedebergs Archiv of Pharmacology. 370, 114-123 (2004).
- Graeff, F. G., Viana, M. B., Mora, P. O. Dual Role of 5-HT in Defense and Anxiety. Neuroscience and Biobehavioral Reviews. 21, 791-799 (1997).
- Cheriyan, J., Sheets, P. L. Altered Excitability and Local Connectivity of mPFC-PAG Neurons in a Mouse Model of Neuropathic Pain. Journal of Neuroscience. 38, 4829-4839 (2018).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유