Method Article
自由に動くマウスの行動を調節する神経活動の光遺伝学的操作
要約
特定の神経集団や脳領域の光遺伝学的操作により、自由に動く動物の高い時間的および空間的分解能で行動を修正することができる。慢性に埋め込まれた光ファイバーと組み合わせて異なる光遺伝学的ツールを使用することにより、さまざまな神経変調および行動検査を行うことができます。
要約
自由に動くマウスにおける神経回路の光遺伝学的調節は、急性および長期の行動に影響を及ぼす。この方法は、中枢神経系のニューロン回路全体まで、単一ニューロンおよび領域特異的送信機放出の操作を行い、行動結果の直接測定を可能にする。ニューロンは、Channelrhodopsin2(ChR2)などの選択したDNAを運ぶウイルスベクターの注入を介して光遺伝学的ツールを発現する。光は、標的領域の真上に終了する慢性光学インプラントを介して特定の脳領域に持ち込まれる。2週間の回復と適切なツール発現の後、マウスは目的のニューロンの光遺伝学的刺激を伴う行動検査に繰り返し使用することができる。
光遺伝学的変調は、化学的または電気的刺激などの一般的に使用される方法と比較して、高い細胞特異性で達成することができる高い時間的および空間的分解能を有する。光は神経組織に害を与えないため、1つのマウスでの複数の行動実験だけでなく、長期実験にも使用できます。光遺伝学的ツールの可能性はほぼ無制限であり、ニューロン全体の活性化またはサイレンシング、あるいは光による特定の受容体タイプの操作を可能にします。
このような光遺伝学的刺激を用いた行動実験の結果は、操作によって引き起こされる行動の変化を直接可視化する。ベースラインとして光刺激を伴わない同じ動物の挙動は、誘発変化に対する良好な制御である。これは、神経の種類や神経伝達物質システムの詳細な概要を可能にする, 不安など、特定の行動に関与.また、神経回路網の可塑性は、光刺激後の長期刺激や行動観察を通じて、非常に詳細に調べることができます。光遺伝学は、神経疾患のいくつかの種類の神経シグナル伝達を啓発するのに役立ちます。
概要
中枢神経系における神経回路の調節とその行動結果は、特に精神疾患や学習や記憶などの認知タスクにおいて、脳の仕組みを理解するために重要です。光遺伝学では、単一細胞または細胞集団は、回路全体まで光によって変調することができる。Channelrhodopsin2(ChR2)やArchaerhodopsin(Arch)のような一般的な光遺伝学的ツールは、ニューロンを活性化または沈黙させ、または別個の脳領域11、2、3、42,3に投影する軸索末端での送信機放出を増加または阻害することができる。,4しかし、Archは、シナプス前の端末での活性化が自発的な送信機放出を増加させることが示されたように、慎重に使用する必要があります5.アーチは、細胞内のpH値を変化させる外側の整流プロトンポンプである。このアルカリミリューはカルシウム流入を誘導し、送信機放出を増強する 5.細胞内シグナル伝達経路を特異的に調節するために、ロドプシンやコーンオプシンなどの光活性化可能な光遺伝学的ツールからなる受容体キメラを、適切なGタンパク質共役受容体と組み合わせて、6、7、86,7,8を作成することができる。利用可能な光遺伝学的ツールの量と変動は、過去10年間で大幅に増加しました 9.
光遺伝学の目的は、行動中に神経回路を操作することです。光遺伝学は、例えば、不安行動の変化などの急性行動変化の測定を可能にする。光遺伝学的ツールは、ウイルスベクターを介して脳の標的領域に送達される。特別なプロモーターやエンハンサー、またはCre-loxPシステムの助けを借りて、細胞型特異性は光遺伝学的ツールの発現のために保証することができる(図1A)。特定の細胞タイプでのみ酵素Cre-Recombinaseを発現する遺伝子組み換えマウスラインがいくつか存在する。例えば、Nex-Creマウスは、皮質中の錐体ニューロンおよびNex-促進器10の制御下の海馬におけるクレリコンビナーゼを発現する。この酵素は、loxP側11に横たわるDNA配列を反転させることができる。したがって、loxP側によって反転され、横たわっている二重凝解光遺伝学的ツールのDNA配列は、他のニューロンタイプ12、13,13ではなく、Cre-Recombinaseを有するニューロンによってのみ転写することができる。Nex-Creマウスの場合、光遺伝学的ツールはピラミッド型ニューロンのみで発現する。特定の脳領域の光刺激は、その後、関心領域の真上の光ファイバーの慢性注入を介して達成される。動物は適切な光源に結合され、ほぼすべての種類の行動テストで自由に行動することができます。
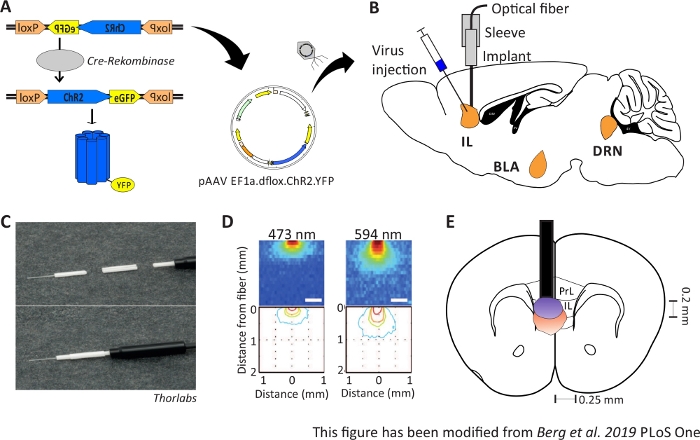
図1:注射と注入。A) ChR2-YFP 用の Cre-loxP システム。二重凝集光遺伝学的ツールは、脳組織への注射のためのアデノ関連ウイルス(AAV)に詰め込まれています。B)mPFCのIL領域への/上の光学神経インターフェースのウイルス注入および注入の矢状の見解。注射および注入は上から行った。対象地域である IL、BLA、DRN が表示されます。C)埋め込み光ファイバー、スリーブ、光源の詳細図。D)200μm光ファイバーから灰色物質の脳組織に青と赤のレーザー光刺激を広げる(Yizharら 2011)。青色光が広がり、最大で0.5mmの組織に、赤色光は約1mmです。色分け:赤50%、黄色10%、緑5%、青色1%(光がこの領域に到達した場合)。EE)200 μmの光ファイバーを用いた左ILの真上の一方的な注入のコロナ図。IL領域は、各半球で0.25ミリメートルの幅と0.2ミリメートルの深さを持っています。青と赤の電球は、5%の光が広がるボーダーであり、Yizharらから適切なサイズに転送されます。ロクスP:X-オーバーP1の軌跡;ChR2: チャネルロドプシン;YFP: 黄色の蛍光タンパク質;dflox: ダブルフラックス;IL: 赤外線皮質;BLA: バソラテラアミダラ;DRN: 後回しのラフェ核;PrL: 前縁領域。この図は、Berg 201948から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
光遺伝学的アプローチは、高い時間的および空間的分解能14 および細胞型特異的変調の両方を可能にするとして利用される。さらに、それ以上の治療を行うことなく、埋め込み装置を繰り返し使用することができる。定位的手術の後、光遺伝学的ツールを運ぶアデノ関連ウイルスの注入および光ファイバーの移植が行われるところで、マウスは2週間回復することができる。手術から回復し、ウイルスが発現するのに十分な時間であるため、我々は、わずか2週間の回復時間を選択しました。行動実験は免疫検査が続くため、実験中にマウスが古くなりすぎないようにする必要があります。そうでなければ、組織の質が低下します。彼らはインプラントから明らかな行動障害を示さないし、典型的なケージの行動に従事する。もちろん、移植は重要な外科的病変を伴う。したがって、マウスは集中的に監視されます。手術後、グループ収容マウスはお互いの新鮮な傷やインプラントを傷つける傾向があり、マウスは単座化する必要があります。しかし、単一の収容マウスは不安レベルが低い15 を示し、一般的にうつ病のような症状が少ない16の場合、住宅状態は雄マウスの不安レベルに大きな影響を与える。
脳回路の化学的または電気的操作は、光遺伝学の高い細胞型特異性を欠き、より低い時間的および空間分解能14、17、1817,18を有する。14実験問題に応じて、電気的または化学的刺激は異なる利点を有することができる。特定の領域でファイバー端子を通過する場合も刺激する必要がある、電気刺激が最良の方法です。化学刺激は、全領域の送信機特異的受容体がアゴニストによって活性化されるべき場合に適した選択である。光遺伝学の化学的または電気的刺激と比較する別の大きな利点は、内因的には、ニューロンが光に敏感ではないということで、副作用19の発生を回避する。確かに、高い光強度は加熱効果88、2020を誘発するかもしれないが、適切な対照群のために、光遺伝学的操作による行動効果を排除することができる。
げっ歯類の挙動を調査することは、特に精神疾患に関して、自由に動く動物の光遺伝学によって、特定の細胞集団21および回路22までの単一の受容体の直接変調を可能にするので、大幅に改善された。このような変調の急性の影響を測定する可能性は、定義された時間23後または慢性刺激24後の長期的な行動効果と同様に、実験設計の広い柔軟性を可能にし、脳回路に非常に詳細な洞察を提供する。光刺激は、光遺伝学的ツールの注射部位に位置するニューロンを調節するために使用することができる。注射と注入の両方が同じ脳領域に対処する場合、この領域における主体ニューロンおよびインターニューロンの軸索を突き出す細胞体および背部は33、6、86,8を標的とすることができる。しかし、光繊維は、注入されたものとは異なる領域に移植することもできる。この場合、光刺激は、注入領域25、26、27,26,27の突起領域における軸索末端での送信機放出を調節することができる。
ここでの研究では、光遺伝学は、不安関連の行動を分析するための実験と組み合わせて使用されます。不安関連の精神疾患は、世界人口の3分の1以上に影響を及ぼす28,29,30人で、経済的負担が高い28,29,3031.影響を受けた人々は、覚醒感、緊張感、心配の後に回避行動32、33,33に苦しんでいます。これらの慢性的に発生する否定的な感情は、主に将来の出来事34に焦点を当て、患者の日常生活を強く妨げる。ベンゾジアゼピンや選択的セロトニン再取り込み阻害薬(SSRI)のような一般的な治療法は、患者の一部でのみ成功しています。35の治療に多くの人が反応せず、そのような35病気の根底にあるメカニズムがまだ完全には理解されていない。内側前頭前野(mPFC)は、,不安,21、25、27、36、37、38の発達と症状において重要な役割21,25,2737を38果たすることが知られている。36具体的には、mPFCにおける眼内皮質(IL)領域の過剰活性化は、不安関連障害の一部である可能性があります39,,40.ここで説明する実験例は、mPFC の IL 領域の変調が不安行動にどのように影響するかを理解するのに役立ちます。さらに、不安関連精神疾患に対する新しい治療戦略の開発も潜在的に支持される可能性がある。
生後2〜6ヶ月の雄のNex-Creマウスは、mPFC41のIL領域内の錐体ニューロンにおいて特にChR2を発現するために使用される。Nex-CreマウスはC57Bl/6バックグラウンドを有し、酵素Cre-recombinaseを特に錐体ニューロンで発現する。立体的手術中、二重凝集したChR2-DNAは、アデノ関連ウイルスベクターを介してIL領域に注入される。光学インプラントは関心のある領域の真上に置かれ(図1B)、インプラントは歯科用セメントで固定される。コントロール動物は、細胞特異的発現を模倣するために、同じ領域で二重フロックスtdTomato-DNAの注射を受ける。
動物は手術の日までグループ収容され、その後は他のマウスによる怪我を避けるために単座化されています。マウスは、単一のマウス用のTypI-Lケージ内の個々の換気ケージ(IVC)ラックに収容されます。明暗サイクルは12:12のリズムに従い、明度の位相は午前10時から始まります。すべての行動実験は、げっ歯類の活性段階に似た暗い段階で行われます。水および標準的な食糧の餌は、アドリビタム利用可能である。2週間の回復の後、錐体ニューロンにおけるChR2の十分な発現を保証し、マウスは行動実験に使用される。
オープンフィールド(OF)は、サンドブラスト40センチの高い壁を持つ50cm x 50 cmの正方形の迷路です。地面は、内側の4が中心を表す16の正方形に分割されています。測定される動作は、1) 中心に費やされた時間、2) 中心エントリ数、および 3) 移動距離の合計です。この実験の間、合計20分の4つの試験があります。試験1および3では、光刺激が起こらず、かつ試験2および4において、5ms光パルスと1mWの光強度473nmの20Hz刺激が行われる(図2A)。後の試験では、検査領域への慣れが考慮されたが、シャム注入対照動物の使用は、習慣がどのように表現されているかを示す。
バーンズ迷路は学習と記憶のための実験です。直径92cmの円形プラットフォームで、円周の周りに20の等距離の穴が含まれています。19の穴が閉じられ、1つの穴の下にエスケープボックスが提示されます。4日間連続して、マウスは脱出箱の位置を知るために4つのトレーニング試験を受ける。5日目にエスケープボックスを取り除き、マウスは正しい穴を見つけるのにどれくらいの時間が必要かをテストされます。測定された動作は、1)エスケープボックス/正しい穴が見つかるまでの時間、2)ターゲットの訪問数とエラー数、および3)エスケープボックス内に移動するまでの距離です。異なるグループの光刺激は、トレーニング日1〜4日に行われる取得または統合中、または試験日の検索中(5日目)に行われます(図2D)。
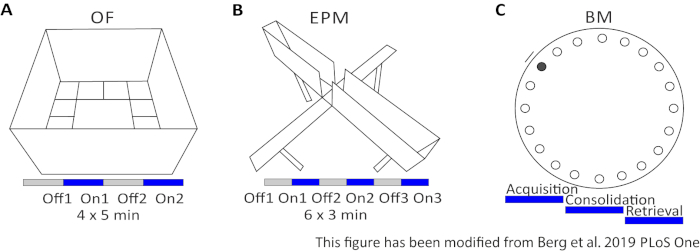
図2 光遺伝学的プロトコルを用いた行動実験A)対応する光刺激プロトコルを用いたオープンフィールド実験の模式図。 C)対応する光刺激プロトコルを用いた上昇プラス迷路実験の模式図。 D)対応する光刺激プロトコルを用いたバーンズ迷路実験の模式図。EPM: 上昇プラス迷路;OF: オープンフィールド;BM:バーンズ迷路テスト。この図は、Berg 201948から変更されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
光遺伝学的刺激のためには、光強度と周波数を、調査中の光遺伝学的ツールと神経細胞型に適合させなければならない。いくつかの研究は、強い光強度88、2020のために可能な加熱効果があることを示しているように、組織への損傷を避けるために、可能な限り低い光強度を使用する必要があります。ChR2の場合、5 msの光パルスを有する20Hzの刺激が一般的に2.ChR2は非常に光に敏感であるため、1mWの光強度で十分です。光刺激プロトコルは、光のオフと試験の間で交互に行動の変化を測定します。行動実験のための外部の部屋の条件は、動物のグループ全体のために安定したままでなければなりません.考慮すべき重要な条件は、ノイズ(デバイス自体がノイズを作る可能性があることを覚えておいてください)、臭い(常にエタノールで行動設定をきれいにする)、光強度、および実験者です。実験者は常に同じ人物でなければなりません。さらに、実験の時間は、1つのグループ内のすべての動物について同じであるべきであるが、施設内の暗位相の開始の数時間後が好ましい。
この実験の目的は、励起的な錐体ニューロンの強い活性化を通じてIL領域の励起/阻害(E/I)比を増加させることである。この特殊な皮質領域におけるE/I比の強化は、マウス40、42、43、4442,43,44の不安レベルを増加させることが知られている。40
プロトコル
ブレーメン大学の施設施設と「セネタリン・フュル・ウィッセンシャフト、ゲスンドハイト・ウント・ヴェルブラウチャーシュッツ」(#146)によって動物被験者を含む手続きが承認されています。
1. 光学インプラント9の調製(図1C)
- セラミックフェルールフラットサイドをベンチバイスに上に置きます。
- 直径200μmのガラス繊維のコートを繊維剥離ツールで剥がし、セラミックファイバースクライブで長さ2~3cmの部分をカットします。
- ガラス繊維の一部をセラミックフェルールに入れ、両側に均一な張り出しを入れます。
- セラミックフェルールの平らな側にスーパーグルーの滴を注入カヌラと一滴置きます。
注: プロトコルはここで一時停止することができます。 - プレインプラントをベンチバイスから取り出し、セラミックフェルールの丸い側に、セラミックファイバースクライブでガラス繊維をできるだけ短くカットします。
- フェルール研磨パックにプレインプラントを置き、4つの異なる研磨紙にラウンドサイドを研磨し、1枚あたり8回20回(30 μmグリット、6 μmグリット、1 μmグリット、最後に0.02 μmグリット)を描きます。
- フェルール研磨パックからプレインプラントを取り出し、セラミックフェルールの平らな側のガラス繊維を移植に必要な長さにカットします。突き出たスーパーグルーの後ろの長さの測定を開始します。
- 均一な切断面のためにちょうどガラス繊維を2〜3回傷つけ、それを壊す。
メモ:パキシノスとフランクリン45 からマウスの脳アトラスを使用して、インプラントの長さを計算します。インプラントは、関心のある領域の真上に終了する必要があり、頭蓋骨の厚さは、長さの計算に含まれている必要があります。IL領域を刺激するために、ガラス繊維の長さは1.8mm(図3)である。
- 均一な切断面のためにちょうどガラス繊維を2〜3回傷つけ、それを壊す。
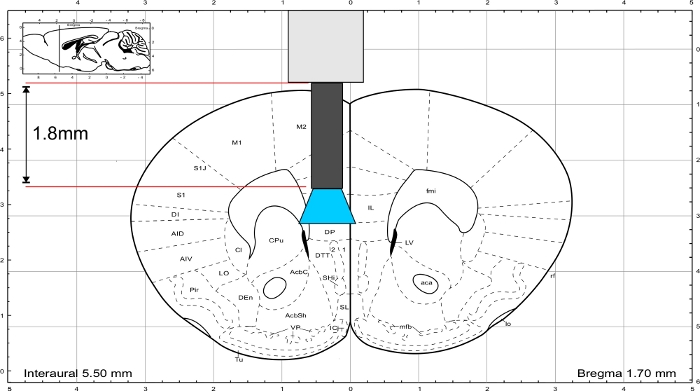
図3:マウスの脳アトラス(パキシノスとフランクリン)を有するインプラントの代表長を有し、IL領域に到達する。この図の大きなバージョンを表示するには、ここをクリックしてください。
- 完成したインプラントをエタノールで10分間消毒し、着床前に空気乾燥させます。
2. 注射と注入
- 手術室に単一のマウスを輸送し、それを重量を量る。腹腔内(すなわち)ケタミン/キシラジン(ケタミン0.12mg/g、キシラジン0.01mg/g)の注射で麻酔を適用する。
- マウスを左手で固定し、頭を低く持った状態で背中に回します。
- 注射器で腹部の左下象限を標的とし、皮膚の下に1cmの注入カヌラに入る。
- 腹腔にゆっくりと一定の動きで麻酔を注入します。
- マウスをケージに戻し、麻酔の深い状態になるまで待ちます。
注:麻酔の深さは、点滅と足の間の反射神経の欠如によって決定することができます。
- 加熱プレートにマウスを置き、頭を定型フレームに固定します。前部の鼻と歯、両側の耳を固定します。
注: 正しい定位座標を確保するには、頭部が左右軸およびロストラル・コーダル軸上でまっすぐである必要があります。 - 2mg/kgカルプロフェンをマウスの後ろに皮下に加え、両目に不透明な眼軟膏を塗布して乾燥から保護します。
- 濡れたペーパータオルで頭皮の髪を湿らせ、はさみで切り落とします。濡れたペーパータオルで、ゆる毛をすべて取り除くようにしてください。頭皮を消毒するには、綿棒を使用し、ヨウ素(ベタイソドーナ100mg / mLポビドンヨウ素と11mg / mLヨウ素)を含むチンキの0.5 mLを取り、空気乾燥させます。
注:はさみの代わりに、電気クリッパーを適切な脱毛に使用することもできます。 - トゥイザーで関心のある領域の上に頭皮を上げ、正中線に沿って1cmカット。頭蓋骨を露出させるために皮膚を脇に押し出すために2つのピンセットを使用してください。また、頭蓋骨の上の薄い皮膚を取り除き、露出した頭蓋骨を乾燥させてください。
- 後の移植のために頭蓋骨を荒らす。
- 2mm×2mmのリン酸(37%)を適用する●スカルの粘着キット(例えばオプティボンド)から、シリンジの先端と一緒に配布し、15sの効果を出します。
- 綿棒ですべての酸を取り除き、頭蓋骨を0.9%NaClの1 mLで2回すすいでください。
- 綿棒と圧縮空気で頭蓋骨を乾燥させます。
注意: リン酸は危険であり、組織の損傷を避けるために完全に除去する必要があります。
- 個々の座標の F 係数を計算します。
- 立体フレームにガラスのカヌラを配置し、ブレグマの真上に配置します。
- 座標系をゼロにし、グラス カニューラをラムダに移動します。
- 次の数式で F 係数46 を計算します。
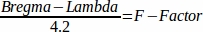
- F ファクターにマウス脳アトラスの座標を掛け合わせて、マウスを個別のマウスに合わせて調整します。
- 注射のために頭蓋骨に穴を開けます。
- 調整された座標を使用して、目的の構造の真上の頭蓋骨上の位置を見つけ、骨表面の上に引っ掻いて注入カヌラの先端を使用してマークします。
- 射出カヌラを使用して、その場でカヌラを回転させることによって、マークされた場所の頭蓋骨に穴を開けます。バリ穴から血液が漏れ出た場合は、1 mLの0.9%NaClですすいで、その後頭蓋骨を乾燥させます。
- ガラスのカニューラにウイルス溶液を取り込みます。
- 頭蓋骨に0.9%NaClの100 μLの滴を置き、上にパラフィルム(1 cm x 1 cm)を置き、無菌側を上に置きます。
- 1~2 μLのウイルス溶液をパラフィルムに入れ、ガラスカニューラの先端を下ろします。
- ガラスカヌラを注射器に接続し、最小限の負圧を加え、ウイルス溶液がカニューレによって取り込まれるまで待ちます(数秒以内)。
注:空気がカニューラに取り込む前に、負圧の適用を停止することが重要です。したがって、ウイルス溶液の小さな残骸が常にあります。
- 対象地域にウイルス溶液を注入します。
- ウイルス充填ガラスのカニューレをバリ穴の上に置きます。
- カヌラの先端が頭蓋骨のレベルにある場合は、カヌラをバーホールにゆっくりと下げ、Z座標をゼロにします。
- カヌラを注射部位の最も低い位置まで慎重に下げます。
- カニューラ内のウイルス溶液の半月板に双眼鏡を集中させる。
- メニスカスがわずかに下がるまで、注射器で少量の正圧を加えます。
- ガラスカニューレを次の位置に上に移動する前に、ウイルスが2〜3分間広がるようにしましょう。
- 対象地域全体で200~300μmごとにウイルス溶液を適用します。
- ガラスカヌラを非常にゆっくりと取り出し、最終的な注射後に廃棄します。
- 密着キット(例えば、オプティボンドTMFL)で注入のために頭蓋骨を準備します。
- 頭蓋骨を圧縮空気で乾かします。
- プライマー5μL(例えば、オプティボンド、1-30%(エタノール、珪酸、グリセリンホスファチメタクリラット、2-(2-(メタクリロイルオキシ)エトキシカルボニル)ベンゾゾエウ、2-ヒドロキイェチルメトメタクリラットを適用し、15秒乾燥させます。
- 同じスティック(420-480nm)で5μLの結合(例えば、オプティボンド、15-20%2-Hydroxyethylmethacrylat+ 1-2%アルカリヘキサフルオロシリカト(Na))を適用し、20sのUV光(420-480nm)で硬化させます。
注:頭蓋骨が乾燥していること、プライマーとボンドが非常に薄い層に塗布されている必要があります。
注意: UV ライトは目に害を与える可能性があるため、UV ライトを直接調ないでください。
- 目的の領域の真上にインプラントを配置します。
- 対応するホルダーにインプラントを固定します。
- 頭蓋骨を圧縮空気で乾かします。
- ガラス繊維の先端をバリ穴の真上に置き、慎重に下げます。
- スーパーグルーの残りの電球が頭蓋骨に触れたときにインプラントを下げるのをやめてください。頭蓋骨に圧力をかけないでください!
注:注射と注入が異なる領域(例えば、 後回しおよび海馬)で行われている場合は、リン酸を塗布した後、2成分の接着の前に必要なすべての穴を開け、前述の指示に従ってください(ステップ2.8-2.14)。
- インプラントを固定します。
- 頭蓋骨がまだ完全に乾燥しているかどうかを確認してください。
- インプラントの周りおよび周囲の領域の液体歯科セメント(例えば、グラディアダイレクトフロ)を適用し、UV光(420-480 nm)で20 sの治療を行います。
注:歯科用セメントの量は、自由な頭蓋骨領域に依存します。頭蓋骨全体を歯科用セメントで覆う必要があります。 - セメントの2層を適用し、完全に自由と乾燥した頭蓋骨領域を埋めます。UV光(420-480 nm)ですべての層を治す。
- 手術を終了します。
- 創傷全体に0.5gのヨウ素軟膏(ベタイソドン100mg/mLポビドンヨウ素と11mg/mLヨウ素)を塗布する。
- 0.9%NaClに溶解したグルコース0.1mLを首に注射し、迅速に回復します。
- 鼻と耳の固定を解除し、新鮮なケージにマウスを持ち込み、加熱ランプの下に置いて体の熱を失わないようにします。
- マウスが目を覚ますと、施設に戻します。
- 少なくとも1日1回は、その健康状態を確認してください。マウスが悪い体質を示す場合は適切な処置をとる(例えば、マウスが痛みの徴候を示す場合は、カルプロフェンで術後鎮痛を3日まで確保する)。
注:2週間の回復の後、マウスは行動実験に使用することができます。
3. 新しい実験の設定(例ChR2刺激とオープンフィールド)
- パルサー
- 光刺激用のパルサー(例えば、プリズマティクス)をプログラムします。
- ソフトウェアを開き、光源が接続されている USB COM ポートを選択します。
- 操作モードの選択 (3) |トリガ HIGH の後にパルスシーケンスを実行し、LOW 時に停止して外部ソフトウェアが光源を制御できるようにします。
- ライトプロトコルをプログラムします。5 ms の光パルスで 20 Hz の刺激を受けた場合:TI = 23 ms、P1D = 5 ms、P1I = 22 ms、P2D = 0 ms を選択します。
- [シーケンスの開始]を押します。このステータスは、テストが終了するまで残ります。
注:パルサーソフトウェア(Prizmatix Pulser)は、ビデオトラッキングソフトウェアの前に起動する必要があります。そうしないと、ビデオトラッキングソフトウェアはデバイスを認識できなくなります。
- ビデオトラッキングソフトウェア(例:エチビジョンXT)
- 定義済みのテンプレートから新しい実験を作成します。
- ソフトウェアを開き、[ ファイル]に移動して 、[テンプレート] から [新規作成] を選択します。[ 定義済みのテンプレートを適用する]を選択します。
- ライブトラッキングを選択し、ソースを押してカメラを選択し、接続されているバスラーGenICamを確認します。
メモ:カメラのライブ画像が右上のウィンドウに表示されます。 - 次へを押して、記録する動物(げっ歯類、マウス)を選択します。
- [次へ]を押して、アリーナ テンプレート[オープン フィールド、 square] を選択します。ゾーン テンプレートの[中央]、[枠線]、[コーナー]を選択し、[次へ] をクリックして確認します。
- [次へ] で追跡する対象を1つ確認します。
- [中心点]、[鼻点]、[尾根]を選択し、背景と比較して動物の色を[Next](次へ)で暗くして確認します。
- [次へ] で推奨サンプルレート 12.5 を確認し、手順を完了します。
- 適切な名前を実験に指定し、保存する場所を選択します。
- 実験設定を定義します。
- セットアップと実験の設定に移動します。[トラックフィーチャ]として[中心点]、[鼻点]、および[尾根検出]を選択します。
- [ 試用版ハードウェアの使用 ] を選択し 、[設定]に移動します。
- [ノルダス USB-IO] ボックスを選択し、[OK]で確認します。
- パルサーデバイスに接続されているTTLポートで[デバイスタイプとして カスタムハードウェア ]を選択し 、[OK]と確認します。
- アリーナの設定を定義します。
- アリーナの設定に移動し、[アリーナの設定 1]を選択します。
注: カメラは自動的に背景画像を開きます。 - グラブで画像を確認します。
- サイズを変更して、定義済みのゾーンを実際のアリーナに適応させます。矢印と右側の 2 つのシンボルを使用します。一部のゾーンが不要な場合は、削除します。
- 1 を押します 。スケールを調整に描画 し、迷路の一方のコーナーからもう一方のコーナーに線を引きます。実距離の長さを cm で入力します。
- もう一方の軸についても繰り返します。
- アリーナの設定に移動し、[アリーナの設定 1]を選択します。
- 光刺激が機能しているかどうかをテストします。
- アリーナ - ハードウェアマッピング に移動し、グレーのバーで テスト を選択します。
- [コマンド 出力 1 高] を選択し、[ テスト] を押します。
注:光ファイバの端から発光する必要があります。 [出力 1 低] と [テスト] を選択すると、刺激が停止します。
- 試験管理の設定を 20 分間の実験で定義します。試験 Off1、On1、Off2、および On2 をそれぞれ 5 分の長さに設定します。
- [試用版のコントロールの設定]に移動し、[期間を追跡する時間 30 分] を選択します。
- [設定を選択して 20 分までの時間] を調整し、30 ~ 20 分を変更して、メイン ルールを準備します。[OK]で確認します。
注: スタートトラック の条件は、 被験者が2秒間アリーナにいるときにする必要があります。これにより、マウスがアリーナに表示されたときにシステムが自動的にトラッキングを開始します。 - 光刺激のサブルールを作成する: 構造に移動し、 さらに [ サブルール]を選択します。
- 光刺激プロトコルなどの名前を付けます。
- メインルールの下に配置し、マウスコースターで青い領域を選択して2つのボックスを広げます。
- 条件に移動し、時間とそれをライトのような名前を1に付ける。
- 調整条件は5分後に満たされます。[OK]で確認します。
- ボックスを黒い線に引き出して、サブルールの [ルールの開始 ] ボックスのすぐ後ろに置きます。
- アクションに移動 |カスタムハードウェアと名前:ライトオン1.
- [ アクション] を選択して [出力 1 高] として実行し 、[OK]で確認します。
- ボックスを [条件] ボックスのすぐ後ろに置きます。
注:実験の5分後に光刺激が始まるはずです。 - 5分後の時間条件を定義する手順を繰り返し、さらに5分後に光刺激を停止するアクション出力1 Lowを定義します。
- もう一度手順を繰り返して、別のライトオフとライトオントライアルをプログラムします。
- 構造に移動 |サブルール参照 と、参照が正しいサブルールに属していることを確認します。
- [ 開始条件 ] を [ 遅延なし] として [開始条件] と [停止条件 ] を [開始条件ごとに 1 回実行する]を選択します。 [OK]で確認します。
- メインルールのアクションボックス1と条件ボックス2の間に参照ボックスを配置し、アクション - 開始トラック から参照に線を引 きます。
注: メインルールは、トラックを開始した後に直接サブルールを開始します。
- システムが追跡する必要があるものを表示する検出設定を定義します。
- [検出の設定]に移動し、[検出設定 1]を選択します。
- テスト マウスをアリーナに配置し、[ 自動セットアップ] を選択します。
- 動物の種類としてげっ歯類を選択し、アリーナでマウスの周りにボックスを描くためにマウスの呪いを使用しています。はい と結果 OK?質問を確認します。
- 追跡する必要があるすべての実験動物の試験リストを定義します。
- トライアルリストに移動し、今日記録するすべての動物を計画する:[トライアルの追加]を選択して番号を選択します。
- すべてのマウスに対して、前に定義した条件をすべて選択します。
- 後で解析を単純化するために 、Animal-ID と 処理 に正しい名前を付けます。
注: 動物IDはシステムにとって無関係であり、実験者による後のデータ分析にのみ重要です。[処理と制御]グループのグループ化は、システムがグループ化する方法と、後の分析ステップですべてのトラックを比較する方法を知るために重要です。
- [取得]に移動し、実験を開始します。
- 定義済みのテンプレートから新しい実験を作成します。
4. オープンフィールド実験(不安)
- 実験用マウスを実験の直前の行動室に持ち込み、適切なレベルの不安を確保します。
注: 行動実験は、マウスが起きているときに暗い段階で行い、比較可能性を確保するために常に同じ時間帯に入る必要があります。 - マウスをスリーブ経由で光源に合わせるには、ケージのグリッドにそっと押し込みます。
- 10分間新鮮なごみで待機ケージに入れて、ライトケーブルに順応させます。
- ビデオトラッキングソフトウェア(例えば、エトビジョンXT)の スタート ボタンを押して、取得を開始します。
- 待っているケージから開いているフィールドの左上角にマウスを移動します。マウスの代わりにアームを追跡しないように、2秒以内にアームを取り外します。
- 実験中にマウスの視野を離れ、落ち着いてください。
- 実験が終わったら20分後、迷路からマウスを取り出し、ライトケーブルを外してホームケージに戻します。
- マウスを施設に戻します。
5. バーンズ迷路(学習)
- 実験の約1時間前に、すべての実験用マウスを行動室に入れます。
- 1つを除くすべての穴を閉じてバーンズ迷路を準備し、その下にエスケープボックスが置かれます。マウスの開始領域であるプラットフォームの中央にカートンの壁を配置します。
- 両方のインプラントで1つのマウスを光源(ライトケーブルのスリーブ)に接続します。
- 実験が始まる前にマウスが動き回るのを防ぐカートンの壁に、バーンズ迷路の真ん中にマウスを直接置きます。
- ビデオトラッキングソフトウェア(例えば、Ethovision XT)で [開始 ]を押し、カートンを取り外します。
注:ソフトウェアは正しい穴に到達するまでマウスを追跡しますが、ソフトウェアが穴の遷移を認識しない場合に備えて、手動で試行を中止する準備をしてください。 - 迷路からマウスを取り出し、ライトケーブルへの接続を取り外します。
注: 1 回のマウスで試行を複数回実行するトレーニング日の場合は、次のトレーニング セッションが開始されるまで、動作室の隣の待合室にマウスを置いたままにします。この日がテスト日で、マウス 1 回につき 1 回のテスト試行だけであった場合は、マウスを施設に戻します。
6. データ分析(4つの識別可能な試験を伴うオープンフィールドデータの例)
- ビデオトラッキングソフトウェア(例:エチビジョンXT)
- データプロファイルで実験グループと試験を定義します。
- 左側の [データ プロファイル ] に移動し、[ 処理されたコントロールとコントロール] を選択します。
- 中央左の新しいウィンドウで [ネスト ]に移動し、[ 試用制御状態]を選択します。
- 要素アクションから状態間隔を選択 : [トラックを開始 ] 要素 アクション: ライトがオンになります 1.
- [フィルタ]ボックスの [処理] と対応する結果ボックスの間に[ネスト]ボックスを配置します。
注: この定義された間隔は Off1 で、光刺激が存在しない実験の最初の 2.5 分を表します。 - 間隔 On1 のステップを繰り返します (要素アクションから: ライトは 1 に行き、要素アクション: ライトが 1)、オフ 2 (要素から 1 光が要素ライトに出る2)、On2 (要素からアクション: ライトは要素アクション:ストップ トラックに 2 に行きます)。
- コントロール フィルタ グループに対して 4 つの間隔を繰り返します。
注: すべてのネストボックスには、名前Off1、On1、Off2、On2の独自の結果ボックスが必要です。現在、治療群と対照群の両方が、別々に分析される4つの異なる光刺激試験に分かれています。
- 分析プロファイルで分析するパラメータを定義します。
- 左側の [分析プロファイル ] に移動し、[ ゾーン内]を選択します。
- [従属変数を ゾーン内で 選択し、 ゾーンとして中央] を選択します。
- [中央]をダブルクリックし、選択した点のいずれかを選択し、中央でのみを選択します。
- ウィンドウを出る前に 、試用統計 に移動し、[ 頻度]、[ 累積期間 ]、および [待ち時間] を最初に選択します。
- 従属変数 距離移動を追加します。
注: [ グループ統計]で、標準誤差または標準偏差をエラーとして使用するかどうかを選択します。このプロファイルでは、センターでの 使用時間、 センターエントリ 、移動 距離合計 のデータを使用できます。
- データの抽出
- [結果]に移動し、[統計とグラフ] を選択します。
- [計算]を押して、分析されたデータを表示します。
注: 試行統計では、各マウスとグループの統計情報が、対応するバープロットを持つ4つの試行に分かれて、両方のグループの平均と誤差を分析します。 - [データのエクスポート]を押して、試用版の統計と保存する場所を選択します。
注: エクスポートされたデータは、Excel ファイルとして保存され、マウスごとに個別の値が付けられます。この Excel ファイルでは、動物 ID はマウスの識別に役立ちます。 - ヒートマップの視覚化に移動し、ヒートマップのプロットを押します。
- 右の [トライアル ] を選択すると、各マウスとトライアルの個々のヒートマップが表示されます。
- マウスを右クリックして、ヒートマップをイメージとしてエクスポートします。
- データプロファイルで実験グループと試験を定義します。
- プロット
- コンピュータでスプレッドシートファイルを開き、測定された条件とグループごとに4つの試験すべてについて平均と標準誤差(SEM)を計算します。
- 統計プログラム(シグマプロットなど)でグラフを生成します。
- 平均と SEM をスプレッドシート ファイルから Sigma プロットに正しい順序でコピーします。行には Off1、On1 などのデータが含まれ、列には試行、平均、SEM がヘッドとして含まれます。
- 3 つの列をすべて選択し、 グラフの作成に進みます。
- [ バー ] ボックスを選択し、グループ化されていないバー (上行、3 番目のボックス) を選択します。
- [完了] をクリックして、新しいグラフ ページを開きます。
- グラフ全体にラベルを付け、 ホームに移動し、左側の [グラフ ] ボックスを選択して [エクスポート]を押します。保存先のフォルダを選択し、形式として メタファイル (*.wmf) を 選択します。
注: .wmf 形式は、後で CorelDraw のようなグラフィカルなソフトウェアで処理できます。
- 取得したデータの統計を計算します。
- スプレッドシート(Off1、On1など)からSigmaプロットの単一列に生データをコピーします。
- 比較する列をマークして [分析] に移動し 、[t-test] を選択して [実行] をクリックします。
- 次にデータ形式のRawを確認し、完了でテストを実行します。
結果
このプロトコルの目的は、光遺伝学的実験中の遺伝子組み換えマウスの挙動の変化を測定することである。光遺伝学的操作は、アデノ関連ウイルスベクターの注入によって行われる。自由に動くマウスの光刺激は、対象領域の真上に光ファイバーを注入して可能である。
図4では光遺伝学的実験の結果を示す。CHR2を介してIL領域の興奮性錐体ニューロンの強い活性化は、オープンフィールドにおける不安関連の行動を増加しました。ChR2は、錐体ニューロンにおける発現のためにNex-CreマウスのmPFCのIL領域に注入された(図4A)。2つの不安テストの間に、オープンフィールド(図4B,C)および新規性抑制された供給テスト(図4F,G)、ChR2は青色光で刺激され、錐体ニューロンを活性化する。対照として、別の群のマウスは、ChR2の代わりにフルオロフォアtdTomatoの注射を受けた(図4D,G)。このような実験では、不安は、より明るい中心領域の回避と定義される。マウスは捕食者を心配しているため、開いた領域の本質的な回避を示しています。
図4Bに示すオープンフィールド実験では、マウスはそれぞれ5分間の4回の試験を実施した。試験1および3では光刺激が起こらず(Off1,2)、試験2および4では、20Hz(5ms光パルス)および1mWの強度(On1,2)で青色光刺激が行われた。ヒートマップは、実験グループでは、中心期間がオフとオンの試験で異なっていることを示しています。光刺激の間、マウスは優先的に国境地帯にとどまる。コントロール動物も国境を好みますが、光刺激時に行動を変えません。図4Cでは、オープンフィールド実験中の主な行動測定値を実験群について示している。データが正常性のシャピロ・ウィルク検定に合格した場合、統計は独立した両側t検定で行われました。正規性検定が失敗した場合、マン・ホイットニー・ランク合計検定は非パラメトリック代替として使用されました。この種の実験では、実験動物や制御動物のベースライン不安とは無関係に、光刺激が時間の経過とともに不安行動を直接変化させることができるかどうかを調査するために、グループ内比較が選択された。両方の光刺激試験中に中心期間が有意に減少し、不安レベルの増加を示す。移動距離の合計は変更されず、運動の動作が影響を受けないことを示しました。中心エントリの数は大幅に増加しませんでした。図4Dでは、制御グループのデータが表示されます。対照動物は、分析されたパラメータのいずれでもオフとオン試験の間の行動変化を示さなかったので、光刺激または移植が観察された効果を引き起こさなかったことを示した。要するに、このテストは、ChR2を介してILピラミッド型ニューロンの光刺激中に不安が増加したことを示しています。
図5では、上昇プラス迷路の光遺伝学的実験が失敗したデータを示しています。図5Aに示されている上昇プラス迷路実験の間、マウスはそれぞれ3分間の6回の試験を完了した。試験1、3、5では光刺激が行われず(Off1、Off2、Off3)、試験2、4、6では、20Hz(5ms光パルス)および1mWの強度(On1、On2、On3)で青色光刺激が行われた。これらの例示的な結果では、光遺伝学的プロトコルの長さと迷路自体の構築は、トランスジェニックマウスラインには適していなかった。図5Bでは、いくつかのマウスが後ろ足で迷路から滑り落ちたり、倒れたりすることさえ見られます。これが起こったとき、マウスは1日後にEPMを実行する2度目の機会を得ました。彼らが再び倒れた場合、彼らは分析から除外されました。マウスが数回滑り落ちたが迷路にとどまったとき、データは正常に分析された。それにもかかわらず、データは非常に慎重に解釈され、制御動物がより重要になります。ネックス・クレマウスは、狭い両手にとどまるのに運動困難を抱えていた。これを避けるために、1cmの高さの小さな壁は、迷路の腕の後ろ足の安全なホールドのために助けたでしょう。ヒートマップとグラフの両方は、実験的な、およびコントロールマウスが、試験2(On1)から開いた腕を避け始めたことを示しています(図5C-E)。オープンアームのエントリと同様に、両グループのオープンアームの時間が大幅に短縮されます。実験群を分析すると、On1試験中にオープンアームとオープンアームエントリの時間が大幅に減少したため、光刺激の大きな有害作用を含むデータのみが得られた。しかし、このデータを同じ行動を示す対照群と比較すると、観察された行動は光遺伝学的刺激によって媒介されるのではなく、迷路への慣化による一般的にオープンアームの回避によって媒介されないことが明らかとなる。このデータは、光遺伝学的刺激によって媒介される行動効果と可能な行動適応を区別するための適切な対照群の重要性を強調している。また、このデータは、特定のムースラインと実験の質問に合わせて実験の設定を適切に適応させることの重要性に光を当てます。
収集された行動データを検証し、強化するために、マウスの脳は、正しい注射と移植のために制御する最後の実験の後に除去される(図6)。脳は4%パラホルムアルデヒドに固定され、頭蓋骨から取り除かれる。脳は30%のショ糖で1〜2日間脱水され、その後クライオススライスされます。厚さ40μmのコロナ脳スライスは、細胞核を染色するDAPIを含む取り付け媒体を用いて、スーパーフロスト目的スライドに洗浄して取り付けます。これにより、コロナスライス内のターゲット領域を識別できます。YFPタグまたはtdTomato自体の蛍光は、ウイルス注射の位置を示す。図6Bでは、左側のChR2-YFP(黄色)、右側のtdTomato(赤)の例示的な注射部位が提示されている。パキシノスとフランクリン45マウス脳アトラスから適応したテンプレートの助けを借りて、IL領域を同定することができます。両方のスライドでは、光遺伝学的ツールはIL領域だけでなく、隣接する脳領域でも発現する。適切な解釈のために、脳組織における青色光の拡散を8(図1D,E)に相談する。青色光が、繊維先端(図1Dのブルーライン)8で初期1mW光強度の5%未満でILより下のDP領域に到達することが分かる。さらに、光の少量は、後方散乱47のためにPrL領域に上方に行くことができます。その結果、IL領域が最も強く照らされると言えるが、DPおよびPrL領域のような隣接領域もわずかに刺激され得る。したがって、IL細胞特異的刺激は保証されておらず、隣接する領域の免疫体系化学分析を行うべきではなく、PrLおよびDP細胞の活性が光を介して変調されているかどうかを確認する必要がある。図6Cでは、もうひとつの重要なコントロールを示しています:Nex-Creマウスラインの特異性。IL領域における2種類の細胞種に対する抗体染色を介して、グルタミン酸原理ニューロンおよびGABAergicインターニューロンは、それが、ChR2-YFP発現が唯一のGABAergicニューロンではなくグルタミン酸ニューロンで起こることが分かる。
全体として、私たちの実験は、行動検査中の光遺伝学的操作では、不安関連行動の変化が観察できることを示しています。同じ動作に対して複数のテストを使用することで、信頼できる結論を導き出すことができます。さらに、免疫ヒストリカル分析は、得られたデータを確認する。我々の実験は、眼管内皮質における錐体ニューロンの特異的活性化が、特定のアッセイにおける不安関連行動を増加させ、示唆している。
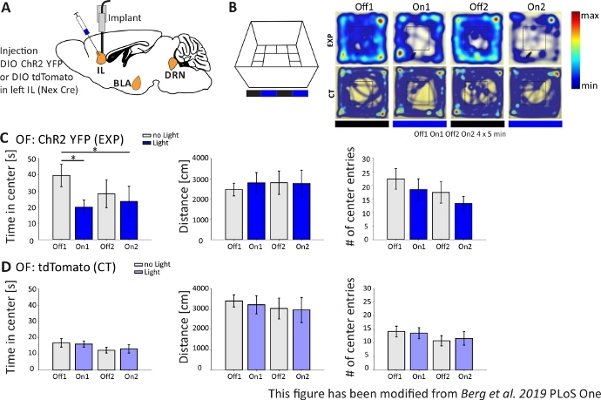
図4: IL錐体ニューロンの光遺伝学的活性化は、不安行動を増加させる。実験中の光刺激:473nm、1 mW、20Hzの刺激。A)ILへのChR2-YFPまたはtdTomatoの注入および注入部位の概略図。実験中、mPFCのIL領域の錐体ニューロンはChR2によって活性化される。 パキシノスとフランクリンマウス脳アトラスから適応したたるみ脳スライス、たるみ:横o,6.B)光刺激プロトコル付きオープンフィールドB迷路(4x5分交互の試験で20分、左)と例示的なChR2注入(EXP)とTdTomato注入(CT)マウスのヒートマップ(右4回の試験)すべて(右)青いレーザー光で刺激されると、EXP動物はOFの中心に費やす時間が少なくなります。CT動物の場合、中心で過ごした時間はライトオフとオン試験の間で異なりません。C)OF 内の EXP 動物のグループ データ、n=11。マウスは、青色光で刺激されたときにOFの中心に大幅に少ない時間を費やす(Off1 39.49±6.9 s、On1 19.87±4.47 s、Off2 28.13±8.55 s、On2 23.42±9.32 s、オフ1:On1、tテスト、p = 0.03;*;オフ 1:On2, MWRS, p=0,049, *).移動距離は影響を受けません(Off1 2703.09±292.65 cm、On1 3113.4±491.15 cm、Off2 3331.86 ±482.62 cm、On2 3082.17±658,61 cm)。# センターエントリの数は時間とともに減少しますが、有意差は表示されません(オフ1 22.36±3.78、On1 18.45±3.95、Off2 17.36±1.99、On2 13.27±2.64)。D)OF 内の CT 動物のグループ データ、n=15。マウスがOFの中心で過ごす時間、移動した距離、中心エントリの#はライトオンとオフの間で変化しません(中央Off116.73±2.65 s、On1 16.02±1.89 s、Off2 12.02±1.76 s、On2 13.04±2.58 s;距離 Off1 3399.69±296.77 cm, On1 3210.6±446.9 cm, Off2 3030.28±513.83 cm, On2 2955±617.7 cm;# センターエントリ Off1 14.2±1.98, On1 13.6±2.02, Off2 10.8±1.88, On2 11.67±2.5)。CTマウスは有意に高いベースライン不安を示す(オフ1 EXP:CT、MWRS、p=0.005、**)。平均値は平均±S.E.M. * は有意差を示します (p≤0.05), ** 有意な差を示します (p≤0.01).t-テストは常に両側、MWRS:マンホイットニーランクサムテスト。IL: 赤外線皮質;BLA: バソラテラアミダラ;DRN: 後回しのラフェ核;OF: オープンフィールド;CT: コントロール動物;EXP: 実験動物;L:光。この図は、ベルクら 2019, PLoS One43およびベルク 201948から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
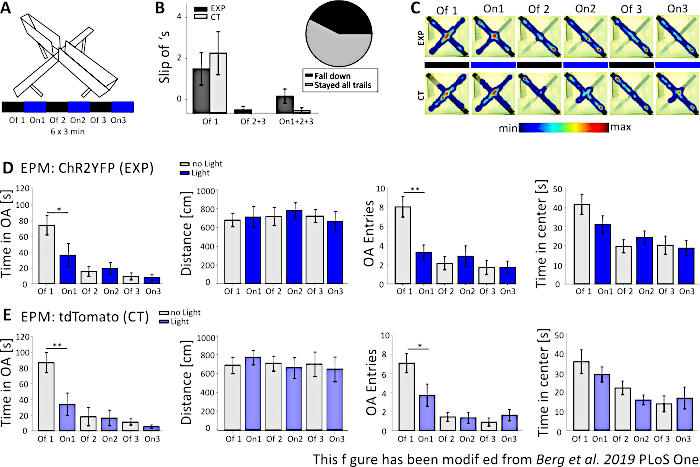
図5: EPM実験は、Nex-Creマウスの行動効果を示すことができなかった。実験中の光刺激:473nm、1 mW、20Hzの刺激。 A)光刺激プロトコルを備えた上昇プラス迷路(18分、6x3分、オフとオン試験を交互に)。 B)「滑り落ちる」マウスのグループデータは、データに含まれます(合計n=23)。Nex-Creマウスは、実験群とは無関係に、背中の足で開いた腕から滑り落ちる傾向があった(左)。後の分析では、6つの試験すべてのために迷路にとどまったマウスだけが考慮された。最初のオフ1フェーズでスリップオフは、後でオープンアームを回避する理由です(Off1 EXP 1.63±0.6、CT 2.2±0.79、オフ2+3 EXP 0.125±0.125、CT 0±0、On1+2+3 EXP 0.625±0.26、CT 0.10.10±)。円グラフ(右)は、18分の間に迷路から落ちるマウスを42.42%と示しています。実験を終えたのはわずか57.57%でした。 C)実験の全6回試験における例示的EXPおよびCTマウスのヒートマップ。両方のグループは、Off1トライアルの後にオープンアームの期間の減少を示しています。 D)EPM 内の EXP 動物のグループ データ、n=12。オープンアームで過ごした時間は、最初の2回の試験の間に大幅に減少し、その後絶えず(Off1 73.91±12.22 s、 On1 36.15±14.65 s, Off2 15.61±6.23 s, On2 19.49±7.51 s, Off3 9.36±4.44 s, On3 7.96±3.47 s. Off1:On1, tテスト, p=0,041, *)。移動距離は影響を受けません(Off1 679.96±71.63 cm、On1 712.24±112.82 cm、Off2 717.49.49±97.39 cm、On2 782.51±81.11 cm、オフ3 722.11±68.60 cm、オン363.9±0cm)。オープンアームエントリの量はOff1からOn1に大幅に減少し、その後一定のままです(Off1 8.08±1.08、On1 3.33±0.76、Off2 2.16±0.69、On2 2.91±1.09、Off3 1.73±0.75、On3 1.73±0.66)。オフ 1:On1、t テスト、p=0.002、**)。EPMの中心で費やされる時間は試験に沿って減少しますが、オフからオントライアル(Off1 41.71±5.34 s、On1 31.2±4.59 s、Off2 19.8±3.44 s、On2 24.49±3.38 s、Off3 20.37±4.77s、On17.88)と大きな差はありません± E)EPM 内の CT 動物のグループ データ、n=11。CTデータはEXPデータと同じ有意な減少を示し、実験が正常に機能していないことを示しています(オープンアームの時間Off1 86.92±12.74s、 On1 33.78±14.38 s, Off2 18.01±11.61 s, On2 16.41±9.61 s, Off3 11.36±4.01 s, On3 5.43±2.07 s. Off1:On1, MWRS, p=0.009, **;距離 Off1 705.11±88.36 cm, On1 789.45±77.53 cm, Off2 724.74±80.49 cm, On2 676.57±111.99 cm, Off3 716.99±132.47 cm, On3 663.03±13.46cm;オープンアームエントリーOff1 7.09±1,On1 3.72±1.17,Off2 1.45±0.47,On2 1.36±0.58,Off3 0.91±0.43,Off3 1.64±0.59。オフ 1:オン1、MWRS、p=0.01、*;時間は、センターOff1 35.89 s、On1 29.25±3.96 s、Off2 22.17±3.58 s、On2 15.9±2.57 s、Off3 13.86±4.2、On3 16.89±±5.75 s)で過ごします。平均値は平均± S.E.M. * 有意な差を示す (p≤0.05), ** 有意な差を示す (p≤0.01).t検定は常に両側、MWRS:マン・ホイットニーランクサム検定です。EPM: 上昇プラス迷路;CT: コントロール動物;EXP: 実験動物;OA:両手を開く。この図は、ベルクら 2019, PLoS One43 およびベルク 201948から変更されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
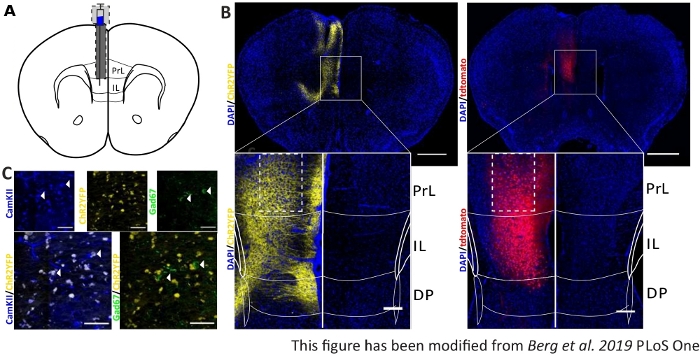
図6:ILおよびNex-Cre特異性におけるChR2およびtdTomatoの注入側。A)AP+1.66mm、mL 0.3mm、DV-1.8mmのコロナ脳スライス上の移植部位の模式図、一方的な注射および注入(マウス脳アトラス、パキシノスとフランクリン、ブレグマ+1.54mmから適応)。BB)Nex-Creマウスにおいて、ChR2-YFP(左、黄色)およびtdTomato(右、赤)の例示的な注射部位がDAPI染色細胞核(青)と結合した。スケールバー 1 mm。インセットはIL領域の高倍率を示す。スケールバー150 μm。白いボックスは、インセットの位置を示します。C)上行:グルタミン酸ニューロン(青)のマーカーとしてCamKIIで染色されたネックスクレマウスの左IL領域の共焦点像(青)、およびNex-CreマウスのGABAergicニューロン(緑色)のマーカーとしてChR2-YFP(黄色)またはGad67。下段:ChR2-YFP(黄色)とCamKII(左、青)の共局在化(左、青)は、Gad67(右、緑)では、グルタミン酸神経細胞に対するNex-Creマウスの特異性を示す。スケールバー50 μm。PrL: 前脳皮質;IL: 赤外線皮質;DP:後部足行皮質。この図は、ベルクら 2019, PLoS One43およびベルク 201948から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
光を使って神経信号を操作することは、10年近く前から選択されています。,2005年以降、新しい光遺伝学的ツール,,44、6、8、14、49、50、51の開発に関する論文の発表数と、6,814,49,脳回路5121、23、40、43、52,52の研究に利用される研究が大幅に増加しました。21,235040,43,一方で、注射可能な光遺伝学的ツール、移植変異体、トランスジェニックマウスラインおよび行動実験の巨大な多様性により、実験の可能性は多様で無制限である。一方、実験条件を選択する際に障害を起させる可能性は非常に高く、実験は非常に特異的であり、しばしば他の研究との比較が困難である。
重要なステップ
このプロトコルの重要な重要なステップの 1 つは、適切な計画です。光遺伝学的ツールの選択は、科学的な質問と一致する必要があります。ニューロンやシナプスの全体的な活性を操作する必要がありますか?その後、市販のChR22121、25、27、Arch25,27 37などのツールが良い選択です。しかし、それとは別に、1つの特別な神経伝達物質システム、あるいは単一の受容体が操作されるべきならば、個々の受容体キメラはしばしばより良い選択である3、6。6GPCRsを持ついくつかの受容体キメラ、いわゆるOpto-Xr、およびそれらを生成するためのガイドラインは、すでに44、5050利用可能です。光遺伝学的ツールの選択以外に、行動実験と組み合わせたマウスラインも重要です。C57Bl/6 や BALB/cByJ のような異なるバックグラウンド株は、いくつかの点で異なる行動の型を表示します53,,54.C57Bl/6マウスはベースライン不安が低く、抗不安作用に使用できるのに対し、BALB/cByJは不安レベルが高いため、抗不安薬に対してより敏感である。さらに、これらのバックグラウンド株のトランスジェニック変異体も、その表現型48において変化し得る。光遺伝学的ツールおよびトランスジェニックマウスラインと組み合わせて特定のプロモーターの適切な組み合わせを使用すると、ほぼすべての所望の細胞集団を標的とすることができる。
手術中の重要なステップは、正しい場所をターゲットにしています。マウス脳アトラスの助けを借りて、前部後軸、および内側横軸に対する適切な座標、および構造の深さが45に確立され得る。実際には、すべての頭蓋骨は少し異なる形と大きさを持っています。したがって、F因子46 は、立体的手術中の正しい鼻および耳の固定と同様に、立体的座標を調整することは非常に重要である。マウスの頭部が傾いている場合、注入canulaは目的の領域をターゲットにすることができません。
さらに、注入カヌラの直径も重要です。それが小さすぎると、ウイルスを組織に放出することはなく、広すぎると、カヌラは関心のある領域に向かう途中でウイルス溶液を漏らします。埋め込まれた光ファイバーが標的領域の真上で終了する場合、上記皮質領域におけるウイルス発現は重要ではない。しかし、インプラントが軸索末端を刺激するために他の領域の上に置かれる場合、上皮質領域の軸索も光によって活性化され、得られたデータを改ざんする。例として:IL領域と前脳(PrL)領域は、両方とも基礎扁桃体55、56に投影するが、不安26、57の変調において全く異なる26機能と役割を有する。56 57インプラントが扁桃体の上に配置されてIL領域から軸索末端を活性化し、かつ注入ウイルス溶液が誤った注入カヌラのためにPrLに入れられた間に、PrLから軸索末端も活性化するリスクが非常に高い。
インプラントの固定のための頭蓋骨の準備の間に、プライマーおよび結合のまばらな使用は信頼でき、耐久の固定のために重要である。2成分接着システムが薄く適用されない場合、歯科用セメントは数日または数週間後に頭蓋骨から切り離される可能性があります。さらに、そうでなければセメントが頭蓋骨に適切に取り付けられなくなるので、頭蓋骨はまたインプラントを固定する前に完全に乾燥しなければならない。
このプロトコルの動作部分には、重要なステップも存在します。まず、迷路の建設は非常に重要です。すべての動作設定では、サイズとフォームに関する文献に、また、プロシージャ自体58、59、6059に関するいくつかの変種が60存在します。58データを比較可能で再現可能にするバリアントを選択することが重要です。また、使用されるマウスラインの特別な要件は、考慮に入れるべきである 43,,48.EPMの代表的なデータでは、いくつかのNex-Creマウスが迷路から落ちたり、数回滑り落ちたりすることが分かります(図2b)。これらのマウスにとって、両手を広げて小さな壁を持つ迷路は、より良い選択肢だったでしょう。
第二に、すべての外部室条件を一定に保つことが重要である61、そうでなければマウスの異なるグループは全く比較できないであろう。この点で、実験の時間を実験の設定が空いていて、実験者が常に存在する場所として選択することが非常に重要です。さらに、建設工事、システムの試験(火災報知器)やマウス施設の清掃日など、建物内のイベントは、取得したデータとの干渉を避けるために考慮する必要があります。
最後に、行動実験には取り扱いや住宅条件が重要です。移植が行われると、他のマウスによる傷害のリスクがあるため、マウスは単座に収容される必要があります。グループ間の良好な比較と1つのグループ内の低いエラーを確保するために、すべてのマウスは同じケージサイズと濃縮を持っている必要があります。不安関連の実験では、単一のハウジングは、単一の住宅は、singe収容された雄マウスがより低いベースライン不安レベル、不安レベルの変動が少なく、およびより少ないうつ病のような症状15、16を示すようにいくつかの利点を16有する。グループ収容雄マウスは、マウス間の階層のために不安レベルが大きく異なる可能性があります。ハウジングに加えて、すべてのマウスとグループの一定の平等な取り扱いも重要です。インプラントの光ファイバーを接続するためにマウスをつかむことは非常にストレスです。したがって、この手順は、同じ手法と同じ実験者を意味し、すべてのマウスで同じである必要があります。さらに、ストレスの多い接続手順からマウスを落ち着かせるための待機ケージの習慣化時間は、迷路までの期間、ごみ、位置において等しい条件を持つ必要があります。マウス機能内での処理は、後での動作のパフォーマンスにも重要です。実験動物とコントロール動物は、マウスにとってもストレスであるため、異なる日や異なる人々によって洗浄されるべきではありません。さらに、動作の違いを避けるために、洗浄日は実験日であってはなりません。
トラブルシューティング
プロトコル中に発生する可能性のあるいくつかの問題があります。例えば、定位手術中に頭蓋骨全体を掘削すると血管に損傷を与える可能性があります。通常、強い出血は、特にブレグマおよびλの上に起こる。これが起こった場合、彼らはその吸収性のために血管からさらに多くの出血を拡張する傾向があるので、綿棒で出血を止めようとしないでください。
また、ウイルス溶液の圧力注入が機能しないことも起こり得る。この場合、パラフィルム、バリ穴または脳組織からのかさぶたがカヌラの先端を詰まらせている可能性がある。この場合、X軸またはy軸を変更せずに脳からゆっくりとカニューラを取り出し、ツイーザを使用してカニューラ先端の前部の1〜2mmを除去します。再度カンデュラを下げる前に、少量の圧力を加え、ウイルスがカニューラチップから出ているかどうかを確認して機能をテストします。便秘を避けるために、一定の速度でカヌラを下げ、注射側の最も深い深さに達するまで動きを止めないでください。カニューラ先端の多くが除去され、直径が大きすぎると、カニューラは組織に損傷を与え、ウイルスを一度に適用するリスクが高くなります。したがって、チップの詰まった部分のみが慎重に取り除かれないようにしてください。
行動実験中に、ビデオトラッキングソフトウェア(例えば、Ethovision XT)での実験のセットアップが問題を引き起こす可能性があります。たとえば、光出力が正常に動作しない場合、これはいくつかの理由が考えられます。Pulserは、エトビジョンXTが開かれる前に開かれ、プログラムされ、開始されなければならない。ハードウェアは「実験用セットアップ」で正しく選択する必要があります(ステップ3.2.2.4)。間違ったIO-Box、または「コスチュームハードウェア」以外が選択されている場合、Pulserデバイスはエチビジョンによって制御することはできません。光出力のテストが成功しても、取得時に「試行制御設定」のプログラムされたライトプロトコルが機能しない場合、サブルールまたはサブルールの参照が正しく見つからないか、条件とアクションが不明である可能性があります。たとえば、参照は正しいサブルールに属していますか?参照は正しくプログラムされていますか (たとえば、サブルールの実行頻度など)。
さらに、「検出設定」の間に動物が適切に追跡される可能性がありますが、取得中に被験者が見つからないサンプルがあります。この場合、実験室の照明が変更されたか、迷路内で不要な影が生じなかったかを確認します。設定は1つの特定の組み合わせに対してのみ動作するので、迷路の底部全体は同じ色を持っている必要があります。何らかの理由で異なる下の色や影を避けることができない場合は、迷路の最も暗い部分で検出設定を定義します。
最初の動物の取得後に設定を変更する場合は、すでに使用されている設定でこれらの変更を適用しないでください。それらを調整するためにそれらを複製します。これは、既に記録されている試用版がデータ分析に対して有効でなくなったことも意味します。このような場合は、この実験グループのすべての動物を元の設定で記録し、その後、ライブトラッキングの代わりに記録されたビデオを分析する新しい実験を作成します。この「ビデオから」実験では、動物間の比較性やデータを失うことなく、いくつかの設定を分析に使用できます。
制限事項と将来のアプリケーション
自由に動く動物の光遺伝学で行動を操作するこの方法には、制限も含まれる。手術中、2つのインプラントの近接性が制限される。二重注入の場合、2つのインプラント間の距離は、インプラントを保持する装置の幅を最小限にする必要があります。装置は、第1のインプラントが既に固定されている間、バリ穴に第2のインプラントを下げる必要がある。,この解決策は、ガラス繊維の先端が非常に近く、頭蓋骨の上のセラミックフェルールが,23、55、56、57、62、63の方が大きいとき23,55,5657、62斜めの注入であるかもしれません。63斜めの埋め込みの欠点は、光の広がりです。繊維先端が真上からではなく傾斜すると、刺激された領域が異なる。近接して2つのターゲット領域の場合、光刺激の位置の変化を考慮する必要があります。
行動実験の間、迷路の建設は動物に接続された光ケーブルに干渉するかもしれない。明暗ボックスなどの一部の動作テストには、屋内領域64、,65が含まれており、他の迷路にはマウスが入力する必要があるコンパートメントが含まれています。このような実験は、この設定では実行できません。または、ワイヤレス システムはオプション22、26、6626,66です。22しかし、幸いなことに、バーンズ迷路のようないくつかの迷路は、マウスが関連するコンパートメント67に入ることができるような方法で配置することができます。
閉鎖されたゾーンを持つものに加えて、広すぎる迷路も問題を引き起こす可能性があります。迷路の面積が大きいほど、動物が迷路内のすべての位置に移動できるようにケーブルが長くならなければなりません。動物がケーブルを踏んだり、それをつかんで噛むことができないことを注意する必要があります。その解決策は、冗長ケーブルをロールアップする構造である可能性があります。欠点は、ケーブルを展開するドラッグがマウスにとって難しいということです。この溶液は、ラットに適した方が良いでしょう。別の可能な選択肢は、実験中ではなく、光刺激を事前に行うためであり得るが、もちろんこれは光刺激による長期的な効果が23に生じる場合にのみ実現可能である。
既存/代替方法との比較
別の方法は、行動88、1818の間に化学的または電気的刺激である。化学アゴニストまたはアンタゴニストは、特定の受容体を介してニューロンを活性化または沈黙させることができ、また、単一の神経伝達物質システム38、68,68を操作することができる。一方で、受容体特異性は、特定のアゴニストまたはアンタゴニストが特定の受容体39のみを活性化するので、化学物質にとって非常に高い。一方、同一神経伝達物質群の受容体サブタイプに対する特異性は、しばしば不十分である。ほとんどの化学物質は、確率が異なる少なくとも2つのサブタイプに結合する。さらに、化学物質は、同じ受容体タイプを持っている限り、神経細胞タイプを区別することはできません。それ以上に、時間的および空間的分解能は、光遺伝学と比較して化学操作に対して貧弱である。アゴニストまたはアンタゴニストは、しばしば経口35または全身注射57、70,70を介して投与される。化学物質の注入が脳組織で直接行われる場合、効果は経口用途よりも速く現れるが、光刺激よりも遅いタイムスケールではまだ遅い。投与された化学物質は脳内に拡散し、神経細胞の種類や脳領域に特異的ではないため、特定の脳回路の操作は不可能である。
電気刺激は、化学的刺激99,1414よりも高い時間分解能を有する。神経組織内の広がりは化学的刺激よりも少なく、空間分解能は化学的刺激よりも優れています。しかし、電気刺激は、電極に近接するすべてのニューロンが電気刺激に応答するので、異なるニューロン細胞タイプまたは受容体タイプに特異的に対処する可能性を欠いている。
自由に動くマウスにおける行動の代替方法は、例えば脳スライスにおける電気生理学的記録であり、そこで単一のニューロンまたは軸索を光遺伝学で変調することができ、誘引効果は、記録電極66、7171を介して測定することができる。インビトロ実験は、光遺伝学的刺激の分子および細胞基盤を調査する可能性を提供するが、他の脳領域からの本質的な接続性および入力が欠落しているという制限がある。もう一つの選択肢は、光遺伝学を多光子イメージング11,72と組み合わせて使用することです。この場合、マウスは頭を固定し、麻酔をしたり、単純なタスクを解決するために目を覚ますことができます。
光遺伝学的実験を成功させるために、幅広いツールやアプリケーションが利用可能です。光遺伝学的ツールの選択と行動のセットアップは、特定の研究の質問に答えるために重要です。ツールと実験の適切な組み合わせを選択した場合、光遺伝学は、高い時間的および空間的分解能を持つニューロン回路の前例のない、詳細な調査を可能にします。これは、精神疾患や認知のための新しい治療戦略を理解し、開発するのに役立ちます.
開示事項
著者らは開示するものは何もない。
謝辞
クラウス・アルミン・ナルヴェ教授とサンドラ・ゲッベルス博士(ドイツ・ゲッティンゲンのマックス・プランク実験医学研究所)に感謝します。また、この記事のJoVEビデオの録画と処理に関するビデオチームのユヌス・ディキチとルーベン・ヴィースナーに感謝します。さらに、クリスティン・クラウセンのナレーションとキンバリー・アン・ゴーが原稿を校正してくれたおかげです。
提示された結果はボーフムのルール大学で得られ、ビデオはブレーメン大学で記録されました。
この作品は、ドイツ・フォルシュングスゲマイインシャフト(DFG、ドイツ研究財団)によって資金提供されました - Projektnummer 122679504 - SFB 874とDFG MA 4692/3-2。
資料
| Name | Company | Catalog Number | Comments |
| Ketamin | Sigma-Aldrich | K2753-64 | Anestasia |
| 20 % Glucose | AlleMan Pharma | Injection s.c. for fast recovery | |
| Behavioral mazes | Costum made | Measure anxiety | |
| Bepanthen | Bayer | Ophthalmic oinment | |
| Betaisodona | Monodipharma | Sterilant containing iodine | |
| Betaisodona | Monodipharma | Iodine oinment | |
| Binocular | Olympus | SZ52, 110AL0.62x WD160 | Surgery |
| Ceramic ferrules | Thorlabs | CFLC230-10 | Implant |
| Ceramic Fiber Scribe | Thorlabs | CSW12.5 | Cutting of the glass fiber |
| Channelrhodopsin2-YFP virus | Penn Vector Core | Addgene 20298 | Optogenetic tool |
| Compressed air | Kontakt Chemie | Druckluft 67 | Drying of the skull |
| Coordinate system | Stoelting | Stereotactic coordinates for the surgery | |
| Correl Draw | Graphical software version 13 | ||
| Cryoslicer | MICROM | HM500OM | Production of brain slices for staining |
| Ethovision XT 14 | Noldus | Software for behavioral tracking | |
| Exel | Statistical Software | ||
| Ferrule Polishing Puck | Thorlabs | D50-F | Polishing implants round side |
| Fiber Patch Cord dual | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cables, which are connected with the two implants of a bilateral implantation |
| Fiber Patch Cord single | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cable, which is connected with the implant via a sleeve |
| Fiber Stripping Tool | Thorlabs | T06S13 | Stripping glass fiber for implant |
| Filter paper | VWR European | 516-0300 | Cut into pieces for the Novelty-Suppressed Feeding test |
| Food pellets | Mühle Levers | Höveler Nagerfutter | Nutrition for the mice |
| Glass pipettes | Harvard Apparatus | GC150-10 | Injection pipettes |
| Gradia direct-Flo | Henry Schein | 103322 | Fluid dental cementum |
| Heating lamp | efbe-Schott/Phillips | R95E | Prevent the mice from cooling after the surgery |
| Heating plate | Stoelting | Integrated into coordinate system | |
| Injection canula | Braun | 100 Sterican, 0,4 x 20 mm, Gr. 20 | All injections and to bore hole into the skull |
| Litter | T 1350 | Grounding for the Novelty-Supressed Feeding test | |
| Mouse cages | Zoonlab | 405 cm^2 | Single housing for experiments |
| Optibond FL | Kerr | 26684E | Preparation of the skull for implantation |
| Optical glass fiber | Thorlabs | FT200EMT | Light fiber for implant |
| Optogenetics-LED.STSI | Prizmatix | Optogenetic toolbox for light stimulation during behavioral experiments | |
| Paraformaldehyde | Sigma-Aldrich | 16005-1KG-R | Perfusion of mice to remove the brains |
| Polishing sheet 0.02 µm grit | Thorlabs | LFCF | Polishing implants round side |
| Polishing sheet 1 µm grit | Thorlabs | LF1D | Polishing implants round side |
| Polishing sheet 30 µm grit | Thorlabs | LF30D | Polishing implants round side |
| Polishing sheet 6 µm grit | Thorlabs | LF6D | Polishing implants round side |
| Pulser Software | Prizmatix | Software for light device control | |
| Rimadyl-Carprofen | Zoetis | Analgesia | |
| Sigma Plot | Software for statistics | ||
| Sleeve | Thorlabs | FT200EMT | Connection of implant and light cable |
| SodiumCloride (NaCl) | Braun | 3570410 | Rinsing of the skull |
| Superglue | Pattex Henkel | To Fix the glass fiber in the ferrule | |
| td-Tomato virus | Penn Vector Core | Addgene 51503 | Optogenetic tool |
| UV light | KoQGHJ | wireless, 1200 mW/cm^2 | Polymeration lamp for dental cementum |
| Xylavet-Xylazin | cp pharma | Anesthesia |
参考文献
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature Letters. 463, 98-102 (2010).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Spoida, K., Masseck, O. A., Deneris, E. S., Herlitze, S. Gq/5-HT2c receptor signals activate a local GABAergic inhibitory feedback circuit to modulate serotonergic firing and anxiety in mice. Proceedings of the National Academy of Science of the United States of America. 111, 6479-6484 (2014).
- Kleinlogel, S. Optogenetic user's guide to Opto-GPCRs modified GPCRs. Frontiers in Bioscience. 21, 794-805 (2016).
- Mahn, M., Prigge, M., Ron, S., Levy, R., Yizhar, O. Biophysical constraints of optogenetic inhibition at presynaptic terminals. Nature Neuroscience. 19, 554-556 (2016).
- Masseck, O. A., et al. Vertebrate Cone Opsins Enable Sustained and Highly Sensitive Rapid Control of Gi/o Signaling in Anxiety Circuitry. Neuron. 81, 1263-1273 (2014).
- Oh, E., Maejima, T., Liu, C., Deneris, E., Herlitze, S. Substitution of 5-HT 1A Receptor signaling by a light-activated G protein-coupled receptor. Journal of Biological Chemistry. 285, 30825-30836 (2010).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in Neural Systems. Neuron Primer. 71, 9-34 (2011).
- Masseck, O. A., Manahan-Vaughan, D. A Guide to Optogenetic Applications, With special Focus on Behavioral and In Vivo Electrophysiological Experiments. HandboOk of In Vivo Neural Plasticity Techniques - A Systems Neuroscheince Approach to the Neural Basis of Memory and Cognition. , 557 (2019).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. , 611-621 (2006).
- Yang, Y. S., Hughes, T. E. Cre Stoplight: A red/green fluorescent reporter of Cre recombinase expression in living cells. Biotechniques. 31, 1036-1041 (2001).
- Schnütgen, F., et al. A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse. Nature Biotechnology. 21, 562-565 (2003).
- Taniguchi, H., et al. A Resource of Cre Driver Lines for Genetic Targeting of GABAergic Neurons in Cerebral Cortex. Neuron. 71, 995-1013 (2011).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 268-273 (2011).
- Palanza, P., Gioiosa, L., Parmigiani, S. Social stress in mice: Gender differences and effects of estrous cycle and social dominance. Physiology and Behavior. 73, 411-420 (2001).
- Karolewicz, B., Paul, I. A. Group housing of mice increases immobility and antidepressant sensitivity in the forced swim and tail suspension tests. European Journal of Pharmacology. 415, 197-201 (2001).
- Masseck, O. A., Rubelowski, J. M., Spoida, K., Herlitze, S. Light- and drug-activated G-protein-coupled receptors to control intracellular signalling. Experimental Physiology. 96, 51-56 (2011).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4, (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature Article. 446, 633-639 (2007).
- Owen, S. F., Liu, M. H., Kreitzer, A. C. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience. 22, 1061-1065 (2019).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nature Communication. 10, 1-12 (2019).
- Allsop, S. A., Vander Weele, C. M., Wichmann, R., Tye, K. M. Optogenetic insights on the relationship between anxiety-related behaviors and social deficits. Frontiers in Behavioral Neuroscience. 8, 1-14 (2014).
- Fuchikami, M., et al. Optogenetic stimulation of infralimbic PFC reproduces ketamine's rapid and sustained antidepressant actions. Proceedings of the National Academy of Science of the United States of America. 112, 8106-8111 (2015).
- Correia, P. A., et al. Transient inhibition and long-term facilitation of locomotion by phasic optogenetic activation of serotonin neurons. Elife. 6, 1-26 (2017).
- Felix-Ortiz, A. C., Burgos-Robles, A., Bhagat, N. D., Leppla, C. A., Tye, K. M. Bidirectional modulation of anxiety-related and social behaviors by amygdala projections to the medial prefrontal cortex. Neuroscience. 321, 197-209 (2016).
- Marek, R., Xu, L., Sullivan, R. K. P., Sah, P. Excitatory connections between the prelimbic and infralimbic medial prefrontal cortex show a role for the prelimbic cortex in fear extinction. Nature Brief Communication. , (2018).
- Parfitt, G. M., et al. Bidirectional Control of Anxiety-Related Behaviors in Mice: Role of Inputs Arising from the Ventral Hippocampus to the Lateral Septum and Medial Prefrontal Cortex. Neuropsychopharmacology. 42, 1715-1728 (2017).
- Bandelow, B., Michaelis, S. Epidemiology of anxiety disorders in the 21st century. Dialogues in Clinical Neuroscience. 17, 327-335 (2015).
- Kessler, R. C., et al. Lifetime Prevalence and Age-of-Onset Distributions of DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 62, 593-602 (2005).
- Kessler, R. C., Petukhova, M., Sampson, N. A., Zaslavsky, A. M., Wittchen, H. U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. International Journal of Methods Psychiatric Research. 21, 169-184 (2014).
- Andlin-Sobocki, P., Wittchen, H. U. Cost of anxiety disorders in Europe. European Journal of Neurology. 12, 39-44 (2005).
- Forster, G. L., Novick, A. M., Scholl, J. L., Wall, M. J. The Role of the Amygdala in Anxiety Disorders. Intech. , 61-102 (2012).
- Liberzon, I. Neural circuits in anxiety and stress disorders a focused review. Therapeutics and Clinical Risk Management. 11, 115-126 (2015).
- Sylvers, P., Lilienfeld, S. O., LaPrairie, J. L. Differences between trait fear and trait anxiety: Implications for psychopathology. Clinical Psychology Review. 31, 122-137 (2011).
- Daws, L. C., Koek, W., Mitchell, N. C. Revisiting Serotonin Reuptake Inhibitors and the Therapeutic Potential of 'Uptake-2' in Psychiatric Disorders. ACS Chemical Neuroscience. 4, 16-21 (2013).
- Felix-Ortiz, A. C., et al. BLA to vHPC inputs modulate anxiety-related behaviors. Neuron Report. 79, 658-664 (2013).
- Padilla-Coreano, N., et al. Direct Ventral Hippocampal-Prefrontal Input Is Required for Anxiety-Related Neural Activity and Behavior. Neuron Article. 89, 857-866 (2016).
- Lisboa, S. F., Stecchini, M. F., Corrêa, F. M. A., Guimarães, F. S., Resstel, L. B. M. Different role of the ventral medial prefrontal cortex on modulation of innate and associative learned fear. Neuroscience. 171, 760-768 (2010).
- Bi, L. L., et al. Enhanced excitability in the infralimbic cortex produces anxiety-like behaviors. Neuropharmacology. 72, 148-156 (2013).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature Article. 477, 171-178 (2011).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. 44, 611-621 (2006).
- Rubenstein, J. L. R., Merzenich, M. M. Model of autism: increased ratio of excitation/ inhibition in key neural systems. Genes, Brain and Behavior. 2, 255-267 (2003).
- Berg, L., Eckardt, J., A, M. O. Enhanced activity of pyramidal neurons in the infralimbic cortex drives anxiety behavior. PLoS One. 14, 1-19 (2019).
- Meunier, C. N. J., Amar, M., Lanfumey, L., Hamon, M., Fossier, P. 5-HT1A receptors direct the orientation of plasticity in layer 5 pyramidal neurons of the mouse prefrontal cortex. Neuropharmacology. 71, 37-45 (2013).
- Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J. . Mouse Brain in Stereotaxic Coordinates. 2, (2004).
- Gore, B. B., Soden, M. E., Zweifel, L. S. Manipulating gene expression in projection-specific neuronal populations using combinatorial viral approaches. Current Protocols in Neuroscience. 435, 1-6 (2014).
- Stujenske, J. M., Spellman, T., Gordon, J. A. Modeling the Spatiotemporal Dynamics of Light and Heat Propagation for InVivo Optogenetics. Cell Report. 12, 525-534 (2015).
- Berg, L. Imbalance of excitation and inhibition within the prefrontal cortex supports anxiety behavior. Ruhr-University Bochum. , (2019).
- Boyden, E. S. A history of optogenetics: The development of tools for controlling brain circuits with light. F1000 Biology Reports. 3, 1-12 (2011).
- Airan, R. D., Thompson, K. R., Fenno, L. E., Bernstein, H., Deisseroth, K. Temporally precise in vivo control of intracellular signalling. Nature. 458, 1025-1029 (2009).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7, 12-23 (2012).
- Covington, H. E., et al. Antidepressant Effect of Optogenetic Stimulation of the Medial Prefrontal Cortex. Journal of Neuroscience. 30, 16082-16090 (2010).
- Lepicard, E. M., Joubert, C., Hagneau, I., Perez-Diaz, F., Chapouthier, G. Differences in anxiety-related behavior and response to diazepam in BALB/cByJ and C57BL/6J strains of mice. Pharmacology, Biochemistry and Behavior. 67, 739-748 (2000).
- Schmidt, M. V., Müller, M. B. Animal models of anxiety. Elsevier. 3, 369-374 (2006).
- Cho, J. H., Deisseroth, K., Bolshakov, V. Y. Synaptic Encoding of Fear Extinction in mPFC-amygdala Circuits. Neuron Article. 80, 1491-1507 (2013).
- Adhikari, A., et al. Basomedial amygdala mediates top-down control of anxiety and fear. Nature. 527, 179-185 (2015).
- Suzuki, S., et al. The infralimbic and prelimbic medial prefrontal cortices have differential functions in the expression of anxiety-like behaviors in mice. Behavioural Brain Research. 304, 120-124 (2016).
- Carola, V., D'Olimpio, F., Brunamonti, E., Mangia, F., Renzi, P. Evaluation of the elevated plus-maze and open-field tests for the assessment of anxiety-related behaviour in inbred mice. Behavioural Brain Research. 134, 49-57 (2002).
- Prut, L., Belzung, C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: A review. European Journal of Pharmacology. 463, 3-33 (2003).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature Letter. 471, 358-362 (2011).
- Bouwknecht, J. A., et al. Differential effects of exposure to low-light or high-light open-field on anxiety-related behaviors: Relationship to c-Fos expression in serotonergic and non-serotonergic neurons in the dorsal raphe nucleus. Brain Research Bulletin. 72, 32-43 (2007).
- Overstreet, D. H., Knapp, D. J., Angel, R. A., Navarro, M., Breese, G. R. Reduction in repeated ethanol-withdrawal-induced anxiety-like behavior by site-selective injections of 5-HT1A and 5-HT2C ligands. Psychopharmacology. 187, 1-12 (2006).
- Takahashi, A., et al. Glutamate Input in the Dorsal Raphe Nucleus As a Determinant of Escalated Aggression in Male Mice. Journal of Neuroscience. 35, 6452-6463 (2015).
- Klemenhagen, K. C., Gordon, J. A., David, D. J., Hen, R., Gross, C. T. Increased Fear Response to Contextual Cues in Mice Lacking the 5-HT1A Receptor. Neuropsychopharmacology. 31, 101-111 (2006).
- Ramos, A. Animal models of anxiety: do I need multiple tests. Trends in Pharmacological Science. 29, 493-498 (2008).
- Isosaka, T., et al. Htr2a-Expressing Cells in the Central Amygdala Control the Hierarchy between Innate and Learned Fear. Cell. 163, 1153-1164 (2015).
- Regev, L., Goshen, I. Employing Optogenetics in Memory Research. Optogenetics: A Roadmap. , 219-256 (2017).
- Shah, A. A., Sjovold, T., Treit, D. Inactivation of the medial prefrontal cortex with the GABA A receptor agonist muscimol increases open-arm activity in the elevated plus-maze and attenuates shock-probe burying in rats. Brain Research. 1028, 112-115 (2004).
- Knight, A. R., et al. Pharmacological characterisation of the agonist radioligand binding site of 5-HT2A, 5-HT2B and 5-HT2C receptors. Naunyn-Schmiedebergs Archiv of Pharmacology. 370, 114-123 (2004).
- Graeff, F. G., Viana, M. B., Mora, P. O. Dual Role of 5-HT in Defense and Anxiety. Neuroscience and Biobehavioral Reviews. 21, 791-799 (1997).
- Cheriyan, J., Sheets, P. L. Altered Excitability and Local Connectivity of mPFC-PAG Neurons in a Mouse Model of Neuropathic Pain. Journal of Neuroscience. 38, 4829-4839 (2018).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved