Method Article
Optogenetische Manipulation der neuronalen Aktivität, um das Verhalten bei frei beweglichen Mäusen zu modulieren
In diesem Artikel
Zusammenfassung
Mit optogenetischer Manipulation bestimmter neuronaler Populationen oder Hirnregionen kann das Verhalten bei frei beweglichen Tieren mit hoher zeitlicher und räumlicher Auflösung verändert werden. Durch den Einsatz verschiedener optogenetischer Werkzeuge in Kombination mit chronisch implantierten optischen Fasern kann eine Vielzahl neuronaler Modulationen und Verhaltenstests durchgeführt werden.
Zusammenfassung
Die optogenetische Modulation neuronaler Schaltkreise bei frei beweglichen Mäusen wirkt sich auf das akute und langfristige Verhalten aus. Diese Methode ist in der Lage, Manipulationen von einzelnen Neuronen und regionsspezifische Senderfreisetzung durchzuführen, bis hin zu ganzen neuronalen Schaltkreisen im zentralen Nervensystem, und ermöglicht die direkte Messung von Verhaltensergebnissen. Neuronen drücken optogenetische Werkzeuge über eine Injektion von viralen Vektoren aus, die die DNA der Wahl tragen, wie Channelrhodopsin2 (ChR2). Licht wird über chronische optische Implantate, die direkt über der Zielregion enden, in bestimmte Hirnregionen gebracht. Nach zwei Wochen Erholung und korrekter Werkzeugexpression können Mäuse wiederholt für Verhaltenstests mit optogenetischer Stimulation der Neuronen von Interesse verwendet werden.
Die optogenetische Modulation hat eine hohe zeitliche und räumliche Auflösung, die mit hoher Zellspezifität erreicht werden kann, im Vergleich zu den häufig verwendeten Methoden wie chemischer oder elektrischer Stimulation. Das Licht schadet dem neuronalen Gewebe nicht und kann daher sowohl für Langzeitexperimente als auch für mehrere Verhaltensexperimente mit einer Maus verwendet werden. Die Möglichkeiten optogenetischer Werkzeuge sind nahezu unbegrenzt und ermöglichen die Aktivierung oder das Stummschaltung ganzer Neuronen oder sogar die Manipulation eines bestimmten Rezeptortyps durch Licht.
Die Ergebnisse solcher Verhaltensexperimente mit integrierter optogenetischer Stimulation visualisieren Verhaltensänderungen, die durch die Manipulation verursacht werden. Das Verhalten desselben Tieres ohne Lichtstimulation als Basisistin ist eine gute Kontrolle für induzierte Veränderungen. Dies ermöglicht einen detaillierten Überblick über neuronale Typen oder Neurotransmitter-Systeme, die an bestimmten Verhaltensweisen beteiligt sind, wie Angst. Die Plastizität neuronaler Netzwerke kann auch durch Langzeitstimulation oder Verhaltensbeobachtungen nach optischer Stimulation sehr detailliert untersucht werden. Optogenetik wird helfen, neuronale Signalisierung bei verschiedenen Arten von neurologischen Erkrankungen zu erleuchten.
Einleitung
Die Modulation der neuronalen Schaltkreise im zentralen Nervensystem und ihre Verhaltensergebnisse sind wichtig für das Verständnis, wie das Gehirn funktioniert, vor allem bei psychiatrischen Erkrankungen und kognitiven Aufgaben wie Lernen und Gedächtnis. Mit der Optogenetik können einzellige zellen- oder Zellpopulationen bis hin zu ganzen Schaltkreisen durch Licht moduliert werden. Häufige optogenetische Werkzeuge wie Channelrhodopsin2 (ChR2) oder Archaerhodopsin (Arch) sind in der Lage, Neuronen zu aktivieren oder zum Schweigen zu bringen, oder die Freisetzung von Sendern an Axonklemmen zu erhöhen oder zu hemmen, die auf verschiedene Hirnregionen1,2,3,4projiziert werden. Arch muss jedoch sorgfältig verwendet werden, da gezeigt wurde, dass seine Aktivierung an präsynaptischen Klemmen die spontane Senderfreigabe5erhöht. Arch ist eine nach außen korrigierende Protonenpumpe, die den pH-Wert innerhalb der Zelle ändert. Dieses alkalische Milieu induziert Kalziumzufluss und verbessert die Senderfreisetzung5. Um spezifisch intrazelluläre Signalwege zu modulieren, können Rezeptorchimären, die aus einem lichtaktivierbaren optogenetischen Werkzeug wie Rhodopsin oder Kegelopsin bestehen, in Verbindung mit einem geeigneten G-Protein-gekoppelten Rezeptor6,,7,8erstellt werden. Die Menge und Variation der verfügbaren optogenetischen Werkzeuge hat in den letzten zehn Jahren deutlich zugenommen9.
Der Zweck der Optogenetik ist es, neuronale Schaltkreise während des Verhaltens zu manipulieren. Die Optogenetik ermöglicht beispielsweise die Messung akuter Verhaltensänderungen wie Veränderungen im Angstverhalten. Optogenetische Werkzeuge werden über virale Vektoren in Zielregionen des Gehirns geliefert. Mit Hilfe von speziellen Promotoren und Enhancern oder dem Cre-loxP-System kann die Zelltypspezifität für die Expression optogenetischer Werkzeuge gewährleistet werden (Abbildung 1A). Es gibt mehrere genetisch veränderte Mauslinien, die das Enzym Cre-Recombinase nur in bestimmten Zelltypen exemiten. Zum Beispiel drücken Nex-Cre-Mäuse die Cre-Recombinase in pyramidenförmigen Neuronen im Kortex und im Hippocampus unter der Kontrolle des Nex-Promotors10aus. Dieses Enzym ist in der Lage, DNA-Sequenzen umzukehren, die von loxP-Seiten11flankiert werden. Folglich kann die DNA-Sequenz eines doppelfläxten optogenetischen Werkzeugs, das von loxP-Seiten invertiert und flankiert wird, nur von Neuronen transkribiert werden, die die Cre-Recombinasebesitzen, aber nicht von anderen neuronalen Typen12,13. Bei Nex-Cre-Mäusen wird das optogenetische Werkzeug ausschließlich in pyramidenförmigen Neuronen ausgedrückt. Die Lichtstimulation bestimmter Hirnregionen erfolgt dann durch chronische Implantation von optischen Fasern direkt über dem Interessengebiet. Tiere können dann an eine geeignete Lichtquelle gekoppelt werden und verhalten sich in fast allen Arten von Verhaltenstests frei.
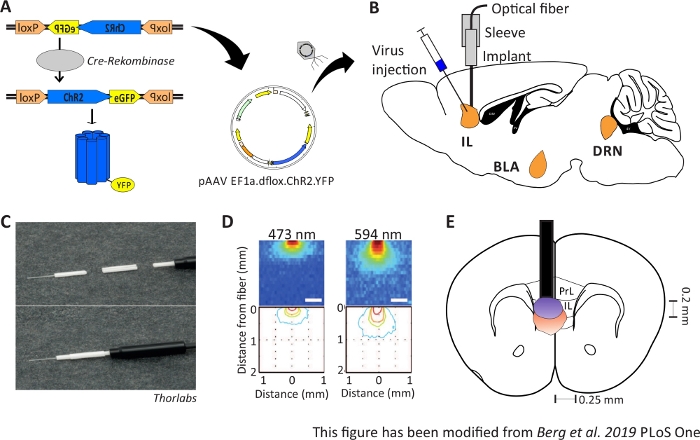
Abbildung 1: Injektion und Implantation. A) Cre-loxP-System für ChR2-YFP. Doppel-Floxed optogenetische nokgenetic Werkzeug wird in einem Adeno assoziierten Virus (AAV) für die Injektion in das Gehirngewebe verpackt. B) Sagittale Ansicht der Virusinjektion und Implantation einer optischen neuronalen Schnittstelle in/über dem IL-Bereich des mPFC. Injektion und Implantation wurden von oben durchgeführt. Alle Regionen von Interesse, IL, BLA und DRN, werden angezeigt. C) Detailansicht der implantierten optischen Faser, Hülse und Lichtquelle. D) Verbreitung der blauen und roten Laserlichtstimulation im grauen Materie-Hirngewebe aus einer 200-m-Lichtfaser (Yizhar et al. 2011). Blaues Licht breitet sich maximal 0,5 mm in das Gewebe aus, rotes Licht ca. 1 mm. Farbcodierung: rot 50%, gelb 10%, grün 5%, blau 1%, wenn Licht diesen Bereich erreicht. E) Koronale Ansicht der einseitigen Implantation direkt über der linken IL mit einer 200 m Glasfaser. Der IL-Bereich hat eine Breite von 0,25 mm in jeder Hemisphäre und eine Tiefe von 0,2 mm. Blaue und rote Glühbirnen sind die Boarder von 5% Licht ausbreitung und werden von Yizhar et al auf die richtige Größe übertragen. LoxP: Lokus von X-over P1; ChR2: Channelrhodopsin; YFP: gelbes fluoreszierendes Protein; dflox: doppelfloxiert; IL: infralimbischer Kortex; BLA: basolaterale Amygdala; DRN: dorsale raphe Kerne; PrL: prälimbische Region. Diese Zahl wurde von Berg 201948geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Optogenetische Ansätze werden genutzt, da sie sowohl eine hohe zeitliche als auch räumliche Auflösung14 und eine zelltypspezifische Modulation ermöglichen. Darüber hinaus ist es möglich, das implantierte Gerät ohne weitere Behandlung wiederholt zu verwenden. Nach einer stereotaktischen Operation, bei der die Injektion eines adenoassoziierten Virus, das das optogenetische Werkzeug trägt, und die Implantation der optischen Faser durchgeführt wird, können sich Mäuse zwei Wochen lang erholen. Wir haben eine Erholungszeit von nur 2 Wochen gewählt, weil dies genug Zeit ist, um sich von der Operation zu erholen und für das Virus auszudrücken. Da auf die Verhaltensexperimente die Immunhistochemie folgt, müssen wir sicherstellen, dass Mäuse während des Experiments nicht zu alt werden; andernfalls wird die Gewebequalität verringert. Sie zeigen keine offensichtlichen Verhaltensstörungen durch das Implantat und verhalten sich in einem typischen Käfigverhalten. Natürlich wird die Implantation von einer signifikanten chirurgischen Läsion begleitet; Daher werden die Mäuse intensiv überwacht. Nach der Operation müssen Mäuse einzeln untergebracht werden, da Gruppenmäuse dazu neigen, sich gegenseitig die frischen Wunden und Implantate zu verletzen. Jedoch, Gehäusebedingungen haben einen großen Einfluss auf die Angst ebene männlichen Mäusen, wie Einzelzimmer Mäuse zeigen niedrigere Angstniveaus15 und im Allgemeinen weniger depressiv-ähnliche Symptome16.
Chemische oder elektrische Manipulation von Gehirnschaltkreisen fehlt die hohe Zelltyp-Spezifität der Optogenetik und haben eine niedrigere zeitliche und räumliche Auflösung14,17,18. Je nach experimenteller Frage kann elektrische oder chemische Stimulation unterschiedliche Vorteile haben. Beim Passieren von Faserklemmen in einer bestimmten Region muss auch stimuliert werden, elektrische Stimulation ist die beste Methode. Chemische Stimulation ist eine gute Wahl, wenn senderspezifische Rezeptoren in einer ganzen Region von Agonisten aktiviert werden sollten. Ein weiterer großer Vorteil der Optogenetik im Vergleich zur chemischen oder elektrischen Stimulation ist, dass endogen, Neuronen sind nicht empfindlich auf Licht, die das Auftreten von Nebenwirkungen vermeidet19. In der Tat, hohe Lichtintensitäten können Heizeffekteinduzieren 8,20, aber aufgrund der richtigen Kontrollgruppen, die Verhaltenseffekte aufgrund optogenetischer Manipulation kann eliminiert werden.
Die Untersuchung des Nagetierverhaltens, insbesondere in Bezug auf psychiatrische Erkrankungen, hat sich mit der Optogenetik bei frei beweglichen Tieren erheblich verbessert, da es die direkte Modulation einzelner Rezeptoren bis zu bestimmten Zellpopulationen21 und Schaltkreise22ermöglicht. Die Möglichkeit, die akuten Wirkungen solcher Modulationen sowie die langfristigen Verhaltenseffekte nach einer definierten Zeit23 oder nach chronischer Stimulation24zu messen, ermöglicht eine breite Flexibilität experimenteller Entwürfe und bietet sehr detaillierte Einblicke in Gehirnschaltungen. Lichtstimulation kann verwendet werden, um Neuronen an der Injektionsstelle des optogenetischen Werkzeugs zu modulieren. Wenn sowohl die Injektion als auch die Implantation die gleiche Hirnregion ansprechen, können Zellkörper und rückenprojizierte Axone von Prinzipneuronen und Interneuronen in dieser Regionzielgerichtetwerden 3,6,8. Die Lichtfaser kann jedoch auch in einer anderen Region als der injizierten implantiert werden. In diesem Fall kann die Lichtstimulation die Senderentriegelung an Axonklemmen in Projektionsbereichen des injizierten Bereichs25,26,27modulieren.
In der Studie hier wird die Optogenetik in Kombination mit Experimenten zur Analyse von Angstverhalten eingesetzt. Angstbedingte psychiatrische Erkrankungen betreffen mehr als ein Drittel der Weltbevölkerung28,29,30 und verursachen eine hohe wirtschaftliche Belastung31. Betroffene leiden unter einem Gefühl von Erregung, Anspannung und Sorge, gefolgt von Vermeidungsverhalten32,33. Diese chronisch auftretenden negativen Emotionen, die sich hauptsächlich auf zukünftige Ereignisse konzentrieren34, stören stark den Alltag der Patienten. Häufige Behandlungen wie Benzodiazeze oder selektive Serotonin-Wiederaufnahmehemmer (SSRIs) sind nur bei einigen Patienten erfolgreich. Eine große Anzahl von Menschen reagieren überhaupt nicht auf die Behandlung35, was zeigt, dass der Mechanismus, der solchen Krankheiten zugrunde liegt, noch nicht vollständig verstanden ist. Der mediale präfrontale Kortex (mPFC) ist dafür bekannt, eine wichtige Rolle bei der Entwicklung und Manifestation von Angst21,25,27,36,37,38zu spielen. Insbesondere könnte die Überaktivierung der infralimbischen Kortex (IL) Region im mPFC Teil von Angststörungensein 39,40. Das hier beschriebene Beispielexperiment könnte helfen zu verstehen, wie Modulationen im IL-Bereich des mPFC das Angstverhalten beeinflussen. Darüber hinaus kann die Entwicklung neuer therapeutischer Strategien für angstbedingte psychiatrische Erkrankungen potenziell auch unterstützt werden.
2-6 Monate alte männliche Nex-Cre Mäuse werden verwendet, um ChR2 speziell in pyramidenförmigen Neuronen innerhalb der IL-Region des mPFC41auszudrücken. Nex-Cre-Mäuse haben einen C57Bl/6-Hintergrund und exprimieren das Enzym Cre-recombinase speziell in pyramidenförmigen Neuronen. Während einer stereotaktischen Operation wird die doppelfloxierte ChR2-DNA über adenoassoziierte virale Vektoren in die IL-Region injiziert. Das optische Implantat wird direkt über dem Interessenbereich platziert (Abbildung 1B) und das Implantat wird mit Zahnzement fixiert. Kontrolltiere erhalten eine Injektion von Doppel-Floxed-TdTomato-DNA in der gleichen Region, um zellspezifische Expression zu imitieren.
Die Tiere sind bis zum Tag der Operation in Gruppen untergebracht und danach einzeln untergebracht, um Verletzungen durch andere Mäuse zu vermeiden. Mäuse sind in einzelnen belüfteten Käfigen (IVC) in TypI-L Käfigen für Einzelmäuse untergebracht. Der Hell-Dunkel-Zyklus folgt einem 12:12 h-Rhythmus, die Lichtphase ab 10 Uhr. Alle Verhaltensexperimente werden in der dunklen Phase durchgeführt, die der aktiven Phase von Nagetieren ähnelt. Wasser und Standard-Lebensmittelpellets sind ad libitum erhältlich. Nach zwei Wochen der Genesung, die eine ausreichende Expression von ChR2 in pyramidenförmigen Neuronen gewährleistet, werden Mäuse für Verhaltensexperimente verwendet.
Das Open Field (OF) ist ein 50 cm x 50 cm quadratisches Labyrinth mit sandgestrahlten 40 cm hohen Wänden. Der Boden ist in 16 Quadrate unterteilt, wo die innere 4 das Zentrum darstellt. Das gemessene Verhalten ist: 1) Zeit in der Mitte verbracht, 2) Anzahl der Mitte Einträge, und 3) Gesamtentfernung verschoben. Während dieses Experiments gibt es 4 Versuche mit einer Gesamtzeit von 20 Minuten. In den Studien 1 und 3 findet keine Lichtstimulation statt, und in den Studien 2 und 4 wird eine 20 Hz Stimulation mit 5 ms Lichtimpuls und 1 mW Lichtintensität von 473 nm durchgeführt (Abbildung 2A). In den späteren Versuchen wurde die Gewöhnung an das Testgebiet berücksichtigt, aber die Verwendung von Schein-injizierten Kontrolltieren zeigt an, wie Gewöhnung ausgedrückt wird.
Das Barnes Maze ist ein Experiment für Lernen und Gedächtnis. Es ist eine kreisförmige Plattform mit einem Durchmesser von 92 cm und enthält 20 äquidistante Löcher um den Umfang. 19 der Löcher sind geschlossen und unter einem Loch wird ein Fluchtkasten präsentiert. An 4 aufeinanderfolgenden Tagen haben Mäuse 4 Trainingsversuche, um den Standort der Fluchtbox zu erfahren. Am5. Tag wird die Escapebox entfernt und Mäuse werden getestet, wie viel Zeit sie benötigen, um das richtige Loch zu finden. Das gemessene Verhalten ist: 1) Zeit, bis das Escape-Box/korrekte Loch gefunden wird, 2) Anzahl der Zielbesuche und Fehler und 3) Abstand verschoben, bis in das Escape-Box. Die Lichtstimulation in verschiedenen Gruppen erfolgt entweder während der Erfassung oder Konsolidierung, die an den Trainingstages 1-4 stattfinden, oder während des Abrufs am Testtag, d. h. Tag 5 (Abbildung 2D).
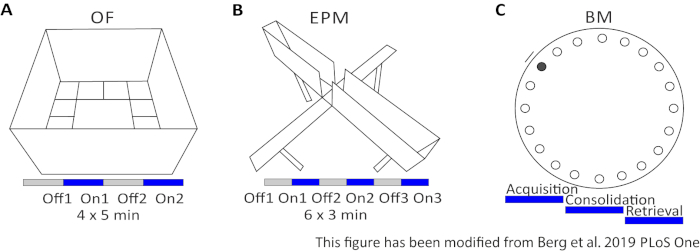
Abbildung 2: Verhaltensexperimente mit optogenetischen Protokollen. A) Schematische Zeichnung des Open Field-Experiments mit dem entsprechenden Lichtstimulationsprotokoll. C) Schematische Zeichnung des Elevated-Plus Maze-Experiments mit dem entsprechenden Lichtstimulationsprotokoll. D) Schematische Zeichnung des Barnes Maze-Experiments mit dem entsprechenden Lichtstimulationsprotokoll. EPM: Elevated-Plus Maze; VON: Open Field; BM: Barnes Maze Test. Diese Zahl wurde von Berg 201948geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Für die optogenetische Stimulation müssen Lichtintensität und -frequenz an das zu untersuchende optogenetische Werkzeug und den neuronalen Typ angepasst werden. Die geringstmögliche Lichtintensität sollte verwendet werden, um Schäden am Gewebe zu vermeiden, da mehrere Studien gezeigt haben, dass es mögliche Heizeffekte aufgrund der starken Lichtintensität8,20gibt. Für ChR2 wird häufig eine 20 Hz Stimulation mit einem 5 ms Lichtimpulsverwendet 2. Da ChR2 sehr lichtempfindlich ist, reichen 1 mW Lichtintensität aus. Das Lichtstimulationsprotokoll wechselt zwischen Licht aus und bei Versuchen, um Verhaltensänderungen direkt zu messen. Die äußeren Raumbedingungen für Verhaltensexperimente sollten für die gesamte Tiergruppe stabil bleiben. Wichtige Zu berücksichtigende Bedingungen sind das Rauschen (beachten Sie, dass Geräte selbst Geräusche machen können), der Geruch (immer die Verhaltenseinstellungen mit Ethanol reinigen), die Lichtintensität und der Experimentator. Der Experimentator sollte immer die gleiche Person sein. Darüber hinaus sollte die Tageszeit der Experimente für alle Tiere in einer Gruppe gleich sein, ein paar Stunden nach Beginn der dunklen Phase in der Anlage wird bevorzugt.
Das Ziel dieses Experiments ist es, das Anregungs-/Hemmungsverhältnis (E/I) in der IL-Region durch starke Aktivierung von erregenden pyramidenförmigen Neuronen zu erhöhen. Ein verbessertes E/I-Verhältnis in dieser speziellen Kortexregion ist bekannt, angstzuhaben bei Mäusen zu erhöhen40,42,43,44.
Protokoll
Verfahren mit Tierischen Probanden wurden von der institutionellen Tierforschungseinrichtung und der "Senatorin für Wissenschaft, Gesundheit und Verbraucherschutz" der Universität Bremen (#146) genehmigt.
1. Vorbereitung des optischen Implantats9 (Abbildung 1C)
- Legen Sie eine Keramikferrule flach Seite nach oben in eine Bank Visier.
- Die Schicht einer Glasfaser mit einem Faserabisolierwerkzeug mit einem Glasfaser-Abisolierwerkzeug abstreifen und 2-3 cm lange Stücke mit einem Keramikfaser-Schreiber schneiden.
- Legen Sie das Stück Glasfaser mit einem gleichmäßigen Überhang auf beiden Seiten in die Keramikferrule.
- Legen Sie einen Tropfen Superkleber an der flachen Seite der Keramikferrule mit einer Injektionskanüle.
HINWEIS: Das Protokoll kann hier angehalten werden. - Nehmen Sie das Vorimplantat aus der Bank vise und auf der runden Seite der Keramikferrule, schneiden Sie die Glasfaser so kurz wie möglich mit dem Keramikfaserschreiber.
- Legen Sie das Vorimplantat an einem Ferrule-Polierpuck und polieren Sie die runde Seite auf 4 verschiedene Polierpapiere, indem Sie acht 20 Mal pro Papier zeichnen (30 m Körnung, 6 m Körnung, 1 m Körnung und schließlich 0,02 m Körnung).
- Nehmen Sie das Vorimplantat aus dem Ferrule-Polierpuck und schneiden Sie die Glasfaser auf der flachen Seite der Keramikferrule auf die für die Implantation benötigte Länge. Beginnen Sie mit der Messung der Länge hinter dem hervorstehenden Superkleber.
- Für eine gleichmäßige Schneidfläche kratzen Sie einfach die Glasfaser 2-3 mal und brechen Sie sie dann.
HINWEIS: Verwenden Sie den Maus-Gehirnatlas von Paxinos und Franklin45, um die Länge des Implantats zu berechnen. Das Implantat muss direkt über dem Interessenbereich enden und die Dicke des Schädels sollte in die Längenberechnung einbezogen werden. Um den IL-Bereich zu stimulieren, hat die Glasfaser eine Länge von 1,8 mm (Abbildung 3).
- Für eine gleichmäßige Schneidfläche kratzen Sie einfach die Glasfaser 2-3 mal und brechen Sie sie dann.
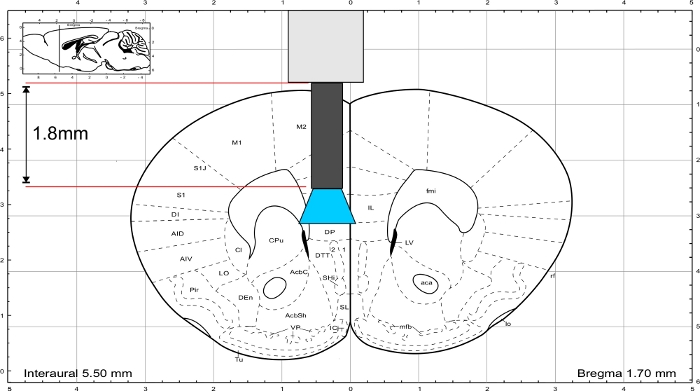
Abbildung 3: Maus-Gehirnatlas (Paxinos und Franklin) mit repräsentativer Länge des Implantats, um die IL-Region zu erreichen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Das fertige Implantat 10 Minuten lang in Ethanol desinfizieren und vor der Implantation an der Luft trocknen lassen.
2. Injektion und Implantation
- Transportieren Sie eine einzelne Maus in den Operationssaal und wiegen Sie sie. Anästhesie mit einer intraperitonealen (i.p.) Injektion von Ketamin/Xylazin (Ketamin 0,12 mg/g, Xylazin 0,01 mg/g) anwenden.
- Fixieren Sie die Maus mit der linken Hand und drehen Sie sie auf den Rücken mit dem Kopf niedrig gehalten.
- Mit der Spritze auf den linken unteren Quadranten des Bauches zielen und 1 cm unter die Haut in die Injektionskanüle geben.
- Injizieren Sie Anästhesie in einer langsamen und konstanten Bewegung in die Bauchhöhle.
- Legen Sie die Maus wieder in ihren Käfig und warten Sie, bis sie einen tiefen Zustand der Anästhesie erreicht.
HINWEIS: Die Tiefe der Anästhesie kann durch das Fehlen von blinkenden und zwischen den Zehen Reflexen bestimmt werden.
- Legen Sie die Maus auf eine Heizplatte und fixieren Sie den Kopf in einem stereotaktischen Rahmen. Fixieren Sie die Nase und die Zähne in der Vorderseite, und die Ohren auf beiden Seiten.
HINWEIS: Der Kopf muss gerade auf der links-rechts und rostral-kaudalen Achse sein, um korrekte stereotaktische Koordinaten zu gewährleisten. - Analgesie mit 2 mg/kg Carprofen subkutan in den Rücken der Maus auftragen und undurchsichtige Augensalbe auf beide Augen auftragen, um sie vor dem Trocknen zu schützen.
- Befeuchten Sie das Haar auf der Kopfhaut mit einem nassen Papiertuch und schneiden Sie es dann mit einer Schere ab. Achten Sie darauf, alle lockeren Haare mit dem nassen Papiertuch zu entfernen. Um die Kopfhaut zu desinfizieren, verwenden Sie einen Baumwollstab und nehmen Sie 0,5 ml einer jodhaltigen Tinktur auf (Betaisodona 100 mg/ml Povidon Jod und 11 mg/ml Jod) und lassen Sie es an der Luft trocknen.
HINWEIS: Anstelle einer Schere kann auch ein elektrischer Clipper für die richtige Haarentfernung verwendet werden. - Heben Sie die Kopfhaut über dem Bereich des Interesses mit einer Pinzette und schneiden Sie 1 cm entlang der Mittellinie. Verwenden Sie zwei Pinzette, um die Haut zur Seite zu schieben, um den Schädel zu belichten. Achten Sie darauf, auch die dünne Haut über dem Schädel zu entfernen und lassen Sie den freiliegenden Schädel trocknen.
- Rauen Sie den Schädel für eine spätere Implantation.
- Tragen Sie einen 2 mm x 2 mm Tropfen Phosphorsäure auf (37%) aus dem Klebesatz (z.B. Optibond) auf dem Schädel, verteilen Sie es mit der Spitze der Spritze und lassen Sie es für 15 s wirksam werden.
- Entfernen Sie alle Säure mit einem Baumwollstab und spülen Sie den Schädel mit 1 ml von 0,9% NaCl zweimal.
- Trocknen Sie den Schädel mit einem Baumwollstab und Druckluft.
Achtung: Phosphorsäure ist gefährlich und muss vollständig entfernt werden, um Gewebeschäden zu vermeiden.
- Berechnen Sie den F-Faktor für einzelne Koordinaten.
- Legen Sie eine Glaskanüle in den stereotaktischen Rahmen und lokalisieren Sie sie direkt über Bregma.
- Null das Koordinatensystem und verschieben Sie die Glaskanüle zu Lambda.
- Berechnen Sie den F-Faktor46 mit der folgenden Formel:
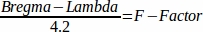
- Multiplizieren Sie den F-Faktor mit den Koordinaten aus dem Maus-Gehirnatlas, um sie an die einzelne Maus anzupassen.
- Bohren Sie ein Loch in den Schädel für die Injektion.
- Verwenden Sie die angepassten Koordinaten, um die Position auf dem Schädel direkt über der Struktur von Interesse zu finden und markieren Sie sie mit der Spitze einer Injektionskanüle, indem Sie sie über der Knochenoberfläche kratzen.
- Verwenden Sie die Injektionskanüle, um ein Loch in den Schädel an der markierten Stelle zu bohren, indem Sie die Kanüle an der Stelle drehen. Wenn Blut aus dem Gratloch austritt, spülen Sie mit 1 ml 0,9% NaCl ab und trocknen Sie den Schädel danach.
- Nehmen Sie die Viruslösung in die Glaskanüle auf.
- Legen Sie einen Tropfen von 100 l von 0,9% NaCl auf den Schädel und ein Stück Parafilm (1 cm x 1 cm) auf die Oberseite, sterile Seite nach oben.
- Legen Sie 1-2 L Viruslösung auf den Parafilm und senken Sie die Spitze der Glaskanüle hinein.
- Schließen Sie die Glaskanüle an eine Spritze an, wenden Sie minimalen Unterdruck an und warten Sie, bis die Viruslösung von der Kanüle aufgenommen wird (innerhalb von Sekunden).
HINWEIS: Es ist wichtig, die Anwendung von Unterdruck zu stoppen, bevor Luft in die Kanüle aufgenommen wird. Daher wird es immer ein kleines Überbleibsel der Viruslösung geben.
- Injizieren Sie die Viruslösung in die Region von Interesse.
- Legen Sie die mit Viren gefüllte Glaskanüle über das Gratloch.
- Senken Sie die Kanüle langsam in das Gratloch und null die Z-Koordinate, wenn sich die Spitze der Kanüle auf der Höhe des Schädels befindet.
- Senken Sie die Kanüle vorsichtig auf die unterste Position der Injektionsstelle.
- Fokussieren Sie das Binokular auf den Meniskus der Viruslösung innerhalb der Kanüle.
- Tragen Sie eine kleine Menge an positivem Druck mit der Spritze auf, bis der Meniskus geringfügig abgesenkt ist.
- Lassen Sie das Virus für 2-3 min verbreiten, bevor Sie die Glaskanüle nach oben in die nächste Position bewegen.
- Wenden Sie die Viruslösung alle 200-300 m in der gesamten Interessenregion an.
- Entfernen Sie die Glaskanüle sehr langsam und entsorgen Sie sie nach der endgültigen Injektion.
- Bereiten Sie den Schädel für die Implantation mit dem Haftsatz (z.B. OptibondTMFL) vor.
- Trocknen Sie den Schädel mit Druckluft.
- 5 l Primer (z.B. Optibond, 1-30% (Ethanol, Kieselsäure, Glycerinphosphatdimethacrylat, 2-(2-(Methacryloyloxy)ethoxycarbonyl)benzoesäure, 2-Hydroxyethylmethacrylat)) mit dem entsprechenden Stick auftragen und 15 s trocknen lassen.
- 5 l Bond (z.B. Optibond, 15-20% 2-Hydroxyethylmethacrylat + 1-2% Alkalihexafluorosilikat(Na)) mit dem gleichen Stick auftragen und 20 s mit UV-Licht (420-480 nm) aushärten.
HINWEIS: Es ist wichtig, dass der Schädel trocken ist und dass Die Grundierung und Bindung in einer sehr dünnen Schicht aufgetragen werden.
Achtung: Schauen Sie nicht direkt in das UV-Licht, da UV-Licht die Augen schädigen kann.
- Positionieren Sie das Implantat direkt über dem Interessengebiet.
- Fixieren Sie das Implantat im entsprechenden Halter.
- Trocknen Sie den Schädel mit Druckluft.
- Positionieren Sie die Spitze der Glasfaser direkt über dem Gratloch und senken Sie sie vorsichtig.
- Hören Sie auf, das Implantat zu senken, wenn die verbleibende Glühbirne von Superkleber den Schädel berührt. Üben Sie keinen Druck auf den Schädel aus!
HINWEIS: Wenn die Injektion und Implantation in verschiedenen Regionen durchgeführt werden (z. B. dorsale Raphe und Hippocampus),bohren Sie alle notwendigen Löcher nach dem Auftragen von Phosphorsäure, aber vor der 2-Komponenten-Adhäsion, dann befolgen Sie die Anweisungen wie zuvor beschrieben (Schritt 2.8-2.14).
- Fixieren Sie das Implantat.
- Prüfen Sie, ob der Schädel noch vollständig trocken ist.
- Flüssiger Zahnzement (z.B. Gradia direct flo) um das Implantat und in der Umgebung auftragen und 20 s mit UV-Licht (420-480 nm) aushärten.
HINWEIS: Die Menge an Zahnzement hängt vom freien Schädelbereich ab. Der gesamte Schädel sollte mit Zahnzement bedeckt sein. - Tragen Sie zwei weitere Zementschichten auf und füllen Sie den freien und getrockneten Schädelbereich vollständig. Härten Sie jede Schicht mit UV-Licht (420-480 nm).
- Beenden Sie die Operation.
- 0,5 g Jodsalbe (Betaisodona 100 mg/ml Povidon jod und 11 mg/ml Jod) auf die gesamte Wunde auftragen.
- Injizieren Sie 0,1 ml Glukose in 0,9% NaCl subkutan in den Hals für eine schnelle Genesung.
- Lassen Sie die Nasen- und Ohrfixierung los, bringen Sie die Maus in einen frischen Käfig und legen Sie sie unter eine Heizlampe, um den Verlust von Körperwärme zu vermeiden.
- Wenn die Maus aufwacht, bringen Sie sie zurück in die Anlage.
- Überprüfen Sie den Gesundheitszustand mindestens einmal täglich. Ergreifen Sie geeignete Maßnahmen, wenn Mäuse schlechte Konstitutionen zeigen (z. B. stellen Sie eine postoperative Analgesie mit Carprofen bis zu 3 Tage sicher, wenn Mäuse Anzeichen von Schmerzen zeigen).
HINWEIS: Nach zwei Wochen Der Genesung können Mäuse für Verhaltensexperimente verwendet werden.
3. Einrichten eines neuen Experiments (Beispiel ChR2 Stimulation und Open Field)
- Impulsgenerator
- Programmieren Sie den Pulser (z.B. Prizmatix) zur Lichtstimulation.
- Öffnen Sie die Software, und wählen Sie den USB-COM-Anschluss aus, an den die Lichtquelle angeschlossen ist.
- Wählen Sie Operation Modus auswählen (3) | Führen Sie die Pulssequenz nach dem Trigger HIGH aus, und stoppen Sie dann, wenn LOW eine externe Software die Lichtquelle steuern kann.
- Programmieren Sie das Lichtprotokoll. Für eine 20 Hz Stimulation mit 5 ms Lichtimpuls: wählen Sie TI = 23 ms, P1D = 5 ms, P1I = 22 ms und P2D = 0 ms.
- Drücken Sie die Startsequenz. Dieser Status bleibt bestehen, bis die Experimente abgeschlossen sind.
HINWEIS: Die Pulser-Software (Prizmatix Pulser) muss vor der Video-Tracking-Software gestartet werden; Andernfalls kann die Video-Tracking-Software das Gerät nicht erkennen.
- Video-Tracking-Software (z.B. Ethovision XT)
- Erstellen Sie ein neues Experiment aus einer vordefinierten Vorlage.
- Öffnen Sie die Software, gehen Sie zu Datei, wählen Sie Neu aus Vorlage. Wählen Sie Eine vordefinierte Vorlage anwendenaus.
- Wählen Sie Live-Tracking und wählen Sie die Kamera, indem Sie auf Source drücken und bestätigen Sie die angeschlossene Basler GenICam.
HINWEIS: Das Livebild der Kamera wird nun im Fenster oben rechts angezeigt. - Drücken Sie weiter und wählen Sie das Tier, das aufgezeichnet werden soll (Nagetiere, Maus).
- Drücken Sie Weiter und wählen Sie die Arena-Vorlage Open Field, square. Wählen Sie die Zonenvorlage Center, Border, Corners aus, und bestätigen Sie sie mit Weiter.
- Bestätigen Sie 1 Thema, das mit Weiternachverfolgt werden soll.
- Wählen Sie Mittelpunkt, Nasenpunkt und Schwanzbasis und bestätigen Sie die Tierfarbe im Vergleich zum Hintergrund als dunkler mit Weiter.
- Bestätigen Sie die empfohlene Abtastrate von 12,5 mit Weiter, und beenden Sie den Schritt.
- Benennen Sie das entsprechende Experiment, und wählen Sie einen zu speichernden Speicherort aus.
- Definieren Sie die experimentellen Einstellungen.
- Wechseln Sie zu Setup- und Experimentaleinstellungen. Wählen Sie Die Erkennung von Mittelpunkt, Nasenpunkt und Schwanzbasis als Tracked-Features.
- Wählen Sie Verwenden von Teststeuerungshardware aus, und wechseln Sie zu Einstellungen.
- Wählen Sie Noldus USB-IO Box und bestätigen Sie mit Ok.
- Wählen Sie Benutzerdefinierte Hardware als Gerätetyp am TTL-Port aus, der mit dem Pulsergerät verbunden ist, und bestätigen Sie dies mit Ok.
- Definieren Sie die Arena-Einstellungen.
- Gehen Sie zu Arena-Einstellungen und wählen Sie Arena-Einstellungen 1aus.
HINWEIS: Die Kamera öffnet nun automatisch ein Hintergrundbild. - Bestätigen Sie das Bild mit Grab.
- Passen Sie die vordefinierten Zonen an die reale Arena an, indem Sie ihre Größe ändern. Verwenden Sie den Pfeil und die beiden Symbole auf der rechten Seite. Wenn einige Zonen nicht erforderlich sind, löschen Sie sie.
- Drücken Sie 1. Zeichnen Sie Scale, um zu kalibrieren, und ziehen Sie eine Linie von einer Ecke des Labyrinths zur anderen. Geben Sie die Länge des realen Abstands in cm ein.
- Wiederholen Sie dies für die andere Achse.
- Gehen Sie zu Arena-Einstellungen und wählen Sie Arena-Einstellungen 1aus.
- Testen Sie, ob die Lichtstimulation funktioniert.
- Wechseln Sie zu Arena - Hardware Mapping, und wählen Sie Test auf der grauen Leiste aus.
- Wählen Sie Befehlsausgang 1 Hoch und drücken Sie Test.
HINWEIS: Es sollte Licht vom Ende der Glasfaser emittieren. Bei auswahl Ausgang 1 Low und Testsollte die Stimulation anhalten.
- Definieren Sie die Teststeuerungseinstellungen für 20 Minuten des Experiments. Setzen Sie Die Testversionen Off1, On1, Off2 und On2 auf jeweils 5 Minuten Länge.
- Wechseln Sie zur Teststeuerungseinstellung, und wählen Sie Die Spurdauer 30 Minutenaus.
- Bereiten Sie die Hauptregel vor, indem Sie die Bedingung: Zeit auf 20 Minuten anpassen, indem Sie Einstellungen auswählen und 30 bis 20 Minuten ändern. Bestätigen Sie mit Ok.
HINWEIS: Die Bedingung für die Startspur sollte sein, wenn der Betreff 2 Sekunden lang in der Arena ist. Auf diese Weise startet das System automatisch die Verfolgung, wenn sich die Maus in der Arena befindet. - Erstellen Sie eine Unterregel für die Lichtstimulation: Gehen Sie zu Strukturen, mehr und wählen Sie Unterregel.
- Geben Sie ihm einen Namen wie Lichtstimulationsprotokoll.
- Platzieren Sie es unter der Hauptregel und verteilen Sie die beiden Felder, indem Sie den blauen Bereich mit dem Maus-Kursr auswählen.
- Gehen Sie zu Bedingungen, Zeit und geben Sie ihm einen Namen wie Licht auf 1.
- Einstellungsbedingung wird nach 5 Minuten erfüllt. Bestätigen Sie mit Ok.
- Platzieren Sie das Feld direkt hinter dem Feld Regelbeginn der Unterregel, indem Sie es in die schwarze Linie ziehen.
- Gehe zu Aktion | Benutzerdefinierte Hardware und nennen Sie es: licht ON 1.
- Wählen Sie Aktion aus, um als Ausgang 1 Hoch auszuführen, und bestätigen Sie mit Ok.
- Platzieren Sie das Feld direkt hinter dem Feld Bedingung.
HINWEIS: Nach 5 Minuten des Experiments sollte die Lichtstimulation beginnen. - Wiederholen Sie die Schritte, um die Zeitbedingung nach 5 Minuten und die Aktion Ausgang 1 Niedrig zu definieren, um die Lichtstimulation nach weiteren 5 Minuten zu stoppen.
- Wiederholen Sie die Schritte erneut, um ein weiteres Licht Aus und Licht Auf Testversion zu programmieren.
- Gehe zu Strukturen | Unterregelverweis, und überprüfen Sie, ob der Verweis zur richtigen Unterregel gehört.
- Wählen Sie Startbedingungen als Ohne Verzögerung und Stop-Bedingungen als Einmal ausführung pro Startbedingung. Bestätigen Sie mit Ok.
- Platzieren Sie das Referenzfeld zwischen Aktionsfeld 1 und Bedingungsfeld 2 der Hauptregel, und zeichnen Sie eine Linie von Aktion - Startspur zur Referenz.
HINWEIS: Nun startet die Hauptregel direkt die Unterregel nach dem Starten der Spur.
- Definieren Sie die Erkennungseinstellungen, um dem System anzuzeigen, was es verfolgen soll.
- Gehen Sie zu Erkennungseinstellungen und wählen Sie Erkennungseinstellungen 1aus.
- Platzieren Sie eine Testmaus in die Arena, und wählen Sie Automatisiertes Setupaus.
- Wählen Sie Rodent als Tiertyp und verwenden Sie die Maus Curser, um eine Box um die Maus in der Arena zu zeichnen. Bestätigen Sie die Ergebnisse OK? Frage mit Ja.
- Definieren Sie die Versuchsliste für alle Versuchstiere, die verfolgt werden sollen.
- Gehen Sie zur Testliste und planen Sie alle Tiere, die noch heute aufgenommen werden sollen: Wählen Sie Versuche hinzufügen aus und wählen Sie eine Zahl aus.
- Wählen Sie alle zuvor definierten Bedingungen für jede Maus aus.
- Benennen Sie die Animal-ID und die Behandlung korrekt, um die Analyse später zu vereinfachen.
HINWEIS: Die Animal-ID ist für das System irrelevant und nur für die spätere Datenanalysation durch den Experimentator wichtig. Die Gruppierung in der Gruppe Behandlung und Steuerung ist wichtig, damit das System weiß, wie man alle Spuren in späteren Analyseschritten vergleicht.
- Gehen Sie zu Akquisition und starten Sie mit dem Experiment.
- Erstellen Sie ein neues Experiment aus einer vordefinierten Vorlage.
4. Open Field Experiment (Angst)
- Bringen Sie die experimentelle Maus in den Verhaltensraum direkt vor dem Experiment, um ein angemessenes Maß an Angst zu gewährleisten.
HINWEIS: Die Verhaltensexperimente sollten während der dunklen Phase durchgeführt werden, wenn Mäuse wach sind, und immer im selben Zeitfenster, um die Vergleichbarkeit zu gewährleisten. - Koppeln Sie die Maus über eine Hülse mit der Lichtquelle, indem Sie sie sanft auf das Gitter des Käfigs drücken.
- Legen Sie es in einen Wartekäfig mit frischem Wurf für 10 min, um sich an das Lichtkabel zu gewöhnen.
- Starten Sie die Erfassung durch Drücken der Start-Taste in der Video-Tracking-Software (z.B. Ethovision XT).
- Übertragen Sie die Maus aus dem wartenden Käfig in die linke obere Ecke des offenen Feldes. Entfernen Sie den Arm innerhalb von 2 Sekunden, um die Verfolgung eines Arms anstelle der Maus zu vermeiden.
- Lassen Sie das Gesichtsfeld der Maus während des Experiments und halten Sie Ruhe.
- Nach 20 Minuten, wenn das Experiment abgeschlossen ist, entfernen Sie die Maus aus dem Labyrinth, trennen Sie das Lichtkabel und legen Sie es wieder in seinen Heimischenkäfig.
- Bringen Sie die Maus zurück in die Anlage.
5. Barnes Maze (Lernen)
- Bringen Sie alle versuchsfreudigen Mäuse etwa 1 Stunde vor dem Experiment in den Verhaltensraum.
- Bereiten Sie das Barnes Maze vor, indem Sie alle Löcher bis auf eines schließen, unter dem eine Escapebox platziert wird. Legen Sie eine Kartonwand in die Mitte der Plattform, die der Startbereich für die Maus ist.
- Schließen Sie eine Maus an die Lichtquelle (Hülse an einem Lichtkabel) an beiden Implantaten an.
- Legen Sie die Maus direkt in die Mitte des Barnes Maze in die Kartonwand, wodurch verhindert wird, dass die Maus vor Beginn des Experiments herumläuft.
- Drücken Sie Start in der Video-Tracking-Software (z. B. Ethovision XT) und entfernen Sie den Karton.
HINWEIS: Die Software verfolgt die Maus, bis das richtige Loch erreicht ist, aber seien Sie darauf vorbereitet, die Testversion manuell zu stoppen, nur für den Fall, dass die Software den Lochübergang nicht erkennt. - Nehmen Sie die Maus aus dem Labyrinth und entfernen Sie die Verbindung zum Lichtkabel.
HINWEIS: Wenn dies ein Trainingstag mit mehreren Versuchen pro Maus ist, lassen Sie die Maus im Wartezimmer neben dem Verhaltensraum, bis die nächste Trainingseinheit beginnt. Wenn dies der Testtag mit nur einer Testversion pro Maus war, bringen Sie die Maus zurück zur Einrichtung.
6. Datenanalyse (Beispiel Open Field-Daten mit 4 unterscheidbaren Studien)
- Video-Tracking-Software (z.B. Ethovision XT)
- Definieren Sie die experimentellen Gruppen und Versuche im Datenprofil.
- Gehen Sie zu Datenprofile auf der linken Seite und wählen Sie Behandelt vs. Steuerung.
- Wechseln Sie zu Nesting im neuen Fenster auf der linken Seite, und wählen Sie Teststeuerungsstatusaus.
- Wählen Sie das Zustandsintervall aus der Elementaktion: Start Track to the Element Action: light goes ON 1.
- Platzieren Sie das Nistfeld zwischen dem Filterfeld Behandlung und dem entsprechenden Ergebnisfeld.
HINWEIS: Dieses definierte Intervall ist Off1, das die ersten 2,5 Minuten des Experiments beschreibt, in denen keine Lichtstimulation vorhanden ist. - Wiederholen Sie die Schritte für intervalle On1 (vom Element Aktion: Licht geht auf 1 zum Element Aktion: Licht geht aus 1), Off2 (vom Element Aktion: Licht geht 1 zum Element Licht geht auf 2) und On2 (vom Element Aktion: Licht geht auf 2 zum Element Aktion: Stoppspur).
- Wiederholen Sie die 4 Intervalle für die Steuerelementfiltergruppe.
HINWEIS: Jedes Nistkasten benötigt ein eigenes Ergebnisfeld mit den Namen Off1, On1, Off2, On2. Nun sind sowohl die Behandlungs- als auch die Kontrollgruppe in 4 verschiedene Lichtstimulationsstudien unterteilt, die separat analysiert werden.
- Definieren Sie die Parameter, die im Analyseprofil analysiert werden sollen.
- Gehen Sie zu Analyseprofile auf der linken Seite und wählen Sie In Zonen.
- Wählen Sie die abhängige Variable in Zone aus, und wählen Sie Zentrum als Zone aus.
- Doppelklicken Sie auf In der Mitte und wählen Sie einen der ausgewählten Punkte und wählen Sie nur in der Mitte.
- Bevor Sie das Fenster verlassen, wechseln Sie zu Teststatistik, und wählen Sie Frequenz, Kumulative Dauer und Latenz an zuerstaus.
- Fügen Sie die abhängige Variable Entfernung verschoben hinzu.
ANMERKUNG: Wählen Sie in der Gruppenstatistikaus, ob der Standardfehler oder die Standardabweichung als Fehler verwendet werden soll. Mit diesem Profil sind die Daten für die zeitbezogene Zeit, die in den Einträgen "Mitte"verbracht wurde, die Mitte-Einträge und die verschobene Gesamtentfernung verfügbar.
- Extrahieren von Daten
- Gehen Sie zu Ergebnisse, und wählen Sie Statistik und Diagrammeaus.
- Drücken Sie Berechnen, um die analysierten Daten anzuzeigen.
HINWEIS: Die Teststatistik gibt Informationen über jede einzelne Maus und Gruppenstatistiken analysiert den Mittelwert und den Fehler für beide Gruppen, unterteilt in 4 Versuche mit dem entsprechenden Balkendiagramm. - Drücken Sie Exportdaten, und wählen Sie die Teststatistiken und den zu speichernden Speicherort aus.
HINWEIS: Die exportierten Daten werden als Excel-Datei und mit individuellen Werten für jede Maus gespeichert. In dieser Excel-Datei hilft die Animal-ID, die Mäuse zu identifizieren. - Gehen Sie zu Heatmap Visualization und drücken Sie Plot Heatmaps.
- Wählen Sie Prüfungen auf der rechten Seite aus, um einzelne Heatmaps für jede Maus und jeden Test zu sehen.
- Machen Sie einen Rechtsklick auf die Maus und exportieren Sie Heatmaps als Bilder.
- Definieren Sie die experimentellen Gruppen und Versuche im Datenprofil.
- Plotten
- Öffnen Sie die Tabellenkalkulationsdatei am Computer und berechnen Sie die Mittelwerte und Standardfehler (SEM) für alle 4 Versuche in jeder gemessenen Bedingung und Gruppe.
- Generieren Sie Diagramme in einem Statistikprogramm (z. B. Sigma Plot).
- Kopieren Sie die Mittelwerte und SEM in die richtige Reihenfolge aus der Tabellenkalkulationsdatei in Sigma Plot. Die Zeilen müssen die Daten für Off1, On1 usw. enthalten und die Spalten enthalten Trial, Mean und SEM als Köpfe.
- Wählen Sie alle drei Spalten aus, und wechseln Sie zu Diagramm erstellen.
- Wählen Sie das Balkenfeld aus, und wählen Sie nicht gruppierte Balken mit Fehler (obere Zeile, drittes Feld).
- Bestätigen Sie mit Fertigstellen, um eine neue Grafikseite zu öffnen.
- Beschriften Sie das gesamte Diagramm, gehen Sie dann zu Startseite, wählen Sie das Feld Diagramm auf der linken Seite aus und drücken Sie Export. Wählen Sie einen Zielordner aus, und wählen Sie MetaFile (*.wmf) als Format aus.
HINWEIS: Das .wmf-Format kann später in einer grafischen Software wie CorelDraw verarbeitet werden.
- Berechnen Sie Statistiken für erhaltene Daten.
- Kopieren Sie Rohdaten aus der Kalkulationstabelle (Off1, On1 usw.) in einzelne Spalten von Sigma Plot.
- Markieren Sie die Spalten, um sie zu vergleichen, und gehen Sie zu Analyse, wählen Sie t-test und drücken Sie Ausführen.
- Bestätigen Sie das Datenformat Raw mit Next, und führen Sie den Test mit Finishaus.
Ergebnisse
Ziel dieses Protokolls ist es, Veränderungen im Verhalten genetisch veränderter Mäuse während eines optogenetischen Experiments zu messen. Optogenetische Manipulation erfolgt durch Injektion eines adeno assoziierten viralen Vektors. Die Lichtstimulation bei frei beweglichen Mäusen ist durch Implantation einer Lichtfaser direkt über dem Interessengebiet möglich.
In Abbildung 4werden die Ergebnisse eines optogenetischen Experiments vorgestellt. Eine starke Aktivierung von exzitatorischen pyramidenförmigen Neuronen in der IL-Region über ChR2 erhöhte Angst-bezogenes Verhalten im Offenen Feld. ChR2 wurde in die IL-Region des mPFC in Nex-Cre-Mäusen zur Expression in pyramidenförmigen Neuronen injiziert (Abbildung 4A). Während zweier Angsttests, dem Offenen Feld (Abbildung 4B,C) und dem Novelty-Suppressed Feeding Test (Abbildung 4F,G), wird ChR2 mit blauem Licht stimuliert und aktiviert pyramidale Neuronen. Als Kontrolle erhielt eine andere Gruppe von Mäusen eine Injektion des Fluorophors tdTomato anstelle von ChR2 (Abbildung 4D,G). In einem solchen Experiment wird Angst als Vermeidung des helleren zentralen Bereichs definiert. Mäuse zeigen eine intrinsische Vermeidung von offenen Flächen, weil sie Angst vor Raubtieren haben.
Im Open Field-Experiment, das in Abbildung 4Bgezeigt wird, führten Mäuse 4 Versuche von jeweils 5 Minuten durch. In den Studien 1 und 3 kam es zu keiner Lichtstimulation (Off1,2) und in den Prüfungen 2 und 4 wurde eine Blaulichtstimulation mit 20 Hz (5 ms Lichtimpuls) und 1 mW Intensität durchgeführt (On1,2). Die Heatmaps zeigen, dass in der experimentellen Gruppe die Mittlere Dauer zwischen Off- und On-Tests unterschiedlich war. Bei der Lichtstimulation bleiben Mäuse bevorzugt im Grenzgebiet. Kontrolltiere bevorzugen auch die Grenze, ändern aber ihr Verhalten bei Lichtstimulation nicht. In Abbildung 4Cwerden die wichtigsten Verhaltensmessungen während des Open Field-Experiments für die experimentelle Gruppe angezeigt. Wenn die Daten den Shapiro-Wilk-Test auf Normalität bestanden haben, wurden Statistiken mit einem unabhängigen zweischwanzigen t-Test durchgeführt. Wenn der Normalitätstest fehlgeschlagen ist, wurde der Mann-Whitney-Rank Sum-Test als nicht-parametrische Alternative verwendet. Für diese Art von Experimenten wurde ein Gruppenvergleich gewählt, um zu untersuchen, ob die Lichtstimulation das Angstverhalten im Laufe der Zeit direkt verändern kann, unabhängig von der Grundangst von Versuchs- und Kontrolltieren. Die mittlere Dauer verringerte sich während der beiden Lichtstimulationsstudien signifikant, was auf erhöhte Angstniveaus hindeutet. Die bewegte Gesamtentfernung wurde nicht verändert, was zeigt, dass das Verhalten des Bewegungsapparates nicht beeinträchtigt wurde. Die Anzahl der Center-Einträge wurde erhöht, wenn auch nicht signifikant. In Abbildung 4Dwerden die Daten der Kontrollgruppe angezeigt. Kontrolltiere zeigten keine Verhaltensänderungen zwischen Off- und On-Studien in einem der analysierten Parameter, was zeigte, dass Lichtstimulation oder Implantation nicht die beobachteten Effekte verursachten. Zusammenfassend zeigt dieser Test erhöhte Angst bei der Lichtstimulation von IL-Pyramidenneuronen über ChR2.
In Abbildung 5werden die Daten eines erfolglosen optogenetischen Experiments für das Elevated-Plus Maze gezeigt. Während des Elevated-Plus Maze-Experiments, das in Abbildung 5Avorgestellt wird, absolvierten Mäuse 6 Versuche von jeweils 3 Minuten. In den Versuchen 1, 3 und 5 wurde keine Lichtstimulation durchgeführt (Off1, Off2, Off3) und in den Versuchen 2, 4 und 6 wurde blaulichtstimulierend mit 20 Hz (5 ms Lichtimpuls) und 1 mW Intensität durchgeführt (On1, On2, On3). In diesen beispielhaften Ergebnissen waren die Länge des optogenetischen Protokolls und der Bau des Labyrinths selbst für die transgene Mauslinie nicht geeignet. In Abbildung 5Bist zu sehen, dass mehrere Mäuse mit ihren Hinterpfoten aus dem Labyrinth gerutscht sind oder sogar umgefallen sind. Als dies geschah, bekamen Mäuse eine zweite Chance, die EPM einen Tag später durchzuführen. Wenn sie wieder herunterfielen, wurden sie von der Analyse ausgeschlossen. Als Mäuse mehrmals abrutschten, aber es schafften, im Labyrinth zu bleiben, wurden die Daten normal analysiert. Dennoch müssen die Daten sehr sorgfältig interpretiert werden, und die Kontrolle der Tiere gewinnt an Bedeutung. Nex-Cre-Mäuse hatten motorische Schwierigkeiten, auf den schmalen offenen Armen zu bleiben. Um dies zu vermeiden, hätten kleine Wände mit einer Höhe von 1 cm zu einem sicheren Halt der hinteren Pfoten an den Armen des Labyrinths beigetragen. Sowohl die Heatmaps als auch die Graphiken zeigen, dass sowohl experimentelle als auch Kontrollmäuse begonnen haben, die offenen Arme von Versuch 2 (On1) auf zu vermeiden (Abbildung 5C-E). Die Zeit auf den offenen Armen wird für beide Gruppen deutlich verkürzt, ebenso wie die offenen Armeintritte. Die Analyse der Versuchsgruppe erhielt nur Daten, die eine große anxiogene Wirkung der Lichtstimulation implizierten, da die Zeit auf den offenen Arm und die Eintritte des offenen Arms während der On1-Studie signifikant verringert wird. Beim Vergleich dieser Daten mit der Kontrollgruppe, die das gleiche Verhalten zeigen, wird jedoch deutlich, dass das beobachtete Verhalten nicht durch die optogenetische Stimulation vermittelt wird, sondern durch Vermeidung der offenen Arme im Allgemeinen aufgrund der Gewöhnung an das Labyrinth. Diese Daten unterstreichen die Bedeutung einer geeigneten Kontrollgruppe, um zwischen Verhaltenseffekten, die durch optogenetische Stimulation vermittelt werden, und möglicher Verhaltensanpassung zu unterscheiden. Diese Daten beleuchten auch die Bedeutung einer ordnungsgemäßen Anpassung eines Versuchsaufbaus an die spezifische Mousselinie und die experimentelle Frage.
Um die gesammelten Verhaltensdaten zu validieren und zu stärken, werden Gehirne von Mäusen nach dem letzten Experiment entfernt, um die richtige Injektion und Implantation zu kontrollieren (Abbildung 6). Gehirne werden in 4% Paraformaldehyd fixiert und aus dem Schädel entfernt. Gehirne werden in 30% Saccharose für 1-2 Tage dehydriert und danach kryosliced. Die 40 m dicken koronalen Hirnscheiben werden gewaschen und auf Superfrostobjektivrutschen mit einem Montagemedium mit DAPI montiert, das Zellkerne färbt. Dies ermöglicht die Identifizierung von Zielbereichen in den koronalen Scheiben. Fluoreszenz des YFP-Tags oder tdTomato selbst gibt den Standort der Virusinjektion an. In Abbildung 6B werden die beispielhaften Injektionsstellen von ChR2-YFP links (gelb) und tdTomato rechts (rot) dargestellt. Mit Hilfe einer Vorlage, die aus dem45 Paxinos- und Franklin 45-Maus-Gehirnatlas angepasst wurde, kann die IL-Region identifiziert werden. In beiden Dias wird das optogenetische Werkzeug in der IL-Region, aber auch in angrenzenden Hirnregionen exprimiert. Für eine korrekte Interpretation wird die Verbreitung von blauem Licht im Hirngewebe konsultiert8 (Abbildung 1D,E). Es kann gesehen werden, dass das blaue Licht den DP-Bereich unterhalb der IL mit nur weniger als 5% der anfänglichen 1 mW Lichtintensität an der Faserspitze erreichen wird (Blaue Linie in Abbildung 1D)8. Zusätzlich kann eine kleine Menge Licht in die PrL-Region aufgrund der Rückstreuung47nach oben gehen. Folglich kann man sagen, dass die IL-Region am stärksten beleuchtet ist, aber angrenzende Regionen wie die DP- und PrL-Region können auch leicht stimuliert werden. Daher ist eine IL-zellspezifische Stimulation nicht garantiert und eine immunhistochemische Analyse der angrenzenden Regionen sollte durchgeführt werden, um zu sehen, ob die Aktivität von PrL- und DP-Zellen über Licht moduliert wird. In Abbildung 6Cwird ein weiteres wichtiges Steuerelement dargestellt: die Spezifität der Nex-Cre-Mauslinie. Durch Antikörperfärbung gegen die beiden Zelltypen in der IL-Region, glutamaterge Prinzip Neuronen und GABAerge Interneurons, Kann man sehen, dass die ChR2-YFP-Expression nur in glutamatergen Neuronen und nicht bei GABAergen auftritt.
Alles in allem zeigen unsere Experimente, dass bei optogenetischer Manipulation während Verhaltenstests Veränderungen im Angstverhalten beobachtet werden können. Durch die Verwendung von mehr als einem Test für das gleiche Verhalten kann eine zuverlässige Schlussfolgerung gezogen werden. Darüber hinaus bestätigt die immunhistochemische Analyse die erhaltenen Daten. Unsere Experimente deuten darauf hin, dass die spezifische Aktivierung von pyramidenförmigen Neuronen im fralimbischen Kortex das Angstverhalten in bestimmten Assays erhöht hat.
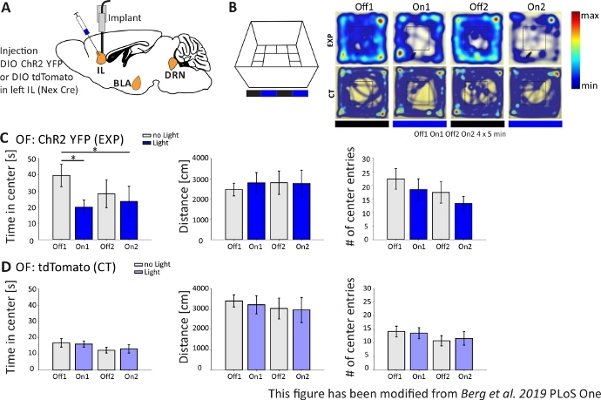
Abbildung 4: Optogenetische Aktivierung von IL-Pyramidenneuronen erhöht das Angstverhalten. Lichtstimulation während der Experimente: 473 nm, 1 mW, 20 Hz Stimulation. A) Schematische Zeichnung der Injektions- und Implantationsstelle für ChR2-YFP oder tdTomato in die IL. Während des Experiments werden pyramidale Neuronen im IL-Bereich des mPFC durch ChR2 aktiviert. Saggitale Hirnscheiben angepasst aus dem Paxinos und Franklin Maus Gehirn Atlas, saggital: lateral o,6. B) Open Field Labyrinth mit Lichtstimulation Stoltonie (20 min mit 4x5 min abwechselnd Off und On Trials; links) und Heatmaps von beispielhaften ChR2-injizierten (EXP) und tdTomato-injizierten (CT) Mäusen in allen 4 Studien des Experiments (rechts). EXP Tiere verbringen weniger Zeit in der Mitte des OF, wenn sie mit blauem Laserlicht stimuliert werden. Bei CT-Tieren unterscheidet sich die im Zentrum verbrachte Zeit nicht zwischen Licht-Aus- und On-Tests. C) Gruppendaten für EXP-Tiere im OF, n=11. Mäuse verbringen deutlich weniger Zeit in der Mitte des OF, wenn sie mit blauem Licht stimuliert werden (Off1 39,49±6,9 s, On1 19,87±4,47 s, Off2 28,13±8,55 s, On2 23,42±9,32 s, Off1:On1, t-Test, p = 0,033, *; Off1:On2, MWRS, p=0,049, *). Die entfernungbewegten (Off1 2703.09±292.65 cm, On1 3113.4±491.15 cm, Off2 3331.86 ±482.62 cm, On2 3082.17±658,61 cm). Die Anzahl der Centereinträge nimmt mit der Zeit ab, zeigt aber keine signifikanten Unterschiede (Aus 1 22,36±3,78, On1 18,45±3,95, Off2 17,36±1,99, On2 13,27±2,64). D) Gruppendaten für CT-Tiere im OF, n=15. Zeit, die Mäuse in der Mitte des OF verbringen, die Entfernung bewegt, die Anzahl der Mitteleinträge ändert sich nicht zwischen Licht Ein und Off-Tests (Zeit in der Mitte Off116.73±2.65 s, On1 16.02±1.89 s, Off2 12.02±1.76 s, On2 13.04±2.58 s; Abstand 1 3399.69±296.77 cm, On1 3210.6±446.9 cm, Off2 3030.28±513.83 cm, On2 2955±617.7 cm; Anzahl der Centereinträge Off1 14.2±1.98, On1 13.6±2.02, Off2 10.8±1.88, On2 11.67±2.5). CT-Mäuse zeigen deutlich höhere Ausgangsangst (Off1 EXP:CT, MWRS, p=0,005, **). Werte sind Mittelwert±S.E.M. * zeigen signifikante Unterschiede (p≤0,05), ** signifikante Unterschiede (p≤0,01). t-Test immer zweischwanzigen, MWRS: Mann-Whitney Rank Sum Test; IL: infralimbischer Kortex; BLA: basolaterale Amygdala; DRN: dorsale raphe Kerne; VON: Open Field; CT: Kontrolltiere; EXP: Versuchstier; L: Licht. Diese Zahl wurde von Berg et al. 2019, PLoS One43 und von Berg 201948geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
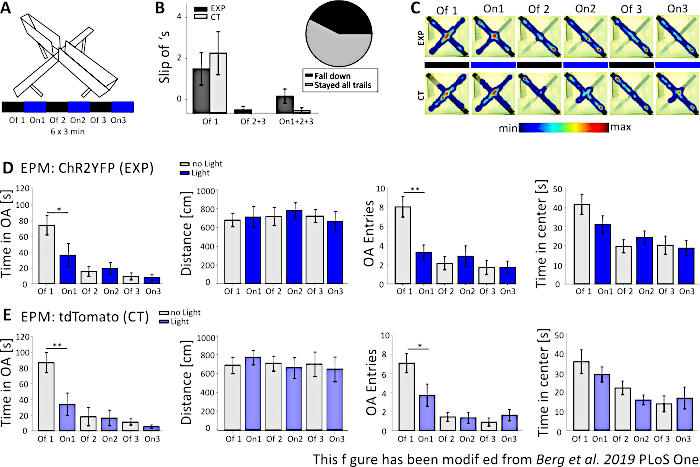
Abbildung 5: Das EPM-Experiment konnte bei Nex-Cre-Mäusen keine Verhaltenseffekte zeigen. Lichtstimulation während der Experimente: 473 nm, 1 mW, 20 Hz Stimulation. A) Elevated-Plus Maze mit Lichtstimulationsprotokoll (18 min, 6x3 min, abwechselnd Aus und On Trials). B) Gruppendaten für die Mäuse, die "abrutschen", sind in den Daten enthalten, insgesamt n=23. Nex-Cre-Mäuse neigten dazu, unabhängig von der Versuchsgruppe (links) mit ihren Hinterpfoten aus dem offenen Arm zu rutschen. Nur Mäuse, die für alle 6 Studien im Labyrinth blieben, wurden in späteren Analysen berücksichtigt. Slip-offs in der ersten Off1-Phase sind Grund für die spätere Vermeidung der offenen Arme (Off1 EXP 1.63±0.6, CT 2.2±0.79, Off2+3 EXP 0.125±0.125, CT 0±0, On1+2+3 EXP 0.625±0.26, CT 0.1±0.1). Das Kreisdiagramm (rechts) zeigt Mäuse, die während der 18 min aus dem Labyrinth fallen, mit 42,42%. Nur 57,57% beendeten das Experiment. C) Heatmaps von beispielhaften EXP- und CT-Mäusen in allen 6 Studien des Experiments. Beide Gruppen zeigen nach der Off1-Studie eine Abnahme der Dauer des offenen Arms. D) Gruppendaten für EXP-Tiere im EPM, n=12. Die Zeit, die in den offenen Armen verbracht wurde, verringerte sich in den ersten beiden Versuchen und danach kontinuierlich (Off1 73,91±12,22 s, Am1 36.15±14.65 s, Off2 15.61±6.23 s, On2 19.49±7.51 s, Off3 9.36±4.44 s, On3 7.96±3.47 s. Off1:On1, t-test, p=0,041, *). Der bewegte Abstand ist nicht betroffen (Off1 679.96±71.63 cm, On1 712.24±112.82 cm, Off2 717.49±97.39 cm, On2 782.51±81.11 cm, Off3 722.11±68.60 cm, On3 663.90±106.57 cm). Die Anzahl der offenen Armeinträge verringert sich deutlich von Off1 auf On1 und bleibt dann konstant (Off1 8.08±1.08, On1 3.33±0.76, Off2 2.16±0.69, On2 2.91±1.09, Off3 1.73±0.75, On3 1.73±0.66. Off1:On1, t-test, p=0.002, **). Die Zeit, die im Zentrum der EPM verbracht wird, nimmt entlang der Versuche ab, zeigt aber keinen signifikanten Unterschied von Off to On Trial (Off1 41.71±5.34 s, On1 31.2±4.59 s, Off2 19.8±3.44 s, On2 24.49±3.38 s, Off3 20.37±4.77 s, On3 18.85±4.07 s). E) Gruppendaten für CT-Tiere im EPM, n=11. DIE CT-Daten zeigen die gleichen signifikanten Rückgänge wie EXP-Daten, was darauf hindeutet, dass das Experiment nicht richtig funktioniert hat (Zeit in offenen Armen Off1 86.92±12.74 s, On1 33.78±14.38 s, Off2 18.01±11.61 s, On2 16.41±9.61 s, Off3 11.36±4.01 s, On3 5.43±2.07 s. Off1:On1, MWRS, p=0.009, **; Abstand 1 705.11±88.36 cm, On1 789.45±77.53 cm, Off2 724.74±80.49 cm, On2 676.57±111.99 cm, Off3 716.99±132.47 cm, On3 663.03±132.46 cm; Offene Armeinträge Off1 7.09±1, On1 3.72±1.17, Off2 1.45±0.47, On2 1.36±0.58, Off3 0.91±0.43, Off3 1.64±0.59. Off1:On1, MWRS, p=0.01, *; Zeit verbringen im Zentrum Off1 35,89 s, On1 29.25±3.96 s, Off2 22.17±3.58 s, On2 15.9±2.57 s, Off3 13.86±4.2 s, On3 16.89±5.75 s). Werte sind Mittelwerte ± S.E.M. * signifikante Unterschiede (p≤0,05) und ** signifikante Unterschiede (p≤0,01) anzeigen. t-Test ist immer zweischwänzig, MWRS: Mann-Whitney Rank Sum Test; EPM: Elevated-Plus Maze; CT: Kontrolltiere; EXP: Versuchstier; OA: offene Arme. Diese Zahl wurde von Berg et al. 2019, PLoS One43 und von Berg 201948geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
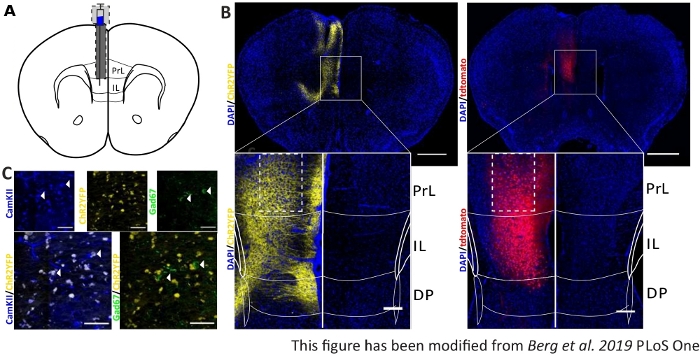
Abbildung 6: Injektionsseite von ChR2 und tdTomato in der IL- und Nex-Cre-Spezifität. A) Schematische Zeichnung der Implantationsstelle auf koronalen Hirnscheiben bei AP + 1,66 mm, ml 0,3 mm, DV -1,8 mm, mit einseitiger Injektion und Implantation (angepasst aus Maushirnatlas, Paxinos und Franklin, Bregma +1,54 mm). B) Beispielhafte Injektionsstellen von ChR2-YFP (links, gelb) und tdTomato (rechts, rot) verschmolzen mit DAPI-gebeizten Zellkernen (blau) bei Nex-Cre-Mäusen. Maßstabsstange 1 mm. Eintsets weisen eine hohe Vergrößerung der IL-Region auf. Skala bar 150 'm. Weiße Felder zeigen die Position der Einzahlenan. C) Obere Reihe: Konfokalaufnahmen der linken IL-Region einer Nex-Cre-Maus, die mit CamKII als Marker für glutamaterge Neuronen (blau) und ChR2-YFP (gelb) oder Gad67 als Marker für GABAerge Neuronen (grün) einer Nex-Cre-Maus befleckt ist. Untere Reihe: Kolokalisierung von ChR2-YFP (gelb) mit CamKII (links, blau), aber nicht mit Gad67 (rechts, grün), die Spezifität von Nex-Cre-Mäusen für glutamaterge Neuronen zeigt. Skalenstange 50 'm. PrL: prälimbischer Kortex; IL: infralimbischer Kortex; DP: dorsale pedunkuläre Kortex. Diese Zahl wurde von Berg et al. 2019, PLoS One43 und von Berg 201948geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Verwendung von Licht zur Manipulation neuronaler Signalisierung ist seit fast einem Jahrzehnt die Methode der Wahl. Seit 2005 die Anzahl der veröffentlichten Artikel über die Entwicklung neuer optogenetischer Werkzeuge4,6,8,14,49,50,51 und Studien, in denen solche Werkzeuge verwendet werden, um Gehirn-Schaltungen zu untersuchen21,23,40,43,52, stark erhöht. Einerseits ist die Experimentiermöglichkeit mit der enormen Vielfalt an injizierbaren optogenetischen Werkzeugen, Implantationsvarianten, transgenen Mauslinien und Verhaltensexperimenten vielfältig und unbegrenzt. Andererseits ist die Möglichkeit, Fehler bei der Auswahl der Versuchsbedingungen zu machen, sehr hoch und die Experimente sind so spezifisch, dass oft die Vergleichbarkeit mit anderen Studien schwierig ist.
Kritische Schritte
Ein wichtiger wichtiger Schritt dieses Protokolls ist die ordnungsgemäße Planung. Die Wahl des optogenetischen Instruments sollte der wissenschaftlichen Frage entsprechen. Ist es nur notwendig, die Gesamtaktivität eines Neurons oder einer Synapse zu manipulieren? Dann sind kommerziell bereitgestellte Werkzeuge wie ChR221,25,27 und Arch37 eine gute Wahl. Aber abgesehen davon, wenn ein spezielles Neurotransmitter-System oder sogar ein einzelner Rezeptor manipuliert werden sollte, ist ein einzelner Rezeptor Chimäre oft die bessere Wahl3,6. Mehrere Rezeptor-Chimären mit GPCRs, die sogenannten Opto-XRs, und Richtlinien, um sie zu produzieren, sind bereits verfügbar4,50. Neben der Wahl optogenetischer Werkzeuge ist auch die Mauslinie in Kombination mit dem Verhaltensexperiment von entscheidender Bedeutung. Verschiedene Hintergrundstämme, wie z.B. C57Bl/6 und BALB/cByJ, zeigen in mancher Hinsicht unterschiedliche Verhaltensphänotypen53,54an. C57Bl/6-Mäuse haben eine niedrige Ausgangsangst und können für angstlösende Manipulationen verwendet werden, während BALB/cByJ höhere Angstniveaus aufweisen und daher empfindlicher auf angstlösende Medikamente reagieren. Darüber hinaus können die transgenen Varianten dieser Hintergrundstämme auch in ihrem Phänotyp48variieren. Mit einer richtigen Kombination spezifischer Promotoren in Verbindung mit einem optogenetischen Werkzeug und einer transgenen Mauslinie kann fast jede gewünschte Zellpopulation gezielt werden.
Ein kritischer Schritt während der Operation ist die Ausrichtung auf den richtigen Ort. Mit Hilfe des Maus-Gehirnatlas können die richtigen Koordinaten für die vordere-hintere Achse und die medial-laterale Achse und die Tiefe der Struktur45festgelegt werden. In Wirklichkeit hat jeder Schädel eine etwas andere Form und Größe. Daher ist der F-Faktor46 zur Einstellung der stereotaktischen Koordinaten sehr wichtig, ebenso wie die richtige Nasen- und Ohrfixierung während der stereotaktischen Chirurgie. Wenn der Kopf der Maus geneigt ist, wird die Injektionskanüle nicht auf den gewünschten Interessenbereich abzielen.
Darüber hinaus ist auch der Durchmesser der Injektionskanüle entscheidend. Wenn es zu klein ist, kann kein Virus in das Gewebe freigesetzt werden, wenn es zu breit ist, wird die Kanüle Viruslösung auf dem Weg in die Region von Interesse lecken. Wenn die implantierte optische Faser direkt über der Zielregion endet, spielt die Virusexpression in den oben genannten Kortexregionen keine Rolle. Wenn das Implantat jedoch über anderen Regionen platziert wird, um Axonklemmen zu stimulieren, werden die Axone der oberen Kortexregionen auch durch Licht aktiviert und verfälschen erhaltene Daten. Ein Beispiel: Die IL-Region und die prälimbische (PrL) Region projizieren beide auf die basale Amygdala55,56, haben aber völlig unterschiedliche Funktionen und Rollen in der Modulation von Angst26,57. Wenn das Implantat oberhalb der Amygdala platziert wird, um Axonklemmen aus der IL-Region zu aktivieren, und während der Injektionviruslösung auch in die PrL aufgrund der falschen Injektionskanüle gelegt wurde, ist das Risiko, auch Axonklemmen aus dem PrL zu aktivieren, sehr hoch.
Bei der Vorbereitung des Schädels auf die Fixierung des Implantats ist der spärliche Einsatz von Primer und Bindung entscheidend für eine zuverlässige und dauerhafte Fixierung. Wenn das 2-Komponenten-Haftsystem nicht dünn aufgetragen wird, kann sich der Zahnzement nach ein paar Tagen oder Wochen vom Schädel lösen. Darüber hinaus muss der Schädel auch vor der Fixierung des Implantats vollständig getrocknet werden, da sonst der Zement nicht richtig am Schädel befestigt wird.
Kritische Schritte sind auch im Verhaltensteil dieses Protokolls vorhanden. Erstens ist der Bau des Labyrinths sehr wichtig. In jedem Verhaltens-Setup existieren in der Literatur mehrere Varianten in Bezug auf Größe und Form, sowie für das Verfahren selbst58,59,60. Es ist wichtig, eine Variante zu wählen, die die Daten vergleichbar und reproduzierbar macht. Auch besondere Anforderungen an genutzte Mauslinien sollten berücksichtigt werden43,48. In den repräsentativen Daten für die EPM ist zu sehen, dass mehrere Nex-Cre-Mäuse aus dem Labyrinth fielen oder mehrmals abrutschten (Abbildung 2b). Für diese Mäuse wäre ein Labyrinth mit einer kleinen Wand um die offenen Arme eine bessere Alternative gewesen.
Zweitens ist es wichtig, alle äußeren Raumbedingungen konstant zu halten61, sonst wären verschiedene Gruppen von Mäusen überhaupt nicht vergleichbar. In dieser Hinsicht ist es sehr wichtig, die Zeit des Experiments als eine zu wählen, in der der Versuchsaufbau leer ist und der Experimentator immer anwesend ist. Darüber hinaus sollten Ereignisse im Gebäude, wie Bauarbeiten, Das Testen von Systemen (Feueralarm) oder der Reinigungstag der Mausanlage, berücksichtigt werden, um Störungen der erhaltenen Daten zu vermeiden.
Schließlich sind Handhabungs- und Gehäusebedingungen für Verhaltensexperimente von entscheidender Bedeutung. Wenn eine Implantation durchgeführt wird, müssen Mäuse allein untergebracht werden, da das Risiko einer Verletzung durch andere Mäuse besteht. Um eine gute Vergleichbarkeit zwischen Gruppen und einen niedrigen Fehler innerhalb einer Gruppe zu gewährleisten, muss jede Maus die gleiche Käfiggröße und -anreicherung aufweisen. Für Angst-bezogene Experimente, Einzelgehäuse hat einige Vorteile als singe untergebracht männliche Mäuse zeigen eine niedrigere Ausgangsangst Ebene, weniger Variation in ihrer Angst-Level, und weniger depressiv-ähnliche Symptome15,16. Gruppe untergebracht männliche Mäuse können in ihrer Angst Ebene aufgrund der Hierarchie unter den Mäusen stark unterscheiden. Neben dem Gehäuse ist auch ein konstanter und gleichberechtigter Umgang mit allen Mäusen und Gruppen wichtig. Die Maus zu greifen, um die Lichtfaser am Implantat zu verbinden, ist sehr anstrengend. Daher muss dieses Verfahren für jede Maus gleich sein, was die gleiche Technik und den gleichen Experimentator bedeutet. Darüber hinaus muss die Gewöhnungszeit im Wartekäfig, die die Maus von der stressigen Verbindungsprozedur abbringen soll, auch gleiche Bedingungen in Dauer, Wurf und Position zum Labyrinth haben. Die Handhabung innerhalb der Mausfunktion ist auch für die spätere Verhaltensleistung entscheidend. Versuchs- und Kontrolltiere sollten nicht an verschiedenen Tagen oder von verschiedenen Menschen gereinigt werden, da dies auch für Mäuse belastend ist. Darüber hinaus sollte der Reinigungstag nicht der versuchsweise Tag sein, um Verhaltensunterschiede zu vermeiden.
Problembehandlung
Es gibt mehrere Probleme, die während des Protokolls auftreten können. Zum Beispiel könnte das Bohren eines Ganzen im Schädel während der stereotaktischen Operation Blutgefäße schädigen. In der Regel tritt starke Blutungen auf, vor allem über Bregma und Lambda. Wenn dies geschieht, versuchen Sie nicht, die Blutung mit Baumwollstäben zu stoppen, da sie dazu neigen, noch mehr Blutungen aus dem Gefäß wegen ihrer Saugfähigkeit zu verlängern, sondern direkt mit NaCl abspülen.
Es kann auch vorkommen, dass die Druckinjektion der Viruslösung nicht funktioniert. In diesem Fall könnte es sein, dass Parafilm, ein Schorf aus dem Gratloch oder Hirngewebe, die Spitze der Kanüle verstopft. Entfernen Sie in diesem Fall die Kanüle langsam aus dem Gehirn, ohne die x- oder y-Achse zu ändern, und entfernen Sie mit einer Pinzette 1-2 mm des vorderen Teils der Kanülenspitze. Bevor Sie die Kanüle erneut senken, testen Sie die Funktionalität, indem Sie einen kleinen Druck ausüben, um zu sehen, ob das Virus aus der Kanülenspitze kommt. Um Verstopfung zu vermeiden, senken Sie die Kanüle mit einer konstanten Geschwindigkeit und stoppen Sie die Bewegung nicht, bis die tiefste Tiefe der Injektionsseite erreicht ist. Wenn zu viel der Kanülenspitze entfernt wird und der Durchmesser zu groß ist, wird die Kanüle Gewebe schädigen und das Risiko, das Virus auf einmal anzuwenden, erhöht. Stellen Sie daher sicher, dass nur der verstopfte Teil der Spitze sorgfältig entfernt wird.
Während des Verhaltensexperiments kann die Einrichtung des Experiments in der Video-Tracking-Software (z. B. Ethovision XT) Probleme verursachen. Wenn z. B. die Lichtleistung nicht richtig funktioniert, kann dies aus mehreren Gründen geschehen. Der Pulser muss geöffnet, programmiert und gestartet werden, bevor Ethovision XT geöffnet wird. Die Hardware muss im "Experimentellen Setup" (Schritt 3.2.2.4) korrekt ausgewählt werden. Wenn die falsche IO-Box oder etwas anderes als "Costume Hardware" ausgewählt ist, kann das Pulser-Gerät nicht von Ethovision gesteuert werden. Wenn der Test der Lichtleistung erfolgreich ist, aber das programmierte Lichtprotokoll in "Teststeuerungseinstellungen" während der Erfassung nicht funktioniert, kann die Unterregel oder Unterregelreferenz falsch lokalisiert werden oder die Bedingungen und Aktionen sind unklar. Zum Beispiel: Gehört der Verweis zur richtigen Unterregel? Ist die Referenz korrekt programmiert (z.B. wie oft wird die Unterregel ausgeführt)?
Darüber hinaus kann es vorkommen, dass das Tier während der "Erkennungseinstellungen" angemessen verfolgt wird, aber während der Erfassung gibt es Proben, bei denen das Motiv nicht gefunden wird. Überprüfen Sie in diesem Fall, ob die Beleuchtung im Versuchsraum verändert wurde oder ob irgendetwas unerwünschte Schatten im Labyrinth erzeugt. Der gesamte Boden des Labyrinths muss die gleiche Farbe haben, da die Einstellung nur für eine bestimmte Kombination funktioniert. Wenn aus welchen Gründen auch immer unterschiedliche Unterfarben oder Schatten nicht vermieden werden können, definieren Sie die Erkennungseinstellung im dunkelsten Teil des Labyrinths.
Um Einstellungen nach dem Erwerb der ersten Tiere zu ändern, wenden Sie diese Änderungen nicht in den bereits verwendeten Einstellungen an. Duplizieren Sie sie, um sie anzupassen. Dies bedeutet auch, dass die bereits aufgezeichnete Studie für die Datenanalyse nicht mehr gültig ist. Zeichnen Sie in einem solchen Fall alle Tiere für diese Versuchsgruppe mit den ursprünglichen Einstellungen auf und erstellen Sie anschließend ein neues Experiment, bei dem die aufgenommenen Videos anstelle von Live-Tracking analysiert werden. In diesem "von Video"-Experiment können mehrere Einstellungen für die Analyse verwendet werden, ohne die Vergleichbarkeit zwischen Tieren oder sogar Daten zu verlieren.
Einschränkungen und zukünftige Anwendungen
Diese Methode der Manipulation des Verhaltens mit der Optogenetik bei frei beweglichen Tieren beinhaltet auch Einschränkungen. Während der Operation ist die Nähe der beiden Implantate eingeschränkt. Bei der doppelten Implantation muss der Abstand zwischen den beiden Implantaten minimal die Breite des Geräts sein, um das Implantat zu halten. Das Gerät muss das zweite Implantat in das Gratloch senken, während die ersten Implantate bereits fixiert sind. Eine Lösung dafür könnte eine abgewinkelte Implantation sein, bei der die Spitzen der Glasfaser sehr nah sein können, während die Keramikfeder über dem Schädel einen größeren Abstand23,55,,56,57,62,63haben. Ein Nachteil einer abgewinkelten Implantation ist die Lichtausbreitung. Wenn die Faserspitze schräg statt von geradeoben ist, ist der stimulierte Bereich anders. Bei zwei Zielregionen in unmittelbarer Nähe muss die veränderte Position der Lichtstimulation berücksichtigt werden.
Während des Verhaltensexperiments kann die Konstruktion des Labyrinths das mit dem Tier verbundene optische Kabel stören. Einige Verhaltenstests, wie z. B. die Hell-Dunkel-Box, enthalten einen Innenbereich64,65, und andere Labyrinthe enthalten Fächer, die die Maus betreten muss. Solche Experimente können mit diesem Setup nicht durchgeführt werden. Alternativ kann ein drahtloses System eine Option22,26,66sein. Aber zum Glück können einige Labyrinthe, wie das Barnes Maze, so angeordnet werden, dass die Mäuse die entsprechenden Fächer67betreten können.
Neben solchen mit geschlossenen Zonen können auch zu breite Labyrinthe Probleme verursachen. Je größer die Fläche des Labyrinths, desto länger muss das Kabel sein, damit das Tier an jede Position im Labyrinth gehen kann. Es ist darauf zu achten, dass das Tier nicht in der Lage ist, auf das Kabel zu treten oder es zu greifen und es zu beißen. Eine Lösung dafür könnte eine Konstruktion sein, die das redundante Kabel aufrollt. Ein Nachteil ist, dass der Luftwiderstand zum Ausrollen des Kabels für Mäuse schwierig ist. Diese Lösung würde besser für Ratten geeignet. Eine weitere Möglichkeit könnte sein, die Lichtstimulation im Voraus durchzuführen, statt während des Experiments ist dies natürlich nur möglich, wenn ein Langzeiteffekt durch die Lichtstimulation auftritt23.
Vergleich zu bestehenden/alternativen Methoden
Alternative Methoden wären chemische oder elektrische Stimulation während des Verhaltens8,18. Chemische Agonisten oder Antagonisten sind in der Lage, Neuronen über bestimmte Rezeptoren zu aktivieren oder zum Schweigen zu bringen und können auch einzelne Neurotransmitter-Systeme38,68manipulieren. Einerseits ist die Rezeptor-Spezifität für Chemikalien recht hoch, da spezifischer Agonist oder Antagonist nur bestimmte Rezeptoren aktiviert39. Auf der anderen Seite, die Spezifität für Rezeptor-Subtypen der gleichen Neurotransmitter-Gruppe ist oft unzureichend. Die meisten Chemikalien binden an mindestens zwei Untertypen mit unterschiedlichen Wahrscheinlichkeiten69. Darüber hinaus können Chemikalien nicht zwischen neuronalen Zelltypen unterscheiden, solange sie die gleichen Rezeptortypen besitzen. Darüber hinaus ist die zeitliche und räumliche Auflösung schlecht für chemische Manipulationen im Vergleich zur Optogenetik. Agonisten oder Antagonisten werden oft oral35 oder über systemische Injektionen57,70verabreicht. Wenn die Infusion der Chemikalie direkt im Gehirngewebe erfolgt, effekte schneller als bei oralen Anwendungen, aber immer noch auf einer langsameren Zeitskala als bei der Lichtstimulation. Da die verabreichten Chemikalien im Gehirn diffundieren und nicht spezifisch für neuronale Typen oder Hirnregionen sind, ist die Manipulation bestimmter Gehirnschaltkreise nicht möglich.
Elektrische Stimulation hat eine höhere zeitliche Auflösung als chemische Stimulation9,14. Die Streuung im neuronalen Gewebe ist geringer als bei der chemischen Stimulation und die räumliche Auflösung ist besser als bei der chemischen Stimulation. Die elektrische Stimulation hat jedoch keine Möglichkeit, verschiedene neuronale Zelltypen oder Rezeptortypen gezielt anzusprechen, da jedes Neuron in der Nähe der Elektrode auf die elektrische Stimulation reagiert.
Alternative Methoden zum Verhalten bei frei beweglichen Mäusen sind beispielsweise elektrophysiologische Aufnahmen in Hirnscheiben, bei denen einzelne Neuronen oder Axone mit Optogenetik moduliert und Effekte über die Aufzeichnung von Elektroden6,71gemessen werden können. In-vitro-Experimente bieten die Möglichkeit, die molekulare und zelluläre Basis optogenetischer Stimulationen zu untersuchen, haben aber die Einschränkung, dass intrinsische Konnektivität und Input aus anderen Hirnregionen fehlen. Eine weitere Möglichkeit ist die Optogenetik in Verbindung mit Multiphotonen-Bildgebung1,72. In diesem Fall haben Mäuse ihren Kopf fixiert und können beästhetisiert werden oder wach sein, um einfache Aufgaben zu lösen.
Um ein erfolgreiches optogenetisches Experiment durchzuführen, stehen heutzutage eine breite Palette von Werkzeugen und Anwendungen zur Verfügung. Die Auswahl optogenetischer Werkzeuge und die Verhaltenseinstellung sind entscheidend, um spezifische Forschungsfragen zu beantworten. Wenn die richtige Kombination von Werkzeugen und Experimenten gewählt wird, ermöglicht die Optogenetik eine beispiellose, eingehende Untersuchung neuronaler Schaltkreise mit hoher zeitlicher und räumlicher Auflösung. Dies wird dazu beitragen, neue therapeutische Strategien für psychiatrische Erkrankungen und Kognition zu verstehen und zu entwickeln.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Herzlichen Dank an Prof. Klaus-Armin Narve und Dr. Sandra Goebbels (Max-Plank-Institut für Experimentelle Medizin, Göttingen, Deutschland) für die freundliche Bereitstellung von Nex-Cre-Mäusen. Außerdem danken wir unserem Video-Team Yunus Dikici und Ruben Wiesner für die Aufnahme und Bearbeitung des JoVE-Videos für diesen Artikel. Außerdem vielen Dank an Kristin Claussen für ihre Stimme und Kimberly Anne Go für das Korrekturlesen des Manuskripts.
Die vorgestellten Ergebnisse wurden an der Ruhr-Universität Bochum eingeholt und das Video an der Universität Bremen aufgenommen.
Gefördert wurde diese Arbeit von der Deutschen Forschungsgemeinschaft (DFG) - Projektnummer 122679504 - SFB 874 und DFG MA 4692/3-2.
Materialien
| Name | Company | Catalog Number | Comments |
| Ketamin | Sigma-Aldrich | K2753-64 | Anestasia |
| 20 % Glucose | AlleMan Pharma | Injection s.c. for fast recovery | |
| Behavioral mazes | Costum made | Measure anxiety | |
| Bepanthen | Bayer | Ophthalmic oinment | |
| Betaisodona | Monodipharma | Sterilant containing iodine | |
| Betaisodona | Monodipharma | Iodine oinment | |
| Binocular | Olympus | SZ52, 110AL0.62x WD160 | Surgery |
| Ceramic ferrules | Thorlabs | CFLC230-10 | Implant |
| Ceramic Fiber Scribe | Thorlabs | CSW12.5 | Cutting of the glass fiber |
| Channelrhodopsin2-YFP virus | Penn Vector Core | Addgene 20298 | Optogenetic tool |
| Compressed air | Kontakt Chemie | Druckluft 67 | Drying of the skull |
| Coordinate system | Stoelting | Stereotactic coordinates for the surgery | |
| Correl Draw | Graphical software version 13 | ||
| Cryoslicer | MICROM | HM500OM | Production of brain slices for staining |
| Ethovision XT 14 | Noldus | Software for behavioral tracking | |
| Exel | Statistical Software | ||
| Ferrule Polishing Puck | Thorlabs | D50-F | Polishing implants round side |
| Fiber Patch Cord dual | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cables, which are connected with the two implants of a bilateral implantation |
| Fiber Patch Cord single | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cable, which is connected with the implant via a sleeve |
| Fiber Stripping Tool | Thorlabs | T06S13 | Stripping glass fiber for implant |
| Filter paper | VWR European | 516-0300 | Cut into pieces for the Novelty-Suppressed Feeding test |
| Food pellets | Mühle Levers | Höveler Nagerfutter | Nutrition for the mice |
| Glass pipettes | Harvard Apparatus | GC150-10 | Injection pipettes |
| Gradia direct-Flo | Henry Schein | 103322 | Fluid dental cementum |
| Heating lamp | efbe-Schott/Phillips | R95E | Prevent the mice from cooling after the surgery |
| Heating plate | Stoelting | Integrated into coordinate system | |
| Injection canula | Braun | 100 Sterican, 0,4 x 20 mm, Gr. 20 | All injections and to bore hole into the skull |
| Litter | T 1350 | Grounding for the Novelty-Supressed Feeding test | |
| Mouse cages | Zoonlab | 405 cm^2 | Single housing for experiments |
| Optibond FL | Kerr | 26684E | Preparation of the skull for implantation |
| Optical glass fiber | Thorlabs | FT200EMT | Light fiber for implant |
| Optogenetics-LED.STSI | Prizmatix | Optogenetic toolbox for light stimulation during behavioral experiments | |
| Paraformaldehyde | Sigma-Aldrich | 16005-1KG-R | Perfusion of mice to remove the brains |
| Polishing sheet 0.02 µm grit | Thorlabs | LFCF | Polishing implants round side |
| Polishing sheet 1 µm grit | Thorlabs | LF1D | Polishing implants round side |
| Polishing sheet 30 µm grit | Thorlabs | LF30D | Polishing implants round side |
| Polishing sheet 6 µm grit | Thorlabs | LF6D | Polishing implants round side |
| Pulser Software | Prizmatix | Software for light device control | |
| Rimadyl-Carprofen | Zoetis | Analgesia | |
| Sigma Plot | Software for statistics | ||
| Sleeve | Thorlabs | FT200EMT | Connection of implant and light cable |
| SodiumCloride (NaCl) | Braun | 3570410 | Rinsing of the skull |
| Superglue | Pattex Henkel | To Fix the glass fiber in the ferrule | |
| td-Tomato virus | Penn Vector Core | Addgene 51503 | Optogenetic tool |
| UV light | KoQGHJ | wireless, 1200 mW/cm^2 | Polymeration lamp for dental cementum |
| Xylavet-Xylazin | cp pharma | Anesthesia |
Referenzen
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature Letters. 463, 98-102 (2010).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Spoida, K., Masseck, O. A., Deneris, E. S., Herlitze, S. Gq/5-HT2c receptor signals activate a local GABAergic inhibitory feedback circuit to modulate serotonergic firing and anxiety in mice. Proceedings of the National Academy of Science of the United States of America. 111, 6479-6484 (2014).
- Kleinlogel, S. Optogenetic user's guide to Opto-GPCRs modified GPCRs. Frontiers in Bioscience. 21, 794-805 (2016).
- Mahn, M., Prigge, M., Ron, S., Levy, R., Yizhar, O. Biophysical constraints of optogenetic inhibition at presynaptic terminals. Nature Neuroscience. 19, 554-556 (2016).
- Masseck, O. A., et al. Vertebrate Cone Opsins Enable Sustained and Highly Sensitive Rapid Control of Gi/o Signaling in Anxiety Circuitry. Neuron. 81, 1263-1273 (2014).
- Oh, E., Maejima, T., Liu, C., Deneris, E., Herlitze, S. Substitution of 5-HT 1A Receptor signaling by a light-activated G protein-coupled receptor. Journal of Biological Chemistry. 285, 30825-30836 (2010).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in Neural Systems. Neuron Primer. 71, 9-34 (2011).
- Masseck, O. A. A Guide to Optogenetic Applications, With special Focus on Behavioral and In Vivo Electrophysiological Experiments. HandboOk of In Vivo Neural Plasticity Techniques - A Systems Neuroscheince Approach to the Neural Basis of Memory and Cognition. Manahan-Vaughan, D. , Academic Press. 557(2019).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. , 611-621 (2006).
- Yang, Y. S., Hughes, T. E. Cre Stoplight: A red/green fluorescent reporter of Cre recombinase expression in living cells. Biotechniques. 31, 1036-1041 (2001).
- Schnütgen, F., et al. A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse. Nature Biotechnology. 21, 562-565 (2003).
- Taniguchi, H., et al. A Resource of Cre Driver Lines for Genetic Targeting of GABAergic Neurons in Cerebral Cortex. Neuron. 71, 995-1013 (2011).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 268-273 (2011).
- Palanza, P., Gioiosa, L., Parmigiani, S. Social stress in mice: Gender differences and effects of estrous cycle and social dominance. Physiology and Behavior. 73, 411-420 (2001).
- Karolewicz, B., Paul, I. A. Group housing of mice increases immobility and antidepressant sensitivity in the forced swim and tail suspension tests. European Journal of Pharmacology. 415, 197-201 (2001).
- Masseck, O. A., Rubelowski, J. M., Spoida, K., Herlitze, S. Light- and drug-activated G-protein-coupled receptors to control intracellular signalling. Experimental Physiology. 96, 51-56 (2011).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4, (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature Article. 446, 633-639 (2007).
- Owen, S. F., Liu, M. H., Kreitzer, A. C. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience. 22, 1061-1065 (2019).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nature Communication. 10, 1-12 (2019).
- Allsop, S. A., Vander Weele, C. M., Wichmann, R., Tye, K. M. Optogenetic insights on the relationship between anxiety-related behaviors and social deficits. Frontiers in Behavioral Neuroscience. 8, 1-14 (2014).
- Fuchikami, M., et al. Optogenetic stimulation of infralimbic PFC reproduces ketamine's rapid and sustained antidepressant actions. Proceedings of the National Academy of Science of the United States of America. 112, 8106-8111 (2015).
- Correia, P. A., et al. Transient inhibition and long-term facilitation of locomotion by phasic optogenetic activation of serotonin neurons. Elife. 6, 1-26 (2017).
- Felix-Ortiz, A. C., Burgos-Robles, A., Bhagat, N. D., Leppla, C. A., Tye, K. M. Bidirectional modulation of anxiety-related and social behaviors by amygdala projections to the medial prefrontal cortex. Neuroscience. 321, 197-209 (2016).
- Marek, R., Xu, L., Sullivan, R. K. P., Sah, P. Excitatory connections between the prelimbic and infralimbic medial prefrontal cortex show a role for the prelimbic cortex in fear extinction. Nature Brief Communication. , (2018).
- Parfitt, G. M., et al. Bidirectional Control of Anxiety-Related Behaviors in Mice: Role of Inputs Arising from the Ventral Hippocampus to the Lateral Septum and Medial Prefrontal Cortex. Neuropsychopharmacology. 42, 1715-1728 (2017).
- Bandelow, B., Michaelis, S. Epidemiology of anxiety disorders in the 21st century. Dialogues in Clinical Neuroscience. 17, 327-335 (2015).
- Kessler, R. C., et al. Lifetime Prevalence and Age-of-Onset Distributions of DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 62, 593-602 (2005).
- Kessler, R. C., Petukhova, M., Sampson, N. A., Zaslavsky, A. M., Wittchen, H. U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. International Journal of Methods Psychiatric Research. 21, 169-184 (2014).
- Andlin-Sobocki, P., Wittchen, H. U. Cost of anxiety disorders in Europe. European Journal of Neurology. 12, 39-44 (2005).
- Forster, G. L., Novick, A. M., Scholl, J. L., Wall, M. J. The Role of the Amygdala in Anxiety Disorders. Intech. , 61-102 (2012).
- Liberzon, I. Neural circuits in anxiety and stress disorders a focused review. Therapeutics and Clinical Risk Management. 11, 115-126 (2015).
- Sylvers, P., Lilienfeld, S. O., LaPrairie, J. L. Differences between trait fear and trait anxiety: Implications for psychopathology. Clinical Psychology Review. 31, 122-137 (2011).
- Daws, L. C., Koek, W., Mitchell, N. C. Revisiting Serotonin Reuptake Inhibitors and the Therapeutic Potential of 'Uptake-2' in Psychiatric Disorders. ACS Chemical Neuroscience. 4, 16-21 (2013).
- Felix-Ortiz, A. C., et al. BLA to vHPC inputs modulate anxiety-related behaviors. Neuron Report. 79, 658-664 (2013).
- Padilla-Coreano, N., et al. Direct Ventral Hippocampal-Prefrontal Input Is Required for Anxiety-Related Neural Activity and Behavior. Neuron Article. 89, 857-866 (2016).
- Lisboa, S. F., Stecchini, M. F., Corrêa, F. M. A., Guimarães, F. S., Resstel, L. B. M. Different role of the ventral medial prefrontal cortex on modulation of innate and associative learned fear. Neuroscience. 171, 760-768 (2010).
- Bi, L. L., et al. Enhanced excitability in the infralimbic cortex produces anxiety-like behaviors. Neuropharmacology. 72, 148-156 (2013).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature Article. 477, 171-178 (2011).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. 44, 611-621 (2006).
- Rubenstein, J. L. R., Merzenich, M. M. Model of autism: increased ratio of excitation/ inhibition in key neural systems. Genes, Brain and Behavior. 2, 255-267 (2003).
- Berg, L., Eckardt, J., A, M. O. Enhanced activity of pyramidal neurons in the infralimbic cortex drives anxiety behavior. PLoS One. 14, 1-19 (2019).
- Meunier, C. N. J., Amar, M., Lanfumey, L., Hamon, M., Fossier, P. 5-HT1A receptors direct the orientation of plasticity in layer 5 pyramidal neurons of the mouse prefrontal cortex. Neuropharmacology. 71, 37-45 (2013).
- Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J. Mouse Brain in Stereotaxic Coordinates. 2, Academic Press. (2004).
- Gore, B. B., Soden, M. E., Zweifel, L. S. Manipulating gene expression in projection-specific neuronal populations using combinatorial viral approaches. Current Protocols in Neuroscience. 435, 1-6 (2014).
- Stujenske, J. M., Spellman, T., Gordon, J. A. Modeling the Spatiotemporal Dynamics of Light and Heat Propagation for InVivo Optogenetics. Cell Report. 12, 525-534 (2015).
- Berg, L. Imbalance of excitation and inhibition within the prefrontal cortex supports anxiety behavior. Ruhr-University Bochum. , Doctoral dissertation (2019).
- Boyden, E. S. A history of optogenetics: The development of tools for controlling brain circuits with light. F1000 Biology Reports. 3, 1-12 (2011).
- Airan, R. D., Thompson, K. R., Fenno, L. E., Bernstein, H., Deisseroth, K. Temporally precise in vivo control of intracellular signalling. Nature. 458, 1025-1029 (2009).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7, 12-23 (2012).
- Covington, H. E., et al. Antidepressant Effect of Optogenetic Stimulation of the Medial Prefrontal Cortex. Journal of Neuroscience. 30, 16082-16090 (2010).
- Lepicard, E. M., Joubert, C., Hagneau, I., Perez-Diaz, F., Chapouthier, G. Differences in anxiety-related behavior and response to diazepam in BALB/cByJ and C57BL/6J strains of mice. Pharmacology, Biochemistry and Behavior. 67, 739-748 (2000).
- Schmidt, M. V., Müller, M. B. Animal models of anxiety. Elsevier. 3, 369-374 (2006).
- Cho, J. H., Deisseroth, K., Bolshakov, V. Y. Synaptic Encoding of Fear Extinction in mPFC-amygdala Circuits. Neuron Article. 80, 1491-1507 (2013).
- Adhikari, A., et al. Basomedial amygdala mediates top-down control of anxiety and fear. Nature. 527, 179-185 (2015).
- Suzuki, S., et al. The infralimbic and prelimbic medial prefrontal cortices have differential functions in the expression of anxiety-like behaviors in mice. Behavioural Brain Research. 304, 120-124 (2016).
- Carola, V., D'Olimpio, F., Brunamonti, E., Mangia, F., Renzi, P. Evaluation of the elevated plus-maze and open-field tests for the assessment of anxiety-related behaviour in inbred mice. Behavioural Brain Research. 134, 49-57 (2002).
- Prut, L., Belzung, C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: A review. European Journal of Pharmacology. 463, 3-33 (2003).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature Letter. 471, 358-362 (2011).
- Bouwknecht, J. A., et al. Differential effects of exposure to low-light or high-light open-field on anxiety-related behaviors: Relationship to c-Fos expression in serotonergic and non-serotonergic neurons in the dorsal raphe nucleus. Brain Research Bulletin. 72, 32-43 (2007).
- Overstreet, D. H., Knapp, D. J., Angel, R. A., Navarro, M., Breese, G. R. Reduction in repeated ethanol-withdrawal-induced anxiety-like behavior by site-selective injections of 5-HT1A and 5-HT2C ligands. Psychopharmacology. 187, Berlin. 1-12 (2006).
- Takahashi, A., et al. Glutamate Input in the Dorsal Raphe Nucleus As a Determinant of Escalated Aggression in Male Mice. Journal of Neuroscience. 35, 6452-6463 (2015).
- Klemenhagen, K. C., Gordon, J. A., David, D. J., Hen, R., Gross, C. T. Increased Fear Response to Contextual Cues in Mice Lacking the 5-HT1A Receptor. Neuropsychopharmacology. 31, 101-111 (2006).
- Ramos, A. Animal models of anxiety: do I need multiple tests. Trends in Pharmacological Science. 29, 493-498 (2008).
- Isosaka, T., et al. Htr2a-Expressing Cells in the Central Amygdala Control the Hierarchy between Innate and Learned Fear. Cell. 163, 1153-1164 (2015).
- Regev, L., Goshen, I. Employing Optogenetics in Memory Research. Optogenetics: A Roadmap. , 219-256 (2017).
- Shah, A. A., Sjovold, T., Treit, D. Inactivation of the medial prefrontal cortex with the GABA A receptor agonist muscimol increases open-arm activity in the elevated plus-maze and attenuates shock-probe burying in rats. Brain Research. 1028, 112-115 (2004).
- Knight, A. R., et al. Pharmacological characterisation of the agonist radioligand binding site of 5-HT2A, 5-HT2B and 5-HT2C receptors. Naunyn-Schmiedebergs Archiv of Pharmacology. 370, 114-123 (2004).
- Graeff, F. G., Viana, M. B., Mora, P. O. Dual Role of 5-HT in Defense and Anxiety. Neuroscience and Biobehavioral Reviews. 21, 791-799 (1997).
- Cheriyan, J., Sheets, P. L. Altered Excitability and Local Connectivity of mPFC-PAG Neurons in a Mouse Model of Neuropathic Pain. Journal of Neuroscience. 38, 4829-4839 (2018).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten