Method Article
Manipulação optogenética da atividade neuronal para modular o comportamento em camundongos em movimento livre
Neste Artigo
Resumo
Com a manipulação optogenética de populações neuronais específicas ou regiões cerebrais, o comportamento pode ser modificado com alta resolução temporal e espacial em animais em movimento livre. Usando diferentes ferramentas optogenéticas em combinação com fibras ópticas cronicamente implantadas, uma variedade de modulações neuronais e testes comportamentais podem ser realizados.
Resumo
A modulação optogenética dos circuitos neuronais em camundongos em movimento livre afeta o comportamento agudo e de longo prazo. Este método é capaz de realizar manipulações de neurônios únicos e liberação de transmissor específico da região, até circuitos neuronais inteiros no sistema nervoso central, e permite a medição direta dos desfechos comportamentais. Os neurônios expressam ferramentas optogenéticas através de uma injeção de vetores virais que carregam o DNA de escolha, como o Channelrhodopsin2 (ChR2). A luz é trazida para regiões cerebrais específicas através de implantes ópticos crônicos que terminam diretamente acima da região alvo. Após duas semanas de recuperação e expressão adequada da ferramenta, os camundongos podem ser usados repetidamente para testes comportamentais com estimulação optogenética dos neurônios de interesse.
A modulação optogenética tem uma alta resolução temporal e espacial que pode ser realizada com alta especificidade celular, em comparação com os métodos comumente utilizados, como estimulação química ou elétrica. A luz não prejudica o tecido neuronal e, portanto, pode ser usada para experimentos de longo prazo, bem como para múltiplos experimentos comportamentais em um rato. As possibilidades de ferramentas optogenéticas são quase ilimitadas e permitem a ativação ou silenciamento de neurônios inteiros, ou mesmo a manipulação de um tipo específico de receptor por luz.
Os resultados desses experimentos comportamentais com estimulação optogenética integrada visualizam diretamente as mudanças de comportamento causadas pela manipulação. O comportamento do mesmo animal sem estimulação de luz como base é um bom controle para mudanças induzidas. Isso permite uma visão geral detalhada dos tipos neuronais ou sistemas neurotransmissores envolvidos em comportamentos específicos, como a ansiedade. A plasticidade das redes neuronais também pode ser investigada em grande detalhe através de estimulação de longo prazo ou observações comportamentais após estimulação óptica. A optogenética ajudará a iluminar a sinalização neuronal em vários tipos de doenças neurológicas.
Introdução
A modulação dos circuitos neuronais no sistema nervoso central e seus desfechos comportamentais são importantes para entender como o cérebro funciona, especialmente em doenças psiquiátricas e tarefas cognitivas, como aprendizado e memória. Com optogenética, células únicas ou populações de células até circuitos inteiros podem ser moduladas pela luz. Ferramentas optogenéticas comuns como Channelrhodopsin2 (ChR2) ou Archaerhodopsin (Arco) são capazes de ativar ou silenciar neurônios, ou aumentar ou inibir a liberação de transmissores em terminais de axônio projetando para regiões cerebrais distintas1,,2,,3,4. No entanto, o Arch precisa ser usado com cuidado, pois foi demonstrado que sua ativação em terminais pré-sinápticos aumenta a liberação espontânea do transmissor5. Arch é uma bomba de próton retificadora externa que altera o valor do pH dentro da célula. Este meio alcalino induz o fluxo de cálcio e aumenta a liberação do transmissor5. Para modular especificamente as vias de sinalização intracelulares, podem ser criadas quimeras receptoras compostas por uma ferramenta optogenética ativada à luz, como rhodopsina ou cone opsin, em conjunto com um receptor adequado de proteína G acoplado,6,,7,,8. A quantidade e variação das ferramentas optogenéticas disponíveis aumentou significativamente durante a última década9.
O objetivo da optogenética é manipular circuitos neuronais durante o comportamento. A optogenética permite, por exemplo, a medição de mudanças comportamentais agudas, como mudanças no comportamento da ansiedade. Ferramentas optogenéticas são entregues em regiões-alvo do cérebro através de vetores virais. Com a ajuda de promotores e intensificadores especiais, ou do sistema Cre-loxP, a especificidade do tipo celular pode ser garantida para a expressão de ferramentas optogenéticas(Figura 1A). Existem várias linhas de camundongos geneticamente modificadas expressando a enzima Cre-Recombinase apenas em tipos de células específicas. Por exemplo, os camundongos Nex-Cre expressam o Cre-Recombinase em neurônios piramifecionais no córtex e no hipocampo sob o controle do Nex-promotor10. Esta enzima é capaz de inverter sequências de DNA, que são flanqueadas pelos lados loxP11. Consequentemente, a sequência de DNA de uma ferramenta optogenética dupla floxed, que é invertida e flanqueada por lados loxP, só pode ser transcrita por neurônios que possuem o Cre-Recombinase,mas não por outros tipos neuronais12,,13. No caso dos camundongos Nex-Cre, a ferramenta optogenética será expressa exclusivamente em neurônios piramim. A estimulação leve de certas regiões cerebrais é então alcançada através da implantação crônica de fibras ópticas diretamente acima da região de interesse. Os animais podem então ser acoplado a uma fonte de luz adequada e se comportar livremente em quase todos os tipos de testes comportamentais.
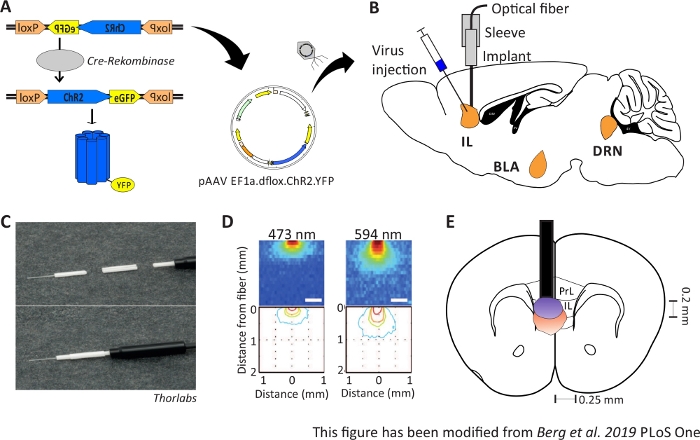
Figura 1: Injeção e implantação. A) Sistema Cre-loxP para ChR2-YFP. A ferramenta optogenética floxada dupla é embalada em um vírus associado ao Adeno (AAV) para injeção no tecido cerebral. B) Visão sagital da injeção do vírus e implantação de uma interface neuronal óptica em/acima da região de IL do mPFC. A injeção e a implantação foram feitas de cima. Todas as regiões de interesse, IL, BLA e DRN, são mostradas. C) Visão detalhada da fibra óptica implantada, manga e fonte de luz. D) Disseminação da estimulação da luz laser azul e vermelha em tecido cerebral de matéria cinzenta a partir de uma fibra de luz de 200 μm (Yizhar et al. 2011). A luz azul se espalha, no máximo, 0,5 mm no tecido, luz vermelha de cerca de 1 mm. Codificação de cores: vermelho 50%, amarelo 10%, verde 5%, azul 1% se a luz atingir essa área. E) Visão coronal da implantação unilateral diretamente acima da IL esquerda com uma fibra óptica de 200 μm. A região de IL tem uma largura de 0,25 mm em cada hemisfério e uma profundidade de 0,2 mm. Lâmpadas azuis e vermelhas são o pensionista de 5% de propagação da luz e são transferidas de Yizhar et al para o tamanho certo. LoxP: lócus de X-over P1; ChR2: Channelrhodopsin; YFP: proteína fluorescente amarela; dflox: floxado duplo; IL: córtex infralimico; BLA: amígdala basolateral; DRN: núcleos de raphe dorsal; PrL: região pré-cíbica. Este número foi modificado a partir de Berg 201948. Clique aqui para ver uma versão maior desta figura.
Abordagens optogenéticas são utilizadas, pois permitem a alta resolução temporal e espacial14 e a modulação específica do tipo celular. Além disso, é possível usar repetidamente o dispositivo implantado sem maior tratamento. Após uma cirurgia estereotática, onde a injeção de um vírus associado ao adeno carregando a ferramenta optogenética e a implantação da fibra óptica é realizada, os camundongos podem se recuperar por duas semanas. Escolhemos um tempo de recuperação de apenas 2 semanas, porque este é tempo suficiente para se recuperar da cirurgia e para o vírus se expressar. Como os experimentos comportamentais são seguidos pela imunohistoquímica, temos que garantir que os ratos não fiquem muito velhos durante o experimento; caso contrário, a qualidade do tecido é diminuída. Eles não mostram prejuízos comportamentais óbvios do implante e se envolvem no comportamento típico da gaiola. É claro que a implantação é acompanhada de uma lesão cirúrgica significativa; portanto, os ratos são monitorados intensamente. Após a cirurgia, os ratos precisam ser alojados sozinhos, pois os ratos alojados em grupo tendem a ferir as feridas e implantes frescos uns dos outros. No entanto, as condições de moradia têm um grande impacto no nível de ansiedade dos camundongos machos, uma vez que os camundongos alojados individuais apresentam níveis de ansiedade mais baixos15 e, em geral, sintomas menos depressivos16.
A manipulação química ou elétrica dos circuitos cerebrais não tem a especificidade do tipo celular elevado da optogenética e tem uma resolução temporal e espacial mais baixa14,,17,,18. Dependendo da questão experimental, a estimulação elétrica ou química pode ter diferentes vantagens. Ao passar terminais de fibra em uma região específica também precisa ser estimulado, a estimulação elétrica é o melhor método. A estimulação química é uma boa escolha para quando os receptores específicos do transmissor em toda uma região devem ser ativados por agonistas. Outra grande vantagem da optogenética em comparação com a estimulação química ou elétrica é que, endógeno, os neurônios não são sensíveis à luz, o que evita a ocorrência de efeitos colaterais19. De fato, altas intensidades de luz podem induzir efeitos de aquecimento8,,20, mas devido a grupos de controle adequados, os efeitos comportamentais devido à manipulação optogenética podem ser eliminados.
A investigação do comportamento dos roedores, especialmente no que diz respeito às doenças psiquiátricas, melhorou muito com a optogenética em animais em movimento livre, pois permite a modulação direta de receptores únicos até populações celulares específicas21 e circuitos22. A possibilidade de medir os efeitos agudos dessas modulações, bem como os efeitos comportamentais de longo prazo após um tempo definido23 ou após a estimulação crônica24,permite uma ampla flexibilidade de projetos experimentais e fornece insights muito detalhados sobre circuitos cerebrais. A estimulação da luz pode ser usada para modular neurônios localizados no local de injeção da ferramenta optogenética. Quando tanto a injeção quanto a implantação abordam a mesma região cerebral, corpos celulares e parte de trás projetando axônios de neurônios de princípios e interneurônios nesta região podem ser direcionados3,,6,,8. No entanto, a fibra de luz também pode ser implantada em uma região diferente da injetada. Neste caso, a estimulação da luz pode modular a liberação do transmissor nos terminais de axônio em áreas de projeção da região injetada25,,26,,27.
No estudo aqui, a optogenética é usada em combinação com experimentos para analisar comportamentos relacionados à ansiedade. As doenças psiquiátricas relacionadas à ansiedade afetam mais de um terço da população mundial28,29,30 e causam uma alta carga econômica31. Os afetados sofrem de um sentimento de excitação, tensão e preocupação seguidos pelo comportamento de evasão32,33. Essas emoções negativas que ocorrem cronicamente, que são principalmente focadas em eventos futuros34,interferem fortemente no cotidiano dos pacientes. Tratamentos comuns como benzodiazepínicos ou inibidores seletivos de recaptação de serotonina (SSRIs) só são bem sucedidos em alguns dos pacientes. Uma grande quantidade de pessoas não responde ao tratamento em todos os35anos, mostrando que o mecanismo subjacente a tais doenças ainda não é totalmente compreendido. O córtex pré-frontal medial (mPFC) é conhecido por desempenhar um papel importante no desenvolvimento e manifestação da ansiedade21,25,27,36,37,38. Especificamente, a superativação do córtex infralímbico (IL) na região do mPFC pode fazer parte dos transtornos relacionados à ansiedade39,40. O experimento de exemplo descrito aqui poderia ajudar a entender como as modulações na região de IL do mPFC influenciam o comportamento de ansiedade. Além disso, o desenvolvimento de novas estratégias terapêuticas para doenças psiquiátricas relacionadas à ansiedade também pode ser potencialmente apoiado.
Camundongos Nex-Cre machos de 2 a 6 meses de idade são usados para expressar ChR2 especificamente em neurônios piramimatais dentro da região IL do mPFC41. Os camundongos Nex-Cre têm um fundo C57Bl/6 e expressam a enzima Cre-recombinase especificamente em neurônios piramifeais. Durante uma cirurgia estereotática, o CHR2-DNA floxado duplo é injetado na região do IL através de vetores virais associados ao Adeno. O implante óptico é colocado diretamente acima da região de interesse(Figura 1B)e o implante é fixado com cimento dental. Os animais de controle recebem uma injeção de tdTomato-DNA floxado duplo na mesma região para imitar a expressão específica das células.
Os animais são alojados em grupo até o dia da cirurgia e depois são alojados para evitar ferimentos de outros camundongos. Os ratos são alojados em racks de gaiola ventilada individual (IVC) em gaiolas TypI-L para ratos alojados. O ciclo claro-escuro segue um ritmo de 12:12 h, a fase de luz começando às 10:00. Todos os experimentos comportamentais são realizados na fase escura, que se assemelha à fase ativa dos roedores. Pelotas de água e alimentos padrão estão disponíveis ad libitum. Após duas semanas de recuperação, o que garante uma expressão suficiente de ChR2 em neurônios piramidários, os camundongos são usados para experimentos comportamentais.
O Campo Aberto (OF) é um labirinto quadrado de 50 cm x 50 cm com paredes de 40 cm de altura. O solo é dividido em 16 praças onde o interior 4 representa o centro. O comportamento medido é: 1) tempo gasto no centro, 2) número de entradas centrais e 3) distância total movida. Durante este experimento, há 4 ensaios totalizando 20 minutos. Nos ensaios 1 e 3, não ocorre estimulação de luz, e nos ensaios 2 e 4, é realizada uma estimulação de 20 Hz com pulso de luz de 5 ms e intensidade de luz de 1 mW de 473 nm(Figura 2A). Nos ensaios posteriores, a habitação na área de testes foi levada em conta, mas o uso de animais de controle injetados em farsas indica como a habitação é expressa.
O Labirinto Barnes é um experimento para aprendizado e memória. É uma plataforma circular de 92 cm de diâmetro e contém 20 orifícios equidistantes ao redor da circunferência. 19 dos buracos estão fechados e sob um buraco uma caixa de escape é apresentada. Por 4 dias consecutivos, os ratos têm 4 testes de treinamento para saber a localização da caixa de escape. No5º dia, a caixa de escape é removida, e os ratos são testados sobre quanto tempo precisam para encontrar o buraco correto. O comportamento medido é: 1) Tempo até que a caixa de escape/orifício correto seja encontrado, 2) Número de visitas e erros de destino e 3) Distância movida até na caixa de escape. A estimulação leve em diferentes grupos é feita durante a aquisição ou consolidação, que ocorrem nos dias de treinamento 1-4, ou durante a recuperação no dia do teste, que é o dia 5(Figura 2D).
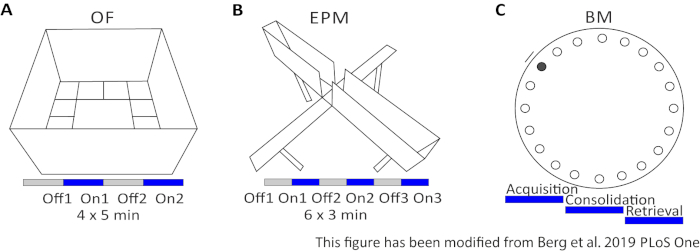
Figura 2: Experimentos comportamentais com protocolos optogenéticos. A) Desenho esquemático do experimento Campo Aberto com o protocolo de estimulação de luz correspondente. C) Desenho esquemático do experimento Elevated-Plus Maze com o protocolo correspondente de estimulação da luz. D) Desenho esquemático do experimento do Labirinto barnes com o protocolo de estimulação de luz correspondente. EPM: Labirinto de elevação; DE: Campo Aberto; BM: Teste do Labirinto barnes. Este número foi modificado a partir de Berg 201948. Clique aqui para ver uma versão maior desta figura.
Para a estimulação optogenética, a intensidade e a frequência da luz devem ser adaptadas à ferramenta optogenética e ao tipo neuronal que está sob investigação. A menor intensidade de luz possível deve ser usada para evitar danos ao tecido, pois vários estudos têm demonstrado que há possíveis efeitos de aquecimento devido à forte intensidade da luz8,,20. Para ChR2, uma estimulação de 20 Hz com pulso de luz de 5 ms é comumente usada2. Como o ChR2 é bastante sensível à luz, a intensidade da luz de 1 mW é suficiente. O protocolo de estimulação da luz alterna entre a luz desligada e os ensaios para medir diretamente as mudanças comportamentais. As condições externas do quarto para experimentos comportamentais devem permanecer estáveis para todo o grupo de animais. Condições importantes a serem consideradas são o ruído (tenha em mente que os próprios dispositivos podem fazer barulho), o cheiro (sempre limpe as configurações comportamentais com etanol), a intensidade da luz e o experimentador. O experimentador deve ser sempre a mesma pessoa. Além disso, a hora do dia dos experimentos deve ser a mesma para todos os animais em um grupo, poucas horas após o início da fase escura na instalação é preferível.
O objetivo deste experimento é aumentar a proporção excitação/inibição (E/I) na região de IL através da forte ativação de neurônios piramimais excitatórios. Uma relação E/I aprimorada nesta região especial do córtex é conhecida por aumentar os níveis de ansiedade em camundongos40,42,43,44.
Protocolo
Procedimentos envolvendo matérias animais foram aprovados pela instalação institucional de pesquisa animal e pelo "Senatorin für Wissenschaft, Gesundheit und Verbraucherschutz" na Universidade de Bremen (#146)
1. Preparação do implante óptico9 (Figura 1C)
- Coloque um lado plano de ferrule de cerâmica em um torno de banco.
- Retire a camada de uma fibra de vidro de 200 μm de diâmetro com uma ferramenta de descascamento de fibras e corte peças de 2-3 cm de comprimento com um escriba de fibra cerâmica.
- Coloque o pedaço de fibra de vidro na ferrula de cerâmica com uma saliência uniforme em ambos os lados.
- Coloque uma gota de supercola no lado plano da ferrula cerâmica com uma cânula de injeção.
NOTA: O protocolo pode ser pausado aqui. - Tire o pré-implante do torno do banco e no lado redondo da ferrule cerâmica, corte a fibra de vidro o mais curto possível com o escriba de fibra cerâmica.
- Coloque o pré-implante em um disco de polimento de ferrule e polir o lado redondo em 4 diferentes papéis de polimento, desenhando oito 20 vezes por papel (30 μm de grão, 6 μm de grão, 1 μm de grão e, finalmente, 0,02 μm de grão).
- Tire o pré-implante do disco de polimento da ferrule e corte a fibra de vidro no lado plano da ferrule cerâmica até o comprimento necessário para a implantação. Comece a medir o comprimento atrás da supercola saliente.
- Para uma superfície de corte uniforme basta arranhar a fibra de vidro 2-3 vezes e depois quebrá-la.
NOTA: Use o atlas cerebral do rato de Paxinos e Franklin45 para calcular o comprimento do implante. O implante deve terminar diretamente acima da região de interesse e a espessura do crânio deve ser incluída no cálculo do comprimento. Para estimular a região do IL, a fibra de vidro tem um comprimento de 1,8 mm(Figura 3).
- Para uma superfície de corte uniforme basta arranhar a fibra de vidro 2-3 vezes e depois quebrá-la.
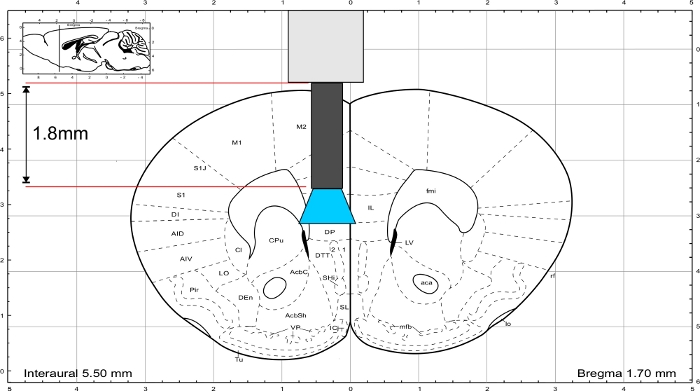
Figura 3: Atlas cerebral do rato (Paxinos e Franklin) com comprimento representativo do implante para chegar à região de IL. Clique aqui para ver uma versão maior desta figura.
- Desinfete o implante acabado por 10 minutos no etanol e deixe-o secar antes da implantação.
2. Injeção e implantação
- Transporte um único rato para a sala cirúrgica e pese-o. Aplique anestesia com uma injeção intraperitoneal (i.p.) de cetamina/xylazina (Cetamina 0,12 mg/g, Xylazine 0,01 mg/g).
- Conserte o mouse com a mão esquerda e gire-o de costas com a cabeça baixa.
- Direja o quadrante inferior esquerdo do abdômen com a seringa e entre na cânula de injeção 1 cm sob a pele.
- Injete anestesia em um movimento lento e constante na cavidade abdominal.
- Coloque o rato de volta em sua gaiola e espere até chegar a um estado profundo de anestesia.
NOTA: A profundidade da anestesia pode ser determinada pela ausência de reflexos piscando e entre os dedos.
- Coloque o mouse em uma placa de aquecimento e fixe a cabeça em uma moldura estereotática. Conserte o nariz e os dentes na frente, e as orelhas de ambos os lados.
NOTA: A cabeça deve estar reto no eixo esquerda-direita e rostral-caudal para garantir as coordenadas estereotáticas corretas. - Aplique analgesia com 2 mg/kg Carprofen subcutâneamente na parte de trás do mouse e aplique pomada opaca nos dois olhos para protegê-los da secagem.
- Umedeça o cabelo no couro cabeludo com uma toalha de papel molhada e depois corte-o usando uma tesoura. Certifique-se de remover todos os cabelos soltos com a toalha de papel molhado. Para desinfetar o couro cabeludo, use uma vara de algodão e tome 0,5 mL de uma tintura contendo iodo (Betaisodona 100 mg/mL Povidon iodo e 11 mg/mL iodo) e deixe-o seco.
NOTA: Em vez de uma tesoura, também pode ser usado um cortador elétrico para depilação adequada. - Levante o couro cabeludo acima da região de interesse com uma pinça e corte 1 cm ao longo da linha média. Use duas pinças para deixar a pele de lado para expor o crânio. Certifique-se também de remover a pele fina acima do crânio e deixar o crânio exposto secar.
- Endureça o crânio para implantação posterior.
- Aplique uma gota de 2 mm x 2 mm de ácido fosfórico (37%) do kit adesivo (por exemplo, Optibond) no crânio, distribua-o com a ponta da seringa e deixe-o fazer efeito por 15 s.
- Remova todo o ácido com uma vara de algodão e enxágue o crânio com 1 mL de 0,9% De LCa duas vezes.
- Seque o crânio com uma vara de algodão e ar comprimido.
Atenção: O ácido fosfórico é perigoso e deve ser removido completamente para evitar danos teciduais.
- Calcule o Fator F para coordenadas individuais.
- Coloque uma cânula de vidro na estrutura estereotática e localize-a diretamente acima do bregma.
- Zero o sistema de coordenadas e mova a cânula de vidro para lambda.
- Calcule o fator F46 com a seguinte fórmula:
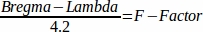
- Multiplique o Fator F com as coordenadas do atlas cerebral do rato para ajustá-los ao mouse individual.
- Faça um buraco no crânio para injeção.
- Use as coordenadas ajustadas para encontrar a localização do crânio diretamente acima da estrutura de interesse e marcá-lo usando a ponta de uma cânula de injeção, arranhando-a acima da superfície óssea.
- Use a cânula de injeção para fazer um furo no crânio no local marcado girando a cânula no local. Se o sangue vazar do orifício da rebarba, enxágue com 1 mL de 0,9% NaCl e seque o crânio depois.
- Leve a solução de vírus para a cânula de vidro.
- Coloque uma gota de 100 μL de 0,9% NaCl sobre o crânio e um pedaço de parafilme (1 cm x 1 cm) em cima, lado estéril para cima.
- Coloque 1-2 μL de solução de vírus sobre o parafilme e abaixe a ponta da cânula de vidro nele.
- Conecte a cânula de vidro a uma seringa, aplique pressão negativa mínima e espere até que a solução do vírus seja retomada pela cânula (em segundos).
NOTA: É importante parar a aplicação de pressão negativa, antes que o ar seja captado na cânula. Portanto, sempre haverá um pequeno remanescente da solução do vírus.
- Injete a solução do vírus na região de interesse.
- Coloque a cânula de vidro preenchida pelo vírus acima do orifício da rebarba.
- Abaixe lentamente a cânula no orifício da rebarba e zero a coordenada z quando a ponta da cânula estiver no nível do crânio.
- Abaixe a cânula cuidadosamente para a posição mais baixa do local da injeção.
- Concentre o binóculo no menisco da solução de vírus dentro da cânula.
- Aplique uma pequena quantidade de pressão positiva com a seringa até que o menisco seja reduzido marginalmente.
- Deixe o vírus se espalhar por 2-3 minutos antes de mover a cânula de vidro para cima para a próxima posição.
- Aplique a solução de vírus a cada 200-300 μm em toda a região de interesse.
- Retire a cânula de vidro muito lentamente e descarte-a após a injeção final.
- Prepare o crânio para implantação com o kit de adesão (por exemplo, OptibondTMFL).
- Seque o crânio com ar comprimido.
- Aplique 5 μL de primer (por exemplo, Optibond, 1-30% (Etanol, ácido sílico, glicerinfosphatdimethacrylat, 2-(2-(Methacryloyloxy)ethoxycarbonyl)benzoesäure, 2-Hydroxyethylmethacrylat)) com a vara correspondente e deixe-o secar por 15 s.
- Aplique 5 μL de título (por exemplo, Optibond, 15-20% 2-Hydroxyethylmethacrylat + 1-2% Alkalihexafluorosilikat(Na)) com a mesma vara e cure-o para 20 s com luz UV (420-480 nm).
NOTA: É essencial que o crânio esteja seco e que o primer e a ligação sejam aplicados em uma camada muito fina.
Atenção: Não olhe diretamente para a luz UV, pois a luz UV pode prejudicar os olhos.
- Posicione o implante diretamente acima da região de interesse.
- Fixar o implante no suporte correspondente.
- Seque o crânio com ar comprimido.
- Posicione a ponta da fibra de vidro diretamente acima do orifício da rebarba e abaixe-a cuidadosamente.
- Pare de baixar o implante quando a lâmpada restante de supercola tocar o crânio. Não exerça pressão no crânio!
NOTA: Se a injeção e a implantação estiverem sendo feitas em diferentes regiões (por exemplo, raphe dorsal e hipocampo),perfurar todos os orifícios necessários após a aplicação do ácido fosfórico, mas antes da adesão de 2 componentes, siga as instruções como descrito anteriormente (etapa 2.8-2.14).
- Conserte o implante.
- Verifique se o crânio ainda está completamente seco.
- Aplique cimento dentário fluido (por exemplo, flo direto gradia) ao redor do implante e na área circundante e cure para 20 s com luz UV (420-480 nm).
NOTA: A quantidade de cimento dental depende da área livre do crânio. O crânio inteiro deve ser coberto por cimento dental. - Aplique mais duas camadas de cimento e encha completamente a área livre e seca do crânio. Cure cada camada com luz UV (420-480 nm).
- Termine a cirurgia.
- Aplique 0,5 g de pomada de iodo (Betaisodona 100 mg/mL de iodo povidone e 11 mg/mL de iodo) em toda a ferida.
- Injete 0,1 mL de glicose dissolvida em 0,9% NaCl subcutâneamente no pescoço para recuperação rápida.
- Solte a fixação do nariz e da orelha, leve o mouse para uma gaiola fresca e coloque-o sob uma lâmpada de aquecimento para evitar a perda de calor corporal.
- Quando o rato acordar, traga-o de volta para a instalação.
- Verifique seu estado de saúde pelo menos uma vez por dia. Tome as medidas apropriadas se os ratos apresentarem alguma constituição ruim (por exemplo, garantir analgesia pós-operatória com Carprofen até 3 dias se os ratos apresentarem algum sinal de dor).
NOTA: Após duas semanas de recuperação, os ratos podem ser usados para experimentos comportamentais.
3. Criação de um novo experimento (exemplo de estimulação chr2 e campo aberto)
- Emissores
- Programe o pulser (por exemplo, Prizmatix) para estimulação de luz.
- Abra o software e selecione a porta USB COM na a próxima.
- Escolha selecionar o modo de operação (3) | Execute a sequência de pulso após o gatilho HIGH e pare quando LOW permitir que um software externo controle a fonte de luz.
- Programe o protocolo de luz. Para uma estimulação de 20 Hz com pulso de luz de 5 ms: escolha TI = 23 ms, P1D = 5 ms, P1I = 22 ms e P2D = 0 ms.
- Pressione sequência de início. Este status permanecerá até que os experimentos sejam concluídos.
NOTA: O software pulser (Prizmatix Pulser) deve ser lançado antes do software de rastreamento de vídeo; caso contrário, o software de rastreamento de vídeo não será capaz de reconhecer o dispositivo.
- Software de rastreamento de vídeo (por exemplo, Ethovision XT)
- Crie um novo experimento a partir de um modelo pré-definido.
- Abra o software, vá para Arquivo,escolha Novo do Modelo. Selecione Aplicar um modelo pré-definido.
- Escolha o rastreamento ao vivo e selecione a câmera pressionando a Fonte e confirme o Basler GenICam conectado.
NOTA: A imagem ao vivo da câmera será agora exibida na janela no canto superior direito. - Pressione em seguida e escolha o animal que deve ser gravado(Roedores, Mouse).
- Pressione o Next e selecione o modelo de arena Open Field, quadrado. Selecione o modelo de página Centro, Borda, Cantos e confirme com o Next.
- Confirme 1 assunto que deve ser rastreado com o Next.
- Selecione o ponto central, o ponto do nariz e a base traseira e confirme a cor animal em comparação com o fundo como mais escuro com o Next.
- Confirme a taxa de amostra recomendada de 12,5 com o Next e termine a etapa.
- Nomeie o experimento apropriado e escolha um local para salvar.
- Defina as configurações experimentais.
- Vá para Configurações de Configuração e Configurações Experimentais. Escolha a detecção de ponto central, ponto de nariz e base traseira como recursos rastreados.
- Selecione O uso do hardware de controle de tentativa e vá para configurações.
- Selecione a caixa USB-IO do Noldus e confirme com Ok.
- Escolha hardware personalizado como tipo de dispositivo na porta TTL, que foi conectada ao dispositivo pulsar, e confirme com Ok.
- Defina as configurações da arena.
- Vá para Configurações da Arena e selecione Configurações da Arena 1.
NOTA: A câmera agora abrirá automaticamente uma imagem de fundo. - Confirme a imagem com Grab.
- Adapte as zonas pré-definidas à arena real alterando seu tamanho. Use a seta e os dois símbolos à sua direita. Se algumas zonas forem desnecessárias, exclua-as.
- Pressione 1. Desenhe escala para calibrar e puxe uma linha de um canto do labirinto para o outro. Digite o comprimento da distância real em cm.
- Repita isso para o outro eixo.
- Vá para Configurações da Arena e selecione Configurações da Arena 1.
- Teste se a estimulação da luz está funcionando.
- Vá para Arena - Mapeamento de hardware e selecione Teste na barra cinza.
- Selecione saída de comando Test 1 Teste de alta e pressão .
NOTA: Deve haver luz emitindo a partir do final da fibra óptica. Ao selecionar a saída 1 baixa e testar,a estimulação deve parar.
- Defina as configurações de controle de ensaio para 20 minutos de experimento. Definir testes Off1, On1, Off2 e On2 para cada um ter 5 minutos de duração.
- Vá para a configuração de controle de tentativa e selecione a duração da faixa de 30 minutos.
- Prepare a regra principal ajustando a Condição: Tempo para 20 minutos selecionando configurações e altere de 30 a 20 minutos. Confirme com Ok.
NOTA: A condição para a pista de largada deve ser quando o assunto estiver na arena por 2 segundos. Dessa forma, o sistema começará automaticamente a rastrear quando o mouse estiver na arena. - Crie uma sub-regra para a estimulação da luz: Vá para estruturas, mais e selecione Sub-regra.
- Dê-lhe um nome como protocolo de estimulação de luz.
- Coloque-o abaixo da regra principal e espalhe as duas caixas selecionando a área azul com o cursor do mouse.
- Vá para Condições, Tempo e dê-lhe um nome como luz em 1.
- Ajustar A condição é atendida após 5 minutos. Confirme com Ok.
- Coloque a caixa diretamente atrás da caixa Rule Begin da sub-regra puxando-a para a linha preta.
- Vá para ação | Hardware personalizado e nomeie-o: luz ON 1.
- Selecione Ação para executar como Output 1 High e confirme com Ok.
- Coloque a caixa diretamente atrás da caixa Condição.
NOTA: Agora, após 5 minutos do experimento, a estimulação da luz deve começar. - Repita as etapas para definir a condição de tempo Após 5 minutos e a saída de ação 1 Baixa para parar a estimulação da luz após mais 5 minutos.
- Repita novamente os passos para programar outra luz Off e light On trial.
- Ir para Estruturas | Referência de sub-regra e verificar se a referência pertence à sub-regra correta.
- Escolha condições de partida como Sem demora e condições de parada como Executar uma vez por condição de início. Confirme com Ok.
- Coloque a caixa de referência entre a caixa de ação 1 e a caixa de condição 2 da regra principal e desenhe uma linha de Ação - faixa inicial para a Referência.
NOTA: Agora, a regra principal inicia diretamente a sub-regra após iniciar a faixa.
- Defina as configurações de detecção para mostrar ao sistema o que ele deve rastrear.
- Vá para configurações de detecção e selecione Configurações de detecção 1.
- Coloque um mouse de teste na arena e selecione Configuração Automatizada.
- Escolha Roedor como tipo animal e use o curser de rato para desenhar uma caixa ao redor do mouse na arena. Confirmar os resultados OK? pergunta com Yes.
- Defina a lista de testes para todos os animais experimentais que devem ser rastreados.
- Vá para a Lista de Testes e planeje todos os animais para gravar hoje: Selecione adicionar ensaios e selecione um número.
- Selecione todas as condições definidas antes para cada mouse.
- Nomeie o Animal-ID e o Tratamento corretamente para simplificar posteriormente a análise.
NOTA: O Animal-ID é irrelevante para o sistema e só é importante para análise posterior de dados pelo experimentador. O grupo de agrupamento em Tratamento e Controle é importante para que o sistema saiba como agrupar e como comparar todas as faixas em etapas posteriores.
- Vá para a Aquisição e comece com o experimento.
- Crie um novo experimento a partir de um modelo pré-definido.
4. Experimento de campo aberto (ansiedade)
- Leve o rato experimental para a sala de comportamento logo antes do experimento para garantir um nível adequado de ansiedade.
NOTA: Os experimentos comportamentais devem ser realizados durante a fase escura quando os ratos estão acordados, e sempre no mesmo espaço de tempo para garantir a comparabilidade. - Acople o mouse através de uma manga à fonte de luz pressionando-o suavemente na grade da gaiola.
- Coloque-o em uma gaiola de espera com lixo fresco por 10 minutos para se aclimatar ao cabo de luz.
- Inicie a aquisição pressionando o botão Iniciar no software de rastreamento de vídeo (por exemplo, Ethovision XT).
- Transfira o mouse da gaiola de espera para o canto superior esquerdo do campo aberto. Remova o braço dentro de 2 segundos para evitar rastrear um braço em vez do mouse.
- Deixe o campo visual do mouse durante o experimento e mantenha a calma.
- Após 20 minutos, quando o experimento estiver concluído, remova o mouse do labirinto, desconecte o cabo de luz e coloque-o de volta em sua gaiola doméstica.
- Traga o rato de volta para a instalação.
5. Barnes Maze (aprendizado)
- Traga todos os ratos experimentais para a sala de comportamento cerca de 1 hora antes do experimento.
- Prepare o Labirinto Barnes fechando todos os buracos, exceto um, sob o qual uma caixa de fuga é colocada. Coloque uma parede de caixa no meio da plataforma, que é a área de partida para o mouse.
- Conecte um mouse à fonte de luz (manga em um cabo de luz) em ambos os implantes.
- Coloque o rato diretamente no meio do Labirinto Barnes na parede da caixa, o que impede o rato de correr por aí antes do experimento começar.
- Pressione Iniciar no software de rastreamento de vídeo (por exemplo, Ethovision XT) e remova a caixa.
NOTA: O software rastreia o mouse até que o orifício correto seja atingido, mas esteja preparado para interromper o teste manualmente apenas no caso de o software não reconhecer a transição do furo. - Retire o mouse do labirinto e remova a conexão com o cabo de luz.
NOTA: Se este for um dia de treinamento com vários ensaios por mouse, deixe o mouse na sala de espera ao lado da sala de comportamento até que a próxima sessão de treinamento comece. Se este foi o dia de teste com apenas um teste por mouse, traga o mouse de volta para a instalação.
6. Análise de dados (exemplo de dados de campo aberto com 4 ensaios distinguíveis)
- Software de rastreamento de vídeo (por exemplo, Ethovision XT)
- Defina os grupos experimentais e ensaios no perfil de dados.
- Vá para Perfis de Dados à esquerda e escolha Tratado vs. Controle.
- Vá para Nesting na nova janela no meio-esquerda e selecione Estado de controle de teste.
- Escolha o intervalo de estado a partir do Elemento Ação: inicie a faixa para a ação do elemento: a luz vai ON 1.
- Coloque a caixa de aninhamento entre o tratamento da caixa filtro e a caixa de resultado correspondente.
NOTA: Este intervalo definido é Off1, que descreve os primeiros 2,5 minutos do experimento onde não há estimulação de luz. - Repita os passos para intervalos On1 (do elemento Ação: luz sobe 1 para o elemento Ação: luz se apaga 1),Off2 (do elemento Ação: luz se apaga 1 para o elemento luz acende 2) e On2 (do elemento Ação: luz sobe 2 para o elemento Ação: faixa de parada).
- Repita os 4 intervalos para o grupo do filtro de controle.
NOTA: Cada caixa de aninhamento precisa de sua própria caixa de resultado com os nomes Off1, On1, Off2, On2. Agora, tanto o grupo de tratamento quanto o controle estão divididos em 4 diferentes ensaios de estimulação de luz que são analisados separadamente.
- Defina os parâmetros a serem analisados no perfil de análise.
- Vá para Perfis de Análise à esquerda e selecione Em zonas.
- Selecione a variável dependente na zona e selecione Centro como zona.
- Clique duas vezes no Centro e escolha qualquer um dos pontos selecionados e selecione apenas no centro.
- Antes de sair da janela vá para Estatísticas de Avaliação e selecione Frequência, Duração Cumulativa e Latência para primeiro.
- Adicione a distânciavariável dependente movida .
NOTA: Nas Estatísticas do Grupo,escolha se deve usar o erro padrão ou o desvio padrão como erro. Com esse perfil, estão disponíveis os dados do Tempo gasto no centro, entradas do Centro e Total de distâncias movidas.
- Extrair dados
- Vá para Resultados e selecione Estatísticas e Gráficos.
- Pressione Calcular para ver os dados analisados.
NOTA: As estatísticas de ensaio dão informações sobre cada rato e estatística de grupo que analisa a média e o erro de ambos os grupos, divididos em 4 ensaios com o gráfico de barras correspondente. - Pressione os dados de exportação e selecione as estatísticas de teste e o local a ser salvo.
NOTA: Os dados exportados são salvos como um arquivo Excel e com valores individuais para cada mouse. Neste arquivo Excel, o Animal-ID ajuda a identificar os ratos. - Vá para a Visualização do Mapa de Calor e pressione o Mapa de Calor do Plotmaps.
- Selecione Testes à direita para ver mapas de calor individuais para cada mouse e ensaio.
- Faça um clique com o botão direito do mouse e exporte mapas de calor como imagens.
- Defina os grupos experimentais e ensaios no perfil de dados.
- Plotagem
- Abra o arquivo de planilha no computador e calcule os meios e erros padrão (SEM) para todas as 4 tentativas em cada condição e grupo medidos.
- Gerar gráficos em um programa de estatísticas (por exemplo, Gráfico Sigma).
- Copie os meios e o SEM na ordem correta do arquivo de planilha para o Sigma Plot. As linhas têm que conter os dados para Off1, On1 etc. e as colunas contêm ensaio, média e SEM como cabeças.
- Selecione as três colunas e vá para Criar gráfico.
- Selecione a caixa Barra e escolha barras não agrupadas com erro (linha superior, terceira caixa).
- Confirme com o Finish para abrir uma nova página de gráfico.
- Rotule todo o gráfico e vá para Home,selecione a caixa Gráfica à esquerda e pressione Exportar. Selecione uma pasta de destino e escolha MetaFile (*.wmf) como formato.
NOTA: O formato .wmf pode ser processado mais tarde em um software gráfico como CorelDraw.
- Calcular estatísticas para dados obtidos.
- Copie dados brutos da planilha (Off1, On1 etc.) em colunas únicas do Sigma Plot.
- Marque as colunas para comparar e ir para Análise,escolha t-test e pressione Run.
- Confirme o formato de dados Raw com Next e execute o teste com Acabamento.
Resultados
O objetivo deste protocolo é medir mudanças no comportamento de camundongos geneticamente modificados durante um experimento optogenético. A manipulação optogenética é feita por injeção de um vetor viral associado a adeno. A estimulação leve em camundongos em movimento livre é possível através da implantação de uma fibra de luz diretamente acima da região de interesse.
Na Figura 4,são apresentados os resultados de um experimento optogenético. Uma forte ativação de neurônios piramimatais excitatórios na região do IL via ChR2 aumentou o comportamento relacionado à ansiedade no Campo Aberto. ChR2 foi injetado na região IL do mPFC em camundongos Nex-Cre para expressão em neurônios piramimatais(Figura 4A). Durante dois testes de ansiedade, o Campo Aberto (Figura 4B,C) e o teste de Alimentação Suprimida da Novidade(Figura 4F,G), ChR2 é estimulado com luz azul e ativa neurônios piramimatais. Como controle, outro grupo de camundongos recebeu uma injeção do fluorohore tdTomato em vez de ChR2 (Figura 4D,G). Em tal experimento, a ansiedade é definida como evitar a área central mais brilhante. Os ratos mostram uma evitação intrínseca de áreas abertas porque estão ansiosos por predadores.
No experimento Open Field, mostrado na Figura 4B,os ratos executaram 4 ensaios de 5 minutos cada. Nos ensaios 1 e 3 não ocorreu estimulação de luz (Off1,2) e nos ensaios 2 e 4, foi realizada estimulação de luz azul com 20 Hz (pulso de luz de 5 ms) e intensidade de 1 mW (On1,2). Os heatmaps mostram que, no grupo experimental, a duração central difere entre os ensaios Off e On. Durante a estimulação da luz, os ratos ficam preferencialmente na zona de fronteira. Os animais de controle também preferem a fronteira, mas não mudam seu comportamento em vez de estimulação de luz. Na Figura 4C,as principais medidas comportamentais durante o experimento open field são mostradas para o grupo experimental. Se os dados passaram no teste Shapiro-Wilk para normalidade, as estatísticas foram feitas com um teste t independente de duas caudas. Se o teste de normalidade falhou, o teste Mann-Whitney-Rank Sum foi usado como alternativa não paramétrica. Para esses tipos de experimentos, foi escolhida uma comparação dentro do grupo para investigar se a estimulação da luz pode mudar diretamente o comportamento de ansiedade ao longo do tempo, independente da ansiedade da linha de base dos animais experimentais e de controle. A duração do centro diminuiu significativamente durante ambos os ensaios de estimulação da luz, indicando aumento dos níveis de ansiedade. A distância total movida não foi alterada, mostrando que o comportamento locomotor não foi afetado. O número de entradas do centro aumentou, embora não significativamente. Na Figura 4D,os dados do grupo controle são mostrados. Os animais de controle não apresentaram alterações comportamentais entre ensaios Off e On em nenhum dos parâmetros analisados, mostrando que a estimulação ou implantação da luz não causaram os efeitos observados. Em suma, este teste mostra aumento da ansiedade durante a estimulação leve de neurônios piramimatais il via ChR2.
Na Figura 5,os dados de um experimento optogenético mal sucedido são mostrados para o Labirinto Elevated-Plus. Durante o experimento Elevated-Plus Maze, que é apresentado na Figura 5A,os ratos completaram 6 ensaios de 3 minutos cada. Nos ensaios 1, 3 e 5 não foi realizada estimulação de luz (Off1, Off2, Off3) e nos ensaios 2, 4 e 6, estimulação de luz azul com 20 Hz (pulso de luz de 5 ms) e intensidade de 1 mW (On1, On2, On3). Nestes resultados exemplares, o comprimento do protocolo optogenético e a construção do labirinto em si não foram adequados para a linha de camundongos transgênicos. Na Figura 5B,pode-se ver que vários ratos escorregaram do labirinto com suas patas traseiras ou até mesmo caíram. Quando isso aconteceu, os ratos tiveram uma segunda chance de realizar o EPM um dia depois. Se caíssem novamente, foram excluídos da análise. Quando os ratos escorregaram várias vezes, mas conseguiram ficar no labirinto, os dados foram analisados normalmente. No entanto, os dados devem ser interpretados com muito cuidado e controlar os animais ganha maior importância. Os ratos Nex-Cre tiveram dificuldades motoras para ficar em braços abertos estreitos. Para evitar isso, pequenas paredes, com uma altura de 1 cm, teriam ajudado a segurar as patas traseiras nos braços do labirinto. Tanto os mapas de calor quanto os gráficos mostram que os ratos experimentais, bem como os de controle, começaram a evitar o braços abertos do ensaio 2 (On1) on(Figura 5C-E). O tempo em braços abertos é significativamente reduzido para ambos os grupos, assim como as entradas de braço aberto. A análise do grupo experimental obteve apenas dados implicando um grande efeito ansiogênico da estimulação da luz, uma vez que o tempo no braço aberto e as entradas do braço aberto são significativamente diminuídos durante o ensaio On1. No entanto, ao comparar esses dados com o grupo controle, que mostram o mesmo comportamento, fica claro que o comportamento observado não é mediado pela estimulação optogenética, mas pela evasão dos braços abertos em geral devido à habitação ao labirinto. Esses dados ressaltam a importância de um grupo de controle adequado para distinguir entre efeitos comportamentais mediados pela estimulação optogenética e possível adaptação comportamental. Além disso, esses dados esclarecem a importância de adaptar adequadamente uma configuração experimental para se adequar à linha de mousse específica e à questão experimental.
Para validar e fortalecer os dados comportamentais coletados, os cérebros dos camundongos são removidos após o último experimento para controlar a injeção e implantação corretas(Figura 6). Cérebros são fixados em 4% de paraformaldeído e removidos do crânio. Cérebros são desidratados em 30% de sacarose por 1-2 dias e crioslicados depois. As fatias cerebrais coronal de 40 μm de espessura são lavadas e montadas em lâminas objetivas superfrost com um meio de montagem contendo DAPI, que mancha núcleos celulares. Isso permite a identificação de áreas alvo nas fatias coronais. A fluorescência da tag YFP ou do próprio tdTomato indica a localização da injeção do vírus. Na Figura 6B são apresentados os locais de injeção exemplar de ChR2-YFP à esquerda (amarelo) e tdTomato à direita (vermelho). Com a ajuda de um modelo, adaptado do atlas cerebral do rato Paxinos e Franklin45, a região do IL pode ser identificada. Em ambos os slides, a ferramenta optogenética é expressa na região de IL, mas também em regiões cerebrais adjacentes. Para uma interpretação adequada, a disseminação da luz azul no tecido cerebral é consultada8 (Figura 1D,E). Observa-se que a luz azul atingirá a região DP abaixo da IL com apenas menos de 5% da intensidade inicial de luz de 1 mW na ponta de fibra (linha azul na Figura 1D)8. Além disso, uma pequena quantidade de luz pode ir para cima para a região da PrL devido à dispersão de47. Consequentemente, pode-se dizer que a região do IL é mais fortemente iluminada, porém regiões adjacentes como a DP e a região da PrL também podem ser ligeiramente estimuladas. Portanto, a estimulação específica das células IL não é garantida e a análise imunohistoquímica das regiões adjacentes deve ser realizada, para ver se a atividade das células prl e DP é modulada via luz. Na Figura 6C,outro controle importante é mostrado: a especificidade da linha de mouse Nex-Cre. Através da coloração de anticorpos contra os dois tipos de células na região do IL, neurônios princípio glutamatergic e interneurônios GABAérgicos, pode-se ver que a expressão ChR2-YFP só ocorre em neurônios glutamatericos e não com os gabaérgicos.
Em suma, nossos experimentos mostram que, com a manipulação optogenética durante os testes comportamentais, mudanças no comportamento relacionado à ansiedade poderiam ser observadas. Ao usar mais de um teste para o mesmo comportamento, uma conclusão confiável pode ser tirada. Além disso, a análise imunohistoquímica confirma os dados obtidos. Nossos experimentos sugerem que a ativação específica de neurônios piramidários no córtex infralímbico aumentou o comportamento relacionado à ansiedade em certos ensaios.
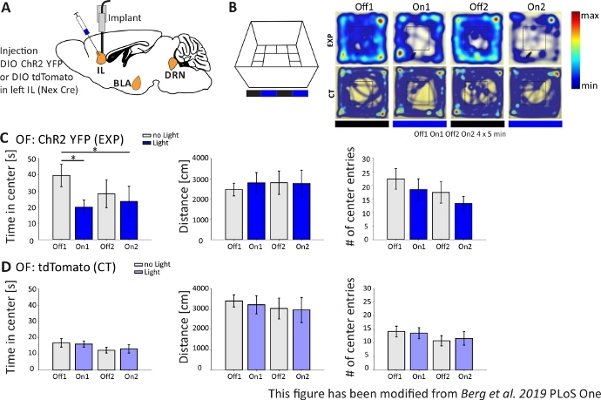
Figura 4: Ativação optogenética de neurônios piramiheiros il aumenta o comportamento de ansiedade. Estimulação de luz durante experimentos: 473 nm, 1 mW, estimulação de 20 Hz. A) Desenho esquemático do local de injeção e implantação para ChR2-YFP ou tdTomato no IL. Durante o experimento, os neurônios piramihados na região il do mPFC são ativados por ChR2. Fatias cerebrais saggitais adaptadas do atlas cerebral do rato Paxinos e Franklin, saggital: lateral o,6. B) Labirinto de campo aberto com protocolo de estimulação de luz (20 min com 4x5 min alternando Off e On trials; esquerda) e mapas de calor de camundongos exemplares injetados chr2(EXP) e tdTomato-injected (CT) em todos os 4 ensaios do experimento (à direita). Os animais EXP passam menos tempo no centro do OF quando estimulados com luz laser azul. Para os animais de tomografia, o tempo gasto no centro não difere entre os ensaios Light Off e On. C) Dados do grupo para animais EXP no OF, n=11. Os camundongos passam significativamente menos tempo no centro do OF quando estimulados com luz azul (Off1 39.49±6.9 s, On1 19.87±4.47 s, Off2 28.13±8.55 s, On2 23.42±9.32 s, Off1:On1, t-test, p = 0,033, *; Off1:On2, MWRS, p=0,049, *). A distância movida não é afetada (Off1 2703.09±292,65 cm, On1 3113.4±491,15 cm, Off2 3331,86 ±482,62 cm, On2 3082,17±658,61 cm). # de entradas centrais diminuem com o tempo, mas não mostram diferenças significativas (Off 1 22.36±3.78, On1 18.45±3.95, Off2 17.36±1.99, On2 13.27±2.64). D) Dados do grupo para animais de tomografia no OF, n=15. Tempo que os ratos passam no centro do OF, a distância movida, # de entradas centrais não muda entre os ensaios light On and Off (Time in center Off116.73±2.65 s, On1 16.02±1.89 s, Off2 12.02±1.76 s, On2 13.04±2.58 s; Distância Off1 3399,69±296,77 cm, On1 3210,6±446,9 cm, Off2 3030,28±513,83 cm, On2 2955±617,7 cm; # das entradas centrais Off1 14.2±1.98, On1 13.6±2.02, Off2 10.8±1.88, On2 11.67±2.5). Os camundongos ct apresentam ansiedade de linha de base significativamente maior (Off1 EXP:CT, MWRS, p=0,005, **). Os valores são médios±S.E.M. * indicam diferenças significativas (p≤0,05), ** indicam diferenças significativas (p≤0,01). t-test sempre duas caudas, MWRS: Teste Mann-Whitney Rank Sum; IL: córtex infralimico; BLA: amígdala basolateral; DRN: núcleos de raphe dorsal; DE: Campo Aberto; CT: controlar animais; EXP: animal experimental; L: luz. Este número foi modificado a partir de Berg et al. 2019, PLoS One43 e de Berg 201948. Clique aqui para ver uma versão maior desta figura.
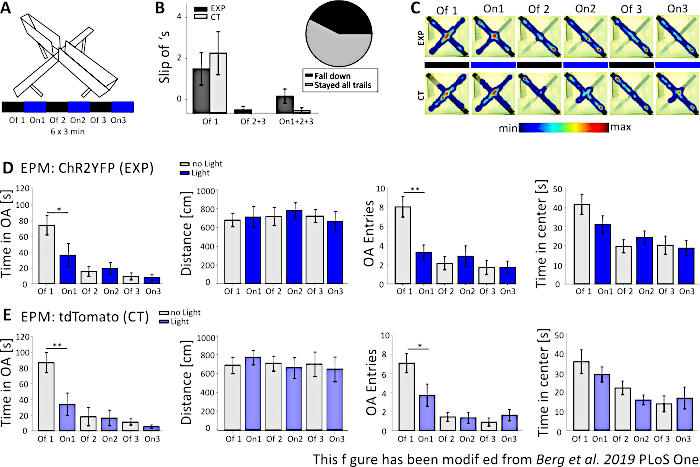
Figura 5: O experimento EPM falhou em mostrar efeitos comportamentais em camundongos Nex-Cre. Estimulação de luz durante experimentos: 473 nm, 1 mW, estimulação de 20 Hz. A) Labirinto de Elevação-Plus com protocolo de estimulação de luz (18 min, 6x3 min, alternando off e on trials). B) Os dados do grupo dos camundongos que "escorregam" estão incluídos nos dados, total n=23. Os ratos Nex-Cre tinham a tendência de escorregar do braço aberto com as patas traseiras, independente do grupo experimental (esquerda). Apenas ratos que permaneceram no labirinto para todos os 6 ensaios foram considerados em análises posteriores. Os deslizes na primeira fase Off1 são motivo para evitar os braços abertos (Off1 EXP 1.63±0.6, CT 2.2±0.79, Off2+3 EXP 0.125±0.125, CT 0±0, On1+2+3 EXP 0.625±0.26, CT 0.1±0.1). Gráfico de tortas (à direita) mostra ratos caindo do labirinto durante os 18 minutos com 42,42%. Apenas 57,57% terminaram o experimento. C) Mapas de calor de exp exemplar e camundongos CT em todos os 6 ensaios do experimento. Ambos os grupos mostram uma diminuição na duração do braço aberto após o teste Off1. D) Dados do grupo para animais EXP no EPM, n=12. O tempo gasto em braços abertos diminuiu significativamente durante os dois primeiros ensaios e constantemente depois (Off1 73.91±12.22 s, On1 36.15±14.65 s, Off2 15.61±6.23 s, On2 19.49±7.51 s, Off3 9.36±4.44 s, On3 7.96±3.47 s. Off1:On1, t-test, p=0,041, *). A distância movida não é afetada (Off1 679,96±71,63 cm, On1 712,24±112,82 cm, Off2 717,49±97,39 cm, On2 782,51±81,11 cm, Off3 722,11±68,60 cm, On3 663,90±106,57 cm). A quantidade de entradas de braço aberto diminui significativamente de Off1 para On1 e, em seguida, permanece constante (Off1 8.08±1.08, On1 3.33±0.76, Off2 2.16±0.69, On2 2.91±1.09, Off3 1.73±0.75, On3 1.73±0.66. Off1:On1, t-test, p=0,002, **). O tempo gasto no centro do EPM diminui ao longo dos ensaios, mas não mostra diferença significativa de Off to On trial (Off1 41.71±5.34 s, On1 31.2±4.59 s, Off2 19.8±3.44 s, On2 24.49±3.38 s, Off3 20.37±4.77 s, On3 18.85±4.07 s). E) Dados do grupo para animais de tomografia no EPM, n=11. Os dados da CT mostram as mesmas reduções significativas dos dados exp, indicando que o experimento não funcionou corretamente (Tempo em braços abertos Off1 86,92±12,74 s, On1 33.78±14.38 s, Off2 18.01±11.61 s, On2 16.41±9.61 s, Off3 11.36±4.01 s, On3 5.43±2.07 s. Off1:On1, MWRS, p=0.009, **; Distância Off1 705,11±88,36 cm, On1 789,45±77,53 cm, Off2 724,74±80,49 cm, On2 676,57±111,99 cm, Off3 716,99±132,47 cm, On3 663,03±132,46 cm; Inscrições abertas de braço Off1 7.09±1, On1 3.72±1.17, Off2 1.45±0.47, On2 1.36±0.58, Off3 0.91±0.43, Off3 1.64±0.59. Off1:On1, MWRS, p=0,01, *; Tempo de passar no centro Off1 35.89 s, On1 29.25±3.96 s, Off2 22.17±3.58 s, On2 15.9±2.57 s, Off3 13.86±4.2 s, On3 16.89±5.75 s). Os valores são médios ± S.E.M. * indicam diferenças significativas (p≤0,05), ** indicam diferenças significativas (p≤0,01). t-test é sempre de duas caudas, MWRS: Mann-Whitney Rank Sum teste; EPM: Labirinto de elevação; CT: controlar animais; EXP: animal experimental; Braços abertos. Este número foi modificado a partir de Berg et al. 2019, PLoS One43 e de Berg 201948. Clique aqui para ver uma versão maior desta figura.
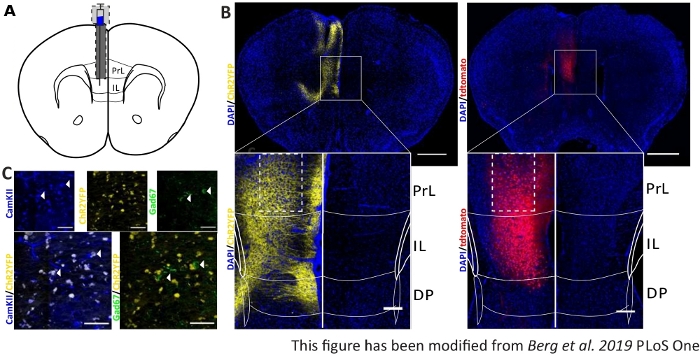
Figura 6: Lado de injeção de ChR2 e tdTomato na especificidade IL e Nex-Cre. A) Desenho esquemático do local de implantação em fatias cerebrais coronais em AP + 1,66 mm, mL 0,3 mm, DV -1,8 mm, com injeção e implantação unilaterais (adaptado do atlas cerebral do rato, Paxinos e Franklin, Bregma +1,54 mm). B) Locais de injeção exemplar de ChR2-YFP (esquerda, amarelo) e tdTomato (direita, vermelho) fundidos com núcleos celulares manchados de DAPI (azul) em camundongos Nex-Cre. Barra de escala 1 mm. Os insets mostram alta ampliação da região de IL. Barra de escala 150 μm. Caixas brancas indicam localização deentradas. C) Linha superior: imagens confocal da região il esquerda de um mouse Nex-Cre manchado com CamKII como um marcador para neurônios glutamatericos (azul), e ChR2-YFP (amarelo) ou Gad67 como um marcador para neurônios GABAérgic (verde), de um rato Nex-Cre. Linha inferior: colocalização de ChR2-YFP (amarelo) com CamKII (esquerda, azul), mas não com Gad67 (direita, verde), mostrando especificidade dos camundongos Nex-Cre para neurônios glutamatericos. Barra de escala 50 μm. PrL: córtex pré-limítromico; IL: córtex infralimico; DP: córtex peduncular dorsal. Este número foi modificado a partir de Berg et al. 2019, PLoS One43 e de Berg 201948. Clique aqui para ver uma versão maior desta figura.
Discussão
Usar a luz para manipular a sinalização neuronal tem sido o método de escolha há quase uma década. Desde 2005, o número de artigos publicados sobre o desenvolvimento de novas ferramentas optogenéticas4,6,8,14,49,50,51 e estudos onde tais ferramentas são utilizadas para investigar circuitos cerebrais21,,23,,40,,43,52, altamente aumentado. Por um lado, com a enorme diversidade de ferramentas optogenéticas injetáveis, variantes de implantação, linhas de camundongos transgênicos e experimentos comportamentais, a possibilidade de experimentos é múltiplas e ilimitadas. Por outro lado, a possibilidade de cometer falhas na escolha de condições experimentais é muito alta e os experimentos são tão específicos, que muitas vezes a comparabilidade com outros estudos é difícil.
Passos críticos
Um passo crítico importante deste protocolo é o planejamento adequado. A escolha da ferramenta optogenética deve corresponder à questão científica. É necessário apenas manipular a atividade geral de um neurônio ou sinapse? Em seguida, ferramentas comercialmente fornecidas como ChR221,,25,27 e Arch37 são uma boa escolha. Mas, além disso, se um sistema neurotransmissor especial ou mesmo um único receptor deve ser manipulado, uma quimera receptora individual é muitas vezes a melhor escolha3,6. Várias quimeras receptoras com GPCRs, as chamadas Opto-XRs e as diretrizes para produzi-las já estão disponíveis4,,50. Além da escolha de ferramentas optogenéticas, a linha do mouse em combinação com o experimento comportamental também é crítica. Diferentes cepas de fundo, como, por exemplo, C57Bl/6 e BALB/cByJ, exibem diferentes fenótipos comportamentais em alguns aspectos53,54. Os camundongos C57Bl/6 têm uma ansiedade de baixa linha de base e podem ser usados para manipulação ansiogênica, enquanto BALB/cByJ apresentam níveis de ansiedade mais altos e, portanto, são mais sensíveis a drogas ansiolíticas. Além disso, as variantes transgênicas dessas cepas de fundo também podem variar em seu fenótipo48. Com uma combinação adequada de promotores específicos em conjunto com uma ferramenta optogenética e linha de mouse transgênico, quase todas as populações de células desejadas podem ser alvo.
Um passo crítico durante a cirurgia é direcionar o local correto. Com a ajuda do atlas cerebral do camundongo, podem ser estabelecidas coordenadas adequadas para o eixo anterior-posterior e eixo medial-lateral, e a profundidade da estrutura pode ser estabelecida45. Na realidade, cada crânio tem uma forma e tamanho ligeiramente diferentes. Assim, o fator F46 para ajustar as coordenadas estereotáticas é bastante importante, assim como a fixação correta do nariz e da orelha durante a cirurgia estereotática. Se a cabeça do mouse estiver inclinada, a cânula de injeção não atingirá a região desejada de interesse.
Além disso, o diâmetro da cânula de injeção também é crítico. Se for muito pequeno, nenhum vírus pode ser liberado no tecido, se for muito largo, a cânula vazará solução de vírus a caminho da região de interesse. Se a fibra óptica implantada terminar diretamente acima da região alvo, a expressão do vírus nas regiões do córtex acima não importa. Mas se o implante for colocado acima de outras regiões para estimular os terminais de axônio, os axônios das regiões do córtex superior também serão ativados pela luz e falsificarão dados obtidos. Como exemplo: A região do IL e a região pré-círia (PrL) projetam a amígdala basal55,56, mas têm funções e papéis completamente diferentes na modulação da ansiedade26,57., Se o implante for colocado acima da amígdala para ativar terminais de axônio da região de IL, e durante a solução de vírus de injeção também foi colocado na PrL devido à cânula de injeção errada, o risco de também ativar terminais de axônio da RPR é muito alto.
Durante a preparação do crânio para a fixação do implante, o uso esparso de primer e ligação é crucial para uma fixação confiável e durável. Se o sistema de adesão de 2 componentes não for aplicado finamente, o cimento dental pode se soltar do crânio após alguns dias ou semanas. Além disso, o crânio também tem que ser completamente seco antes de consertar o implante, pois caso contrário, o cimento não se prenderá adequadamente ao crânio.
Passos críticos também existem na parte comportamental deste protocolo. Primeiro, a construção do labirinto é muito importante. Em cada configuração comportamental, existem diversas variantes na literatura em relação ao tamanho e forma, bem como para o procedimento em si58,59,,60. É importante escolher uma variante que torne os dados comparáveis e reprodutíveis. Além disso, os requisitos especiais para linhas de mouse utilizadas devem ser levados em conta43,48. Nos dados representativos do EPM pode-se ver que vários ratos Nex-Cre caíram do labirinto ou escorregaram várias vezes(Figura 2b). Para esses ratos, um labirinto com uma pequena parede ao redor dos braços abertos teria sido uma alternativa melhor.
Em segundo lugar, é fundamental manter todas as condições externas do quarto constantes61, caso contrário, diferentes grupos de camundongos não seriam comparáveis. Nesse sentido, é muito importante escolher o tempo do experimento como aquele em que a configuração experimental está vaga e o experimentador está sempre presente. Além disso, eventos no prédio, como obras, testes de qualquer sistema (alarme de incêndio) ou o dia de limpeza da instalação do mouse, devem ser considerados para evitar interferências nos dados obtidos.
Finalmente, as condições de manuseio e habitação são críticas para experimentos comportamentais. Quando uma implantação é realizada, os camundongos precisam ser alojados sozinhos devido ao risco de lesões de outros camundongos. Para garantir uma boa comparabilidade entre grupos e um erro baixo dentro de um grupo, cada mouse precisa ter o mesmo tamanho e enriquecimento da gaiola. Para experimentos relacionados à ansiedade, a moradia única tem algumas vantagens, pois os camundongos machos abrigados por singe apresentam menor nível de ansiedade na linha de base, menor variação em seu nível de ansiedade e sintomas menos depressivos15,,16. Camundongos machos alojados em grupo podem diferir fortemente em seu nível de ansiedade por causa da hierarquia entre os camundongos. Além da habitação, um manuseio constante e igualitário de todos os ratos e grupos também é importante. Pegar o mouse para conectar a fibra de luz no implante é muito estressante. Portanto, este procedimento tem que ser o mesmo para cada rato, ou seja, a mesma técnica e o mesmo experimentador. Além disso, o tempo de habituação na gaiola de espera, que se destina a acalmar o rato do procedimento de conexão estressante, também precisa ter condições iguais de duração, lixo e posição para o labirinto. O manuseio dentro da instalação do mouse também é fundamental para o desempenho comportamental posterior. Animais experimentais e de controle não devem ser limpos em dias diferentes ou por pessoas diferentes, pois isso também é estressante para ratos. Além disso, o dia da limpeza não deve ser o dia experimental para evitar diferenças de comportamento.
Solucionando problemas
Há vários problemas que podem ocorrer durante o protocolo. Por exemplo, perfurar um todo no crânio durante a cirurgia estereotática pode danificar os vasos sanguíneos. Normalmente, ocorre um sangramento forte, especialmente acima de bregma e lambda. Se isso acontecer, não tente parar o sangramento com palitos de algodão, pois eles tendem a estender ainda mais sangramento para fora do vaso por causa de sua absorção, em vez disso, enxaguar diretamente com NaCl.
Também pode acontecer que a injeção de pressão da solução do vírus não está funcionando. Neste caso, pode ser que o parafilm, uma cicatriz do buraco da rebarba ou tecido cerebral, esteja entupindo a ponta da cânula. Neste caso, remova a cânula lentamente para fora do cérebro sem alterar o eixo x ou y e use uma pinça para remover 1-2 mm da parte frontal da ponta da cânula. Antes de baixar a cânula novamente, teste para funcionalidade aplicando uma pequena quantidade de pressão para ver se o vírus sai da ponta da cânula. Para evitar prisão de ventre, baixe a cânula com uma velocidade constante e não pare o movimento até que a profundidade mais profunda do lado da injeção seja atingida. Se muito da ponta da cula é removida e o diâmetro é muito grande, a cânula danificará o tecido e o risco de aplicar o vírus de uma só vez será aumentado. Assim, certifique-se de que apenas a parte entupida da ponta seja cuidadosamente removida.
Durante o experimento comportamental, a configuração do experimento no software de rastreamento de vídeo (por exemplo, Ethovision XT) pode causar problemas. Se, por exemplo, a saída de luz não estiver funcionando corretamente, isso pode ser devido a várias razões. O Pulser deve ser aberto, programado e iniciado antes que o Ethovision XT seja aberto. O hardware precisa ser selecionado corretamente na "configuração experimental" (etapa 3.2.2.4). Se a caixa de IO errada ou qualquer outra coisa que não seja "Hardware de Fantasia" for selecionada, o dispositivo Pulser não poderá ser controlado pela Ethovision. Se o teste da saída de luz for bem sucedido, mas o protocolo de luz programado em "Configurações de controle de teste" não funcionar durante a aquisição, a referência de sub-regra ou sub-regra pode estar localizada incorretamente ou as condições e ações não estão claras. Por exemplo: a referência pertence à sub-regra correta? A referência é programada corretamente (por exemplo, com que frequência a sub-regra é executada)?
Além disso, pode acontecer que durante as "configurações de detecção" o animal seja adequadamente rastreado, mas durante a aquisição há amostras onde o sujeito não é encontrado. Neste caso, verifique se a iluminação na sala experimental foi alterada, ou se alguma coisa produziu sombras indesejadas dentro do labirinto. Toda a parte inferior do labirinto tem que ter a mesma cor, pois a configuração só funcionará para uma combinação específica. Se por quaisquer razões diferentes cores inferiores ou sombras não puderem ser evitadas, defina a configuração de detecção na parte mais escura do labirinto.
Para alterar quaisquer configurações após a aquisição dos primeiros animais, não aplique essas alterações nas configurações já utilizadas. Duplique-os para ajustá-los. Isso também significa que o ensaio já registrado não é mais válido para análise de dados. Nesse caso, grave todos os animais para este grupo experimental com as configurações originais, e crie um novo experimento depois onde os vídeos gravados são analisados em vez de rastreamento ao vivo. Neste experimento "de vídeo", várias configurações podem ser usadas para análise sem perder a comparabilidade entre animais ou mesmo dados.
Limitações e aplicações futuras
Esse método de manipulação do comportamento com optogenética em animais em movimento livre também inclui limitações. Durante a cirurgia, a proximidade dos dois implantes é restrita. Para a implantação dupla, a distância entre os dois implantes deve ser minimamente a largura do aparelho para segurar o implante. O aparelho precisa baixar o segundo implante para o orifício da rebarba, enquanto os primeiros implantes já estão fixos. Uma solução para isso pode ser uma implantação em ângulo, onde as pontas da fibra de vidro podem estar muito próximas, enquanto os ferules de cerâmica acima do crânio têm maior distância23,55,56,,57,62,63. Uma desvantagem de uma implantação em ângulo é a luz se espalhando. Quando a ponta de fibra é inclinada em vez de de cima, a área estimulada é diferente. No caso de duas regiões-alvo próximas, a posição alterada da estimulação da luz precisa ser considerada.
Durante o experimento comportamental, a construção do labirinto pode interferir com o cabo óptico conectado ao animal. Alguns testes comportamentais, como a caixa escura-clara, contêm uma área interna64,,65, e outros labirintos contêm compartimentos que o mouse precisa para entrar. Tais experimentos não podem ser realizados com esta configuração. Alternativamente, um sistema sem fio pode ser uma opção22,26,66. Mas, felizmente, alguns labirintos, como o Labirinto barnes, podem ser organizados de tal forma, que os ratos são capazes de entrar nos compartimentos relevantes67.
Além daqueles com zonas fechadas, labirintos muito largos podem causar também problemas. Quanto maior a área do labirinto, mais tempo o cabo tem que ser para permitir que o animal vá para cada posição do labirinto. É preciso ter cuidado para que o animal não seja capaz de pisar no cabo ou agarrá-lo e mordê-lo. Uma solução para isso pode ser uma construção que enrola o cabo redundante. Uma desvantagem é que o arrasto para desenrolar o cabo é difícil para ratos. Esta solução seria mais adequada para ratos. Outra opção possível poderia ser fazer a estimulação da luz com antecedência, em vez de durante o experimento, é claro que isso só é viável se um efeito de longo prazo devido à estimulação da luz ocorrer23.
Comparação com métodos existentes/alternativos
Métodos alternativos seriam estimulação química ou elétrica durante o comportamento8,18. Agonistas químicos ou antagonistas são capazes de ativar ou silenciar neurônios através de receptores específicos e também podem manipular sistemas neurotransmissores únicos38,68. Por um lado, a especificidade do receptor é bastante alta para produtos químicos, pois agonista ou antagonista específico só ativa certos receptores39. Por outro lado, a especificidade para subtipos receptores do mesmo grupo neurotransmissor é muitas vezes insuficiente. A maioria dos produtos químicos se liga a pelo menos dois subtipos com probabilidades diferentes69. Além disso, os produtos químicos não podem distinguir entre os tipos de células neuronais, desde que possuam os mesmos tipos de receptores. Além disso, a resolução temporal e espacial é pobre para manipulações químicas em comparação com a optogenética. Agonistas ou antagonistas são frequentemente administrados oralmente35 ou através de injeções sistêmicas57,70. Se a infusão do produto químico for feita diretamente no tecido cerebral, os efeitos aparecem mais rápido do que com aplicações orais, mas ainda em uma escala de tempo mais lenta do que com estimulação de luz. Como os produtos químicos administrados se difundem no cérebro e não são específicos para tipos neuronais ou regiões cerebrais, a manipulação de circuitos cerebrais específicos não é possível.
A estimulação elétrica tem uma resolução temporal maior do que a estimulação química9,14. A disseminação no tecido neuronal é menor do que com estimulação química e a resolução espacial é melhor do que com estimulação química. No entanto, a estimulação elétrica não tem a possibilidade de abordar especificamente diferentes tipos de células neuronais ou tipos de receptores, pois cada neurônio próximo ao eletrodo responderá à estimulação elétrica.
Métodos alternativos ao comportamento em camundongos em movimento livre são, por exemplo, gravações eletrofisiológicas em fatias cerebrais, onde neurônios únicos ou axônios podem ser modulados com optogenética e efeitos provocados podem ser medidos através da gravação de eletrodos6,,71. Experimentos in vitro oferecem a possibilidade de investigar a base molecular e celular de estimulações optogenéticas, mas têm a limitação de que a conectividade intrínseca e a entrada de outras regiões cerebrais estão faltando. Outra opção é usar optogenética em conjunto com imagens multifotográficas1,72. Neste caso, os ratos têm a cabeça fixada e podem ser anestesiados ou estar acordados para resolver tarefas simples.
Para realizar um experimento optogenético bem-sucedido, uma ampla gama de ferramentas e aplicativos estão disponíveis hoje em dia. A seleção de ferramentas optogenéticas e a configuração comportamental são fundamentais para responder a questões específicas de pesquisa. Se a combinação certa de ferramentas e experimentos for escolhida, a optogenética permite uma investigação sem precedentes e aprofundada de circuitos neuronais com alta resolução temporal e espacial. Isso ajudará a entender e desenvolver novas estratégias terapêuticas para doenças psiquiátricas e cognição.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Muito obrigado ao Prof Klaus-Armin Narve e à Dra. Além disso, agradecemos nossa equipe de vídeo Yunus Dikici e Ruben Wiesner pela gravação e processamento do vídeo do JoVE para este artigo. Além disso, muito obrigado a Kristin Claussen por sua dublagem e Kimberly Anne Go para a revisão do manuscrito.
Os resultados apresentados foram obtidos na Universidade Ruhr em Bochum e o vídeo foi gravado na Universidade de Bremen.
Este trabalho foi financiado pela Deutsche Forschungsgemeinschaft (DFG, German Research Foundation) - Projektnummer 122679504 - SFB 874 e DFG MA 4692/3-2.
Materiais
| Name | Company | Catalog Number | Comments |
| Ketamin | Sigma-Aldrich | K2753-64 | Anestasia |
| 20 % Glucose | AlleMan Pharma | Injection s.c. for fast recovery | |
| Behavioral mazes | Costum made | Measure anxiety | |
| Bepanthen | Bayer | Ophthalmic oinment | |
| Betaisodona | Monodipharma | Sterilant containing iodine | |
| Betaisodona | Monodipharma | Iodine oinment | |
| Binocular | Olympus | SZ52, 110AL0.62x WD160 | Surgery |
| Ceramic ferrules | Thorlabs | CFLC230-10 | Implant |
| Ceramic Fiber Scribe | Thorlabs | CSW12.5 | Cutting of the glass fiber |
| Channelrhodopsin2-YFP virus | Penn Vector Core | Addgene 20298 | Optogenetic tool |
| Compressed air | Kontakt Chemie | Druckluft 67 | Drying of the skull |
| Coordinate system | Stoelting | Stereotactic coordinates for the surgery | |
| Correl Draw | Graphical software version 13 | ||
| Cryoslicer | MICROM | HM500OM | Production of brain slices for staining |
| Ethovision XT 14 | Noldus | Software for behavioral tracking | |
| Exel | Statistical Software | ||
| Ferrule Polishing Puck | Thorlabs | D50-F | Polishing implants round side |
| Fiber Patch Cord dual | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cables, which are connected with the two implants of a bilateral implantation |
| Fiber Patch Cord single | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cable, which is connected with the implant via a sleeve |
| Fiber Stripping Tool | Thorlabs | T06S13 | Stripping glass fiber for implant |
| Filter paper | VWR European | 516-0300 | Cut into pieces for the Novelty-Suppressed Feeding test |
| Food pellets | Mühle Levers | Höveler Nagerfutter | Nutrition for the mice |
| Glass pipettes | Harvard Apparatus | GC150-10 | Injection pipettes |
| Gradia direct-Flo | Henry Schein | 103322 | Fluid dental cementum |
| Heating lamp | efbe-Schott/Phillips | R95E | Prevent the mice from cooling after the surgery |
| Heating plate | Stoelting | Integrated into coordinate system | |
| Injection canula | Braun | 100 Sterican, 0,4 x 20 mm, Gr. 20 | All injections and to bore hole into the skull |
| Litter | T 1350 | Grounding for the Novelty-Supressed Feeding test | |
| Mouse cages | Zoonlab | 405 cm^2 | Single housing for experiments |
| Optibond FL | Kerr | 26684E | Preparation of the skull for implantation |
| Optical glass fiber | Thorlabs | FT200EMT | Light fiber for implant |
| Optogenetics-LED.STSI | Prizmatix | Optogenetic toolbox for light stimulation during behavioral experiments | |
| Paraformaldehyde | Sigma-Aldrich | 16005-1KG-R | Perfusion of mice to remove the brains |
| Polishing sheet 0.02 µm grit | Thorlabs | LFCF | Polishing implants round side |
| Polishing sheet 1 µm grit | Thorlabs | LF1D | Polishing implants round side |
| Polishing sheet 30 µm grit | Thorlabs | LF30D | Polishing implants round side |
| Polishing sheet 6 µm grit | Thorlabs | LF6D | Polishing implants round side |
| Pulser Software | Prizmatix | Software for light device control | |
| Rimadyl-Carprofen | Zoetis | Analgesia | |
| Sigma Plot | Software for statistics | ||
| Sleeve | Thorlabs | FT200EMT | Connection of implant and light cable |
| SodiumCloride (NaCl) | Braun | 3570410 | Rinsing of the skull |
| Superglue | Pattex Henkel | To Fix the glass fiber in the ferrule | |
| td-Tomato virus | Penn Vector Core | Addgene 51503 | Optogenetic tool |
| UV light | KoQGHJ | wireless, 1200 mW/cm^2 | Polymeration lamp for dental cementum |
| Xylavet-Xylazin | cp pharma | Anesthesia |
Referências
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature Letters. 463, 98-102 (2010).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Spoida, K., Masseck, O. A., Deneris, E. S., Herlitze, S. Gq/5-HT2c receptor signals activate a local GABAergic inhibitory feedback circuit to modulate serotonergic firing and anxiety in mice. Proceedings of the National Academy of Science of the United States of America. 111, 6479-6484 (2014).
- Kleinlogel, S. Optogenetic user's guide to Opto-GPCRs modified GPCRs. Frontiers in Bioscience. 21, 794-805 (2016).
- Mahn, M., Prigge, M., Ron, S., Levy, R., Yizhar, O. Biophysical constraints of optogenetic inhibition at presynaptic terminals. Nature Neuroscience. 19, 554-556 (2016).
- Masseck, O. A., et al. Vertebrate Cone Opsins Enable Sustained and Highly Sensitive Rapid Control of Gi/o Signaling in Anxiety Circuitry. Neuron. 81, 1263-1273 (2014).
- Oh, E., Maejima, T., Liu, C., Deneris, E., Herlitze, S. Substitution of 5-HT 1A Receptor signaling by a light-activated G protein-coupled receptor. Journal of Biological Chemistry. 285, 30825-30836 (2010).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in Neural Systems. Neuron Primer. 71, 9-34 (2011).
- Masseck, O. A., Manahan-Vaughan, D. A Guide to Optogenetic Applications, With special Focus on Behavioral and In Vivo Electrophysiological Experiments. HandboOk of In Vivo Neural Plasticity Techniques - A Systems Neuroscheince Approach to the Neural Basis of Memory and Cognition. , 557 (2019).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. , 611-621 (2006).
- Yang, Y. S., Hughes, T. E. Cre Stoplight: A red/green fluorescent reporter of Cre recombinase expression in living cells. Biotechniques. 31, 1036-1041 (2001).
- Schnütgen, F., et al. A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse. Nature Biotechnology. 21, 562-565 (2003).
- Taniguchi, H., et al. A Resource of Cre Driver Lines for Genetic Targeting of GABAergic Neurons in Cerebral Cortex. Neuron. 71, 995-1013 (2011).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 268-273 (2011).
- Palanza, P., Gioiosa, L., Parmigiani, S. Social stress in mice: Gender differences and effects of estrous cycle and social dominance. Physiology and Behavior. 73, 411-420 (2001).
- Karolewicz, B., Paul, I. A. Group housing of mice increases immobility and antidepressant sensitivity in the forced swim and tail suspension tests. European Journal of Pharmacology. 415, 197-201 (2001).
- Masseck, O. A., Rubelowski, J. M., Spoida, K., Herlitze, S. Light- and drug-activated G-protein-coupled receptors to control intracellular signalling. Experimental Physiology. 96, 51-56 (2011).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4, (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature Article. 446, 633-639 (2007).
- Owen, S. F., Liu, M. H., Kreitzer, A. C. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience. 22, 1061-1065 (2019).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nature Communication. 10, 1-12 (2019).
- Allsop, S. A., Vander Weele, C. M., Wichmann, R., Tye, K. M. Optogenetic insights on the relationship between anxiety-related behaviors and social deficits. Frontiers in Behavioral Neuroscience. 8, 1-14 (2014).
- Fuchikami, M., et al. Optogenetic stimulation of infralimbic PFC reproduces ketamine's rapid and sustained antidepressant actions. Proceedings of the National Academy of Science of the United States of America. 112, 8106-8111 (2015).
- Correia, P. A., et al. Transient inhibition and long-term facilitation of locomotion by phasic optogenetic activation of serotonin neurons. Elife. 6, 1-26 (2017).
- Felix-Ortiz, A. C., Burgos-Robles, A., Bhagat, N. D., Leppla, C. A., Tye, K. M. Bidirectional modulation of anxiety-related and social behaviors by amygdala projections to the medial prefrontal cortex. Neuroscience. 321, 197-209 (2016).
- Marek, R., Xu, L., Sullivan, R. K. P., Sah, P. Excitatory connections between the prelimbic and infralimbic medial prefrontal cortex show a role for the prelimbic cortex in fear extinction. Nature Brief Communication. , (2018).
- Parfitt, G. M., et al. Bidirectional Control of Anxiety-Related Behaviors in Mice: Role of Inputs Arising from the Ventral Hippocampus to the Lateral Septum and Medial Prefrontal Cortex. Neuropsychopharmacology. 42, 1715-1728 (2017).
- Bandelow, B., Michaelis, S. Epidemiology of anxiety disorders in the 21st century. Dialogues in Clinical Neuroscience. 17, 327-335 (2015).
- Kessler, R. C., et al. Lifetime Prevalence and Age-of-Onset Distributions of DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 62, 593-602 (2005).
- Kessler, R. C., Petukhova, M., Sampson, N. A., Zaslavsky, A. M., Wittchen, H. U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. International Journal of Methods Psychiatric Research. 21, 169-184 (2014).
- Andlin-Sobocki, P., Wittchen, H. U. Cost of anxiety disorders in Europe. European Journal of Neurology. 12, 39-44 (2005).
- Forster, G. L., Novick, A. M., Scholl, J. L., Wall, M. J. The Role of the Amygdala in Anxiety Disorders. Intech. , 61-102 (2012).
- Liberzon, I. Neural circuits in anxiety and stress disorders a focused review. Therapeutics and Clinical Risk Management. 11, 115-126 (2015).
- Sylvers, P., Lilienfeld, S. O., LaPrairie, J. L. Differences between trait fear and trait anxiety: Implications for psychopathology. Clinical Psychology Review. 31, 122-137 (2011).
- Daws, L. C., Koek, W., Mitchell, N. C. Revisiting Serotonin Reuptake Inhibitors and the Therapeutic Potential of 'Uptake-2' in Psychiatric Disorders. ACS Chemical Neuroscience. 4, 16-21 (2013).
- Felix-Ortiz, A. C., et al. BLA to vHPC inputs modulate anxiety-related behaviors. Neuron Report. 79, 658-664 (2013).
- Padilla-Coreano, N., et al. Direct Ventral Hippocampal-Prefrontal Input Is Required for Anxiety-Related Neural Activity and Behavior. Neuron Article. 89, 857-866 (2016).
- Lisboa, S. F., Stecchini, M. F., Corrêa, F. M. A., Guimarães, F. S., Resstel, L. B. M. Different role of the ventral medial prefrontal cortex on modulation of innate and associative learned fear. Neuroscience. 171, 760-768 (2010).
- Bi, L. L., et al. Enhanced excitability in the infralimbic cortex produces anxiety-like behaviors. Neuropharmacology. 72, 148-156 (2013).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature Article. 477, 171-178 (2011).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. 44, 611-621 (2006).
- Rubenstein, J. L. R., Merzenich, M. M. Model of autism: increased ratio of excitation/ inhibition in key neural systems. Genes, Brain and Behavior. 2, 255-267 (2003).
- Berg, L., Eckardt, J., A, M. O. Enhanced activity of pyramidal neurons in the infralimbic cortex drives anxiety behavior. PLoS One. 14, 1-19 (2019).
- Meunier, C. N. J., Amar, M., Lanfumey, L., Hamon, M., Fossier, P. 5-HT1A receptors direct the orientation of plasticity in layer 5 pyramidal neurons of the mouse prefrontal cortex. Neuropharmacology. 71, 37-45 (2013).
- Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J. . Mouse Brain in Stereotaxic Coordinates. 2, (2004).
- Gore, B. B., Soden, M. E., Zweifel, L. S. Manipulating gene expression in projection-specific neuronal populations using combinatorial viral approaches. Current Protocols in Neuroscience. 435, 1-6 (2014).
- Stujenske, J. M., Spellman, T., Gordon, J. A. Modeling the Spatiotemporal Dynamics of Light and Heat Propagation for InVivo Optogenetics. Cell Report. 12, 525-534 (2015).
- Berg, L. Imbalance of excitation and inhibition within the prefrontal cortex supports anxiety behavior. Ruhr-University Bochum. , (2019).
- Boyden, E. S. A history of optogenetics: The development of tools for controlling brain circuits with light. F1000 Biology Reports. 3, 1-12 (2011).
- Airan, R. D., Thompson, K. R., Fenno, L. E., Bernstein, H., Deisseroth, K. Temporally precise in vivo control of intracellular signalling. Nature. 458, 1025-1029 (2009).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7, 12-23 (2012).
- Covington, H. E., et al. Antidepressant Effect of Optogenetic Stimulation of the Medial Prefrontal Cortex. Journal of Neuroscience. 30, 16082-16090 (2010).
- Lepicard, E. M., Joubert, C., Hagneau, I., Perez-Diaz, F., Chapouthier, G. Differences in anxiety-related behavior and response to diazepam in BALB/cByJ and C57BL/6J strains of mice. Pharmacology, Biochemistry and Behavior. 67, 739-748 (2000).
- Schmidt, M. V., Müller, M. B. Animal models of anxiety. Elsevier. 3, 369-374 (2006).
- Cho, J. H., Deisseroth, K., Bolshakov, V. Y. Synaptic Encoding of Fear Extinction in mPFC-amygdala Circuits. Neuron Article. 80, 1491-1507 (2013).
- Adhikari, A., et al. Basomedial amygdala mediates top-down control of anxiety and fear. Nature. 527, 179-185 (2015).
- Suzuki, S., et al. The infralimbic and prelimbic medial prefrontal cortices have differential functions in the expression of anxiety-like behaviors in mice. Behavioural Brain Research. 304, 120-124 (2016).
- Carola, V., D'Olimpio, F., Brunamonti, E., Mangia, F., Renzi, P. Evaluation of the elevated plus-maze and open-field tests for the assessment of anxiety-related behaviour in inbred mice. Behavioural Brain Research. 134, 49-57 (2002).
- Prut, L., Belzung, C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: A review. European Journal of Pharmacology. 463, 3-33 (2003).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature Letter. 471, 358-362 (2011).
- Bouwknecht, J. A., et al. Differential effects of exposure to low-light or high-light open-field on anxiety-related behaviors: Relationship to c-Fos expression in serotonergic and non-serotonergic neurons in the dorsal raphe nucleus. Brain Research Bulletin. 72, 32-43 (2007).
- Overstreet, D. H., Knapp, D. J., Angel, R. A., Navarro, M., Breese, G. R. Reduction in repeated ethanol-withdrawal-induced anxiety-like behavior by site-selective injections of 5-HT1A and 5-HT2C ligands. Psychopharmacology. 187, 1-12 (2006).
- Takahashi, A., et al. Glutamate Input in the Dorsal Raphe Nucleus As a Determinant of Escalated Aggression in Male Mice. Journal of Neuroscience. 35, 6452-6463 (2015).
- Klemenhagen, K. C., Gordon, J. A., David, D. J., Hen, R., Gross, C. T. Increased Fear Response to Contextual Cues in Mice Lacking the 5-HT1A Receptor. Neuropsychopharmacology. 31, 101-111 (2006).
- Ramos, A. Animal models of anxiety: do I need multiple tests. Trends in Pharmacological Science. 29, 493-498 (2008).
- Isosaka, T., et al. Htr2a-Expressing Cells in the Central Amygdala Control the Hierarchy between Innate and Learned Fear. Cell. 163, 1153-1164 (2015).
- Regev, L., Goshen, I. Employing Optogenetics in Memory Research. Optogenetics: A Roadmap. , 219-256 (2017).
- Shah, A. A., Sjovold, T., Treit, D. Inactivation of the medial prefrontal cortex with the GABA A receptor agonist muscimol increases open-arm activity in the elevated plus-maze and attenuates shock-probe burying in rats. Brain Research. 1028, 112-115 (2004).
- Knight, A. R., et al. Pharmacological characterisation of the agonist radioligand binding site of 5-HT2A, 5-HT2B and 5-HT2C receptors. Naunyn-Schmiedebergs Archiv of Pharmacology. 370, 114-123 (2004).
- Graeff, F. G., Viana, M. B., Mora, P. O. Dual Role of 5-HT in Defense and Anxiety. Neuroscience and Biobehavioral Reviews. 21, 791-799 (1997).
- Cheriyan, J., Sheets, P. L. Altered Excitability and Local Connectivity of mPFC-PAG Neurons in a Mouse Model of Neuropathic Pain. Journal of Neuroscience. 38, 4829-4839 (2018).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados